Method Article
聚乙胺包覆氧化铁纳米粒子作为载体, 在体外和体内向巨噬细胞输送小干扰 rna
* 这些作者具有相同的贡献
摘要
我们描述了一种使用聚乙烯烯胺 (pei) 涂层超顺磁性氧化铁纳米粒子与 sirna 转染巨噬细胞的方法。这些纳米颗粒可以有效地传递 sirna 巨噬细胞在体外和体内和沉默目标基因表达。
摘要
巨噬细胞由于在调节免疫反应方面的关键作用, 一直是深入研究的对象, 在自身免疫性疾病、动脉粥样硬化和癌症等许多疾病中都是一个有希望的治疗目标。rnai 介导的基因沉默是探索和操纵巨噬细胞功能的一种有价值的选择方法;然而, 巨噬细胞与 sirna 的转染通常被认为是技术上具有挑战性的, 目前, 很少有专门用于 sirna 转移到巨噬细胞的方法。在这里, 我们提出了一个协议, 使用聚乙烯烯胺涂层超顺磁性氧化铁纳米粒子 (pei-spions) 作为有针对性地传递 sirna 到巨噬细胞的载体。当 fe: sirna 重量比达到4及以上时, pei-spions 能够结合并完全冷凝 sirna。在体外, 这些纳米粒子可以有效地将 sirna 传递到初级巨噬细胞中, 也可以传递到类似巨噬细胞的 raw 264.7 细胞系中, 而不会在最佳转染剂量下损害细胞活力, 最终, 它们会诱发sirna 介导的靶向基因沉默。除了用于体外sirna 转染外, pei-spion 也是一种很有前途的工具, 可将sirna 传递给体内的巨噬细胞。鉴于其磁性能和基因沉默能力的综合特点, 系统管理的 pei-spion/srna 颗粒不仅可以调节巨噬细胞的功能, 而且可以使巨噬细胞被成像和跟踪。从本质上讲, pei-spions 代表了一个简单、安全和有效的非病毒平台, 用于在体外和体内将 sirna 传递给巨噬细胞。
引言
巨噬细胞是一种分布在所有身体组织中的先天免疫细胞, 尽管数量不同。通过产生多种细胞因子和其他介质, 它们在宿主防御入侵微生物病原体、损伤后组织修复和维持组织稳态1方面发挥着至关重要的作用。巨噬细胞由于其重要性, 一直是深入研究的主题。然而, 尽管 sirna 介导的基因沉默在基因调控和功能研究中很普遍, 但它在巨噬细胞中成功的可能性较小, 因为这些细胞--特别是初级巨噬细胞--往往难以转染。这可归因于与最成熟的转染方法相关的毒性相对较高, 在这种方法中, 细胞膜是化学的 (例如, 与聚合物和脂质的) 或物理的 (例如, 通过电穿孔和基因枪) 被破坏, 让 sirna 分子穿过膜, 从而极大地降低了巨噬细胞的生存能力2,3。此外, 巨噬细胞是富含降解酶的专用吞噬细胞。这些酶会损害 sirna 的完整性, 削弱其沉默效率, 即使基因特异性 sirna 已被传递到细胞3,4。因此, 一个有效的巨噬细胞靶向 sirna 传递系统需要在传递过程中保护 sirna 的完整性和稳定性4。
越来越明显的是, 功能失调的巨噬细胞与某些常见临床疾病 (如自身免疫性疾病、动脉粥样硬化和癌症) 的发生和发展有关。因此, 调节巨噬细胞功能, 例如, sirna, 已经成为一种有吸引力的方法来治疗这些疾病5, 6,7.虽然已经取得了很大进展, 但基于 sirna 的治疗策略的一个主要挑战是系统管理的 sirna 的细胞特异性差, 巨噬细胞的 sirna 吸收不足, 从而导致不受欢迎的副作用。与游离核酸疗法相比, 由于其自发倾向于被网状内皮系统捕获, 通常缺乏最佳的细胞选择性, 并经常导致离靶不良效应, 药物负载纳米粒子 (nps),可设计为在体内被动靶向巨噬细胞, 允许提高治疗效果与最小的副作用8。目前探索的用于传递 rna 分子的 np 包括无机纳米载体、各种脂质体和聚合物9。其中, 聚乙基烯胺 (pei) 是一种能够将核酸结合并凝结成稳定的 np 的阳离子聚合物, 它显示出最高的 rna 传递能力9,10。pei 保护核酸免受酶和非酶降解, 介导它们在细胞膜上的转移, 并促进它们在细胞内的释放。虽然最初作为 dna 传递试剂引入, pei 后来被证明是一个有吸引力的平台, 在本地或系统 9,10体内 sirna 传递。
超顺磁性氧化铁纳米粒子 (spions) 由于其磁性能、生物相容性、与生物重要物体的可比尺寸、较高的表面积与体积比以及易于适应的特性, 在生物医学领域显示出巨大的前景表面活性剂附件11的表面。例如, 由于 spions 作为造影剂的潜在效用和巨噬细胞的快速吸收, 已成为一种最受欢迎的临床工具, 可对巨噬细胞进行成像。虽然 spions 也被广泛研究为核酸交付车辆11,13,14, 15,据我们所知, 文献中很少有关于 spions 作为载体的报告。巨噬细胞靶向 sirna 的传递。对于 spions 的基因传递, 它们的表面通常涂有一层亲水阳离子聚合物, 负电荷核酸可以被静电吸引和捆绑在上面。在这里, 我们提出了一种方法, 合成 spions 的表面被修改与低分子量 (10 kda), 分枝 pei (pei-spions)。然后利用这些磁性纳米平台浓缩 sirna, 形成 pei-spion/sirna 复合物, 使 sirna 能够进入细胞。我们认为, 网状内皮系统16细胞自发吞噬的 spions, 再加上 pei 结合和凝结核酸的强大能力, 使得 pei-spions 适合有效地将 sirna 运进 sirna巨 噬 细胞。这里提供的数据支持了 pei-spion/sina 介导的基因沉默在培养和体内巨噬细胞中的可行性。
研究方案
所有涉及活体动物的方法都是按照中国东南大学的动物护理和使用指南进行的。
1. pei-spions 的制备
-
油酸修饰 spions 的制备
- 在 n2 的保护下, 在水中溶解 fecl 3·6h2o 和 feso 4·7h2o.
- 在烧杯中加入28克 fecl 3·6h2o 和20克 feso4·7h2o, 加入80毫升的去离子水中.通过玻璃导管将 n2 引入水中, 搅拌至固体物质溶解。
- 将反应混合物加热至 72°c, 搅拌速率为800转/分, 然后加入40毫升氨水 (28%)。搅拌5分钟。
- 在上述溶液中滴注9毫升的油酸, 在72°c 下搅拌3小时。
- 将生成的溶液冷却至室温 (rt)。通过磁选来沉淀溶液。
- 用绝对乙醇清洗含有 spions 3倍的沉淀物, 然后将沉淀物分散在 n-已烷的100毫升中。
- 在 n2 的保护下, 在水中溶解 fecl 3·6h2o 和 feso 4·7h2o.
-
二硫代琥珀酸修饰 spone 的制备
- 加入800毫克油酸 (oa) 修饰的 spions, 分散在 n-已烷200毫升中, 400 毫克二硫代琥珀酸 (dmsa) 分散在200毫升的丙酮中, 放入60°c 水浴中的三颈烧瓶中。
注: 要确定从上一步获得的 oa 修饰 spion 的浓度, 请对 spion 分散量进行小体积 (例如1毫升), 使 n-已烷挥发, 并称量由此产生的粉末。 - 在上述溶液中滴注200μl 三乙胺, 在 1, 000 转/分搅拌, 并回流。
- 搅拌和回流5小时后, 通过磁选得到黑色沉淀物。
- 利用四甲基氢氧化铵调整溶液的 ph 值, 均匀地分散去离子水中的亲水性 sponic。
- 加入800毫克油酸 (oa) 修饰的 spions, 分散在 n-已烷200毫升中, 400 毫克二硫代琥珀酸 (dmsa) 分散在200毫升的丙酮中, 放入60°c 水浴中的三颈烧瓶中。
-
pei-spions 的制备
- 在-mL 三颈烧瓶中滴入 pei 溶液 (10 kda), 在 1, 000 转/分的机械搅拌下, 为 2小时 (w1:3 pei = 1:3).
注: pei-spions 的电荷和大小因 wfe 与 w pei 的比例而异。wf:w pei 比为1:3 可以作为一个很好的起点, 用于合成适合 sirna 传递的 pei-spione。 - 将生成的溶液添加到分子量为 100 kda、含量为 15 ml 的超滤管中;然后, 离心机在 5400 x g 10分钟, 直到剩余的溶液是1毫升。在溶液中加入去离子水, 使体积达到15毫升, 并重复上述工艺 10倍, 以获得最终产品。然后, 通过0.22μm 过滤器对溶液进行过滤, 并将最终产品存储在4°c。
- 用酚类化合物 17的比色法测定 pei-spions 的铁浓度。用去离子化的无菌水稀释 pei-spions, 浓度为1毫克 f\ ml, 并将其储存在4°c。
- 用去离子水稀释 pi-spion 溶液 (1 毫克 fe/ml) 的10μl 至1毫升;然后, 利用动态光散射装置对其流体力学尺寸和 zeta 电位进行测试。
注意: 在大约30-50 纳米的范围内准备 pei-spions。在此大小范围内, np 大小对 sirna 结合和细胞吸收的影响似乎并不显著。平均 zeta 电位超过 + 37 mv 的 pei-spion 在转染剂量范围内可能有毒, 应进行细胞毒性试验, 以确保安全。通过调整 pei 含量, 可以将纳米粒子的表面电荷和流体动力学尺寸控制在所需的范围内。
- 在-mL 三颈烧瓶中滴入 pei 溶液 (10 kda), 在 1, 000 转/分的机械搅拌下, 为 2小时 (w1:3 pei = 1:3).
2. pei-spion/sirna nps 的制备及琼脂糖凝胶电泳
- 用无 rnase 的水稀释 sirna, 最终产生 20μm (0.26μμμl) 的最终浓度。
- 准备5个标记为0、1、2、4和8的无 rnase 微离心管。标签代表不同的铁: sirna 重量比率。将吡格3μl sirna 溶液输送到所有管 (约0.8 微克的 sirn·管)。
- 在分别标记为0、1、2、4和8的管中加入0、0.8、1.6、3.2 和6.4 微克的铁。将每根管的总样品量保持在20μl 以下。通过上下轻轻移液混合。
- 在 rt 中对混合物进行30分钟的培育, 以使 PEI-SPION/siRNA 复合体形成。在此期间, 用高纯度琼脂糖制成3% 琼脂糖凝胶。
注: 可以制备和测试其他 pei-spion/sirna 复合物与其他 fe: sirna 比率 (例如, 5 或 6)。 - 每5μl 样品加入1μl 的 6x dna 加载缓冲液, 并谨慎混合。加载所有样品, 并运行电泳在 5 vcme, 直到溴酚蓝色迁移到凝胶长度的三分之二。用溴化乙酯 (eb) 染色凝胶15-20分钟。
注: 应使用新鲜制备的电泳缓冲液和 eb 溶液。 - 在紫外线成像系统下可视化 sirna 带。检查 f:sirna 比率, 其中 sirna 与 pei-spione 形成复合物, 因此, 代表游离 sirna 的波段被阻碍或检测不到。
3. raw264.7 巨噬细胞的转染
- 在一个10-co2 孵化器中, 使用 dmem 完整培养基, 每100微克/青霉素在37°c 时培养小鼠巨噬细胞样 raw264.7 细胞, 这种细胞含量为10厘米.
- 在转染前一天, 从细胞中抽吸培养基, 用磷酸盐缓冲盐水 (ph 7.4) 冲洗。在10厘米的盘子中加入1毫升0.25% 的胰蛋白酶。在 5% co2 孵化器中, 在37°c 下对 raw264.7 细胞进行约5-10分钟的胰化 。
- 当大多数细胞分离 (5-10分钟后), 添加5毫升的 dmem 完整的培养基到菜品中, 以灭活胰蛋白酶。向上和向下移液, 将细胞团簇分散到单个细胞中。
- 将细胞悬浮液转移到无菌的15-ml 锥形管。在 rt 以 300 x g 离心 3分钟, 去除上清液。
- 用5毫升新鲜 dmem 完整培养基对细胞进行再利用, 并对细胞进行计数。
- 将 9 x 10 4个细胞分在6孔板上, 每孔2毫升的完整 dmem 培养基, 并在37°c 时在 5% co2 孵化器中孵育约24小时。
注意: 如果使用不同尺寸的板, 请根据相对表面积调整镀层细胞密度, 使细胞在转染时达到80% 的融合度。 - 当细胞融合率为80% 时, 从细胞中取出培养基, 用每口1毫升的 dmem 完整培养基代替。将板材送回孵化器, 直到 PEI-SPION/siRNA 复合物准备好并准备好使用 (约 30分钟)。
- 制备 pei-spion/sirna 复合物: 计算转染实验所需的 PEI-SPION/siRNA 复合物的数量。在一个 1.5 ml 的无 rnase 微离心管中, 以给定的 fe:sirna 比将适量的 pei-spione 与 sirna 混合。例如, 在铁: sirna 比率为4时制备含有 100μg fe 的 pei-spion/sirna nps, 将 pei-spions 添加 100μl (1 mg fe) 至 96μl sirna (0.26μμl), 然后将其与微移液轻轻混合。在 rt 孵化30分钟。
注: 准备一份超过总最终质量的 PEI-SPION/siRNA 复合物的体积, 以考虑任何附带损失。使 pei-spion/sirna 复合物在低 fe: sirna 比率下, sirna 分子被完全加载到 pei-spions 上, 因此, 少量的 pei-spions 可用于最大限度地减少潜在的细胞毒性。试点实验 (凝胶阻滞试验) 优化铁: sirna 比是必要的。 - 从孵化器中取出6孔板 (3.7 步)。在每口井上加入所需体积的 PEI-SPION/siRNA 复合物, 并谨慎地旋流板, 以确保均匀分布。将钢板返回孵化器, 直到评估细胞吸收或基因敲除效率 (1-3 d)。
注: 用 pei-spion/sirna 在浓度 ~ 15μg fe/ml 下转染巨噬细胞, 可最大限度地提高转染效率, 同时最大限度地降低潜在的细胞毒性。
4. 对实验性关节炎大鼠巨噬细胞的系统传递
- 获取7周大的特定无病原体雄性 wistar 大鼠。在使用前让老鼠习惯 7d, 并为它们提供足够的食物和水。导致佐剂性关节炎 (aa) 在大鼠如上文所述18。
- 按照步骤3.8 中的描述, 准备 PEI-SPION/siRNA 复合物。
- 通过尾静脉将 PEI-SPION/siRNA nps (0.3 毫克 sirnna kg) 注入 aa 大鼠体内。例如, 通过流式细胞仪评估细胞的吸收, 通过实时荧光成像系统等方式评估组织的生物分布, 或基于临床、组织学和影像学等的治疗效果在所需时间点18进行分析。
注: 对于细胞和组织生物分布研究, 用一次注射所需的 np 来治疗大鼠;为了进行治疗研究, 给老鼠注射 n p, 每周检测 1 x, 连续三周。
结果
该协议制备的 pei-spions 的大小和 zeta 电位分别在 29-48 nm (多分散指数: 0.12-0.23) 和 30-48 mv 之间。在4°c 的水中, 它们在4°c 下稳定超过 12个月, 没有明显的聚集。为了评价它们的 sirna 结合能力, pei-spions 在不同的 f:sina 重量比条件下与 sirna 混合。图 1显示, 当 fe: sirna 重量比达到4及以上时, 游离 sirna 的带完全缺失, 这意味着成功的 sirna 与 pei-spions 结合。pei 在生物医学应用中的一个主要关切是其毒性, 这是强正电荷的结果, 特别是在高分子量和高剂量下。如图 2 a所示, zeta 电位为30.5 和 37 mv 的 pei-spion 在浓度高达 30μg fe/ml 时没有表现出明显的细胞毒性, 比通常用于细胞转染的浓度 (15μg fe/ml) 高出约两倍。然而, 即使在所检查的最低剂量 (10μg f\ ml) 下, zeta 电位为 48 mv 的 pei-spions 也是有毒的。因此, pei-spions 具有依赖电荷的毒性。由于阳离子电荷对巨噬细胞的 np 吸收并不重要 19, 我们建议将平均 zeta 电位不高于 + 37 mv 的 pei-spions 用于 sirna 转移, 尽管 sirna 结合会在一定程度上降低电荷, 并且减轻细胞毒性18。
为了测试 pei-spion 在巨噬细胞中的潜在应用, 利用小鼠巨噬细胞基因组 raw 264.7 进行了体外转染。经流式细胞仪分析, 90% 以上的细胞被荧光标记的 PEI-SPION/siRNA 复合物转染在 15μg fe/ml (图 2b) 中。在转染效率方面, 在 fe 形成的 pei-spion/sirna nps 实际上没有差异: sirna 权重比为4和 8, 但在后一种条件下, 形成的 np 体积较小, 正电荷较弱。因为每个粒子加载的 sirna 量较小。我们还评估了 pei-spion/sirna 浓度对普鲁士蓝染色细胞内化的影响。如图2c 所示, 转染细胞内的蓝斑在7.5 微克 f\ ml 时被最低限度地检测, 但在 15μg f\ ml 时清晰可见。有趣的是, 将 pei-spion/sirna 浓度增加到 32μg fe/ml 并没有增加染色强度, 这可能是因为 pei-spion/srna 的吸收在15微克 fe/ml 的浓度下饱和。此外, pei-spion 介导 sirna 转移的能力在原发性巨噬细胞18中得到了证实, 在此提出的方法在大鼠腹腔巨噬细胞中具有较高的 sirna 转染效率, 相当于 raw264.7 中的水平。细胞。与非特异性 sirna (图 2d) 相比, 具有特异性 sirna 的 pei-sp相处 (pei-spione) 转染的腹腔巨噬细胞的靶向 mrna 水平显著下降, 这意味着 sirna 可以从内吞囊中逃逸到细胞质, 并到达 rnai 机械。
我们以前还研究了在佐剂关节炎大鼠体内对系统管理的 PEI-SPION/siRNA 复合物的吸收。我们分析了 pei-spion/srna 在吞噬巨噬细胞和非吞噬 t 淋巴细胞中的转染效率。如图 3所示, cd11b+ 细胞在所有被检测器官的任何时间点都比 cdhi + 细胞更有效地吸收 PEI-SPION/siRNA 复合物, 这表明 PEI-SPION/siRNA nps 优先目标巨噬细胞18。值得注意的是, 在发炎的关节 18中观察到了大量的 nps 积累, 这表明 pei-spion 可以成为一个有吸引力的平台, 用于在类风湿关节炎中系统地提供 sirna 疗法, 这些药物的发病机制与巨噬细胞功能障碍, 其中局部 sirna 管理不是最喜欢的选择, 由于参与的多个器官的疾病。
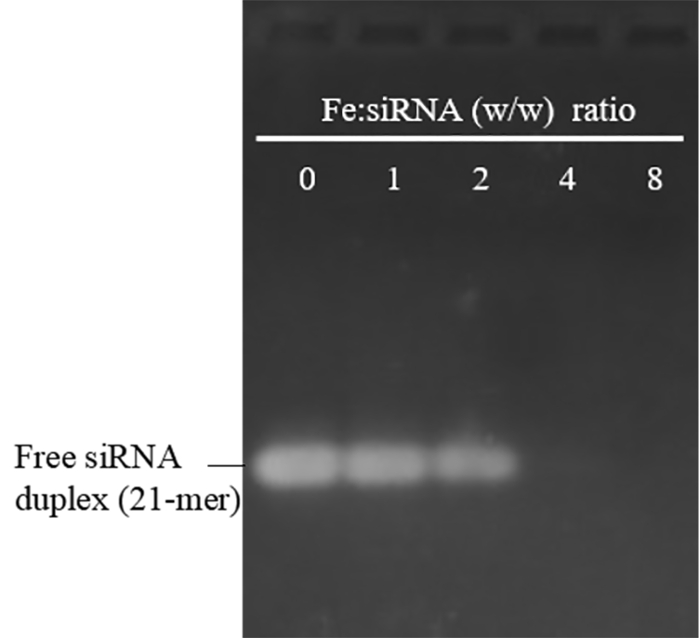
图 1: PEI-SPION/siRNA 配合物的琼脂糖电泳形成于不同的 fe: sirna (w/w) 比率.铁: sirna 比率为0表示无 pei-spes 的游离 sirna 双面体。这里使用的游离 pei-spions 的平均大小和 zeta 电位分别为30纳米和 45 mv。当 fe:sirna 比率达到4及以上时, sirna 可以与 pei-sprione 完全结合到 pei-spione, 这与以前使用 pei-spione 的结果一致, 平均大小为 48 nm, zeta 电位为 30.5 mv18。不存在缓动带 (PEI-SPION/siRNA 复合物) 可能反映了在染色过程中 sirna 无法进入 eb, 表明了强 sirna 的结合, 或 pei-spone 的冷凝能力。请点击这里查看此图的较大版本.

图 2: pei-spion 和 pei-spion/sirna nps 的生物学特性.(a) 该面板显示细胞活力分析。原264.7 细胞用具有不同 zeta 电位的 pei-spions 的指示剂量进行了16小时的处理, 然后进行了 mts 检测。细胞活力被归一化反对控制 (无微粒曝光)。数据为重复井的平均±sd。(b) 该面板显示了由 raw 264.7 细胞吸收的 pei-spion®-sirna 吸收的流动细胞仪分析。用15μ-spone 的 pe-spone (下板) 分别以4和8的铁: sirna (ww) 比对 pei-spone 进行了24小时的培养。非特异性 (nc) sirna代表非荧光 sirna。m2: 门控区域;pe-h: cy3 荧光强度。此处使用的 pei-spion 的 sirna 转染效率 (37.8 nm, 48 mv) 与以前使用 pei-spion 的研究相似, 平均尺寸为 48 nm, zeta 电位为 30.5 mv18。(c) 该面板通过可视化细胞铁矿床来分析 pei-spions即 l 的吸收情况。原264.7 细胞与7.5、15和 32μg fe/ml pei-spione (48 纳米, 30.5 mv) 混合 sirna (f:sirna = 8) 并被普鲁士蓝染色。刻度柱为20μm。(d) 该小组展示了 pei-spions 提供的 sirna 的沉默效率的体外验证。将一种特定的 sirna 靶向大鼠 il-2\-15 受体β链加载到 pei-spone (48 nm, 30.5 mv) 的 fe: sirna = 8, 然后转染大鼠腹膜巨噬细胞。用 nc sirna 作为对照。采用定量 pcr 技术对基因沉默效应进行了评价。细胞与配合物一起孵育, 以 15μg fe/ml。数据为三段井的平均值± sd。d 小组已从段等人处修改.18得到出版商的许可。请点击这里查看此图的较大版本.

图 3:体内细胞吸收 pei-spion/sirna nps.用 pei-spion (48 nm, 30.5 mv) 配制的 0.3 mgsg/kg cy3-sirna 静脉注射了30.5 关节炎大鼠。用注射 pbs 的大鼠作为对照。注射后2、8和24小时采集血液、脾脏、肝脏、肾脏和发炎的关节。利用流式细胞仪 (a) 抗 cd3 和 (b) 抗 cd11b 单克隆抗体对 pei-spion® cyp-3-西 rna nps 的细胞吸收进行了评估。在门控 cd3+ 或 cd11b+ 细胞中, 其吸收百分比为 cy3-sirna。这里显示的结果代表了两个独立的实验。这一数字已从段等人处修改。18得到出版商的许可。请点击这里查看此图的较大版本.
讨论
巨噬细胞很难通过常用的非病毒方法进行转染, 如电穿孔、阳离子脂质体和脂质种。在这里, 我们描述了一个可靠和有效的方法来转染巨噬细胞与 sirna。使用目前的协议, 90% 以上的巨噬细胞样 raw 264.7 细胞 (图 2b) 和大鼠腹腔巨噬细胞18可以用 sirna 转染, 而不会对细胞的存活能力造成重大损害。该方法依赖于由氧化铁芯和 pei 壳组成的纳米载体--的输送平台 pei-spion。因此, 该协议的第一步是合成适合 sirna 传递的 pei-spione。通常情况下, 通过配体交换方法从油酸包衣 spions 中制备果皮, 用 pei 或其衍生物15直接从 spios 表面交换油酸, 生成带正电荷的亲水性 np.表面。在这里介绍的情况下, 在 spion 表面上封顶的油酸被水溶性二甲氨基琥珀酸所取代, 然后通过静电相互作用将 pei 加载到 spiic 表面。该方法温和、易于大量制备, 合成的 np 在水20中具有良好的稳定性。众所周知, pei 具有细胞毒性, 毒性与其分子量21密切相关。为了确保安全, 合成 pei-spions 时的一个重要考虑因素是, 这些粒子被涂覆了低分子量的 pei, 这是在本协议中的 10 kda。pei 的不良毒性作用主要是由其正电荷介导的;因此, pei-spions 的 zeta 电位的测量是必不可少的, 其数值不应高于 37 mv。只需降低 pei 含量, 就可以减少正电荷。成功应用这种 sirna 输送系统的另一个关键步骤是通过凝胶阻滞优化 f:sina 比率。在低 fe: sirna 比率下, sirna 分子仍然能够与 pei-spions 结合, 这似乎是合理的。在这种情况下, 可以使用少量的 pei-spions, 从而最大限度地减少其潜在的细胞毒性。
如果没有产生所需的沉默效率或治疗效果, 请使用流式细胞仪或荧光显微镜检查转染效率, 使用加载荧光标记 sirna 的载体。或者, PEI-SPION/siRNA 的吸收可以通过传统的普鲁士蓝染色进行检测, 这种染色足够灵敏, 可以检测细胞中的铁颗粒。如果转染效率确实较低, 则可能需要优化转染条件, 如细胞密度、转染时间和 PEI-SPION/siRNA 颗粒的剂量。细胞通道数也会影响转染22的效率.在大多数情况下, 沉默效应不足并不是由 pei-spionsirna 摄取不足引起的, 因为目前的 pei-spion 系统已被证明有助于有效地向巨噬细胞转移 sirna。有时, 结合几个针对同一基因的 sirna 可以是提高击倒效率的好策略。值得注意的是, 虽然 rnai 一般发生在转染24小时内, 但基因沉默的发生和持续时间取决于目标的转化率、sirna 的稀释率和寿命, 甚至取决于培养基中血清的浓度。因此, 可能需要时间过程实验来准确地确定最大效应 2,22的时间点。对于体内应用, 治疗效果还取决于 sirna 靶点是否以及在多大程度上促成了疾病表型;因此, 选择合适的 sirna 目标对于预期结果至关重要。
该协议在向巨噬细胞传递 sirna 方面有几个优点。(1) 该方法操作简单, 是一种廉价的大量生产 pei-spions 的方法, 所生产的 nps 如果保存在 4°c, 在水中稳定12个月以上。(2) 巨噬细胞对 spion 的自发吞噬促进了 pei-spion 介导的 sirna 的有效转移, 从而提高了转染效率。预计该方法除 raw 264.7 细胞和大鼠腹腔巨噬细胞外, 只要转染剂量优化, 还适用于其他巨噬细胞系和原代巨噬细胞。(3) 与其他巨噬细胞转染方法 (如核核素) 相比, sirna 转染速度快、容易进行, 这很耗时, 需要一个核装置 2.(4) pei-spion 可以作为某些疾病模型中巨噬细胞靶向的全身 sirna 传递的理想载体。巨噬细胞在各种慢性炎症性疾病以及肿瘤的发展和进展中发挥着关键作用;这些疾病的一个显著组织学特征是血管异常, 内皮细胞泄漏。因此, 由于增强了渗透性和保留效果, 系统管理的药物负载的 np 往往会在病变组织中积累, 并容易被局部巨噬细胞捕获, 从而增强特异性, 减少副作用, 并改善疗效。在佐剂关节炎的大鼠模型中, 静脉注射 pei-spionsrna 复合物的 cd11b+ 细胞在注射18后的前24小时内被 ~ 40% 的 cd11b+ 细胞吸收。相反, 当阳离子脂质体被用作小鼠全身 sirna 传递的载体时, 关节炎关节中 cd11b+ 细胞中只有不到5% 的细胞将 sirna 脂质体23包裹在一起.此外, 由于其磁特性, 外磁磁场的应用可能会进一步促进 PEI-SPION/siRNA 复合物在目标组织中的积累, 并增加其细胞吸收。同样值得注意的是, 这种 ssirna 负载的 np 不仅可用于调节巨噬细胞功能, 还可用于巨噬细胞的成像, 以提供诊断信息、监测治疗效果和预测患者的临床结果12。
但是, 与此协议关联的限制确实存在。pei-spion 系统显示了一个狭窄的剂量范围的 sirna 交付。最大吸收发生在 raw264.7 细胞以 15μg fe/ml (图 2b和2c) 的浓度暴露于 pei-spion/spionsrna 时。将 pei-spion/sirna 浓度增加到 32μg fe-ml 并没有导致细胞吸收增加 (图 2c), 相反, 可能会增加由于 pei 的内在毒性而导致细胞死亡的风险。另一方面, 将 pei-spion/sirna 降低到5或7.5 微克 fe/ml 明显减少了 raw264.7 细胞对其的吸收 (图 2b和2c)。因此, 我们提出最佳的 PEI-SPION/siRNA 浓度为约15 微克 fe/ml (最终浓度在井中) 的体外巨噬细胞转染。另一个需要考虑的限制是 pei-spions 对巨噬细胞活动的可能影响。纳米粒子可能会诱发免疫反应24, 这取决于它们的表面修饰、表面电荷、大小、形状, 甚至取决于合成它们所使用的方法。mulens-arias等人最近报告说, pei 涂层的 spions 触发巨噬细胞激活25。本文提出的 pei-spion 合成方法与 mulens-arias等人的方法有显著差异, 因此, 基于本协议制备的 pei-spion 是否会引发巨噬细胞的激活, 有待进一步研究。然而, 为了明确解决这一问题, 我们建议, 除了与争抢 sirna 相结合的 pei-spion 之外, 车辆本身 (仅限 pei-spion) 在使用本协议时还可以作为另一个控件。最后, 该协议由于其相对较大的尺寸, 不适合 dna 的传递。
总之, 我们提出了一种方法, 利用 pei 涂层 spion 作为载体, sirna 转染在巨噬细胞。这些 nps 可以有效地将 sirna 传递到永垂不朽的巨噬细胞系中, 并在体外传递到原代巨噬细胞中, 并在不影响细胞活力的最佳转染剂量下诱导基因沉默。此外, pei-spions 可用于体内sirna 传递巨噬细胞, 使其成为可能的图像, 以及调节巨噬细胞的功能障碍, 有助于许多慢性炎症性疾病的发展和进展和进展。癌症。
披露声明
作者没有什么可透露的。
致谢
这项工作得到了国家自然科学基金 (81772308) 和国家重点研究开发计划 (编号: 2017yfa0205502) 的支持。
材料
| Name | Company | Catalog Number | Comments |
| DMEM | Gibco | C11995500BT | Warm in 37°C water bath before use |
| Fetal bovine serum | Gibco | A31608-02 | |
| Penicillin/streptomycin (1.5 ml) | Gibco | 15140122 | |
| Tetrazolium-based MTS assay kit | Promega | G3582 | For cytotoxicity analysis |
| RAW 264.7 cell line | Cell Bank of Chinese Academy of Sciences, Shanghai, China | TCM13 | |
| Tissue culture plates (6-well) | Corning | 3516 | |
| Tissue culture dishes (10 cm) | Corning | 430167 | |
| RNase-free tubes (1.5 ml) | AXYGEN | MCT-150-C | |
| Centrifuge tubes (15 ml) | Corning | 430791 | |
| Trypsin | Gibco | 25200-056 | |
| Wistar rats | Shanghai Experimental Animal Center of Chinese Academy of Sciences | ||
| Bacillus Calmette–Guérin freeze-dried powder | National Institutes for Food and Drug Control, China | for inducing adjuvant arthritis in rats | |
| siRNA | GenePharma (Shanghai, China) | ||
| Cy3-siRNA | RiboBio (Guangzhou, China) | ||
| Polyethyleneimine (10 kDa) | Aladdin Chemical Reagent Co., Ltd. | E107079 | |
| Ammonia water | Aladdin Chemical Reagent Co., Ltd. | A112077 | |
| Oleic acid | Aladdin Chemical Reagent Co., Ltd. | O108484 | |
| Dimethylsulfoxide | Aladdin Chemical Reagent Co., Ltd. | D103272 | |
| FeSO4•7H2O | Sinopharm Chemical Reagent Co., Ltd | 10012118 | |
| FeCl3•6H2O | Sinopharm Chemical Reagent Co., Ltd | 10011918 | |
| Dimercaptosuccinic acid | Aladdin Chemical Reagent Co., Ltd. | D107254 | |
| ultrafiltration tube | Millipore | UFC910096 | |
| Tetramethylammonium hydroxide solution | Aladdin Chemical Reagent Co., Ltd. | T100882 | |
| Particle size and zeta potential analyzer | Malvern, England | Nano ZS90 |
参考文献
- Murray, P. J., Wynn, T. A. Protective and pathogenic functions of macrophage subsets. Nature Reviews Immunology. 11 (11), 723(2011).
- Maeß, M. B., Wittig, B., Lorkowski, S. Highly efficient transfection of human THP-1 macrophages by nucleofection. Journal of Visualized Experiments. (91), e51960(2014).
- Zhang, X., Edwards, J. P., Mosser, D. M. The Expression of Exogenous Genes in Macrophages: Obstacles and Opportunities. Macrophages and Dendritic Cells. , Springer. 123-143 (2009).
- Zhang, M., Gao, Y., Caja, K., Zhao, B., Kim, J. A. Non-viral nanoparticle delivers small interfering RNA to macrophages in vitro and in vivo. PLoS ONE. 10 (3), e0118472(2015).
- Davignon, J. -L., et al. Targeting monocytes/macrophages in the treatment of rheumatoid arthritis. Rheumatology. 52 (4), 590-598 (2012).
- Brown, J. M., Recht, L., Strober, S. The promise of targeting macrophages in cancer therapy. Clinical Cancer Research. 23 (13), 3241-3250 (2017).
- Karunakaran, D., et al. Targeting macrophage necroptosis for therapeutic and diagnostic interventions in atherosclerosis. Science Advances. 2 (7), e1600224(2016).
- Prosperi, D., Colombo, M., Zanoni, I., Granucci, F. Drug nanocarriers to treat autoimmunity and chronis inflammatory diseases. Seminars in Immunology. 34, 61-67 (2017).
- Höbel, S., Aigner, A. Polyethylenimines for siRNA and miRNA delivery in vivo. Wiley Interdisciplinary Reviews: Nanomedicine and Nanobiotechnology. 5 (5), 484-501 (2013).
- Whitehead, K. A., Langer, R., Anderson, D. G. Knocking down barriers: advances in siRNA delivery. Nature Reviews Drug Discovery. 8 (2), 129(2009).
- Liu, G., et al. N-Alkyl-PEI-functionalized iron oxide nanoclusters for efficient siRNA delivery. Small. 7 (19), 2742-2749 (2011).
- Weissleder, R., Nahrendorf, M., Pittet, M. J. Imaging macrophages with nanoparticles. Nature Materials. 13 (2), 125(2014).
- Magro, M., et al. Covalently bound DNA on naked iron oxide nanoparticles: Intelligent colloidal nano-vector for cell transfection. Biochimica et Biophysica Acta (BBA)-General Subjects. 1861 (11), 2802-2810 (2017).
- Abdelrahman, M., et al. siRNA delivery system based on magnetic nanovectors: Characterization and stability evaluation. European Journal of Pharmaceutical Sciences. 106, 287-293 (2017).
- Zhang, H., Lee, M. -Y., Hogg, M. G., Dordick, J. S., Sharfstein, S. T. Gene delivery in three-dimensional cell cultures by superparamagnetic nanoparticles. ACS Nano. 4 (8), 4733-4743 (2010).
- Moghimi, S. M., Hunter, A. C., Murray, J. C. Long-circulating and target-specific nanoparticles: theory to practice. Pharmacological Reviews. 53 (2), 283-318 (2001).
- Harvey, A. E. Jr, Smart, J. A., Amis, E. Simultaneous spectrophotometric determination of iron (II) and total iron with 1, 10-phenanthroline. Analytical Chemistry. 27 (1), 26-29 (1955).
- Duan, J., et al. Polyethyleneimine-functionalized iron oxide nanoparticles for systemic siRNA delivery in experimental arthritis. Nanomedicine. 9 (6), 789-801 (2014).
- Fröhlich, E. The role of surface charge in cellular uptake and cytotoxicity of medical nanoparticles. International Journal of Nanomedicine. 7, 5577(2012).
- Wu, Y., et al. Ultra-small particles of iron oxide as peroxidase for immunohistochemical detection. Nanotechnology. 22 (22), 225703(2011).
- Xia, T., et al. Polyethyleneimine coating enhances the cellular uptake of mesoporous silica nanoparticles and allows safe delivery of siRNA and DNA constructs. ACS Nano. 3 (10), 3273-3286 (2009).
- Mocellin, S., Provenzano, M. RNA interference: learning gene knock-down from cell physiology. Journal of Translational Medicine. 2 (1), 39(2004).
- Courties, G., et al. et al.In vivo RNAi-mediated silencing of TAK1 decreases inflammatory Th1 and Th17 cells through targeting of myeloid cells. Blood. 116 (18), 3505-3516 (2010).
- Zolnik, B. S., Gonzalez-Fernandez, A., Sadrieh, N., Dobrovolskaia, M. A. Minireview: nanoparticles and the immune system. Endocrinology. 151 (2), 458-465 (2010).
- Mulens-Arias, V., Rojas, J. M., Pérez-Yagüe, S., Morales, M. P., Barber, D. F. Polyethylenimine-coated SPIONs trigger macrophage activation through TLR-4 signaling and ROS production and modulate podosome dynamics. Biomaterials. 52, 494-506 (2015).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。