Method Article
Polyethyleneimine beschichteten Eisenoxid-Nanopartikeln als Vehikel für die Lieferung von kleinen interferierende RNA an Makrophagen In Vitro und In Vivo
* Diese Autoren haben gleichermaßen beigetragen
In diesem Artikel
Zusammenfassung
Wir beschreiben eine Methode der Verwendung von Polyethyleneimine (PEI)-superparamagnetischen Eisenoxid-Nanopartikeln für transfecting Makrophagen mit SiRNA beschichtet. Diese Nanopartikel können effizient SiRNA zu Makrophagen in Vitro und in Vivo und Stille Ziel Genexpression liefern.
Zusammenfassung
Wegen ihre entscheidende Rolle bei der Regulation der Immunantwort Makrophagen kontinuierlich Gegenstand intensiver Forschung und stellen eine vielversprechende therapeutische Ziel bei vielen Erkrankungen wie Autoimmunerkrankungen, Arteriosklerose und Krebs. RNAi vermittelte Gen-silencing ist ein wertvoller Ansatz, Sonde und Makrophagen Funktion zu manipulieren; jedoch die Transfektion von Makrophagen mit SiRNA wird oft als technisch anspruchsvoll, und zur Zeit gibt es einige Methoden, die die SiRNA-Übertragung auf Makrophagen gewidmet. Hier präsentieren wir ein Protokoll mit Polyethyleneimine beschichteten superparamagnetischen Eisenoxid-Nanopartikeln (PEI-Mondfotos) als Vehikel für die gezielte Bereitstellung von SiRNA zu Makrophagen. PEI-Mondfotos sind in der Lage, verbindliche und vollständig kondensiert SiRNA erreicht die Fe: SiRNA-Gewichts-Verhältnis 4 und vor. In-vitro-, diese Nanopartikel können effizient SiRNA liefern, in primären Makrophagen sowie in die Makrophagen-wie RAW 264,7 Zell-Linie, ohne kompromittierende Zellviabilität an die optimale Dosis für Transfection und, letztlich, sie induzieren SiRNA-vermittelten Ziel Gen-silencing. Neben für in-vitro- SiRNA Transfection verwendet, sind PEI-Mondfotos auch ein viel versprechendes Instrument für die Bereitstellung von SiRNA zu Makrophagen in Vivo. Angesichts seiner kombinierten Funktionen der magnetische Eigenschaft und Gen-silencing Fähigkeit dürften systemisch verabreichten PEI-SPION/SiRNA-Partikel nicht nur zu modulieren, Makrophagen-Funktion, sondern auch aktivieren Makrophagen abgebildet und nachverfolgt werden. PEI-Mondfotos repräsentieren im Wesentlichen eine einfache, sichere und wirksame nonviral Plattform für SiRNA Lieferung an Makrophagen in Vitro und in Vivo.
Einleitung
Makrophagen sind eine Art von angeborenen immunen Zellen verteilt in allen Körpergeweben, wenn auch in unterschiedlichen Mengen. Durch die Herstellung einer Vielzahl von Zytokinen und anderer Vermittler, spielen sie wichtige Rollen in der Wirt Verteidigung gegen eindringende mikrobielle Krankheitserreger, in Reparatur von Gewebe nach Verletzungen und bei der Aufrechterhaltung der Homöostase-Gewebe1. Aufgrund ihrer Bedeutung waren Makrophagen kontinuierlich Gegenstand intensiver Forschung. Jedoch trotz der Prävalenz in der Genregulation und Funktionsstudien, SiRNA-vermittelten Gen-silencing ist weniger wahrscheinlich, da in Makrophagen erfolgreich diese Zellen – insbesondere primäre Makrophagen – sind oft schwer zu transfizieren. Dies kann eine relativ hohe Toxizität im Zusammenhang mit etabliertesten Transfektion Ansätze, in denen die Zellmembran chemisch ist (z. B.mit Polymeren und Lipide) zugeschrieben werden oder körperlich (z.B.durch Elektroporation und gen Kanonen) gestört, um SiRNA-Moleküle die Membran, dadurch drastisch Makrophagen Lebensfähigkeit2,3überqueren zu lassen. Darüber hinaus sind Makrophagen spezielle Fresszellen, die reich an abbauende Enzyme. Diese Enzyme können die Integrität von SiRNA, die Stummschaltung Effizienz zu schwächen, auch wenn in der Zelle3,4Gen-spezifischen SiRNA geliefert wurde beschädigt. Daher muss eine wirksame Makrophagen ausgerichtete SiRNA Delivery-System zum Schutz der Integrität und Stabilität von SiRNA während Lieferung4.
Es wird immer offensichtlicher, dass dysfunktionale Makrophagen in der Initiierung und Progression von bestimmten gemeinsamen klinischen Erkrankungen wie Autoimmunerkrankungen, Arteriosklerose und Krebs verwickelt sind. Aus diesem Grund Modulation Makrophagen-Funktion mit, zum Beispiel, SiRNA hat als eine attraktive Methode für die Behandlung dieser Erkrankungen5,6,7aufgetaucht. Obwohl große Fortschritte erzielt wurden, ist eine große Herausforderung SiRNA basierenden Behandlungsstrategie der Arme Zelle Besonderheit der systemisch verabreichten SiRNA und die unzureichende SiRNA-Aufnahme durch Makrophagen, die somit zu unerwünschten Nebenwirkungen führen. Im Vergleich mit kostenlosen Nukleinsäure-Therapeutika, die in der Regel fehlt optimale Zelle Selektivität und führen oft zu Nebenwirkungen, Medikament beladenen Nanopartikeln (NPs), aufgrund ihrer spontanen Neigung gefangen vom retikuloendothelialen System Ziel, für passive targeting zu Makrophagen in Vivo, zulassend verbesserten therapeutischen Wirksamkeit mit minimalen Nebenwirkungen8projektierbar. Aktuelle NPs erforscht für die Lieferung von RNA-Molekülen gehören anorganische darin, verschiedene Liposomen und Polymere-9. Unter anderem zeigt Polyethyleneimine (PEI), eine Art von kationischen polymeren in der Lage zu binden und kondensierenden Nukleinsäuren in stabilisierter NPs, die höchsten RNA liefert Kapazität9,10. PEI schützt Nukleinsäuren vor enzymatischen und nonenzymatic Abbau, vermittelt ihre Übertragung über die Zellmembran und fördert ihre intrazellulären Freigabe. Obwohl zunächst als ein DNA-Lieferung-Reagenz eingeführt, zeigte sich PEI anschließend zu einer attraktiven Plattform für in Vivo SiRNA Delivery, entweder lokal oder systemisch9,10.
Superparamagnetischen Eisenoxid-Nanopartikeln (Mondfotos) zeigten viel versprechend in der Biomedizin, aufgrund ihrer magnetischen Eigenschaften, Biokompatibilität, vergleichbarer Größe auf biologisch wichtige Objekte, hohe Oberfläche-Bereich-zu-Volumen-Verhältnis und leicht anpassbar Oberfläche für Bioagent Anlage11. Zum Beispiel haben wegen ihres potenziellen Nutzens als Kontrastmittel und schnelle Aufnahme durch Makrophagen Mondfotos als klinische Lieblingswerkzeug Bild Gewebe Makrophagen12entstanden. Während Mondfotos als Nukleinsäure-Lieferung Fahrzeuge11,13,14,15, nach unserer Kenntnis auch ausgiebig studiert haben enthält die Literatur einige Berichte von Mondfotos als Träger für Makrophagen-gezielte SiRNA Lieferung. Gen-Lieferung von Mondfotos ist ihre Oberfläche in der Regel mit einer Schicht von hydrophilen kationischen polymeren beschichtet auf dem negativ geladenen Nukleinsäuren elektrostatisch angezogen und angebunden werden können. Hier präsentieren wir Ihnen eine Methode zur Synthese von Mondfotos, dessen Oberfläche mit niedrigem Molekulargewicht (10 kDa), verzweigte PEI (PEI-Mondfotos) geändert wird. Diese magnetische Nanoplatforms werden dann eingesetzt, um kondensieren SiRNA, bilden PEI-SPION/SiRNA-komplexe, die SiRNA-Transport in die Zelle zu ermöglichen. Wir Grund, dass spontane Phagozytose von Mondfotos durch Zellen des retikuloendothelialen System16, gepaart mit der starken Fähigkeit der Bindung und kondensierenden Nukleinsäuren von PEI, rendert PEI-Mondfotos geeignet für den effizienten Transport von SiRNA in Makrophagen. Die hier vorgestellten Daten unterstützen die Machbarkeit des PEI-SPION/SiRNA-mediated Gene silencing in Makrophagen in Kultur als auch in Vivo.
Protokoll
Alle Methoden, die mit lebenden Tieren, im Einklang mit dem Tier durchgeführt wurden kümmern und Richtlinien der Southeast University, China.
1. Vorbereitung des PEI-Mondfotos
-
Vorbereitung der Ölsäure geändert Mondfotos
- Lösen sich FeCl3•6H2O und FeSO4•7H2O in Wasser unter dem Schutz der N2.
- Hinzufügen von FeCl3•6H2O 28 g und 20 g FeSO4•7H2O in 80 mL entionisiertem Wasser in ein Becherglas. Führen Sie N2 in das Wasser durch eine Glas-Leitung ein und rühren Sie, bis die feste Materie aufgelöst hat.
- Erhitzen Sie das Reaktionsgemisch auf 72 ° C mit einer mitreißenden Rate von 800 u/min, gefolgt von Zugabe von 40 mL Ammoniakwasser (28 %). 5 min köcheln.
- Hinzugeben Sie 9 mL Ölsäure tropfenweise in die oben genannten Lösung und rühren Sie es bei 72 ° C für 3 h.
- Kühlen Sie die resultierende Lösung auf Raumtemperatur (RT). Die Lösung über magnetische Trennung herbeiführen.
- Waschen Sie den Niederschlag mit Mondfotos 3 X mit absoluten Spiritus und dann den Niederschlag in 100 mL N-Hexan zu zerstreuen.
- Lösen sich FeCl3•6H2O und FeSO4•7H2O in Wasser unter dem Schutz der N2.
-
Vorbereitung der Dimercaptosuccinic Säure-modifizierte Mondfotos
- Hinzufügen von 800 mg von Ölsäure (OA)-geändert Mondfotos zerstreut in 200 mL N-Hexan und 400 mg Dimercaptosuccinic Säure (DMSA) in 200 mL Aceton, dispergiert in einem drei-Hals-Kolben in einem Wasserbad bei 60 ° C.
Hinweis: Zur Bestimmung der Konzentration von OA-modifizierte SPION aus dem vorherigen Schritt erhalten, nehmen Sie ein kleines Volumen (z.B. 1 mL) der SPION Dispersion, verdampfen Sie das N-Hexan und wiegen Sie das resultierende Pulver. - Fügen Sie 200 µL Triethylamin tropfenweise in die oben genannten Lösung mit Rühren bei 1.000 u/min und zurückfließt.
- Erhalten Sie nach 5 h rühren und zurückfließt einen schwarzen Niederschlag durch magnetische Trennung.
- Die hydrophilen Mondfotos in entionisiertem Wasser homogen durch den pH-Wert der Lösung mit Tetramethylammonium Hydroxid zu zerstreuen.
- Hinzufügen von 800 mg von Ölsäure (OA)-geändert Mondfotos zerstreut in 200 mL N-Hexan und 400 mg Dimercaptosuccinic Säure (DMSA) in 200 mL Aceton, dispergiert in einem drei-Hals-Kolben in einem Wasserbad bei 60 ° C.
-
Vorbereitung der PEI-Mondfotos
- DMSA-modifizierte SPION kolloidalen Lösung tropfenweise hinzufügen, in PEI-Lösung (10 kDa) in einen 500-mL drei Hals Kolben unter mechanischen Rühren bei 1.000 u/min für 2 h (WFe: WPEI = 1:3).
Hinweis: Die Ladung und Größe des PEI-Mondfotos variieren je nach Verhältnis von WFe WPEI. Der W-Fe: WPEI -Verhältnis von 1:3 kann ein guter Ausgangspunkt zur Synthese von PEI-Mondfotos für SiRNA Delivery geeignet sein. - Fügen Sie die resultierende Lösung in eine Ultrafiltration Rohr mit einem Molekulargewicht Cutoff von 100 kDa und einen Inhalt von 15 mL; dann, Zentrifuge bei 5.400 x g für 10 min bis die restliche Lösung 1 mL ist. Die Lösung für das Volumen 15 mL wieder machen und wiederholen den obigen Vorgang 10 deionisiertes Wasser hinzufügen X, um das Endprodukt zu erhalten. Dann filtern Sie die Lösung durch einen 0,22-μm-Filter und speichern Sie das Endprodukt bei 4 ° C.
- Bestimmen Sie die Fe-Konzentration von PEI-Mondfotos durch die kolorimetrischen Verfahren unter Verwendung Phenanthroline17. PEI-Mondfotos mit entionisiertem sterilem Wasser zu einer Konzentration von 1 mg Fe/mL verdünnen und bei 4 ° c lagern
- Verdünnen Sie 10 μL der PEI-SPION-Lösung (1 mg Fe/mL), 1 mL mit entionisiertem Wasser; Anschließend testen Sie die hydrodynamischen Größe und Zetapotenzial durch ein dynamischen Lichtstreuung Gerät.
Hinweis: Bereiten Sie PEI-Mondfotos im Bereich von etwa 30-50 nm. In diesem Größenbereich scheint die Wirkung der NP Größe auf SiRNA Bindung und zelluläre Aufnahme nicht erheblich sein. PEI-Mondfotos mit einer durchschnittlichen Zeta-Potential über + 37 mV in der Dosisbereich zur Transfektion toxisch sein kann, und ein Zytotoxizität-Assay durchgeführt werden, um Sicherheit zu gewährleisten. Die Oberflächenladung und hydrodynamischen Größe der Nanopartikel können durch Anpassen der PEI-Inhalte innerhalb eines gewünschten Bereichs gesteuert werden.
- DMSA-modifizierte SPION kolloidalen Lösung tropfenweise hinzufügen, in PEI-Lösung (10 kDa) in einen 500-mL drei Hals Kolben unter mechanischen Rühren bei 1.000 u/min für 2 h (WFe: WPEI = 1:3).
2. Vorbereitung und Agarose-Gelelektrophorese PEI-SPION/SiRNA NPS
- Verdünnen Sie SiRNA mit RNase-freies Wasser um eine Endkonzentration von 20 μM (0,26 µg/μl) zu erzielen.
- Bereiten Sie fünf RNase-freie Mikrozentrifugenröhrchen beschriftet, 0, 1, 2, 4 und 8. Die Etiketten sind verschiedene Fe: SiRNA-Gewichts-Verhältnis. Pipettieren 3 μL der SiRNA-Lösung für alle Rohre (~0.8 μg SiRNA/Röhre).
- Fügen Sie 0, 0,8, 1,6 mm, 3,2 und 6.4 μg Fe in Form von PEI-Mondfotos beschriftet 0, 1, 2, 4 und 8, bzw. Rohre hinzu. Halten Sie die Gesamtstichprobe jede Röhre weniger als 20 μL. Mischen Sie, indem Sie sanft auf und ab pipettieren.
- Inkubieren Sie die Mischungen bei RT für 30 min, PEI-SPION/SiRNA Komplexbildung zu ermöglichen. Während dieser Zeit machen Sie eine 3 % Agarose mit hohem Reinheitsgrad Agarose-gel.
Hinweis: Zusätzliche PEI-SPION/SiRNA-komplexe mit anderen Fe: SiRNA-Verhältnisse (z.B.5 oder 6) können vorbereitet und getestet werden. - 1 μl 6 x DNA Loading Puffer je 5 μl Probe hinzufügen und vorsichtig mischen. Laden Sie alle Proben und Elektrophorese mit 5 V/cm ausgeführt, bis die Bromophenol Blue bis zu zwei Drittel der Länge des Gels migriert. Färben Sie das Gel mit Interkalation Bromid (EB) für 15-20 min.
Hinweis: Frisch zubereitete Elektrophorese Puffer und EB-Lösung sollte verwendet werden. - SiRNA Bands unter einem UV-imaging-System zu visualisieren. Überprüfen Sie die Fe: SiRNA-Verhältnisse an die SiRNA Formen komplexe mit PEI-Mondfotos und infolgedessen die Bands kostenlos SiRNA vertreten sind, verzögert oder nicht nachweisbar.
3. die Transfektion von RAW264.7 Makrophagen In-vitro-
- Kultur Mauszellen Makrophagen-wie RAW264.7-ein 10-cm-Schüssel mit DMEM komplette mittlere mit 10 % fötalen Rinderserum (FBS) pro 100 U/mL Penicillin pro 100 μg/mL Streptomycin bei 37 ° C in einem 5 % CO2 Inkubator.
- Aspirieren Sie einen Tag vor der Transfektion Medium aus den Zellen und spülen Sie sie mit Phosphat-gepufferte Kochsalzlösung (pH 7,4). Die 10-cm-Schüssel 1 mL von 0,25 % Trypsin hinzufügen. Trypsinize RAW264.7 Zellen für ca. 5-10 min bei 37 ° C in einem 5 % CO2 Inkubator.
- Wenn die Mehrheit der Zellen (nach ca. 5-10 min) getrennt haben, fügen Sie 5 mL DMEM komplette Medium in die Schale, die Trypsin zu inaktivieren. Pipettieren rauf und runter, Zellcluster in Einzelzellen zu zerstreuen.
- Übertragen Sie die Zellsuspension auf eine sterile 15 mL konische Rohr. Zentrifugieren sie 300 X g für 3 min bei RT. Entfernen Sie überstand.
- Aufschwemmen der Zellen mit 5 mL frischem DMEM komplette Medium und die Zellen zu zählen.
- Platte 9 x 104 Zellen pro auch in einem 6-Well-Platte mit 2 mL des kompletten DMEM Medium und Inkubation bei 37 ° C in einem 5 % CO2 Inkubator für ca. 24 h.
Hinweis: Wenn Sie einen Teller mit einer anderen Größe zu verwenden, einstellen Sie die vergoldeten Zelldichte im Verhältnis zu der relativen Fläche so, dass die Zellen 80 % Konfluenz zum Zeitpunkt der Transfektion erreichen. - Wenn Zelle Konfluenz 80 % ist, entfernen Sie das Medium aus den Zellen zu und ersetzen Sie es mit 1 mL DMEM komplette Medium pro Bohrloch. Rückkehr der Plattenrandes in den Inkubator bis PEI-SPION/SiRNA-komplexe vorbereitet worden und sind bereit für den Einsatz (ca. 30 min).
- Bereiten Sie PEI-SPION/SiRNA-komplexe: berechnen Sie die Menge der PEI-SPION/SiRNA-komplexe für eine Transfektion Experiment benötigt. Mischen Sie in einem 1,5 mL RNase-freie Microcentrifuge Schlauch einen angemessenen Betrag von PEI-Mondfotos mit SiRNA bei einem bestimmten Fe: SiRNA-Verhältnis. Zum Beispiel um PEI-SPION/SiRNA NPs enthält 100 µg Fe bei einem Fe: SiRNA-Verhältnis von 4 vorzubereiten, addieren Sie 100 µL (1 mg Fe/mL) PEI-Mondfotos, 96 μL von SiRNA (0,26 µg/μl), gefolgt von sanft mit einer Mikropipette mischen. 30 min bei RT inkubieren
Hinweis: Bereiten Sie ein Volumen von PEI-SPION/SiRNA-Komplex, 10 % mehr als die abschließende Gesamtmasse entfallen jegliche anfallende Verluste ist. Stellen Sie PEI-SPION/SiRNA-komplexe bei niedrigen Fe: SiRNA Verhältnisse, unter denen SiRNA-Moleküle werden auf PEI-Mondfotos vollständig geladen und somit können kleine Mengen von PEI-Mondfotos verwendet werden, um potenzielle Zytotoxizität zu minimieren. Pilotprojekte (Gel Retardierung Assay) für die Optimierung des Fe: SiRNA sind notwendig. - Nehmen Sie die 6-Well-Platte aus dem Inkubator (Schritt 3,7). Fügen Sie eine gewünschte Lautstärke des PEI-SPION/SiRNA komplexes tropfenweise in jede Vertiefung und wirbeln Sie die Platte vorsichtig um eine gleichmäßige Verteilung zu gewährleisten. Die Platte in den Inkubator erst die Bewertung der zellulären Aufnahme oder gen Knockdown Effizienz (1-3 d) zurück.
Hinweis: Transfecting Makrophagen mit PEI-SPION/SiRNA in einer Konzentration von ~ 15 μg Fe/mL können Transfection Leistungsfähigkeit maximieren bei gleichzeitiger Minimierung der möglichen Zytotoxizität.
4. systemische Lieferung von SiRNA zu Makrophagen bei Ratten mit experimentellen Arthritis
- Erhalten Sie spezifische Erreger-freie männliche Wistar-Ratten, die 7 Wochen alt sind. Gewöhnen Sie die Ratten für 7D vor Gebrauch und versorgen sie mit ausreichend Nahrung und Wasser. Adjuvanter Arthritis (AA) bei den Ratten als zuvor beschriebenen18zu induzieren.
- Bereiten Sie PEI-SPION/SiRNA-komplexe wie in Schritt 3.8 beschrieben vor.
- Die PEI-SPION/SiRNA NPs (0,3 mg von SiRNA/kg) in der AA Ratten über die Rute Vene injizieren. Bewerten der zelluläre Aufnahme über, zum Beispiel Durchflusszytometrie, Gewebe Bioverteilung über, zum Beispiel eine Echtzeit-Fluoreszenz imaging-System, oder therapeutische Wirkungen anhand z. B. klinische, histologische und radiologische Analysen zur gewünschten Zeit weist18.
Hinweis: Für Mobilfunk und Gewebe Bioverteilung Studien, behandeln Sie die Ratten mit einer einzigen Injektion die gewünschte NPS; injizieren Sie für Therapiestudien die Ratten mit dem NPs geprüft 1 x pro Woche für drei aufeinander folgende Wochen sein.
Ergebnisse
Die Größe und Zeta Potential der PEI-Mondfotos vorbereitet mit diesem Protokoll wurden im Bereich von 29-48 nm (Polydispersität Index: 0,12 - 0,23) und 30-48 mV, beziehungsweise. Sie waren seit über 12 Monaten ohne offensichtliche Aggregation im Wasser bei 4 ° C stabil. Um ihre SiRNA verbindliche Fähigkeit zu bewerten, wurden PEI-Mondfotos mit SiRNA bei verschiedenen Fe: SiRNA-Gewichts-Verhältnis gemischt. Abbildung 1 zeigt, dass erreicht die Fe: SiRNA-Gewichts-Verhältnis 4 und höher, die Band von freien SiRNA war völlig fehlt, was bedeutet erfolgreiche SiRNA Bindung an PEI-Mondfotos. Ein wichtiges Anliegen von PEI in biomedizinische Anwendung ist seine Giftigkeit, die die starke positive Ladung, besonders bei hohen Molekulargewichte und hohen Dosen führt. Wie in Abbildung 2A, PEI-Mondfotos mit einem Zeta potential gezeigt 30,5 und 37 mV nicht scheinbare Zytotoxizität in Konzentrationen bis zu 30 μg Fe/mL aufweisen, die über zweifache höher als die Konzentration (15 μg Fe/mL) normalerweise verwendet für Zelle Transfektion ist. Jedoch PEI-Mondfotos mit einem Zeta-Potential von 48 mV wurden giftige selbst bei der niedrigsten Dosis geprüft (10 μg Fe/mL). PEI-Mondfotos besitzen daher eine Gebühr-abhängige Toxizität. Da kationische Ladung nicht wichtig für die NP-Aufnahme durch Makrophagen19ist, empfehlen wir, die PEI-Mondfotos mit einem durchschnittlichen Zetapotential nicht höher als + 37 mV sind für die SiRNA-Übertragung verwendet, obwohl SiRNA Bindung die Ladung zu einem gewissen Grad verringern würde und lindern Sie Zytotoxizität18.
Um die mögliche Anwendung von PEI-Mondfotos für SiRNA Lieferung an Makrophagen zu testen, wurde die in-vitro- Transfektion mit murinen Makrophagen-Zelllinie RAW 264,7 durchgeführt. Wie durch Durchflusszytometrie analysiert, wurden mehr als 90 % der Zellen mit Gewebekulturen beschrifteten PEI-SPION/SiRNA-komplexe bei 15 µg Fe/mL (Abb. 2 b) transfiziert. In Bezug auf Transfection Leistungsfähigkeit gab es eigentlich keinen Unterschied zwischen PEI-SPION/SiRNA NPs an Fe: SiRNA-Gewichts-Verhältnis von 4 und 8, gebildet, obwohl die letztgenannte Bedingung der NPs, die gebildet wurden kleiner und schwächer in positive Ladung unterstanden weil eine geringere Menge von SiRNA pro Partikel geladen wurde. Wir auch bewertet die Wirkung von PEI-SPION/SiRNA Konzentration auf zelluläre Internalisierung von preußischen Blaufärbung. Wie in Abbildung 2dargestellt, waren die blauen Flecken in den transfizierten Zellen minimal nachweisbar bei 7,5 µg Fe/mL, aber deutlich sichtbar bei 15 µg Fe/mL. Interessanterweise die PEI-SPION/SiRNA-Konzentration auf 32 µg Fe/mL nicht die Färbung Intensitäten wahrscheinlich erhöhen weil die PEI-SPION/SiRNA-Aufnahme bei Konzentrationen um 15 µg Fe/mL gesättigt war. Darüber hinaus die Fähigkeit des PEI-Mondfotos für die Vermittlung der SiRNA-Übertragung wurde in primären Makrophagen18bestätigt, und die hier vorgestellte Methode hatte eine hohe SiRNA Transfection Leistungsfähigkeit in Ratte peritonealen Makrophagen, entspricht damit in RAW264.7 Zellen. Die peritonealen Makrophagen transfiziert mit PEI-Mondfotos beherbergen bestimmte SiRNA zeigte eine signifikante Abnahme in der Ziel-mRNA-Ebene im Vergleich zu unspezifischen SiRNA (Abb. 2D), was impliziert, dass SiRNA konnte entfliehen Endozytose-Vesikel in der Zytoplasma und Reichweite der RNAi-Maschinen.
Wir haben früher auch in Vivo zelluläre Aufnahme systemisch verabreichten PEI-SPION/SiRNA-komplexe bei Ratten mit adjuvanter Arthritis18untersucht. Wir analysierten PEI-SPION/SiRNA Transfection Leistungsfähigkeit in phagocytic Makrophagen und nonphagocytic T-Lymphozyten. Wie in Abbildung 3dargestellt, nahm CD11b + Zellen effizienter als CD3 + Zellen zu jedem Zeitpunkt in alle Organe untersucht, darauf hinweist, dass PEI-SPION/SiRNA NPs bevorzugt Makrophagen18Ziel PEI-SPION/SiRNA-komplexe. Insbesondere wurde eine hochrangige Ansammlung von der NPs beobachtet in entzündeten Gelenken18, darauf hindeutet, dass die PEI-SPION eine attraktive Plattform für die systemische Lieferung von SiRNA-Therapeutika bei rheumatoider Arthritis sein kann, deren Pathogenese verknüpft ist Makrophagen Dysfunktion und für welche lokalen SiRNA Administration ist keine beliebte Wahl aufgrund der Beteiligung von mehreren Organen der Krankheit.
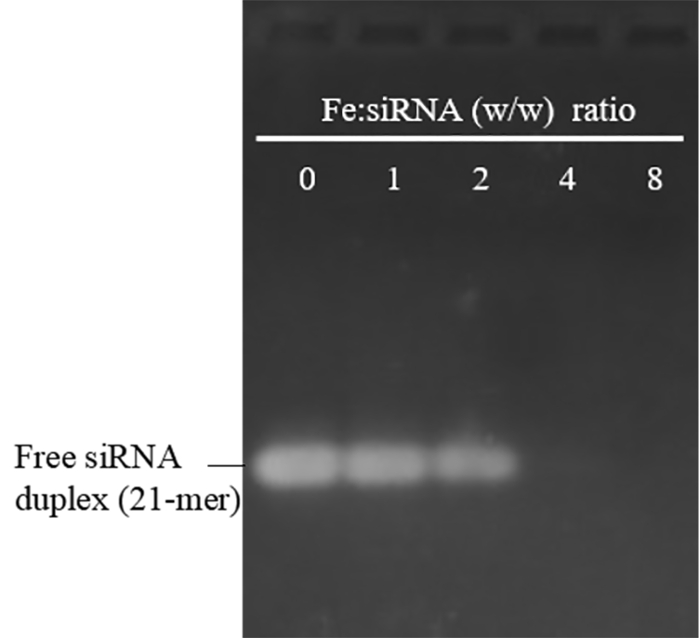
Abbildung 1: Agarose-Gelelektrophorese der PEI-SPION/SiRNA-komplexe an verschiedenen Fe: SiRNA (w/w) Verhältnisse gebildet. Fe: SiRNA Verhältnis 0 stellt kostenlose SiRNA Duplex ohne PEI-MONDFOTOS. Die durchschnittliche Größe und Zeta-Potential von freien PEI-Mondfotos verwendet hier waren 30 nm und 45 mV. SiRNA konnte vollständig binden, PEI-Mondfotos erreicht das Fe: SiRNA-Verhältnis 4 und höher, Einklang mit den bisherigen Ergebnissen mit PEI-Mondfotos mit einer durchschnittlichen Größe von 48 nm und eine Zeta-Potential von 30,5 mV18. Das Fehlen der zurückgebliebene Bands (PEI-SPION/SiRNA-komplexe) spiegeln Unzugänglichkeit von SiRNA, EB, während der Färbung, ein Hinweis auf starke SiRNA Bindung und/oder die kondensierende Fähigkeit des PEI-Mondfotos. Bitte klicken Sie hier für eine größere Version dieser Figur.

Abbildung 2: biologische Charakterisierung von PEI-SPION und PEI-SPION/SiRNA NPs. (A) dieses Panel zeigt einen Zelle Lebensfähigkeit Assay. RAW 264,7 Zellen wurden für 16 h mit der angegebenen Dosen von PEI-Mondfotos mit verschiedenen Zeta-Potential behandelt und anschließend ein MTS-Test durchgeführt wurde. Die Zellviabilität war gegen die Kontrolle (keine Partikel Exposition) normalisiert. Die Daten sind der Mittelwert ± SD von doppelten Brunnen. (B) dieses Panel zeigt eine durchflusszytometrischen Analyse der PEI-SPION/Cy3-SiRNA-Aufnahme von RAW 264,7 Zellen. Die Zellen wurden jeweils für 24 h mit 15 µg Fe/mL (obere Leiste) oder 5 μg Fe/mL (untere Leiste) PEI-Mondfotos komplexiert mit Cy3 beschriftet SiRNA bei einem Fe: SiRNA (w/w)-Verhältnis von 4 und 8, inkubiert. Unspezifische (NC) SiRNA stellt fluoreszierende SiRNA nicht–. M2: gated Region; PE-H: Cy3 Fluoreszenzintensität. Die SiRNA Transfection Leistungsfähigkeit der PEI-Mondfotos verwendet hier (37,8 nm, 48 mV) war ähnlich wie bei einer früheren Studie mit PEI-Mondfotos mit einer durchschnittlichen Größe von 48 nm und eine Zeta-Potential von 30,5 mV18. (C) dieses Panel zeigt eine Analyse der PEI-SPION/SiRNA-Aufnahme durch die Visualisierung der zellulären Eisenvorkommen. RAW 264,7 Zellen inkubiert mit 7,5, 15 und 32 μg Fe/mL PEI-Mondfotos (48 nm, 30,5 mV) komplexiert mit SiRNA (Fe: SiRNA = 8) und von Preußisch-Blau gefärbt. Der Maßstabsbalken sind 20 μm. (D) dieses Panel zeigt eine in-vitro- Validierung der Stummschaltung Effizienz von SiRNA von PEI-Mondfotos geliefert. Eine spezifische SiRNA-targeting Ratte IL-2/15-Rezeptor β Kette wurde auf PEI-Mondfotos geladen (48 nm, 30,5 mV) bei Fe: SiRNA = 8, und dann in Ratte peritonealen Makrophagen transfiziert. Ein NC-SiRNA diente als Kontrolle. Die Gen-silencing Effekt wurde anhand quantitativer PCR. Die Zellen wurden mit den komplexen bei 15 μg Fe/mL inkubiert. Die Daten sind der Mittelwert ± SD von dreifacher Brunnen. Panel D wurde von Duan Et Al. modifiziert 18 mit Erlaubnis des Herausgebers. Bitte klicken Sie hier für eine größere Version dieser Figur.

Abbildung 3: In Vivo zelluläre Aufnahme von PEI-SPION/SiRNA NPs. Drei arthritische Ratten wurden mit einer einzigen Dosis von 0,3 mg/kg Cy3 SiRNA mit PEI-SPION formuliert intravenös injiziert (48 nm, 30,5 mV). Eine Ratte injiziert mit PBS diente als Kontrolle. Blut, Milz, Leber, Niere und entzündeten Gelenken sammelten bei 2, 8 und 24 h nach der Injektion. Die zelluläre Aufnahme von PEI-SPION/Cy3-SiRNA NPs wurde von Durchflusszytometrie mit Anti-CD3 (A) und (B) Anti-CD11b monoklonalen Antikörpern bewertet. Die Prozentsätze sind Cy3 SiRNA Akzeptanz innerhalb der geschlossenen CD3 + oder CD11b +-Zellen. Die hier dargestellten Ergebnisse sind repräsentativ für zwei unabhängige Experimente. Diese Zahl wurde von Duan Et Al. modifiziert 18 mit Erlaubnis des Herausgebers. Bitte klicken Sie hier für eine größere Version dieser Figur.
Diskussion
Makrophagen sind refraktär gegenüber von häufig verwendeten nonviral Ansätze wie Elektroporation, kationische Liposomen und Lipid Arten transfizieren. Hier haben wir eine zuverlässige und effiziente Methode, um Makrophagen mit SiRNA transfizieren. Mit Hilfe dieses Protokolls, werden über 90 % der Makrophagen-wie RAW 264,7 Zellen (Abb. 2 b) und Ratte peritonealen Makrophagen18 mit SiRNA ohne wesentliche Beeinträchtigung des die Zellviabilität transfiziert können. Diese Methode hängt der Übertragungsplattform PEI-SPION, das ist ein Nanocarrier bestehend aus einem Kern aus Eisenoxid und eine Schale von PEI. Also, ist der erste wichtige Schritt des Protokolls die Synthese von PEI-Mondfotos geeignet für SiRNA Lieferung. In der Regel PEI-beschichtete Mondfotos bereiten wir aus Ölsäure-beschichtete Mondfotos durch ein Ligand-Austausch-Verfahren in denen Ölsäure durch PEI oder seine Derivate15, direkt von der Oberfläche des Mondfotos ausgetauscht wird erzeugen hydrophile NPs mit einem positiv geladenen Oberfläche. Im hier vorgestellten Fall die Ölsäure auf der Oberfläche der Mondfotos gekappt wurde ersetzt durch wasserlösliche Dimercaptosuccinic Säure, und dann wurde PEI verladen SPION Oberflächen durch elektrostatische Wechselwirkungen. Diese Methode ist sanft und einfach in großen Mengen zuzubereiten, und der synthetisierten NPs haben ausgezeichneten Stabilität in Wasser20. Es ist bekannt, dass PEI zytotoxische und die Toxizität stark mit seiner Molekulargewicht21 korreliert. Um Sicherheit zu gewährleisten, ist eine wichtige Überlegung bei der Synthese von PEI-Mondfotos, dass diese Partikel mit niedrigem Molekulargewicht PEI, beschichtet sind, die 10 kDa in diesem Protokoll ist. Die unerwünschte toxische Wirkung von PEI ist vor allem durch seine positive Ladung vermittelt; Daher ist die Messung der Zeta-Potential von PEI-Mondfotos unerlässlich, und der Wert sollte nicht höher als 37 mV. Eine Abnahme der positiven Ladung lässt sich einfach durch die Reduzierung des PEI-Inhalts. Ein weiterer wichtiger Schritt für den erfolgreichen Einsatz dieser SiRNA Delivery Systems ist die Optimierung des Verhältnisses von Gel Retardierung Fe: SiRNA. Es scheint vernünftig zu PEI-SPION/SiRNA-komplexe niedrige Fe: SiRNA-Verhältnisse unter denen SiRNA Moleküle binden an PEI-Mondfotos noch fähig sind. In diesem Fall können kleine Mengen von PEI-Mondfotos verwendet werden, damit Minimierung ihrer potenziellen Zytotoxizität.
Für den Fall, dass eine gewünschte Stummschaltungs-Effizienz oder therapeutische Wirkung nicht produziert wird, prüfen Sie Transfektion von Flow Cytometry oder Fluoreszenz Mikroskopie mit den Träger mit Gewebekulturen beschrifteten SiRNA geladen. Alternativ kann die PEI-SPION/SiRNA-Aufnahme von konventionellen preußischen Blaufärbung, untersucht werden, ist empfindlich genug, um einzelne Granulat von Eisen in Zellen zu erkennen. Wenn die Transfektion Effizienz in der Tat gering ist, kann es erforderlich, die Transfektion Bedingungen z. B. Zelldichte und Transfektion Zeit die Dosis von PEI-SPION/SiRNA Partikel zu optimieren. Die Zelle Durchgangsnummer kann auch die Effizienz der Transfektion22beeinflussen. In den meisten Fällen verursacht ein unzureichende Stummschaltungs-Effekt nicht durch eine unzureichende Aufnahme der PEI-SPION/SiRNA, wie das gegenwärtige System der PEI-SPION gezeigt hat, um einen effektive SiRNA-Transfer zu Makrophagen zu erleichtern. Manchmal kann kombinieren mehrere SiRNAs Ausrichtung auf demselben gen eine gute Strategie, Knockdown Effizienz zu erhöhen. Es ist bemerkenswert, dass, obwohl RNAi in der Regel innerhalb von 24 Stunden nach der Transfektion tritt, Beginn und Dauer der Gen-silencing die Fluktuationsrate des Ziels, die Verdünnung und Langlebigkeit von SiRNA und sogar die Konzentration des Serums im Medium abhängig. So, mal Kurs, die Experimente erforderlich sein, um genau zu bestimmen, den Zeitpunkt der maximalen Wirkung2,22. Für in-Vivo -Anwendung die therapeutische Wirksamkeit hängt auch, ob und in welchem Umfang die SiRNA-Ziel trägt zur Krankheit Phänotypen; Somit ist die Wahl eines geeigneten SiRNA-Ziels kritisch für die erwarteten Ergebnisse.
Es gibt mehrere Vorteile dieses Protokolls für die Bereitstellung von SiRNA zu Makrophagen. (1) das Verfahren ist einfach durchzuführen und ist eine preiswerte Möglichkeit, PEI-Mondfotos in großen Mengen zu produzieren, und der NPs produziert seit mehr als 12 Monaten stabil im Wasser sind, wenn sie bei 4 ° c gelagert werden (2) spontane Phagozytose von Mondfotos durch Makrophagen ermöglicht einen effektive PEI-SPION-vermittelten SiRNA-Transfer, was hohe Transfektion Effizienz. Es wird erwartet, dass neben RAW 264,7 Zellen und Ratte peritonealen Makrophagen, dieser Ansatz für andere Makrophagen-Zelllinien und primären Makrophagen gilt, solange die Dosis zur Transfektion optimiert ist. (3) SiRNA Transfection ist schnell und leicht zu führen im Vergleich zu anderen Makrophagen Transfektion Methoden wie Nucleofection, das ist zeitaufwändig und erfordert ein Nucleofector Gerät2. (4) PEI-SPION ist ein ideales Fahrzeug für Makrophagen-bezogenen systemischen SiRNA Lieferung in bestimmte Krankheitsmodelle. Makrophagen spielen eine entscheidende Rolle in der Entstehung und Progression von verschiedenen chronischen entzündlichen Erkrankungen sowie Tumoren; und ein auffällig histologische Merkmal dieser Krankheiten ist die abnorme Blutgefäße mit undichten Endothel. Daher, aufgrund der verbesserten Durchlässigkeit und Retentionswirkung, systemisch verabreichte Medikament geladen NPs tendenziell im erkrankten Gewebe ansammeln und werden leicht durch lokale Makrophagen führt zu verbesserten Spezifität erfasst, reduziert Nebenwirkungen und verbessert therapeutische Wirksamkeit. In einem Rattenmodell der adjuvanten Arthritis wurden intravenös injizierten PEI-SPION/SiRNA-komplexe von ~ 40 % der CD11b + Zellen während der ersten 24 Std. nach der Injektion18aufgegriffen. Im Gegensatz dazu als kationische Liposomen als Träger für die systemische SiRNA Lieferung bei Mäusen verwendet wurde, weniger als 5 % der CD11b + Zellen in arthritischen Gelenken eingeschlossen die SiRNA Lipoplexes23. Darüber hinaus aufgrund ihrer magnetischen Eigenschaften, kann die Anwendung eines externen Magnetfeldes weiter erleichtern die Anhäufung von PEI-SPION/SiRNA-komplexe in den Zielgeweben und erhöhen deren zelluläre Aufnahme. Bemerkenswert ist auch, dass solche SiRNA geladen NPs nicht nur für die Modulation Makrophagen Funktion, sondern auch für bildgebende Makrophagen verwendet werden, können um diagnostische Informationen, die Wirksamkeit der Behandlung der Monitor, und Patienten klinische Ergebnisse12Vorhersagen.
Allerdings existieren Einschränkungen verbunden mit diesem Protokoll. Die PEI-SPION-System weist eine schmale Strecke der Dosierung für SiRNA Lieferung. Die maximale Aufnahme ereignete sich, als RAW264.7 Zellen, PEI - SPION/SiRNAs in einer Konzentration von 15 µg Fe/mL (Abb. 2 b und 2 C) ausgesetzt waren. Erhöhung der PEI-SPION/SiRNA-Konzentration auf 32 µg Fe/mL führte nicht zu einer Zunahme der zelluläre Aufnahme (Abbildung 2), sondern im Gegenteil, vielleicht erhöhen das Risiko von Induktion Zelltod aufgrund der intrinsischen Toxizität von PEI. Auf der anderen Seite verringert abnehmend PEI-SPION/SiRNA auf 5 oder 7,5 µg Fe/mL natürlich die Aufnahme von RAW264.7 Zellen (Abb. 2 b und 2 C). Daher schlagen wir vor, dass die optimale PEI-SPION/SiRNA Konzentration zur in-vitro- Makrophagen Transfektion ~ 15 µg Fe/mL (Endkonzentration im Brunnen). Eine weitere Einschränkung, die berücksichtigt werden muss ist die mögliche Wirkung von PEI-Mondfotos auf Makrophagen-Aktivität. Nanopartikel können die Immunantwort24, abhängig von ihrer Oberflächenmodifizierung, Oberflächenladung, Größe, Form und sogar auf die Methodik zu synthetisieren sie auslösen. Mulens-Arien Et Al. berichtete kürzlich, dass PEI-beschichtete Mondfotos Makrophagen Aktivierung25auslösen. Die Methode der PEI-SPION Zusammenfassung hier unterscheidet sich deutlich von der Mulens-Arien Et Al., und daher, ob PEI-Mondfotos bereit anhand des vorliegenden Protokoll Triggers Makrophagen Aktivierung erwartet weitere Untersuchung. Aber um dieses Anliegen eindeutig zu beheben, empfehlen wir, neben der PEI-SPION komplexiert mit Scramble SiRNA, das Fahrzeug selbst (PEI-SPION) kann als ein anderes Steuerelement dienen, wenn Sie dieses Protokoll verwenden. Zu guter Letzt eignet sich dieses Protokoll nicht für die Lieferung von DNA aufgrund seiner relativ großen Größe.
Zusammenfassend lässt sich sagen haben wir hier eine Methode der Verwendung von PEI-beschichtete Mondfotos als Vehikel für SiRNA Transfection in Makrophagen. Diese NPs können effizient liefern SiRNA in verewigt Makrophagen-Zelllinien sowie in primären Makrophagen in Vitround funktionell induzieren Gen-silencing ohne Zellviabilität an die optimale Dosis zur Transfektion. Darüber hinaus PEI-Mondfotos verwendet werden, für die in Vivo SiRNA Lieferung an Makrophagen, machen es möglich, Bild, als auch modulieren, Makrophagen, deren Dysfunktion trägt dazu bei, die Entstehung und Progression von vielen chronisch entzündlichen Erkrankungen, und Krebsarten.
Offenlegungen
Die Autoren haben nichts preisgeben.
Danksagungen
Diese Arbeit wurde von der National Natural Science Foundation of China (81772308) und National Key Research and Development Program of China (Nr. 2017YFA0205502) unterstützt.
Materialien
| Name | Company | Catalog Number | Comments |
| DMEM | Gibco | C11995500BT | Warm in 37°C water bath before use |
| Fetal bovine serum | Gibco | A31608-02 | |
| Penicillin/streptomycin (1.5 ml) | Gibco | 15140122 | |
| Tetrazolium-based MTS assay kit | Promega | G3582 | For cytotoxicity analysis |
| RAW 264.7 cell line | Cell Bank of Chinese Academy of Sciences, Shanghai, China | TCM13 | |
| Tissue culture plates (6-well) | Corning | 3516 | |
| Tissue culture dishes (10 cm) | Corning | 430167 | |
| RNase-free tubes (1.5 ml) | AXYGEN | MCT-150-C | |
| Centrifuge tubes (15 ml) | Corning | 430791 | |
| Trypsin | Gibco | 25200-056 | |
| Wistar rats | Shanghai Experimental Animal Center of Chinese Academy of Sciences | ||
| Bacillus Calmette–Guérin freeze-dried powder | National Institutes for Food and Drug Control, China | for inducing adjuvant arthritis in rats | |
| siRNA | GenePharma (Shanghai, China) | ||
| Cy3-siRNA | RiboBio (Guangzhou, China) | ||
| Polyethyleneimine (10 kDa) | Aladdin Chemical Reagent Co., Ltd. | E107079 | |
| Ammonia water | Aladdin Chemical Reagent Co., Ltd. | A112077 | |
| Oleic acid | Aladdin Chemical Reagent Co., Ltd. | O108484 | |
| Dimethylsulfoxide | Aladdin Chemical Reagent Co., Ltd. | D103272 | |
| FeSO4•7H2O | Sinopharm Chemical Reagent Co., Ltd | 10012118 | |
| FeCl3•6H2O | Sinopharm Chemical Reagent Co., Ltd | 10011918 | |
| Dimercaptosuccinic acid | Aladdin Chemical Reagent Co., Ltd. | D107254 | |
| ultrafiltration tube | Millipore | UFC910096 | |
| Tetramethylammonium hydroxide solution | Aladdin Chemical Reagent Co., Ltd. | T100882 | |
| Particle size and zeta potential analyzer | Malvern, England | Nano ZS90 |
Referenzen
- Murray, P. J., Wynn, T. A. Protective and pathogenic functions of macrophage subsets. Nature Reviews Immunology. 11 (11), 723(2011).
- Maeß, M. B., Wittig, B., Lorkowski, S. Highly efficient transfection of human THP-1 macrophages by nucleofection. Journal of Visualized Experiments. (91), e51960(2014).
- Zhang, X., Edwards, J. P., Mosser, D. M. The Expression of Exogenous Genes in Macrophages: Obstacles and Opportunities. Macrophages and Dendritic Cells. , Springer. 123-143 (2009).
- Zhang, M., Gao, Y., Caja, K., Zhao, B., Kim, J. A. Non-viral nanoparticle delivers small interfering RNA to macrophages in vitro and in vivo. PLoS ONE. 10 (3), e0118472(2015).
- Davignon, J. -L., et al. Targeting monocytes/macrophages in the treatment of rheumatoid arthritis. Rheumatology. 52 (4), 590-598 (2012).
- Brown, J. M., Recht, L., Strober, S. The promise of targeting macrophages in cancer therapy. Clinical Cancer Research. 23 (13), 3241-3250 (2017).
- Karunakaran, D., et al. Targeting macrophage necroptosis for therapeutic and diagnostic interventions in atherosclerosis. Science Advances. 2 (7), e1600224(2016).
- Prosperi, D., Colombo, M., Zanoni, I., Granucci, F. Drug nanocarriers to treat autoimmunity and chronis inflammatory diseases. Seminars in Immunology. 34, 61-67 (2017).
- Höbel, S., Aigner, A. Polyethylenimines for siRNA and miRNA delivery in vivo. Wiley Interdisciplinary Reviews: Nanomedicine and Nanobiotechnology. 5 (5), 484-501 (2013).
- Whitehead, K. A., Langer, R., Anderson, D. G. Knocking down barriers: advances in siRNA delivery. Nature Reviews Drug Discovery. 8 (2), 129(2009).
- Liu, G., et al. N-Alkyl-PEI-functionalized iron oxide nanoclusters for efficient siRNA delivery. Small. 7 (19), 2742-2749 (2011).
- Weissleder, R., Nahrendorf, M., Pittet, M. J. Imaging macrophages with nanoparticles. Nature Materials. 13 (2), 125(2014).
- Magro, M., et al. Covalently bound DNA on naked iron oxide nanoparticles: Intelligent colloidal nano-vector for cell transfection. Biochimica et Biophysica Acta (BBA)-General Subjects. 1861 (11), 2802-2810 (2017).
- Abdelrahman, M., et al. siRNA delivery system based on magnetic nanovectors: Characterization and stability evaluation. European Journal of Pharmaceutical Sciences. 106, 287-293 (2017).
- Zhang, H., Lee, M. -Y., Hogg, M. G., Dordick, J. S., Sharfstein, S. T. Gene delivery in three-dimensional cell cultures by superparamagnetic nanoparticles. ACS Nano. 4 (8), 4733-4743 (2010).
- Moghimi, S. M., Hunter, A. C., Murray, J. C. Long-circulating and target-specific nanoparticles: theory to practice. Pharmacological Reviews. 53 (2), 283-318 (2001).
- Harvey, A. E. Jr, Smart, J. A., Amis, E. Simultaneous spectrophotometric determination of iron (II) and total iron with 1, 10-phenanthroline. Analytical Chemistry. 27 (1), 26-29 (1955).
- Duan, J., et al. Polyethyleneimine-functionalized iron oxide nanoparticles for systemic siRNA delivery in experimental arthritis. Nanomedicine. 9 (6), 789-801 (2014).
- Fröhlich, E. The role of surface charge in cellular uptake and cytotoxicity of medical nanoparticles. International Journal of Nanomedicine. 7, 5577(2012).
- Wu, Y., et al. Ultra-small particles of iron oxide as peroxidase for immunohistochemical detection. Nanotechnology. 22 (22), 225703(2011).
- Xia, T., et al. Polyethyleneimine coating enhances the cellular uptake of mesoporous silica nanoparticles and allows safe delivery of siRNA and DNA constructs. ACS Nano. 3 (10), 3273-3286 (2009).
- Mocellin, S., Provenzano, M. RNA interference: learning gene knock-down from cell physiology. Journal of Translational Medicine. 2 (1), 39(2004).
- Courties, G., et al. et al.In vivo RNAi-mediated silencing of TAK1 decreases inflammatory Th1 and Th17 cells through targeting of myeloid cells. Blood. 116 (18), 3505-3516 (2010).
- Zolnik, B. S., Gonzalez-Fernandez, A., Sadrieh, N., Dobrovolskaia, M. A. Minireview: nanoparticles and the immune system. Endocrinology. 151 (2), 458-465 (2010).
- Mulens-Arias, V., Rojas, J. M., Pérez-Yagüe, S., Morales, M. P., Barber, D. F. Polyethylenimine-coated SPIONs trigger macrophage activation through TLR-4 signaling and ROS production and modulate podosome dynamics. Biomaterials. 52, 494-506 (2015).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten