Method Article
Пищеварение мышиных печени для анализа гранулярных поток лимфы эндотелиальных клеток
В этой статье
Резюме
Цель настоящего Протокола заключается в идентификации населения лимфатический эндотелиальных клеток в печени с помощью описанных маркеров. Мы используем коллагеназы IV и DNase и нежный мясорубки ткани, в сочетании с проточной цитометрии, чтобы определить собственный населения лимфатический эндотелиальных клеток.
Аннотация
В печени лимфатические сосуды находятся в пределах портала триады, и их описывается функция удаление интерстициальной жидкости из печени в лимфатические узлы где можно обследованных сотовой мусора и антигены. Мы очень заинтересованы в понимании, как лимфатический сосудистую могут быть вовлечены в воспаление и функция иммунных клеток в печени. Однако, очень мало был опубликован создание пищеварение протоколов для изоляция лимфатическую эндотелиальных клеток (LECs) из печени или определенных маркеров, которые могут быть использованы для оценки функции печени МГС на основе за клеток. Таким образом мы оптимизированный метод для пищеварения и окрашивание печени с целью оценить LEC населения в печени. Мы убеждены в том, что метод конспектированный здесь будет полезным для выявления и изоляции LECs из печени и укрепит наше понимание как LECs реагировать печень микроокружения.
Введение
Не хорошо понимают роль лимфатические сосуды и МГС в печени. В то время как лимфатические сосуды находятся в пределах портала Триада печени1 и расширять во время болезни2, очень мало понимается относительно функции и фенотип МГС в печени. С открытием маркеров, которые находятся главным образом на МГС3важность этих клеток в различных тканей ниши в гомеостаза и болезни будет заполнить значительный пробел в нашем понимании. МГС играют важную роль в поддержании периферийных терпимости в лимфатических узлов и метастатические опухоли, взаимодействуя непосредственно с T клетки4,5,6,,78, 9 , 10 , 11 , 12 , 13. МГС в лимфатических узлов может способствовать защитный иммунитет через их взаимодействие с мигрирующие дендритные клетки14,,1516. Таким образом существует несколько ролей для LECs, которые могут быть специфическими для тканей и взаимодействия, в которых они присутствуют. Однако очень мало понимается как LECs взаимодействуют с иммунных клеток в тканях или как LECs функционируют в различных органов и систем; Таким образом оценки МГС на основе за клеток в печени или других органов может привести к достижения в LECs, как программы ткани конкретных иммунитета. Хотя большая часть литературы, которая сосредотачивается на МГС в печени использует микроскопии для визуализации LECs, используя один или два маркеры и морфология17, очень мало было сделано для конкретно оценить МГС на основе по ячейкам с помощью проточной цитометрии, хотя одно исследование оценить различия между синусоидального эндотелиальных клеток печени (LSECs) и МГС18. Возможность анализировать LEC населения в печени подачей cytometry позволяет для углубленного изучения LEC фенотип во время нормальной гомеостаза или болезни.
Чтобы оценить LECs подачей cytometry, необходимы несколько поверхностных маркеров. Как правило LECs визуализируются выражение связанных с Просперо гомеобокс 1 (Prox-1), лимфатический сосуд эндотелиальной гиалуроновая кислота рецепторов 1 (LYVE1) или Сосудистый эндотелиальный фактор роста рецептор 3 (VEGFR3) с помощью микроскопии. Однако в печени, выражение этих маркеров не ограничивается МГС. Prox-1 широко выражается гепатоцитов во время регенерации печени развития и травмы19, и LYVE1 и VEGFR3 являются выраженные эндотелиальных клеток печени синусоидального18. В лимфоузел, LECs идентифицируются с помощью проточной цитометрии как кластеры дифференциации (CD) CD45 - CD31 + и podoplanin + (PDPN)16. Однако этот подход является слишком минимальной, чтобы изолировать МГС в печени, так как CD45 - CD31 + клетки будет захватить эндотелиальных клеток, а преобладающее население сосудистой эндотелиальных клеток в печени LSECs. Таким образом другие маркеры необходимо различать редких LEC населения с обильным LSEC населения. CD16/32 (выраженные Зрелые LSECs18) и CD146 (общий сосудистый эндотелиальных клеток маркер, преимущественно, выраженные в печени синусоиды20 синусоидального эндотелиальных клеток печени с практически не выражение лимфатической эндотелиальные клетки21) были кандидат маркеров.
Таким образом мы оптимизированный метод для изоляции и визуализации МГС в печени, используя выше маркеров, CD45, CD31, CD146, CD16/32 и PDPN для проточной цитометрии. Мы описывают использование коллагеназы IV, DNase 1 и механического разделения для переваривания ткани печени в одну ячейку подвеска. Мы также описывают использование градиента плотности iodixanol для изоляции не Паренхиматозный клеток (NPC) и ликвидации сотовой мусора. Наконец мы с использованием нескольких маркеров, определить оптимальный поток цитометрии стробирования стратегию для выявления LECs из печени с PDPN как основной маркер.
протокол
Все методы, описанные здесь были одобрены институциональный уход животных и использование Комитет (IACUC) медицинского городка университета Колорадо Anschutz.
1. Подготовка материалов
- Сделать 5 мг/мл раствора DNase I в фосфат амортизированное saline (PBS).
- Сделайте смесь пищеварение , добавив 5000 ед/мл коллагеназы IV нажмите на EHAA СМИ.
- Теплая смесь пищеварение при 37 ° C за 30 мин до использования.
- Сделать в изоляции буфера , добавив 4,8% бычьим сывороточным альбумином (БСА) и 2 мм Этилендиаминтетрауксусная кислота (ЭДТА) для Hanks сбалансированного солевого раствора (HBSS).
- Сделать буфера lysis эритроцитов (РБК) , добавив, что хлорид аммония 100 мм, 10 мм KHCO3и ЭДТА 0,1 мм для дистиллированной H2O.
2. подготовка одной ячейки подвеска из печени мыши
- Усыпить мыши с CO2 и шейки матки дислокации.
- Спрей вниз мыши с 70% этанол намочить его мех. Прикрепить мышь ноги на доску рассечение.
- Рассечение ножницами вырезать кожу около 1 см выше ануса, стараясь резать только через кожу (около 1 мм). Потяните кожу от тела с зубчатым щипцами и вставьте ножницы между кожей и брюшины. Откройте ножницы, чтобы отделить кожу от брюшины и, затем, порезать кожу от разреза на шее.
- PIN-код кожи в Правление рассечение, используя один контактный под каждой руки и над каждой ногой. Подтянуть перитонеальный sac и отрезать вверх к шее. Grab долей печени и вырезать чуть ниже грудины.
Примечание: Следует если любой из печени будет использоваться для иммуногистохимии (IHC). - Вырезать вокруг печени и удалить печень от мыши и поместить его в 4 мл нажмите EHAA средств массовой информации.
- С помощью скальпеля, вырезать печени в ~ 1 мм диаметр штук.
- Добавьте 500 мкл смеси пищеварение и 500 мкл DNase I (2 мг/мл) к печени.
- Инкубировать печени для 30 минут при 37 ° C. После 15 минут смешайте с помощью пипетки 5 мл жидкости.
- После 30 минут инкубации передать переваривается образца через стрейнер 100 мкм в 50 мл Конические трубки.
- Аккуратно вставьте оставшиеся части через фильтр с поршень шприца 1 мл.
- Промойте фильтр с 5 мл буфера изоляции и аккуратно вставьте ткани через сито с задней части плунжера от 1 мл шприц. Повторяйте эти шаги до тех пор, пока фильтр промывают 25 мл буфера изоляции.
- Центрифуга клетки на 400 x g за 5 мин тщательно аспирационная покинуть супернатант.
- Ресуспензируйте лепешка с 4 мл буфера lysis РБК. Инкубируйте клетки при комнатной температуре в течение 5 мин.
- Вымойте клетки с 10 мл буфера изоляции и центрифуги на 400 x g за 5 мин.
- Подсчет ячеек на Горяева для определения полной печени.
- Ресуспензируйте клетки в 5 мл 20% iodixanol и слой их с 1 мл раствора PBS.
- Центрифуга клетки на 300 x g 15 мин без тормоза.
- Удалите слой между PBS и iodixanol и поместите их, через фильтр 100 мкм, в новой 50 мл Конические трубки.
- Вымойте клетки с 10 мл буфера изоляции и центрифуги на 400 x g за 5 мин.
- Отменить супернатант и Ресуспензируйте клетки в 500 мкл PBS с 2% плода бычьим сывороточным (ФБС).
3. анализ гранулярных клеток одного из печени потока
- Подсчет количества ячеек с помощью микроскопа, с помощью исключения Трипановый синий для измерения жизнеспособных клеток и Горяева. Добавить 10 мкл клеток 10 мкл Трипановый синий и немедленно разместить их на Горяева и количество живых клеток (не голубые) под микроскопом. Затем вычислите количество клеток / мкл.
- Алиготе приблизительно 5 миллионов оставшихся nonparenchymal клеток в одну скважину 96-луночных плиты.
- Центрифуга клетки на 400 x g за 5 мин.
- Отменить супернатант и Ресуспензируйте клетки в 90 мкл PBS с 2% FBS.
- Добавьте анти CD45 (1: 200), анти CD146 (1: 200), анти CD31 (1: 200) и PDPN (1: 200) разводят в 10 мкл 10 x 2.4G2 или анти CD16/32 (1: 200).
Примечание: Блок не Fc (2.4G2) был использован при использовании анти CD16/32-обозначенного антитела. - Чтобы определить, где следует установить позитивные и негативные ворота, включают флуоресценции минус один (FMO) пятно для каждого цвета и управления isotype антитела.
- Чтобы определить живой против мертвых клеток, пятно с маркером жизнеспособности (например, призрак красный 780). Инкубируйте клетки на 4 ° C на 30 мин.
- Вымыть клетки с 100 мкл PBS с 2% FBS.
- Используйте небольшое Алиготе клеток для лазерных и компенсации настройки на проточный цитометр. Пятно клетки с антитело для каждого индивидуального Флюорофор и один без каких-либо антитела.
Примечание: В зависимости от проточный цитометр используется следует создать матрицу компенсации для удаления спектрального наложения. - Поместите образец трубу на цитометр зонд и собирать и записывать все события.
4. анализ данных
- Глядя на стороне точечной против вперед точечной районе, ворота на «живых» клетки, основанные на размер и степень детализации и жизнеспособности маркер красителя.
- Далее используя CD45 блестящий фиолетовый 510 и CD31 PerCp Cy5.5, ворота на CD45 - CD31 + клеток с использованием изотипа элементы управления и FMO определить положительные и отрицательные населения.
- Наконец, используя CD146 v450 или FITC CD16/32 и PDPN APC, возьмите CD146 - PDPN + или CD16/32-PDPN + клеток, снова с использованием изотипа элементов управления и FMO, чтобы определить положительные и отрицательные населения. Эти клетки являются Мик.
Результаты
Исследования, анализ печени лимфатические использовали главным образом иммуногистохимия чтобы quantitate частоты и диаметр лимфатических сосудов в печени. Однако этот метод не позволяет для оценки МГС на основе по ячейкам или выражение несколько маркеров, цитокины, chemokines или факторов транскрипции. Таким образом, мы спросили ли печени LECs могут быть изолированы от печени и оцениваются с помощью проточной цитометрии. Предыдущие работы, изолируя Лимфоузел LECs была выполнена с использованием Liberase DL (коллагеназа i-II-и dispase) и 1 DNase, в сочетании с механической сепарации тканей лимфатических узлов с иглы14,16. Таким образом был использован один и тот же протокол пищеварения на ткань печени, или коллагеназы IV и DNase 1 был использован как описано ранее, для изоляции иммунных клеток печени22 и последовали за пищеварение с плотность шаг градиента разделения (iodixanol) Удаление гепатоцитов и увеличить частоту другие типы клеток в печени (рис. 1A). После печени пищеварение и центрифугирование с градиент плотности клетки окрашивали CD45, CD31, PDPN и CD16/32. Выражаться путем Зрелые LSEC населения, но не LEC населения18был описан CD16/32. Таким образом, МГС были закрытого CD45-, CD31 +, CD16/32-, PDPN + клеток, в то время как LSECs были закрытого как CD45-, CD31 +, CD16 / 32 + и -PDPN (рис. 1A). Ворота были на живые клетки (призрак красный минус) и на основе изотипа контроля и FMO, окрашивание (рис. 1A). APC LYVE-1 на население LEC было также подтверждено (Рисунок 1B). Оба метода позволило визуализации населения LEC в печени; Однако окрашивание профиль клеток был визуально лучше при использовании коллагеназы IV и DNase 1 чем коллагеназы I-II-и dispase (рис. 1 c). Таким образом все будущие манипуляции выполнялись с помощью коллагеназы IV и DNase 1, как описано в протоколе. В среднем мы получили около 1300 МГС в грамм ткани печени или 2200 LECs за наивного печени, с помощью этого метода пищеварение.
Были использованы для оптимизации стробирования стратегии и комбинации флуорофоров и ликвидации загрязнения LSECs, CD16/32 и CD146. CD16/32 является Fc рецепторов гамма II и III и выражается на зрелых LSECs, но не на МГС18. CD16/32 может отличить PDPN + CD16/32-клетки от PDPN-CD16 / 32 + клеток, особенно когда с помощью PDPN конъюгированных APC или PE и CD16/32 конъюгированных FITC (рис. 1а), но менее хорошо, когда PDPN был конъюгированных для PE-Cy7 (рис. 1 c). Выражение CD16/32 не найден на LECs, но находится на LSECs. ФК блок использует CD16/32 антитела к минимуму Fc рецептор привязки и nonantigen конкретные иммуноглобулинов с Fc-рецепторами. Так как CD16/32 была использована для визуализации LSECs, привязка неспецифических иммуноглобулинов выше и CD146 была оптимизирована как альтернатива для измерения LSECs. Таким образом мы протестировали конъюгированных V450, маркер сосудистой эндотелиальных клеток, выраженные высоко LSECs и других сосудистых эндотелиальных клеток20 , но с низким выражение не LECs23CD146. Сначала мы оптимизировали окрашивание CD146 с помощью управления FMO и изотипа CD16/32 и CD146 (рис. 2A). Если мы оценивали только CD16 / 32 + клетки или CD16/32-клетки, CD16 / 32 + клетки были все CD146 + и PDPN - а CD16/32-клетки были преимущественно CD146 - и PDPN - или PDPN + (рис. 2B). Для подтверждения этого окрашивание, FMO был использован. Путем удаления PDPN из пятно, PDPN + населения исчез (рис. 2 c). Интересно, что были не CD146 + PDPN + клеток, подтверждающий, что CD146 или очень смирен выражается не в PDPN + МГС. Таким образом, мы уверены, что любой из этих маркеров могут использоваться до ворот сосудистой эндотелиальных клеток в печени.
Для дополнительной проверки, что PDPN является соответствующий маркер для LECs, печени секций от мышей окрашивали PDPN (зеленый) и F4/80 (коричневый) (рис. 3A). Эндотелия ни макрофаги выразил PDPN в мышиных печени. Мы также были в состоянии отличить cholangiocytes, который может испачкать позитивные для PDPN, от лимфатические сосуды, на основе различных ядерных структур желчных протоков и окрашивание Цитокератины 7 (рисунок 3B; красный: Цитокератины 7, зеленый: PDPN). Так как несколько маркеры используются для проточной цитометрии, таких как CD31, которая выражается не cholangiocytes24, мы уверены, что мы удаляем эти клетки из анализа, тем самым подтверждающие что клетки печени, которые CD45-, CD31 +, CD146 Ло/neg, CD16/32-, и PDPN + МГС. Наконец чтобы предоставить доказательства того, что окрашенные клетки являются LECs, мы сортируются эта популяция клеток и используются качественные реального времени полимеразной цепной реакции для оценки выражения Vegfr3 и prox-1 . Vegfr3 и prox-1 были оценены, как эти стенограммы выражаются в другие клетки в печени —prox1 гепатоцитов и Vegfr3 по LSECS (среди прочих) — но не другие клетки, кроме LECs выразить оба. Выражение оба эти маркеры был значительно выше в отсортированном населения, чем в линии клетки культивировали мышиных макрофагов (RAW264.7), которая обычно не выразить эти маркеры, но похож на выражение для искусственного мышиных МГС (рис. 3 c ).
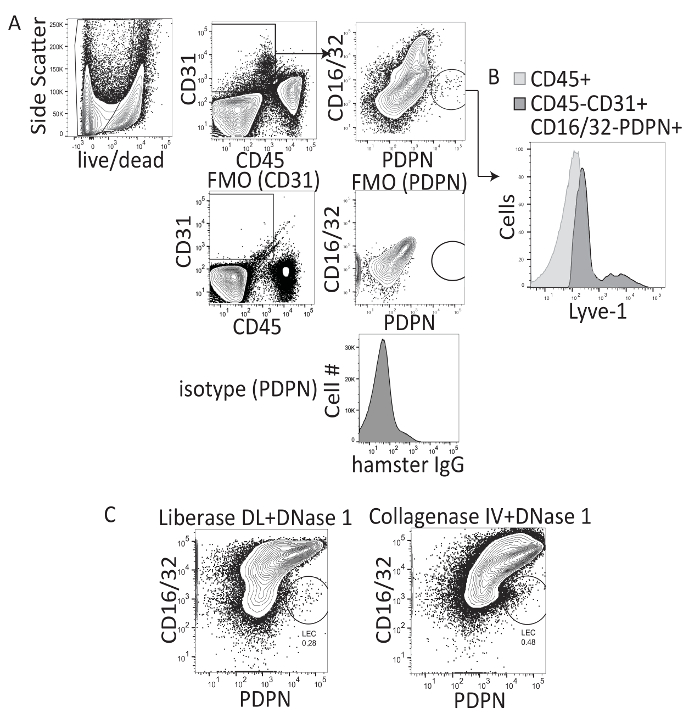
Рисунок 1 : Представитель потока cytometry анализ коллагеназы I-II-dispase и коллагеназы IV-переваривается мышиных ткани печени. (A) Эта группа показывает стробирования стратегия, флуоресценции минус один окрашивание, и изотипа контролирует процедуры. (B) этой группы показывает, LYVE-1 пятнать CD16/32-PDPN + клеток. (C) Эта группа показывает последний поток цитометрии ворота после переваривания мыши печень с либо коллагеназы I-II-dispase (например, Liberase DL) или коллагеназы IV и оценки CD16/32 PerCP X PDPN PE-Cy7 где LECs, CD16/32- и PDPN +. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
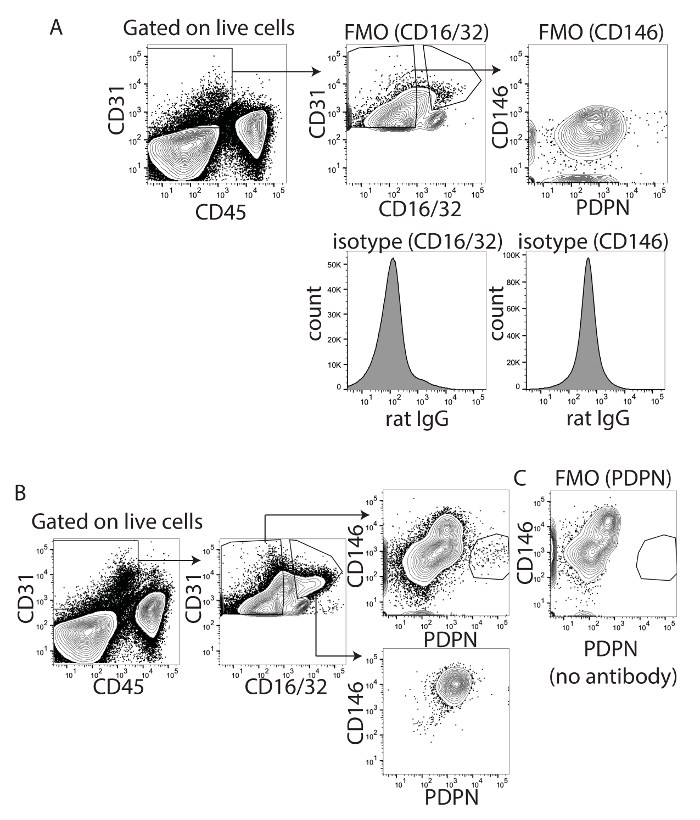
Рисунок 2 : Определение CD146 и PDPN как соответствующие маркеры для эндотелиальных клеток печени лимфатический. (A) Эта группа показывает флуоресценции минус один и изотипа управления для CD16/32 (слева) и CD146 (справа). (B) Эта группа показывает закрытом CD16/32 положительные или отрицательные клетки определяется группа A. Показана CD146XPDPN от обеих групп населения. (C) Эта группа показывает флуоресценции минус один для PDPN продемонстрировать, что окрашивание отсутствует когда антитела не добавляется. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
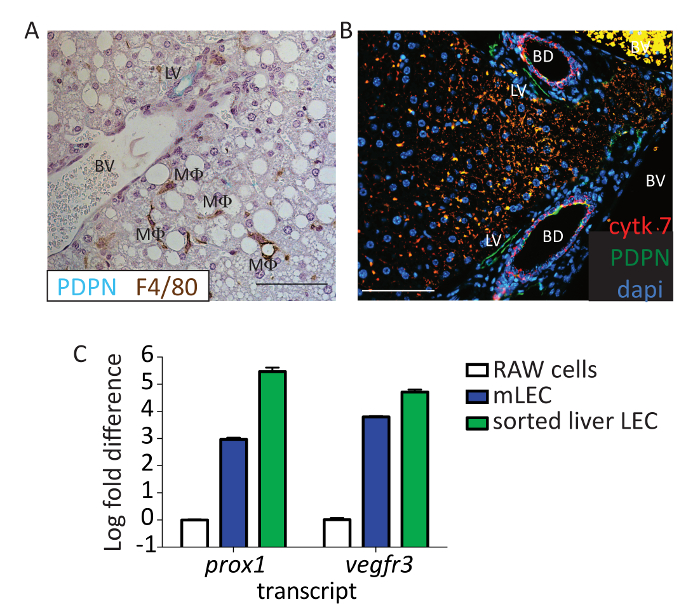
Рисунок 3 : Определение потока PDPN + клеток как лимфатический эндотелиальных клеток. (A) Эта группа показывает представитель иммуногистохимия от мыши печени, окрашенных с PDPN (синий/зеленый) и F4/80 (коричневый). Помечены лимфатический сосуд (LV), кровеносный сосуд (BV) и макрофагов (MF). Шкалы бар = 100 µm. Формалин Исправлена парафин врезанных тканей был deparaffinized на 20 мин в ксилоле. Ткани были гидратированных воды через градиент этанола, и антиген поиска была выполнена с помощью рН 6 антигена извлечения буфер в скороварке за 15 мин ткани был заблокирован с помощью 0,1% BSA и витражи, с помощью мыши анти PDPN и анти мыши F4/80 за 1 час на номер Температура. HRP IgG против хомяка и анти кролик IgG HRP использовались как вторичные антитела. 3, 3'-диаминобензидин (DAB) + и зеленый вина были использованы для обнаружения F4/80 и PDPN, соответственно. Ткани counterstained с гематоксилином и отражаться на микроскопе. (B) Эта группа показывает же эксперимент выполняется как группа , за исключением здесь, PDPN показан в зеленой, Цитокератины 7 в красном и 4 ', 6-diamidino-2-phenylindole (DAPI) в голубом. Шкалы бар = 100 µm. ткани был заблокирован с использованием осла 5% и 5% козьего сыворотки и витражи, с помощью мыши анти PDPN (8.1.1) 1: 100 и анти мышь Цитокератины 7 1: 200 на 1 ч при комнатной температуре. Анти хомяка IgG AF647 и анти кролик IgG-PE использовались как вторичные антитела. Ткань была counterstained с DAPI и образы. Шкалы бар = 100 мкм. Помечены лимфатический сосуд (LV), кровеносный сосуд (BV) и желчных протоков (BD). (C) Эта группа показывает, складку журнал изменения в Vegfr3 и prox-1 выражение из отсортированных печени, LECs основаны на окрашивание в протоколе (CD45-, CD31 +, CD146Ло/negи PDPN +) по сравнению с RAW клетки или первичной мышиных Лимфоузел МГС. Отсортированный клетки были переданы через колонку биополимера измельчения, РНК добывали с помощью РНК добыча комплект и cDNA было сделано с использованием обратной транскрипции Кит. Стенограмма изобилие нормализована уборки Джин, Gapdh, для каждого образца. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
Обсуждение
Общее значение МГС в иммунного гомеостаза и регулирование недавно пришло света25. Большая часть опубликованных лимфатический литературы фокусируется на кожу и лимфатические узлы; Однако лимфатические находятся во всем теле26 и, таким образом, необходимо наше понимание их важности в различных органах. Здесь мы покажем метод, в котором МГС в печени могут быть изучены на основе ячеек, чтобы лучше понять их одновременных выражение различных поверхностных маркеров, цитокины, chemokines и внутриклеточные белки такие факторы транскрипции. Этот метод будет полезным для будущих исследований для оценки фенотипа и функции МГС в печени во время болезни и здоровья.
Одним из препятствий для идентификации МГС в печени является их относительно низкой частоты, по сравнению с другими типами клеток. Гепатоциты составляют около 80% печени, и удаление этих клеток, используя градиент плотности (iodixanol), прежде чем печени на проточный цитометр требует меньше времени и, таким образом, обеспечивает лучшую жизнеспособность. Для того, чтобы отличить населения LYVE1 + МГС в печени от LYVE1 + LSECs, мы использовали маркеры CD16/32 и CD146, найдены на LSECs и с низким выражение не МГС. Это, в сочетании с отсутствием или низким выражение PDPN других эндотелиальных клеток в печени, Допускается проверка подачей cytometry населения, которые мы определили были МГС. Действительно ниже по течению транскрипционный анализ анализ подтвердил, что эта стратегия стробирования производства МГС (рис. 3 c).
Изоляция LECs из лимфатических узлов является лучшим делается с помощью коллагеназы I-II-и dispase; Однако мы обнаружили, что, хотя этот метод извлечения LECs из печени, печени пищеварение протокол, с помощью коллагеназы IV обеспечивает лучше течению анализ с помощью проточной цитометрии. С помощью механического нарушения печени позволяет коллагеназы больше площади поверхности лучше взаимодействовать с внеклеточная матрица связанные клетки, как LECs, и использование нажмите EHAA СМИ без FBS позволяет для переваривания печени происходят в только 30 мин. Это сокращение времени сохраняет жизнеспособность LEC по течению анализы как проточной цитометрии или сортировки потока. Действительно мы смогли восстановить достаточно жизнеспособных клеток для визуализации LECs проточной цитометрии и сортировка по течению transcriptional анализа потока.
Комбинированный, разделение гепатоцитов из не Паренхиматозный клетки, использование коллагеназы типа IV и разъяснения и демонстрация маркеров для МГС в печени и маркеры для других групп населения эндотелиальных клеток, таких как CD16/32 и CD146, позволили надлежащей идентификации МГС в печени. Эти методы заполнить значительный пробел в литературе о как МГС в печени может определяться проточной цитометрии, особенно поскольку печень содержит ряд других клеток, которые выражают маркеры, известный быть уникальными для МГС в лимфатических узлов (prox1 и vegfr3). Таким образом эти методы приведет к течению исследования относительно функции печени LEC. Кроме того этот метод можно изменить для других тканей для того, чтобы лучше оценить ткане-LEC маркеры и подмножества.
Раскрытие информации
Авторы не имеют ничего сообщать.
Благодарности
Авторы хотели бы поблагодарить GI и печени Innate иммунных программы за финансовую поддержку этого проекта. B.A.J.T. также финансируется R01 AI121209.
Материалы
| Name | Company | Catalog Number | Comments |
| Clicks/EHAA media | Irvine Scientific | 9195 | |
| Collagenase IV | Worthington Biochemical corporation | LS004188 | |
| DNase I | Worthington Biochemical corporation | LS002145 | Deoxyribonuclease 1 |
| OptiPrep | Sigma Aldrich | D1556 | Density Gradient Medium |
| V450 anti mouse CD146(clone ME-9F1) | BD biosciences | 562232 | |
| FITC anti mouse CD146 (clone ME-9F1) | Biolegend | 134706 | Fluorescein isothiocyanate (FITC) |
| Pacific Blue anti mouse CD31(clone 390) | Biolegend | 102422 | |
| PerCp/Cy5.5 anti mouse CD31(clone 390) | Biolegend | 102420 | Peridinin-chlorophyll proteins-Cyanine 5.5 (PerCP-Cy5.5) |
| APC anti mouse PDPN (clone 8.1.1) | Biolegend | 127410 | Allophycocyanin (APC), podoplanin (PDPN) |
| APC/Cy7 anti mouse CD45 (clone 30-F11) | Biolegend | 103116 | |
| Brilliant Violet 510 anti mouse CD45 (clone 30-F11) | Biolegend | 103138 | |
| FITC anti mouse CD16/32 (clone 93) | Biolegend | 101306 | Fluorescein isothiocyanate (FITC) |
| PerCp/Cy5.5 anti mouse CD16/32(clone 93) | Biolegend | 101324 | Peridinin-chlorophyll proteins-Cyanine 5.5 (PerCP-Cy5.5) |
| ghost red 780 viability dye | TONBO biosceinces | 3-0865-T100 | |
| APC syrian hamster IgG (clone SHG-1) | Biolegened | 402102 | |
| PerCp/Cy5.5 rat IgG2a (clone RTK2758) | Biolegend | 400531 | |
| FITC rat IgG2 (clone eBR2a) | ebioscience | 1-4321-80 | |
| Anti mouse LYVE1 (clone 223322) | R&D systems | FAB2125A | |
| anti-mouse Cytokeratin(clone EPR17078) | abcam | ab181598 | |
| anti-mouse F4/80 (clone Cl:A3-1) | Bio-rad | MCA497 | |
| BSA (fraction V) | Fischer | BP1600-100 | Bovine Serum Albumin (BSA) |
| Goat serum | Jackson Immunoresearch | 017-000-121 | |
| Donkey Serum | Jackson Immunoresearch | 017-000-121 | |
| EDTA | VWR | E177 | Ethylenediaminetetraacetic acid (EDTA) -for RBC lysis buffer |
| Ammonium Chloride | Fischer | A687-500 | for RBC Lysis buffer |
| Potassium Bicarbonate | Fischer | P184-500 | for RBC Lysis buffer |
| Scalpel | Feather | 2975#21 | |
| 100 μm cell strainer | Fischer | 22363549 | |
| 2.4G2 | in house/ATCC | ATCC HB-197 | FC block to inhibit non-specific binding to Fc gamma + cells -made from hybridoma |
| Phosphate Buffered Saline (PBS) | Corning | 21-040-CV | |
| Hanks Balanced Salt Solution (HBSS) | Gibco | 14185-052 | |
| Fetal Bovine Serum (FBS) | Atlanta biologicals | S11550 | |
| 96 well plate | Corning | 3788 | |
| 6 well plate | Corning | 3506 | |
| 50 mL conical | Truline | TR2004 | |
| 15 mL conical | Falcon | 352196 | |
| 1 mL Pipete tip | USA scientific | 1111-2721 | |
| 200 µL pipete tip | USA scientific | 1110-1700 | |
| 10 µL pipete tip | USA scientific | 1111-3700 | |
| seriological 10 mL pipete | greiner bio-one | 607107 | |
| seriological 5 mL pipete | greiner bio-one | 606107 | |
| Cell incubator | Fischer | Heracell 160i | |
| BD FacsCanto II flow cytometer | BD biosciences | ||
| Clinical Centrifuge | Beckman coulter | model X-14R |
Ссылки
- Tanaka, M., Iwakiri, Y. Lymphatics in the liver. Current Opinion in Immunology. 53, 137-142 (2018).
- Vollmar, B., Wolf, B., Siegmund, S., Katsen, A. D., Menger, M. D. Lymph vessel expansion and function in the development of hepatic fibrosis and cirrhosis. The American Journal of Pathology. 151 (1), 169-175 (1997).
- Podgrabinska, S., et al. Molecular characterization of lymphatic endothelial cells. Proceedings of the National Academy of Sciences of the United States of America. 99 (25), 16069-16074 (2002).
- Cohen, J. N., et al. Lymph node-resident lymphatic endothelial cells mediate peripheral tolerance via Aire-independent direct antigen presentation. Journal of Experimental Medicine. 207 (4), 681-688 (2010).
- Cohen, J. N., et al. Tolerogenic properties of lymphatic endothelial cells are controlled by the lymph node microenvironment. PLoS One. 9 (2), e87740 (2014).
- Rouhani, S. J., et al. Roles of lymphatic endothelial cells expressing peripheral tissue antigens in CD4 T-cell tolerance induction. Nature Communications. 6, 6771 (2015).
- Tewalt, E. F., et al. Lymphatic endothelial cells induce tolerance via PD-L1 and lack of costimulation leading to high-level PD-1 expression on CD8 T cells. Blood. 120 (24), 4772-4782 (2012).
- Dubrot, J., et al. Lymph node stromal cells acquire peptide-MHCII complexes from dendritic cells and induce antigen-specific CD4(+) T cell tolerance. Journal of Experimental Medicine. 211 (6), 1153-1166 (2014).
- Hirosue, S., et al. Steady-state antigen scavenging, cross-presentation, and CD8+ T cell priming: a new role for lymphatic endothelial cells. Journal of Immunology. 192 (11), 5002-5011 (2014).
- Lund, A. W., et al. VEGF-C promotes immune tolerance in B16 melanomas and cross-presentation of tumor antigen by lymph node lymphatics. Cell Reports. 1 (3), 191-199 (2012).
- Lund, A. W., et al. Lymphatic vessels regulate immune microenvironments in human and murine melanoma. Journal of Clinical Investigation. 126 (9), 3389-3402 (2016).
- Swartz, M. A. Immunomodulatory roles of lymphatic vessels in cancer progression. Cancer Immunology Research. 2 (8), 701-707 (2014).
- Dietrich, T., et al. Cutting edge: lymphatic vessels, not blood vessels, primarily mediate immune rejections after transplantation. Journal of Immunology. 184 (2), 535-539 (2010).
- Kedl, R., et al. Migratory Dendritic Cells acquire archived antigen from Lymphatic Endothelial Cells for antigen presentation during lymph node contraction. Nature Communications. 8, 2034 (2017).
- Kedl, R. M., Tamburini, B. A. Antigen archiving by lymph node stroma: A novel function for the lymphatic endothelium. European Journal of Immunology. 45 (10), 2721-2729 (2015).
- Tamburini, B. A., Burchill, M. A., Kedl, R. M. Antigen capture and archiving by lymphatic endothelial cells following vaccination or viral infection. Nature Communications. 5, 3989 (2014).
- Yokomori, H., et al. Lymphatic marker podoplanin/D2-40 in human advanced cirrhotic liver--re-evaluations of microlymphatic abnormalities. BMC Gastroenterology. 10, 131 (2010).
- Nonaka, H., Tanaka, M., Suzuki, K., Miyajima, A. Development of murine hepatic sinusoidal endothelial cells characterized by the expression of hyaluronan receptors. Developmental Dynamics. 236 (8), 2258-2267 (2007).
- Dudas, J., et al. Prospero-related homeobox 1 (Prox1) is a stable hepatocyte marker during liver development, injury and regeneration, and is absent from "oval cells". Histochemistry and Cell Biology. 126 (5), 549-562 (2006).
- Schrage, A., et al. Murine CD146 is widely expressed on endothelial cells and is recognized by the monoclonal antibody ME-9F1. Histochemistry and Cell Biology. 129 (4), 441-451 (2008).
- Amatschek, S., et al. Blood and lymphatic endothelial cell-specific differentiation programs are stringently controlled by the tissue environment. Blood. 109 (11), 4777-4785 (2007).
- Huang, L., Soldevila, G., Leeker, M., Flavell, R., Crispe, I. N. The liver eliminates T cells undergoing antigen-triggered apoptosis in vivo. Immunity. 1 (9), 741-749 (1994).
- Shay, T., Kang, J. Immunological Genome Project and systems immunology. Trends in Immunology. 34 (12), 602-609 (2013).
- Li, B., et al. Adult Mouse Liver Contains Two Distinct Populations of Cholangiocytes. Stem Cell Reports. 9 (2), 478-489 (2017).
- Randolph, G. J., Ivanov, S., Zinselmeyer, B. H., Scallan, J. P. The Lymphatic System: Integral Roles in Immunity. Annual Review of Immunology. 35, 31-52 (2016).
- Olszewski, W. L. The lymphatic system in body homeostasis: physiological conditions. Lymphatic Research and Biology. 1 (1), 11-21 (2003).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены