Method Article
リンパ管内皮細胞のフローサイトのマウス肝臓の消化
要約
このプロトコルの目的は、説明されているマーカーを用いた肝臓内リンパ管の内皮細胞集団を識別するためにです。コラゲナーゼ IV と DNase と組み合わせてフローサイトメトリー、リンパ管内皮細胞の明瞭な人口を識別するために、組織の穏やかなミンチを駆使しています。
要約
肝臓内ポータル トライアド内リンパ管に発見されてし、記述されている機能はリンパ節、肝臓から間質液を削除する細胞残渣および抗原を調査することができます。リンパ血管が炎症や肝臓内の免疫細胞の機能に関与する方法を理解することに非常に興味を持っております。しかし、ほとんどはリンパ血管内皮細胞 (LECs) 肝臓や肝臓の評価に使用することができます特定のマーカーからの分離のための消化力のプロトコルを確立する公開されているセルごとに LECs。したがって、消化や肝臓で LEC の人口を評価するために、肝臓の染色法を最適化されています。ここで概説している方法を LECs の肝臓からの単離、同定に役立つ LECs が肝の微小環境に応答する方法の私達の理解を強化して確信しております。
概要
肝臓のリンパ管と LECs の役割はよくわかっていません。リンパ管肝1のポータル トライアド内にある病気の2の間に展開し、ほとんどは機能および肝臓内 LECs の表現型について理解されます。LECs3に主にあるマーカーの発見と恒常性と病気ニッチを異なる組織内でこれらの細胞の重要性は私達の理解の重要なギャップを埋めます。LECs は、T 細胞4,5,6,7,8、と直接相互作用によってリンパ節、転移性腫瘍周辺の公差を維持する上で主要な役割を持っています。9,10,11,12,13。 リンパ節で LECs は、渡り鳥樹状細胞14,,1516との相互作用を介して防御免疫を促進できます。したがって、特定組織と相互作用が存在するかもしれない LECs に複数のロールがあります。ただし、非常に少しは LECs が組織の免疫細胞と対話する方法または LECs が異なる器官システムでどのように機能するかについて理解したがって、肝臓や他の臓器内のセルごとごとに LECs を評価 LECs プログラムの組織特異的免疫の進歩につながる可能性があります。肝臓で LECs に焦点を当てて文献の多くはマーカーと形態17の 1 つまたは 2 つ使用して LECs を可視化する顕微鏡を使用して、ほとんどはフローサイトメトリー、しかし 1 つの調査を使用してセルごとに LECs を具体的に評価に行われています。肝類洞内皮細胞 (LSECs) と LECs18の違いを評価しました。フローサイトメトリーによる肝臓のレック集団を分析できることで、LEC の表現型の詳細な研究通常恒常性や病気の時にことができます。
フローサイトメトリーによる LECs を評価するには、複数の表面マーカーが必要です。通常、LECs は、プロスペロー関連ホメオ ボックス 1 の式 (Prox-1)、リンパ管の内皮細胞のヒアルロン酸受容体 1 (LYVE1) または顕微鏡を用いた血管内皮細胞増殖因子受容体 3 (VEGFR3) によって視覚化されます。しかし、肝臓では、これらのマーカーの発現は LECs を制限されません。肝で肝開発、再生、および傷害19時近接 1 を広く表現し、LYVE1 と VEGFR3 は肝類洞内皮細胞18によって表されます。リンパ節で LECs は、分化 (CD) のクラスターとしてフローサイトメトリーを使用して識別されます CD45、CD31 +、ポドプラニン + (PDPN)16。しかし、このアプローチは CD45-CD31 陽性細胞は、血管内皮細胞をキャプチャし、肝臓の血管内皮細胞の優勢な人口が LSECs ので、肝臓で LECs を分離するも最小限。したがって、他のマーカーは、豊富な LSEC 人口からまれな LEC の人口を区別するために必要です。CD16/32 (成熟した LSECs18によって表される)、CD146 (一般的な血管内皮細胞マーカーは主に肝類洞内皮細胞20リンパでない式には少し肝洞様毛細血管内で表現内皮細胞21) 候補マーカーします。
したがって、我々 は分離とフローサイトメトリー用上記のマーカー、CD45、CD31、CD146、CD16/32、および PDPN を利用した肝臓内 LECs を可視化法を最適化されています。IV コラゲナーゼの使用、DNase 1 と単一細胞懸濁液に肝臓消化機械的分離について述べる。非実質細胞 (NPC) と細胞残屑を除去するために分離の iodixanol の密度勾配の使用についても述べる。最後に、複数のマーカーを使用して、我々 は優勢なマーカーとしての PDPN と肝臓から LECs を識別するために最適な流れ cytometry ゲーティング戦略を決定します。
プロトコル
ここで説明するすべての方法は、制度的動物ケアおよび使用委員会 (IACUC) コロラド大学アンシュッツ メディカル キャンパスのによって承認されています。
1 材料の準備
- DNase の 5 mg/mL の溶液を作るリン酸緩衝生理食塩水 (PBS) で。
- IV コラゲナーゼの 5,000 U/mL をクリックしての EHAA メディアに追加することによって消化の混合物を作る。
- 使用する前に 30 分の 37 ° C で分解混合物を温めます。
- 4.8% ウシ血清アルブミン (BSA) を追加することによって、分離バッファーを作るし、2 mM エチレンジアミン四酢酸 (EDTA) にハンクス平衡塩類溶液 (HBSS)。
- 塩化アンモニウム 100 mM、10 mM KHCO3、および 0.1 mM EDTA を蒸留 H2O を追加することによって赤血球 (RBC) 換散バッファーを作る
2. マウス肝臓からの単一細胞懸濁液の準備
- CO2と頚部転位マウスを安楽死させます。
- その毛皮をウェットを 70% エタノールでマウスをスプレーします。ピン マウスの解剖板に足。
- 解剖はさみを使って、肌皮膚 (約 1 mm) だけをカットするように注意しながら、肛門の上約 1 cm をカットします。歯の鉗子で体から皮膚を引っ張るし、皮膚と腹膜の間ハサミを挿入します。腹膜から皮膚を分離し、その後、首の切開から皮膚をカットするはさみを開きます。
- 各腕の下と各脚の上の 1 つのピンをしている郭清ボードに皮膚を固定します。腹膜嚢を引き上げ、首に向かって上向きにカットします。肝臓の葉をつかむし、胸骨のすぐ下をカットします。
注: 免疫組織染色 (IHC) の肝臓のいずれかを使用する場合は、注意をすべき。 - 肝臓の周りカットしマウスから肝臓を削除、クリックしての EHAA メディアの 4 mL に置きます。
- メスを使用して、〜 1 mm の肝径部分をカットします。
- 消化液 500 μ L と DNase の 500 μ L を追加私は肝臓に (2 mg/mL)。
- 37 ° C で 30 分の肝臓を孵化させなさい15 分後に 5 mL のピペットを使用して液体を混ぜます。
- インキュベーションの 30 分後に 50 mL の円錐管に 100 μ m ストレーナー消化サンプルを転送します。
- 1 mL シリンジのプランジャーをフィルターを介して残りの部分を軽く押します。
- 5 mL の分離バッファーを持つフィルターを洗って、1 mL シリンジからプランジャーの背面にストレーナーを通して組織をゆっくりと。フィルターは分離バッファーの 25 の mL と洗浄されるまで、この手順を繰り返します。
- 400 x gで細胞を遠心分離機の 5 分は慎重に上清を離れて吸い出しなさい。
- RBC 換散バッファーの 4 mL にペレットを再懸濁します。セル 5 分間室温で孵化させなさい。
- 400 x gで 5 分間遠心分離バッファーの 10 ml セルを洗浄します。
- 完全に肝臓の数を決定する検定のセルをカウントします。
- 20 %iodixanol の 5 mL の細胞を再懸濁します、1 ml の PBS の層のそれら。
- 300 x gブレーキなしの 15 分で細胞を遠心します。
- PBS と、iodixanol のレイヤーを削除、新しい 50 mL の円錐管に 100 μ m フィルターを介してそれらを配置します。
- 400 x gで 5 分間遠心分離バッファーの 10 ml セルを洗浄します。
- 上澄みを廃棄し、2% ウシ胎児血清 (FBS) を 500 μ L の PBS で細胞を再懸濁します。
3. 肝臓から単一細胞のフローサイトメトリーによる解析
- 検定とトリパン ブルー色素排除を使用して実行可能なセルを測定する顕微鏡を使用してセルをカウントします。トリパン ブルーの 10 μ L に 10 μ L のセルを追加したり、すぐに診断に入れますや生きている細胞を顕微鏡で (青ではない)。その後、あたりの細胞数を計算します。
- 96 ウェル プレートの単一ウェルに残りの実質細胞の約 500 万の約数。
- 400 x gで 5 分で細胞を遠心します。
- 上澄みを廃棄し、2 %90 μ L の PBS で細胞を再懸濁します FBS。
- PDPN (1: 200) 2.4G2 やアンチスパイウェア-CD16/32 (レバレッジ) x 10 の 10 μ L で希釈した反 CD31 (レバレッジ)、アンチ CD146 (1: 200) 抗 CD45 (レバレッジ) を追加します。
注:抗 CD16/32 標識抗体を使用した場合、Fc ブロック (2.4G2) が使用されていません。 - 正と負のゲートを設定する必要があるには、各色のアイソタイプ コントロール抗体 (FMO) しみマイナス蛍光があります。
- ライブと死んだ細胞を決定するには、生存率マーカー (例えば、ゴースト赤 780) で染色します。4 ° C、30 分で細胞を孵化させなさい。
- 2 %100 μ L の PBS のセルを洗浄して政府短期証券。
- 細胞の小さな因数を使って流れの cytometer のレーザーと補正の設定を調整します。それぞれの個々 の蛍光体、抗体なしで 1 つへの抗体と細胞を染色します。
注:によって使用されている流れの cytometer で補償行列は、スペクトル重複除去に備えます。 - Cytometer プローブ上にサンプル チューブを置き、収集、すべてのイベントを記録します。
4. データ解析
- 側方散乱と前方散乱エリアを見て、「ライブ」の細胞生存率と粒度サイズ マーカー色素に基づくゲート。
- 次に、CD45 鮮やかなバイオレット 510 と CD31 PerCp Cy5.5、アイソタイプ コントロールと FMO を使って正と負の集団を決定する CD45-CD31 陽性細胞のゲートを使用します。
- 最後に、PDPN APC や CD16/32 FITC CD146 v450 を使用して、CD146-PDPN + または CD16/32 を取る-PDPN + 細胞は、再びアイソタイプ コントロールと FMO を使用して正と負の集団を決定します。これらの細胞は、LECs です。
結果
研究は、肝臓のリンパ管を分析は主に周波数と肝臓のリンパ管の直径を量的に免疫組織化学を使用しています。ただし、セルごとに LECs の評価または複数のマーカー、サイトカイン、ケモカイン、または転写因子の発現のためには、このメソッドはできません。したがって、我々 は尋ねたかどうか肝 LECs 肝臓から分離することができるし、フローサイトメトリーを使用して評価。Liberase DL (コラゲナーゼ私-II-と-dispase) と DNase 1 針14,16リンパ節組織の機械的分離と組み合わせてを使用してリンパ節 LECs を分離する前の作業を行った。したがって、肝組織に同じの消化力のプロトコルが使用された、または IV コラゲナーゼと DNase 1 を用いて肝22から免疫細胞分離のため、前に説明したとする密度勾配分離 (iodixanol) ステップと消化を続けて肝細胞を削除し、(図 1 a) 肝内の他の細胞型の頻度が増加します。肝臓消化と密度勾配の遠心分離、CD45、CD31、PDPN、CD16/32 と染色されました。CD16/32 は、成熟した LSEC 集団がいないレック集団18表現するのに記載されています。したがって、LECs は CD45-、CD31 + CD16/32 ゲートが-、PDPN + 細胞、LSECs、CD45-、CD31 + CD16 としてゲート中/32 + と PDPN - (図 1 a)。ゲートは生きているセル (赤いゴースト負) の設定され、アイソタイプ コントロールと (図 1 a) を染色 FMO に基づきます。LEC の人口にしかし 1 APC はまた確認された (図 1 b)。両方の方法は、肝臓内で LEC 人口の可視化を許可しかし、細胞の染色のプロファイルはコラゲナーゼ私-II-と-dispase (図 1) よりコラゲナーゼ IV と DNase の 1 を使用する場合、視覚的に優れていた。したがって、すべての将来の操作を行った IV コラゲナーゼと DNase の 1 を使用してプロトコルで説明したよう。平均では、肝組織の 1 グラムあたり約 1,300 LECs またはこの消化法を用いた素朴な肝臓あたり 2,200 LECs を得た。
ゲーティング戦略と fluorophores の組み合わせを最適化するために、LSECs の汚染を除去するために、CD16/32 と CD146 の両方を使用しました。CD16/32 は、Fc のガンマの受容体 II および III は、LECs18ではなく成熟した LSECs に表現されます。CD16/32 でした PDPN CD16 から PDPN + CD16/32-セルを区別/32 + 細胞、特にときに APC または PE 共役 PDPN を使用して、CD16/32 共役 FITC (図 1 a)、PDPN が PE Cy7 (図 1) に共役したときも少ない。CD16/32 の式は、LECs 上で見つからないが、LSECs に記載されています。Fc ブロックは、Fc 受容体結合および nonantigen 特異的免疫グロブリン Fc 受容体への結合を最小限に抑える CD16/32 抗体を使用します。CD16/32 LSECs の視覚化に使用しているので、免疫グロブリンの非特異的結合は高く、CD146 は LSECs を測定する別の方法として最適化されました。したがって、我々 は V450、LSECs と他の血管内皮細胞の20が式なしに低 LECs23で高い表現血管内皮細胞マーカーに共役 CD146 をテストしました。我々 は最初の CD146 染色、最適化 CD16/32 と CD146 の両方に FMO とアイソタイプ コントロールを使用 (図 2 a)。CD16 のみを行った場合/32 + セルまたは CD16/32-細胞、CD16/32 + 細胞がすべて CD146 + と PDPN-CD16/32 細胞が主に CD146 - と PDPN - または PDPN + (図 2 b)。この染色を確認、FMO を使用しました。汚れから PDPN を削除する、PDPN + 人口消失 (図 2)。興味深いことに、CD146 + PDPN + 細胞、CD146 表現されることがないまたは非常に卑しい PDPN + LECs によって確認することはありませんでした。したがって、我々 はこれらのマーカーのいずれかを使用できることを確信しています、肝臓の血管内皮細胞をゲートに。
さらに PDPN が LECs の適切なマーカーであることを検証するため、PDPN (緑) と F4/80 (ブラウン) (図 3 a) マウス肝切片染色.血管内皮細胞もマクロファージは、マウスの肝臓で PDPN を表現しました。また胆管は、胆管とサイトケラチン 7 染色によって異なる核構造に基づくリンパ管からの PDPN の肯定的な染色することを区別することができました (図 3 b; 赤: サイトケラチン 7、緑: PDPN)。フローサイトメトリー、CD31 は、胆管24で表現されていないなどの複数のマーカーを使用して、我々 は分析からこれらの細胞を削除すること、それにより確認するは CD45-、CD31 + CD146 は、肝臓から細胞と確信しておりますlo/指定、総额、CD16/32-、PDPN + LECs と。最後に、陽性細胞の LECs を証拠を提供するために我々 はセルのこの人口をソートし、 Vegfr3と近接 1の式を評価する定性的なリアルタイムのポリメラーゼの連鎖反応を使用します。Vegfr3と近接 1は、これらの転写産物は肝臓で他の細胞によって表現されると評価された-肝細胞と LSECS によってVegfr3によって (とりわけ)、prox1 -LECs のほかの他のセルも両方を表現することが。通常これらのマーカーを表現していないが、培養マウス LECs (図 3 の式と似ていますが培養マクロファージ細胞株 (RAW264.7) よりも並べ替えられた人口の両方のこれらのマーカーの発現が有意).
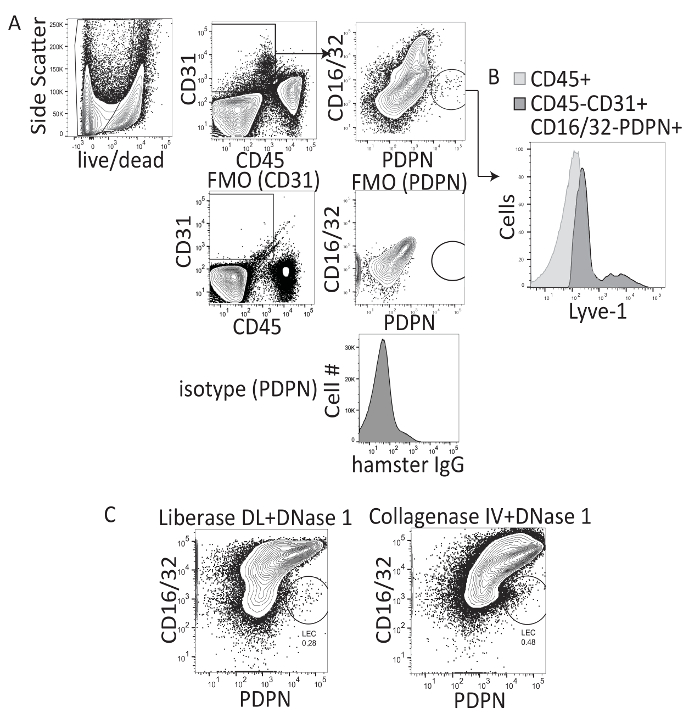
図 1: コラゲナーゼ私-II-当期及びコラゲナーゼ IV 消化マウス肝組織の代表的なフロー フローサイトメトリー解析します。(A) このパネル ゲート方式、マイナス 1 つ染色、蛍光を示しています、アイソタイプ コントロール プロシージャ。(B) このパネルは、CD16/32 のしかし 1 染色を示しています-PDPN + 細胞。(C) このパネルはどちらかコラゲナーゼ私-II-dispase (例えば、Liberase DL) とマウス肝臓を消化した後最終的な流れの cytometry ゲートを示しています IV コラゲナーゼや CD16/32 PerCP X PDPN の PE-Cy7 CD16/32 がある LECs を評価- と PDPN +。この図の拡大版を表示するのにはここをクリックしてください。
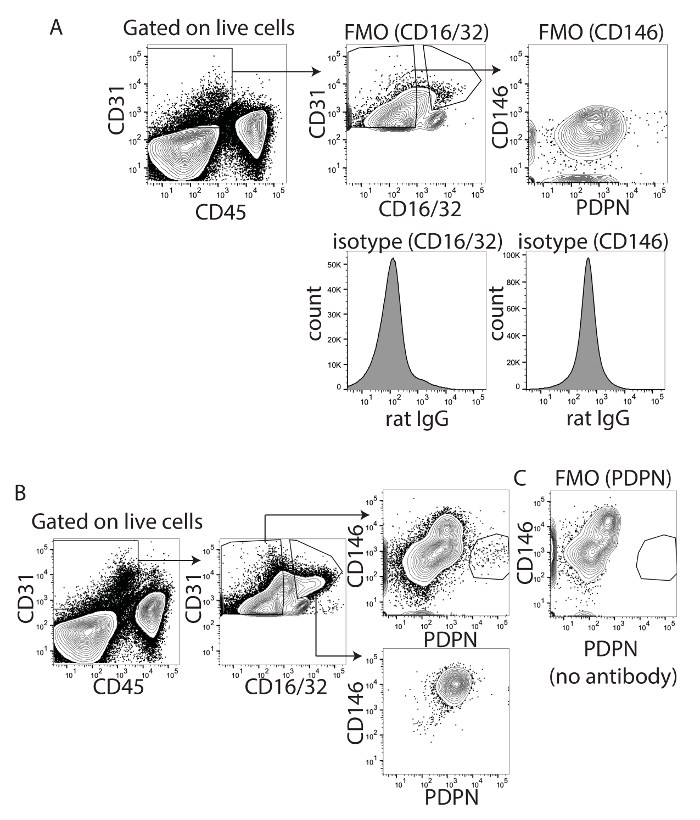
図 2: 適切な肝リンパ管内皮細胞マーカーとしての CD146 と PDPN の同定します。(A) マイナス 1 とアイソタイプこのパネル ショー蛍光 CD16/32 (左) と CD146 (右) を制御します。(B) このパネルには、パネルAから決定されるゲートの CD16/32 の正または負のセルが表示されます。両方の人口から CD146XPDPN を示します。(C) このパネルは蛍光染色が不在のとき、抗体は追加されないことを実証する PDPN の 1 を引いた値を示しています。この図の拡大版を表示するのにはここをクリックしてください。
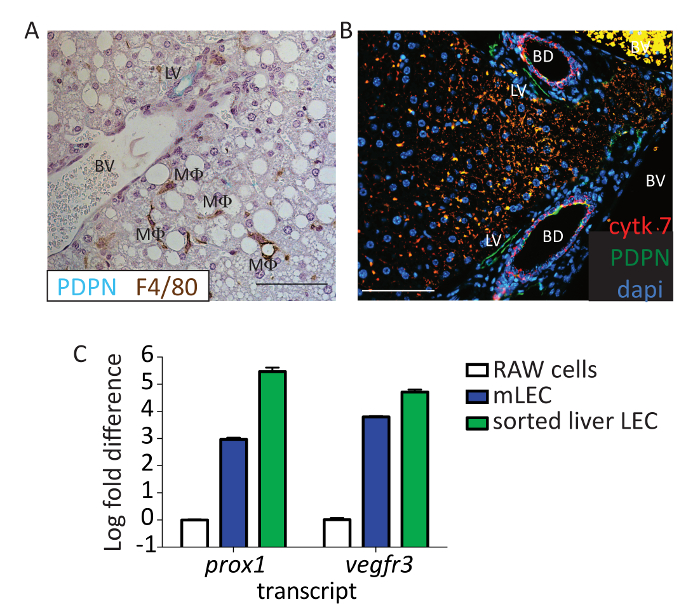
図 3: PDPN + フローの識別細胞としてリンパ管内皮細胞。このパネルでは、代表的な免疫マウスからショー (A) 肝 PDPN (ブルー/グリーン) と F4/80 (ブラウン) ステンド グラスします。リンパ管 (LV)、血管 (BV) とマクロファージ (MF) のラベルです。スケールバー = 100 μ m. ホルマリン固定パラフィン包埋組織キシレンで 20 分間だった deparaffinized。組織されたエタノールの勾配によって水を水和し、抗原検索 15 分組織は 0.1 %bsa を使用してブロックされた pH 6 抗原検索バッファーの圧力鍋を使用して実行された部屋で 1 時間抗マウス PDPN と抗マウス F4/80 を使用して温度。反ハムスター IgG HRP と抗うさぎ IgG HRP は、二次抗体として使用されました。3, 3'-ジアミノベンジジン (軽打) + ヴィーナ グリーンは F4/80 PDPN をそれぞれ検出に使われました。組織は、ヘマトキシリンと counterstained され、顕微鏡のイメージします。PDPN は赤と 4 ', 6-diamidino-2-phenylindole (DAPI) 青で緑、サイトケラチン 7 に示すように、(B) このパネルは、パネル、ここ以外で同じ実験を示しています。スケール バー = 100 μ m. 5% ロバと 5% ヤギ血清を使用し、室温で 1 時間抗マウスの PDPN (8.1.1) 1: 100 と抗マウス サイトケラチン 7 1: 200 を使用して染色、組織がブロックされました。反ハムスター IgG AF647 と抗うさぎ IgG PE は、二次抗体として使用されました。組織は DAPI で counterstained され、イメージを作成します。スケールバー = 100 μ m。リンパ管 (LV)、血管 (BV)、胆管 (BD) が付きます。(C) このパネルは、LECs は生細胞またはプライマリ マウス リンパ節 LECs と比較してプロトコル (CD45、CD31 +、CD146lo/指定、総额、・ PDPN +) で染色に基づいて並べ替えられた肝臓からVegfr3と近接 1式の変更ログ フォールドを示しています。生体高分子破砕列を並べ替えられた細胞を通過していた、RNA が RNA 抽出キットで抽出された cDNA は、逆のトランスクリプションのキットを使用して作られました。トラン スクリプトの豊かさは、すべてのサンプルのハウスキーピング遺伝子Gapdhに正規化されました。この図の拡大版を表示するのにはここをクリックしてください。
ディスカッション
免疫恒常性と調節で LECs の全体的な重要性は、最近光25に来てください。発表されたリンパの文献の多くは皮膚やリンパ節に焦点を当ててください。しかし、リンパ管は26体で発見され、したがって、異なる臓器の重要性の理解が必要です。セルごとに異なる表面マーカー、サイトカイン、ケモカイン、および転写因子などの細胞内タンパク質の同時発現を理解する肝で LECs を研究できる方法を紹介します。このメソッドは、表現型および肝臓で LECs の機能を評価し、健康と病気の間に今後の研究の役に立つでしょう。
肝臓で LECs の同定のためのハードルの 1 つは、他の細胞型と比較して比較的低い周波数です。肝細胞は、肝臓と流れの cytometer で肝臓を実行しているより少ない時間を必要とし、したがってより良い生存率を提供する前に、密度勾配 (iodixanol) を使用してこれらの細胞を削除の約 80% を構成します。LYVE1 + LSECs から肝臓の LYVE1 + LECs の人口を区別するために、マーカー CD16/32、LECs をされた LSECs と式を持たない低 CD146 を使用しました。これは、不足または LECs を特定された人口にいたフローサイトメトリーによる検証を許可されて、肝臓で他の血管内皮細胞による PDPN の発現は低下と相まってください。確かに、下流の転写解析は、LECs (図 3)、このゲートの戦略に生成を確認しました。
LECs のリンパ節からの分離をお勧めコラゲナーゼ私-II-と-dispase; を使用してしかし、我々 は肝臓から LECs を抽出は中、コラゲナーゼ IV を使用して肝臓の消化力のプロトコルは、フローサイトメトリーを使用してより良い下流分析を提供します、発見。肝臓の機械的破壊を使用して、コラゲナーゼより LECs のような細胞外マトリックス関連細胞と対話するより多くの表面積でき、FBS せずクリックの EHAA メディアを使用して肝臓の消化のため 30 分のみで発生します。この時間が減少は、フローサイトメトリーや流れの並べ替えのような下流の試金のための LEC 生存率を保持しています。確かに、cytometry 流れと流れの下流の転写解析の並べ替えによって LECs を視覚化するのに十分な実行可能なセルを回復することができました。
組み合わせることで、肝非実質細胞、IV、コラゲナーゼ型の使用の明確化および分離と肝臓で LECs を特定のマーカーとマーカー CD16/32 などの他の血管内皮細胞集団に固有のデモとCD146、肝臓で LECs の適切な同一証明を許可します。これらのメソッドは、肝臓で LECs が、フローサイトメトリーによって識別できます肝にはリンパ節 (prox1とで LECs を一意にする知られているマーカーを表現する他のセルの数が含まれていますので、特にどのについての文献で重要なギャップを埋めるvegfr3)。したがって、これらのメソッドは、LEC の肝機能に関する下流の研究に します。さらに、他の組織の場合より良い組織固有 LEC マーカーおよびサブセットを評価するためにこのメソッドを変更できます。
開示事項
著者が明らかに何もありません。
謝辞
著者は、このプロジェクトの金融支援のため消化管と肝臓生得免疫プログラムを感謝したいです。B.A.J.T. も R01 AI121209 によって資金を供給します。
資料
| Name | Company | Catalog Number | Comments |
| Clicks/EHAA media | Irvine Scientific | 9195 | |
| Collagenase IV | Worthington Biochemical corporation | LS004188 | |
| DNase I | Worthington Biochemical corporation | LS002145 | Deoxyribonuclease 1 |
| OptiPrep | Sigma Aldrich | D1556 | Density Gradient Medium |
| V450 anti mouse CD146(clone ME-9F1) | BD biosciences | 562232 | |
| FITC anti mouse CD146 (clone ME-9F1) | Biolegend | 134706 | Fluorescein isothiocyanate (FITC) |
| Pacific Blue anti mouse CD31(clone 390) | Biolegend | 102422 | |
| PerCp/Cy5.5 anti mouse CD31(clone 390) | Biolegend | 102420 | Peridinin-chlorophyll proteins-Cyanine 5.5 (PerCP-Cy5.5) |
| APC anti mouse PDPN (clone 8.1.1) | Biolegend | 127410 | Allophycocyanin (APC), podoplanin (PDPN) |
| APC/Cy7 anti mouse CD45 (clone 30-F11) | Biolegend | 103116 | |
| Brilliant Violet 510 anti mouse CD45 (clone 30-F11) | Biolegend | 103138 | |
| FITC anti mouse CD16/32 (clone 93) | Biolegend | 101306 | Fluorescein isothiocyanate (FITC) |
| PerCp/Cy5.5 anti mouse CD16/32(clone 93) | Biolegend | 101324 | Peridinin-chlorophyll proteins-Cyanine 5.5 (PerCP-Cy5.5) |
| ghost red 780 viability dye | TONBO biosceinces | 3-0865-T100 | |
| APC syrian hamster IgG (clone SHG-1) | Biolegened | 402102 | |
| PerCp/Cy5.5 rat IgG2a (clone RTK2758) | Biolegend | 400531 | |
| FITC rat IgG2 (clone eBR2a) | ebioscience | 1-4321-80 | |
| Anti mouse LYVE1 (clone 223322) | R&D systems | FAB2125A | |
| anti-mouse Cytokeratin(clone EPR17078) | abcam | ab181598 | |
| anti-mouse F4/80 (clone Cl:A3-1) | Bio-rad | MCA497 | |
| BSA (fraction V) | Fischer | BP1600-100 | Bovine Serum Albumin (BSA) |
| Goat serum | Jackson Immunoresearch | 017-000-121 | |
| Donkey Serum | Jackson Immunoresearch | 017-000-121 | |
| EDTA | VWR | E177 | Ethylenediaminetetraacetic acid (EDTA) -for RBC lysis buffer |
| Ammonium Chloride | Fischer | A687-500 | for RBC Lysis buffer |
| Potassium Bicarbonate | Fischer | P184-500 | for RBC Lysis buffer |
| Scalpel | Feather | 2975#21 | |
| 100 μm cell strainer | Fischer | 22363549 | |
| 2.4G2 | in house/ATCC | ATCC HB-197 | FC block to inhibit non-specific binding to Fc gamma + cells -made from hybridoma |
| Phosphate Buffered Saline (PBS) | Corning | 21-040-CV | |
| Hanks Balanced Salt Solution (HBSS) | Gibco | 14185-052 | |
| Fetal Bovine Serum (FBS) | Atlanta biologicals | S11550 | |
| 96 well plate | Corning | 3788 | |
| 6 well plate | Corning | 3506 | |
| 50 mL conical | Truline | TR2004 | |
| 15 mL conical | Falcon | 352196 | |
| 1 mL Pipete tip | USA scientific | 1111-2721 | |
| 200 µL pipete tip | USA scientific | 1110-1700 | |
| 10 µL pipete tip | USA scientific | 1111-3700 | |
| seriological 10 mL pipete | greiner bio-one | 607107 | |
| seriological 5 mL pipete | greiner bio-one | 606107 | |
| Cell incubator | Fischer | Heracell 160i | |
| BD FacsCanto II flow cytometer | BD biosciences | ||
| Clinical Centrifuge | Beckman coulter | model X-14R |
参考文献
- Tanaka, M., Iwakiri, Y. Lymphatics in the liver. Current Opinion in Immunology. 53, 137-142 (2018).
- Vollmar, B., Wolf, B., Siegmund, S., Katsen, A. D., Menger, M. D. Lymph vessel expansion and function in the development of hepatic fibrosis and cirrhosis. The American Journal of Pathology. 151 (1), 169-175 (1997).
- Podgrabinska, S., et al. Molecular characterization of lymphatic endothelial cells. Proceedings of the National Academy of Sciences of the United States of America. 99 (25), 16069-16074 (2002).
- Cohen, J. N., et al. Lymph node-resident lymphatic endothelial cells mediate peripheral tolerance via Aire-independent direct antigen presentation. Journal of Experimental Medicine. 207 (4), 681-688 (2010).
- Cohen, J. N., et al. Tolerogenic properties of lymphatic endothelial cells are controlled by the lymph node microenvironment. PLoS One. 9 (2), e87740 (2014).
- Rouhani, S. J., et al. Roles of lymphatic endothelial cells expressing peripheral tissue antigens in CD4 T-cell tolerance induction. Nature Communications. 6, 6771 (2015).
- Tewalt, E. F., et al. Lymphatic endothelial cells induce tolerance via PD-L1 and lack of costimulation leading to high-level PD-1 expression on CD8 T cells. Blood. 120 (24), 4772-4782 (2012).
- Dubrot, J., et al. Lymph node stromal cells acquire peptide-MHCII complexes from dendritic cells and induce antigen-specific CD4(+) T cell tolerance. Journal of Experimental Medicine. 211 (6), 1153-1166 (2014).
- Hirosue, S., et al. Steady-state antigen scavenging, cross-presentation, and CD8+ T cell priming: a new role for lymphatic endothelial cells. Journal of Immunology. 192 (11), 5002-5011 (2014).
- Lund, A. W., et al. VEGF-C promotes immune tolerance in B16 melanomas and cross-presentation of tumor antigen by lymph node lymphatics. Cell Reports. 1 (3), 191-199 (2012).
- Lund, A. W., et al. Lymphatic vessels regulate immune microenvironments in human and murine melanoma. Journal of Clinical Investigation. 126 (9), 3389-3402 (2016).
- Swartz, M. A. Immunomodulatory roles of lymphatic vessels in cancer progression. Cancer Immunology Research. 2 (8), 701-707 (2014).
- Dietrich, T., et al. Cutting edge: lymphatic vessels, not blood vessels, primarily mediate immune rejections after transplantation. Journal of Immunology. 184 (2), 535-539 (2010).
- Kedl, R., et al. Migratory Dendritic Cells acquire archived antigen from Lymphatic Endothelial Cells for antigen presentation during lymph node contraction. Nature Communications. 8, 2034 (2017).
- Kedl, R. M., Tamburini, B. A. Antigen archiving by lymph node stroma: A novel function for the lymphatic endothelium. European Journal of Immunology. 45 (10), 2721-2729 (2015).
- Tamburini, B. A., Burchill, M. A., Kedl, R. M. Antigen capture and archiving by lymphatic endothelial cells following vaccination or viral infection. Nature Communications. 5, 3989 (2014).
- Yokomori, H., et al. Lymphatic marker podoplanin/D2-40 in human advanced cirrhotic liver--re-evaluations of microlymphatic abnormalities. BMC Gastroenterology. 10, 131 (2010).
- Nonaka, H., Tanaka, M., Suzuki, K., Miyajima, A. Development of murine hepatic sinusoidal endothelial cells characterized by the expression of hyaluronan receptors. Developmental Dynamics. 236 (8), 2258-2267 (2007).
- Dudas, J., et al. Prospero-related homeobox 1 (Prox1) is a stable hepatocyte marker during liver development, injury and regeneration, and is absent from "oval cells". Histochemistry and Cell Biology. 126 (5), 549-562 (2006).
- Schrage, A., et al. Murine CD146 is widely expressed on endothelial cells and is recognized by the monoclonal antibody ME-9F1. Histochemistry and Cell Biology. 129 (4), 441-451 (2008).
- Amatschek, S., et al. Blood and lymphatic endothelial cell-specific differentiation programs are stringently controlled by the tissue environment. Blood. 109 (11), 4777-4785 (2007).
- Huang, L., Soldevila, G., Leeker, M., Flavell, R., Crispe, I. N. The liver eliminates T cells undergoing antigen-triggered apoptosis in vivo. Immunity. 1 (9), 741-749 (1994).
- Shay, T., Kang, J. Immunological Genome Project and systems immunology. Trends in Immunology. 34 (12), 602-609 (2013).
- Li, B., et al. Adult Mouse Liver Contains Two Distinct Populations of Cholangiocytes. Stem Cell Reports. 9 (2), 478-489 (2017).
- Randolph, G. J., Ivanov, S., Zinselmeyer, B. H., Scallan, J. P. The Lymphatic System: Integral Roles in Immunity. Annual Review of Immunology. 35, 31-52 (2016).
- Olszewski, W. L. The lymphatic system in body homeostasis: physiological conditions. Lymphatic Research and Biology. 1 (1), 11-21 (2003).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved