Method Article
림프 내 피 세포의 흐름 Cytometric 분석 Murine 간 소화
요약
이 프로토콜의 목표 설명된 마커를 사용 하 여 간 내 림프 내 피 세포 인구를 식별 하는 것입니다. 우리는 콜라 IV 및 DNase 및 조직, 림프 내 피 세포의 명료한 인구를 식별 하기 위해 cytometry와 결합의 부드러운 닦지를 이용 한다.
초록
간, 내 림프 혈관 포털 깡패 내에서 발견 되 고 그들의 설명한 기능 세포 파편과 항을 조사 수 있는 림프절을 간에서 틈새 액체를 제거 하는. 우리는 림프 맥 관 구조 염증 및 간 내에서 면역 세포 기능에 관여 하는 수도 있습니다 어떻게 이해에 매우 관심이 다입니다. 그러나, 아주 작은 게시 된 간 또는 간 평가 하는 데 사용할 수 있는 특정 마커 (LECs)의 림프 내 피 세포의 고립에 대 한 소화 프로토콜 설정 LECs 당 셀 기준. 따라서, 우리는 소화와 간에서 LEC 인구를 평가 하기 위해 간 얼룩에 대 한 방법을 최적화 합니다. 우리는 여기에 설명 된 방법을 식별 및 간에서 LECs의 격리에 대 한 도움이 될 것입니다 LECs 간 microenvironment에 대응 하는 방법에 대 한 우리의 이해를 강화할 것 이다 확신.
서문
간에서 림프 혈관 및 LECs의 역할은 잘 이해 되지. 림프 혈관 간1 의 포털 3 인조 내의 질병2중 확장 하는 동안 아주 작은 기능 및 간 내 LECs의 표현 형에 관한 이해 된다. LECs3에 주로 발견 되는 마커의 발견과 항상성 및 질병에 다른 조직 틈새 내의 이러한 셀의 중요성 우리의 이해에 중요 한 격차를 채울 것입니다. LECs는 T 세포4,,56,7,8, 와 직접 상호 작용 하 여 림프 노드 및 전이성 종양 주변 공차를 유지 하는 주요 역할 9 , 10 , 11 , 12 , 13. 림프 노드에서 LECs 철새 수지상 세포14,,1516와 그들의 상호 작용을 통해 보호 면역을 홍보할 수 있습니다. 따라서, 특정 조직에 있는 그들은 존재 하는 상호 작용 수 있는 LECs에 대 한 여러 역할이 있습니다. 그러나, 아주 작은 LECs 조직에서 면역 세포 상호 작용 하는 방법 또는 다른 기관 체계; LECs 작동 하는 방법에 대 한 이해는 따라서, 간 또는 다른 장기에서 세포 당 기준 LECs 평가 어떻게 LECs 조직 특정 면역 프로그램에서 발생할 수 있습니다. 문학에 초점을 맞춘 LECs 간에서 많이 LECs 하나 또는 두 개의 마커 및 형태학17를 사용 하 여 시각화를 현미경을 사용 하 여, 하는 동안 아주 작은 일 하고있다 특히 cytometry, 비록 한 연구를 사용 하 여 셀에 의해 셀 별로 LECs를 평가 하 한 간 사인 내 피 세포 (LSECs), LECs18간의 차이 평가. Cytometry 여 간에서 LEC 인구를 분석할 수 있는 정상적인 항상성 또는 질병 동안 LEC 표현 형의 심도 있는 연구에 대 한 수 있습니다.
LECs cytometry로를 평가 하려면 여러 표면 마커 필요 합니다. 일반적으로, LECs 지주 님 관련 homeobox 1의 표현 (Prox-1), 림프 혈관 내 피 hyaluronan 수용 체 1 (LYVE1) 또는 혈관 내 피 성장 인자 수용 체 3 (VEGFR3) 현미경을 사용 하 여 시각화 됩니다. 그러나,이 간,이 마커의 식 LECs 제한 되지 않습니다. Prox 1 널리 간 개발, 재생, 및 부상19, hepatocytes에 의해 표현 하 고 LYVE1 및 VEGFR318간 사인 내 피 세포 의해 표현 됩니다. 림프절, LECs cytometry 차별화 (CD)의 클러스터로 사용 하 여 식별 됩니다 CD45-CD31 +, podoplanin + (PDPN)16. 그러나,이 방법은 너무 CD45-CD31 + 세포는 내 피 세포와 간에서 혈관 내 피 세포의 주된 인구는 LSECs 이후 간에서 LECs을 최소 이다. 따라서, 다른 마커는 풍부한 LSEC 인구에서 드문 LEC 인구 구분 필요 합니다. CD16/32 (성숙 LSECs18에 의해 표현)와 CD146 (일반적인 혈관 내 피 세포 마커를 주로 림프 여 식이 없는 거의 간 사인 내 피 세포20 여 간 사인 내 표현 내 피 세포21) 후보 마커를 했다.
따라서, 우리는 분리 하 고 간 cytometry에 대 한 위의 마커, CD45, CD31, CD146, CD16/32, 및 PDPN를 사용 하 여에서 LECs을 시각화 하는 방법을 최적화 합니다. 우리는 콜라 4의 사용, DNase 1, 및 단일 셀 서 스 펜 션에 간 조직 소화에 대 한 기계적 분리 설명합니다. 우리는 또한 세포질 파편을 제거 하 고 비 parenchymal 세포 (NPC)의 분리에 대 한 iodixanol 밀도 그라디언트를 사용 하 여를 설명 합니다. 주된 마커로 PDPN 간에서 LECs을 식별 하는 최적의 흐름 cytometry 제어 전략을 결정 마지막으로, 여러 개의 마커를 사용 하 여, 우리.
프로토콜
여기에 설명 된 모든 메서드는 기관 동물 관리 및 사용 위원회 (IACUC) 콜로라도 대학 Anschutz 의료 캠퍼스의 승인 되었습니다.
1입니다. 자료의 준비
- 5 mg/mL 솔루션 DNase의 인산 염 버퍼 식 염 수 (PBS)에 내가.
- 클릭의 EHAA 미디어 콜라 IV의 5000 U/mL을 추가 하 여 소화 혼합물 을 확인 합니다.
- 사용 하기 30 분 전에 37 ° C에서 소화 혼합 따뜻한.
- 4.8% 소 혈 청 알 부 민 (BSA)와 행 크 스를 2 mM ethylenediaminetetraacetic 산 (EDTA) 균형 소금물 (HBSS) 추가 하 여 절연 버퍼 를 확인 합니다.
- 염화 암모늄 100 mM, 10 mM KHCO3및 0.1 m m EDTA를 H2o. 소 주를 추가 하 여 적혈구 (RBC) 세포의 용 해 버퍼를 확인
2. 마우스 간에서 단일 세포 현 탁 액의 준비
- CO2 와 자 궁 경부 전위 마우스 안락사
- 그것의 모피를 젖은 70% 에탄올과 마우스 아래로 스프레이. 마우스의 고정 해 부 보드 발.
- 해 부가 위를 사용 하 여 피부 피부 (약 1 m m)만 극복 하 게 주의 되 고 항문 위에 약 1cm를 잘라. 이빨된 집게와 몸 떨어져 피부를 당겨 하 고 피부와 복 막 사이 위를 삽입 합니다. 복에서 피부를 분리 하 고, 다음, 목에 절 개에서 피부를 잘라가 위를 엽니다.
- 각각의 팔 아래 및 각 다리 위에서 하나의 핀을 사용 하 여 해 부 보드에 피부를 고정 합니다. 복 주머니를 올려 고 목으로 위쪽으로 잘라. 간 엽을 흉 골 바로 아래를 잘라.
참고: 한다 주의 간의 immunohistochemistry (IHC) 사용 될 것입니다. - 간 주위와 마우스에서 간 제거 잘라내어 클릭의 EHAA 미디어의 4 mL에 배치.
- 메스를 사용 하 여 간 ~ 1 m m에서 직경 조각 잘라.
- 추가 소화 혼합물의 500 µ L 500 µ L는 DNase의 간 난 (2 mg/mL).
- 37 ° c.에 30 분 간 품 어 15 분 후 5 mL 피 펫을 사용 하 여 액체 믹스.
- 외피의 30 분 후 50 mL 원뿔 튜브를 100 µ m 스 트레이너를 통해 소화 샘플을 전송.
- 부드럽게 필터 1 mL 주사기의 플런저를 통해 남은 조각을 밀어.
- 절연 버퍼의 5 mL로 필터를 세척 하 고 1 mL 주사기에서 조직 플런저의 뒷면으로 스 트레이너를 통해 가볍게 눌러. 이 필터는 절연 버퍼의 25 mL로 씻어 때까지 반복 합니다.
- 5 분은 신중 하 게는 상쾌한에서 발음에 대 한 400 x g 에서 세포를 원심.
- RBC 세포의 용 해 버퍼의 4 mL와 펠 릿 resuspend 5 분 동안 실내 온도에 세포를 품 어.
- 절연 버퍼 및 5 분에 대 한 400 x g 에서 원심 분리기의 10 mL로 세포 세척.
- 전체 간 수를 확인 하려면 hemocytometer 셀을 계산 합니다.
- Resuspend 20 %iodixanol 5 ml에서는 세포 고 1 mL의 PBS로 레이어.
- 세포는 브레이크 없이 15 분 300 x g 에서 원심
- PBS는 iodixanol 사이 레이어를 제거 하 고 새로운 50 mL 원뿔 튜브로 100 µ m 필터를 통해 그들을 배치.
- 절연 버퍼 및 5 분에 대 한 400 x g 에서 원심 분리기의 10 mL로 세포 세척.
- 삭제는 상쾌한 고 2% 태아 둔감 한 혈 청 (FBS)와 PBS의 500 µ L에 셀 resuspend.
3. 간에서 단일 세포의 Cytometric 분석 흐름
- Hemocytometer 고 trypan 블루 제외를 사용 하 여 측정 가능한 세포를 현미경을 사용 하 여 셀을 계산 합니다. Trypan 블루의 10 µ L를 셀의 10 µ L을 추가 하 고 즉시는 hemocytometer에 넣어 현미경 (하지 블루) 라이브 셀. 그런 다음, microliter 당 셀의 수를 계산 합니다.
- 약 수 약 5 백만 96 잘 접시의 단일 우물으로 남아 있는 nonparenchymal 세포의.
- 5 분에 대 한 400 x g 에서 셀 원심
- 삭제는 상쾌한 고 2%와 PBS의 90 µ L 셀 resuspend FBS.
- 안티-CD45 (1: 200), 안티-CD146 (1: 200), 안티-CD31 (1: 200)을 추가 하 고 PDPN (1: 200) 2.4G2 또는 안티-CD16/32 (1: 200) x 10의 10 µ L에 희석.
참고: 안티 CD16/32-표시 된 항 체 사용 되었다 때 아니 Fc 블록 (2.4G2) 사용 되었다. - 긍정적이 고 부정적인 게이츠 설정할 위치를 확인 하려면 각 색상 및 항 체 isotype 컨트롤 1 (FMO) 얼룩 빼기 형광을 포함 합니다.
- 라이브 대 죽은 세포를 확인 하려면 생존 표시 (예, 귀신 빨간 780)와 함께 얼룩. 30 분 동안 4 ° C에서 세포를 품 어.
- 2%와 PBS의 100 µ L로 세포 세척 FBS.
- 셀의 작은 약 수를 사용 하 여 교류 cytometer에서 레이저와 보상 설정을 조정할. 각 개별 fluorophore와 어떤 항 체 없이 하나의 항 체와 세포 얼룩.
참고: 사용 되 고 교류 cytometer 따라 보상 매트릭스 스펙트럼 중복 제거를 설립 되어야 합니다. - Cytometer 프로브에 샘플 튜브를 배치 하 고 수집 하 고 모든 이벤트를 기록.
4. 데이터 분석
- 측면-분산형 지역 대 앞으로 피해 지역에서 찾고, 크기와 단위 생존 마커 염료에 따라 "라이브" 셀 게이트.
- 다음, CD45 화려한 바이올렛 510과 CD31 PerCp Cy5.5, CD45-CD31 + 셀을 긍정적이 고 부정적인 인구 isotype 컨트롤 및 FMO를 사용 하 여 게이트를 사용 합니다.
- 마지막으로, CD146-PDPN + 또는 CD16/32를 걸릴 CD146 v450 또는 CD16/32 FITC와 PDPN APC를 사용 하 여-PDPN + 셀, 사용 하 여 다시 isotype 컨트롤 및 FMO, 긍정적이 고 부정적인 인구 확인 하. 이 세포는 LECs는.
결과
간 lymphatics를 분석 하는 연구는 주로 주파수와 간에서 림프 혈관의 직경을 quantitate 하 immunohistochemistry를 사용 됩니다. 그러나,이 메서드는 셀에 의해 셀 기준 LECs의 평가 대 한 또는 여러 마커, cytokines, 발산, 또는 녹음 방송 요인의 표현에 대 한 허용 하지 않습니다. 따라서, 우리는 물었다 간 여부 LECs 간 으로부터 격리 될 수 있고 cytometry 사용 하 여 평가. 림프절 LECs 분리 이전 작업 Liberase DL (콜라 나-II-및-dispase)와 DNase 1 바늘14,16림프절 조직의 기계적 분리와 결합을 사용 하 여 수행 되었다. 따라서, 간 조직에 동일한 소화 프로토콜 사용 되었다 또는 콜라 IV 및 DNase 1 간22 에서 면역 세포 격리에 대 한 이전 설명 하 고 소화를 밀도 그라데이션 분리 (iodixanol) 단계를 따 랐 다 사용 되었다 hepatocytes 제거 하 고 다른 종류의 세포 간 (그림 1A) 내의 주파수를 증가. 간 소화 하 고 밀도 그라데이션으로 원심 분리, 셀 CD16/32, PDPN, CD31, CD45 얼룩이 있었다. CD16/32 성숙 LSEC 인구, 하지만 하지 LEC 인구18에 의해 표현 될 설명 하고있다. 따라서, LECs CD45-, CD31 + CD16/32로 문이 있었다-, PDPN +, LSECs CD45-, CD31 + CD16으로 개폐 했다 하는 동안 셀 / 32 + PDPN-(그림 1A). 게이츠는 라이브 셀 (빨간 유령 부정)에 설정 하 고 isotype 컨트롤 및 FMO 착 (그림 1A)에 따라 했다. LYVE-1 APC LEC 인구에는 또한 확인 (그림 1B). 두 방법 간; 내 LEC 인구의 시각화를 허용 그러나, 세포의 얼룩 프로필 때 시각적으로 더 나은 콜라 나-II-및-dispase (그림 1C) 보다 콜라 IV 및 DNase 1를 사용 하 여. 따라서, 모든 미래 조작은 수행 했다 콜라 IV DNase 1을 사용 하 여 프로토콜에 설명 된 대로. 평균적으로, 우리는 간 조직의 그램 당 약 1300 LECs 또는이 소화 메서드를 사용 하 여 순진한 간 당 2200 LECs 얻었다.
제어 전략 및 fluorophores의 조합을 최적화 하 고 LSECs의 오염 제거 CD16/32와 CD146 모두 사용 되었다. CD16/32 Fc 감마 수용 체 II 및 III 이며 성숙 LSECs에 그러나 LECs18에 표시 됩니다. CD16/32 수 PDPN CD16에서 PDPN + CD16/32-셀을 구별/32 + 셀, 특히 때 PDPN를 사용 하 여 APC 또는 PE에 활용 된 CD16/32 FITC (그림 1A), 하지만 덜 PDPN PE-Cy7 (그림 1C)을 활용 했다 때에 잘 활용. CD16/32의 식 LECs에 찾을 수 없습니다 하지만 LSECs에 발견 된다. Fc 블록 CD16/32 항 체를 사용 하 여 Fc 수용 체 바인딩 및 nonantigen 면역 글로불린 Fc 수용 체의 특정 바인딩 최소화. CD16/32는 LSECs를 시각화 하는 데 사용 되었다, 면역 글로불린의 비 특정 바인딩 높았다 고 CD146 LSECs를 측정 하는 대신 최적화 되었다. 따라서, 우리 CD146 V450, 혈관 내 피 세포 마커 높은 LSECs 및 다른 혈관 내 피 세포20 하지만 식이 없는 낮은 LECs23에 의해 표현에 활용 된 테스트. 우리는 먼저 CD146의 얼룩 최적화 CD16/32와 CD146 FMO와 isotype 컨트롤을 사용 하 여 (그림 2A). 만약 우리가 CD16 평가 / 32 + 셀 또는 CD16/32-세포는 CD16 / 32 + 셀 되었고 모든 CD146 + PDPN-CD16/32-셀은 주로 CD146-PDPN-및 PDPN + (그림 2B). 이 얼룩 것인지 FMO 사용 되었다. 얼룩에서 PDPN를 제거 하 여 PDPN + 인구 (그림 2C) 사라졌다. 흥미롭게도, CD146 + PDPN + 셀, 그 CD146 하지 또는 매우 낮은 표현 된다 PDPN + LECs에 의해 확인 했다. 따라서, 우리는 이러한 표시 중 하나가 사용 될 수 있다는 확신에 혈관 내 피 세포 밖으로 게이트.
더 확인 하려면 그 PDPN LECs에 대 한 적절 한 표식, 쥐에서 간 섹션 PDPN (녹색)와 f 4/80 (갈색) (그림 3A) 얼룩이 있었다. 혈관 내 피도 세포 PDPN murine 간 표현. 우리는 또한 cholangiocytes, PDPN에서 cytokeratin 7 얼룩이 지 고 담 즙 덕트의 고유 핵 구조에 따라 림프 혈관에 대 한 긍정적인 얼룩이 질 수 있다 구별할 수 (그림 3B; 레드: cytokeratin 7, 녹색: PDPN). 이후 여러 마커 CD31, cholangiocytes24로 표현 하지, 같은 cytometry 사용 됩니다 우리는 우리가 분석에서 이러한 셀을 제거 하는, 그로 인하여 확인을 간 CD45-, CD31 +, CD146는에서 세포 확신 소호/neg, CD16/32-, PDPN +는 LECs 및. 마지막으로, 스테인드 셀 LECs는 증거를 제공 하기 위해 우리 세포의이 인구를 정렬 하 고 Vegfr3 와 prox-1 식 질적 실시간 중 합 효소 연쇄 반응을 사용. Vegfr3 와 prox-1 평가 했다, 이러한 증명서 간에 있는 다른 세포에 의해 표현으로-(다른 사람) 사이 hepatocytes와 Vegfr3 LSECS,prox1 -LECs 외 다른 셀을 모두 표현 하지만. 두 이러한 마커의 표현이 했다 교양된 murine macrophage 셀 라인 (RAW264.7)는 일반적으로 이러한 마커를 표현 하지 않는다 하지만 교양된 murine LECs (그림 3C 식에 유사에 보다 정렬 된 인구에서 상당히 높은 ).
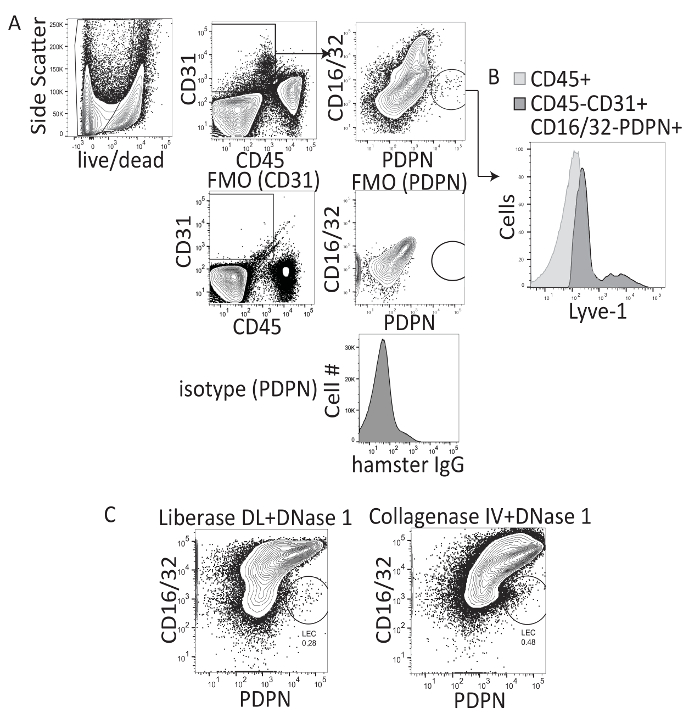
그림 1 : 콜라 나-II-dispase와 콜라 4 소화 murine 간 조직의 대표 흐름 cytometry 분석. (A)이이 패널 표시 제어 전략, 한 얼룩 빼기 형광 고 isotype 절차에 대 한 제어. (B)이이 패널 표시 CD16/32 LYVE-1 얼룩-PDPN + 셀. (C)이이 패널 중 콜라 나-II-dispase (예를 들어, Liberase DL)와 마우스 간 소화 후 최종 흐름 cytometry 게이트 표시 또는 콜라 IV 및 CD16/32 PerCP X PDPN PE-Cy7 어디 LECs는 CD16/32 평가-및 PDPN +. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
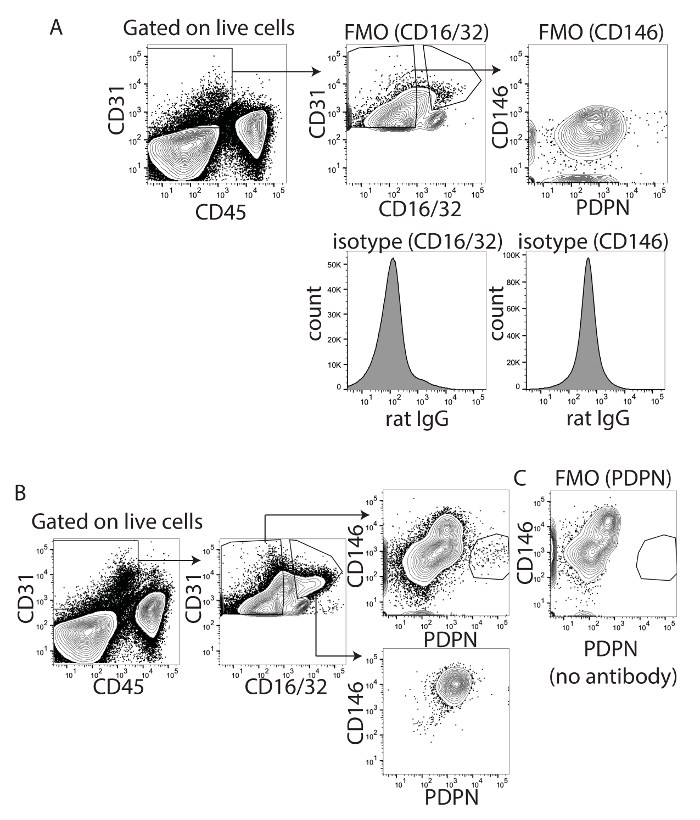
그림 2 : 간 림프 내 피 세포에 대 한 적절 한 표식으로 CD146와 PDPN의 id. (A)이 패널 쇼 형광 고 isotype 마이너스 컨트롤 CD16/32 (왼쪽)와 CD146 (오른쪽). (B)이이 패널 표시 문이 CD16/32 포지티브 또는 네거티브 셀 패널 A에서 결정 합니다. 표시 하는 것은 두 모집단에서 CD146XPDPN입니다. (C)이이 패널 PDPN는 얼룩이 지는 항 체 추가 되지 않습니다 때 결 석 입증 한 마이너스 형광을 표시 합니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
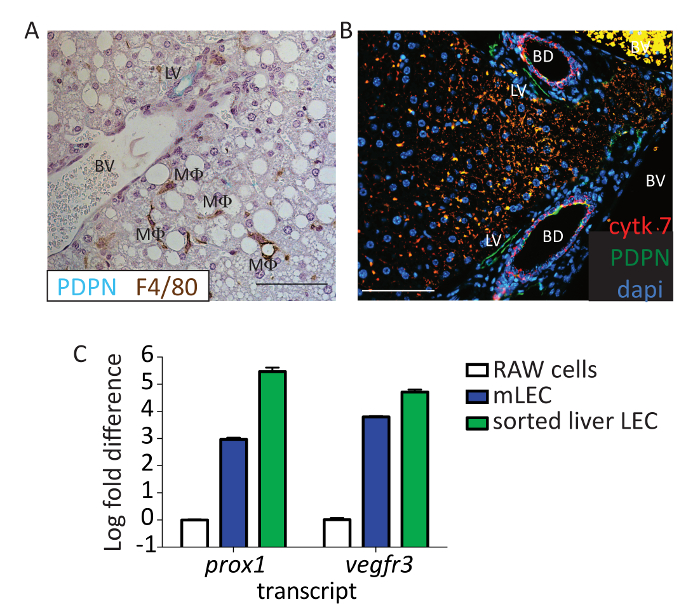
그림 3 : 흐름 PDPN +의 세포로 림프 내 피 세포. (A) 마우스에서이 패널 쇼 대표 immunohistochemistry 간 F4/80 (브라운) PDPN (블루/그린)와 스테인드. 림프 배 (LV), 혈관 (BV), 고 대 식 세포 (MF)로 표시 됩니다. 눈금 막대 = 100 µ m. 포 르 말린 고정 파라핀 끼워 넣어진 조직 크 실 렌에서 20 분은 deparaffinized. 조직 했다 에탄올, 그라디언트를 통해 물을 충분 한지 체크 해 그리고 항 원 검색 15 분 조직 0.1 %BSA 사용 하 여 차단 된에 대 한 압력 밥 솥에서 pH 6 항 원 검색 버퍼를 사용 하 여 수행한 룸에서 1 시간에 대 한 반대로 마우스 PDPN와 반대로 마우스 F4/80을 사용 하 여 스테인드 온도입니다. 반대로 햄스터 IgG HRP와 반대로 토끼 IgG HRP 2 차 항 체로 사용 되었다. 3, 3'-Diaminobenzidine (한 덩어리) + 미 오 그린 F4/80 및 PDPN, 각각 검출 하는 데 사용 했다. 조직의는 hematoxylin와 counterstained 그리고 현미경에 몇 군데. (B)이이 패널 패널 여기를 제외 하 고 는 에서 수행 하는 동일한 실험, PDPN 빨강, 및 4, 6-diamidino-2-phenylindole (DAPI) 파란색에서 녹색, cytokeratin 7에에서 표시 됩니다. 눈금 막대 = 100 µ m. 5% 당나귀와 5% 염소 혈 청을 사용 하 고 실 온에서 1 h에 대 한 반대로 마우스 PDPN (8.1.1) 1: 100와 반대로 마우스 cytokeratin 7 1: 200을 사용 하 여 스테인드 조직 차단 되었습니다. 반대로 햄스터 IgG AF647와 반대로 토끼 IgG-PE 2 차 항 체로 사용 되었다. 조직은 DAPI와 counterstained 그리고 몇 군데. 눈금 막대 = 100 µ m. 림프 배 (LV), 혈관 (BV), 그리고 담 즙 덕트 (BD)로 표시 됩니다. (C)이이 패널 표시 로그 배 LECs 원시 셀 또는 기본 murine 림프절 LECs에 비해 프로토콜 (CD45, CD31 +, CD146lo/neg및 PDPN +)에서 얼룩에 따라 정렬 된 간 Vegfr3 와 prox-1 식에서 변경 합니다. 정렬된 셀 biopolymer 분쇄 열 통과 했다, RNA는 RNA 추출 키트를 사용 하 여 추출 된와 cDNA 역방향 전송 키트를 사용 하 여 만들어졌다. 대 본 풍부한 모든 샘플에 대 한 내부 관리 유전자, Gapdh, 정규화 되었다. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
토론
빛25LECs의 전반적인 중요성 면역 항상성 그리고 규칙에 최근에 왔다. 게시 된 림프 문학의 많은 피부와 림프절;에 초점을 맞추고합니다 그러나, lymphatics26 신체 걸쳐 발견 되 고, 따라서, 다른 기관에 그들의 중요성의 우리의 이해는 필요 하다. 여기 우리가 다른 표면 마커, cytokines, 발산, 및 녹음 방송 요인 등 세포내 단백질의 그들의 동시 표현 이해 하기 셀에 의해 셀 기준 LECs에에서 공부 될 수 있다 메서드를 보여줍니다. 이 메서드는 미래 연구 건강 및 질병 표현 형 및 간에서 LECs의 기능 평가를 위해 유용할 것 이다.
간에서 LECs의 식별에 대 한 장애물 중 하나는 다른 세포 유형에 비해 상대적으로 낮은 주파수 이다. Hepatocytes 간, 그리고 제거 전에 실행 간 교류 cytometer에 적은 시간을 요구 하 고, 따라서, 더 나은 생존 능력을 제공 합니다 밀도 그라데이션 (iodixanol)를 사용 하 여 이러한 셀의 약 80%를 차지 한다. LYVE1 + LSECs에서 간에서 LYVE1 + LECs의 인구를 구별 하기 위해 우리는 마커 CD16/32 및 CD146 LSECs와 식이 없는 낮은 LECs 발견 사용. 이, 부족 또는 낮은 표현의 다른 내 피 세포 간, cytometry 식별 인구 LECs 했다 하 여 유효성 검사를 허용에 의해 PDPN와 결합. 실제로, 다운스트림 transcriptional 분석 확인이 제어 전략 LECs (그림 3C) 생산.
림프 노드에서 LECs의 절연은 최고의 콜라 내가-II-및-dispase;를 사용 하 여 완료 그러나, 우리는,이 방법은 간에서 LECs를 추출지 않습니다, 하는 동안 콜라 IV를 사용 하 여 간 소화 프로토콜 cytometry 사용 하는 더 나은 다운스트림 분석 제공 발견. 더 많은 노출 영역 더 나은 LECs, 같은 세포 외 매트릭스 관련 세포와 상호 작용 하는 콜라 수 간의 기계적 장애를 사용 하 여 하며 FBS 없이 클릭의 EHAA 미디어를 사용 하 여 간의 소화에 대 일 분만에 발생 하 이 감소 시간 LEC cytometry 또는 흐름 정렬 같은 다운스트림 분석 실험에 대 한 생존 능력을 유지합니다. 실제로, LECs cytometry 및 다운스트림 transcriptional 분석에 대 한 정렬 흐름 시각화를 충분히 가능한 셀을 복구할 수 있었습니다.
결합, 비 parenchymal 세포, 콜라 종류 IV의 사용 및 설명에서 hepatocytes의 분리 및 간에서 LECs에 마커 및 마커 CD16/32 같은 다른 내 피 세포 인구를 특정 하 고 CD146, 간에서 LECs의 적절 한 식별을 수 있습니다. 이러한 방법을 어떻게 간에서 LECs 확인 될 수 있다 cytometry, 여 간 림프절 (prox1 및 에서에서 LECs에 고유한 것으로 알려진 마커를 표현 하는 다른 셀의 수를 포함 하는 때문에 특히에 대 한 문학에서 중요 한 공백을 채울합니다 vegfr3). 따라서, 이러한 방법 간 LEC 기능에 대 한 다운스트림 연구 이어질 것입니다. 또한,이 방법은 더 나은 조직-LEC 마커 및 하위 집합을 평가 하기 위해 다른 조직에 대 한 수정할 수 있습니다.
공개
저자는 공개 없다.
감사의 말
저자 기 및 간 타고 난 면역 프로그램이이 프로젝트의 통화 지원에 감사 하 고 싶습니다. B.A.J.T.는 또한 R01 AI121209에 의해 자금을.
자료
| Name | Company | Catalog Number | Comments |
| Clicks/EHAA media | Irvine Scientific | 9195 | |
| Collagenase IV | Worthington Biochemical corporation | LS004188 | |
| DNase I | Worthington Biochemical corporation | LS002145 | Deoxyribonuclease 1 |
| OptiPrep | Sigma Aldrich | D1556 | Density Gradient Medium |
| V450 anti mouse CD146(clone ME-9F1 | BD biosciences | 562232 | |
| FITC anti mouse CD146 (clone ME-9F1 | Biolegend | 134706 | Fluorescein isothiocyanate (FITC) |
| Pacific Blue anti mouse CD31(clone 390) | Biolegend | 102422 | |
| PerCp/Cy5.5 anti mouse CD31( clone 390) | Biolegend | 102420 | Peridinin-chlorophyll proteins-Cyanine 5.5 (PerCP-Cy5.5) |
| APC anti mouse PDPN (clone 8.1.1) | Biolegend | 127410 | Allophycocyanin (APC), podoplanin (PDPN) |
| APC/Cy7 anti mouse CD45 (clone 30-F11) | Biolegend | 103116 | |
| Brilliant Violet 510 anti mouse CD45 (clone 30-F11 | Biolegend | 103138 | |
| FITC anti mouse CD16/32 (clone 93) | Biolegend | 101306 | Fluorescein isothiocyanate (FITC) |
| PerCp/Cy5.5 anti mouse CD16/32( clone 93) | Biolegend | 101324 | Peridinin-chlorophyll proteins-Cyanine 5.5 (PerCP-Cy5.5) |
| ghost red 780 viability dye | TONBO biosceinces | 3-0865-T100 | |
| APC syrian hamster IgG (clone SHG-1) | Biolegened | 402102 | |
| PerCp/Cy5.5 rat IgG2a (clone RTK2758) | Biolegend | 400531 | |
| FITC rat IgG2 (clone eBR2a) | ebioscience | 1-4321-80 | |
| Anti mouse LYVE1 (clone 223322) | R&D systems | FAB2125A | |
| anti-mouse Cytokeratin(clone EPR17078) | abcam | ab181598 | |
| anti-mouse F4/80 (clone Cl:A3-1) | Bio-rad | MCA497 | |
| BSA (fraction V) | Fischer | BP1600-100 | Bovine Serum Albumin (BSA) |
| Goat serum | Jackson Immunoresearch | 017-000-121 | |
| Donkey Serum | Jackson Immunoresearch | 017-000-121 | |
| EDTA | VWR | E177 | Ethylenediaminetetraacetic acid (EDTA) -for RBC lysis buffer |
| Ammonium Chloride | Fischer | A687-500 | for RBC Lysis buffer |
| Potassium Bicarbonate | Fischer | P184-500 | for RBC Lysis buffer |
| Scalpel | Feather | 2975#21 | |
| 100um cell strainer | Fischer | 22363549 | |
| 2.4G2 | in house/ATCC | ATCC HB-197 | FC block to inhibit non-specific binding to Fc gamma + cells -made from hybridoma |
| Phosphate Buffered Saline (PBS) | Corning | 21-040-CV | |
| Hanks Balanced Salt Solution (HBSS) | Gibco | 14185-052 | |
| Fetal Bovine Serum (FBS) | Atlanta biologicals | S11550 | |
| 96 well plate | Corning | 3788 | |
| 6 well plate | Corning | 3506 | |
| 50 ml conical | Truline | TR2004 | |
| 15 ml conical | Falcon | 352196 | |
| 1 ml Pipete tip | USA scientific | 1111-2721 | |
| 200 µl pipete tip | USA scientific | 1110-1700 | |
| 10 µl pipete tip | USA scientific | 1111-3700 | |
| seriological 10ml pipete | greiner bio-one | 607107 | |
| seriological 5ml pipete | greiner bio-one | 606107 | |
| Cell incubator | Fischer | Heracell 160i | |
| BD FacsCanto II flow cytometer | BD biosciences | ||
| Clinical Centrifuge | Beckman coulter | model X-14R |
참고문헌
- Tanaka, M., Iwakiri, Y. Lymphatics in the liver. Current Opinion in Immunology. 53, 137-142 (2018).
- Vollmar, B., Wolf, B., Siegmund, S., Katsen, A. D., Menger, M. D. Lymph vessel expansion and function in the development of hepatic fibrosis and cirrhosis. The American Journal of Pathology. 151 (1), 169-175 (1997).
- Podgrabinska, S., et al. Molecular characterization of lymphatic endothelial cells. Proceedings of the National Academy of Sciences of the United States of America. 99 (25), 16069-16074 (2002).
- Cohen, J. N., et al. Lymph node-resident lymphatic endothelial cells mediate peripheral tolerance via Aire-independent direct antigen presentation. Journal of Experimental Medicine. 207 (4), 681-688 (2010).
- Cohen, J. N., et al. Tolerogenic properties of lymphatic endothelial cells are controlled by the lymph node microenvironment. PLoS One. 9 (2), e87740 (2014).
- Rouhani, S. J., et al. Roles of lymphatic endothelial cells expressing peripheral tissue antigens in CD4 T-cell tolerance induction. Nature Communications. 6, 6771 (2015).
- Tewalt, E. F., et al. Lymphatic endothelial cells induce tolerance via PD-L1 and lack of costimulation leading to high-level PD-1 expression on CD8 T cells. Blood. 120 (24), 4772-4782 (2012).
- Dubrot, J., et al. Lymph node stromal cells acquire peptide-MHCII complexes from dendritic cells and induce antigen-specific CD4(+) T cell tolerance. Journal of Experimental Medicine. 211 (6), 1153-1166 (2014).
- Hirosue, S., et al. Steady-state antigen scavenging, cross-presentation, and CD8+ T cell priming: a new role for lymphatic endothelial cells. Journal of Immunology. 192 (11), 5002-5011 (2014).
- Lund, A. W., et al. VEGF-C promotes immune tolerance in B16 melanomas and cross-presentation of tumor antigen by lymph node lymphatics. Cell Reports. 1 (3), 191-199 (2012).
- Lund, A. W., et al. Lymphatic vessels regulate immune microenvironments in human and murine melanoma. Journal of Clinical Investigation. 126 (9), 3389-3402 (2016).
- Swartz, M. A. Immunomodulatory roles of lymphatic vessels in cancer progression. Cancer Immunology Research. 2 (8), 701-707 (2014).
- Dietrich, T., et al. Cutting edge: lymphatic vessels, not blood vessels, primarily mediate immune rejections after transplantation. Journal of Immunology. 184 (2), 535-539 (2010).
- Kedl, R., et al. Migratory Dendritic Cells acquire archived antigen from Lymphatic Endothelial Cells for antigen presentation during lymph node contraction. Nature Communications. 8, 2034 (2017).
- Kedl, R. M., Tamburini, B. A. Antigen archiving by lymph node stroma: A novel function for the lymphatic endothelium. European Journal of Immunology. 45 (10), 2721-2729 (2015).
- Tamburini, B. A., Burchill, M. A., Kedl, R. M. Antigen capture and archiving by lymphatic endothelial cells following vaccination or viral infection. Nature Communications. 5, 3989 (2014).
- Yokomori, H., et al. Lymphatic marker podoplanin/D2-40 in human advanced cirrhotic liver--re-evaluations of microlymphatic abnormalities. BMC Gastroenterology. 10, 131 (2010).
- Nonaka, H., Tanaka, M., Suzuki, K., Miyajima, A. Development of murine hepatic sinusoidal endothelial cells characterized by the expression of hyaluronan receptors. Developmental Dynamics. 236 (8), 2258-2267 (2007).
- Dudas, J., et al. Prospero-related homeobox 1 (Prox1) is a stable hepatocyte marker during liver development, injury and regeneration, and is absent from "oval cells". Histochemistry and Cell Biology. 126 (5), 549-562 (2006).
- Schrage, A., et al. Murine CD146 is widely expressed on endothelial cells and is recognized by the monoclonal antibody ME-9F1. Histochemistry and Cell Biology. 129 (4), 441-451 (2008).
- Amatschek, S., et al. Blood and lymphatic endothelial cell-specific differentiation programs are stringently controlled by the tissue environment. Blood. 109 (11), 4777-4785 (2007).
- Huang, L., Soldevila, G., Leeker, M., Flavell, R., Crispe, I. N. The liver eliminates T cells undergoing antigen-triggered apoptosis in vivo. Immunity. 1 (9), 741-749 (1994).
- Shay, T., Kang, J. Immunological Genome Project and systems immunology. Trends in Immunology. 34 (12), 602-609 (2013).
- Li, B., et al. Adult Mouse Liver Contains Two Distinct Populations of Cholangiocytes. Stem Cell Reports. 9 (2), 478-489 (2017).
- Randolph, G. J., Ivanov, S., Zinselmeyer, B. H., Scallan, J. P. The Lymphatic System: Integral Roles in Immunity. Annual Review of Immunology. 35, 31-52 (2016).
- Olszewski, W. L. The lymphatic system in body homeostasis: physiological conditions. Lymphatic Research and Biology. 1 (1), 11-21 (2003).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유