Method Article
Digestión del hígado murino para el análisis cytometric del flujo de las células endoteliales linfáticas
En este artículo
Resumen
El objetivo de este protocolo es identificar las poblaciones de células endoteliales linfáticas dentro del hígado usando marcadores descritos. Utilizamos colagenasa IV y DNasa y un picado suave del tejido, combinado con citometría de flujo, para identificar una población diferente de células endoteliales linfáticas.
Resumen
En el hígado, los vasos linfáticos se encuentran dentro de la tríada portal, y su función es eliminar líquido intersticial desde el hígado a los ganglios linfáticos donde detritos celulares y antígenos pueden ser examinados. Estamos muy interesados en la comprensión de cómo puede participar la vasculatura linfática en inflamación y función de las células inmunes en el hígado. Sin embargo, muy poco ha publicado establecer protocolos de digestión para el aislamiento de las células endoteliales linfáticas (LECs) desde el hígado o los marcadores específicos que pueden utilizarse para evaluar hígado LECs de forma por la célula. Por lo tanto, hemos optimizado un método para la digestión y la coloración del hígado con el fin de evaluar la población de la LEC en el hígado. Estamos seguros de que el método descrito aquí será útil para la identificación y aislamiento de LECs de hígado y fortalecerá nuestra comprensión de cómo LECs responden al microambiente hepático.
Introducción
No se comprende bien el papel de los vasos linfáticos y LECs en el hígado. Mientras que los vasos linfáticos se encuentran dentro de la tríada portal del hígado1 y durante la enfermedad2, muy poco se entiende sobre la función y el fenotipo de LECs dentro del hígado. Con el descubrimiento de marcadores que se encuentran principalmente en el LECs3, la importancia de estas células dentro de nichos de diferentes tejidos en homeostasis y enfermedad llenará un vacío importante en nuestro entendimiento. LECs tienen un papel importante en mantener la tolerancia periférica en los ganglios linfáticos y en los tumores metastáticos interactuando directamente con T las células4,5,6,7,8, 9 , 10 , 11 , 12 , 13. LECs en los ganglios linfáticos pueden promover inmunidad protectora a través de sus interacciones con las células dendríticas migratorias14,15,16. Por lo tanto, hay múltiples funciones de LECs que pueden ser específicos de los tejidos y las interacciones en que están presentes. Sin embargo, muy poco se entiende sobre cómo interactúan con las células inmunes en el tejido los LECs o funcionan de LECs en diferentes órganos; por lo tanto, evaluar LECs en una base por células en el hígado u otros órganos puede conducir a avances en cómo LECs programa inmunidad específica de tejido. Mientras que mucha de la literatura que se centra en el LECs en el hígado utiliza la microscopia visualizar LECs con uno o dos marcadores y morfología17, muy poco se ha hecho para evaluar específicamente LECs en una base de la célula por célula mediante citometría de flujo, aunque un estudio evaluar las diferencias entre las células endoteliales sinusoidales hepáticas (LSECs) y LECs18. Poder analizar las poblaciones de la LEC en el hígado mediante citometría de flujo permite el estudio en profundidad del fenotipo de la LEC durante la homeostasis normal o enfermedad.
Para evaluar el LECs por citometría de flujo, se necesitan múltiples marcadores de superficie. Por lo general, LECs son visualizados por la expresión de homeobox relacionado con prospero 1 (Prox 1), receptor del recipiente linfático hyaluronan endotelial 1 (LYVE1) o factor de crecimiento endotelial vascular del receptor 3 (VEGFR3) mediante microscopía. Sin embargo, en el hígado, la expresión de estos marcadores no se limita a LECs. Prox-1 se expresa ampliamente por los hepatocitos durante el desarrollo del hígado, regeneración y lesiones19, y LYVE1 y VEGFR3 son expresados por las células endoteliales sinusoidales del hígado18. En los ganglios linfáticos, el LECs se identifican mediante citometría de flujo como racimos de diferenciación (CD) CD45 - CD31 + y podoplanin + (PDPN)16. Sin embargo, este enfoque es también mínimo para aislar LECs en el hígado, ya que las células CD45 - CD31 + capturará las células endoteliales, y la población predominante de las células endoteliales vasculares en el hígado es LSECs. Así, se necesitan otros marcadores para distinguir la rara población de LEC de la abundante población de LSEC. CD16/32 (expresado por maduros LSECs18) y CD146 (un célula endotelial vascular marcador común que es predominantemente expresada dentro de los sinusoides del hígado por las células endoteliales sinusoidales del hígado20 con poca o ninguna expresión por linfático las células endoteliales21) fueron marcadores de candidato.
Por lo tanto, hemos optimizado un método para aislar y visualizar LECs en el hígado utilizando los anteriores marcadores, CD45, CD31, CD146, CD16/32 y PDPN para citometría de flujo. Describimos el uso de colagenasa IV, DNasa 1 y separación mecánica para la digestión del tejido del hígado en una suspensión unicelular. También describimos el uso de iodixanol gradiente de densidad para el aislamiento de células no parenquimatosas (NPC) y para eliminar desechos celulares. Por último, uso de marcadores múltiples, determinar la estrategia bloquea de citometría de flujo óptimo para identificar LECs del hígado con PDPN como el marcador predominante.
Protocolo
Todos los métodos aquí descritos han sido aprobados por el cuidado institucional del Animal y el Comité uso (IACUC) del Universidad de Colorado Anschutz Medical Campus.
1. preparación de los materiales
- Hacer una solución de 5 mg/mL de DNasa I en tampón fosfato salino (PBS).
- Hacer una mezcla de digestión mediante la adición de 5.000 U/mL de colagenasa IV a los medios de comunicación EHAA haga clic en el.
- Caliente la mezcla de digestión a 37 ° C por 30 min antes de usar.
- Hacer un buffer de aislamiento añadiendo 4.8% albúmina de suero bovino (BSA) y 2 mM dihidratada del ácido (EDTA) a Hanks equilibrada solución de sal (HBSS).
- Hacer un buffer de lisis de glóbulos rojos (gr) mediante la adición de cloruro de amonio 100 mM, 10 mM KHCO3y 0.1 mM EDTA al agua destilada H2O.
2. preparación de una suspensión unicelular de un hígado de ratón
- Eutanasia el ratón con CO2 y la dislocación cervical.
- Aerosol hacia abajo el ratón con etanol al 70% para humedecer su piel. Pin el ratón patas para una mesa de disección.
- Con unas tijeras de disección para cortar la piel 1 cm arriba del ano, teniendo cuidado de cortar sólo a través de la piel (aproximadamente 1 mm). Tire de la piel del cuerpo con pinzas dentadas e inserte las tijeras entre la piel y el peritoneo. Abrir las tijeras para separar la piel del peritoneo y, luego, cortar la piel de la incisión en el cuello.
- Perno de la piel a la Junta de disección utilizando un perno debajo de cada brazo y encima de cada pata. Levante el saco peritoneal y corte hacia arriba hacia el cuello. Los lóbulos del hígado del gancho agarrador y corte justo debajo del esternón.
Nota: Debe tenerse cuidado si alguno del hígado se utiliza para inmunohistoquímica (IHQ). - Cortar alrededor del hígado y retire el hígado del ratón y colocarlo en 4 mL de medio de EHAA haga clic en el.
- Con un bisturí, cortar el hígado en ~ 1 mm de diámetro.
- Añadir 500 μl de la mezcla de digestión y 500 μl de la DNasa I (2 mg/mL) para el hígado.
- Incubar el hígado durante 30 min a 37 ° C. Después de 15 minutos, mezcle el líquido con una pipeta de 5 mL.
- Después de 30 min de incubación, transferir la muestra digerida a través de un tamiz de 100 μm a un tubo cónico de 50 mL.
- Empuje suavemente las piezas restantes a través del filtro con el émbolo de una jeringa de 1 mL.
- Lavar el filtro con 5 mL de tampón de aislamiento y empuje suavemente el tejido a través de la coladera con la parte posterior de un émbolo de una jeringa de 1 mL. Repetir este proceso hasta que el filtro se lava con 25 mL de tampón de aislamiento.
- Centrifugar las células a 400 x g por 5 min aspirar cuidadosamente apagado el sobrenadante.
- Resuspender el precipitado con 4 mL de tampón de lisis RBC. Incube las células a temperatura ambiente durante 5 minutos.
- Lavar las células con 10 mL de tampón de aislamiento y centrifugar a 400 x g durante 5 minutos.
- Contar las células en un hemocitómetro para determinar el recuento completo de hígado.
- Resuspender las células en 5 mL de 20% iodixanol y capa con 1 mL de PBS.
- Centrifugar las células a 300 x g durante 15 min sin freno.
- Sacar la capa entre el PBS y el iodixanol y, a través de un filtro de 100 μm, en un nuevo tubo cónico de 50 mL.
- Lavar las células con 10 mL de tampón de aislamiento y centrifugar a 400 x g durante 5 minutos.
- Desechar el sobrenadante y resuspender las células en 500 μl de PBS con 2% de suero bovino fetal (FBS).
3. flujo cytometric del análisis de las células del hígado
- Contar las células usando un hemocitómetro y microscopio, mediante exclusión del azul tripán para medir células viables. Añadir 10 μl de las células a 10 μl de azul tripán y colóquelos inmediatamente en un hemocitómetro y contar las células vivas (no azules) bajo un microscopio. Luego, calcular el número de células por microlitro.
- Alícuota aproximadamente 5 millones de las restantes células de nonparenchymal en un único pozo de una placa de 96 pocillos.
- Centrifugar las células a 400 x g durante 5 minutos.
- Deseche el sobrenadante y resuspender las células en 90 μl de PBS con 2% FBS.
- Añadir anti-CD45 (1: 200), anti-CD146 (1: 200), anti-CD31 (1: 200) y PDPN (1: 200) diluido en 10 μl de 10 x 2.4G2 o anti-CD16/32 (1: 200).
Nota: Ningún bloque Fc (2.4G2) fue utilizado cuando se utilizó el anticuerpo anti-CD16/32-labeled. - Para determinar donde se deben establecer puertas positivas y negativas, incluyen una fluorescencia menos una mancha (FMO) para cada color y un anticuerpo control de isotipo.
- Para determinar en comparación con las células muertas, manchas con un marcador de viabilidad (p. ej., fantasma rojo 780). Incube las células a 4 ° C durante 30 minutos.
- Lavar las células con 100 μl de PBS con 2% FBS.
- Utilice una pequeña alícuota de células para ajustar los parámetros del láser y la compensación en el citómetro de flujo. Se tiñen las células con un anticuerpo para cada fluoróforo individual y sin ningún anticuerpo.
Nota: Según el citómetro de flujo se utiliza, debe establecerse una matriz de compensación para eliminar el solapamiento espectral. - Coloque el tubo de muestra en la sonda de citómetro y recoger y registrar todos los eventos.
4. Análisis de datos
- Mirando de lado-dispersión vs transhorizonte área, puerta en "vivas" células basado en tamaño y granularidad y viabilidad marcador tinte.
- A continuación, utilizando CD45 brillante violeta 510 y CD31 PerCp Cy5.5, puerta de las células CD45 - CD31 + usando los controles de isotipo y FMO para determinar poblaciones positivas y negativas.
- Por último, utilizando CD146 v450 o CD16/32 FITC y PDPN APC, tomar las CD146 - PDPN + y CD16/32-PDPN + células, otra vez usando los controles de isotipo y FMO, para determinar las poblaciones positivas y negativas. Estas células son el LECs.
Resultados
Estudios análisis de hígado linfáticos han utilizado principalmente inmunohistoquímica para cuantificar la frecuencia y el diámetro de los vasos linfáticos en el hígado. Sin embargo, este método no permite para la evaluación de LECs en forma de celda por celda o para la expresión de múltiples marcadores de citoquinas, quimioquinas y factores de transcripción. Por lo tanto, preguntamos si hígado LECs puede ser aislados del hígado y evaluado mediante citometría de flujo. Trabajo previo aislamiento de LECs de nodo de linfa fue realizado usando somatométrica DL (colagenasa i-II-y-dispase) y DNasa 1 combinado con la separación mecánica del tejido del nodo de linfa con agujas14,16. Por lo tanto, se utilizó el mismo protocolo de digestión de tejido del hígado, o la colagenasa IV y DNasa 1 fue utilizado como descrito previamente, para el aislamiento de células inmunitarias del hígado22 y seguido la digestión con un paso de densidad gradiente de separación (iodixanol) para Quite de hepatocitos y aumentar la frecuencia de otros tipos de células dentro del hígado (figura 1A). Tras digestión hígada y centrifugación con el gradiente de densidad, las células se tiñeron con CD45, CD31, PDPN y CD16/32. CD16/32 se ha descrito para ser expresado por las poblaciones de LSEC maduritas, pero no LEC las poblaciones18. Así, fueron bloqueados LECs como CD45-, CD31 +, CD16/32-, PDPN + de las células, mientras que LSECs fueron bloqueados como CD45-, CD31 +, CD16 / 32 + y PDPN-(figura 1A). Puertas en células vivas (negativo de fantasma rojo) y basadas en los controles de isotipo y FMO tinción (figura 1A). LYVE 1 APC sobre la población de la LEC fue también confirmada (figura 1B). Ambos métodos permiten la visualización de la población de la LEC en el hígado; sin embargo, el perfil de tinción de las células fue visualmente mejor cuando se utiliza la colagenasa IV y DNasa 1 de colagenasa-II-y-dispase (figura 1). Por lo tanto, todas las manipulaciones futuras se realizaron mediante colagenasa IV y DNasa 1, como se describe en el protocolo. En promedio, se obtuvieron aproximadamente 1.300 LECs por gramo de tejido hepático o 2.200 LECs por hígado de ingenuo, este método de la digestión.
Para optimizar la combinación de fluoróforos y estrategia bloquea y para eliminar la contaminación de LSECs, CD16/32 y CD146 fueron utilizados. CD16/32 es Fc gamma receptores II y III y se expresa en LSECs maduros pero no en el LECs18. CD16/32 podría distinguir las PDPN + CD16/32-células de la PDPN-CD16 / 32 + células, sobre todo cuando uso PDPN conjugado con APC o PE y CD16/32 conjugado a FITC (figura 1A), pero menos bien cuando PDPN fue conjugado con PE-Cy7 (figura 1). La expresión de CD16/32 no se encuentra en el LECs pero se encuentra en LSECs. Bloque FC utiliza el anticuerpo CD16/32 para minimizar el atascamiento del receptor de Fc y unión específica nonantigen de las inmunoglobulinas a los receptores de Fc. Desde CD16/32 fue utilizado para visualizar LSECs, el atascamiento no específico de inmunoglobulinas fue mayor y CD146 fue optimizada como una alternativa para medir LSECs. Por lo tanto, hemos probado CD146 conjugado V450, un marcador de células endoteliales vasculares altamente expresado por LSECs y otros de las células endoteliales vasculares20 pero con poco a ninguna expresión por LECs23. Primero hemos optimizado tinción de CD146 utilizando controles de FMO e isotipo para CD16/32 y CD146 (figura 2A). Si evaluamos sólo el CD16 / 32 + células o el CD16/32 células, el CD16 / 32 + células eran todos CD146 + y PDPN - mientras que las células CD16/32 eran principalmente CD146 - y PDPN - o PDPN + (figura 2B). Para confirmar esta coloración, FMO fue utilizado. Mediante la eliminación de PDPN de la mancha, la población PDPN + desaparecieron (figura 2). Curiosamente, no había CD146 + PDPN + células, confirmando que CD146 no es o muy humilde expresada por PDPN + LECs. Por lo tanto, estamos seguros de que cualquiera de estos marcadores puede ser utilizada para puerta hacia fuera de las células endoteliales vasculares en el hígado.
Para validar aún más que el PDPN es un marcador adecuado de LECs, secciones de hígado de los ratones fueron teñidas con PDPN (verde) y F4/80 (marrón) (Figura 3A). El endotelio vascular ni macrófagos expresan PDPN en el hígado murino. También hemos podido distinguir cholangiocytes, que puede tinción positiva para PDPN, de los vasos linfáticos, basado en las distintas estructuras nucleares de los conductos biliares y por la coloración de la citoqueratina 7 (figura 3B; rojo: citoqueratina 7, verde: PDPN). Puesto que la múltiples marcadores se utilizan para citometría de flujo, como el CD31, que no se expresa por cholangiocytes24, estamos seguros de que estamos eliminando estas células a partir del análisis, confirmando de tal modo que las células del hígado que son CD146 CD45-, CD31 +, lo/neg, CD16/32-, y PDPN + LECs. Por último, para proporcionar evidencia de que las células son LECs, había ordenada de esta población de células y utiliza la reacción en cadena de la polimerasa en tiempo real cualitativo para evaluar las expresiones Vegfr3 y prox-1 . Vegfr3 y prox-1 fueron evaluados, estas transcripciones son expresadas por otras células en el hígado —prox1 por hepatocitos y Vegfr3 por LSECS (entre otros), pero no otras células además de LECs expresan ambos. La expresión de estos marcadores de ambos fue significativamente mayor en la población ordenada que en la línea celular de macrófagos murinos cultivadas (264.7) que normalmente no expresan estos marcadores es similar en la expresión cultivos LECs murinos (figura 3 ).
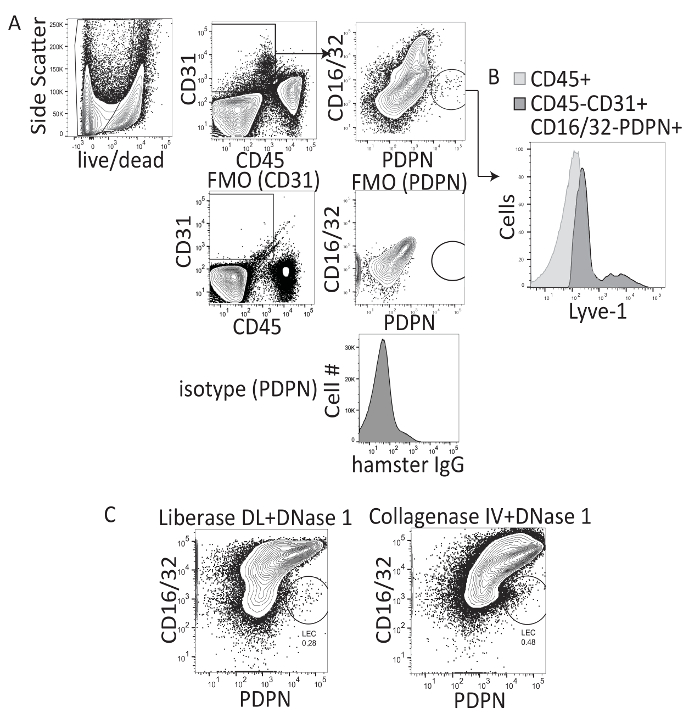
Figura 1 : Análisis de citometría de flujo representativo de colagenasa I-II-dispase y colagenasa IV-digerido murino tejido del hígado. (A) este panel muestra la estrategia bloquea, fluorescencia menos una coloración, y controles de isotipo para el procedimiento. (B) este panel muestra la tinción 1 LYVE de CD16/32-PDPN + células. (C) este panel muestra la puerta de la citometría de flujo final después de digerir los hígados de ratón con cualquiera colagenasa-II-dispase (p. ej., somatométrica DL) o la colagenasa IV y evaluación CD16/32 PerCP X PDPN PE-Cy7 donde LECs son CD16/32- y PDPN +. Haga clic aquí para ver una versión más grande de esta figura.
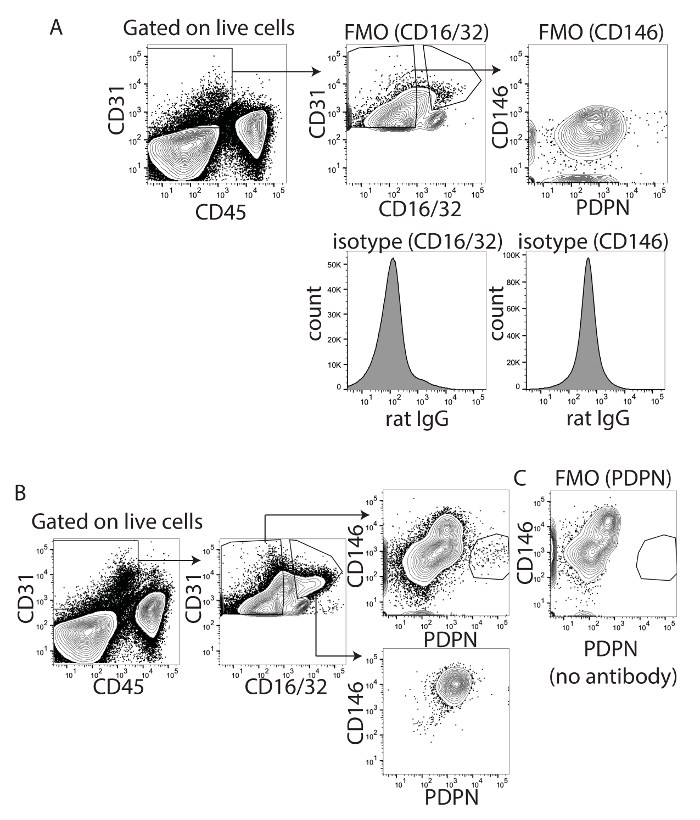
Figura 2 : Identificación de CD146 y PDPN como marcadores apropiados para células endoteliales del hígado linfáticos. (A) este panel muestra fluorescencia menos uno e isotipo controles para CD16/32 (izquierda) y CD146 (derecha). (B) este panel muestra cerrada CD16/32 positivas o negativas células determinadas desde el panel A. Es CD146XPDPN de ambas poblaciones. (C) este panel muestra fluorescencia menos uno para PDPN demostrar que la tinción es ausente cuando no se agrega el anticuerpo. Haga clic aquí para ver una versión más grande de esta figura.
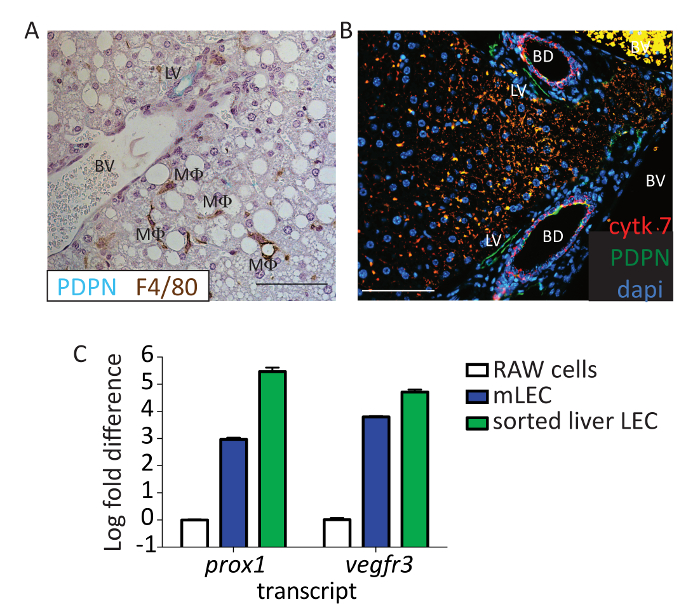
Figura 3 : Identificación del flujo PDPN + células endoteliales como linfático. Hígado (A) este panel muestra inmunohistoquímica representativas de un ratón teñida con PDPN (verde) y F4/80 (marrón). Están marcados los vasos linfáticos (LV), vaso sanguíneo (BV) y macrófagos (MF). Barra de escala = 100 μm. tejido parafina-encajado formalina-fijo fue desparafinarse por 20 min en xileno. Los tejidos fueron hidratados al agua a través de un gradiente de etanol, y recuperación del antígeno se realizó con tampón de recuperación de antígeno pH 6 en una olla a presión por 15 minutos tejido fue bloqueado con 0.1% de BSA y teñido usando ratón anti PDPN y anti-ratón F4/80 por 1 h en la sala de temperatura. Anti-hamster IgG HRP y anti-conejo IgG HRP fueron utilizados como anticuerpos secundarios. 3, 3'-diaminobenzidina (DAB) + y Viña verde fueron utilizados para detectar la F4/80 y PDPN, respectivamente. Tejido era contratinción con hematoxilina y reflejado en un microscopio. (B) este panel muestra el mismo experimento realizado en panel , excepto aquí, PDPN se muestra en verde, citoqueratina 7 en rojo y 4′, 6-diamidino-2-phenylindole (DAPI) en azul. Barra de escala = 100 μm. tejido fue bloqueado con burro de 5% y 5% de suero de cabra y teñidas con anti-mouse PDPN (8.1.1) 1: 100 y anti-ratón citoqueratina 7 1: 200 por 1 h a temperatura ambiente. Anti-hamster AF647 IgG y anti-rabbit IgG-PE fueron utilizados como anticuerpos secundarios. Tejido era contratinción con DAPI y reflejado. Barra de escala = 100 μm. Los vasos linfáticos (LV), vaso sanguíneo (BV) y biliar (BD) se etiquetan. (C) este panel muestra un pliegue de registro cambio de expresión Vegfr3 y prox-1 clasificado hígado LECs basados en la tinción en el protocolo (CD45-, CD31 +, CD146lo/negy PDPN +) en comparación con las células RAW o murino primario del nodo de linfa LECs. Células clasificadas pasaron a través de una columna de trituración de biopolímero se extrajo RNA usando un kit de extracción de RNA y cDNA fue realizado utilizando un kit de transcripción inversa. Abundancia de la transcripción se normalizó al gen housekeeping, Gapdh, de cada muestra. Haga clic aquí para ver una versión más grande de esta figura.
Discusión
La importancia de LECs en homeostasis inmune y regulación ha llegado recientemente a luz25. Gran parte de la bibliografía linfática se centra en piel y ganglios linfáticos; sin embargo, linfáticos se encuentran en todo el cuerpo26 y, por lo tanto, es necesaria la comprensión de su importancia en diversos órganos. A continuación os mostramos un método en el que se pueden estudiar LECs en el hígado en forma de célula por célula para comprender mejor su expresión concurrente de diferentes marcadores de superficie, citoquinas, quimiocinas y proteínas intracelulares como factores de transcripción. Este método será útil para futuros estudios evaluar el fenotipo y la función de LECs en el hígado durante la salud y la enfermedad.
Uno de los obstáculos para la identificación de LECs en el hígado es su frecuencia relativamente baja en comparación con otros tipos de células. Hepatocitos constituyen alrededor del 80% del hígado y la eliminación de estas células mediante gradiente de densidad (iodixanol) antes de ejecutar el hígado en un citómetro de flujo requiere menos tiempo y, así, proporciona mejor viabilidad. Para distinguir la población de LYVE1 + LECs en hígado de LYVE1 + LSECs, se utilizaron los marcadores CD16/32 y CD146 encontrado en LSECs y con baja o ninguna expresión por LECs. Esto, sumado a la falta o baja expresión de PDPN por cualquier otra célula endotelial en el hígado, permite la validación por citometría de flujo que la población se identificaron fueron LECs. De hecho, posteriores análisis transcripcional confirmó que esta estrategia bloquea había producido LECs (figura 3).
El aislamiento de LECs desde el nodo de linfa es mejor hacer uso de colagenasa-II-y-dispase; sin embargo, encontramos que, si bien este método extraer LECs de hígado, un protocolo de hígado digestión con colagenasa IV proporciona un mejor análisis aguas abajo mediante citometría de flujo. El uso de una interrupción mecánica del hígado permite la colagenasa más superficie interactuar mejor con las células asociada a la matriz extracelulares, como LECs, y medios de clics EHAA sin FBS permite la digestión del hígado ocurren en sólo 30 minutos. Esta vez disminuida mantiene viabilidad LEC para ensayos posteriores como citometría de flujo o flujo clasificación. De hecho, hemos sido capaces de recuperar suficientes células viables para visualizar LECs por citometría de flujo y flujo de clasificación para el análisis transcripcional aguas abajo.
Combinado, la separación de los hepatocitos de las células no parenquimatosas, el uso de colagenasa tipo IV y de la aclaración y demostración de marcadores específicos de LECs en el hígado y marcadores específicos de otras poblaciones de células endoteliales, como CD16/32 y CD146, permite la correcta identificación de LECs en el hígado. Estos métodos de llenan un vacío importante en la literatura sobre cómo LECs en el hígado pueden ser identificados por citometría de flujo, especialmente puesto que el hígado contiene un número de otras células que expresan marcadores conocidos por ser exclusivo de LECs en el nodo de linfa (prox1 y VEGFR3). Por lo tanto, estos métodos dará lugar a posteriores estudios sobre función hepática de la LEC. Además, este método puede modificarse para otros tejidos con el fin de evaluar marcadores LEC y subconjuntos específicos de tejido.
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
Los autores desean agradecer a la GI y programas inmune innata de hígado para el apoyo financiero de este proyecto. B.A.J.T. es también financiado por AI121209 R01.
Materiales
| Name | Company | Catalog Number | Comments |
| Clicks/EHAA media | Irvine Scientific | 9195 | |
| Collagenase IV | Worthington Biochemical corporation | LS004188 | |
| DNase I | Worthington Biochemical corporation | LS002145 | Deoxyribonuclease 1 |
| OptiPrep | Sigma Aldrich | D1556 | Density Gradient Medium |
| V450 anti mouse CD146(clone ME-9F1) | BD biosciences | 562232 | |
| FITC anti mouse CD146 (clone ME-9F1) | Biolegend | 134706 | Fluorescein isothiocyanate (FITC) |
| Pacific Blue anti mouse CD31(clone 390) | Biolegend | 102422 | |
| PerCp/Cy5.5 anti mouse CD31(clone 390) | Biolegend | 102420 | Peridinin-chlorophyll proteins-Cyanine 5.5 (PerCP-Cy5.5) |
| APC anti mouse PDPN (clone 8.1.1) | Biolegend | 127410 | Allophycocyanin (APC), podoplanin (PDPN) |
| APC/Cy7 anti mouse CD45 (clone 30-F11) | Biolegend | 103116 | |
| Brilliant Violet 510 anti mouse CD45 (clone 30-F11) | Biolegend | 103138 | |
| FITC anti mouse CD16/32 (clone 93) | Biolegend | 101306 | Fluorescein isothiocyanate (FITC) |
| PerCp/Cy5.5 anti mouse CD16/32(clone 93) | Biolegend | 101324 | Peridinin-chlorophyll proteins-Cyanine 5.5 (PerCP-Cy5.5) |
| ghost red 780 viability dye | TONBO biosceinces | 3-0865-T100 | |
| APC syrian hamster IgG (clone SHG-1) | Biolegened | 402102 | |
| PerCp/Cy5.5 rat IgG2a (clone RTK2758) | Biolegend | 400531 | |
| FITC rat IgG2 (clone eBR2a) | ebioscience | 1-4321-80 | |
| Anti mouse LYVE1 (clone 223322) | R&D systems | FAB2125A | |
| anti-mouse Cytokeratin(clone EPR17078) | abcam | ab181598 | |
| anti-mouse F4/80 (clone Cl:A3-1) | Bio-rad | MCA497 | |
| BSA (fraction V) | Fischer | BP1600-100 | Bovine Serum Albumin (BSA) |
| Goat serum | Jackson Immunoresearch | 017-000-121 | |
| Donkey Serum | Jackson Immunoresearch | 017-000-121 | |
| EDTA | VWR | E177 | Ethylenediaminetetraacetic acid (EDTA) -for RBC lysis buffer |
| Ammonium Chloride | Fischer | A687-500 | for RBC Lysis buffer |
| Potassium Bicarbonate | Fischer | P184-500 | for RBC Lysis buffer |
| Scalpel | Feather | 2975#21 | |
| 100 μm cell strainer | Fischer | 22363549 | |
| 2.4G2 | in house/ATCC | ATCC HB-197 | FC block to inhibit non-specific binding to Fc gamma + cells -made from hybridoma |
| Phosphate Buffered Saline (PBS) | Corning | 21-040-CV | |
| Hanks Balanced Salt Solution (HBSS) | Gibco | 14185-052 | |
| Fetal Bovine Serum (FBS) | Atlanta biologicals | S11550 | |
| 96 well plate | Corning | 3788 | |
| 6 well plate | Corning | 3506 | |
| 50 mL conical | Truline | TR2004 | |
| 15 mL conical | Falcon | 352196 | |
| 1 mL Pipete tip | USA scientific | 1111-2721 | |
| 200 µL pipete tip | USA scientific | 1110-1700 | |
| 10 µL pipete tip | USA scientific | 1111-3700 | |
| seriological 10 mL pipete | greiner bio-one | 607107 | |
| seriological 5 mL pipete | greiner bio-one | 606107 | |
| Cell incubator | Fischer | Heracell 160i | |
| BD FacsCanto II flow cytometer | BD biosciences | ||
| Clinical Centrifuge | Beckman coulter | model X-14R |
Referencias
- Tanaka, M., Iwakiri, Y. Lymphatics in the liver. Current Opinion in Immunology. 53, 137-142 (2018).
- Vollmar, B., Wolf, B., Siegmund, S., Katsen, A. D., Menger, M. D. Lymph vessel expansion and function in the development of hepatic fibrosis and cirrhosis. The American Journal of Pathology. 151 (1), 169-175 (1997).
- Podgrabinska, S., et al. Molecular characterization of lymphatic endothelial cells. Proceedings of the National Academy of Sciences of the United States of America. 99 (25), 16069-16074 (2002).
- Cohen, J. N., et al. Lymph node-resident lymphatic endothelial cells mediate peripheral tolerance via Aire-independent direct antigen presentation. Journal of Experimental Medicine. 207 (4), 681-688 (2010).
- Cohen, J. N., et al. Tolerogenic properties of lymphatic endothelial cells are controlled by the lymph node microenvironment. PLoS One. 9 (2), e87740 (2014).
- Rouhani, S. J., et al. Roles of lymphatic endothelial cells expressing peripheral tissue antigens in CD4 T-cell tolerance induction. Nature Communications. 6, 6771 (2015).
- Tewalt, E. F., et al. Lymphatic endothelial cells induce tolerance via PD-L1 and lack of costimulation leading to high-level PD-1 expression on CD8 T cells. Blood. 120 (24), 4772-4782 (2012).
- Dubrot, J., et al. Lymph node stromal cells acquire peptide-MHCII complexes from dendritic cells and induce antigen-specific CD4(+) T cell tolerance. Journal of Experimental Medicine. 211 (6), 1153-1166 (2014).
- Hirosue, S., et al. Steady-state antigen scavenging, cross-presentation, and CD8+ T cell priming: a new role for lymphatic endothelial cells. Journal of Immunology. 192 (11), 5002-5011 (2014).
- Lund, A. W., et al. VEGF-C promotes immune tolerance in B16 melanomas and cross-presentation of tumor antigen by lymph node lymphatics. Cell Reports. 1 (3), 191-199 (2012).
- Lund, A. W., et al. Lymphatic vessels regulate immune microenvironments in human and murine melanoma. Journal of Clinical Investigation. 126 (9), 3389-3402 (2016).
- Swartz, M. A. Immunomodulatory roles of lymphatic vessels in cancer progression. Cancer Immunology Research. 2 (8), 701-707 (2014).
- Dietrich, T., et al. Cutting edge: lymphatic vessels, not blood vessels, primarily mediate immune rejections after transplantation. Journal of Immunology. 184 (2), 535-539 (2010).
- Kedl, R., et al. Migratory Dendritic Cells acquire archived antigen from Lymphatic Endothelial Cells for antigen presentation during lymph node contraction. Nature Communications. 8, 2034 (2017).
- Kedl, R. M., Tamburini, B. A. Antigen archiving by lymph node stroma: A novel function for the lymphatic endothelium. European Journal of Immunology. 45 (10), 2721-2729 (2015).
- Tamburini, B. A., Burchill, M. A., Kedl, R. M. Antigen capture and archiving by lymphatic endothelial cells following vaccination or viral infection. Nature Communications. 5, 3989 (2014).
- Yokomori, H., et al. Lymphatic marker podoplanin/D2-40 in human advanced cirrhotic liver--re-evaluations of microlymphatic abnormalities. BMC Gastroenterology. 10, 131 (2010).
- Nonaka, H., Tanaka, M., Suzuki, K., Miyajima, A. Development of murine hepatic sinusoidal endothelial cells characterized by the expression of hyaluronan receptors. Developmental Dynamics. 236 (8), 2258-2267 (2007).
- Dudas, J., et al. Prospero-related homeobox 1 (Prox1) is a stable hepatocyte marker during liver development, injury and regeneration, and is absent from "oval cells". Histochemistry and Cell Biology. 126 (5), 549-562 (2006).
- Schrage, A., et al. Murine CD146 is widely expressed on endothelial cells and is recognized by the monoclonal antibody ME-9F1. Histochemistry and Cell Biology. 129 (4), 441-451 (2008).
- Amatschek, S., et al. Blood and lymphatic endothelial cell-specific differentiation programs are stringently controlled by the tissue environment. Blood. 109 (11), 4777-4785 (2007).
- Huang, L., Soldevila, G., Leeker, M., Flavell, R., Crispe, I. N. The liver eliminates T cells undergoing antigen-triggered apoptosis in vivo. Immunity. 1 (9), 741-749 (1994).
- Shay, T., Kang, J. Immunological Genome Project and systems immunology. Trends in Immunology. 34 (12), 602-609 (2013).
- Li, B., et al. Adult Mouse Liver Contains Two Distinct Populations of Cholangiocytes. Stem Cell Reports. 9 (2), 478-489 (2017).
- Randolph, G. J., Ivanov, S., Zinselmeyer, B. H., Scallan, J. P. The Lymphatic System: Integral Roles in Immunity. Annual Review of Immunology. 35, 31-52 (2016).
- Olszewski, W. L. The lymphatic system in body homeostasis: physiological conditions. Lymphatic Research and Biology. 1 (1), 11-21 (2003).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados