Method Article
Цифровой анализ иммуностоинга взаимодействующих белков в тканях легких человека
В этой статье
Резюме
Взаимодействующий белок W10 (ЗВИНТ) участвует в митотической шпиндельной контрольно-пропускной пункт и патогенезе карциномы. Здесь мы вводим методологию иммуностоинга зВИНТ в тканях рака легких человека, а затем цифровое сканирование целых слайдов и анализ изображений. Эта методология может обеспечить высокое качество цифровых изображений и надежные результаты.
Аннотация
Целью данного исследования является внедрение методологии иммуностоинга тканей легких человека, за которой следует цифровое сканирование и анализ изображений. Цифровое сканирование — это быстрый способ сканировать стопку слайдов и создавать цифровые изображения с высоким качеством. Он может производить соответствующие результаты с помощью обычной световой микроскопии (CLM) патологоанатомами. Кроме того, наличие цифровых изображений позволяет позволить одним и тем же слайдам одновременно наблюдаться несколькими людьми. Кроме того, цифровые изображения слайдов могут храниться в базе данных, что означает, что можно избежать длительного износа стеклянных слайдов. Ограничения этого метода таковы. Во-первых, она нуждается в высококачественной подготовленной ткани и оригинальных слайдах иммуногистохимии (IHC) без каких-либо повреждений или избыточного остатка герметика. Во-вторых, опухолевые или неопухолевые области должны быть указаны опытными патологоанатомами перед анализом с помощью программного обеспечения, чтобы избежать путаницы о опухоли или неопухолевых областях во время скоринга. В-третьих, оператор должен контролировать воспроизведение цвета на протяжении всего процесса оцифровки в визуализации с целью сканирования.
Введение
Взаимодействующий белок W10 (ЗВИНТ) является необходимым компонентом кинетохорного комплекса, который участвует в митотической шпиндельной контрольно-пропускной пункте1,2,3. Сообщалось, что истощение ЗВИНТ приводит к аномальной преждевременнойхромосомной сегрегации 1,2,3. Недавние исследования показали, что ЗВИНТ участвует в патогенезе множественных опухолей, способствуя пролиферации опухолевых клеток4,5. Ранее мы сообщали о переэкспрессии зВИНТ при раке легких5. Общепризнано, что анализ слайдов патологоанатомов с использованиемCLM занимает много времени, а не количественный 6,7,8. Кроме того, износ хранимых стеклянных слайдов может сделать невозможным втягивание ранее созданных слайдов. Новый метод компьютерной, цифровой визуализации цельного слайда (WSI) может преодолеть эти ограничения6,7,8.
С этой целью мы описываем методологию иммуностоинга зВИНТ в тканях рака легких человека в сочетании с цифровым сканированием и программным анализом изображений. Основным преимуществом этой методики является производство соответствующих результатов с CLM. Эта технология может быть широко использована в области патологического скоринга гематоксилин-эозина окрашивания (H и E) и IHC, флуоресценция на месте гибридизации (FISH), ткани microarrays (TMA), и открытие и развитие наркотиков.
протокол
Все описанные здесь методы были одобрены Этическим комитетом больницы Чжуннань Уханьского университета и больницей Ренмин Уханьского университета.
1. Подготовка слайдов IHC
- Исправить образец легочной ткани, погрузив фрагмент легочной ткани человека (около 3 х 3 см) в 4% параформальдегида в фосфат-буферированном солей (PBS) в течение 24 ч при комнатной температуре (RT).
- Обезвождение ткани в 80%, 95%, и 100% этанола в течение 15 мин, 20 мин, и 20 мин, соответственно, при комнатной температуре. Наконец, погрузите ткань в 100% ксилена 3x на 20 минут каждый при комнатной температуре.
- Для встраивания погрузите ткань в парафин (63 градуса по Цельсию) в течение 30 мин. Измените парафин и погрузите ткань еще на 45 мин. Наконец, изменить парафин снова и погрузить ткани в него еще на 1 ч.
- Используйте роторный микротом, чтобы разрезать ткань на 5 мкм толщиной разделов и поместить их на 20 мкг /мЛ поли-L-лизин покрытием слайдов.
- Для девокинга поместите горки в духовку 65 градусов по Цельсию в течение 2 ч, а затем погрузите секции в диметилбензен в течение 15 мин, а затем замачивайте 100% ксилена в течение 15 мин.
- Гидрат слайды с тканевой секции 2x на 5 мин в 100% этанола, а затем лечение с последовательно разбавленного этанола 5 мин в 95% этанола, 5 мин в 80% этанола, 5 мин в 70% этанола, и 5 мин в 50% этанола.
- Выполните антигенный ремонт.
- Разбавленная лимонная кислота ремонт жидкости (20x) до 1x с двойной дистиллированной H2O (ddH2O).
- Поместите слайды с секциями тканей и 1x лимонной кислоты ремонт жидкости (300 мл) в антиген ремонт коробки, а затем, тепло их в микроволновой печи при высокой мощности в течение 2 минут, а затем нагрева при низкой мощности для поддержания кипения в течение 6 мин.
- Дайте секциям остыть естественным образом до комнатной температуры.
- Замените лимонную кислотную ремонтную жидкость 0,01 М ПБС, промойте секции 3x, каждый раз в течение 5 мин, в роторный шейкер при комнатной температуре.
- Устраните эндогенную переоксидаза.
- Разбавить 30% H2O2 до 3% с ddH2O, добавить его в слайды (убедитесь, что она охватывает все ткани), и инкубировать слайды во мокром ящике при комнатной температуре в течение 30 минут.
Примечание: Влажная коробка представляет собой пластиковую коробку 10 х 15 см и может содержать воду. - Вымойте слайды 3x, каждый раз в течение 5 минут, с 0,01 М PBS в роторной шейкер при комнатной температуре.
- Разбавить 30% H2O2 до 3% с ddH2O, добавить его в слайды (убедитесь, что она охватывает все ткани), и инкубировать слайды во мокром ящике при комнатной температуре в течение 30 минут.
- Блокируйте неспецифический антиген.
- Разбавить концентрированную нормальную козью сыворотку до 10% козьей сыворотки с PBS с 0,1% Tween 20 (PBST).
- Добавьте 10% козьей сыворотки к горок и инкубировать их в мокрой коробке при 37 градусах по Цельсию в течение 30 минут.
Примечание: Сыворотка козы должна охватывать все ткани в слайдах.
- Попятнайте ткани.
- Инкубировать слайды с кроликом анти-человеческого анти-ЗВИНТ антитела (1:50) на 4 КС в одночасье.
- Вымойте слайды 3x, каждый раз в течение 5 мин, с 0,01 M PBST (1 мл 0,1% Tween 20 в 1000 мл PBS) в роторный шейкер при комнатной температуре.
- Инкубировать слайды со вторичными антителами (анти-кроличья система обнаружения, 1:200) в течение 30 минут при 37 градусах Цельсия.
- Вымойте слайды 3x, каждый раз в течение 5 минут, с 0,01 M PBST в роторный шейкер.
- Чтобы визуализировать иммуностоидинг, добавьте слайды до 300 кл свежего 3,3-диаминобензидина, а затем промойте горки водопроводной водой при комнатной температуре.
Примечание: Степень окрашивания контролируется под микроскопом (увеличение 10X - 40X). - Противопоставление ткани. Пятно горки с гематаксилином окрашивающий раствор в течение 2 мин при комнатной температуре, а затем, мыть горки с водопроводной водой в течение 15 минут.
Примечание: Ядро появляется синий под микроскопом (увеличение 10X - 40X). Если степень синего окрашивания является более мощным, дифференциация соляного алкоголя на 3 - 5 с может быть использована, а затем промыть ткани обратно в синий с водопроводной водой в течение 15 минут, чтобы облегчить видные окрашивания ткани. - Обезвоживать горки в течение 5 мин в 50% этанола, 5 мин в 70% этанола, 2x в 80% этанола в течение 5 мин, 5 мин в 95% этанола, и, наконец, 2x на 5 мин каждый в 100% этанола при комнатной температуре.
- Для прозрачности погрузите секции тканей в бак, содержащий 100% ксилена в течение 15 мин, и перенесите секции в другой резервуар, содержащий 100% ксилен в течение 15 мин при комнатной температуре.
- Для уплотнения возьмите 50 - 100 л нейтральной десен и добавьте 5% ксилена в смесь (избегайте смешивания пузырьков). Добавьте 15 кл.л. вышеупомянутой смеси в разделы легочной ткани. Запечатать пленку с крышкой стекла и осторожно нажмите пузырьки.
2. Автоматическое сканирование всего слайда слайдов IHC
- Дайте запечатанным горки высохнуть в течение 12 ч при комнатной температуре, чтобы высушить их.
- Выберите опцию Bright field вручную и введите интерфейс ручного сканирования.
- Пересмотрите название слайдов и выберите путь хранения для изображений.
- Установите область сканирования и выберите примеры сканирования опции с использованием пороговых значений, установленныхпользователями. Порог составляет около 50 с значением расширения области сканирования 200 мкм.
- Установите значение фокусировки сканирования, выберите фокус автоматически — оно колеблется от 1050 до 2650 и, наконец, выберите однослойныйрежим.
- Загрузите слайды IHC на рабочую станцию и начните автоматическое сканирование.
Примечание: Убедитесь, что слайды не повреждены. Поддержание слайдов чистыми и полупрозрачными и избежать пыли, конфетти, и избыток остатков герметика на слайдах. Стеклянная горка и крышка должны быть лишены знаков. Не чистите горки ксиленом. Размер слайдов приведен в таблице 1. - Автоматическое сканирование всей секции тканей на слайде с 20X, 40X или 100X увеличение.
- Сбор и хранение изображений в конце сканирования в целом слайда.
3. Анализ слайдов с помощью программного обеспечения для визуализации
- Начните гистопатологический анализ изображений программного обеспечения и выбрать локальный компьютер.
- Откройте файл, в котором хранятся данные сканирования.
- Выберите подходящий уровень масштабирования в диапазоне 2X до 40X.
- Отрегулируйте цвет, чтобы установить оптимальный контраст через настройки цвета Toggle.
- Вручную обведите круг и назовите части интереса на каждом изображении.
Примечание: Например, вы можете объехать одну область и назвать ее областью опухоли. - Выберите плагины и КК. В это время всплывает строитель сценариев.
- Выберите квант плотности и отрегулируйте панель Detection.
Примечание: Этот процесс должен быть выполнен тщательно. Бар голубой толерантности используется для регулировки цвета клеточного ядра. Бар толерантности Браун используется для регулировки насыщенности заполнения цвета изображения. Результаты изображений после корректировки должны соответствовать исходным аналогам. - Отрегулируйте уровни Оценка, чтобы сделать интенсивность окрашивания кружевных областей, аналогичных исходным изображениям.
Примечание: Темно-коричневый цвет указывает на сильный положительный, коричнево-желтый умеренно положительный, светло-желтый слабо положительный, а белый отрицательный. - Храните и назовите модель файлом. Примените модель к другим слайдам и выберите выбранную аннотацию".
- Пусть программное обеспечение автоматически вычислит H-оценку для обведемых областей на изображении.
4. Количественная оценка баллов с использованием H-системы подсчета баллов9,10
- Рассчитайте процент иммуностоинга и интенсивность окрашивания (0: отрицательный, 1 ": слабый, 2 ": умеренный, 3": сильный).
- Используйте систему скоринга (H-score) для расчета патологического скоринга опухоли и прилегающих неопухолевых областей.
Примечание: H-оценка (% клеток со слабой интенсивностью x 1) (% клеток с умеренной интенсивностью x 2) (% клеток с сильной интенсивностью x 3). Таким образом, максимальный H-оценка составляет 300, если 100% клеток количественно с сильной интенсивностью.
Результаты
Мы измерили уровни экспрессии зВИНТа в 28 парах немелкоклеточного рака легких (NSCLC) образцов (опухолевые и прилегающие неопухолевые ткани), в том числе 14 плоскоклеточных карциномы (SCCs) и 14 аденокарциномы (ADCs), По МХК. Полное скользящное цифровое сканирование слайдов обеспечило цифровые изображения высокого качества(рисунок 1A). Результаты показали, что H-оценка рака легких была значительно выше, чем у соседних нераковых тканей (P lt; 0.0001, двуххвостый т-тест) ( Рисунок 1A и 1B). Кроме того, мы обнаружили, что уровень экспрессии в SCCs был значительно выше, чем в ADCs(рисунок 1C).
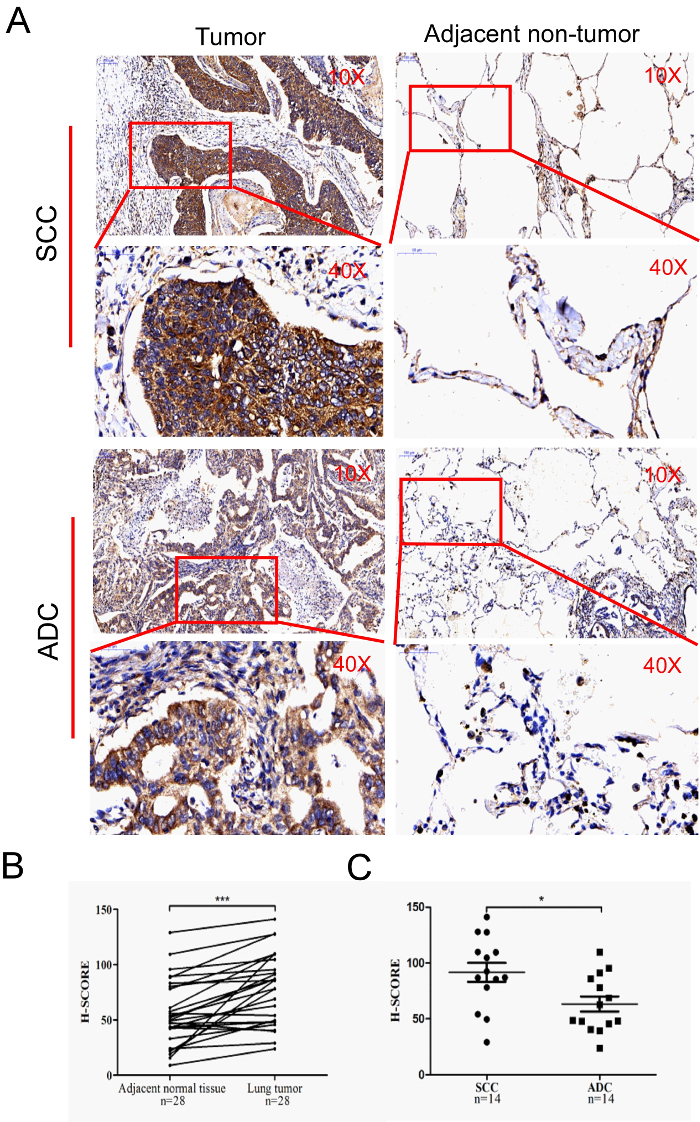
Рисунок 1 : Иммуногистохимическое окрашивание тканей рака легких. Эта цифра была изменена из юаня и др. 5 с разрешения Dove Press. (A) Эта панель показывает репрезентативные иммуногистохимические изображения больных раком легких (увеличение: 10X и 40X). (B) Эта панель показывает H-счет рака легких и прилегающих нераковых тканей. (C) Эта панель показывает H-счет ADCs и SCCs. Бары ошибок указывают на стандартное отклонение. - П Злт; 0,05; П Злт; 0,001. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
| MIN (мм) | MAX (мм) | |
| Ширина | 25 | 26 |
| Длина | 75 лет | 76 |
| Толщина | 0,9 | 1,2 |
Таблица 1: Размеры слайдов.
Обсуждение
Сканирование цельного слайда становится горячей темой для его надежного сканирования и производства высококачественных изображений для клинических и исследовательских целей11,12,13. Изображения могут быть получены с помощью слайд-сканирования микроскопов в течениеминут 11,12,13. Применяя эту методологию, мы получили высококачественные изображения для слайдов «WINT IHC» и сравнили H-счет между опухолевыми и неопухолевыми тканями. В протоколе, представленном здесь, наиболее важными шагами являются подготовка высококачественных слайдов IHC, приобретение изображения, а также спецификация опухолевых и неопухолевых областей до патологического скоринга13,14 , 15 лет , 16.
Текущий метод имеет некоторые преимущества по сравнению с (CLM). Цифровое сканирование достаточно быстро (20 слайдов/час) для сканирования стопки слайдов и получения высококачественных цифровых изображений. Он может дать соответствующие результаты с CLM, но занимает относительно меньше времени. Наличие цифровых изображений позволяет позволить одним и тем же слайдам одновременно наблюдаться несколькими людьми. Цифровые изображения слайдов могут храниться в базе данных, что означает, что избежать длительного износа стеклянных слайдов.
Ограничения этого метода включают в себя необходимость высококачественных тканейи IHC слайды 6,8,11 и технические знания, чтобы указать опухоли или неопухолевых образцов ткани до анализа с помощью программного обеспечения изображений , для того, чтобы избежать путаницы о опухоли или неопухолевых областях во время скоринга6,7. Оператор также должен контролировать воспроизведение цвета на протяжении всего процесса оцифровки в полной слайд-изображении17.
Этот метод может быть активно применен в FISH, TMA, и открытие и развитие лекарственных средств6,18. Табата и др. исследовали использование WSI в первичных патологических диагнозах19. Они ретроспективно проанализировали 1070 образцов WSI из девяти больниц японии и подтвердили факт использования WSI в первичных диагнозах. Одним из главных преимуществ WSI является то, что он позволяет одновременно просматривать слайды несколькими студентами20. Таким образом, проверка изображений сканирования цельного слайда может способствовать развитию цифровойдиагностики в образовательных и исследовательских целях 6,18,21.
Раскрытие информации
Авторам нечего раскрывать.
Благодарности
Этот проект был поддержан Национальным природным фондом Китая (No 81500151, 81400121, 81270607, 81541027 и 81501352) и Природным фондом провинции Хубэй (Китай) (No 2017CFB631). Авторы выражают свою признательность Го Цинь, Чан Мин, Ли Хуэй, и их коллеги в Wuhan Google биологических технологий Co., LTD за их техническую поддержку. Авторы также благодарят Мухаммада Джамаля за редактирование языка.
Материалы
| Name | Company | Catalog Number | Comments |
| Pannoramic MIDI | 3D HISTECH | Cat: PMIDI-040709 | An automated digital slide scanner with a remarkable feature set :12-slide capacity, fluorescence scanning, and many more. |
| QuantCenter | 3D HISTECH | Downloaded from the official website of the company | The framework for 3DHISTCH's image analysis applications. |
| LEICA RM2235 | Leica Microsystems | Cat: 14050038604 | The enhanced precision of the new accessories will add convenience to block to knife approach as well as specimen orientation. |
| Rabbit anti-human Anti-ZWINT antibody | Abcam | Cat: ab197794 | Immunohistochemical analysis of ZWINT in human lung tissue. |
| Anti-rabbit secondary antibody | Wuhan Goodbio Technology | Cat:GB23303-1 | Secondary antibody for IHC staining. |
| Phosphate-buffered saline | Wuhan Goodbio Technology | Cat:G0002 | A solution containing a phosphate buffer. |
| OLYMPUS CX23 | OLYMPUS | Cat:6M87620 | Microscope for detection of H&E or IHC slides. |
| Dimethylbenzene | Shanghai Lingfeng Chemical Reagent | Cat:1330-20-7 | A colorless, flammable fluid used as a solvent and clarifying agent in the preparation of tissue sections for microscopic study. |
| Hematoxylin Staining Solution | Wuhan Servicebio technology | Cat:G1039 | It is commonly used for histologic studies, oftern colors the nuclei of cells blue. |
| Tween 20 | Baitg | Cat:2005-64-5 | It is a polysorbate-type nonionic surfactant formed by the ethoxylation of sorbitan before the addition of lauric acid. It is used as a deterent and emulsifier in pharmacological applications. |
| Citric acid repair liquid | Wuhan Servicebio technology | Cat:G1202 | Is is used to repair antigen after fixation during IHC procedure. |
| LEICA ASP200s | Leica | Cat: 14048043626 | It was designed for routine and research histopathology of up to 200 cassettes. |
| LEICA Arcadia H | Leica | Cat: 14039354103 | It is a heated paraffin embedding station and allows for simple operation and precise control, resulting in improved quality, a smooth workflow and reliability. |
| LEICA Arcadia C | Leica | Cat: 14039354102 | It is a cold plate holding more than 60/65 cassettes on its large working surface. It was designed with an environment adaptive control module to make sure the operating temperature is always stabilized at -6°C. |
| CaseViewer Software | 3DHISTECH |
Ссылки
- Endo, H., Ikeda, K., Urano, T., Horie-Inoue, K., Inoue, S. Terf/TRIM17 stimulates degradation of kinetochore protein ZWINT and regulates cell proliferation. The Journal of Biochemistry. 151 (2), 139-144 (2012).
- Wang, H., et al. Human Zwint-1 specifies localization of Zeste White 10 to kinetochores and is essential for mitotic checkpoint signaling. Journal of Biological Chemistry. 279 (52), 54590-54598 (2004).
- Lin, Y. T., Chen, Y., Wu, G., Lee, W. H. Hec1 sequentially recruits Zwint-1 and ZW10 to kinetochores for faithful chromosome segregation and spindle checkpoint control. Oncogene. 25 (52), 6901-6914 (2006).
- Ying, H., et al. Overexpression of Zwint predicts poor prognosis and promotes the proliferation of hepatocellular carcinoma by regulating cell-cycle-related proteins. OncoTargets and Therapy. 11, 689-702 (2018).
- Yuan, W., et al. Bioinformatic analysis of prognostic value of ZW10 interacting protein in lung cancer. OncoTargets and Therapy. 11, 1683-1695 (2018).
- Higgins, C. Applications and challenges of digital pathology and whole slide imaging. Biotechnic & Histochemistry. 90 (5), 341-347 (2015).
- Webster, J. D., Dunstan, R. W. Whole-slide imaging and automated image analysis: considerations and opportunities in the practice of pathology. Veterinary Pathology. 51 (1), 211-223 (2014).
- Al-Janabi, S., Huisman, A., van Diest, P. J. Digital pathology: current status and future perspectives. Histopathology. 61 (1), 1-9 (2012).
- Bonomi, P. D., et al. Predictive biomarkers for response to EGFR-directed monoclonal antibodies for advanced squamous cell lung cancer. Annals of Oncology. 29 (8), 1701-1709 (2018).
- Villalobos, M., et al. ERCC1 assessment in upfront treatment with and without cisplatin-based chemotherapy in stage IIIB/IV non-squamous non-small cell. Medical Oncology. 35 (7), 106 (2018).
- Griffin, J., Treanor, D. Digital pathology in clinical use: where are we now and what is holding us back?. Histopathology. 70 (1), 134-145 (2017).
- Huisman, A., Looijen, A., van den Brink, S. M., van Diest, P. J. Creation of a fully digital pathology slide archive by high-volume tissue slide scanning. Human Pathology. 41 (5), 751-775 (2010).
- Gray, A., Wright, A., Jackson, P., Hale, M., Treanor, D. Quantification of histochemical stains using whole slide imaging: development of a method and demonstration of its usefulness in laboratory quality control. Journal of Clinical Pathology. 68 (3), 192-199 (2015).
- Hofman, F. M., Taylor, C. R. Immunohistochemistry. Current Protocols in Immunology. 103, (2013).
- Ramos-Vara, J. A. Principles and Methods of Immunohistochemistry. Methods in Molecular Biology. 1641, 115-128 (2017).
- Otali, D., Fredenburgh, J., Oelschlager, D. K., Grizzle, W. E. A standard tissue as a control for histochemical and immunohistochemical staining. Biotechnic & Histochemistry. 91 (5), 309-326 (2016).
- Clarke, E. L., Treanor, D. Colour in digital pathology: a review. Histopathology. 70 (2), 153-163 (2017).
- Potts, S. J. Digital pathology in drug discovery and development: multisite integration. Drug Discovery Today. 14 (19-20), 935-941 (2009).
- Tabata, K., et al. Whole-slide imaging at primary pathological diagnosis: Validation of whole-slide imaging-based primary pathological diagnosis at twelve Japanese academic institutes. Pathology International. 67 (11), 547-554 (2017).
- Saco, A., Bombi, J. A., Garcia, A., Ramírez, J., Ordi, J. Current Status of Whole-Slide Imaging in Education. Pathobiology. 83 (2-3), 79-88 (2016).
- Griffin, J., Treanor, D. Digital pathology in clinical use: where are we now and what is holding us back?. Histopathology. 70 (1), 134-145 (2017).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены