Method Article
Очистка и пробирного активность In Vitro для ppGpp (p) синтетаза с Clostridium difficile
В этой статье
Резюме
Здесь мы описываем метод для очистки гистидин меткой pyrophosphokinase ферментов и используя тонкий слой хроматографии радиоизотопами субстратов и продуктов для анализа для ферментативной активности в пробирке. Assay активность фермента широко применима к любой киназы, циклазы нуклеотидов или реакции фосфора передача, механизм которого включает нуклеотидов трифосфата гидролиза.
Аннотация
Киназы и pyrophosphokinase ферменты передать фосфат гамма или бета гамма пирофосфат остаток от нуклеотида трифосфата прекурсоров субстратов для создания фосфорилированных продуктов. Использование γ -32- P пометкой прекурсоры NTP позволяет одновременный мониторинг использования и продукта формирования субстрата, рентгенография. Хроматографии (ТСХ) тонким слоем на пластины целлюлозы позволяет быстрое разделение и чувствительных количественной оценки субстрата и продукта. Мы представляем метод для использования тонкослойной хроматографии для анализа активности pyrophosphokinase очищенный синтетаза ppGpp (p). Этот метод использовался ранее для характеризовать деятельность циклических нуклеотидов и динуклеотид синтетаз и широко подходит для характеризующие активность фермента, который гидролизует Бонд трифосфата нуклеотидов или передает терминал фосфат с донором фосфатной к другой молекуле.
Введение
Киназы и pyrophosphokinase (или diphospho киназы) ферментов передать фосфатов из нуклеотидов трифосфата (NTP) прекурсоров молекулы субстрата. Подложки могут включать другие нуклеотиды, аминокислоты или белки, углеводы и липиды1. Bioinformatic анализы иногда можно предсказать фермента родственных субстрата или подложек, основанный на схожести с характеризуется ферментов, но по-прежнему необходима экспериментальная проверка. Аналогичным образом сходство фермент для его substrate(s) и скорость, с которой она катализирует реакцию люминофор передача и последствия сопутствующих факторов, ингибиторы, или другие фермента эффекторы должны быть определены экспериментально. Чтобы избежать истощение АТФ прекурсора других АТФ потребителями ферменты, присутствующие в цитоплазмой бактериальное, анализов количественных деятельности требуют очищенный протеин.
Очищение протеина хромотографией сродства металла тщательно охваченных литература2,3. Гистидин теги, состоящий из шести последовательных гистидина остатков, приложил к N - или C-конечная рекомбинантных белков позволяют быстрое очищение метал близость хроматографии4,5,6. Эти последовательности являются небольшими по сравнению с белками, они изменить и обычно имеют минимальное влияние на функции белка, хотя они могут иногда изменять стабильности белок фермента кинетики7,8. Гистидин теги в N - и C-Термини же протеина могут иметь различные эффекты, которые трудно предсказать, не зная структуры белка в вопросе. Гистидин теги обычно включаются во время клонирования рекомбинантных белков путем разработки грунты, которые кодируют шесть гистидина остатков, либо сразу 3' для начала кодон ГПТ или сразу 5' к стоп-кодон открытом чтения кадра. После усиления hexahistidine содержащие ген лигируют в вектор под контролем промотора индуцибельной и выразил, обычно в лаборатории штамм E. coli. Рекомбинация белок затем могут быть изолированы на близость смол, содержащих иммобилизованные двухвалентной катионов (обычно никель или кобальта)9. Загрязняя родной метал связывающих белков могут быть удалены путем титрования с имидазола, которое конкурсно вытесняет связанный протеин2. Наконец целевого белка этого eluted из столбца с более высокими концентрациями имидазола. Существует несколько коммерческих источников для иммобилизованных катиона металла смолы, и производители предоставляют рекомендации для буфера условий и концентрации имидазола. После элюции белка могут быть проанализирован натрия Додециловый сульфат полиакриламидный гель-электрофорез (SDS-PAGE), dialyzed или сразу же использоваться в функциональных анализов.
Существует несколько способов косвенно контролировать активность протеинкиназы, связывая Бонд гидролиз АТФ фосфат второй реакции, которая выпускает или возбуждает Флюорофор или генерирует хемилюминесценции, но эти реакции имеют несколько движущихся частей и может быть технически сложных10. Наиболее простым способом конкретно измерить активность люминофор передача является непосредственно контролировать передачу radiolabeled фосфатной группы из коммерчески доступных γ -32-P предшественником NTP-radiolabeled субстрата11 , 12 , 13. смеси radiolabeled субстратов и продуктов могут быть разделены и количественно методом хроматографии (ТСХ) тонким слоем. TLC использует дифференциального мобильность растворенных веществ в данного растворителя, позволяя растворителя (жидкой фазы) для переноса капиллярность по всей поверхности (твердой фазы), после чего смесь растворов был адсорбированных14. Растворенных веществ, которые являются небольшими и/или отсутствие благоприятных взаимодействия с твердой фазы будет переносить большие расстояния от их первоначального расположения чем растворенных веществ с более высокой молекулярной массой или большой работоспособностью для тела. Для изучения люминофор передача фосфат постановление увеличить молекулярный вес молекул они добавляются и добавить отрицательный заряд ионных кислой или нейтральной рН11,12,14. Это снижает их мобильности на базовой поверхности, например Пей целлюлозы. Когда в кислой калия фосфатного буфера, смеси моно-, ди-, три-, тетра- и pentaphosphate видов могут быть легко разделены на ОПЭ целлюлозы, позволяя количественная оценка каждого вида (рис. 2, рис. 3). Такие анализы могут быть выполнены с помощью lysates клетки содержащие фермент интерес, но это включает в себя потенциал для деятельности других киназы, фосфатаз и общие ATPases к разрушающим субстрат или продукт. Для оценки количественных в vitro активность фермента необходимо очистить фермента интерес.
Гуанозина tetraphosphate (ppGpp) и pentaphosphate (pppGpp) гуанозина являются рибонуклеотид сигнальные молекулы, образованные передачи пирофосфат группа от прекурсор аденозинтрифосфатом (АТФ), соответственно, гуанозина дифосфат (ВВП) или гуанозина субстрата tetraphosphate (GTP)15. Эти сигналы одной рибонуклеотид, известные как ppGpp (p), посредником клетки широкий ответ экологического стресса, известный как строгие ответ в различных видов бактериальных,1516. Два сохранившихся классы ферментов катализируют образование (p) ppGpp15,17 Rel/Spo гомолога (RSH) ферментов являются «долго» бифункциональных (p) ppGpp синтетаза/гидролаз, назван в честь их сходство с реальными и SpoT (p) ppGpp метаболических ферменты от кишечной палочки , которые содержат синтетаза, гидролазы и нормативной областях, в то время как малые alarmone синтетазы (SAS) ферменты являются короткие монофункциональный синтетаз исключительно в грамм положительных бактерий15, 17 , 18. спорообразующих грамположительные бактерии Clostridium difficile кодирует предполагаемого RSH и SAS генов19. Здесь мы представляем первоначальный деятельность анализов, которые подтверждают, что фермент RSH C. difficile является каталитически активных синтетаза ppGpp (p).
протокол
1. индуцибельной гиперэкспрессия белка, гистидин тегами
- Усилить rsh от C. difficile R20291 геномной ДНК.
- Используйте высококачественный полимеразы и следуйте инструкциям производителя.
- Усилить C. difficile rsh с помощью грунтовки
rsh_F (CAGGTACCGGTTATATGCATGATAAAGAATTACAAG) и
rsh_R (CCCTGCAGCTAATGGTGATGGTGATGGTGATTTGTCATTCTATAAATAC), который вводит тег hexahistidine C-терминала.
Примечание: KpnI и PstI, вырезать сайтов в грунт последовательности выделены жирным шрифтом. - Дайджест pMMBneo вектор и продукт PCR rsh-his6 с Pstl и KpnI ограничения, вырезать сайтов при 37 ° C на 45 мин.
- Очищают линеаризованного вектора и ПЦР фрагментов через последующей очистки с комплектом извлечения геля ДНК и электрофорез геля агарозы.
- Измерение оптической плотности 280 Нм (280) вектора и усиленные продукт PCR. Используйте уравнение
 для определения концентрации ДНК каждого фрагмента ДНК.
для определения концентрации ДНК каждого фрагмента ДНК.
- Перевязать rsh в pMMBneo для выражения.
- Объединение 25 нг усваивается PMMBneo вектора, 125 нг продукт гена rsh-his6 , 2 мкл 10 x буфер лигаза и 1 мкл ДНК лигаза. Используйте нуклеиназы свободной воды для регулировки объема до 20 мкл. Инкубируйте на 16 ° C для 16 h.
Примечание: Эффективность лигирование зависит размер фрагментов и должна быть скорректирована на основании протоколов производитель. - Трансформировать перевязаны векторное произведение в E. coli DH5-α или другой recA - плазмида поддержание напряжения. Выберите для преобразованных ячеек на ФУНТ пластин с 100 мкг/мл канамицин и проинкубируйте 16 – 24 ч при 37 ° C.
- Выберите четыре колонии от преобразования пластины (s) и полоска на свежие пластины, содержащие 100 мкг/мл канамицин для изоляции ДНК. Инкубировать новые пластины при 37 ° C для 16 – 24 h и выберите один изолировать для последующего белков.
- Для подтверждения успешной лигирование нетронутыми rsh белка кодирования региона, подбор колонии выбрали изолировать в 20 мкл воды, тепла на 95 ° C в течение 10 мин и использовать в качестве шаблона для подтверждающих PCR используя же грунт, используется для усиления ген.
- Объединение 25 нг усваивается PMMBneo вектора, 125 нг продукт гена rsh-his6 , 2 мкл 10 x буфер лигаза и 1 мкл ДНК лигаза. Используйте нуклеиназы свободной воды для регулировки объема до 20 мкл. Инкубируйте на 16 ° C для 16 h.
- Трансформировать проверенных плазмида согласно протоколы стандартные преобразования для преобразования бактериальных плазмид E. coli в E. coli BL21 системы для производства белка высокой доходности.
- Экспресс RSH-His6 в E. coli.
- Выберите одного Колония E. coli BL21 преобразована с pMMBneo::rsh и прививать 2 мл среды фунтов с 50 мкг/мл канамицин. Инкубировать при 37 ° C 12 – 16 ч при встряхивании в 250 об/мин.
- Прививать 500 мл LB среде, содержащей 50 мкг/мл канамицин с 0,5 мл на ночь культуры для роста клеток и белков.
- Инкубировать выражение культуры при 37 ° C и 250 об/мин в шейкер инкубатор, до тех пор, пока плотность клеток достигает ОД600 0,167 при 37 ° C.
- Снизить температуру инкубатора до 30 ° C и подождите 30 минут для культуры температура понизится.
- Побудить RSH выражение, добавив изопропиловым β-D-thiogalactoside (IPTG) до конечной концентрации 0,5 мм. Разрешить индукции провести ночь (для 16-18 ч) при 30 ° C, тряски на 250 об/мин.
- Пелле центрифугированием в 3080 x г за 30 мин при 4 ° C.
Примечание: Гранулы можно хранить на ночь при-20 ° C для очистки целевого белка на следующий день без заметные потери белка урожая или ферментативную активность.
2. белка очистки хромотографией сродства никеля
Примечание: Продолжите непосредственно с очистки белков, описанные ниже после уточнения lysate клетки. Хранение пояснил lysate при температуре 4 ° C на ночь для очистки последующие белка снижает урожайность белка.
- Очищение протеина используя 1 мл никель-Nitriloacetic кислота (Ni-НТА) смолы на столбце гравитации.
- За день до использования, сбалансировать столбце на ночь при 4 ° C с 2 мл уравновешивания буфера (10 мм трис-HCl рН 7,79, 300 мм NaCl, 50 NaH2PO4, лизоцима 0.5 мг/мл, 5 мм MgCl2, 10 мм имидазола, 0,25 мм DTT, 5 мм phenylmethane сульфонил Фторид (PMSF), 10% глицерина).
- Следующий день приносят столбце от 4 ° C до RT перед загрузкой осветленный lysate и пусть он стоять на ~ 2-3 ч.
Примечание: Чего столбец в термально уравновешении важно избежать воздушных пузырьков, образуя в столбце. - Ресуспензируйте Пелле, полученного на шаге 1.3.6 литического буфера (10 мм трис-HCl рН 7,8, 300 мм NaCl, 5 MgCl2, 50 мм NaH2PO4, 10% глицерина, лизоцима 0.5 мг/мл, 10 мм имидазола, 0,25 мм DTT и 5 мм PMSF).
- Sonicate клетки на льду для интервалов s 8 x 10, приостановка 30 s между импульсами.
- Уточнить lysate центрифугированием в 3080 x г за 30 мин при температуре 4 ° C с помощью microcentrifuge.
- Подготовить lysate с равными объемами литического буфера, а затем применить prepped уточнить lysate столбцу и собирать потока через.
- Повторно осветленный lysate потока через столбец и собирать вторичный проточный.
- Промойте колонку с мыть буфера 1 (10 мм трис-HCl (рН 7.79), 300 мм NaCl, 5 мм2MgCl 50 NaH2PO4, 30 мм имидазола, 10% глицерина). Соберите потока через.
Примечание: Включение 5 мм MgCl2 в буферы мыть и элюции имеет важное значение для ферментативной активности очищенный протеин. - Промойте колонку с мыть буфером 2 (10 мм трис-HCl (рН 7.79), 300 мм NaCl, 5 мм2MgCl 50 мм NaH2PO4 и 50 мм имидазола). Соберите потока через.
- Примените 2 мл Элюирующий буфер (10 мм трис-HCl (рН 7.79), 300 мм NaCl, 50 NaH2PO4, 10% глицерина и 75 мм имидазола). Сбор через поток в двух фракций 1 мл.
Примечание: Столбце после этого шага может храниться в буфере уравновешивания на 4 ° C, если же белка будет очищаться в следующем assay очистки. Этот столбец может использоваться до 3 раз, если хранятся надлежащим образом.
- Оцените столбец дроби для чистоты, SDS-PAGE.
- Чтобы качественно оценить очищение протеина, запустите 20 мкл аликвоты всех фракций столбец на геле полиакриламида 4% / 10% за 60 мин в 170 V.
- Пятно гель с 0.1% Кумасси синим при комнатной температуре за 5 ч, нежно покачиваясь на рокер benchtop.
- Отмойте гель в 40% метанола, 10% уксусной кислоты кристаллизированной на ночь при комнатной температуре, раскачиваясь на рокер benchtop.
Примечание: Представитель лари изображен на рисунке 1.
- Dialyze элюировать фракция 2 на ночь при 4 ° C.
- Dialyze против диализа буфера (15.7 мм трис-HCl (рН 7,6), 471.9 NaCl, 15.69 мм MgCl2, DTT, 1,5 мм PMSF и 15,7% глицерина 1,57 мм) в соотношении 200: 1, с помощью диализа устройства 1 мл с молекулярной массой 20 кДа светотеневой границы (MWCO).
- Определить концентрацию образец dialyzed протеина путем измерения оптической плотности при 280 Нм и с помощью вычисляемых Молярная вымирания коэффициент 82085 M-1см-1 20.
- Храните 5 мкл аликвоты образца dialyzed белка в аликвоты-80 ° c до использования.
3. белка деятельности пробирного хромотографией тонким слоем
- Подготовьте пластину хроматографии тонким слоем.
- Перед выполнением реакции, подготовить полиэтиленимина (PEI)-пластины целлюлозы промывкой в деионизированной воде. Поместите пластины в камере стекла с двойной дистиллированной водой до глубины ~0.5 см.
- Позвольте воде мигрировать в верхней части плиты.
Примечание: Промывки пластин это не строго необходимо, как пластины могут быть использованы без него, но стиральная увеличить четкость полученные изображения. Промывка пластин в двух перпендикулярных направлениях дальнейшего гарантирует, что любых загрязнений, присутствующих в смоле изолированы в одном углу пластины (рис. 2). - Принесите тарелки из стекла камеры и оставить на стойке benchtop для высыхания на ночь (12 – 18 ч).
- Марк сухой плиты 2,0 см от одного края с мягким карандашом, чтобы указать, где образцы будут применяться для TLC. 2 мкл образцы, применять образцы не менее 1,0 см друг от друга (рис. 2).
Примечание: Это позволяет четкое разделение между смежными spot, которая имеет решающее значение для количественного определения сигнала. До тех пор, как смола целлюлозы не царапины, небольшие карандашными пометками на поверхности не будет мешать растворителей миграции. - При планировании эксперименты, всегда оставляют одно место на каждой табличке неиспользуемые.
Примечание: Это обеспечит пустую полосу для количественного определения образца (рис. 2). 20 см TLC плита будет иметь номер для 19 мест.
- Активность фермента пробирного
- Подготовьте 5 x буфер смеси, содержащие 50 мм трис-HCl (рН 7,5), Ацетат аммония 25 мм, 10 мм KCl, 1 мм DTT и 0,6 мм СПС.
Примечание: Эта смесь может подготовлен в больших количествах и замороженных в 10 мкл аликвоты для последующего использования. Не подвергайте смесь нескольких циклов замораживания оттаивания. - Подготовка индивидуальных реакций, содержащие 3 мкм RSH, 1 x буферной смеси, 0,6 мм ВВП, 1,2 мм MgCl2. Добавьте 1.0 мкКи γ -32P-АТФ 10 мкл реакции и использовать нуклеиназы свободной воды довести реакции до нужного тома. Добавьте RSH после того, как другие компоненты были неоднозначными, как добавлением RSH нуклеотида содержащие смесь инициирует assay ферментативную активность.
Примечание: Окончательный реакции объем будет зависеть количество timepoints пробы. Для выборки 2 мкл/timepoint, соберите 10 мкл реакционной смеси для каждого 4 timepoints. - Для управления для гидролиза АТФ от загрязняющих нуклеиназы деятельности, собрать 10 мкл реакции, содержащие не белок и проинкубируйте его параллельно. Место 2 мкл образцов при t = 0 и в конце эксперимента, чтобы обеспечить, что СПС не гидролизуется в отсутствие белка.
- Сразу же после добавления RSH, удалить 2 мкл и пятно на обозначенные Пей целлюлоза пластину как t = 0 мин образца.
- Инкубируйте реакции при 37 ° C, удаление 2 мкл аликвоты на желаемой timepoints.
Примечание: Ферментативную активность будет приостанавливаться, когда образец адсорбированные на пластину целлюлозы. Подождите 10-30 мин, после того, как последний пятно добавляется к плите до развития для обеспечения полной адсорбции и сушка образца.
- Подготовьте 5 x буфер смеси, содержащие 50 мм трис-HCl (рН 7,5), Ацетат аммония 25 мм, 10 мм KCl, 1 мм DTT и 0,6 мм СПС.
- Тонкий слой хроматографии
- Заполните хроматографии камера с 1,5 М 1,5 М х2PO4 (рН 3.64) на глубину 0,5 см.
Примечание: Объем необходимо будет зависеть от размеров бака хроматографии. Любой стеклянной тары с уровня снизу, которая является достаточно широким, чтобы позволить вставки TLC плиты без изгиб может использоваться как развивающихся танк с добавлением крышкой. TLC плиты можно резать на узкие полоски с чистой razorblade для обеспечения развития в стеклянный стакан, покрыты полиэтиленовой пленкой. - Погрузите нижний край пластины в растворителе. Разрешить растворителя мигрировать в верхней части плиты (~ 90 мин.).
Примечание: в то время как растворителя миграции будет остановить в верхней части плиты и образцы будут не потеряли или работать вместе во время длительного погружения, плиты не следует оставлять в растворителе на ночь. Электрокипятильники длиннее 4 h может вызвать смолы для отсоединения от пластины бэк и привести к потере сигнала. - Снять пластину из бака хроматографии и поместите его на benchtop сушки стойку.
- Разрешить пластину в воздух сухой на ночь.
Примечание: Сушка может быть ускорен с помощью фен. Сухость может оцениваться по цвету смолы, которая будет темнее при намокании и возвращение к цвету неиспользуемые пластины, когда полностью высохнет. - После того, как пластины сухой, оберните пластину в полиэтиленовой пленкой, чтобы избежать передачи радиоактивного материала для визуализации кассету и анализировать радиоавтографией (рис. 3).
- Заполните хроматографии камера с 1,5 М 1,5 М х2PO4 (рН 3.64) на глубину 0,5 см.
- Анализ данных
- Разоблачить пластину Пей целлюлозы, содержащие отдельные реакции phosphorimager кассету для 4 ч при комнатной температуре.
Примечание: Это достаточно воздействия давать очень четкое изображение с использованием указанных концентрации свежих γ -32P-СПС. Если используются нижнюю радиоизотопами субстрата, время экспозиции может быть увеличена до 12-16 ч. - Изображение кассету на phosphorimager.
- Использование изображений программного обеспечения с графическим интерфейсом пользователя, привлечь интерес регионов (ROI), выбрав Нарисуйте прямоугольник и с помощью мыши рисовать прямоугольные ROIs вокруг одной всю полосу и АТФ и ppGpp пятна содержащихся в этом Лейн (рис. 3 ).
- Используйте команды выберите, копировать и вставить (или соответствующие команды, на основе изображений программное обеспечение используется) рисовать идентичные ROIs в других полос движения для обеспечения что ROI измерения сигнала в рамках идентичных областей в каждой полосе. Включать ROI от неиспользуемых Лейн, чтобы использоваться в качестве заготовок.
- С помощью анализировать | Инструменты | ROI менеджер | Добавить команды изображений программное обеспечение, выберите все трансформирования, обращено на ОПЭ пластины целлюлозы.
- С помощью анализировать | Набор измерений | Мера команды, количественную оценку интенсивности сигнала в пределах каждой ROI и экспорт измерений в виде таблицы (рис. 3). Вычитание пустые значения ROI от экспериментальных сигналов.
- Рассчитать, какой процент пустыми сигнала в пределах каждой полосы объясняется АТФ и ppGpp, с помощью формул

Примечание: ROIs могут быть сделаны и предел, с использованием коммерческого программного обеспечения, совместимых с phosphorimager или свободно доступных ImageJ программного обеспечения (национальные институты здравоохранения).
- Разоблачить пластину Пей целлюлозы, содержащие отдельные реакции phosphorimager кассету для 4 ч при комнатной температуре.
Результаты
Мы представляем метод очищения сродства синтетаза ppGpp (p) с Clostridium difficile и оценки ее Ферментативная активность. Рисунок 1 демонстрирует очищение протеина, достигнутые металла аффинной хроматографии. Вторая фракция элюции (E2) от этого очищения был dialyzed и используется для assay ферментативную активность. Рисунок 2 описаны необходимые шаги для подготовки и проведения анализов pyrophosphotransferase хромотографией тонким слоем. Рисунок 3 показывает, как данные из этих экспериментов предел с упором на соответствующие резьбовые и преобразование интенсивности сигнала в процентах. В рисунке 4Aмы представляем представитель TLC авторадиография (p) ppGpp синтетаза анализа с использованием очищенного RSH, синтетаза ppGpp C. difficile (p). Первоначальное место расположение, ppGpp и АТФ пятна хорошо видны на авторадиография, равно как и растворителя Фронт, который виден, потому что она содержит следовые количества radiolabeled неорганического фосфата. Молекулы с более фосфорной кислоты постановление проявляют меньше мобильности из первоначального местоположения пятно, как они имеют больше молекулярным весом и более отрицательные ионной заряда; Это препятствует их мобильности на основные Пей целлюлозы. В течение 120 минут при 37 ° C ppGpp накопления и истощение АТФ незначительны в реакциях не хватает синтетаза фермент, в то время как истощение АТФ и ppGpp накопление очевидны в присутствии RSH Рисунок 4A). Рисунок 4B показывает абсолютное АТФ и ppGpp сигналы от четырех экспериментов. Рисунок 4 c показывает те же данные как Рисунок 4B с абсолютной сигналы преобразуются в процентах всего радиоактивных сигнала. Это минимизирует неточности вследствие дозирования ошибки и/или радиоактивного распада и позволяет данным эксперименты, проведенные в разные дни, чтобы быть объединены без внесения неопределенности в данных.

Рисунок 1: никель очищение сродства RSH. Геля Кумасси окрашенных SDS-PAGE, показывая lysate (L) и центрифугировали lysate (CL) индуцированного BL21 pMMB::rsh-his6 , а также потока через (FT), вымыть 1 (W1), мыть 2 и элюции (E1 и E2) фракции после очищение сродства никеля. E2 фракция была dialyzed и использоваться для последующих ферментные анализы. Молекулярная масса белка размер стандартов отображаются справа. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
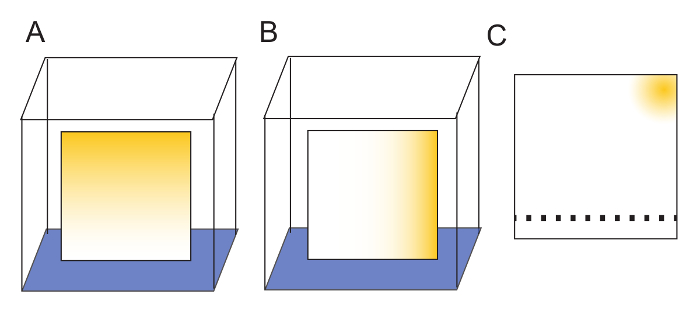
Рисунок 2: подготовка TLC плит. (A) пластины промывают в одном измерении, поместив нижний край в воде (синий). Загрязнителей (желтый) мигрируют в верхней части плиты с растворителем. (B) после того, как полностью высушена тарелку, омывается в втором измерении его поворота 90 ° по отношению к первой стирки и снова позволяя воде мигрировать в верхней части плиты. (.C) после мытья, любые загрязнители изолированы в одном углу плиты. Смола промывают TLC пластины могут быть помечены нежно с мягким карандашом, чтобы указать, где должны быть выставлены образцы. 2 мкл образцы не менее 1 см между пятна обеспечит адекватные пример разделения. Образцы были замечены 2 см «снизу» пластины. После образца приложения растворитель разрешено запускать в «top» где любых загрязнений будут изолированы от воды автомойки. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.

Рисунок 3: сигнал квантификации. Регионы интереса (ROI), определение общей, АТФ и ppGpp сигнал отображаются для пустой Лейн и экспериментальной Лейн. Интенсивность сигнала в каждой пустой ROI вычитается из значения экспериментальной, и СПС и ppGpp сигналы нормализуются всего сигнала с помощью уравнения показано представить процент всего радиоактивных сигнала, присваиваемые АТФ и ppGpp. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
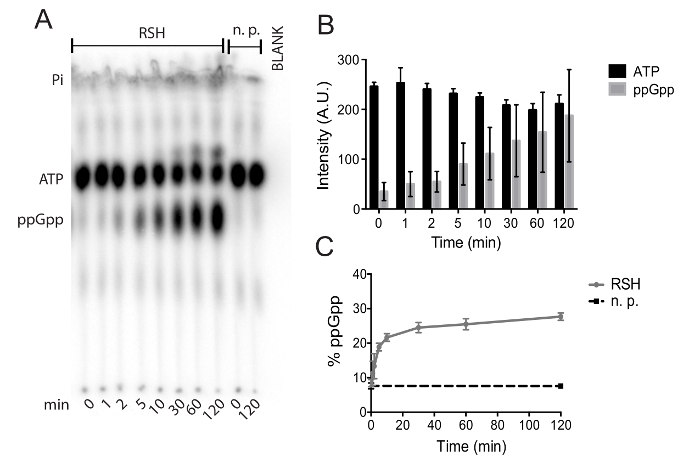
Рисунок 4. Авторадиография представитель TLC плиты: (A) это изображение показывает растворителя Фронт, СПС, ppGpp и первоначальный пятно местах осуществляется с использованием реакции очищенной C. difficile RSH. Управления реакции, содержащие не белок (н.п.) позволяет количественной оценки uncatalyzed гидролиза АТФ, а пустой лэйн позволяет точные сигнала количественной оценки. (B) сигнал абсолютной интенсивности АТФ и ppGpp в течение 120 минут инкубации с C. difficile RSH. Показаны являются средства и стандартные отклонения четырех независимых экспериментах. (C) те же данные (b) с ppGpp сигнала представлены в процентах от общей радиоактивных сигнала. накопление ppGpp в реакции управления не белка (н.п.) показан в черном. Показаны являются средства и стандартные отклонения два независимых экспериментов с двух технических реплицирует. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
Обсуждение
Здесь мы приводим очистки его меткой RSH от C. difficile и представит метод количественной оценки деятельности с использованием хроматографии radiolabeled тонким слоем. Этот метод использовался ранее для оценки активности ферментов циклазы diguanylate C. difficile, а также синтетаза ppGpp (p), циклазы нуклеотидов, киназы и фосфодиэстеразы ферментов из других организмов11,12 ,13,21. В то время как метод не роман, широко применяется для многих видов анализа, и мы надеемся, что исследователи найдет свою презентацию в видео формате полезны.
Наиболее важные шаги в рамках Протокола являются очищение протеина (шаги 2.1.3–2.1.10), подготовка реакции для хроматографии (шаг 2,2-2,3) тонким слоем и анализ данных (шаг 3.4). Мы нашли следующие изменения, чтобы быть особенно полезным: Добавление2 MgCl для буферов, используемых для очистки столбец никеля (шаги 2.1.3–2.1.10) имеет решающее значение для ферментативной активности очищенный протеин и презентация данные о деятельности ферментов как % ppGpp производится довольно чем абсолютное ppGpp производства гарантирует, что данные, собранные в разные дни, с различными γ-32P-АТФ согласуются. Этот метод доступен для любого исследовательской группы с доступом к phosphorimager, и анализ данных является простым. По quantitating phosphotransfer деятельности в процентном отношении 32P преобразованы в ppGpp, мы обеспечить воспроизводимость данных. Потому что очень маленький реакционных объемов запятнаны пластины Пей целлюлозы, существует значительный потенциал для незначительные неточности дозирования ввести значительные ошибки в абсолютное количество γ -32P-АТФ или 32P-ppGpp в данной полосе на пластину TLC, но распространение радиоактивных сигнала между возможных форм зависит от нынешнего общего сигнала. Кроме того общая радиоактивных сигнала в данной полосе может зависеть от возраста γ -32P-ATP использовано в эксперименте. 32 P имеет период полураспада 14.3 дней, поэтому независимые анализы выполняются несколько дней врозь может показать существенные различия в общей радиоактивных сигнал обнаружен, но относительные количества radiolabeled АТФ и ppGpp зависят только от активности ферментов. Представляя данные как «% ppGpp» а не абсолютное ppGpp сигнала предотвращает Введение случайный шум от дозирования ошибка или радиоактивного распада. Это иллюстрируется различия между Рисунок 4B и 4 C. Как отобразить средства и стандартные отклонения данных из те же четыре эксперименты, но данные в рисунке 4 c нормализован всего радиоактивных сигнал.
Мы определили, что фермент RSH C. difficile является функциональной ppGpp синтетаза в пробирке, способный быстро pyrophosphotransfer от АТФ phosphodonor и акцептор ВВП. Эта реакция зависит от магния, который координирует СПС и привязки гуанозина RSH семьи ферменты22. Мы изменили производитель протоколы для хромотографию сродства никеля включить 5 мм MgCl2 в lysis и мыть буферов, а также Элюирующий буфер, потому что мы нашли, что очистка в отсутствие магния наносит ущерб Ферментативная активность очищенный протеин. Это свидетельствует о том, что ионы магния могут играть не стимулирующую роль в стабилизации структуры белков в отсутствие привязки нуклеотидов, но дальнейших структурных характеристик будет необходимо подтвердить это.
Насколько нам известно эта работа является первый опубликованный доклад ppGpp синтеза в C. difficile и указывает, что этот организм, скорее всего, использовать (p) ppGpp опосредованной строгие ответ выжить внеклеточного стресс. (p) ppGpp метаболизм никогда ранее сообщалось в этот важный человеческий патоген. Учитывая, что строгие ответ причастны упорство в многих других патогенов, вполне вероятно, что ppGpp опосредованной сигнализации (p) могут играть роль в высокой стрессоустойчивость C. difficile клеток и высокой повторение курса C. difficile инфекции в23,24,25.
Раскрытие информации
Авторы заявляют, что без финансовых интересов или другие конфликты интересов.
Благодарности
Эта работа финансировалась NIAID 1K22AI118929-01. EBP была поддержана летом исследовательский грант программы стипендий от управлением исследований в университете старого Доминиона, Норфолк, Виргиния, США.
Материалы
| Name | Company | Catalog Number | Comments |
| Inducible overexpression of a histidine-tagged protein | |||
| Phusion polymerase | New England Biolabs (NEB) | M0530L | |
| QIAEX II DNA Gel Extraction Kit | Qiagen | 20021 | |
| KpnI restriction enzyme | NEB | R0142S | |
| PstI restriction enzyme | NEB | R0140S | |
| T4 DNA ligase | NEB | M0202 | |
| NEB® 5-alpha Competent E. coli (High Efficiency) | NEB | C2987I | |
| BL21 (DE3) Competent E. coli | NEB | C2527I | |
| IPTG | Sigma-Aldrich | 10724815001 | |
| JXN-26 centrifuge with JLA 10.500 rotor | Beckman Coulter Avanti | - | |
| Microcentrifuge with D3024/D3024R rotor | Scilogex | - | |
| MaxQ SHKE6000 Incubator | Thermo Scientific | - | |
| Ultrasonic processor | Sonics | VC-750 | |
| Protein purification by nickel affinity chromatography | |||
| Ni-NTA resin | G Biosciences | 786-940/941 | |
| Pierce Disposable Gravity columns, 10 mL | Thermo Scientific | 29924 | |
| 1 mL Spectra/ Por float-A-lyzer G2 dialysis device (MWCO: 20-kD) | Spectrum | G235033 | |
| Mini-Protean Electrophoresis Cell | BioRad | 1658004 | |
| Protein activity assay by thin layer chromatography | |||
| Thin layer chromatograph (TLC) development tank | General Glass Blowing Company | 80-3 | |
| Polyethylenimine (PEI)-cellulose plates (20 cm x 20 cm, 100 μm thickness) with polyester support | Sigma-Aldrich | Z122882-25EA | |
| ATP, [γ-32P]- 3000 Ci/mmol 10mCi/ml lead, 100 μCi | Perkin Elmer | NEG002A | |
| Adenosine 5’-triphosphate (ATP) 100 mM | Bio Basic Canada | AB0311 | |
| Guanosine-5’-diphosphate disodium salt (GDP) | Alfa Aesar | AAJ61646MC/E | |
| Storage phosphor screen | GE Healthcare Life Sciences | BAS-IP TR 2040 E Tritium Screen | |
| Storm 860 phosphorimager | GE Healthcare Life Sciences | - |
Ссылки
- Cheek, S., Ginalski, K., Zhang, H., Grishin, N. V. A comprehensive update of the sequence and structure classification of kinases. BMC Structural Biology. 5 (1), 6 (2005).
- Porath, J. Immobilized metal ion affinity chromatography. Protein Expression and Purification. 3 (4), 263-281 (1992).
- Arnau, J., Lauritzen, C., Pedersen, J. Cloning strategy, production and purification of proteins with exopeptidase-cleavable His-tags. Nature Protocols. 1 (5), 2326-2333 (2006).
- Porath, J., Carlsson, J., Olsson, I., Belfrage, G. Metal chelate affinity chromatography, a new approach to protein fractionation. Nature. 258 (5536), 598-599 (1975).
- Smith, M. C., Furman, T. C., Ingolia, T. D., Pidgeon, C. Chelating peptide-immobilized metal ion affinity chromatography. A new concept in affinity chromatography for recombinant proteins. Journal of Biological Chemistry. 263 (15), 7211-7215 (1988).
- Graslund, S., et al. Protein production and purification. Nature Methods. 5 (2), 135-146 (2008).
- Booth, W. T., et al. Impact of an N-terminal Polyhistidine Tag on Protein Thermal Stability. ACS Omega. 3 (1), 760-768 (2018).
- Thielges, M. C., Chung, J. K., Axup, J. Y., Fayer, M. D. Influence of histidine tag attachment on picosecond protein dynamics. Biochemistry. 50 (25), 5799-5805 (2011).
- Chaga, G. S. Twenty-five years of immobilized metal ion affinity chromatography: past, present and future. Journal of Biochemical and Biophysical Methods. 49 (1-3), 313-334 (2001).
- Ma, H., Deacon, S., Horiuchi, K. The challenge of selecting protein kinase assays for lead discovery optimization. Expert opinion on drug discovery. 3 (6), 607-621 (2008).
- Tamayo, R., Tischler, A. D., Camilli, A. The EAL domain protein VieA is a cyclic diguanylate phosphodiesterase. Journal of Biological Chemistry. 280 (39), 33324-33330 (2005).
- Purcell, E. B., McKee, R. W., McBride, S. M., Waters, C. M., Tamayo, R. Cyclic Diguanylate Inversely Regulates Motility and Aggregation in Clostridium difficile. Journal of Bacteriology. 194 (13), 3307-3316 (2012).
- Purcell, E. B., Tamayo, R. Identification and characterization of cyclic nucleotide phosphodiesterases. Methods in Molecular Biology. 1016, 235-243 (2013).
- Ross, P., et al. Control of cellulose synthesis Acetobacter xylinum. A unique guanyl oligonucleotide is the immediate activator of the cellulose synthase. Carbohydrate Research. 149 (1), 101-117 (1986).
- Potrykus, K., Cashel, M. (p)ppGpp: still magical?. Annual Review of Microbiology. 62, 35-51 (2008).
- Boutte, C. C., Crosson, S. Bacterial lifestyle shapes stringent response activation. Trends in Microbiology. 21 (4), 174-180 (2013).
- Nanamiya, H., et al. Identification and functional analysis of novel (p)ppGpp synthetase genes in Bacillus subtilis. Molecular Microbiology. 67 (2), 291-304 (2008).
- Gaca, A. O., et al. Basal Levels of (p)ppGpp in Enterococcus faecalis: the Magic beyond the Stringent Response. mBio. 4 (5), (2013).
- Sebaihia, M., et al. The multidrug-resistant human pathogen Clostridium difficile has a highly mobile, mosaic genome. Nature Genetics. 38 (7), 779-786 (2006).
- Gasteiger, E., et al. ExPASy: The proteomics server for in-depth protein knowledge and analysis. Nucleic Acids Research. 31 (13), 3784-3788 (2003).
- Purcell, E. B., et al. A nutrient-regulated cyclic diguanylate phosphodiesterase controls Clostridium difficile biofilm and toxin production during stationary phase. Infection and Immunity. , (2017).
- Mechold, U., Murphy, H., Brown, L., Cashel, M. Intramolecular Regulation of the Opposing (p)ppGpp Catalytic Activities of RelSeq, the Rel/Spo Enzyme from Streptococcus equisimilis. Journal of Bacteriology. 184 (11), 2878-2888 (2002).
- Dalebroux, Z. D., Svensson, S. L., Gaynor, E. C., Swanson, M. S. ppGpp Conjures Bacterial Virulence. Microbiology and Molecular Biology Reviews. 74 (2), 171-199 (2010).
- Bartlett, J. G. Clostridium difficile: progress and challenges. Annals of the New York Academy of Sciences. 1213, 62-69 (2010).
- . . US Department of Health and Human Services. , (2013).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены