Method Article
浄化、体外(p) ppGppクロストリジウム ・ ディフィシルから合成酵素の活性
要約
ここでは、放射性標識基質と酵素活性の生体外の試金する製品の薄層クロマトグラフィーによるヒスチジン ピロホスホキナーゼ酵素の浄化法について述べる.酵素活性測定法はキナーゼ、ヌクレオチド酸シクラーゼ、またはその機構を含むヌクレオチド三リン酸加水分解蛍光体移動反応に広く適用可能。
要約
酵素キナーゼとピロホスホキナーゼは、ヌクレオチド三リン酸前駆体から γ リン酸または β-γ ピロリン酸基をリン酸化製品を作成する基板に転送します。使用-p NTP 前駆体をラベル付けにより、γ-32のラジオグラフィによる基板の利用と製品の形成を同時にモニタリングします。薄層クロマトグラフィー (TLC) セルロース プレート上では、迅速な分離と基板と製品の定量法をことができます。アッセイの精製 (p) ppGpp 合成酵素のピロホスホキナーゼ活動に薄層クロマトグラフィーを利用するための方法を提案します。このメソッドは以前環状ヌクレオチド及び還元型酵素の活動の特性に使用されています、ヌクレオチドの三リン酸塩結合を加水分解するまたは端末に転送する酵素の活性の特性を広く適切ですリン酸リン酸ドナーから別の分子へ。
概要
キナーゼとピロホスホキナーゼ (または diphospho キナーゼ) の酵素はヌクレオチド三リン酸 (NTP) 前駆体から基質分子にリン酸塩を転送します。基板は他のヌクレオチド、アミノ酸や蛋白質、炭水化物および脂質1を含めることができます。酵素の同種基板や基板の特徴酵素に類似度に基づく情報の解析が予測できる時が、実験による検証が必要です。同様に、その substrate(s) のレートでそれは蛍光体転送反応を触媒する酵素の親和性と共同の要因、阻害剤、または他の酵素のエフェクタの効果は実験的決定する必要があります。その他の ATP 消費の酵素を細菌の細胞質に存在して ATP 前駆体の枯渇を避けるため、定量的活性アッセイは浄化された蛋白質を要求します。
金属アフィニ ティー ・ クロマトグラフィー蛋白質の浄化は、文献2,3徹底的に覆われています。N- または C 末端の組換え蛋白質を追加 6 連続ヒスチジン残基から成るヒスチジン タグは、金属親和性クロマトグラフィー4,5,6による急速な浄化を許可します。これらのシーケンスが彼らは時々、タンパク質の安定性や酵素反応速度論7、8を変更すること、彼らは変更し、タンパク質の機能にほとんど影響を持つ通常のタンパク質に比べて小さいです。ヒスチジン タグで N と C-末端同じ蛋白質の問題の蛋白質の構造を知らなくても予測することは困難である、さまざまな効果を持つことができます。ヒスチジンのタグは、通常ケーブルをどちらかすぐに六つのヒスチジン残基をエンコードのプライマーを設計することによって、3' ATG 開始コドンにまたはすぐに 5' 停止コドンに開いたリーディング ・ フレームの組換え蛋白質のクローン作成中に組み込まれています。増幅後、hexahistidine を含む遺伝子は誘導性プロモーターの制御の下でベクトルに、大腸菌の実験室で、通常表されます。組換えタンパク質は、固定化の二価陽イオン (通常ニッケルまたはコバルト)9を含む親和性の樹脂で分離できます。ネイティブ金属結合蛋白質の汚染は、競争力のある連結蛋白質2を転置するイミダゾールを滴定法によって削除できます。最後に、ターゲット蛋白質はイミダゾールの高濃度の列から溶離されます。固定化金属陽イオン樹脂のいくつかの商業源があるし、メーカーは、バッファー条件とイミダゾールの集中のための推奨事項を提供します。溶出後タンパク質ナトリウム dodecyl 硫酸塩-ポリアクリルアミドゲル電気泳動 (SDS-PAGE) を用いて、透析、または機能の試金ですぐに使用します。
ATP のリン酸結合の加水分解を解放または励起、蛍光、化学発光を生成します 2 番目の反応に結合することによって直接にキナーゼ活動を監視する方法はいくつかありますが、これらの反応は複数の可動部が、することができます。ロジスティック困難である10。特に蛍光体転送アクティビティを測定する最も簡単な方法は直接の監視から市販の γ-32radiolabeled リン酸基の転送 -P、非標識基板11に NTP 前駆体,12,13。 標識基板と製品の混合物を分離および薄層クロマトグラフィー (TLC) による定量化できます。TLC は、毛管作用によって、溶質の混合物の吸着14をされている表面 (固相) に移行する溶媒 (液相) により溶媒中の溶質の差分のモビリティを利用しています。小さいや固相との良好な相互作用が不足する溶質移行より高い分子量またはソリッドの偉大な親和性と溶質それぞれ初期の場所から長い距離。蛍光体転送の検討、リン酸基は彼らを追加する、中性または酸性 pH11,12,14負イオン電荷を追加分子の分子量を増やします。これは PEI セルロースなどの基本的な面で自分たちのモビリティを減らします。酸性カリウム リン酸バッファーに開発され、モノ、ジ、トリ、テトラ-、pentaphosphate 種の混合物は、PEI セルロース、(図 2 図 3) 各種の定量化を可能に容易に分離できます。関心の酵素を含むセル lysates を使用してこのようなアッセイを行うことが、これは基板や製品を破壊する他のキナーゼ、ホスファターゼ、および一般的な Atpase の活動の可能性を含まれています。酵素活性の定量の in vitro評価、関心の酵素を浄化するために必要です。
グアノシン四リン酸 (ppGpp) とグアノシン pentaphosphate (pppGpp) は、リボヌクレオチド シグナリング分子、ピロリン酸の移動によって形成されたグループ アデノシン三リン酸 (ATP) の前駆体から、それぞれ、グアノシン二リン酸 (GDP) またはグアノシン四リン酸 (GTP) 基板15。(P) ppGpp と総称するこれらの単一リボヌクレオチド信号は、多様な細菌種15,16で厳格な応答として知られている環境ストレスへのセル全体の応答を仲介します。形成を触媒する酵素の 2 つの保存されたクラス (p) ppGpp15,17 Rel/Spo の相同物 (RSH) 酵素が 'long' 二官能性 (p) ppGpp 合成酵素/加水分解酵素関連やスポット (p) が彼らの類似の名前 ppGpp 代謝小さな alarmone 合成酵素 (SAS) 酵素がグラム陽性菌15,排他的に見られる短い単シンテターゼ、合成酵素、加水分解酵素、および規制のドメインを含む大腸菌由来の酵素17,18. 胞子形成グラム陽性菌クロストリジウム ・ ディフィシルは、RSH と SAS の推定の遺伝子19をエンコードします。C. ディフィシルRSH 酵素が触媒活性を示す (p) ppGpp 合成酵素であることを確認する初期活性測定法を紹介します。
プロトコル
1. 誘導ヒスチジン付けられた蛋白質過剰発現
- Difficile C. R20291 ゲノム DNA からrshを増幅します。
- 高品質なポリメラーゼを使用し、製造元の指示に従ってください。
- C. ディフィシル rshのプライマーを用いて増幅します。
rsh_F (カリフォルニア州GGTACCGGTTATATGCATGATAAAGAATTACAAG) と
rsh_R (CCCTGCAGCTAATGGTGATGGTGATGGTGATTTGTCATTCTATAAATAC)、C 末端 hexahistidine タグを紹介します。
注: KpnI とプライマー シーケンス内のサイトをカット PstI は、太字で表示されます。 - Pstl、KpnI 制限 45 分の 37 ° C でサイトをカット pMMBneo ベクトルとrsh his6 PCR の製品を消化します。
- 一直線に並べられたベクトルと agarose のゲルの電気泳動および DNA ゲル抽出キットのそれに続く浄化による PCR のフラグメントを浄化します。
- 280 nm の吸光度 (280) ベクターと増幅 PCR の製品を測定します。式を使用して
 各 DNA 断片の DNA 濃度を決定します。
各 DNA 断片の DNA 濃度を決定します。
- 式の pMMBneo にrshを縛る。
- 消化 PMMBneo ベクトル、125 の結合 25 ng rsh his6遺伝子産物、リガーゼ バッファー x 10 の 2 μ、1 μ L の DNA のリガーゼの ng。ヌクレアーゼ フリー水を使用すると、20 μ L に容量を調整できます。16 h 16 ° C で孵化させなさい。
注: 結紮術の有効性フラグメントのサイズに依存し、製造元プロトコルに基づいて調整する必要があります。 - 大腸菌dh 5 位 α またはプラスミッド メンテナンス系統別recA -結紮のベクトル積に変換します。100 μ g/mL カナマイシンと LB の版に変換されたセルを選択し、37 ° C で 16-24 時間インキュベート
- 変換プレート (s) から 4 つのコロニーをピックアップし、それぞれの DNA の隔離のための 100 μ g/mL カナマイシンを含む新鮮なプレート上を連勝します。16-24 h 37 ° C で新しい板をインキュベートし、後続の蛋白質の表現の 1 つの分離を選択します。
- そのままrsh蛋白質コード領域の結紮を確認するには、水の 20 μ L を選択したの植民地に分離の選択は 10 分 95 ° C で熱し、確証的遺伝子を増幅するために使用同じプライマーを用いた PCR のテンプレートとして使用します。
- 消化 PMMBneo ベクトル、125 の結合 25 ng rsh his6遺伝子産物、リガーゼ バッファー x 10 の 2 μ、1 μ L の DNA のリガーゼの ng。ヌクレアーゼ フリー水を使用すると、20 μ L に容量を調整できます。16 h 16 ° C で孵化させなさい。
- 高収量タンパク質生産のためのエシェリヒア属大腸菌BL21 システムにエシェリヒア属大腸菌細菌プラスミドの変換のための標準的な変形のプロトコルに従って検証されたプラスミドを変換します。
- エシェリヒア属大腸菌の RSH His6 を表現します。
- PMMBneo で形質転換大腸菌BL21 の単一コロニーを選択::rshと 50 μ g/mL カナマイシンと LB 培地 2 mL を接種します。37 ° C で 12-16 h 250 rpm で揺れながら。
- 一晩かけて培養細胞増殖とタンパク質発現のための 0.5 mL で 50 μ g/mL カナマイシンを含む LB 培地 500 mL に接種します。
- 37 ° C でインキュベーター シェーカー 250 rpm 式文化をインキュベート細胞密度、外径600 0.167 37 ° c に達するまで
- 30 ° C にインキュベーター温度を減らし、培養温度をドロップするための 30 分を待ちます。
- 0.5 mM の最終的な集中にイソプロピル β-D-thiogalactoside (IPTG) を追加することで RSH 式を誘導します。250 rpm で揺れ、30 ° C で一晩 (16-18 h) のための場所を取るに誘導を許可します。
- 4 ° C で 30 分間 3,080 × g で遠心分離によってペレットします。
メモ: ペレットは、蛋白質収量や酵素活性の顕著な損失なし翌日ターゲット蛋白質を浄化するための-20 ° C で一晩保存できます。
2 ニッケルのアフィニ ティー ・ クロマトグラフィーによって蛋白質の浄化
注: は、直接細胞ライセートを明確にした下記タンパク質精製の手順に進みます。格納する明らかに 4 ° C にて一晩後続タンパク質精製蛋白質収量が減少するため。
- 重力列に 1 mL のニッケル-Nitriloacetic 酸 (Ni NTA) 樹脂を使用して蛋白質を浄化します。
- 前日に使用、2 mL の平衡バッファー (10 mM トリス塩酸 pH 7.79、300 mM の NaCl、50 mM NaH2PO4、0.5 mg/mL リゾチーム、MgCl25 mM、10 mM のイミダゾール、0.25 mM DTT、5 mM phenylmethane スルホニル 4 ° C で一晩コラムを平衡させフッ化物 (PMSF) 10% グリセロール)。
- 次の日は、列をもたらす明らかにしを読み込む前に RT 4 ° C からライセートとそれの略 ~ 2-3 h。
注: は、列内で形作る空気泡を避けるために重要な熱平衡に列をもたらすことです。 - 換散バッファー (10 mM トリス塩酸 pH 7.8, 5 mM MgCl2、50 ミリメートル NaH2PO410% グリセロール、0.5 mg/mL リゾチームの 300 mM NaCl、10 mM のイミダゾール、0.25 mM DTT と 5 mM PMSF) の 1.3.6 のステップで得られたペレットを再懸濁します。
- 8 x 10 の間隔、30 を一時停止するため氷の上細胞を超音波パルス間 s。
- 遠心機を使用しての 4 ° C で 30 分間 3,080 × g で遠心分離によってライセートを明確に。
- 換散バッファーの平等なボリューム lysate を準備し、適用、準備中の列に lysate を明らかにし、フローを介して収集します。
- ライセート フロースルー列とセカンダリの流れを通して収集する適用を明らかに。
- 洗浄バッファー 1 (10 mM トリス-HCl (pH 7.79) 300 mM 5 mM MgCl2、50 ミリメートル NaH2PO4、30 mM のイミダゾール 10% グリセリン, 塩化ナトリウム) を洗い流します。流れを収集します。
注: 5 mM MgCl2洗うと溶出バッファー内の介在物は浄化された蛋白質の酵素の活動のために重要。 - 洗浄バッファー 2 (トリス-HCl (pH 7.79) 300 mM NaCl、5 mM MgCl2、50 ミリメートル NaH2PO4と 50 mM のイミダゾール 10 mM) を洗い流します。流れを収集します。
- 2 mL の溶出バッファー (トリス-HCl (pH 7.79) 300 mM 塩化ナトリウム、NaH2PO4、50 ミリメートル 10% グリセロールと 75 mM のイミダゾール 10 mM) を適用します。1 mL の 2 つの分数のフロースルーを収集します。
注: この手順後カラムは、同じタンパク質は次の浄化法で浄化される場合、4 ° C で平衡バッファーに格納します。列は、適切に保存されている場合 3 回まで使用できます。
- SDS-PAGE による純度の列の分数を評価します。
- 蛋白質の浄化の質的評価、170 V で 60 分 4/10% ポリアクリルアミドゲルの列のすべての分数の 20 μ 因数を実行します。
- 5 h、ベンチトップ ロッカーに穏やかに揺れるため室温で 0.1 %coomassie 青いゲルの汚れ。
- 40% メタノール、ベンチトップ ロッカーの揺動、室温で一晩 10% 氷酢酸で脱色します。
注:図 1の代表的なゲルの写真です。
- Dialyze 4 ° C で一晩 2 画分を溶出
- 1 mL の透析装置を用いた 20 kDa の分子量カットオフ (MWCO) 200: 1 の比率で透析バッファー (15.7 mM トリス-HCl (pH 7.6), 471.9 mM NaCl、15.69 mM MgCl2、1.57 mM DTT、1.5 mM PMSF、15.7% グリセロール) に対して dialyze します。
- 280 で吸光度を測定することにより透析蛋白質のサンプルの濃度を決定する nm と計算される分子吸光係数 82085 M-1cm-1 20を使用しています。
- 使用するまで因数-80 ° C で透析の蛋白質のサンプルの 5 μ 因数を格納します。
3. 薄層クロマトグラフィーによるタンパク質活性測定法
- 薄層クロマトグラフィーのプレートを準備します。
- 反応を実行する、前に準備ポリエチレンイミン (PEI)-脱イオン水洗浄によるセルロース板。~0.5 cm の深さに二重蒸留水とガラス室でプレートを配置します。
- プレートの上部に移行するために水を許可します。
注: 皿を洗うプレートがないとされることがありますが、洗濯は、結果の画像の鮮明さを向上は、厳密に必要はありません。さらに 2 つの垂直方向に板を洗浄により任意の汚染物質を樹脂の存在がプレート (図 2) の一角に分離されます。 - ガラス室からプレートを持参し、一晩の乾燥 (12-18 h) する卓上ラックに残します。
- サンプルを TLC に適用されますを示す柔らかい鉛筆で 1 つの端から 2.0 cm 乾板をマークします。2 μ L サンプル、適用サンプル 1.0 cm 以上離れて (図 2)。
メモ: これは信号定量化のために重大である隣接するスポット間の明確な分離をできます。セルロース樹脂は傷、小さい限り、表面に鉛筆マークが溶媒の移行を妨げない。 - 実験を計画するときは、常に未使用各プレートに 1 つのスポットを残します。
注: これはサンプルの定量化 (図 2) の空白のレーンを提供します。20 cm TLC プレート、19 点のための部屋があります。
- 酵素活性測定法
- 50 mM トリス-HCl (pH 7.5) 25 mM 10 mM KCl、1 mM DTT と 0.6 mM ATP 酢酸アンモニウムを含む 5 x バッファー ミックスを準備します。
注: このミックスが大量に用意して、後で使用のための 10 の μ 因数で冷凍します。複数の凍結融解にミックスを与えないでください。 - 3 μ M 1.2 mM MgCl21 x バッファー ミックス、0.6 mM、GDP、RSH を含む個々 の反応を準備します。Γ -32P ATP 反応の 10 μ L あたり 1.0 μCi を追加し、ヌクレアーゼ フリー水を使用して適切なボリュームまで反応をもたらします。ヌクレオチドを含むミックスに RSH の添加酵素活性アッセイを開始、他の成分が混合されている後に、RSH を追加します。
メモ: 最終的な反応体積が縦長サンプリングの数によって異なります。2 μ L/timepoint のサンプル、各 4 縦長の反応混合物の 10 μ L をアセンブルしてください。 - 汚染のヌクレアーゼ活性からの ATP 加水分解を制御するには、タンパク質を含まない 10 μ L 反応を組み立てるし、並列で孵化します。T で 2 μ L のサンプルを見つける = 0 と ATP を蛋白質の不在でなく加水分解したことを確認するための実験の終わりに。
- RSH の追加が、直ちに 2 μ L と t としてラベル付けされた PEI セルロース プレート上にスポット 0 分サンプルを =。
- 必要な縦長で 2 μ 因数を取り外し、37 ° C で反応を孵化させなさい。
注: 酵素活性はサンプルはセルロース プレートに吸着したときに停止します。最後のスポット完全な吸着とサンプルの乾燥を確実に開発する前にプレートを追加した後は、10-30 分を待ちます。
- 50 mM トリス-HCl (pH 7.5) 25 mM 10 mM KCl、1 mM DTT と 0.6 mM ATP 酢酸アンモニウムを含む 5 x バッファー ミックスを準備します。
- 薄層クロマトグラフィー
- クロマトグラフィーのチャンバーを 1.5 M 1.5 M KH2PO4 (pH 3.64) 0.5 cm の深さに。
注意: ボリュームがクロマトグラフィー タンクの寸法によって異なりますが必要があります。曲げず TLC プレートの挿入を許可するように十分な幅がレベル下で任意のガラス容器は、カバーの添加による現像槽として使用可能性があります。TLC プレートは、プラスチック フィルムで覆われているガラス ビーカーでの開発を可能にするきれいな黒人と狭いストリップにカットできます。 - 溶媒中でプレートの下端を浸します。プレート (〜 90 分) の上部に移行すること。
注意: 溶剤移行はプレートの上部に停止しますが、サンプルは失われたまたはより長い液浸の間に一緒に実行されません、プレート残さないように溶媒中で一晩。バッキング プレートからデタッチし、信号の損失につながる樹脂はめ込み 4 h よりも長い可能性があります。 - クロマトグラフィー タンクからプレートを削除し、卓上型物干しラックの上に置きます。
- 空気にプレートを一晩で乾燥できます。
注: は、ヘアー ドライヤーを使用して加速されることがあります乾燥します。乾燥は、濡れたとき暗くなります樹脂および完全に乾く未使用プレートの色に戻るの色によって評価できます。 - プレートを乾燥後、イメージングのカセットへの放射性物質の転送を避けるために、(図 3) オートラジオグラフィーによって分析プラスチック フィルムでプレートをラップします。
- クロマトグラフィーのチャンバーを 1.5 M 1.5 M KH2PO4 (pH 3.64) 0.5 cm の深さに。
- データ分析
- 室温で 4 h 用 phosphorimager カセットに区切られた反応を含む PEI セルロース プレートを公開します。
注: これは示された新鮮な γ-32P ATP 濃度を使用して非常に明確なイメージを生成するための十分な露出です。放射性標識基板の下の量を使用する場合 12-16 h に露光時間を増やせます。 - 画像は phosphorimager のカセット。
- イメージング ソフトウェアを使用すると、グラフィカル ユーザー インターフェイスと、四角形の描画を選択して長方形・ ロワ (図 3 車線内に約 1 つの全体の車線および ATP と ppGpp スポットを描画するマウスを使用して関心領域 (Roi) を描く).
- 選択、コピー、および貼り付けコマンド (または使用しているイメージング ソフトウェアに基づいて対応するコマンド) を使用して、Roi は、各レーンの同一エリア内の信号を測定できるように他の車線内で同一・ ロワを描画します。空白として使用される未使用レーンから Roi を含んでいます。
- 分析、を使用して |ツール |ROI マネージャー |追加イメージング ソフトウェアのコマンドは PEI セルロース プレートに描かれた陰影のすべてを選択します。
- 分析、を使用して |測定の設定 |メジャーコマンド、各 ROI 内の信号強度を定量化し、測定値をスプレッドシート (図 3) としてエクスポートします。実験的信号から空白の ROI 値を減算します。
- ATP と ppGpp の数式を使用に起因する各車線内でブランク信号の割合を計算します。

注: ・ ロワ描かれるかもしれません、商用ソフトウェア、phosphorimager と互換性のあるまたは自由に利用できる ImageJ ソフトウェア (健康の国民の協会) を使用して量的に表わされます。
- 室温で 4 h 用 phosphorimager カセットに区切られた反応を含む PEI セルロース プレートを公開します。
結果
クロストリジウム ・ ディフィシルとその酵素活性の評価から (p) ppGpp 合成酵素の親和性の浄化のための方法を提案する.金属アフィニ ティー ・ クロマトグラフィーにより蛋白質の浄化を図 1に示します。この精製から 2 番目の溶出 (E2) 分数は透析、酵素活性アッセイに使用します。図 2は、準備し、薄層クロマトグラフィーによる pyrophosphotransferase の試金を遂行するに必要な手順を説明します。図 3は、これらの実験からのデータを適切なブランキングと信号強度の割合への変換に重点を置いて測定する方法を示しています。図 4 a c. ディフィシル(p) ppGpp 合成酵素精製 RSH を使用して (p) ppGpp 合成酵素試金の代表的な TLC オートラジオグラフィーを提案する.初期のスポットの場所、ppGpp、ATP スポットは、radiolabeled 無機隣酸塩の微量を含んでいるために表示される、溶媒フロント同様、オートラジオグラフィーにはっきりと見えます。大きい分子量とより否定的なイオン電荷; 彼らが持っているより多くのリン酸基を持つ分子展示初期の場所から以下のモビリティ基本的な PEI セルロースに対する自分たちのモビリティの妨げになります。37 ° C で 120 分のコースで、ppGpp 蓄積 ATP の枯渇、反応合成酵素酵素に欠けている ATP の枯渇と ppGpp 蓄積が RSH図 4 aの存在下で容易に明らかでは無視)。図 4 bには、4 つの実験から絶対 ATP と ppGpp の信号が表示されます。図 4番組絶対信号図 4 bと同じデータは、総放射性信号のパーセンテージに変換されます。これは不正確なピペッティング エラーおよび/または放射性崩壊を最小限に、データの不確実性を導入することがなくプールに別の日に実験からのデータをできます。

図 1: RSH の親和性の浄化をニッケルします。ライセート (L) と誘導 BL21 pMMB の遠心のライセート (CL) を示す Coomassie ステンド SDS-PAGE ゲル::rsh his6だけでなく、フロースルー (FT)、1 (W1) を洗って、ニッケルのアフィニ ティー精製後 2、および溶出 (E1 と E2) 分数を洗います。E2 分数は透析され、それに続く酵素アッセイに使用します。分子量蛋白質のサイズの標準は、右側に表示されます。この図の拡大版を表示するのにはここをクリックしてください。
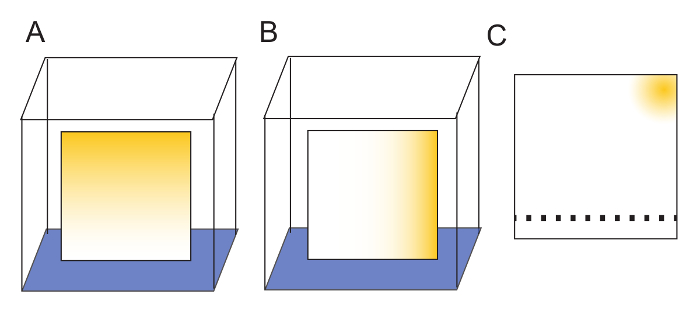
図 2: TLC プレートの準備。(A) 板は水 (青) の下端を配置することによって 1 つのディメンションで洗浄します。(黄色) の汚染物質は溶媒とプレートの上部に移行します。(B) 2 番目の次元の最初の洗浄を基準にして 90 ° 回転し、再びプレートの上部に移行する水によって洗浄したプレートが完全に乾燥した後。(C) 任意洗浄後の汚染物質は、プレートの 1 つのコーナーで分離されます。洗浄の TLC 板の樹脂は、サンプルの斑点を付けることを示す柔らかい鉛筆で優しくマーク可能性があります。2 μ L サンプル、最小スポット間 1 cm は適切なサンプルの分離になります。サンプルは、プレートの 『 どん底 』 から 2 cm 斑点を付けられます。サンプル アプリケーションでは後で任意の汚染物質が分離されている水洗浄によって 'トップ、' を実行する溶媒となっています。この図の拡大版を表示するのにはここをクリックしてください。

図 3: 信号を定量化します。合計を定義する興味 (ROIs) の地域は、ATP と ppGpp 信号は空レーンと実験レーンの表示されます。各空白の ROI 内の信号強度が実験値から減算され、ATP と ppGpp の信号が ATP と ppGpp に起因する総放射性信号の割合を示す方程式を用いて総信号に正規化されました。この図の拡大版を表示するのにはここをクリックしてください。
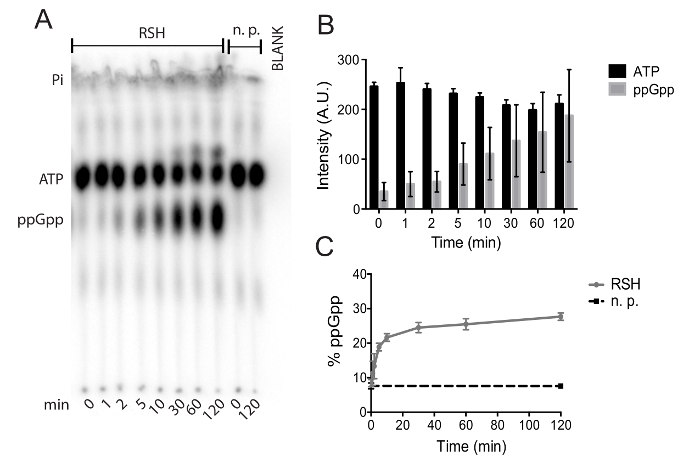
図 4。代表的な TLC プレートのオートラジオグラフィー: (A) を用いて反応の初期のスポット位置、ppGpp、ATP difficile C. RSH を精製した、この画像に溶媒フロントが示しています。コントロール反応蛋白質 (国立公園) が含まれていない空白のレーンにより、信号の正確な定量化しながら uncatalyzed ATP 加水分解反応の定量化が可能します。(B) 絶対信号強度 ATP と ppGpp difficile C. RSH の孵化の 120 分間。例は、手段と 4 つの独立実験の標準偏差です。(C) (B) から、ppGpp と同じデータ信号の総放射性信号のパーセント値を示します。ppGpp 蓄積反作用制御無しの蛋白質 (国立公園) では、黒で表示されます。例は、平均と標準偏差をそれぞれ 2 つの技術的な複製と 2 つの独立実験です。この図の拡大版を表示するのにはここをクリックしてください。
ディスカッション
ここで報告difficile C.から彼の付けられた RSH の浄化と radiolabeled 薄層クロマトグラフィーを用いた活動の定量化手法を提案します。このメソッドは、以前のdifficile C.、(p) ppGpp 合成酵素、ヌクレオチド酸シクラーゼ、キナーゼ diguanylate 酸シクラーゼ酵素と他の生物から11,12 ホスホジエステラーゼの酵素活性を評価するために使用されています ,,1321。メソッドは、小説ではない、それは多くのタイプの試金に広く適用し、我々 研究者が役立つことを願ってそのプレゼンテーション ビデオ形式で。
プロトコルの中で最も重要な手順は、蛋白質の浄化 (手順 2.1.3–2.1.10)、反応薄層クロマトグラフィー (手順 2.2 – 2.3)、準備とデータ解析 (ステップ 3.4)。我々 は、特に参考に次の変更を発見した: MgCl2ニッケル カラム精製 (手順 2.1.3–2.1.10) に使用されるバッファーの追加が浄化された蛋白質の酵素の活動のプレゼンテーションの重要な%ppgpp と酵素活性データ生成ではなく絶対 ppGpp の生産は、別の日に収集されたデータによりより別の γ-32P ATP は、一貫性のあります。このメソッドは、phosphorimager へのアクセスを任意の研究グループにアクセスできると、データ分析は簡単です。32P の割合として、phosphotransfer 活動を量的に表わすによって我々 ppGpp に変換、データの再現性を確保します。Γ-32P ATP または指定されたレーンで32P ppGpp の絶対量に大きな誤差を導入するわずかなピペッティング誤りの大きな潜在的可能性があるため、非常に小さな反応ボリューム PEI セルロース プレートに斑点を付けるが、TLC プレートが可能な形態間の放射性信号の分布は現在全信号の独立しました。さらに、指定されたレーンの総放射性信号できます γ-32P ATP の実験で使用されるの年齢によって決まります。32P は 14.3 日の半減期を持っている、独立した試金実行数日離れて検出された全放射性信号で相当な相違を示すことができるが、標識の ATP と ppGpp の相対的な量によって異なります酵素活性のみ。絶対 ppGpp のではなく 'パーセント ppGpp' としてデータの表示信号はピペッティング エラーまたは放射性崩壊からのランダム ノイズの導入を防ぎます。これは、例を図 4 bの違いをと4 C両方の手段と同じ 4 つの実験からのデータの標準偏差を表示が図 4のデータは、総放射性信号に正規化されています。
Difficile C. RSH 酵素が機能 ppGpp 合成酵素ある生体外で、ATP phosphodonor と GDP アクセプタからの迅速な pyrophosphotransfer の対応を定めています。この反応はマグネシウム、ATP とグアノシン バインディングを RSH 家族酵素22座標に依存します。含める、換散 5 mM MgCl2ニッケルのアフィニ ティー ・ クロマトグラフィーのメーカー プロトコルを変更しているし、洗浄バッファーとして溶出バッファー不在でマグネシウムの精製に有害であることを発見したので、浄化された蛋白質の酵素活性は。これは、マグネシウム イオンは、ヌクレオチド結合の不在でタンパク質の構造を安定させる非触媒の役割を果たすことが、さらに構造解析がこれを確認する必要がありますを示唆しています。
私たちの知る限り、この作業は ppGpp 合成difficile C.の最初の出版されたレポートは、し、この生物が細胞外ストレスを生き残るために (p) ppGpp による厳格な応答を利用する可能性が高いことを示します。(p) ppGpp 代謝は決して前にこの重要な人間の病原体で報告されています。(P) ppGpp を介したシグナル伝達がdifficile C.細胞の高ストレス耐性とdifficile C.の高い再発率の役割を果たす可能性があります可能性がありますそれは厳格な応答は、他の多くの病原体の永続性に関与している、ことを考える感染症23,24,25。
開示事項
著者はない競合する金銭的な利益やその他の利害の関係を宣言します。
謝辞
この作品は、NIAID 1K22AI118929-01 によって賄われていた。EBP はオールド ドミニオン大学、ノーフォーク、バージニア州、アメリカ合衆国での調査のオフィスから夏研究フェローシップ プログラム助成金によって支えられました。
資料
| Name | Company | Catalog Number | Comments |
| Inducible overexpression of a histidine-tagged protein | |||
| Phusion polymerase | New England Biolabs (NEB) | M0530L | |
| QIAEX II DNA Gel Extraction Kit | Qiagen | 20021 | |
| KpnI restriction enzyme | NEB | R0142S | |
| PstI restriction enzyme | NEB | R0140S | |
| T4 DNA ligase | NEB | M0202 | |
| NEB® 5-alpha Competent E. coli (High Efficiency) | NEB | C2987I | |
| BL21 (DE3) Competent E. coli | NEB | C2527I | |
| IPTG | Sigma-Aldrich | 10724815001 | |
| JXN-26 centrifuge with JLA 10.500 rotor | Beckman Coulter Avanti | - | |
| Microcentrifuge with D3024/D3024R rotor | Scilogex | - | |
| MaxQ SHKE6000 Incubator | Thermo Scientific | - | |
| Ultrasonic processor | Sonics | VC-750 | |
| Protein purification by nickel affinity chromatography | |||
| Ni-NTA resin | G Biosciences | 786-940/941 | |
| Pierce Disposable Gravity columns, 10 mL | Thermo Scientific | 29924 | |
| 1 mL Spectra/ Por float-A-lyzer G2 dialysis device (MWCO: 20-kD) | Spectrum | G235033 | |
| Mini-Protean Electrophoresis Cell | BioRad | 1658004 | |
| Protein activity assay by thin layer chromatography | |||
| Thin layer chromatograph (TLC) development tank | General Glass Blowing Company | 80-3 | |
| Polyethylenimine (PEI)-cellulose plates (20 cm x 20 cm, 100 μm thickness) with polyester support | Sigma-Aldrich | Z122882-25EA | |
| ATP, [γ-32P]- 3000 Ci/mmol 10mCi/ml lead, 100 μCi | Perkin Elmer | NEG002A | |
| Adenosine 5’-triphosphate (ATP) 100 mM | Bio Basic Canada | AB0311 | |
| Guanosine-5’-diphosphate disodium salt (GDP) | Alfa Aesar | AAJ61646MC/E | |
| Storage phosphor screen | GE Healthcare Life Sciences | BAS-IP TR 2040 E Tritium Screen | |
| Storm 860 phosphorimager | GE Healthcare Life Sciences | - |
参考文献
- Cheek, S., Ginalski, K., Zhang, H., Grishin, N. V. A comprehensive update of the sequence and structure classification of kinases. BMC Structural Biology. 5 (1), 6(2005).
- Porath, J. Immobilized metal ion affinity chromatography. Protein Expression and Purification. 3 (4), 263-281 (1992).
- Arnau, J., Lauritzen, C., Pedersen, J. Cloning strategy, production and purification of proteins with exopeptidase-cleavable His-tags. Nature Protocols. 1 (5), 2326-2333 (2006).
- Porath, J., Carlsson, J., Olsson, I., Belfrage, G. Metal chelate affinity chromatography, a new approach to protein fractionation. Nature. 258 (5536), 598-599 (1975).
- Smith, M. C., Furman, T. C., Ingolia, T. D., Pidgeon, C. Chelating peptide-immobilized metal ion affinity chromatography. A new concept in affinity chromatography for recombinant proteins. Journal of Biological Chemistry. 263 (15), 7211-7215 (1988).
- Graslund, S., et al. Protein production and purification. Nature Methods. 5 (2), 135-146 (2008).
- Booth, W. T., et al. Impact of an N-terminal Polyhistidine Tag on Protein Thermal Stability. ACS Omega. 3 (1), 760-768 (2018).
- Thielges, M. C., Chung, J. K., Axup, J. Y., Fayer, M. D. Influence of histidine tag attachment on picosecond protein dynamics. Biochemistry. 50 (25), 5799-5805 (2011).
- Chaga, G. S. Twenty-five years of immobilized metal ion affinity chromatography: past, present and future. Journal of Biochemical and Biophysical Methods. 49 (1-3), 313-334 (2001).
- Ma, H., Deacon, S., Horiuchi, K. The challenge of selecting protein kinase assays for lead discovery optimization. Expert opinion on drug discovery. 3 (6), 607-621 (2008).
- Tamayo, R., Tischler, A. D., Camilli, A. The EAL domain protein VieA is a cyclic diguanylate phosphodiesterase. Journal of Biological Chemistry. 280 (39), 33324-33330 (2005).
- Purcell, E. B., McKee, R. W., McBride, S. M., Waters, C. M., Tamayo, R. Cyclic Diguanylate Inversely Regulates Motility and Aggregation in Clostridium difficile. Journal of Bacteriology. 194 (13), 3307-3316 (2012).
- Purcell, E. B., Tamayo, R. Identification and characterization of cyclic nucleotide phosphodiesterases. Methods in Molecular Biology. 1016, 235-243 (2013).
- Ross, P., et al. Control of cellulose synthesis Acetobacter xylinum. A unique guanyl oligonucleotide is the immediate activator of the cellulose synthase. Carbohydrate Research. 149 (1), 101-117 (1986).
- Potrykus, K., Cashel, M. (p)ppGpp: still magical? Annual Review of Microbiology. 62, 35-51 (2008).
- Boutte, C. C., Crosson, S. Bacterial lifestyle shapes stringent response activation. Trends in Microbiology. 21 (4), 174-180 (2013).
- Nanamiya, H., et al. Identification and functional analysis of novel (p)ppGpp synthetase genes in Bacillus subtilis. Molecular Microbiology. 67 (2), 291-304 (2008).
- Gaca, A. O., et al. Basal Levels of (p)ppGpp in Enterococcus faecalis: the Magic beyond the Stringent Response. mBio. 4 (5), (2013).
- Sebaihia, M., et al. The multidrug-resistant human pathogen Clostridium difficile has a highly mobile, mosaic genome. Nature Genetics. 38 (7), 779-786 (2006).
- Gasteiger, E., et al. ExPASy: The proteomics server for in-depth protein knowledge and analysis. Nucleic Acids Research. 31 (13), 3784-3788 (2003).
- Purcell, E. B., et al. A nutrient-regulated cyclic diguanylate phosphodiesterase controls Clostridium difficile biofilm and toxin production during stationary phase. Infection and Immunity. , (2017).
- Mechold, U., Murphy, H., Brown, L., Cashel, M. Intramolecular Regulation of the Opposing (p)ppGpp Catalytic Activities of RelSeq, the Rel/Spo Enzyme from Streptococcus equisimilis. Journal of Bacteriology. 184 (11), 2878-2888 (2002).
- Dalebroux, Z. D., Svensson, S. L., Gaynor, E. C., Swanson, M. S. ppGpp Conjures Bacterial Virulence. Microbiology and Molecular Biology Reviews. 74 (2), 171-199 (2010).
- Bartlett, J. G. Clostridium difficile: progress and challenges. Annals of the New York Academy of Sciences. 1213, 62-69 (2010).
- US Department of Health and Human Services. , Centers for Disease Control and Prevention, US Department of Health and Human Services. Atlanta, GA. (2013).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved