Method Article
艰难梭菌(p) pppp 合成酶的纯化及体外活性测定
摘要
本文介绍了一种纯化带组氨酸标记的热释蛋白酶的方法, 并利用放射性标记底物和产物的薄层色谱法测定了体外的酶活性。酶活性测定广泛适用于任何激酶、核苷酸循环酶或磷转移反应, 其机理包括三磷酸核苷酸水解。
摘要
激酶和焦磷酸激酶酶将磷酸伽玛或β-焦磷酸钙基团从三磷酸核苷酸前体转移到底物, 以产生磷酸化产物。使用γ-32-p标记的 ntp 前体可以通过射线成像同时监测基板的利用率和产品的形成。纤维素板上的薄层色谱 (tlc) 允许对底物和产品进行快速分离和敏感定量。我们提出了一种利用薄层色谱法测定纯化 (p) pppp 合成酶的热磷酸酶活性的方法。这种方法以前曾被用来表征循环核苷酸和二核苷酸合成酶的活性, 广泛适用于表征水解三磷酸核苷酸键或转移末端的任何酶的活性磷酸盐从磷酸盐供体到另一个分子。
引言
激酶和焦磷酸激酶 (或二磷酸激酶) 酶将磷酸酯从三磷酸核苷酸 (ntp) 前体转移到底物分子。底物可以包括其他核苷酸、氨基酸或蛋白质、碳水化合物和脂质1。生物信息学分析有时可以根据与表征酶的相似性预测酶的同源基底物或底物, 但实验验证仍然是必要的。同样, 必须通过实验确定酶对底物的亲和力及其催化磷转移反应的速度, 以及共同因素、抑制剂或其他酶效应的影响。为了避免细菌细胞质中其他消耗 atp 的酶消耗 atp 前体的消耗, 定量活性检测需要纯化的蛋白质。
用金属亲和层析纯化蛋白质已在文献2,3中得到了深入的报道。组氨酸标记由六个连续的组氨酸残基附加到重组蛋白的 n-或 c 末端允许通过金属亲和层析 4,5,6快速纯化。这些序列与它们修饰的蛋白质相比很小, 通常对蛋白质功能的影响很小, 尽管它们有时会改变蛋白质的稳定性和/或酶动力学7,8.同一蛋白质的 n-和 c 端部的组氨酸标记可以产生不同的效果, 如果不知道所涉及的蛋白质的结构, 就很难预测。组氨酸标记通常是在重组蛋白克隆过程中采用的, 方法是设计编码6个组氨酸残基的引物, 或者立即 3 ' 到 atg 启动密码子, 或者立即 5 ' 到开放阅读框架的停止密码子。扩增后, 含有六分苷的基因在诱导启动子的控制下被连接成载体并表达, 通常是在大肠杆菌的实验室菌株中表达的。然后, 重组蛋白可以在含有固定化二价阳离子 (通常是镍或钴)的亲和树脂上分离9。用咪唑滴定法可以去除污染原生金属结合蛋白, 从而有竞争力地取代结合蛋白2。最后, 目标蛋白从浓度较高的咪唑柱中洗脱。固定化金属阳离子树脂有多种商业来源, 制造商为缓冲条件和咪唑浓度提供建议。洗脱后, 蛋白质可通过十二烷基硫酸钠-聚丙烯酰胺凝胶电泳 (sds-page) 进行分析, 进行透析, 或立即用于功能分析。
有几种方法可以通过将 atp 磷酸盐键水解与释放或激发荧光或产生化学发光的第二反应相结合来间接监测激酶活性, 但这些反应具有多个运动部件, 并且可以是后勤上具有挑战性10。专门测量磷转移活性的最直接方法是直接监测放射性标记磷酸盐基团从市售的γ-32-pntp 前体转移到非放射性标记基板 11的情况,12,13. 放射性标记基板和产品的混合物可以用薄层色谱法 (tlc) 进行分离和定量。薄层色谱利用溶质在给定溶剂中的不同流动性, 允许溶剂 (液相) 通过毛细管作用在表面 (固相) 上迁移, 在表面上吸附了溶质混合物14。与分子量较高或与固体有很大亲和力的溶质相比, 小的溶质与与固相缺乏良好的相互作用, 它们的迁移距离将更长。为了检测磷的转移, 磷酸盐分子增加了分子的分子量, 并在中性或酸性 ph 值11,12,14时添加负离子电荷。这降低了它们在基本表面 (如 pei-纤维素) 上的流动性。在酸性磷酸钾缓冲液中开发时, 单、二、三、四、五磷酸五甲酸盐的混合物可以在 pei 纤维素上很容易分离, 从而能够对每个物种进行定量 (图 2, 图 3)。这种检测可以使用含有感兴趣酶的细胞裂解物进行, 但这包括其他激酶、磷酸酶和一般 atpase 的活性耗尽底物和/或产品的可能性。为了对酶活性进行体外定量评估, 有必要对感兴趣的酶进行纯化。
鸟苷四磷酸酯 (ppgpp) 和 guanosine pentapph0fate (pppgpp) 是由焦磷酸基团从三磷酸腺苷 (atp) 前体转移到磷酸 guanosine (gdp) 或鸟苷四磷酸酯 (gtp) 基板15。这些单一的核糖核酸信号, 统称为 (p) ppgpp, 介导了细胞范围内对环境压力的反应, 被称为在不同细菌物种15,16的严格反应。两类保守的酶催化 (p) ppgpp15、17 Rel/Spo homolog (rsh) 酶的形成, 是 "长" 双功能 (p) ppgpp synthaseasepaseasep 水解酶, 其命名与 rela 和 spot (p) ppgpp 代谢相似大肠杆菌中含有合成酶、水解酶和调节域的酶, 而小的 alarmone 合成酶 (sas) 酶是短的单功能合成酶, 专门存在于 gram 阳性菌15中,17,18. 形成孢子的革兰氏阳性细菌艰难梭菌编码假定 rsh 和 sas 基因19。在这里, 我们提出的初始活性检测, 证实艰难梭菌rsh 酶是一种催化活性 (p) ppgpp 合成酶。
研究方案
1. 被 histidin-getl 标记的蛋白的诱导过度表达
- 从艰难梭菌r20291 基因组 dna 中扩增 rsh.
- 使用高保真聚合酶, 并按照制造商的说明进行操作。
- 使用引物放大艰难梭菌
rsh _ f (caggtacc gttattatatataagattacaag) 和
rsh _ r (cc ctgcagctaggggggggggggggggggtgttcatttaittataac), 它引入了一个 c 端的六角替丁标签。
注: 引物序列中的 kpni 和 psti 切割站点是带粗的。 - 在37°c 条件下, 用 pstl 和 kpni 限制切割位点消化 pmmbneo 载体和rsh-his6 pcr 产物45分钟。
- 通过琼脂糖凝胶电泳纯化线性化载体和 pcr 片段, 并随后使用 dna 凝胶提取试剂盒进行纯化。
- 测量该载体的280纳米吸收率 (a280) 和扩增的 pcr 产物。使用该方程
 来确定每个 dna 片段的 dna 浓度。
来确定每个 dna 片段的 dna 浓度。
- 将rsh 配入 pmmbneo 进行表达。
- 结合消化后的 pmmbneo 载体的 25 ng、 rsh-his6基因产物的 125 ng、10x 连接酶缓冲液的2μl 和 dna 连接酶的1μl。使用无核酸酶水将总体积调整为20μl。在16°c 下孵化16小时。
注: 结扎的效果取决于片段大小, 必须根据制造商协议进行调整。 - 将结扎的载体产物转化为大肠杆菌dh5-α或其他再质粒维持菌株。选择100μgml 卡那霉素板上的转化细胞, 并在37°c 下孵育16–24小时。
- 从转化板中选取四个菌落, 并在含有100μgml 卡那霉素的新鲜板上各选择四个菌落, 以便进行 dna 分离。在37°c 下培育新的板16-24 小时, 并为随后的蛋白质表达选择一个分离体。
- 为了确认完整 rsh 蛋白编码区域的成功结扎, 请将所选择的分离物的菌落放入20μl 的水中, 在95°c 下加热 10分钟, 并使用用于扩增该基因的相同引物作为确认 pcr 的模板。
- 结合消化后的 pmmbneo 载体的 25 ng、 rsh-his6基因产物的 125 ng、10x 连接酶缓冲液的2μl 和 dna 连接酶的1μl。使用无核酸酶水将总体积调整为20μl。在16°c 下孵化16小时。
- 根据大肠杆菌细菌质粒转化标准转化方案, 将经验证的质粒转化为大肠杆菌bl21 系统, 用于高产蛋白质生产。
- 大肠杆菌中的快速 rsh-hs6.
- 选择用 pmmbneo 转化的大肠杆菌 bl21 的单菌落:: rsh , 用50μgml 卡那霉素接种 lb 培养基2毫升。在 37°c 12-16小时内孵化, 在250转/分晃动。
- 接种含有50μgml 卡那霉素的 lb 培养基500毫升, 隔夜培养 0.5 ml 用于细胞生长和蛋白质表达。
- 在37°c 和250转/分的孵化器振动台孵育表达培养, 直到细胞密度在37°c 时达到 od600 0.167。
- 将孵化器温度降低到 30°c, 等待30分钟才能使培养温度下降。
- 在最终浓度为 0.5 mm 的情况下, 加入异丙基β-d-硫代丙酸 (iptg), 从而促进 rsh 的表达。允许感应在30°c 下进行一夜 (16-18小时), 在250转/分的情况下晃动。
- 在 3,080 x 克离心, 在4°c 下30分钟的离心。
注: 颗粒可在-20°c 下过夜储存, 以便第二天纯化目标蛋白, 而不会明显丧失蛋白质产量或酶活性。
2. 镍亲和层析法纯化蛋白质
注: 澄清细胞裂解液后, 请直接继续进行下面提供的蛋白质纯化步骤。在4°c 过夜储存澄清的裂解液, 进行后续的蛋白质纯化, 可降低蛋白质产量。
- 在重力柱上使用1毫升镍-硝基乙酸 (ni-nta) 树脂纯化蛋白质。
- 使用前一天, 在4°c 条件下将色谱柱与2毫升平衡缓冲液 (10 mm Tris-HCl ph 7.79) 平衡后进行平衡, 300 mL 氯化萘, 50 mL nah2po 4,0.5 mg/ml 溶菌酶, 5 mL mmcl2, 10 mL 咪唑, 0.25 mL dtt, 5 毫米苯基甲烷磺胺基氟化物 (pmsf), 10% 甘油)。
- 第二天, 在装载澄清的裂解液之前, 将色谱柱从4°c 带到 rt, 并让它代表 ~ 2-3小时。
注: 使柱达到热平衡是至关重要的, 以避免气泡形成在列内。 - 在裂解缓冲液中1.3.6 的步骤中重新使用颗粒 (10 mm tris-hcl ph 7.8, 300 mm nocl, 5 mm mgcl2, 50 mm nah 2 po 4, 10% 甘油, 0.5mgml 溶菌酶, 10 mm 咪唑, 0.25 mm dtt 和 5 mm pmf)。
- 冰上的三联细胞间隔为 8 x 10秒, 在脉冲之间间隔30秒。
- 用微型离心机在4°c 条件下, 在 3, 080 x g 的离心时澄清裂解液, 时间为30分钟。
- 用等量的裂解缓冲液制备裂解液, 然后将准备好的澄清裂解液应用于色谱柱, 并收集流动液。
- 重新应用澄清裂解液流经柱, 并收集二次流经。
- 用洗涤缓冲液 1 (10 mm tris-hcl (ph 值 7.79))、300 mm ncl、5 mm mgcl 2、50 mm nah2po4、30 mm 咪唑、10% 甘油清洗柱.收集流经。
注: 在洗涤和洗脱缓冲液中加入 5 mm mgcl2对于纯化蛋白质的酶活性非常重要。 - 用洗涤缓冲液 2 (10 mm tris-hcl (ph 值 7.79)、300 mm ncl、5 mm mgcl2、50 mm nah2 po 4和 50 mm imidazole) 清洗色谱. 收集流经。
- 使用2毫升洗脱缓冲液 (10 mm tris-hcl (ph 值 7.79), 300 mm ncl, 50 mm nah 2 po4,10% 甘油和 75 mm 咪唑)。收集流经两个分数, 每个分数为1毫升。
注: 如果在下一次纯化试验中将纯化相同的蛋白质, 则此步骤后的色谱柱可以储存在4°c 的平衡缓冲液中。如果存储得当, 该列最多可以使用3次。
- 通过 sds-page 评估柱的纯度。
- 为了定性地评估蛋白质纯化, 在170v 时, 在 4%/10% 的聚丙烯酰胺凝胶上运行所有色谱的 20μl aliquots。
- 在室温下涂上0.1% 的库马西蓝色凝胶, 在台式摇椅上轻轻摇晃。
- 在40% 的甲醇中, 在室温下隔夜使用10% 的冰醋酸, 在台式摇杆上摇晃凝胶。
注:图 1显示了具有代表性的凝胶。
- 在4°c 下过夜透析长笛分数2。
- 透析缓冲液透析 (15.69 mm Tris-HCl (ph 7.6), 471 mm ncl、15.69 mm mgcl 2、1.57 mm dtt、1.5 mm pmsf 和15.69 甘油), 采用200x:1 的比例, 使用具有 20 kda 分子量截止 (mwco) 的 1 ml 透析装置。
- 通过测量280纳米的吸收率, 并使用计算出的摩尔消光系数 82085 m-1厘米-1 20 来确定透析蛋白样品的浓度。
- 在-80°c 的温度下, 将透析蛋白样品的 5μl aliquots 储存在 aliquots 中, 直至使用。
3. 薄层色谱法测定蛋白质活性
- 制备薄层色谱板。
- 在进行反应之前, 在去离子水中洗涤, 制备聚乙烯烯胺 (pei) 纤维素板。将板材放入具有双蒸馏水的玻璃室中, 深度约为0.5 厘米。
- 让水迁移到板的顶部。
注: 清洗板材并不是绝对必要的, 因为板材可能在没有它的情况下使用, 但清洗确实会提高生成图像的清晰度。在两个垂直方向清洗板材进一步确保了树脂中存在的任何污染物都被隔离在板材的一个角落 (图 2)。 - 将板材从玻璃室中取出, 放在台式机架上过夜 (12–18小时)。
- 用柔软的铅笔将干板从一个边缘标记2.0 厘米, 以表明样品将应用于薄层色谱的位置。对于2μl 样品, 应用相距不小于1.0 厘米的样品 (图 2)。
注: 这允许相邻点之间的清晰分离, 这对于信号量化至关重要。只要纤维素树脂不被划伤, 表面上的小铅笔痕迹就不会干扰溶剂的迁移。 - 在计划实验时, 总是在每个板材上留下一个未使用的位置。
注: 这将为样品量化提供一个空白通道 (图 2)。一个20厘米的薄层色谱板将有19个斑点的空间。
- 酶活性测定
- 制备5倍缓冲液, 其中包含 50 mm tris-hcl (ph 7.5)、25 mm 醋酸铵、10 mm kcl、1 mm dtt 和 0.6 mm atp。
注: 这种混合物可以大量制备, 冷冻在10μl 的等价物中, 供以后使用。不要将混合物混合在多个冻融周期中。 - 准备含有 3μm rsh、1x 缓冲液、0.6 mm gdp、1.2 mm mgmcl2的个别反应。每10μl 反应加入10μμi的γ-32 p-atp, 并使用无核酸酶水将反应提高到所需的体积。在其他成分混合后加入 rsh, 因为在含核苷酸的混合物中加入 rsh 会启动酶活性测定。
注: 最终反应量将取决于采样的时间点数。要对2μl 时间点进行采样, 请为每个4个时间点组装10μl 的反应混合物。 - 为了控制 atp 水解对污染核酸酶活性的影响, 组装一个不含蛋白质的10μl 反应, 并同时孵育。在 t = 0 和实验结束时发现2μl 样品, 以确保 atp 在没有蛋白质的情况下不会水解。
- 添加 rsh 后, 立即取出 2μl, 并将其作为 t = 0分钟样品插入标记为 pei-纤维素板。
- 在37°c 下培养反应, 在所需的时间点去除2μl 的等价物。
注: 当样品吸附在纤维素板上时, 酶活性将停止。在最后一个点被添加到板上后等待10–30分钟, 然后再开发, 以确保完全吸附和样品干燥。
- 制备5倍缓冲液, 其中包含 50 mm tris-hcl (ph 7.5)、25 mm 醋酸铵、10 mm kcl、1 mm dtt 和 0.6 mm atp。
- 薄层色谱
- 在色谱室中填充 1.5 m 1.5 m khkh 2 po 4 (ph 值 3.64), 深度为0.5 厘米。
注: 所需的体积将取决于色谱槽的尺寸。任何水平底部足够宽, 可以在不弯曲的情况下插入薄层色谱板的玻璃容器, 都可以作为开发中的罐, 并增加一个盖子。薄层色谱板可以用干净的剃须刀切割成更窄的条带, 以便在覆盖在塑料薄膜上的玻璃烧杯中进行开发。 - 将板材的底部边缘浸入溶剂中。允许溶剂迁移到板顶部 (~ 90分钟)。
注: 虽然溶剂迁移将停止在板的顶部, 样品不会丢失或一起运行在较长的浸入过程中, 板不应留在溶剂过夜。超过4小时的浸入会导致树脂从板背上分离, 导致信号丢失。 - 从色谱槽中取出板材, 并将其放置在台式晾衣架上。
- 让盘子连夜风干。
注: 使用吹风机可能会加速干燥。干燥可以通过树脂的颜色来评估, 树脂在潮湿时会变暗, 完全干燥时又会恢复到未使用的板材的颜色。 - 板材干燥后, 将板材包裹在塑料薄膜中, 以避免放射性物质转移到成像盒中, 并通过自动摄影进行分析 (图 3)。
- 在色谱室中填充 1.5 m 1.5 m khkh 2 po 4 (ph 值 3.64), 深度为0.5 厘米。
- 数据分析
- 在室温下, 将含有分离反应的 pei 纤维素板暴露在室温下4小时。
注: 这足以暴露, 以产生一个非常清晰的图像使用所指示的浓度新鲜γ-amp-atp。如果使用较低数量的放射性标记基板, 曝光时间可增加到12-16小时。 - 将盒式磁带成像在荧光象仪上。
- 使用带有图形用户界面的成像软件, 通过选择"绘制矩形"并使用鼠标在整个车道和该车道中包含的 atp 和 ppgpp 点周围绘制矩形 roi 来绘制感兴趣的区域 (roi) (图 3)).
- 使用"选择"、"复制" 和 "粘贴"命令 (或基于所使用的成像软件的相应命令) 在其他车道内绘制相同的 roi, 以确保 roi 在每个通道的相同区域内测量信号。包括未使用车道上的 roi, 用作空白。
- 使用分析工具类投资回报经理添加成像软件的命令, 选择在 pei 纤维素板上绘制的所有 roi。
- 使用分析设置测量测量命令, 量化每个 roi 中的信号强度, 并将测量导出为电子表格 (图 3)。从实验信号中减去空白 roi 值。
- 使用公式计算每个车道内的空白信号可归因于 atp 和 ppgpp 的百分比

注: 可使用与磷成像仪兼容的商业软件或免费提供的 imagej 软件 (国家卫生研究院) 对 roi 进行绘制和定量。
- 在室温下, 将含有分离反应的 pei 纤维素板暴露在室温下4小时。
结果
我们提出了一种方法的亲和力纯化 a (p) pppp 合成酶从艰难梭菌和评估其酶活性。图 1显示了金属亲和层析法实现的蛋白质纯化。对该纯化的第二洗脱 (e2) 组分进行透析, 用于酶活性测定。图 2详细说明了用薄层色谱法制备和实施热磷化酶检测的必要步骤。图 3说明了这些实验中的数据是如何量化的, 重点是适当的空白和将信号强度转换为百分比。在图 4 a中, 我们提出了一个具有代表性的 tlc 自体物谱 a (p) pppp 合成酶检测使用纯化 rsh, 艰难梭菌(p) ppgpp 合成酶。最初的斑点位置, ppgpp 和 atp 斑点是清楚地可见的自动状物, 是可见的溶剂前, 因为它包含微量的放射性标记无机磷酸盐。具有较多磷酸分子的分子表现出较少的流动性, 从最初的点位置, 因为他们有更大的分子量和更多的负离子电荷;这阻碍了他们在基本的 pei 纤维素上的流动性。在37°c 的120分钟时间内, 在缺乏合成酶酶的反应中, ppgpp 积累和 atp 消耗可以忽略不计, 而 atp 消耗和 ppgpp 积累在 rsh图 4a的存在下都很明显。图 4b显示了四个实验的绝对 atp 和 ppgpp 信号。图 4c显示了与图 4 b 相同的数据, 其绝对信号转换为总放射性信号的百分比。这最大限度地减少了由于移液错误和放射性衰变造成的不准确性, 并允许将在不同日期进行的实验中的数据汇集在一起, 而不会给数据带来不确定性。

图 1: rsh 的镍亲和力纯化.一种显示诱导 bl21 pmmb 的裂解液 (l) 和离心裂解液 (cl) 的库玛酸染色 sds-page 凝胶:rsh-his6以及通过 (ft)、洗涤 1 (w1)、洗涤2和洗脱 (e1 和 e2) 组分后, 镍亲和力纯化。e2 组分经过透析, 用于随后的酶检测。右侧显示了蛋白质大小标准的分子权重。请点击这里查看此图的较大版本.
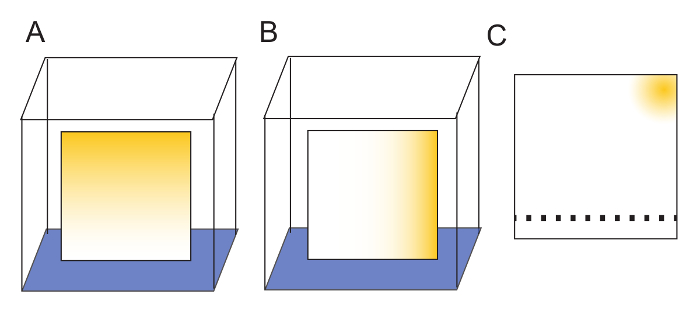
图 2: 薄层色谱板的制备.(a) 将底板置于水中 (蓝色), 以一维清洗板材。污染物 (黄色) 随溶剂迁移到板顶部。(b) 板完全干燥后, 通过相对于第一次清洗旋转 90°, 并再次允许水迁移到板顶, 将其在第二维度中清洗。(c) 洗涤后, 任何污染物都被隔离在板的一个角落。清洗后的薄层色谱板的树脂可以用柔软的铅笔轻轻标记, 以指示样品应在何处被发现。对于2μl 样品, 在斑点之间至少有1厘米的距离将确保充分的样品分离。样品距离盘子的 "底部" 有2厘米的地方。样品应用后, 溶剂可以运行到 "顶部", 在那里, 任何污染物都将被洗水隔离。请点击这里查看此图的较大版本.

图 3: 信号量化.定义总计、atp 和 ppgpp 信号的感兴趣区域 (roi) 显示为空白车道和实验车道。从实验值中减去每个空白 roi 中的信号强度, 并使用所示方程将 atp 和 ppgpp 信号归一化为总信号, 以表示可归因于 atp 和 ppgpp 的总放射性信号的百分比。请点击这里查看此图的较大版本.
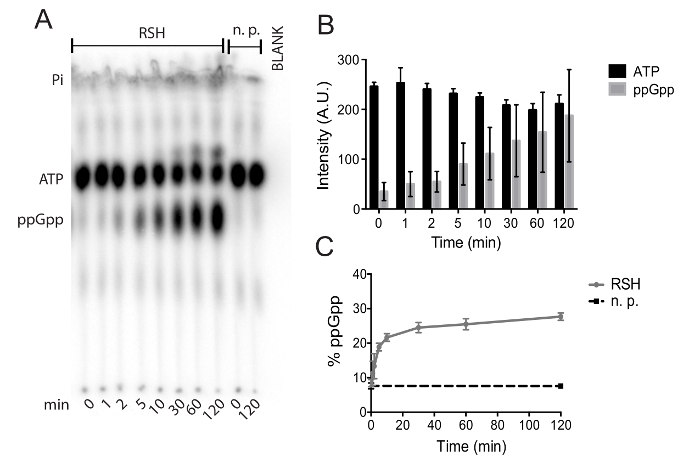
图4。具有代表性的 tlc 板的 autoradidateat: (a) 此图像显示了使用纯化的艰难喷铬 rsh进行的反应的溶剂前、atp、ppgpp 和初始现货位置。不含蛋白质 (n. p.) 的控制反应允许定量的未经催化的 atp 水解, 而空白车道允许准确的信号定量。(b)艰难梭菌rsh 孵育120分钟期间 atp 和 ppgpp 的绝对信号强度。显示了四个独立实验的手段和标准差。(c) 来自 (b) 的数据与 ppgpp 信号的百分比相同。ppgpp 在无蛋白质 (n. p. p.) 控制反应中的积累表现为黑色。显示的是两个独立实验的手段和标准偏差, 每个实验都有两个技术复制。请点击这里查看此图的较大版本.
讨论
本文报道了艰难梭菌中 hs 标记 rsh 的纯化过程, 并提出了一种利用放射性标记薄层色谱法进行活性定量的方法。这种方法以前曾被用来评估艰难梭菌的二瓜酸环化酶的活性, 以及来自其他生物体的 ppgpp 合成酶、核苷酸循环酶、激酶和磷酸二酯酶的活性11,12 ,13,21。虽然这种方法并不新颖, 但它广泛适用于许多类型的检测, 我们希望研究人员能发现它以视频格式的呈现是有帮助的。
协议中最关键的步骤是蛋白质纯化 (步骤 2.1.3 2.1.10)、薄层色谱反应准备 (第2.2–2.3 步) 和数据分析 (步骤 3.4)。我们发现以下修改特别有帮助: 在用于镍柱纯化的缓冲液中添加 mgcl2 (步骤 2.1.3 2.1.10) 对于纯化蛋白质的酶活性至关重要, 并介绍产生的酶活性数据为% ppgpp, 而不是产生的绝对 ppgpp, 可确保在不同日期收集的数据, 不同的γ-32p-atp 是一致的。任何可以访问磷成像仪的研究小组都可以使用这种方法, 数据分析也很简单。通过将磷化活动的百分比计算为转换为 ppgpp 的 32 p, 我们确保了数据的重现性。由于 pei 纤维素板上发现的反应量非常小, 因此在给定的车道上, 轻微的移液误差很有可能导致γ-32p-atp 或32p-ppgpp 的绝对数量出现重大误差。在 tlc 板上, 但可能形式之间的放射性信号分布与存在的总信号无关。此外, 给定车道上的总放射性信号可能取决于实验中使用的γ-32p-atp 的年龄。32p 的半衰期为 14.3天, 因此间隔几天进行的独立检测可以显示检测到的总放射性信号有很大差异, 但放射性标记 atp 和 ppgpp 的相对数量仅取决于酶活性。将数据呈现为 "百分比 ppgpp" 而不是绝对 ppgpp 信号可防止随机噪声的引入, 从而防止移液错误或放射性衰变。图 4b 和4B之间的差异就说明了这一点。两者都显示了来自相同四个实验的数据的手段和标准偏差, 但图 4c中的数据已归一化为总放射性信号。
我们已经确定, 艰难梭菌rsh 酶是一种功能性 pppp 合成酶在体外, 能够快速焦磷从 atp 磷和 gdp 受体转移。这种反应依赖于镁, 镁通过 rsh 家族酶22来协调 atp 和鸟苷的结合。我们修改了镍亲和层析的制造商协议, 在裂解和洗涤缓冲液以及洗脱缓冲液中加入了 5 mm mgcl2 , 因为我们发现, 在没有镁的情况下进行纯化对纯化蛋白的酶活性。这表明镁离子可能在没有核苷酸结合的情况下在稳定蛋白质结构方面发挥非催化作用, 但需要进一步的结构表征来证实这一点。
据我们所知, 这项工作是第一个发表的报告 ppgpp 合成在艰难梭菌, 并表明这种生物体很可能利用 (p) pppp 介导的严格反应, 以生存细胞外应激。(p) 在这种重要的人类病原体中, 以前从未报道过 ppgpp 代谢。鉴于严格的反应与许多其他病原体的持久性有关, 因此, ppp 介导的信号可能会对艰难梭菌细胞的高应激耐受性和艰难梭菌的高复发率起到一定作用。感染23,24,25。
披露声明
提交人声明没有相互竞争的经济利益或其他利益冲突。
致谢
这项工作由 niaid 1k22ai118929-01 资助。ebp 得到了美国弗吉尼亚州诺福克郡老多米尼翁大学研究办公室的暑期研究研究金计划赠款的支持。
材料
| Name | Company | Catalog Number | Comments |
| Inducible overexpression of a histidine-tagged protein | |||
| Phusion polymerase | New England Biolabs (NEB) | M0530L | |
| QIAEX II DNA Gel Extraction Kit | Qiagen | 20021 | |
| KpnI restriction enzyme | NEB | R0142S | |
| PstI restriction enzyme | NEB | R0140S | |
| T4 DNA ligase | NEB | M0202 | |
| NEB® 5-alpha Competent E. coli (High Efficiency) | NEB | C2987I | |
| BL21 (DE3) Competent E. coli | NEB | C2527I | |
| IPTG | Sigma-Aldrich | 10724815001 | |
| JXN-26 centrifuge with JLA 10.500 rotor | Beckman Coulter Avanti | - | |
| Microcentrifuge with D3024/D3024R rotor | Scilogex | - | |
| MaxQ SHKE6000 Incubator | Thermo Scientific | - | |
| Ultrasonic processor | Sonics | VC-750 | |
| Protein purification by nickel affinity chromatography | |||
| Ni-NTA resin | G Biosciences | 786-940/941 | |
| Pierce Disposable Gravity columns, 10 mL | Thermo Scientific | 29924 | |
| 1 mL Spectra/ Por float-A-lyzer G2 dialysis device (MWCO: 20-kD) | Spectrum | G235033 | |
| Mini-Protean Electrophoresis Cell | BioRad | 1658004 | |
| Protein activity assay by thin layer chromatography | |||
| Thin layer chromatograph (TLC) development tank | General Glass Blowing Company | 80-3 | |
| Polyethylenimine (PEI)-cellulose plates (20 cm x 20 cm, 100 μm thickness) with polyester support | Sigma-Aldrich | Z122882-25EA | |
| ATP, [γ-32P]- 3000 Ci/mmol 10mCi/ml lead, 100 μCi | Perkin Elmer | NEG002A | |
| Adenosine 5’-triphosphate (ATP) 100 mM | Bio Basic Canada | AB0311 | |
| Guanosine-5’-diphosphate disodium salt (GDP) | Alfa Aesar | AAJ61646MC/E | |
| Storage phosphor screen | GE Healthcare Life Sciences | BAS-IP TR 2040 E Tritium Screen | |
| Storm 860 phosphorimager | GE Healthcare Life Sciences | - |
参考文献
- Cheek, S., Ginalski, K., Zhang, H., Grishin, N. V. A comprehensive update of the sequence and structure classification of kinases. BMC Structural Biology. 5 (1), 6(2005).
- Porath, J. Immobilized metal ion affinity chromatography. Protein Expression and Purification. 3 (4), 263-281 (1992).
- Arnau, J., Lauritzen, C., Pedersen, J. Cloning strategy, production and purification of proteins with exopeptidase-cleavable His-tags. Nature Protocols. 1 (5), 2326-2333 (2006).
- Porath, J., Carlsson, J., Olsson, I., Belfrage, G. Metal chelate affinity chromatography, a new approach to protein fractionation. Nature. 258 (5536), 598-599 (1975).
- Smith, M. C., Furman, T. C., Ingolia, T. D., Pidgeon, C. Chelating peptide-immobilized metal ion affinity chromatography. A new concept in affinity chromatography for recombinant proteins. Journal of Biological Chemistry. 263 (15), 7211-7215 (1988).
- Graslund, S., et al. Protein production and purification. Nature Methods. 5 (2), 135-146 (2008).
- Booth, W. T., et al. Impact of an N-terminal Polyhistidine Tag on Protein Thermal Stability. ACS Omega. 3 (1), 760-768 (2018).
- Thielges, M. C., Chung, J. K., Axup, J. Y., Fayer, M. D. Influence of histidine tag attachment on picosecond protein dynamics. Biochemistry. 50 (25), 5799-5805 (2011).
- Chaga, G. S. Twenty-five years of immobilized metal ion affinity chromatography: past, present and future. Journal of Biochemical and Biophysical Methods. 49 (1-3), 313-334 (2001).
- Ma, H., Deacon, S., Horiuchi, K. The challenge of selecting protein kinase assays for lead discovery optimization. Expert opinion on drug discovery. 3 (6), 607-621 (2008).
- Tamayo, R., Tischler, A. D., Camilli, A. The EAL domain protein VieA is a cyclic diguanylate phosphodiesterase. Journal of Biological Chemistry. 280 (39), 33324-33330 (2005).
- Purcell, E. B., McKee, R. W., McBride, S. M., Waters, C. M., Tamayo, R. Cyclic Diguanylate Inversely Regulates Motility and Aggregation in Clostridium difficile. Journal of Bacteriology. 194 (13), 3307-3316 (2012).
- Purcell, E. B., Tamayo, R. Identification and characterization of cyclic nucleotide phosphodiesterases. Methods in Molecular Biology. 1016, 235-243 (2013).
- Ross, P., et al. Control of cellulose synthesis Acetobacter xylinum. A unique guanyl oligonucleotide is the immediate activator of the cellulose synthase. Carbohydrate Research. 149 (1), 101-117 (1986).
- Potrykus, K., Cashel, M. (p)ppGpp: still magical? Annual Review of Microbiology. 62, 35-51 (2008).
- Boutte, C. C., Crosson, S. Bacterial lifestyle shapes stringent response activation. Trends in Microbiology. 21 (4), 174-180 (2013).
- Nanamiya, H., et al. Identification and functional analysis of novel (p)ppGpp synthetase genes in Bacillus subtilis. Molecular Microbiology. 67 (2), 291-304 (2008).
- Gaca, A. O., et al. Basal Levels of (p)ppGpp in Enterococcus faecalis: the Magic beyond the Stringent Response. mBio. 4 (5), (2013).
- Sebaihia, M., et al. The multidrug-resistant human pathogen Clostridium difficile has a highly mobile, mosaic genome. Nature Genetics. 38 (7), 779-786 (2006).
- Gasteiger, E., et al. ExPASy: The proteomics server for in-depth protein knowledge and analysis. Nucleic Acids Research. 31 (13), 3784-3788 (2003).
- Purcell, E. B., et al. A nutrient-regulated cyclic diguanylate phosphodiesterase controls Clostridium difficile biofilm and toxin production during stationary phase. Infection and Immunity. , (2017).
- Mechold, U., Murphy, H., Brown, L., Cashel, M. Intramolecular Regulation of the Opposing (p)ppGpp Catalytic Activities of RelSeq, the Rel/Spo Enzyme from Streptococcus equisimilis. Journal of Bacteriology. 184 (11), 2878-2888 (2002).
- Dalebroux, Z. D., Svensson, S. L., Gaynor, E. C., Swanson, M. S. ppGpp Conjures Bacterial Virulence. Microbiology and Molecular Biology Reviews. 74 (2), 171-199 (2010).
- Bartlett, J. G. Clostridium difficile: progress and challenges. Annals of the New York Academy of Sciences. 1213, 62-69 (2010).
- US Department of Health and Human Services. , Centers for Disease Control and Prevention, US Department of Health and Human Services. Atlanta, GA. (2013).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。