Method Article
Очистка внеклеточного трипаносом, в том числе африканских, от крови на Аниониты (Diethylaminoethyl целлюлоза столбцы)
В этой статье
Резюме
Этот метод разделения трипанасомных из крови зависит от их поверхности заряда меньше отрицательных, чем клетки крови млекопитающих. Инфицированной крови помещают и лечение на столбец анионита. Этот метод, наиболее монтажа диагностики для Африканский трипаносомоз, обеспечивает очищенный паразитов для иммунологических, биологических, биохимических, фармацевтической и молекулярной биологии исследований.
Аннотация
Этот метод позволяет разделение трипаносом, паразитов, ответственный за Африканский трипаносомоз животных и человека (шляпы), от инфицированной крови. Это лучший метод для диагностики первой стадии ШЛЯПУ и Кроме того этот метод паразита очищения серологических и научные исследования.
HAT вызвана цеце препроводил Trypanosoma brucei гамбийскую и T. b. rhodesiense. Связанные трипаносом уже возбудителей животных трипаносомозом. Трипанасомных обнаружение имеет важное значение для HAT диагностики, лечения и последующих мер. Метод, описанный здесь является метод обнаружения наиболее чувствительных паразита, адаптированы к условиям поля для диагностики т. б. гамбийскую ШЛЯПУ и может быть завершена в течение одного часа. Кровь накладывается на столбец анионит (открытое целлюлоза), ранее скорректирована до pH 8, и добавляется Элюирующий буфер. Крайне отрицательно заряженных клетки крови являются абсорбированном виде на столбце, в то время как менее отрицательно заряженных трипаносом проходят через. Собранные трипаносом гранулированных центрифугированием и соблюдаться микроскопии. Кроме того паразиты готовятся без повреждения клеток, сохраняя их инфективности.
Очищенный трипаносом требуются для иммунологических тестов; они используются в trypanolysis assay, золотой стандарт в ШЛЯПЕ серология. Окрашенных паразитов используются в тесте агглютинации карты (CATT) для поля серология. Антигены из очищенного трипаносом, таких как вариант поверхностный гликопротеин, exoantigens, также используются в различных иммуноанализа. Процедуру, описанную здесь предназначен для африканских трипаносом; Следовательно хроматографии условия должны быть адаптированы для каждого штамма трипанасомных и в более общем плане, в кровь каждого вида млекопитающих хост.
Эти увлекательные патогенов, легко очищенный и доступны для использования в биохимических, молекулярной и клеточной биологии исследования, включая совместное культуру с клеток хозяина расследовать паразито хозяинных отношений на уровне мембранных рецепторов, сигнализации и Джин выражение; наркотиками испытания в vitro; расследование удаления генов, мутации или гиперэкспрессия на метаболические процессы, цитоскелета биогенеза и выживания паразита.
Введение
Представлен метод описанные здесь позволяет разделение трипаносом, паразитов, ответственный за Африканский трипаносомоз животных и человека (шляпы), от крови. Это лучший метод для диагностики первой стадии ШЛЯПУ и Кроме того, этот паразит метод очистки позволяет надежные серологических и исследовательские расследования.
HAT вызвана цеце препроводил Trypanosoma brucei гамбийскую и T. b. rhodesienseв1. Эти паразиты простейших умножить внеклеточно в крови, лимфы и межклеточной жидкости во время первой стадии заболевания (Гемолимфатический этап). Второй этап (meningoencephalitic этап) начинается, когда паразитов пересечь гематоэнцефалический барьер; неврологические проявления, включая расстройства сна, который дал свое имя «сонная болезнь» к этой болезни, типичны для этого второго этапа2. Связанные трипаносом (т. evansi, т. congolense, т. vivax, т. б. brucei) уже возбудителей животных африканского трипаносомоза (АС)3.
Всемирная организация здравоохранения (ВОЗ) стремится устранить ШЛЯПУ как проблемы общественного здравоохранения к 2020 году и остановить передачу 20304. Недавнее введение тестов быстрой диагностики имеет улучшенный Серологический диагноз1,4,5. Были разработаны несколько молекулярных диагностических тестов, но их роль в области диагностики до сих пор не установленным5. Они используются для идентификации подвидов brucei группы и атипичные трипаносомоз, вызванные паразитами, ответственных за животных трипаносомозом6.
Обнаружение паразит имеет важное значение для диагностики, лечения и последующих мер, как серология может дать ложные положительные и к сожалению ложные отрицательные результаты1. Прямого микроскопические наблюдения этих простейших hemoflagellate трудно в случаях ШЛЯПУ, которые вызваны т. б. гамбийскую, (больше чем 95% случаев) как низкий parasitemias являются правилом, тогда как для HAT вызванных T. b. rhodesiense, большой Количество паразитов часто присутствуют в крови. Были использованы различные методы концентрации, как толстая капля и капиллярной трубки центрифугирования (КТК), но разделение паразитов от крови по столбцу анионита (открытое целлюлоза) следуют центрифугирования и микроскопические наблюдения Пелле, является наиболее чувствительным методом (около 50 паразитов/мл крови могут быть обнаружены)1,7. Следовательно, очистки трипаносом этим методом Аниониты (открытое целлюлоза) является лучшим и, на сегодняшний день, эталонный метод для визуализации и изоляции паразитов из крови для диагностики ШЛЯПУ. В полевых условиях успешно используется мини-колонки открытое целлюлозы и несколько улучшений способствовали микроскопические наблюдения7,8.
Метод отделения трипанасомных от крови, описанные ниже, зависит от поверхности заряд паразита, который меньше отрицательных, чем клетки крови млекопитающих9. Интересно, что этот метод был разработан 50 лет назад, в 1968 году д-р Шейла Ланхем и остается золотым стандартом для обнаружения и подготовка трипаносом кровоток. Это быстро и воспроизводимый для salivarian трипаносом из широкого спектра млекопитающих, позволяя диагноз как трипаносомоз животных и человека10.
Получить жизни, очищенный паразитов, инфицированной крови добавляется на столбец анионита. Условия хроматографии (главным образом, pH, ионной силы буферы/СМИ) должны быть адаптированы для каждого вида трипанасомных и вообще, каждый микс mammalian клеток крови и трипаносом10. Элюирующий буфер точно скорректирована с pH 8 для большинства африканских трипаносом10. Этот метод способствует концентрации паразитов в крови больных, потому что parasitemias может быть слишком низким для того чтобы быть обнаружены микроскопические наблюдения в одиночку, и она также позволяет лабораторных исследований. Работа с свежевыделенных трипаносом и на крови от инфицированных животных, используя эту технику, более актуально для различных расследований, чем исследования с паразитами, которые были культивировали в стерильных условиях в лаборатории на неопределенный срок.
Паразито хозяинных отношений наилучшим учился с паразита заражения природного хозяина, таким образом, т. musculi, естественный мышиных паразита, который является представителем внеклеточного трипаносом, имеет много преимуществ, как мышиных инфекции включает в мелких лабораторных животных и не требует биологической безопасности уровня (BSL) условий. Т. musculi не убить иммунокомпетентных мышей, в отличие от многих других видов Трипаносомы , в том числе патогенов человека. Т. musculi не устраняются в Т клеток, лишенные мышей и parasitemias может быть увеличена в зараженных мышей, изменяя потребление продовольствия и питательных веществ11. Этот паразит модулирует иммунный ответ в сопутствующих инфекций с других патогенов12. Т. musculi от зараженных мышей экспонат отличия от искусственного musculi т., например, выражение мембранных рецепторов ФК теряется в стерильных культурах musculi т. , по сравнению с паразитами, очищенного от зараженных мышей13 , 14. Экскретируется выделяется факторы (ESF) также качественно и количественно менее выражена в стерильных трипанасомных культур и отличаются между штаммы изолированы в эндемичных районах15. ЕФС являются первым антигенов, чтобы отображаться иммунной системы и поэтому играют важную роль в начального узла иммунный ответ16.
В экспериментально зараженных животных для лабораторных исследований этот протокол облегчает эксперименты на большее количество паразитов, свести к минимуму количество мышей, особенно при использовании ослабленным животных. Вариант поверхностных гликопротеинов (VSGs), которые используются в тесте агглютинации карты трипаносомоза (CATT) в массового скрининга по-прежнему очищенного от трипаносом, которые распространяются в крыс. Два быстрых диагностических тестов (индивидуально упакованные кассеты), которые теперь доступны для использования на местах, по-прежнему используют источник инфекционный модель родной VSGs и не в vitro культивированный трипаносом1,4, 5. улучшения в изучении биологии и иммунологии трипанасомных способствовало поскольку эти паразиты очищенной целлюлозы открытое можно легко получить в больших количествах из естественно или экспериментально зараженных узлов и в частности, грызуны.
протокол
Расследований соответствовал руководящим принципам для ухода и использования лабораторных животных (низ публикация № 85±23, редакция 1996). Протоколы были одобрены Комитетом наших местных этики.
1. Животные
- Держите самок мышей Swiss (о-1), в возрасте от восьми до десяти недель, 20-25 г, в животное жилищного фонда пятнадцать дней до каждого эксперимента. Дом их в вентилируемых ящики, которые находятся в охраняемых, (22 ° C) температуры и влажности воздуха (50%) контролируемых номер, с 12 часов света цикл включения/выключения.
- Дать животных свободный доступ к продовольствию и воде. Свести к минимуму боль, страдания и бедствия и обеспечить обогащение среды.
- Для жилья, используйте clear стенами клетки, обогащения с деревянными палками и картона туннелей. Аккуратно нарисуйте животное в туннель для передачи его из клетки в ладони.
- Выполняйте ежедневный мониторинг оценить признаки прострации, социальной изоляции, телесных повреждений, взъерошенные волосы или отсутствия ухода.
- Вес каждого животного один раз в неделю. Выполните регулярные проверки с ветеринаром.
- Для природных паразитов собирать кровь на пике паразитемии и паразитов, гибели животных, собирать кровь за день до предполагаемой смерти.
Примечание: Все эксперименты с инфекционными агентами выполняются в специальных комнатах, по данным Университета одобрил руководящие принципы.
2. буферы, СМИ препараты
- Весят из каждого вещества и добавьте дистиллированную воду для следующих буферов:
- Подготовить концентрации фосфатов амортизированное Saline (2 x):
Na2HPO4 (безводный) (МВт 141.96 g) 10.14 g
NaH2PO4∙2H2O (МВт 156.01 g) 0.62 g
NaCl (МВт 58.44 g) 2,55 g
H2O в 1 Л дистиллированной - Подготовьте фосфат амортизированное Saline глюкозы:
Na2HPO4 (безводный) (МВт 141.96 g) 5.39 g
NaH2PO4∙2H2O (МВт 156.01 g) 0,31 g
NaCl (МВт 58.44 g) 1.70 g
Глюкоза (МВт 180 g) 10 г
H2O в 1 Л дистиллированной - Подготовьте 1м х2PO4.
- Подготовить Элюирующий буфер: Дополнение фосфат амортизированное Saline глюкозы с
Пенициллин (100 ед/мл), стрептомицин (100 мкг/мл) и фенола красного (5 мкг/мл).
- Подготовить концентрации фосфатов амортизированное Saline (2 x):
3. Подготовка открытое целлюлозы
- План около 5 часов для подготовки открытое целлюлозы.
- Вымойте 100 g открытое-целлюлозы с дистиллированной водой в колбу с узким горлышком и позволяют урегулировать, а затем удалить мелкие частицы. Повторите моет, до тех пор, пока супернатант ясно.
- Добавьте 3 Л концентрированной 2 x Phosphate-Buffered соли и размешать.
- Отрегулируйте пэ-аш до 8.0 с 1м х2PO4 и удалить супернатант.
- Дважды промыть дистиллированной водой и оставить для урегулирования.
- Вымойте и дают отстояться дважды с 3 литра Phosphate-Buffered солевой раствор глюкозы и отбросить supernatants.
- Измерить объем целлюлозы и добавить одинаковый объем Phosphate-Buffered Saline-глюкоза, распространять в пластиковые бутылки и хранить при температуре от-20 ° C.
4. паразитов
- Сбор трипанасомных штаммов в районах, эндемичных для человека и животных трипаносомозом. Держите паразитов, замороженные в жидком азоте.
Примечание: Трипаносомы musculi не патогенных для человека и является внеклеточным трипанасомных, безопасно заменить патогенных трипаносом в различных лабораторных экспериментов. - В случае лабораторных исследований, требующих патогенов человека обрабатывать эксперименты с осторожностью в условиях уровень (BSL) посвященный соответствующей биологической безопасности и меры предосторожности; BSL2 т. б. гамбийскую и BSL3 для T. b. rhodesiense. В полевых условиях, устанавливается стандартная практика микробиологические: безопасный выборки, механические закупорить, частые очистки поверхностей и стерилизации отходов.
5. мыши инфекции
- Быстро разморозить паразитов в водяной бане при температуре 37 ° C.
- Наблюдать падение талой инфицированной крови с помощью микроскопа. Оценка жизнеспособности паразитов, измеряя процент подвижных форм17.
- Inject внутрибрюшинно паразитов в мышах (0,5 мл на мыши). Каждый день, послеоперационные инфекции, собирать 20 мкл крови хвост в пункционная игла и наблюдать под микроскопом. Оцените паразитемии согласно Герберт и Ламсден18 путем подсчета паразитов в нескольких областях, Микроскоп, или с помощью haemocytometer.
- Когда паразитемии достигает порога, определенного для каждого штамма, соберите кровь (1 мл/мыши) в Элюирующий буфер (5 мл/мышь), содержащих гепарин (10 ед/мл).
Примечание: Оригинальные и новые работы Ланхем и Годфри сообщили, что оптимальный ионной силы фосфата буфер солевой глюкозы для нескольких видов хост/паразитов от рН 8,0 Стоковый раствор.
6. паразит разделения
Примечание: Все эксперименты с этого момента должно быть сделано в культуре ткани капюшоном носить перчатки. Комнатной температуре и влажности воздуха в лаборатории используется были 22 ° C и 45% соответственно. В полевых условиях паразит разделения успешно выступили на 34 ° C.
- 10 мл шприц в вертикальной поддержки и добавить ранее вырежьте циркуляр, кусок фильтровальной бумаги, стекловаты или целлюлозные губки.
- Залейте целлюлозы открытое в шприц, вплоть до уровня 8 мл, затем вымыть с 25 мл буфера.
- Аккуратно добавить 2 мл разбавленной крови в верхней части столбца, а затем добавьте элюции среднего. Регулярно добавьте Элюирующий буфер согласно транзита трипаносом.
- Сбор сточных вод капли от столбцов в пластиковых пробирок и регулярно проверять на наличие паразитов с помощью микроскопа.
- Когда больше не паразиты обнаруживаются в столбце сточных, центрифуга трубки (1800 x g, 10 минут, при температуре 4 ° C в лаборатории и в полевых условиях при температуре окружающего воздуха).
- Удалить супернатант и приостановить паразитов в 1 мл соответствующей среды, необходимые для следующего этапа расследования.
- Количество паразитов с Горяева и развести их в соответствующей среде при необходимости.
Результаты
Очищенный трипаносом были использованы в фармацевтических испытаний. Паразиты передаются в культуре скважины, содержащие серийных разведений конкретных препаратов, самостоятельно или смешанные19. Микроскопические наблюдения, оценки подвижности является маркером жизнеспособности, могут быть выполнены, когда проверяются только несколько перевозку, тогда как AlamarBlue клетки жизнеспособности пробирного является отличным способом для большой подвижности анализов во время наркотиков скрининг20. Эффект пентамидин, ссылка препарат, который используется в терапии ШЛЯПУ, отображается на рисунке 1.
Макрофаги являются очень полезными в культурах как клетки фидера. Они позволяют, в пробирке, начала и развития трипанасомных культуры21. Мы сообщили, что количество альтернативно Активированные макрофаги увеличиваются в трипанасомных инфицированных млекопитающих, в которых они пользу паразита роста22. Эта активация альтернативных макрофагов поставляет L-орнитин, которая необходима для роста паразита. В vitro Макрофаг паразит Сопредседатель культур показали трипаносом побудить альтернативных активация макрофагов через секретируемые факторов. Внеклеточные трипаносом выделяют кинезин, который связывает макрофагов маннозы связывания рецепторов вызывая arginase выражение, обеспечивая производство L-орнитин, пользу паразита дифференциации и умножения23,24 ( Рисунок 2). Манноза препятствует кинезин привязки и arginase индукции, и маннозы рецептор недостаточным мышей разъяснить цель кинезин на макрофагов (рис. 3).
Поскольку многочисленные трипанасомных геномов теперь были упорядочены и аннотированная, мы смогли воспользоваться преимуществами этих больших наборов данных. Впоследствии мы были в состоянии осуществлять прямой и обратной генетики на этих паразитов. Используя эти данные, очищенная кровь формы трипаносом были использованы охарактеризовать и проанализировать важные структуры, такие как flagellar карман (ПС) и его ассоциированных цитоскелета. FP является единственным сайт эндо и экзоцитоз в трипаносом и это также, где переменная поверхностных гликопротеинов ввозятся из системы endomembrane25. Flagellar карманные воротник (FPC) является кольцевой формы структура, которая прилагается к жгутика в точке, где он выходит из ПС, но до тех пор, пока недавно немногая было знано о составляющих белков заводского контроля над производством. Мы определили основной белок FPC, ТБ-BILBO1 и показали, что важно для выживания паразита как в виде искусственного насекомых мухи цеце, так и в форме кровоток26. Нокдаун BILBO1 ТБпутем интерференции предотвращает образование FP и подавляет биогенеза многих других важных цитоскелета структур, делая заводского контроля над производством и FP важные цели вмешательства в всех патогенной трипаносом. Зондирование очищенный или культивированный паразита клетки с антителами к ТБBILBO1 указывает, что в форме кровоток и procyclic (насекомое) форме, он создает кольцевые структуры, которая обходит жгутика. Такой маркировки, в форме кровоток, показан на рисунке 4.
Очищенная кровь формы трипаносом позволили квалификация многих необычных биохимических и метаболические особенности, включая метаболизма глюкозы, который проходит в Пероксисома как органеллы, называется glycosomes (см. Рисунок 5). Общепризнано, что пируват является основной конечный продукт экскретируется от метаболизма глюкозы в кровоток трипаносом, с практически не производства сукцината и ацетат внутри митохондрий. В противоположность этому procyclic трипаносом преобразовать треонин в ацетат и глюкозы в сукцината и ацетат27,28. Энергии метаболизма trypanosomatids может оцениваться путем адаптации имеющихся углеродных источников. Сочетая Метаболомные анализы и обратной генетики подтвердили производство в митохондриях кровоток трипаносом ацетата от глюкозы производные пируват и треонин, а также производство сукцината глюкозы19,20 (Рис. 5). Например, 1H ЯМР анализ конечных продуктов, экскретируется в кровоток формы трипаносом инкубировали в PBS, содержащих 4 мм глюкозы, показал что глюкоза главным образом преобразуется в пирувата (85,1% экскретируется конечных продуктов), с незначительными производства Аланинаминотрансфераза (9,2%), ацетат (4,9%) и29сукцинат (0,8%). Эти пути, которые являются незначительными с точки зрения метаболический поток по сравнению с пируваткиназой производства из глюкозы, имеют важное значение для роста паразита. Таким образом, пути производства сукцината может рассматриваться как хорошей потенциальной мишенью для разработки новых лекарств trypanocidal.
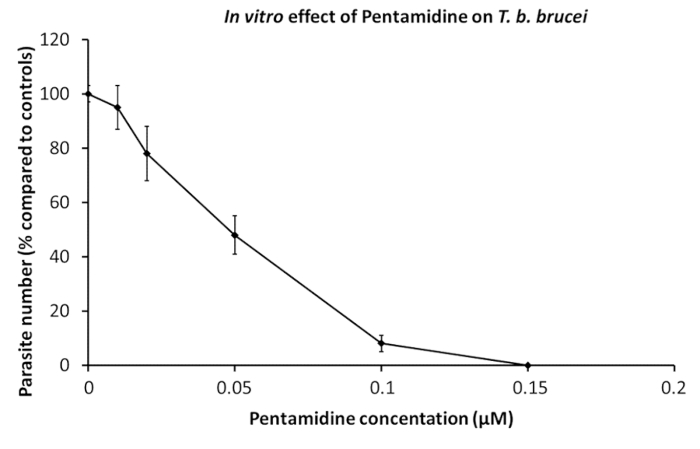
Рисунок 1 : В пробирке эффект пентамидин на Т. б. brucei. Разведений пентамидин были добавлены 2 x 105 паразитов для определения концентрации, подавляя рост паразита на 50% (IC50). Доза эффект кривых на 24 часа культуры. Планки погрешностей представляют Среднеквадратичная ошибка среднего значения от 5 независимых экспериментов. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
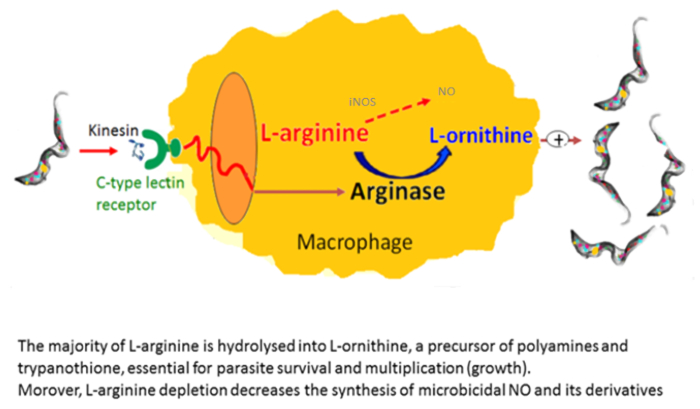
Рисунок 2 : Arginase трипанасомных опосредованной индукции. Кинезин, выпущенный трипаносом связывается с рецепторами Лектин C-типа, ведущих к индукции arginase. Это приводит к росту производства L-орнитин и Полиамины, важным для паразита роста и дифференциации и L-аргинин истощения, что приводит к нижней производство цитотоксических нет макрофагов NOS II. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
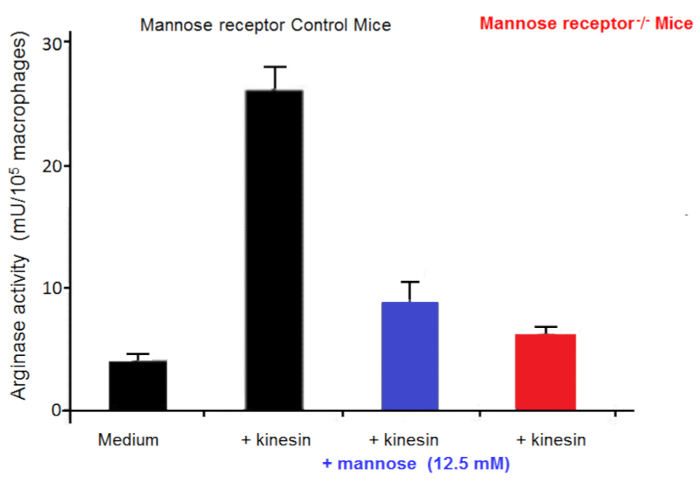
Рисунок 3 : Активность макрофагов arginase. Arginase деятельность в макрофагах от управления мышей и маннозы рецептор выбить (KO) мышах культивировали в пробирке в среде для 48 часов, с или без кинезин или маннозы. Планки погрешностей представляют Среднеквадратичная ошибка среднего значения от 5 независимых экспериментов. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.

Рисунок 4 : ТБ BILBO1 маркировка кровоток формы Trypanosoma brucei brucei ячейка (A) иммунофлюоресценции маркировки кровь, формы культуры, 427, 90-13 ячейку, был исследован с анти BILBO1 моноклональные антитела следуют FITC-помечены антитела анти мыши и визуализируются с использованием ультрафиолетового света, (ТБ BILBO1 являются зеленый кольцевой сигналов) и ДНК, привязка краситель DAPI (синий сигналы) A (B) слияние DAPI, анти BILBO1 и Фазовый контраст изображения A. Шкала бар равняется 10 мкм. анти-BILBO1 мыши моноклональные был разбавленным 1:10 в PBS и вторичные антитела ( анти мыши IgM FITC) был разбавленным масштаба 1: 100. Изображения были взяты на микроскопе с цифровой камерой. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.

Рисунок 5 : Схематическое изображение метаболизма глюкозы и треонина в кровоток формы трипаносом. Экскретируется конечных продуктов из метаболизм глюкозы и треонина упакованы. Толстые синие стрелки указывают ферментативные шаги метаболизма глюкозы, ведущих к пируват производства, которое является основной конечный продукт экскретируется от гликолиза. Черные стрелки представляют забывают незначительные метаболических путей из глюкозы и треонина деградации, которые необходимы для роста паразита. Экспериментально подтверждена вклад указанных ферментов: ACH, ацетил-КоА thioesterase (EC 3.1.2.1); ASCT, ацетат: сукцината CoA трансферазы (EC 2.8.3.18); AKCT, 2-амино-3-ketobutyrate коэнзима A лигаза (EC 2.3.1.29); PEPCK, phosphoenolpyruvate carboxykinase (EC 4.1.1.49); PDH, пируват дегидрогеназа комплекс (EC 1.2.4.1); TDH, треонин 3-дегидрогеназы (EC 1.1.1.103). Сокращения: AcCoA, ацетил-КоА; АОВ, амино oxobutyrate; ДХАП, дигидроксиацетон фосфат; G3P, Глицеральдегид-3-фосфат; MAL, малат; ОА, оксалоацетат; ОПТОСОЗ, phosphoenolpyruvate; PYR, пируват. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
Обсуждение
Очищенный трипаносом представляют собой мощное средство для изучения иммунологии, биохимии, клеточной и молекулярной биологии. Большие просторы данных и результаты были получены из трипаносом, который затем помог получить информацию от других эукариотических клеток30. Трипаносом также являются предметом важных и интересных исследований, потому что они разработали многочисленные механизмы, которые позволяют им, чтобы выжить и развиваться в двух весьма различных средах: вектор муха цеце и млекопитающих принимающей23, 31. поступили различные методы, чтобы изолировать трипаносом, и обзор на подходы, основанные на микрофлюидика недавно были опубликованы32. Следовательно воспроизводимые и надежные средства изоляции паразит имеет важное значение.
Открытое целлюлозы подготовка является необходимым шагом в этом протоколе подготовки паразита. Стиральная условия должны выполняться осторожно, чтобы избежать мелких частиц и сбалансировать смолы, и рН должна быть отрегулирована (рН 8,0 apt для большинства видов трипанасомных). Все меры должны быть скорректированы для улучшения паразита очищения и урожайности при сохранении свойства паразита жизнеспособность и сотовых. Важно отметить, что паразит жизнеспособность и инфективности были сохранены после очистки через колонку открытое целлюлозы. Однако некоторые штаммы более хрупкие, чем другие и может быть менее инфекционный после очистки33. Таким образом влияние условий разделения на pellicular мембранных компонентов, метаболизм паразита, сигнализации, функции нуклеиновых кислот и животных инфективности, должны быть оценены, и должны соответствующим образом адаптировать условия разделения.
Ограничения в этой технике, что эта процедура быть адаптированы к каждому трипанасомных видов данного хоста и также много времени. Кроме того открытое целлюлозы в настоящее время дорого. Предварительные анализы необходимы для оптимизации условий разделения, особенно СМИ, которые могут иметь различных ионных сильные и точный уровень pH. Предварительно столбец шаги, включая выбор антикоагулянт, предварительного центрифугирования, чтобы удалить часть эритроцитов, Баффи пальто использования и Лизис эритроцитов, выбираются в соответствии каждого эксперимента. Точные изменения на один параметр (буферов, температуру на протяжении всего протокола, параметров центрифугирования) могут значительно увеличить количество, степень очистки и жизнеспособности паразитов получил33. Разработка новых параметров разделения согласно видов паразитов и млекопитающих кровяные клетки, чтобы разделить, может быть необходимым. Внести первоначальный протокол Ланхем и Годфри позволила очистка биологически и антигенно сохранились т. cruzi из крови34. Новые смолы также могут быть протестированы и использованы с надлежащие условия для различных видов35.
Важную роль экскретируется выделяется факторов (ES), trypanosomatids недавно был подчеркнуто16. ES содержат молекул, участвующих в патологии и иммуномодуляция, таких как кинезин, который сохраняется среди трипаносом24. Подготовка ES от очищенной паразитов требует особую осторожность, чтобы избежать загрязнения элюции компоненты средств массовой информации и лизированных паразитов.
На основе ES вакцины эффективны против лейшманий, связанной с паразитом, уже существует и доступен (CaniLeish Virbac)36. Ассоциация молекул сохраняется, играет существенную роль в паразита выживания и роста может представлять основой для будущей вакцины против трипаносом, для людей и животных, в одной здравоохранения подход. Очистка африканских трипаносом от крови по столбцам открытое целлюлозы, с улучшениями, по-прежнему является золотым стандартом для обнаружения трипанасомных в естественных хостов с низким parasitemias в эндемичных районах и потребность паразитов в больших количествах для экспериментальные исследования.
Раскрытие информации
Авторы не имеют ничего сообщать.
Благодарности
Мы благодарим всех членов UMR 177 INTERTRYP IRD CIRAD Université de Bordeaux. Это исследование было поддержано внутреннего финансирования от университета Бордо и поддержки от НРУ, LABEX нар ParaFrap-11-LABX-0024 и ассоциации pour le développement de la recherche en parasitologie et Медисин tropicale и службы де Кооперасьон et действий culturelle де l'Ambassade де Франс меню Банги (банковский).
Материалы
| Name | Company | Catalog Number | Comments |
| 10 mL Pipettes | Falcon | 357,551 | |
| 2 mL Pipettes | Falcon | 352,507 | |
| Centrifugation tube 50 mL | Falcon | 352,070 | |
| Centrifuge | Sigma Aldrich | 4K15 | |
| DEAE cellulose | Santa Cruz | s/c- 211213 | 100 G |
| filter paper | Whatman | 1,001,125 | |
| Flat bottom flask narrow neck | Duran | 21 711 76 | 6000 mL |
| Glucose | VWR | 101174Y | 500 G |
| Heparin | Sigma Aldrich | H3149-50KU | 5 000 U |
| KH2PO4 | VWR | 120 26936.260 | 500 G |
| Microscope | Olympus | CH-20 | |
| Microscope coverslips | Thermofisher scientific | CB00100RA020MNT0 | |
| Microscope slides | Thermofisher scientific | AGAA000001 | |
| Na2HPO4 | VWR | 100 28026;260 | 500 G |
| NaCl | VWR | 27800.291 | 1 KG |
| NaH2PO4 | VWR | 110 33616;262 | 500 G |
| Nalgene Plastic Media Bottles size 125 mL | Thermofisher scientific | 342024-0125 | |
| Nalgene Plastic Media Bottles size 500 mL | Thermofisher scientific | 342024-0500 | |
| Pasteur Pipette | VWR | BRND125400 | |
| Penicillin 10,000 UI/Streptomycin 10,000 µg | EUROBIO | CABPES01 OU | 100 mL |
| Phenol red | Sigma Aldrich | P0290 | 100 mL |
| Syringue | Dutscher | SS+10S21381 | |
| Tissue culture hood | Thermoelectro Corporation | MSC-12 | |
| Trypanosoma brucei brucei | Institute of Tropical Medicine (Antwerp, Belgium). | ANTAT 1.1 | |
| Trypanosoma brucei gambiense | Institute of Tropical Medicine (Antwerp, Belgium). | ITMAP 1893 | |
| Trypanosoma musculi | London School of Hygiene and Tropical Medicine (UK) | Partinico II |
Ссылки
- Büscher, P., Cecchi, G., Jamonneau, V., Priotto, G. Human African trypanosomiasis. Lancet. 390 (10110), 2397-2409 (2017).
- Lejon, V., Bentivoglio, M., Franco, J. R. Human African trypanosomiasis. Handbook of Clinical Neurology. 114, 169-181 (2013).
- Giordani, F., Morrison, L. J., Rowan, T. G., De Koning, H. P., Barrett, M. P. The animal trypanosomiases and their chemotherapy: a review. Parasitology. 143 (14), 1862-1889 (2016).
- Aksoy, S., Buscher, P., Lehane, M., Solano, P., Van Den Abbeele, J. Human African trypanosomiasis control: Achievements and challenges. PLoS Neglected Tropical Diseases. 11 (4), e0005454(2017).
- Büscher, P., Deborggraeve, S. How can molecular diagnostics contribute to the elimination of human African trypanosomiasis? Expert Review of Molecular Diagnostics. 15 (5), 607-615 (2015).
- Truc, P., et al. Atypical human infections by animal trypanosomes. PLoS Neglected Tropical Diseases. 7 (9), e2256(2013).
- Lumsden, W. H., Kimber, C. D., Evans, D. A., Doig, S. J. Trypanosoma brucei: miniature anion-exchange centrifugation technique for detection of low parasitaemias: adaptation for field use. Transactions of the Royal Society of Tropical Medicine and Hygiene. 73 (3), 312-317 (1979).
- Büscher, P., et al. Improved Models of Mini Anion Exchange Centrifugation Technique (mAECT) and Modified Single Centrifugation (MSC) for sleeping sickness diagnosis and staging. PLoS Neglected Tropical Diseases. 3 (11), e471(2009).
- Lanham, S. M. Separation of trypanosomes from the blood of infected rats and mice by anion-exchangers. Nature. 218 (5148), 1273-1274 (1968).
- Lanham, S. M., Godfrey, D. G. Isolation of salivarian trypanosomes from man and other mammals using DEAE-cellulose. Experimental Parasitology. 28 (3), 521-534 (1970).
- Humphrey, P. A., Ashraf, M., Lee, C. M. Growth of trypanosomes in vivo, host body weight gains, and food consumption in zinc-deficient mice. Journal of the National Medical Association. 89 (1), 48-56 (1997).
- Lowry, J. E., Leonhardt, J. A., Yao, C., Belden, E. L., Andrews, G. P. Infection of C57BL/6 mice by Trypanosoma musculi modulates host immune responses during Brucella abortus cocolonization. Journal of Wildlife Diseases. 50 (1), 11-20 (2014).
- Vincendeau, P., Daëron, M., Daulouede, S. Identification of antibody classes and Fc receptors responsible for phagocytosis of Trypanosoma musculi by mouse macrophages. Infection and Immunity. 53 (3), 600-605 (1986).
- Vincendeau, P., Daëron, M. Trypanosoma musculi co-express several receptors binding rodent IgM, IgE, and IgG subclasses. Journal of Immunology. 142 (5), 1702-1709 (1989).
- Holzmuller, P., et al. Virulence and pathogenicity patterns of Trypanosoma bruceigambiense field isolates in experimentally infected mouse: differences in host immune response modulation by secretome and proteomics. Microbes and Infections. 10 (1), 79-86 (2008).
- Holzmuller, P., et al. How do parasites and their excreted-secreted factors modulate the inducible metabolism of L-arginine in macrophages? Frontiers in Immunology. 9, 778(2018).
- Abrahamson, I. A., Da Silva, W. D. Antibody-dependent cytotoxicity against Trypanosoma cruzi. Parasitology. 75 (3), 317-323 (1977).
- Herbert, W. J., Lumsden, W. H. Trypanosoma brucei: a rapid "matching" method for estimating the host's parasitemia. Experimental Parasitology. 40 (3), 427-431 (1976).
- Dauchy, F. A., et al. Trypanosoma brucei CYP51: Essentiality and Targeting Therapy in an Experimental Model. PLoS Neglected Tropical Diseases. 10 (11), e0005125(2016).
- Raz, B., Iten, M., Grether-Bühler, Y., Kaminsky, R., Brun, R. The Alamar Blue assay to determine drug sensitivity of African trypanosomes (T. b. rhodesiense and T. b. gambiense) in vitro. Acta Tropica. 68 (2), 139-147 (1997).
- Albright, J. W., Albright, J. F. In vitro growth of Trypanosoma musculi in cell-free medium conditioned by rodent macrophages and mercaptoethanol. International Journal for Parasitology. 10 (2), 137-142 (1980).
- Gobert, A. P., et al. L-Arginine availability modulates local nitric oxide production and parasite killing in experimental trypanosomiasis. Infection and Immunity. 68 (8), 4653-4657 (2000).
- De Muylder, G., et al. A Trypanosoma brucei kinesin heavy chain promotes parasite growth by triggering host arginase activity. PLoS Pathogens. 9 (10), e1003731(2013).
- Nzoumbou-Boko, R., et al. Trypanosoma musculi Infection in Mice Critically Relies on Mannose Receptor-Mediated Arginase Induction by a TbKHC1 Kinesin H Chain Homolog. Journal of Immunology. 199 (5), 1762-1771 (2017).
- Bonhivers, M., Nowacki, S., Landrein, N., Robinson, D. R. Biogenesis of the trypanosome endo-exocytotic organelle is cytoskeleton mediated. PLoS Biology. 6 (5), e105(2008).
- Albisetti, A., et al. Interaction between the flagellar pocket collar and the hook complex via a novel microtubule-binding protein in Trypanosoma brucei. PLoS Pathogens. 13 (11), e1006710(2017).
- Cross, G. A. M., Klein, R. A., Linstead, D. J. Utilization of amino acids by Trypanosoma brucei in culture: L-threonine as a precursor for acetate. Parasitology. 71 (2), 311-326 (1975).
- Bringaud, F., Rivière, L., Coustou, V. Energy metabolism of trypanosomatids: adaptation to available carbon sources. Molecular and Biochemical Parasitology. 149 (1), 1-9 (2006).
- Mazet, M., et al. Revisiting the central metabolism of the bloodstream forms of Trypanosoma brucei: production of acetate in the mitochondrion is essential for the parasite viability. PLoS Neglected Tropical Diseases. 7 (12), e2587(2013).
- Coutton, C., et al. Mutations in CFAP43 and CFAP44 cause male infertility and flagellum defects in Trypanosoma and human. Nature Communications. 9 (1), 686(2018).
- Cnops, J., Magez, S., De Trez, C. Escape mechanisms of African trypanosomes: Why trypanosomosis is keeping us awake. Parasitology. 142 (3), 417-427 (2015).
- Barrett, M. P., et al. Microfluidics-Based Approaches to the Isolation of African Trypanosomes. Pathogens. 6 (4), (2017).
- Taylor, A. E., Lanham, S. M., Williams, J. E. Influence of methods of preparation on the infectivity, agglutination, activity, and ultrastructure of bloodstream trypanosomes. Experimental Parasitology. 35 (2), 196-208 (1974).
- Gutteridge, W. E., Cover, B., Gaborak, M. Isolation of blood and intracellular forms of Trypanosoma cruzi from rats and other rodents and preliminary studies of their metabolism. Parasitology. 76 (2), 159-176 (1978).
- Cruz-Saavedra, L., et al. Purification of Trypanosoma cruzi metacyclic trypomastigotes by ion exchange chromatography in sepharose-DEAE, a novel methodology for host-pathogen interaction studies. Journal of Microbiological Methods. 142, 27-32 (2017).
- Lemesre, J. L., et al. Long-lasting protection against canine visceral leishmaniasis using the LiESAp-MDP vaccine in endemic areas of France: double-blind randomised efficacy field trial. Vaccine. 25 (21), 4223-4234 (2007).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены