Method Article
Purificazione dei tripanosomi extracellulare, tra cui africana, dal sangue mediante scambiatori di anioni (colonne Diethylaminoethyl-cellulosa)
In questo articolo
Riepilogo
Questo metodo di separazione Tripanosoma dal sangue dipende dalla loro carica superficiale essendo meno negativo rispetto a cellule del sangue dei mammiferi. Sangue infetto è collocato e trattati su una colonna di scambiatore di anioni. Questo metodo, più il montaggio diagnostico per la tripanosomiasi africana, fornisce parassiti purificati per indagini immunologiche, biologiche, biochimiche, farmaceutiche e biologia molecolare.
Abstract
Questo metodo consente la separazione dei tripanosomi, parassiti responsabili di tripanosomiasi africana umana e animale (HAT), da sangue infetto. Questo è il metodo migliore per la diagnosi della prima fase cappello e inoltre questo metodo di purificazione del parassita permessi sierologico e le indagini di ricerca.
CAPPELLO è causato da Mosca Tse-Tse trasmessi Trypanosoma brucei gambiense e rhodesiense del t.b.. Trypanosomes correlate sono gli agenti causali di tripanosomiasi animale. Rilevamento di Tripanosoma è essenziale per la diagnosi, trattamento e follow-up di cappello. La tecnica qui descritta è la tecnica più sensibile di rilevazione parassita, adattata alle condizioni del campo per la diagnosi del gambiense del t.b. cappello e può essere completata entro un'ora. Sangue è a strati su una colonna di scambiatore di anioni (DEAE cellulosa) precedentemente regolata a pH 8 e tampone di eluizione viene aggiunto. Caricate altamente negativa globuli sono adsorbiti sulla colonna mentre il meno negativamente trypanosomes passano attraverso. Trypanosomes raccolti sono pellettati mediante centrifugazione e osservata da microscopia. Inoltre, i parassiti sono preparati senza danno cellulare, pur mantenendo la loro infettività.
Purificata trypanosomes sono necessari per i test immunologici; sono utilizzati nell'analisi della trypanolysis, il gold standard nella sierologia di cappello. Macchiato parassiti sono utilizzati nel test di agglutinazione di carta (CATT) per sierologia di campo. Gli antigeni da trypanosomes purificata, come variante della glicoproteina di superficie, esoantigeni, sono utilizzati anche in vari test immunologici. La procedura qui descritta è progettata per tripanosomi africani; di conseguenza, devono essere adattati per ogni ceppo di Tripanosoma e più in generale, per il sangue di ogni specie di mammifero ospite cromatografia condizioni.
Queste affascinanti gli agenti patogeni sono facilmente purificato e disponibile per l'uso biochimici, molecolari e cellulari tra cui co-coltura con cellule dell'ospite per indagare le relazioni ospite-parassita a livello dei recettori di membrana, segnalazione e gene di studi di biologia espressione; droga test in vitro; indagine di omissione del gene, mutazione o sovraespressione sui processi metabolici, biogenesi del citoscheletro e sopravvivenza del parassita.
Introduzione
Il metodo presentato descritto qui consente la separazione dei tripanosomi, parassiti responsabili di tripanosomiasi africana umana e animale (HAT), dal sangue. Questo è il metodo migliore per la diagnosi della prima fase cappello e inoltre questo metodo di purificazione del parassita permessi robusto indagine sierologica e di ricerca.
CAPPELLO è causato da Mosca Tse-Tse trasmessi Trypanosoma brucei gambiense e rhodesiense del t.b.1. Questi protozoi parassiti si moltiplicano extracellularly nella circolazione sanguigna, linfatica e fluidi interstiziali durante la prima fase della malattia (stadio emolinfatico). La seconda fase (fase meningoencephalitic) inizia quando i parassiti attraversano la barriera ematoencefalica; segni neurologici, tra cui un disturbo del sonno, che ha dato il suo nome "malattia del sonno" per questa malattia, sono tipici di questa seconda fase2. Trypanosomes correlate (T. evansi, T. congolense, vivax T. brucei b. T.) sono gli agenti causali di animale africano Tripanosoma (AAT)3.
L'organizzazione mondiale della sanità (OMS) mira all'eliminazione cappello come un problema di salute pubblica entro il 2020 e di fermare la trasmissione di 20304. La recente introduzione di test di diagnosi rapida ha una migliore diagnosi sierologica1,4,5. Diversi test diagnostici molecolari sono stati sviluppati ma il loro ruolo nella diagnostica sul campo non è stato ancora stabilito5. Essi vengono utilizzati per identificare la sub-specie del gruppo brucei e tripanosomiasi atipica causata da parassiti responsabili di animale Tripanosoma6.
La rilevazione del parassita è essenziale per la diagnosi, trattamento e follow-up, come la sierologia può dare risultati falsi positivi e purtroppo falsi negativi1. L'osservazione microscopica diretta di questi protisti emoflagellato è difficile nei casi di cappello che sono causati da gambiense del t.b., (più di 95% dei casi) come bassi parassitemie sono la regola, mentre per il cappello causato da rhodesiense del t.b., un grande numero di parassiti sono spesso presente nel sangue. Sono state utilizzate varie tecniche di concentrazione, come goccia spessa e centrifugazione tubo capillare (CTC), ma la separazione dei parassiti dal sangue di una colonna di scambiatore di anioni (DEAE cellulosa) seguita da centrifugazione e osservazione al microscopio della a pellet, è il metodo più sensibile (può essere rilevato circa 50 parassiti/mL di sangue)1,7. Di conseguenza, la purificazione di trypanosomes da questo metodo di anione-scambiatori (DEAE cellulosa) è il migliore e, ad oggi, il metodo di riferimento per la visualizzazione e isolare i parassiti dal sangue per la diagnosi di cappello. In condizioni di campo, una mini-colonna di DEAE cellulosa è stata utilizzata con successo e diversi miglioramenti hanno facilitato l'osservazione microscopica7,8.
Il metodo di separazione Tripanosoma dal sangue, descritto di seguito, dipende dalla carica superficiale del parassita, che è meno negativo di cellule del sangue dei mammiferi9. Interessante, questo metodo è stato sviluppato 50 anni fa, nel 1968 da Dr. Sheila Lanham e rimane il gold standard per il rilevamento e la preparazione dei tripanosomi flusso sanguigno. È veloce e riproducibile per salivarian trypanosomes da una vasta gamma di mammiferi, permettendo la diagnosi di entrambi di tripanosomiasi animale e umano10.
Per ottenere parassiti living, purificati, sangue infetto è aggiunto su una colonna di scambiatore di anioni. Condizioni di cromatografia (principalmente pH, forza ionica del buffer e media) devono essere adattati ad ogni specie di Tripanosoma e più in generale, ad ogni mix di cellule del sangue dei mammiferi e trypanosomes10. Tampone di eluizione è regolato precisamente a pH 8 per l'africano trypanosomes10. Questo metodo favorisce la concentrazione di parassiti trovati nel sangue dei pazienti, perché parassitemie può essere troppo bassa per essere rilevata da osservazione microscopica da solo, e permette anche le indagini del laboratorio. Lavorare con trypanosomes appena isolate e il sangue di animali infetti, utilizzando questa tecnica, è più pertinente per varie indagini rispetto agli studi con i parassiti che sono stati coltivati in condizioni axeniche in laboratorio per un periodo indefinito.
Rapporti ospite-parassita sono meglio studiati con un parassita che infetta il sua ospite naturale, pertanto, musculi T., un parassita murino naturale, che è rappresentante di trypanosomes extracellulare, ha molti vantaggi come infezione murina coinvolge un piccolo laboratorio animale e non necessita di condizioni di livello (BSL) di sicurezza biohazard. T. musculi non uccidere i topi immunocompetenti, a differenza di molte altre specie di Trypanosoma , tra cui agenti patogeni umani. T. musculi non vengono eliminate in topi privati del T cell e parassitemie può essere aumentato in topi infettati modificando l'assunzione degli elementi nutritivi e cibo11. Questo parassita modula la risposta immunitaria in co-infezioni con altri agenti patogeni12. T. musculi da topi infetti esibire differenze da coltivate musculi T., ad esempio, l'espressione di recettori di membrana Fc viene perso in T. musculi colture axeniche, rispetto ai parassiti purificati da topi infetti13 , 14. fattori secreti Excreted (FSE) sono anche qualitativamente e quantitativamente meno espressa nelle colture axeniche Tripanosoma e differiscono tra i ceppi isolati in zone endemiche15. FSE sono gli antigeni primi da visualizzare per il sistema immunitario dell'ospite e quindi giocare un ruolo importante nell'host iniziale risposta immunitaria16.
Negli animali infettati sperimentalmente per le indagini del laboratorio, questo protocollo facilita la sperimentazione su un maggior numero di parassiti, riducendo al minimo il numero di topi necessaria soprattutto quando si utilizzano animali immunodepressi. Le glicoproteine di superficie variante (generatori di segnale vettoriale) che vengono utilizzate nel Test di agglutinazione di carta per tripanosomiasi (CATT) in screening di massa sono ancora purificate da trypanosomes che vengono propagati in ratti. I due test diagnostici rapidi (confezionati singolarmente cassette) che sono ora disponibili per l'uso in campo, ancora utilizza un'origine infettiva modello nativo generatori di segnale vettoriale e non in vitro coltivate trypanosomes1,4, 5. l'avanzamento nello studio del Tripanosoma immunologia e biologia è stata facilitata dal momento che questi parassiti DEAE cellulosa purificata possono essere facilmente ottenuti in grandi quantità dai padroni di casa naturalmente o sperimentalmente infetti e in particolare, roditori.
Protocollo
Indagini conformano alle linee guida per la cura e l'uso di animali da laboratorio (NIH pubblicazione n. 85±23, riveduta 1996). Protocolli sono stati approvati dal nostro comitato etico locale.
1. gli animali
- Tenere topi Swiss (OF-1) femmina invecchiati otto-dieci settimane vecchie, 20-25 g, in un animale alloggiamento impianto quindici giorni prima di ogni esperimento. Ospitarli in scatole ventilate che vengono tenuti in un protetto, temperatura (22 ° C) e umidità (50%) controllato la camera, con 12 ore ciclo di luce di accensione e spegnimento.
- Dare animali libero accesso a cibo e acqua. Ridurre al minimo dolore, sofferenza e angoscia e fornire un arricchimento dell'ambiente.
- Per l'alloggiamento, utilizzare gabbie con pareti chiare, arricchimento con bastoni di legno e cartone tunnel. Tirare delicatamente verso un animale in un tunnel per il trasferimento dalla gabbia al palmo della mano.
- Esegue il monitoraggio giornaliero per valutare segni di prostrazione, isolamento sociale, lesioni corporali, capelli arruffati o mancanza di governare.
- Pesare ogni animale una volta a settimana. Eseguire ispezioni regolari da parte di un veterinario.
- Per i parassiti naturali, raccogliere il sangue al picco di parassitemia e per i parassiti che causano la morte degli animali, raccogliere il sangue il giorno prima della morte presunta.
Nota: Tutti gli esperimenti con agenti infettivi sono eseguiti nelle sale dedicate, secondo linee guida Università approvato.
2. tamponi, preparazioni di media
- Pesare ciascuna sostanza e aggiungere acqua distillata per i buffer seguenti:
- Preparare la soluzione tampone fosfato concentrato (2x):
Na2HPO4 (anidro) (MW 141,96 g) 10,14 g
NaH2PO4∙2H2O (MW 156,01 g) 0,62 g
NaCl (MW 58,44 g) 2,55 g
Acqua distillata di H2O a 1 L - Preparare il tampone fosfato salino-glucosio:
Na2HPO4 (anidro) (MW 141,96 g) 5,39 g
NaH2PO4∙2H2O (MW 156,01 g) 0,31 g
NaCl (MW 58,44 g) 1,70 g
Glucosio (MW 180g) 10 g
Acqua distillata di H2O a 1 L - Preparare 1 M KH2PO4.
- Preparare il tampone di eluizione: Supplemento Phosphate-Buffered Saline-glucosio con
Penicillina (100 U/mL), streptomicina (100 µ g/mL) e rosso fenolo (5 µ g/mL).
- Preparare la soluzione tampone fosfato concentrato (2x):
3. preparazione di DEAE-cellulosa
- Piano circa 5 ore per la preparazione di DEAE-cellulosa.
- 100 g di DEAE-cellulosa con acqua distillata in una boccetta con un collo stretto di lavare e far risolvere, poi scarta le particelle fini. Ripetere i lavaggi fino a quando il surnatante è chiaro.
- Aggiungere 3 L di concentrato 2X Phosphate-Buffered Saline e mescolare.
- Regolare il pH a 8.0 con 1m KH2PO4 ed eliminare il surnatante.
- Lavare due volte con acqua distillata e lasciare a stabilirsi.
- Lavare e far pagare due volte con 3 litri Phosphate-Buffered Saline-glucosio e scartare i surnatanti.
- Misurare il volume di cellulosa e aggiungere un volume equivalente di Phosphate-Buffered Saline-glucosio, distribuire in bottiglie di plastica e conservare a-20 ° C.
4. parassiti
- Raccogliere ceppi Tripanosoma nelle aree endemiche per la tripanosomiasi umana e animale. Mantenere i parassiti congelati in azoto liquido.
Nota: Trypanosoma musculi è non patogeni per l'uomo ed è un extracellulare Tripanosoma utilizzato per sostituire tranquillamente trypanosomes patogeni in vari esperimenti di laboratorio. - Nel caso di indagini di laboratorio che richiedono agenti patogeni umani, gestire esperimenti con cura in condizioni di livello (BSL) di sicurezza biohazard appropriato dedicato e precauzioni; BSL2 per gambiense del t.b. e BSL3 per rhodesiense del t.b.. In condizioni di campo, viene stabilita la pratica standard microbiologico: sicuro campionamento, meccanico di pipettaggio, frequenti decontaminazione delle superfici e la sterilizzazione dei rifiuti.
5. infezione di Mouse
- Scongelare rapidamente i parassiti in un bagno di acqua a 37 ° C.
- Osservare una goccia di sangue infetto scongelati con un microscopio. Valutare parassita vitalità misurando la percentuale di forme mobili17.
- Iniettare parassiti per via intraperitoneale nei topi (0,5 mL per topo). Ogni giorno, dopo l'infezione, raccogliere 20 µ l di sangue di coda dalla puntura dell'ago e osservare al microscopio. Valutare la parassitemia secondo Herbert e Lumsden18 contando i parassiti in diversi campi di microscopio, o utilizzando un emocitometro.
- Quando la parassitemia raggiunge una soglia definita per ogni ceppo, raccogliere il sangue (1 mL/mouse) nel buffer di eluizione (5 mL/topo) contenente eparina (10 U/mL).
Nota: Il lavoro originale e romanzo di Lanham e Godfrey segnalato che la forza ionica ottima di fosfato tampone salino glucosio per diverse specie di ospite/parassita da una soluzione madre di pH 8.0.
6. separazione di parassita
Nota: Tutti gli esperimenti da questo punto in poi devono avvenire in una cappa di coltura del tessuto con i guanti. La temperatura e l'umidità nei laboratori utilizzati erano 22 ° C e 45% rispettivamente. In condizioni di campo, separazione del parassita è stata eseguita con successo a 34 ° C.
- Inserire una siringa da 10 mL in un supporto verticale e aggiungere una circolare tagliata precedentemente, pezzo di carta da filtro, lana di vetro o spugna di cellulosa.
- Versare il DEAE cellulosa nella siringa finché non viene raggiunto il livello 8 mL, poi lavare con 25 mL di tampone di eluizione.
- Attentamente aggiungere 2 mL di sangue diluito nella parte superiore della colonna e quindi aggiungere mezzo di eluizione. Regolarmente aggiungere tampone di eluizione secondo il transito dei tripanosomi.
- Raccogliere gocce degli effluenti dalle colonne in una provetta da centrifuga e verificare regolarmente la presenza di parassiti con un microscopio.
- Quando i parassiti non vengono rilevati nell'effluente colonna, centrifugare la provetta (1.800 x g, 10 minuti, a 4 ° C in laboratorio e a temperatura ambiente in condizioni di campo).
- Rimuovere il supernatante e sospendere i parassiti in 1 mL di terreno pertinente richiesto per il prossimo passo investigativo.
- Contare i parassiti con un emocitometro e diluirli in mezzo appropriato se necessario.
Risultati
Trypanosomes purificati sono stati utilizzati in prove farmaceutiche. I parassiti vengono trasferiti nei pozzetti di coltura contenenti diluizioni seriali di droghe specifiche, da solo o misto19. Osservazioni al microscopio, valutazione della motilità è un indicatore della redditività, possono essere eseguite quando solo pochi Dug sono in fase di test, mentre AlamarBlue cella analisi di attuabilità è un metodo eccellente per saggi di grande motilità durante lo screening di20. L'effetto di pentamidina, un farmaco di riferimento utilizzato nella terapia del cappello, viene visualizzato in Figura 1.
I macrofagi sono molto utili nelle culture come le cellule di alimentatore. Essi consentono, in vitro, l'iniziazione e lo sviluppo del Tripanosoma culture21. Abbiamo riferito che i numeri dei macrofagi attivati in alternativa sono aumentati nei mammiferi infettati Tripanosoma in cui favoriscono parassita di crescita22. Questa attivazione del macrofago alternativo fornisce L-ornitina, che è essenziale per la crescita del parassita. In vitro co-culture del macrofago-parassita hanno indicato che trypanosomes indurre attivazione alternativa del macrofago via fattori secreti. Extracellulare trypanosomes secernono una chinesina che lega i ricevitori del associazione di mannosio del macrofago che inducono espressione dell'arginasi fornendo produzione di L-ornitina favorendo parassita differenziazione e moltiplicazione23,24 ( Figura 2). Mannosio inibisce la chinesina associazione e induzione dell'arginasi e topi ricevitore-carenti di mannosio delucidare il bersaglio di kinesin sui macrofagi (Figura 3).
Poiché numerosi genomi Tripanosoma ora sono stati sequenziati e annotati, siamo stati in grado di approfittare di questi grandi insiemi di dati. Successivamente, siamo stati in grado di svolgere la genetica inversa e diretta su questi parassiti. Utilizzando questi dati, purificato forma di circolazione sanguigna trypanosomes sono stati usati per caratterizzare e analizzare strutture importanti quali la tasca flagellare (FP) e suoi associato citoscheletro. La FP è il sito di solo di endo ed esocitosi in trypanosomes ed è anche dove le glicoproteine di superficie variabile sono vittime della tratta dal sistema di endomembrane25. Il collare di tasca flagellare (FPC) è un anulare a forma di struttura associata al flagello nel punto dove esce la FP, ma fino a quando recentemente poco si conosceva i costituenti della proteina del FPC. Abbiamo identificato una proteina importante della FPC, TbBILBO1 e hanno dimostrato che è essenziale per la sopravvivenza del parassita sia nella forma colta insetto Mosca Tse-Tse e nel flusso sanguigno modulo26. Atterramento di TbBILBO1 di RNAi previene la formazione di FP e inibisce la biogenesi di molte altre importanti strutture citoscheletriche, rendendo il FPC e gli obiettivi importanti di FP per intervento in tutti i patogeni trypanosomes. Parassita purificato o coltivate cellule con anticorpi anti- TbBILBO1 di sondaggio indica che nel modulo di flusso sanguigno e prociclico (insetto), crea una struttura a forma di anello che elude il flagello. Tale etichettatura, su una forma di circolazione sanguigna, è illustrato nella Figura 4.
Flusso sanguigno purificata forma trypanosomes hanno consentito la caratterizzazione di molti insolita peculiarità biochimiche e metaboliche, compreso il metabolismo del glucosio, che si svolge in peroxisome-come organelli chiamati glycosomes (Vedi Figura 5). È stato generalmente accettato che piruvato è il prodotto finale principale escreto dal metabolismo del glucosio dai trypanosomes circolazione sanguigna, con virtualmente nessuna produzione di succinato e acetato all'interno del mitocondrio. Al contrario, i tripanosomi prociclico convertono treonina in acetato e glucosio in succinato e acetato27,28. Metabolismo energetico dei trypanosomatids può essere valutato dall'adattamento alla fonti di carbonio disponibile. Combinazione di genetica inversa e analisi metabolomica confermato produzione nel mitocondrio dei tripanosomi flusso sanguigno di acetato da glucosio-derivati del piruvato e treonina, così come produzione di succinato da glucosio19,20 (Figura 5). Per esempio, 1H-NMR analisi dei prodotti finiti escreta dal flusso sanguigno forma trypanosomes incubati in PBS contenente glucosio 4 mM, rivelato che glucosio principalmente è convertito in piruvato (85,1% dei prodotti escreti), con minore produzione di alanina (9,2%), acetato (4,9%) e succinato (0,8%)29. Questi percorsi, che sono minori in termini di cambiamento continuo metabolico rispetto alla produzione di piruvato da glucosio, sono essenziali per la crescita del parassita. La filiera di produzione del succinato così può essere considerato come un buon potenziale bersaglio per lo sviluppo di nuovi farmaci trypanocidal.
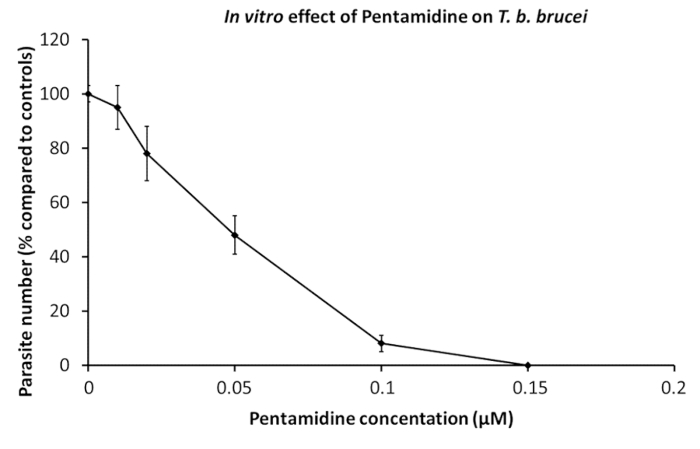
Figura 1 : Effetto in vitro di pentamidina su T. brucei b.. Diluizioni di pentamidina sono stati aggiunti 2 x 105 parassiti per determinare la concentrazione di inibizione della crescita di parassita del 50% (IC50). Curve dose-effetto 24 ore di cultura. Barre di errore rappresentano l'errore standard della media da 5 esperimenti indipendenti. Clicca qui per visualizzare una versione più grande di questa figura.
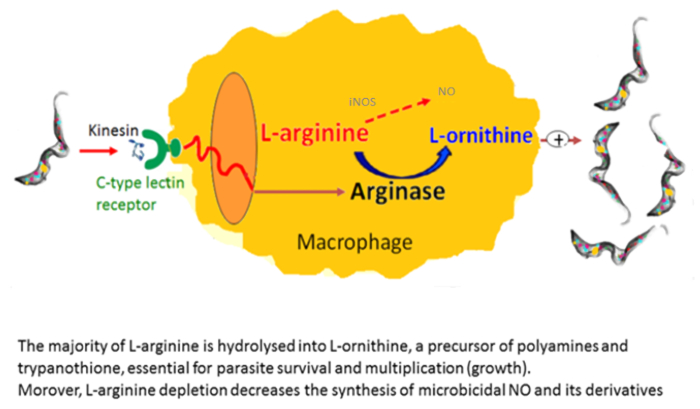
Figura 2 : Induzione Tripanosoma-mediata dell'arginasi. Una chinesina rilasciato da tripanosomi si lega ai recettori di lectina C-tipo che portano all'induzione dell'arginasi. Ciò si traduce in aumento della produzione di L-ornitina e poliamine, essenziale per la crescita del parassita e differenziazione e nello svuotamento di L-arginina, con conseguente minore produzione di citotossico NO dal macrofago NOS II. Clicca qui per visualizzare una versione più grande di questa figura.
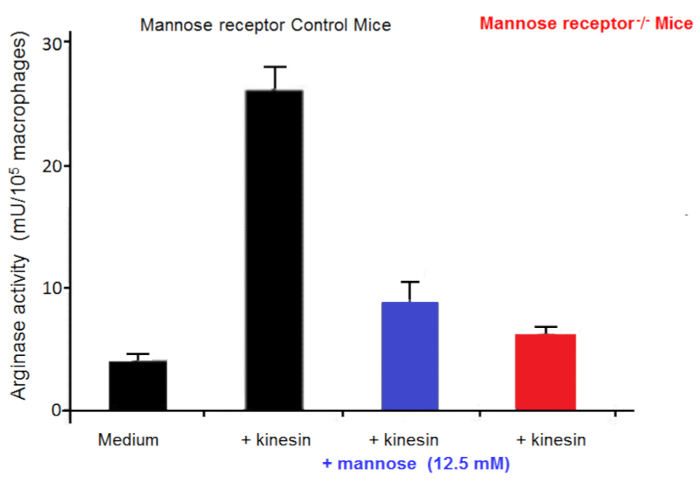
Figura 3 : Attività dell'arginasi del macrofago. L'attività dell'arginasi in macrofagi dai topi di controllo e mannosio recettore topi knock out (KO) coltivate in vitro in mezzo per 48 ore, con o senza chinesina o mannosio. Barre di errore rappresentano l'errore standard della media da 5 esperimenti indipendenti. Clicca qui per visualizzare una versione più grande di questa figura.

Figura 4 : TB BILBO1 etichettatura di una forma di circolazione sanguigna Trypanosoma brucei brucei cella Immunofluorescenza (A) l'etichettatura di una circolazione sanguigna, forma della coltura, 427 cella 90-13 che è stato sondato con anticorpo monoclonale anti-BILBO1 seguita da un anticorpo di anti-topo FITC-etichettati e visualizzato usando la luce ultravioletta, (Tb BILBO1 sono i segnali anulari verdi) e il DNA binding colorante DAPI (segnali di blu) (B) A unire delle immagini di contrasto DAPI, anti-BILBO1 e fase di 10 µm. Anti-BILBO1 mouse monoclonale è stato diluito 01:10 in PBS e l'anticorpo secondario (è uguale a barra di scala r. anti-topo IgM FITC) è stato diluito 1: 100. Immagini sono state scattate su un microscopio dotato di una fotocamera digitale. Clicca qui per visualizzare una versione più grande di questa figura.

Figura 5 : Rappresentazione schematica del metabolismo glucidico e treonina in trypanosomes forma flusso sanguigno. Prodotti finiti viene escreti dal metabolismo del glucosio e treonina sono boxed. Le frecce blue spesse indicano passaggi enzimatici del metabolismo del glucosio che porta alla produzione di piruvato, che è il principale prodotto finale escreto da glicolisi. Frecce nere rappresentano trascurato le vie metaboliche secondarie dalla degradazione del glucosio e treonina, che sono essenziali per la crescita del parassita. Il contributo degli enzimi indicati è stato validato sperimentalmente: ACH, acetil-CoA tioesterasi (CE 3.1.2.1); ASCT, acetato: Succinato CoA-transferasi (EC 2.8.3.18); AKCT, 2-ammino-3-ketobutyrate coenzima A ligasi (EC 2.3.1.29); PEPCK, carbossichinasi del fosfoenolpiruvato (EC 4.1.1.49); PDH, complesso della deidrogenasi del piruvato (CE 1.2.4.1); TDH, treonina 3-deidrogenasi (EC 1.1.1.103). Abbreviazioni: AcCoA, acetil-CoA; AOB, amino ossobutirrato; DHAP, diidrossiacetone fosfato; G3P, gliceraldeide 3-fosfato; MAL, malato; OA, ossaloacetato; PEP, fosfoenolpiruvato; PYR, piruvato. Clicca qui per visualizzare una versione più grande di questa figura.
Discussione
Purificata trypanosomes rappresentano un potente mezzo per studiare immunologia, biochimica, biologia molecolare e cellulare. Grandi distese di dati e risultati sono state ottenute da trypanosomes, che ha poi contribuito a ottenere informazioni dalle altre cellule eucariotiche30. Trypanosomes sono anche oggetto di ricerca importante e interessante, perché essi hanno messo a punto numerosi meccanismi che consentono loro di sopravvivere e crescere in due ambienti molto diversi: il vettore di Mosca Tse-Tse e il mammifero ospite23, 31. varie tecniche per isolare i trypanosomes sono stati segnalati, e una recensione su approcci basati su microfluidica è stato recentemente pubblicati32. Quindi, un mezzo robusto e riproducibile di isolamento parassita è essenziale.
DEAE cellulosa preparazione è un passo indispensabile in questo protocollo di preparazione del parassita. Condizioni di lavaggio devono essere effettuate con cautela per eliminare le particelle fini ed equilibrare la resina e il pH deve essere regolato con precisione (pH 8.0 è adatto per la maggior parte delle specie di Tripanosoma). Tutti i passaggi devono essere regolati per migliorare la purificazione del parassita e la resa mantenendo proprietà vitalità e cellular parassita. D'importanza, l'infettività e la vitalità del parassita sono stati mantenuti dopo la purificazione attraverso una colonna di DEAE-cellulosa. Tuttavia, alcuni ceppi sono più fragili rispetto ad altri e potrebbero essere meno infettive dopo purificazione33. Di conseguenza, l'impatto delle condizioni di separazione su componenti della membrana pellicolare, metabolismo del parassita, segnalazione, le funzioni dell'acido nucleico e infettività degli animali, devono essere valutate e condizioni di separazione devono essere adattati di conseguenza.
Limitazioni di questa tecnica sono che questa procedura deve essere adattata a ciascuna specie di Tripanosoma in un dato host ed è anche molto tempo. Inoltre, DEAE cellulosa ora è costoso. Le analisi preliminari sono necessarie per ottimizzare le condizioni di separazione, in particolare i media, che possono avere diversi punti di forza Ioniche e un pH preciso. Passaggi di pre-colonna, tra cui la scelta dell'anticoagulante, previa centrifugazione per rimuovere la maggior parte degli eritrociti, l'uso del cappotto buffy e lisi degli eritrociti, sono scelte in ogni esperimento. Precise modifiche su un singolo parametro (buffer, temperatura in tutto il protocollo, i parametri di centrifugazione) potrebbe aumentare notevolmente il numero, il grado di purificazione e di attuabilità di parassiti ottenuto33. Lo sviluppo di nuovi parametri di separazione secondo la specie di parassita e le cellule del sangue dei mammiferi essere separati, potrebbe essere necessario. Adattamenti del protocollo iniziale di Loi e di Godfrey ha permesso la purificazione di biologicamente ed antigenicamente conservato T. cruzi dal sangue34. Nuove resine possono anche essere testate e utilizzate con condizioni appropriate per diverse specie35.
Il ruolo principale di escrete/secrete fattori (ES) di trypanosomatids è stato recentemente enfatizzato16. ES contengono molecole coinvolte nella patologia e immunomodulazione, come la chinesina, che è conservata tra trypanosomes24. Preparazione di ES da parassiti purificati richiede particolare cura per evitare la contaminazione da componenti di media di eluizione e lisati parassiti.
Un vaccino basato su ES efficace contro Leishmania, un parassita correlato, già esiste ed è disponibile (CaniLeish Virbac)36. Associazione delle molecole conservate giocando ruoli essenziali nella crescita e sopravvivenza del parassita potrebbe rappresentare la base per un futuro vaccino contro trypanosomes, sia per gli esseri umani e animali, in un approccio one-salute. Purificazione dei tripanosomi africani dal sangue da colonne DEAE-cellulosa, con miglioramenti, resta il gold standard per il rilevamento di Tripanosoma in ospiti naturali con basse parassitemie nelle zone endemiche e per la necessità di parassiti in gran numero per indagini sperimentali.
Divulgazioni
Gli autori non hanno nulla a rivelare.
Riconoscimenti
Ringraziamo tutti i membri di UMR 177 INTERTRYP IRD CIRAD Université de Bordeaux. Questa ricerca è stata sostenuta da finanziamenti interni da Università di Bordeaux e supporto dall'ANR, LABEX ANR ParaFrap-11-LABX-0024 e dall'associazione pour le développement de la recherche en parasitologie et médecine tropicale e il de servizio Coopération et d'Action culturelle de l'Ambassade de France à Bangui (Centrafrique).
Materiali
| Name | Company | Catalog Number | Comments |
| 10 mL Pipettes | Falcon | 357,551 | |
| 2 mL Pipettes | Falcon | 352,507 | |
| Centrifugation tube 50 mL | Falcon | 352,070 | |
| Centrifuge | Sigma Aldrich | 4K15 | |
| DEAE cellulose | Santa Cruz | s/c- 211213 | 100 G |
| filter paper | Whatman | 1,001,125 | |
| Flat bottom flask narrow neck | Duran | 21 711 76 | 6000 mL |
| Glucose | VWR | 101174Y | 500 G |
| Heparin | Sigma Aldrich | H3149-50KU | 5 000 U |
| KH2PO4 | VWR | 120 26936.260 | 500 G |
| Microscope | Olympus | CH-20 | |
| Microscope coverslips | Thermofisher scientific | CB00100RA020MNT0 | |
| Microscope slides | Thermofisher scientific | AGAA000001 | |
| Na2HPO4 | VWR | 100 28026;260 | 500 G |
| NaCl | VWR | 27800.291 | 1 KG |
| NaH2PO4 | VWR | 110 33616;262 | 500 G |
| Nalgene Plastic Media Bottles size 125 mL | Thermofisher scientific | 342024-0125 | |
| Nalgene Plastic Media Bottles size 500 mL | Thermofisher scientific | 342024-0500 | |
| Pasteur Pipette | VWR | BRND125400 | |
| Penicillin 10,000 UI/Streptomycin 10,000 µg | EUROBIO | CABPES01 OU | 100 mL |
| Phenol red | Sigma Aldrich | P0290 | 100 mL |
| Syringue | Dutscher | SS+10S21381 | |
| Tissue culture hood | Thermoelectro Corporation | MSC-12 | |
| Trypanosoma brucei brucei | Institute of Tropical Medicine (Antwerp, Belgium). | ANTAT 1.1 | |
| Trypanosoma brucei gambiense | Institute of Tropical Medicine (Antwerp, Belgium). | ITMAP 1893 | |
| Trypanosoma musculi | London School of Hygiene and Tropical Medicine (UK) | Partinico II |
Riferimenti
- Büscher, P., Cecchi, G., Jamonneau, V., Priotto, G. Human African trypanosomiasis. Lancet. 390 (10110), 2397-2409 (2017).
- Lejon, V., Bentivoglio, M., Franco, J. R. Human African trypanosomiasis. Handbook of Clinical Neurology. 114, 169-181 (2013).
- Giordani, F., Morrison, L. J., Rowan, T. G., De Koning, H. P., Barrett, M. P. The animal trypanosomiases and their chemotherapy: a review. Parasitology. 143 (14), 1862-1889 (2016).
- Aksoy, S., Buscher, P., Lehane, M., Solano, P., Van Den Abbeele, J. Human African trypanosomiasis control: Achievements and challenges. PLoS Neglected Tropical Diseases. 11 (4), e0005454(2017).
- Büscher, P., Deborggraeve, S. How can molecular diagnostics contribute to the elimination of human African trypanosomiasis? Expert Review of Molecular Diagnostics. 15 (5), 607-615 (2015).
- Truc, P., et al. Atypical human infections by animal trypanosomes. PLoS Neglected Tropical Diseases. 7 (9), e2256(2013).
- Lumsden, W. H., Kimber, C. D., Evans, D. A., Doig, S. J. Trypanosoma brucei: miniature anion-exchange centrifugation technique for detection of low parasitaemias: adaptation for field use. Transactions of the Royal Society of Tropical Medicine and Hygiene. 73 (3), 312-317 (1979).
- Büscher, P., et al. Improved Models of Mini Anion Exchange Centrifugation Technique (mAECT) and Modified Single Centrifugation (MSC) for sleeping sickness diagnosis and staging. PLoS Neglected Tropical Diseases. 3 (11), e471(2009).
- Lanham, S. M. Separation of trypanosomes from the blood of infected rats and mice by anion-exchangers. Nature. 218 (5148), 1273-1274 (1968).
- Lanham, S. M., Godfrey, D. G. Isolation of salivarian trypanosomes from man and other mammals using DEAE-cellulose. Experimental Parasitology. 28 (3), 521-534 (1970).
- Humphrey, P. A., Ashraf, M., Lee, C. M. Growth of trypanosomes in vivo, host body weight gains, and food consumption in zinc-deficient mice. Journal of the National Medical Association. 89 (1), 48-56 (1997).
- Lowry, J. E., Leonhardt, J. A., Yao, C., Belden, E. L., Andrews, G. P. Infection of C57BL/6 mice by Trypanosoma musculi modulates host immune responses during Brucella abortus cocolonization. Journal of Wildlife Diseases. 50 (1), 11-20 (2014).
- Vincendeau, P., Daëron, M., Daulouede, S. Identification of antibody classes and Fc receptors responsible for phagocytosis of Trypanosoma musculi by mouse macrophages. Infection and Immunity. 53 (3), 600-605 (1986).
- Vincendeau, P., Daëron, M. Trypanosoma musculi co-express several receptors binding rodent IgM, IgE, and IgG subclasses. Journal of Immunology. 142 (5), 1702-1709 (1989).
- Holzmuller, P., et al. Virulence and pathogenicity patterns of Trypanosoma bruceigambiense field isolates in experimentally infected mouse: differences in host immune response modulation by secretome and proteomics. Microbes and Infections. 10 (1), 79-86 (2008).
- Holzmuller, P., et al. How do parasites and their excreted-secreted factors modulate the inducible metabolism of L-arginine in macrophages? Frontiers in Immunology. 9, 778(2018).
- Abrahamson, I. A., Da Silva, W. D. Antibody-dependent cytotoxicity against Trypanosoma cruzi. Parasitology. 75 (3), 317-323 (1977).
- Herbert, W. J., Lumsden, W. H. Trypanosoma brucei: a rapid "matching" method for estimating the host's parasitemia. Experimental Parasitology. 40 (3), 427-431 (1976).
- Dauchy, F. A., et al. Trypanosoma brucei CYP51: Essentiality and Targeting Therapy in an Experimental Model. PLoS Neglected Tropical Diseases. 10 (11), e0005125(2016).
- Raz, B., Iten, M., Grether-Bühler, Y., Kaminsky, R., Brun, R. The Alamar Blue assay to determine drug sensitivity of African trypanosomes (T. b. rhodesiense and T. b. gambiense) in vitro. Acta Tropica. 68 (2), 139-147 (1997).
- Albright, J. W., Albright, J. F. In vitro growth of Trypanosoma musculi in cell-free medium conditioned by rodent macrophages and mercaptoethanol. International Journal for Parasitology. 10 (2), 137-142 (1980).
- Gobert, A. P., et al. L-Arginine availability modulates local nitric oxide production and parasite killing in experimental trypanosomiasis. Infection and Immunity. 68 (8), 4653-4657 (2000).
- De Muylder, G., et al. A Trypanosoma brucei kinesin heavy chain promotes parasite growth by triggering host arginase activity. PLoS Pathogens. 9 (10), e1003731(2013).
- Nzoumbou-Boko, R., et al. Trypanosoma musculi Infection in Mice Critically Relies on Mannose Receptor-Mediated Arginase Induction by a TbKHC1 Kinesin H Chain Homolog. Journal of Immunology. 199 (5), 1762-1771 (2017).
- Bonhivers, M., Nowacki, S., Landrein, N., Robinson, D. R. Biogenesis of the trypanosome endo-exocytotic organelle is cytoskeleton mediated. PLoS Biology. 6 (5), e105(2008).
- Albisetti, A., et al. Interaction between the flagellar pocket collar and the hook complex via a novel microtubule-binding protein in Trypanosoma brucei. PLoS Pathogens. 13 (11), e1006710(2017).
- Cross, G. A. M., Klein, R. A., Linstead, D. J. Utilization of amino acids by Trypanosoma brucei in culture: L-threonine as a precursor for acetate. Parasitology. 71 (2), 311-326 (1975).
- Bringaud, F., Rivière, L., Coustou, V. Energy metabolism of trypanosomatids: adaptation to available carbon sources. Molecular and Biochemical Parasitology. 149 (1), 1-9 (2006).
- Mazet, M., et al. Revisiting the central metabolism of the bloodstream forms of Trypanosoma brucei: production of acetate in the mitochondrion is essential for the parasite viability. PLoS Neglected Tropical Diseases. 7 (12), e2587(2013).
- Coutton, C., et al. Mutations in CFAP43 and CFAP44 cause male infertility and flagellum defects in Trypanosoma and human. Nature Communications. 9 (1), 686(2018).
- Cnops, J., Magez, S., De Trez, C. Escape mechanisms of African trypanosomes: Why trypanosomosis is keeping us awake. Parasitology. 142 (3), 417-427 (2015).
- Barrett, M. P., et al. Microfluidics-Based Approaches to the Isolation of African Trypanosomes. Pathogens. 6 (4), (2017).
- Taylor, A. E., Lanham, S. M., Williams, J. E. Influence of methods of preparation on the infectivity, agglutination, activity, and ultrastructure of bloodstream trypanosomes. Experimental Parasitology. 35 (2), 196-208 (1974).
- Gutteridge, W. E., Cover, B., Gaborak, M. Isolation of blood and intracellular forms of Trypanosoma cruzi from rats and other rodents and preliminary studies of their metabolism. Parasitology. 76 (2), 159-176 (1978).
- Cruz-Saavedra, L., et al. Purification of Trypanosoma cruzi metacyclic trypomastigotes by ion exchange chromatography in sepharose-DEAE, a novel methodology for host-pathogen interaction studies. Journal of Microbiological Methods. 142, 27-32 (2017).
- Lemesre, J. L., et al. Long-lasting protection against canine visceral leishmaniasis using the LiESAp-MDP vaccine in endemic areas of France: double-blind randomised efficacy field trial. Vaccine. 25 (21), 4223-4234 (2007).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon