Method Article
Purification des Trypanosomes extracellulaires, y compris les pays d’Afrique, du sang par échangeurs d’anions (colonnes diéthylaminoéthyl-cellulose)
Dans cet article
Résumé
Cette méthode de séparation des trypanosomes dans le sang dépend de leur charge de surface étant moins négatif que les cellules de sang de mammifères. Sang contaminé est placé et traité sur une colonne d’échangeur d’anions. Cette méthode, plus raccord diagnostique pour la trypanosomiase africaine, fournit parasites purifiées à des investigations immunologiques, biologiques, biochimiques, pharmaceutiques et de la biologie moléculaire.
Résumé
Cette méthode permet la séparation des trypanosomes, parasites responsables de la trypanosomiase africaine humaine et animale (tha), du sang infecté. Il s’agit de la meilleure méthode pour le diagnostic de la première étape de chapeau et de plus cette méthode de purification du parasite permet sérologique et enquêtes de recherche.
CHAPEAU est causée par la mouche tsé-tsé transmis Trypanosoma brucei gambiense et T. b. rhodesiense. Trypanosomes connexes sont les agents responsables de la trypanosomiase animale. Détection de trypanosome est essentielle pour chapeau diagnostic, traitement et suivi. La technique décrite ici est la technique de détection plus sensible parasite, adaptée aux conditions de terrain pour le diagnostic de T. b. gambiense HAT et peut être complétée en une heure. Sang est posée sur une colonne d’échangeur d’anions (DEAE cellulose) préalablement ajustée à pH 8 et tampon d’élution est ajouté. Très négativement chargés de globules sont adsorbés sur la colonne alors que les trypanosomes moins négativement chargés de passer à travers. Trypanosomes recueillies sont granulées par centrifugation et observés au microscope. En outre, parasites sont préparés sans dommages cellulaires tout en conservant leur infectiosité.
Trypanosomes purifiés sont nécessaires pour les tests immunologiques. Ils sont utilisés dans l’analyse de la demande, l’étalon-or en sérologie HAT. Parasites colorés sont utilisés dans le test d’agglutination de carte (CATT) sérologie de champ. Antigènes de trypanosomes purifiés, comme la glycoprotéine de surface variant, antigènes exogènes, sont également utilisés dans les Immunoessais divers. La procédure décrite ici est conçue pour les trypanosomes africains ; par conséquent, conditions chromatographiques doivent être adaptés à chaque souche trypanosome et plus généralement, dans le sang de chaque espèce de mammifère hôte.
Ces fascinants pathogènes sont facilement purifié et disponible pour une utilisation en biochimique, moléculaire et cellulaire des études de biologie y compris co-culture avec des cellules de l’hôte pour étudier les relations hôte-parasite au niveau des récepteurs membranaires, signalisation et gène expression ; drogue test in vitro; enquête de surexpression sur les processus métaboliques, la biogenèse du cytosquelette et de survie du parasite, mutation ou délétion du gène.
Introduction
La méthode présentée décrite ici permet la séparation des trypanosomes, parasites responsables de la trypanosomiase africaine humaine et animale (tha), du sang. Il s’agit de la meilleure méthode pour le diagnostic de la première étape de chapeau et de plus cette méthode de purification du parasite permet robuste enquête sérologique et de la recherche.
CHAPEAU est causée par la mouche tsé-tsé transmis Trypanosoma brucei gambiense et T. b. rhodesiense1. Ces parasites protozoaires se multiplient extracellulaire dans la circulation sanguine, lymphatique et fluides interstitiels durant la première phase de la maladie (stade réalisée). La deuxième étape (étape méningo-encéphalitique) commence lorsque les parasites traversent la barrière hémato encéphalique ; des signes neurologiques, y compris un trouble du sommeil, qui a donné son nom « maladie du sommeil » à cette maladie, sont typiques de cette deuxième étape2. Les trypanosomes (T. evansi, T. congolense, T. vivax, T. b. brucei) sont les agents causals de l’animal de la trypanosomose africaine (AAT)3.
L’organisation mondiale de la santé (OMS) a pour but d’éliminer le chapeau comme un problème de santé publique d’ici à 2020 et d’arrêter la transmission en 20304. L’introduction récente de tests de diagnostic rapide a améliorer le diagnostic sérologique1,4,5. Plusieurs tests diagnostiques moléculaires ont été développés, mais leur rôle dans le diagnostic de terrain n’a pas encore été établi5. Ils sont utilisés pour identifier les sous-espèces du groupe brucei et atypique trypanosomose causée par des parasites responsables de trypanosomose animale6.
La détection du parasite est essentielle pour le diagnostic, le traitement et le suivi, comme sérologie peut donner des résultats faussement positifs et de faux malheureusement négatifs1. L’observation microscopique directe de ces protistes hemoflagellate est difficile dans les cas de chapeau qui sont causées par T. b. gambiense, (plus de 95 % des cas) comme faibles parasitémies sont la règle, tandis que pour le bonnet causée par T. b. rhodesiense, un grand nombre de parasites est fréquemment présent dans le sang. Différentes techniques de concentration ont été utilisées, telles que la goutte épaisse et centrifugation de tube capillaire (CTC), mais la séparation des parasites du sang par une colonne d’échangeur d’anions (DEAE cellulose) suivie par centrifugation et observation microscopique de la Pellet, est la méthode la plus sensible (environ 50 parasites/mL de sang peut être détectée)1,7. Par conséquent, la purification des trypanosomes par cette méthode de l’échangeur d’anions (DEAE cellulose) est le meilleur et, à ce jour, la méthode de référence pour les visualiser et isoler les parasites du sang pour le diagnostic de la HAT. Sur le terrain, une mini colonne de DEAE cellulose a été utilisée avec succès et plusieurs améliorations ont facilité l’observation microscopique7,8.
La méthode de séparation de trypanosomes dans le sang, décrit ci-dessous, dépend de la charge de surface parasite, qui est moins négatif que les cellules de sang de mammifères9. Fait intéressant, cette méthode a été développée en 1968 par le Dr Sheila Lanham il y a 50 ans et demeure l’étalon-or pour la détection et préparation des trypanosomes de circulation sanguine. C’est rapide et reproductible de trypanosomes salivarian parmi un large éventail de mammifères, permettant le diagnostic de tant de trypanosomiase humaine et animale10.
Pour obtenir des parasites vivants, purifiées, sang infecté est ajouté sur une colonne d’échangeur d’anions. Conditions chromatographiques (pH, force ionique de tampons/médias, principalement) doivent être adaptés à chaque espèce de trypanosomes et, plus généralement, à chaque mélange de cellules de sang de mammifères et trypanosomes10. Tampon d’élution est précisément ajusté à pH 8 pour plus de pays africains trypanosomes10. Cette méthode favorise la concentration des parasites dans le sang des patients, car parasitémies peut être trop faible pour être détectée par l’observation microscopique, et cela permet également aux examens de laboratoire. Travailler avec les trypanosomes fraîchement isolées et sur le sang des animaux infectés, en utilisant cette technique, est plus pertinent pour les diverses enquêtes que les études avec les parasites qui ont été cultivées dans des conditions axéniques en laboratoire pour une durée indéterminée.
Relations hôte-parasite sont mieux étudiées avec un parasite qui infecte son hôte naturel, par conséquent, T. musculi, un parasite murin naturel, qui est représentatif des trypanosomes extracellulaires, présente de nombreux avantages comme infection murine consiste en un animal de laboratoire petit et ne nécessite pas de conditions de niveau (BSL) de sécurité biologique. T. musculi ne tue pas les souris immunocompétentes, contrairement à beaucoup d’autres espèces de Trypanosoma , y compris les agents pathogènes humains. T. musculi ne sont pas éliminées chez les souris privés de lymphocytes T et parasitémies peut être augmentée chez les souris infectées par modification de l’apport alimentaire et nutriments11. Ce parasite module la réponse immunitaire chez des co-infections avec d’autres agents pathogènes12. T. musculi de souris infectées pièce différences de culture T. musculi, par exemple, l’expression des récepteurs Fc membrane se perd dans les cultures axéniques T. musculi , par rapport aux parasites purifiées à partir de souris infectées13 , 14. Excreted-sécrétée facteurs (FSE) sont également qualitativement et quantitativement moins exprimées dans les cultures axéniques trypanosome et diffèrent entre les souches isolées dans les zones d’endémie15. FSE sont les antigènes premières affiche pour le système immunitaire et donc jouer un rôle important dans l’hôte initial réponse immunitaire16.
Chez les animaux infectés expérimentalement pour les examens de laboratoire, ce protocole facilite l’expérimentation sur un plus grand nombre de parasites, réduisant au minimum le nombre de souris nécessaire surtout lors de l’utilisation des animaux immunodéprimés. Les glycoprotéines de surface variant (GSV) qui sont utilisés dans le Test d’Agglutination de carte pour la trypanosomiase (CATT) dans le dépistage de masse sont toujours purifiés de trypanosomes reproduits chez les rats. Les deux tests de diagnostic rapide (cassettes emballées individuellement) qui sont maintenant disponibles pour une utilisation sur le terrain, toujours utilisez une source de modèle infectieux de native VSGs et pas in vitro culture trypanosomes1,4, 5. les progrès dans l’étude du trypanosome immunologie et en biologie a été facilitée puisque ces DEAE cellulose purifiée parasites peuvent être facilement obtenus en grandes quantités d’hôtes naturellement ou expérimentalement infectés, en particuliers, rongeurs.
Protocole
Enquêtes étaient conformes aux lignes directrices pour le soin et l’utilisation des animaux de laboratoire (NIH Publication n° 85±23, révisée en 1996). Des protocoles ont été approuvées par notre comité d’éthique local.
1. les animaux
- Garder des souris femelles de Suisse (de-1), âgés de huit à dix semaines, 20-25 g, chez un animal logement facilité quinze jours avant chaque expérience. Les loger dans des boîtes aérées qui sont conservés dans un protégé, température (22 ° C) et humidité (50 %) contrôlé la salle, avec 12 heures de marche/arrêt cycle de lumière.
- Donner animaux libre accès à la nourriture et l’eau. Minimiser la douleur, de souffrance et de détresse et de fournir l’enrichissement de l’environnement.
- Pour le logement, utiliser les cages à parois clear, enrichissement avec des bâtons en bois et les tunnels en carton. Tirer doucement un animal dans un tunnel pour transférer de la cage dans la paume de la main.
- Effectuer une surveillance quotidienne pour évaluer les signes de prostration, isolement social, blessure du corps, des cheveux ébouriffé ou manque de toilettage.
- Peser chaque animal une fois par semaine. Inspectez régulièrement par un vétérinaire.
- Pour les parasites naturels, recueillir le sang à l’apogée de la parasitémie et des parasites causant la mort animale, recueillir le sang la veille de la mort présumée.
Remarque : Toutes les expériences avec les agents infectieux sont effectuées dans des salles dédiées, conformément aux lignes directrices de l’université a approuvé.
2. tampons, les préparatifs des médias
- Peser chaque substance et ajouter de l’eau distillée pour les tampons suivants :
- Préparer une solution Saline tamponnée au Phosphate concentrée (x 2) :
Na2HPO4 (anhydre) (MW g 141,96) 10,14 g
NaH2PO4∙2H2O (MW g 156,01) 0,62 g
NaCl (MW g 58,44) 2,55 g
Eau distillée H2O à 1 L - Préparer le tampon Phosphate salin-Glucose :
Na2HPO4 (anhydre) (MW g 141,96) 5,39 g
NaH2PO4∙2H2O (MW g 156,01) 0,31 g
NaCl (MW g 58,44) 1,70 g
Glucose (MW 180 g) 10 g
Eau distillée H2O à 1 L - Préparer 1 M KH2PO4.
- Préparer le tampon d’élution : Supplément de tampon Phosphate salin-Glucose avec
La pénicilline (100 U/mL), streptomycine (100 µg/mL) et le rouge de phénol (5 µg/mL).
- Préparer une solution Saline tamponnée au Phosphate concentrée (x 2) :
3. préparation de DEAE-cellulose
- Plan d’environ 5 heures pour la préparation de DEAE-cellulose.
- Lavez 100 g de DEAE-cellulose avec de l’eau distillée dans une fiole avec un col étroit et laisser s’installer, puis jeter les particules fines. Répétez les lavages jusqu'à ce que le liquide surnageant est clair.
- Ajouter 3 L de concentré 2 x Phosphate-Buffered Saline et remuer.
- Ajuster le pH à 8,0 avec 1 M KH2PO4 et jeter le surnageant.
- Laver deux fois avec l’eau distillée et laisser pour reposer.
- Laver et laisser reposer deux fois avec 3 litres Phosphate-Buffered Saline-Glucose et jeter le surnageant.
- Mesurer le volume de la cellulose et ajouter un volume égal de solution Saline-Glucose Phosphate-Buffered, répartir dans des bouteilles en plastique et conserver à-20 ° C.
4. les parasites
- Recueillir des souches de trypanosomes dans les zones endémiques pour la trypanosomiase humaine et animale. Garder les parasites congelés dans l’azote liquide.
NOTE : Trypanosoma musculi est non pathogènes pour l’être humain et un trypanosome extracellulaire permet de remplacer en toute sécurité des trypanosomes pathogènes dans diverses expériences de laboratoire. - Dans le cas des examens de laboratoire nécessitant des pathogènes humains, gérer des expériences avec soin dans des conditions de niveau (BSL) de sécurité dédié biohazard approprié et précautions ; BSL2 pour T. b. gambiense et BSL3 pour T. b. rhodesiense. Dans des conditions opérationnelles, les pratiques microbiologiques standard sont établie : sécuriser l’échantillonnage, pipetage mécaniques, fréquente décontamination des surfaces et la stérilisation des déchets.
5. infection des souris
- Décongeler rapidement les parasites dans un bain-marie à 37 ° C.
- Observer une goutte de sang infecté dégelé avec un microscope. Évaluer la viabilité de parasite en mesurant le pourcentage de formes mobiles17.
- Injecter des parasites par voie intrapéritonéale à des souris (0,5 mL / souris). Chaque jour, après l’infection, recueillir 20 µL de sang de queue par piqûre d’aiguille et observer au microscope. Évaluer la parasitémie selon Herbert et Lumsden18 en comptant les parasites dans plusieurs champs microscopiques, ou en utilisant un hémocytomètre.
- Lorsque la parasitémie atteint un seuil défini pour chaque souche, recueillir le sang (1 mL/souris) dans la mémoire tampon d’élution (5 mL/souris) contenant de l’héparine (10 U/mL).
NOTE : Le œuvre originale et novatrice de Lanham et Godfrey faisait que la force ionique optimale du phosphate buffered glucose salin pour plusieurs espèces d’hôte/parasite d’une solution mère de pH 8.0.
6. séparation de parasite
NOTE : Toutes les expériences à partir de là doivent se faire sous une hotte de vitroplants avec des gants. La température ambiante et l’humidité dans les laboratoires utilisés étaient de 22 ° C et 45 % respectivement. Sur le terrain, séparation du parasite a été exécutée avec succès à 34 ° C.
- Introduire une seringue de 10 mL dans un support vertical et ajouter une circulaire découpée, morceau de papier filtre, laine de verre ou éponge en cellulose.
- Versez la DEAE cellulose dans la seringue jusqu'à ce que le niveau de 8 mL est atteint et laver ensuite avec 25 mL de tampon d’élution.
- Ajouter 2 mL de sang dilué avec précaution en haut de la colonne, puis ajoutez moyen d’élution. Ajoutons régulièrement la mémoire tampon d’élution selon le transit des trypanosomes.
- Collecter les effluents gouttes les colonnes dans un tube à centrifuger et vérifier régulièrement la présence de parasites au microscope.
- Lorsque les parasites sont ne sont plus détectés dans l’effluent de la colonne, centrifuger le tube (1 800 x g, 10 minutes, à 4 ° C en laboratoire et à la température ambiante sur le terrain).
- Retirez le surnageant et suspendre les parasites dans 1 mL de milieu pertinent requis pour la prochaine étape d’enquête.
- Compter les parasites avec un hémocytomètre et diluez-les dans un milieu approprié si nécessaire.
Résultats
Trypanosomes purifiés ont été utilisés dans des essais pharmaceutiques. Les parasites sont transférés dans des puits de culture contenant les dilutions en série de médicaments spécifiques, soit seules ou mélangées,19. Observations microscopiques, évaluation de la motilité est un marqueur de viabilité, peut être réalisée lorsque seulement quelques mamelons sont mis à l’essai, tandis que AlamarBlue analyse de viabilité de cellules est une excellente méthode pour des dosages de grande mobilité durant20de dépistage de la drogue. L’effet de pentamidine, un médicament de référence utilisé dans la thérapie de chapeau, est affiché à la Figure 1.
Les macrophages sont très utiles dans les cultures comme des cellules nourricières. Ils permettent, in vitro, l’initiation et le développement du trypanosome cultures21. Nous avons signalé que le nombre de macrophages activés alternativement est augmenté chez les mammifères infectés par le trypanosome dans lequel ils privilégient parasite croissance22. Cette activation macrophage alternatives fournit L-ornithine, qui est essentiel pour la croissance du parasite. In vitro co-cultures macrophage-parasite ont montré que trypanosomes induisent l’activation alternative de macrophages par l’intermédiaire de facteurs sécrétés. Trypanosomes extracellulaires sécrètent une kinésine qui lie les récepteurs macrophage mannose binding induisant expression arginase fournissant la production de L-ornithine favorisant parasite la différenciation et la multiplication23,24 ( Figure 2). Mannose inhibe la liaison de kinésine et l’induction de l’arginase, et souris déficientes en récepteur mannose élucider la cible de kinésine sur les macrophages (Figure 3).
Puisque de nombreux génomes trypanosome ont maintenant été séquencés et annotées, nous avons pu profiter de ces grands ensembles de données. Par la suite, nous avons été en mesure de réaliser la génétique avance et arrière sur ces parasites. En utilisant ces données, purifiée forme de circulation sanguine trypanosomes ont été utilisées pour caractériser et analyser des structures importantes telles que la poche flagellaire (FP) et ses associé cytosquelette. Le FP est le seul site d’endo et Exocytose de trypanosomes et est également où les glycoprotéines de surface variables sont victimes de la traite du système endomembranaire25. Le collier de poche flagellaire (FPC) est un annulaire en forme de structure qui est attaché au flagelle au point où elle quitte le FP, mais jusqu'à récemment était peu d’information sur les constituants protéiques de la FPC. Nous avons identifié une protéine majeure de la FPC, TbBILBO1 et ont montré qu’il est essentiel pour la survie du parasite sous la forme de la mouche tsé-tsé insectes cultivées, tant dans la circulation sanguine formule26. Empêche la formation de la FP et inhibe la biogenèse des nombreuses autres structures importantes du cytosquelette, rendant le CPF et les cibles importantes de FP d’intervention dans tous les trypanosomes pathogènes choc de TbBILBO1 par Arni. Sonder le parasite purifiée ou de culture de cellules avec des anticorps BILBO1 Tbindique que sous forme de circulation sanguine et forme procycliques (insecte), il crée une structure en forme d’anneau qui contourne le flagelle. Ces étiquetages, sur une forme de circulation sanguine, est montré dans la Figure 4.
Circulation sanguine purifiée forme trypanosomes ont permis la caractérisation des nombreuses particularités biochimiques et métaboliques inhabituelles, y compris le métabolisme du glucose, qui se déroule dans les peroxysomes comme organites appelés glycosomes (voir Figure 5). Il était généralement admis que pyruvate est le produit final majeur excrété par le métabolisme du glucose par les trypanosomes de circulation sanguine, avec pratiquement aucune production de succinate et d’acétate à l’intérieur de la mitochondrie. En revanche, les trypanosomes procycliques convertissent thréonine en acétate et le glucose en succinate et acétate27,28. Métabolisme énergétique de trypanosomatidés peut être évalué par l’adaptation à des sources de carbone disponible. La combinaison génétique inverse et métabolomique analyses a confirmé la production dans la mitochondrie des trypanosomes circulation sanguine de l’acétate de glucose dérivé de pyruvate et thréonine, ainsi que la production du succinate de glucose19,20 (Figure 5). Par exemple, 1H-RMN analyse de produits finis excrétés par la circulation sanguine forme trypanosomes incubés dans du PBS contenant du glucose de 4 mM, a révélé que le glucose est principalement converti en pyruvate (85,1 % des produits finis excrétés), dont la production mineure alanine (9,2 %), acétate de (4,9 %) et29de la succinate (0,8 %). Ces voies, qui sont mineures en termes de flux métabolique par rapport à la production de pyruvate du glucose, sont essentiels à la croissance du parasite. La voie de production de succinate peut donc être considérée comme une bonne cible potentielle pour le développement de nouveaux médicaments trypanocides.
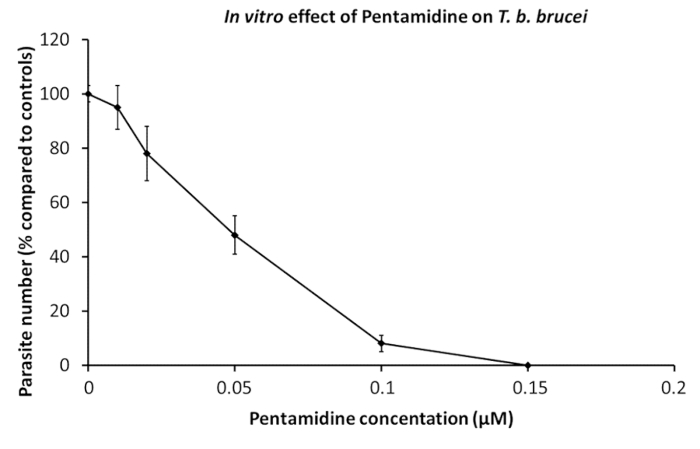
Figure 1 : In vitro l’effet de pentamidine sur T. b. brucei. Dilutions de pentamidine ont été ajoutées à 2 x 105 parasites afin de déterminer la concentration inhibant la croissance du parasite par 50 % (CI50). Courbes dose-effet avec 24 heures de culture. Barres d’erreur représentent l’écart-type de la moyenne de 5 expériences indépendantes. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
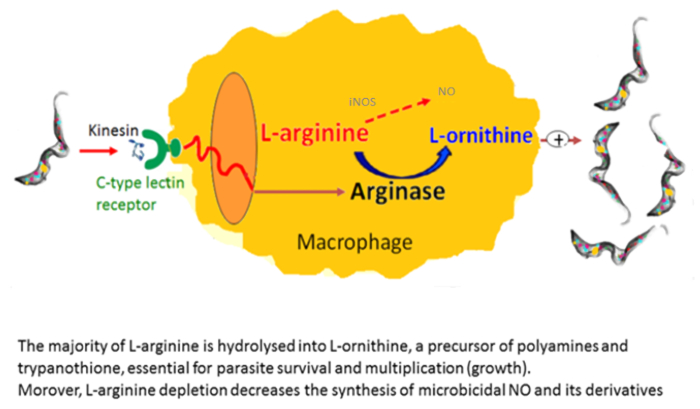
Figure 2 : Induction induite par le trypanosome arginase. Une kinésine libérée par les trypanosomes se lie aux récepteurs de lectine de type C conduisant à l’induction de l’arginase. Cela se traduit par une production accrue de L-ornithine et polyamines, essentiels pour la croissance du parasite et la différenciation et épuisement de L-arginine, résultant en une baisse de la production de NO cytotoxique par macrophage NOS II. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
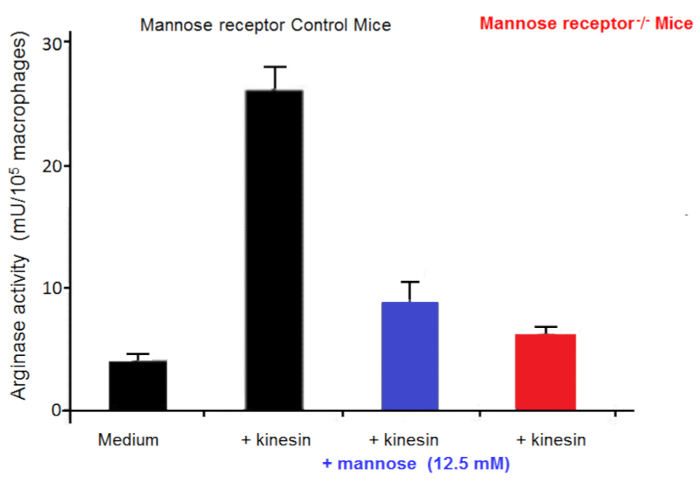
Figure 3 : Activité des macrophages arginase. Activité de l’arginase dans les macrophages de souris témoins et Mannose récepteur assommer souris (KO) cultivées in vitro dans un milieu pendant 48 heures, avec ou sans la kinésine ou mannose. Barres d’erreur représentent l’écart-type de la moyenne de 5 expériences indépendantes. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.

Figure 4 : TB BILBO1 marquage d’une forme de circulation sanguine Trypanosoma brucei brucei cellule Immunofluorescence (A) l’étiquetage d’une circulation sanguine, la forme de la culture, 427 cellules 90-13 qui a été sondé avec l’anticorps monoclonal anti-BILBO1 suivie d’un anticorps antisouris marqué FITC et visualisés à l’aide de la lumière ultraviolette, (Tb BILBO1 sont les signaux verts annulaires) et l’ADN liant colorant DAPI (bleus signaux) (B) A fusionner des images à contraste DAPI, anti-BILBO1 et phase d’a. échelle bar est égal à 10 µm. Anti-BILBO1 souris anticorps monoclonaux a été dilué 01:10 dans du PBS et l’anticorps secondaire ( anti-souris IgM FITC) a été dilué au 1/100. Des images ont été prises sur un microscope équipé d’une caméra numérique. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.

Figure 5 : Représentation schématique du métabolisme de glucose et de la thréonine en trypanosomes forme circulation sanguine. Produits finis excrétées de métabolisme de glucose et de la thréonine sont boxed. Les flèches bleues épaisses indiquent les étapes enzymatiques du métabolisme glucidique conduisant à la production de pyruvate, qui est le principal produit excrété de la glycolyse. Les flèches noires représentent négligé mineurs voies métaboliques du glucose et la thréonine de dégradation, qui sont essentiels à la croissance du parasite. La contribution des enzymes indiquées ont été validée expérimentalement : ACH, acétyl-COA thioestérase (EC 3.1.2.1) ; ASCT, acétate : succinate CoA-transférase (EC 2.8.3.18) ; AKCT, 2-amino-3-cétobutyrate coenzyme A ligase (EC 2.3.1.29) ; PEPCK, phosphoénolpyruvate carboxykinase (EC 4.1.1.49) ; PDH, complexe pyruvate déshydrogénase (EC 1.2.4.1) ; TDH, thréonine 3-déshydrogénase (EC 1.1.1.103). Abréviations : AcCoA, acétyl-COA ; AOB, amino oxobutyrate ; DHAP, dihydroxyacétone phosphate ; G3P, glycéraldéhyde 3-phosphate ; LTA, malate ; Arthrose, oxaloacétate ; PEP, phosphoénolpyruvate ; PYR, pyruvate. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
Discussion
Trypanosomes purifiés représentent un moyen puissant pour étudier, immunologie, biochimie, biologie cellulaire et moléculaire. Grandes étendues de données et les résultats ont été obtenus de trypanosomes, qui a ensuite aidé à obtenir des informations auprès des autres cellules eucaryotes30. Trypanosomes font également l’objet de recherches importantes et intéressantes, parce qu’ils ont conçu de nombreux mécanismes qui leur permettent de survivre et se développer dans deux milieux très différents : le vecteur de la mouche tsé-tsé et le mammifère hôte23, 31. diverses techniques pour isoler les trypanosomes ont été signalés, et un examen sur les approches axées sur la microfluidique a récemment été publié32. Un moyen fiable et reproductible de l’isolement du parasite est donc essentiel.
DEAE cellulose préparation est une étape indispensable dans le présent protocole de préparation de parasite. Les conditions de lavage doivent être effectuées avec prudence pour éliminer les fines particules et équilibrer la résine et le pH doit être ajusté avec précision (pH 8.0 est apte pour la plupart des espèces de trypanosomes). Toutes les mesures doivent être adaptées pour améliorer la purification du parasite et le rendement tout en conservant les propriétés de viabilité et cellulaires de parasite. Ce qui est important, l’infectiosité et la viabilité des parasites ont été maintenues après purification par une colonne de DEAE cellulose. Cependant, certaines souches sont plus fragiles que d’autres et peuvent être moins infectieux après purification33. Par conséquent, l’impact des conditions de séparation sur les composants de la membrane pelliculaires, métabolisme de parasite, signalisation, fonctions d’acide nucléique et l’infectiosité animale, doivent être évaluées et des conditions de séparation doivent être adaptés en conséquence.
Limitations de cette technique sont que cette procédure doit être adaptée à chaque espèce de trypanosomes dans un hôte donné et qu’il est aussi beaucoup de temps. En outre, DEAE cellulose est maintenant cher. Des essais préliminaires sont nécessaires pour optimiser les conditions de la séparation, notamment les médias, qui peuvent avoir différentes forces ioniques et un pH précis. La précolonne étapes, y compris le choix d’anticoagulant, centrifugation préalable pour enlever la majorité des érythrocytes, l’utilisation de la couche leuco-plaquettaire et la lyse des érythrocytes, sont choisis en fonction de chaque expérience. Des changements précis sur un seul paramètre (tampons, température dans tout le protocole, paramètres de centrifugation) peut accroître considérablement le nombre, le degré de purification et de la viabilité des parasites a obtenu33. Développement de nouveaux paramètres de séparation selon l’espèce de parasite et les cellules sanguines chez les mammifères à être séparés, peut être nécessaire. Ajustements au protocole initial de Lanham et Godfrey a permis la purification biologique et sur le plan antigénique préservé T. cruzi de sang34. Nouvelles résines peuvent également être testés et utilisés avec des conditions appropriées pour les différentes espèces de35.
Le rôle majeur des facteurs excrété/sécrétée (ES) de trypanosomatidés a récemment insisté sur16. ES contiennent des molécules impliquées dans la pathologie et l’immunomodulation, comme la kinésine, qui est conservée parmi les trypanosomes24. Préparation de ES de parasites purifiées demande une attention particulière pour éviter la contamination par composants media d’élution et parasites lysés.
Un vaccin basé sur les ES efficace contre la leishmaniose, un parasite connexe, existe déjà et est disponible (CaniLeish Virbac)36. Association de molécules conservées jouant un rôle essentiel dans la croissance et la survie du parasite pourrait représenter la base pour un futur vaccin contre les trypanosomes, pour les humains et les animaux, dans une approche de celle de santé. Purification du trypanosome africain du sang par des colonnes de DEAE-cellulose, avec améliorations, demeure l’étalon-or pour la détection de trypanosomes chez les hôtes naturels avec faibles parasitémies en zones d’endémie et la nécessité pour les parasites en grand nombre pour investigations expérimentales.
Déclarations de divulgation
Les auteurs n’ont rien à divulguer.
Remerciements
Nous remercions tous les membres de l’UMR 177 INTERTRYP IRD CIRAD Université de Bordeaux. Cette recherche a été financée par des fonds internes de l’Université de Bordeaux et de soutien de l’ANR, LABEX ParaFrap ANR-11-LABX-0024 et de l’Association pour le développement de la recherche en parasitologie et médecine tropicale et le Service de coopération et d’action culturelle de l’ambassade de France à Bangui (Centrafrique).
matériels
| Name | Company | Catalog Number | Comments |
| 10 mL Pipettes | Falcon | 357,551 | |
| 2 mL Pipettes | Falcon | 352,507 | |
| Centrifugation tube 50 mL | Falcon | 352,070 | |
| Centrifuge | Sigma Aldrich | 4K15 | |
| DEAE cellulose | Santa Cruz | s/c- 211213 | 100 G |
| filter paper | Whatman | 1,001,125 | |
| Flat bottom flask narrow neck | Duran | 21 711 76 | 6000 mL |
| Glucose | VWR | 101174Y | 500 G |
| Heparin | Sigma Aldrich | H3149-50KU | 5 000 U |
| KH2PO4 | VWR | 120 26936.260 | 500 G |
| Microscope | Olympus | CH-20 | |
| Microscope coverslips | Thermofisher scientific | CB00100RA020MNT0 | |
| Microscope slides | Thermofisher scientific | AGAA000001 | |
| Na2HPO4 | VWR | 100 28026;260 | 500 G |
| NaCl | VWR | 27800.291 | 1 KG |
| NaH2PO4 | VWR | 110 33616;262 | 500 G |
| Nalgene Plastic Media Bottles size 125 mL | Thermofisher scientific | 342024-0125 | |
| Nalgene Plastic Media Bottles size 500 mL | Thermofisher scientific | 342024-0500 | |
| Pasteur Pipette | VWR | BRND125400 | |
| Penicillin 10,000 UI/Streptomycin 10,000 µg | EUROBIO | CABPES01 OU | 100 mL |
| Phenol red | Sigma Aldrich | P0290 | 100 mL |
| Syringue | Dutscher | SS+10S21381 | |
| Tissue culture hood | Thermoelectro Corporation | MSC-12 | |
| Trypanosoma brucei brucei | Institute of Tropical Medicine (Antwerp, Belgium). | ANTAT 1.1 | |
| Trypanosoma brucei gambiense | Institute of Tropical Medicine (Antwerp, Belgium). | ITMAP 1893 | |
| Trypanosoma musculi | London School of Hygiene and Tropical Medicine (UK) | Partinico II |
Références
- Büscher, P., Cecchi, G., Jamonneau, V., Priotto, G. Human African trypanosomiasis. Lancet. 390 (10110), 2397-2409 (2017).
- Lejon, V., Bentivoglio, M., Franco, J. R. Human African trypanosomiasis. Handbook of Clinical Neurology. 114, 169-181 (2013).
- Giordani, F., Morrison, L. J., Rowan, T. G., De Koning, H. P., Barrett, M. P. The animal trypanosomiases and their chemotherapy: a review. Parasitology. 143 (14), 1862-1889 (2016).
- Aksoy, S., Buscher, P., Lehane, M., Solano, P., Van Den Abbeele, J. Human African trypanosomiasis control: Achievements and challenges. PLoS Neglected Tropical Diseases. 11 (4), e0005454(2017).
- Büscher, P., Deborggraeve, S. How can molecular diagnostics contribute to the elimination of human African trypanosomiasis? Expert Review of Molecular Diagnostics. 15 (5), 607-615 (2015).
- Truc, P., et al. Atypical human infections by animal trypanosomes. PLoS Neglected Tropical Diseases. 7 (9), e2256(2013).
- Lumsden, W. H., Kimber, C. D., Evans, D. A., Doig, S. J. Trypanosoma brucei: miniature anion-exchange centrifugation technique for detection of low parasitaemias: adaptation for field use. Transactions of the Royal Society of Tropical Medicine and Hygiene. 73 (3), 312-317 (1979).
- Büscher, P., et al. Improved Models of Mini Anion Exchange Centrifugation Technique (mAECT) and Modified Single Centrifugation (MSC) for sleeping sickness diagnosis and staging. PLoS Neglected Tropical Diseases. 3 (11), e471(2009).
- Lanham, S. M. Separation of trypanosomes from the blood of infected rats and mice by anion-exchangers. Nature. 218 (5148), 1273-1274 (1968).
- Lanham, S. M., Godfrey, D. G. Isolation of salivarian trypanosomes from man and other mammals using DEAE-cellulose. Experimental Parasitology. 28 (3), 521-534 (1970).
- Humphrey, P. A., Ashraf, M., Lee, C. M. Growth of trypanosomes in vivo, host body weight gains, and food consumption in zinc-deficient mice. Journal of the National Medical Association. 89 (1), 48-56 (1997).
- Lowry, J. E., Leonhardt, J. A., Yao, C., Belden, E. L., Andrews, G. P. Infection of C57BL/6 mice by Trypanosoma musculi modulates host immune responses during Brucella abortus cocolonization. Journal of Wildlife Diseases. 50 (1), 11-20 (2014).
- Vincendeau, P., Daëron, M., Daulouede, S. Identification of antibody classes and Fc receptors responsible for phagocytosis of Trypanosoma musculi by mouse macrophages. Infection and Immunity. 53 (3), 600-605 (1986).
- Vincendeau, P., Daëron, M. Trypanosoma musculi co-express several receptors binding rodent IgM, IgE, and IgG subclasses. Journal of Immunology. 142 (5), 1702-1709 (1989).
- Holzmuller, P., et al. Virulence and pathogenicity patterns of Trypanosoma bruceigambiense field isolates in experimentally infected mouse: differences in host immune response modulation by secretome and proteomics. Microbes and Infections. 10 (1), 79-86 (2008).
- Holzmuller, P., et al. How do parasites and their excreted-secreted factors modulate the inducible metabolism of L-arginine in macrophages? Frontiers in Immunology. 9, 778(2018).
- Abrahamson, I. A., Da Silva, W. D. Antibody-dependent cytotoxicity against Trypanosoma cruzi. Parasitology. 75 (3), 317-323 (1977).
- Herbert, W. J., Lumsden, W. H. Trypanosoma brucei: a rapid "matching" method for estimating the host's parasitemia. Experimental Parasitology. 40 (3), 427-431 (1976).
- Dauchy, F. A., et al. Trypanosoma brucei CYP51: Essentiality and Targeting Therapy in an Experimental Model. PLoS Neglected Tropical Diseases. 10 (11), e0005125(2016).
- Raz, B., Iten, M., Grether-Bühler, Y., Kaminsky, R., Brun, R. The Alamar Blue assay to determine drug sensitivity of African trypanosomes (T. b. rhodesiense and T. b. gambiense) in vitro. Acta Tropica. 68 (2), 139-147 (1997).
- Albright, J. W., Albright, J. F. In vitro growth of Trypanosoma musculi in cell-free medium conditioned by rodent macrophages and mercaptoethanol. International Journal for Parasitology. 10 (2), 137-142 (1980).
- Gobert, A. P., et al. L-Arginine availability modulates local nitric oxide production and parasite killing in experimental trypanosomiasis. Infection and Immunity. 68 (8), 4653-4657 (2000).
- De Muylder, G., et al. A Trypanosoma brucei kinesin heavy chain promotes parasite growth by triggering host arginase activity. PLoS Pathogens. 9 (10), e1003731(2013).
- Nzoumbou-Boko, R., et al. Trypanosoma musculi Infection in Mice Critically Relies on Mannose Receptor-Mediated Arginase Induction by a TbKHC1 Kinesin H Chain Homolog. Journal of Immunology. 199 (5), 1762-1771 (2017).
- Bonhivers, M., Nowacki, S., Landrein, N., Robinson, D. R. Biogenesis of the trypanosome endo-exocytotic organelle is cytoskeleton mediated. PLoS Biology. 6 (5), e105(2008).
- Albisetti, A., et al. Interaction between the flagellar pocket collar and the hook complex via a novel microtubule-binding protein in Trypanosoma brucei. PLoS Pathogens. 13 (11), e1006710(2017).
- Cross, G. A. M., Klein, R. A., Linstead, D. J. Utilization of amino acids by Trypanosoma brucei in culture: L-threonine as a precursor for acetate. Parasitology. 71 (2), 311-326 (1975).
- Bringaud, F., Rivière, L., Coustou, V. Energy metabolism of trypanosomatids: adaptation to available carbon sources. Molecular and Biochemical Parasitology. 149 (1), 1-9 (2006).
- Mazet, M., et al. Revisiting the central metabolism of the bloodstream forms of Trypanosoma brucei: production of acetate in the mitochondrion is essential for the parasite viability. PLoS Neglected Tropical Diseases. 7 (12), e2587(2013).
- Coutton, C., et al. Mutations in CFAP43 and CFAP44 cause male infertility and flagellum defects in Trypanosoma and human. Nature Communications. 9 (1), 686(2018).
- Cnops, J., Magez, S., De Trez, C. Escape mechanisms of African trypanosomes: Why trypanosomosis is keeping us awake. Parasitology. 142 (3), 417-427 (2015).
- Barrett, M. P., et al. Microfluidics-Based Approaches to the Isolation of African Trypanosomes. Pathogens. 6 (4), (2017).
- Taylor, A. E., Lanham, S. M., Williams, J. E. Influence of methods of preparation on the infectivity, agglutination, activity, and ultrastructure of bloodstream trypanosomes. Experimental Parasitology. 35 (2), 196-208 (1974).
- Gutteridge, W. E., Cover, B., Gaborak, M. Isolation of blood and intracellular forms of Trypanosoma cruzi from rats and other rodents and preliminary studies of their metabolism. Parasitology. 76 (2), 159-176 (1978).
- Cruz-Saavedra, L., et al. Purification of Trypanosoma cruzi metacyclic trypomastigotes by ion exchange chromatography in sepharose-DEAE, a novel methodology for host-pathogen interaction studies. Journal of Microbiological Methods. 142, 27-32 (2017).
- Lemesre, J. L., et al. Long-lasting protection against canine visceral leishmaniasis using the LiESAp-MDP vaccine in endemic areas of France: double-blind randomised efficacy field trial. Vaccine. 25 (21), 4223-4234 (2007).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon