Method Article
Reinigung der extrazellulären Trypanosomen, einschließlich Afrika, aus Blut von Anionen-Austauscher (Diethylaminoethyl-Zellulose Spalten)
In diesem Artikel
Zusammenfassung
Diese Methode der Trypanosomen Trennung vom Blut hängt ihre Oberflächenladung wird weniger negativ als Blut Säugerzellen. Infiziertem Blut ist platziert und auf ein Anion-Exchanger Spalte behandelt. Diese Methode, die passende Diagnose für afrikanische Trypanosomiasis, bietet gereinigte Parasiten für immunologische, biologische, biochemische, pharmazeutische und molekularbiologischen Untersuchungen.
Zusammenfassung
Diese Methode ermöglicht die Trennung von Trypanosomen, Parasiten verantwortlich für tierische und menschliche afrikanische Trypanosomiasis (Hut), von infiziertem Blut. Dies ist die beste Methode für die Diagnose der ersten Phase HAT und außerdem dieser Parasit Reinigungsverfahren ermöglicht serologische und Forschung Untersuchungen.
Hut wird durch Tsetse-Fliege übertragen Trypanosomen Trypanosomen rhodesiense verursacht und T. B. Rhodesiense. Damit verbundenen Trypanosomen sind die Erreger der Tier Trypanosomiasis. Trypanosomen-Erkennung ist essentiell für Hut-Diagnose, Behandlung und Nachsorge. Die hier beschriebene Technik ist die empfindlichste Parasit Erkennung Technik, angepasst auf Freilandbedingungen für die Diagnose von T. B. rhodesiense Hut und kann innerhalb einer Stunde abgeschlossen sein. Blut wird auf ein Anion-Exchanger Säule (DEAE Zellulose) vorher eingestellten pH-Wert 8 geschichtet und Elution Puffer hinzugefügt. Stark negativ geladenen Blutzellen werden auf die Säule adsorbiert, während die weniger negativ geladenen Trypanosomen durchlaufen. Gesammelten Trypanosomen sind pelleted durch Zentrifugation und beobachtet von Mikroskopie. Darüber hinaus sind Parasiten ohne Zellschädigung bereit, unter Beibehaltung ihrer Infektiosität.
Gereinigte Trypanosomen sind erforderlich für immunologische Tests; Sie sind in der Trypanolysis-Assay, der Goldstandard in der Hut Serologie eingesetzt. Gefärbte Parasiten sind in der Karte Agglutination Test (CATT) für Feld Serologie genutzt. Antigene von gereinigten Trypanosomen wie Variante Oberfläche Glykoprotein, Exoantigens, sind auch in verschiedenen Immunassays verwendet. Die hier beschriebene Vorgehensweise richtet sich an afrikanischen Trypanosomen; Infolgedessen haben Chromatographie Bedingungen zu jeder Trypanosomen-Stamm, und ganz allgemein an das Blut der einzelnen Arten der Host Säugetier angepasst werden.
Diese faszinierenden Krankheitserreger sind leicht gereinigt und zur Verfügung in biochemische, molekulare und Zelle Biologie Studien einschließlich Kokultur mit Wirtszellen zu untersuchen, Wirt-Parasit-Beziehungen auf der Ebene der Membranrezeptoren, Signal- und gen Ausdruck; Drogen Sie-Tests in Vitro; Untersuchung von gen-Löschung, Mutation oder Überexpression auf metabolische Prozesse, Zellskelett Biogenese und Parasiten überleben.
Einleitung
Die vorgestellte Methode beschrieben hier ermöglicht die Trennung von Trypanosomen, Parasiten verantwortlich für tierische und menschliche afrikanische Trypanosomiasis (Hut), aus Blut. Dies ist die beste Methode für die Diagnose der ersten Phase HAT und außerdem ermöglicht dieser Parasit Reinigungsverfahren robuste serologische und Forschung Untersuchung.
Hut, verursacht durch Tsetse-Fliege übertragen Trypanosomen Trypanosomen rhodesiense und T. B. Rhodesiense1. Diese Protozoen Parasiten vermehren extrazellulär in Blut, Lymphe und interstitiellen Flüssigkeiten in der ersten Phase der Erkrankung (hemolymphatic Stadium). Die zweite Stufe (meningoencephalitic Stadium) beginnt, wenn die Parasiten die Blut-Hirn-Schranke überqueren; neurologische Symptome, einschließlich einer Schlafstörung, die seinen Namen "Schlafkrankheit" dieser Krankheit gegeben hat, sind typisch für diese zweite Stufe2. Damit verbundenen Trypanosomen (T. Evansi, T. Congolense, T. Vivax, T. B. Trypanosomen) sind die Erreger der afrikanischen Trypanosomosen (AAT)3Tier.
Die Weltgesundheitsorganisation (WHO) zielt darauf ab, Hut als Problem der öffentlichen Gesundheit bis zum Jahr 2020 zu beseitigen und Übertragung von 20304zu stoppen. Die kürzlich erfolgten Einführung der raschen Diagnosetests hat verbesserte serologische Diagnostik1,4,5. Wurden mehrere molekulare Diagnostik entwickelt, aber ihre Rolle im Bereich Diagnostik wurde noch nicht etablierten5. Sie werden verwendet, um die Unterarten der Trypanosomen -Gruppe und atypische Trypanosomiasis verursacht durch Parasiten verantwortlich für tierische Trypanosomosen6zu identifizieren.
Die Erkennung des Parasiten ist wichtig für die Diagnose, Behandlung und Nachsorge, da Serologie falsch positive und leider falsch-negative Ergebnisse1geben kann. Die direkte mikroskopische Beobachtung von diesen Hemoflagellate Protisten ist schwierig in Hut-Fällen, die von T. B. rhodesiense, (mehr als 95 % der Fälle) verursacht werden können, wie niedrige Parasitemias die Regel sind, während T. B. Rhodesiense, einen großen Hut durch Anzahl der Parasiten sind häufig im Blut vorhanden. Verschiedene Techniken der Konzentration verwendet worden sind, wie dicke Tropfen und Kapillarrohr Zentrifugation (CTC), aber die Trennung der Parasiten von Blut durch eine Spalte der Anionen-Austauscher (DEAE Zellulose) gefolgt von Zentrifugation und mikroskopische Beobachtung von der Pellet, ist die empfindlichste Methode (rund 50 Parasiten/mL Blut nachweisbar)1,7. Folglich ist die Reinigung der Trypanosomen Anionen-Austauscher (DEAE Zellulose) dadurch das beste und bis heute ist die Referenzmethode zur Visualisierung und Parasiten aus Blut für Hut-Diagnose zu isolieren. Unter Feldbedingungen eine Mini-Spalte der DEAE Cellulose erfolgreich eingesetzt und mehrere Verbesserungen konnten mikroskopischen Beobachtung7,8.
Die Methode der Trypanosomen Trennung von Blut, wie unten beschrieben, hängt Parasit Oberflächenladung, die weniger negativ als Blut Säugerzellen9ist. Interessanterweise ist diese Methode entwickelte sich vor 50 Jahren, im Jahr 1968 von Dr. Sheila Lanham, und bleibt der Goldstandard für Erkennung und Vorbereitung der Trypanosomen Blutbahn. Es ist schnell und reproduzierbar für Salivarian Trypanosomen aus einer Vielzahl von Säugetieren, erlaubt die Diagnose sowohl tierische und menschliche Trypanosomiasis10.
Um lebendige, gereinigten Parasiten zu erhalten, wird infiziertes Blut auf ein Anion-Exchanger-Spalte hinzugefügt. Chromatographie-Bedingungen (vor allem pH-Wert, Ionenstärke der Puffer/Medien) müssen für die einzelnen Trypanosomen-Arten, und ganz allgemein für jede Mischung von Säugerzellen Blut und Trypanosomen10angepasst werden. Elution Buffer ist genau auf pH 8 für die meisten afrikanischen Trypanosomen10eingestellt. Diese Methode begünstigt die Konzentration der Parasiten im Blut von Patienten gefunden, weil Parasitemias zu niedrig, um durch mikroskopische Beobachtung allein erkannt werden können, und es ermöglicht auch Laboruntersuchungen. Arbeiten mit frisch isolierte Trypanosomen und auf das Blut von infizierten Tieren, die mit dieser Technik ist mehr relevant für die verschiedenen Untersuchungen als Studien mit Parasiten, die in axenic Bedingungen im Labor auf unbestimmte Zeit kultiviert wurde.
Wirt-Parasit-Beziehungen sind am besten untersucht mit einem Parasiten infiziert seinen natürlichen Wirt, daher T. Musculi, einen natürlichen murinen Parasiten, die Vertreter der extrazellulären Trypanosomen, hat viele Vorteile, wie in murinen Infektion beinhaltet eine kleinen Versuchstier und erfordert keine Biohazard Sicherheitsbedingungen Niveau (BSL). T. Musculi tötet nicht immunkompetenten Mäusen, im Gegensatz zu vielen anderen Trypanosomen -Arten, einschließlich menschliche Krankheitserreger. T. Musculi entfallen nicht in T-Zell-beraubt Mäuse und Parasitemias kann bei infizierten Mäusen erhöht werden, indem Sie Nahrung und Nährstoff-Aufnahme11ändern. Dieser Parasit moduliert die Immunantwort bei Co-Infektionen mit anderen Krankheitserregern12. T. Musculi von infizierten Mäusen Ausstellung Unterschiede von kultivierten T. Musculi, z. B. der Ausdruck von Membranrezeptoren Fc T. Musculi axenic Kulturen, im Vergleich zu Parasiten gereinigt von infizierten Mäusen13 verliert , 14. Excreted abgesondert Faktoren (ESF) sind auch qualitativ und quantitativ weniger in axenic Trypanosomen Kulturen zum Ausdruck gebracht und unterscheiden sich zwischen den Stämmen in endemischen Gebieten15isoliert. ESF sind die ersten Antigene auf das Immunsystem des Wirts angezeigt werden und so eine wichtige Rolle in der ursprünglichen Host Immunantwort16.
Bei experimentell infizierten Tieren für Laboruntersuchungen erleichtert dieses Protokolls Experimente an einer größeren Anzahl von Parasiten, die Minimierung von Mäusen erforderlich, insbesondere bei Verwendung von immunsupprimierten Tieren. Die Variante Oberfläche Glykoproteine (VSGs), die in der Karte Agglutination Test für Trypanosomiasis (CATT) in Massen-Screening verwendet werden sind noch gereinigt von Trypanosomen, die bei Ratten übertragen werden. Die zwei diagnostische Schnelltests (einzeln verpackte Kassetten), die jetzt verfügbar sind für den Einsatz im Feld, sind immer noch mit einer infektiösen Modell Quelle der native VSGs und nicht in Vitro kultiviert Trypanosomen1,4, 5. der Fortschritt in der Studie der Trypanosomen Immunologie und Biologie wurde erleichtert, da diese DEAE Zellulose gereinigt Parasiten leicht in großen Mengen von natürlich oder experimentell infizierten Hosts und in bestimmten, Nagetiere erzielt werden können.
Protokoll
Untersuchungen gemäß den Leitlinien für die Pflege und Verwendung von Labortieren (NIH Publikation Nr. 85±23, revidiert 1996). Protokolle wurden von unseren lokalen Ethikkommission genehmigt.
(1) Tiere
- Halten Sie weibliche Schweizer (von 1) Mäuse im Alter von acht bis zehn Wochen alt, 20-25 g, bei einem Tier Gehäuse Anlage 15 Tage vor jedem Experiment. Beherbergen sie in belüfteten Boxen, die in einem geschützten, Temperatur (22 ° C) und Luftfeuchtigkeit (50 %) gehalten werden Zimmer mit 12 Stunden ein-/Licht-Zyklus gesteuert.
- Den Tieren freien Zugang zu Nahrungsmitteln und Trinkwasser. Minimieren Sie Schmerzen, leiden und Ängsten und bieten Sie Bereicherung der Umgebung.
- Verwenden Sie für den Wohnungsbau, klar einwandig Käfige, Anreicherung mit Holzstäbchen und Karton Tunnel. Zeichnen Sie ein Tier sanft in einen Tunnel auf der Handfläche der Hand aus dem Käfig zu übertragen.
- Überwachen Sie täglich um Anzeichen von Erschöpfung, soziale Isolation, Körper Verletzung, zerzauste Haare, oder Mangel an Pflege zu beurteilen.
- Wiegen Sie jedes Tier einmal pro Woche. Führen Sie regelmäßige Inspektionen durch einen Tierarzt.
- Für natürliche Parasiten sammeln Sie Blut auf dem Höhepunkt des Parasitemia und für Parasiten verursacht tierischen Tod, sammeln Sie Blut am Vortag vermuteten Tod.
Hinweis: Alle Experimente mit Infektionserregern sind in speziellen Räumen nach Universität genehmigten Richtlinien durchgeführt.
2. Puffer, Medien-Vorbereitungen
- Wiegen Sie jedes Stoffes und fügen Sie destilliertes Wasser für die folgenden Puffer:
- Konzentrierte Phosphat-gepufferte Kochsalzlösung vorbereiten (2 X):
Na2HPO4 (wasserfrei) (MW 141,96 g) 10,14 g
NaH2PO4∙2H2O (MW 156,01 g) 0,62 g
NaCl (MW 58,44 g) 2,55 g
H2O, 1 L destilliertem - Phosphat-gepufferte Kochsalzlösung-Glukose vorbereiten:
Na2HPO4 (wasserfrei) (MW 141,96 g) 5,39 g
NaH2PO4∙2H2O (MW 156,01 g) 0,31 g
NaCl (MW 58,44 g) 1,70 g
Glukose (MW 180 g) 10 g
H2O, 1 L destilliertem - 1 M KH2PO4vorbereiten.
- Bereiten Sie Elution Buffer: Ergänzen Sie Phosphat-gepufferte Kochsalzlösung-Glucose mit
Penicillin (100 U/mL), Streptomycin (100 µg/mL) und Phenol-rot (5 µg/mL).
- Konzentrierte Phosphat-gepufferte Kochsalzlösung vorbereiten (2 X):
3. Vorbereitung der DEAE-cellulose
- Planen Sie ca. 5 Stunden für die DEAE-Zellulose-Vorbereitung.
- 100 g DEAE-Zellulose mit destilliertem Wasser in eine Flasche mit einem schmalen Hals waschen und lassen zu begleichen, dann Feinstaub zu verwerfen. Wiederholen Sie wäscht, bis der Überstand klar ist.
- 3 L konzentrierter 2 x Phosphate-Buffered Kochsalzlösung und rühren hinzufügen.
- PH bis 8.0 mit 1 M KH2PO4 anpassen und überstand verwerfen.
- Zweimal mit destilliertem Wasser zu waschen und um zu begleichen lassen.
- Waschen und zweimal mit 3 Liter Phosphate-Buffered Kochsalzlösung-Glukose zu begleichen und verwerfen die Überstände lassen.
- Messen Sie das Volumen der Cellulose und fügen Sie ein gleiches Volumen des Phosphate-Buffered Kochsalzlösung-Glucose, in Kunststoff-Flaschen verteilen und Lagerung bei-20 ° C.
(4) Parasiten
- Trypanosomen Stämme in Gebieten endemisch für Mensch und Tier Trypanosomiasis zu sammeln. Halten Sie Parasiten in flüssigem Stickstoff eingefroren.
Hinweis: Trypanosomen Musculi ist für den Menschen apathogen und eine extrazelluläre Trypanosomen sicher Pathogene Trypanosomen in verschiedenen Laborversuchen ersetzt. - Bei Laboruntersuchungen erfordert menschliche Krankheitserreger Experimente mit Sorgfalt gewidmet entsprechende Biohazard Sicherheitsbedingungen Niveau (BSL) und Vorsichtsmaßnahmen zu behandeln; BSL2 für T. B. rhodesiense und BSL3 für T. B. Rhodesiense. Unter Feldbedingungen, mikrobiologische Standardpraxis etabliert: Sampling, mechanische pipettieren, häufige Dekontamination von Oberflächen und Sterilisation von Abfällen zu sichern.
(5) Maus-Infektion
- Tauen Sie schnell Parasiten in einem Wasserbad bei 37 ° C auf.
- Einen Tropfen von aufgetauten infiziertem Blut mit einem Mikroskop zu beobachten. Bewerten Sie Parasiten Lebensfähigkeit durch Messung der Anteil der bewegliche Formen17.
- Injizieren Sie Parasiten intraperitoneal in Mäusen (0,5 mL pro Maus). Jeden Tag nach der Infektion, sammeln Sie 20 µL Blut Schweif durch Punktion und unter dem Mikroskop beobachten. Parasitemia nach Herbert und Lumsden18 durch Parasiten in mehreren Mikroskop zählen oder mithilfe einer Zählkammern zu bewerten.
- Wenn die Parasitemia einen Schwellenwert, der für jede Belastung definiert ist überschreitet, sammeln Sie das Blut (1 mL/Maus) in der Elution Puffer (5 mL/Maus) mit Heparin (10 U/mL).
Hinweis: Die originelle und neuartige Arbeit Lanham und Godfrey berichtet, dass die optimale Ionenstärke des Phosphats saline Glukose für mehrere Parasit/Arten von pH 8,0-Stammlösung gepuffert.
(6) Parasit Trennung
Hinweis: Alle Versuche ab diesem Zeitpunkt müssen in einer Gewebekultur Kapuze mit Handschuhen durchgeführt werden. Die Raumtemperatur und Luftfeuchtigkeit in den Labors verwendet wurden 22 ° C und 45 %. Unter Feldbedingungen hat Parasiten Trennung erfolgreich bei 34 ° c durchgeführt
- Eine 10 mL Spritze in eine vertikale Unterstützung geben Sie und eine zuvor ausgeschnittene Rundschreiben, Stück Filterpapier, Glaswolle oder Zelluloseschwamm.
- Gießen Sie die DEAE Cellulose in die Spritze, bis 8 mL Niveau erreicht ist, und dann waschen mit 25 mL Elution Puffer.
- Vorsichtig 2 mL verdünnte Blut am oberen Rand der Spalte und anschließend fügen Sie Elution Medium hinzu. Fügen Sie regelmäßig Elution Puffer entsprechend den Transit von der Trypanosomen.
- Sammeln Sie Abwasser Tropfen aus den Spalten in ein Zentrifugenröhrchen und prüfen Sie regelmäßig auf das Vorhandensein von Parasiten mit einem Mikroskop.
- Wenn Parasiten in der Spalte Abwasser nicht mehr erkannt werden, Zentrifugieren Sie das Rohr (1.800 X g, 10 Minuten, bei 4 ° C im Labor und bei Raumtemperatur unter Feldbedingungen).
- Entfernen des Überstands und die Parasiten in 1 mL des entsprechenden Mediums erforderlich für investigative als nächstes aussetzen.
- Zählen Sie Parasiten mit einer Hemocytometer zu und verdünnen sie in geeigneter Form zu, wenn nötig.
Ergebnisse
Gereinigte Trypanosomen wurden in Arzneimitteltests verwendet. Parasiten sind in Kultur Brunnen mit Verdünnungsreihen von bestimmten Medikamenten, entweder allein oder gemischt19übertragen. Mikroskopische Beobachtungen auswerten Motilität ist ein Marker der Lebensfähigkeit, kann durchgeführt werden, wenn nur ein paar Enten getestet werden, während AlamarBlue Zelle Lebensfähigkeit Assay ist eine hervorragende Methode für große Beweglichkeit Assays während Drogen-screening-20. Der Effekt von Pentamidin, ein Referenz-Medikament in der Hut-Therapie wird in Abbildung 1angezeigt.
Makrophagen sind sehr nützlich in Kulturen als Feeder-Zellen. Sie ermöglichen es, in-vitro- die Initiierung und Entwicklung der Trypanosomen Kulturen21. Wir haben berichtet, dass die Erhöhung der Anzahl an Alternativ aktivierten Makrophagen in Trypanosomen infiziert Säugetiere sind in denen sie Parasiten Wachstum22begünstigen. Diese alternative Makrophagen Aktivierung liefert L-Ornithin, was für Parasiten Wachstum unerlässlich ist. In-vitro- Makrophagen-Parasit Ko-Kulturen haben gezeigt, dass Trypanosomen Makrophagen alternative Aktivierung über sezernierten Faktoren induzieren. Extrazelluläre Trypanosomen sezernieren ein Kinesin die Makrophagen Mannose bindende Rezeptoren induziert Arginase Ausdruck mit L-Ornithin Produktion Begünstigung Parasit Differenzierung und Vermehrung23,24 ( bindet Abbildung 2). Mannose hemmt Kinesin Bindung und Arginase Induktion und Mannose-Rezeptor-defizienten Mäusen zu erhellen das Ziel von Kinesin auf Makrophagen (Abbildung 3).
Da zahlreiche Trypanosomen Genomen jetzt sequenziert und kommentiert haben, waren wir in der Lage, diese große Datenmengen nutzen. Anschließend wurden wir forward und reverse Genetik auf diese Parasiten durchführen zu können. Mithilfe dieser Daten gereinigt Blutstrom Form Trypanosomen verwendet wurde, zu charakterisieren und zu analysieren, wichtige Strukturen wie die flagellar Tasche (FP) und seiner damit verbundenen Zytoskelett. Die FP ist der einzige Ort der Endo und Exozytose in Trypanosomen und ist auch wo die Variable Oberfläche Glykoproteine aus der Endomembrane System25verschleppt werden. Der flagellar Tasche Kragen (FPC) ist eine ringförmige Struktur, die die Geissel an der Stelle zugeordnet ist, wo es die FP beendet, aber bis vor kurzem wenig bekannt war, über die Eiweiß-Bestandteile der FPC, geformt. Wir haben eine große Protein der FPC, TbBILBO1 identifiziert und haben gezeigt, dass es essentiell für das Überleben der Parasit in der kultivierten Insekt Tsetse-Fliege-Form und in die Blutbahn Form26. Knockdown von TbBILBO1 durch RNAi verhindert FP und hemmt die Biogenese von viele andere wichtigen Zellskelett Strukturen, Herstellung der FPC und die FP wichtige Ziele für die Intervention in alle pathogener Trypanosomen. Sondierung der gereinigten oder kultivierten Parasit Zellen mit Antikörpern gegen TbBILBO1 zeigt, dass im Blutkreislauf und prozyklischen (Insect) Form, sie schafft eine ringförmige Struktur, die die Geissel umgeht. Solche Beschriftung auf einem Formular Blutkreislauf ist in Abbildung 4dargestellt.
Gereinigte Blut Form Trypanosomen konnten die Charakterisierung von vielen ungewöhnlichen biochemische und metabolische Besonderheiten, einschließlich Metabolismus von Glukose, die findet statt im Peroxisom-wie Organellen genannt Glycosomes (siehe Abbildung 5). Es wurde allgemein anerkannt, dass Pyruvat ist das Hauptprodukt von Glukose-Stoffwechsel durch die Blutbahn Trypanosomen, mit praktisch keine Produktion von Succinat und Acetat in das Mitochondrium ausgeschieden Ende. Im Gegensatz dazu wandeln die prozyklischen Trypanosomen Threonin in Acetat und Glukose in Succinat und Acetat27,28. Energie-Stoffwechsel der Trypanosomatids kann durch Anpassung an den verfügbaren Kohlenstoffquellen ausgewertet werden. Kombination von reverse Genetik und Metabolomic Analysen bestätigt Produktion in den Mitochondrien von Blut Trypanosomen-Acetat aus Glukose-abgeleitete Pyruvat und Threonin sowie Produktion von Succinat aus Glukose19,20 (Abbildung 5). Zum Beispiel ergab 1H-NMR-Analyse von Endprodukten, die vom Blutstrom Form Trypanosomen inkubiert mit PBS-Puffer mit 4 mM Glukose ausgeschieden, dass Glukose Pyruvat (85,1 % der ausgeschiedenen Endprodukte), vor allem umgewandelt wird mit geringen Produktion von Alanin (9,2 %), Acetat (4,9 %) und Succinat (0,8 %)29. Diese Wege, die in Bezug auf metabolic Flux im Vergleich zu Pyruvat Produktion von Glukose gering sind, sind essentiell für das Wachstum des Parasiten. Succinat Produktion Weg kann somit als ein guter potenzielles Ziel für die Entwicklung neuer Medikament Medikamente angesehen werden.
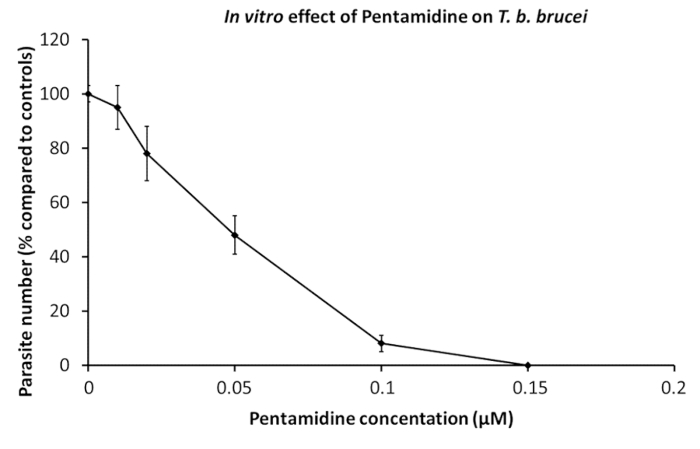
Abbildung 1 : In-vitro- Wirkung von Pentamidin auf T. B. Trypanosomen. Verdünnungen von Pentamidin wurden 2 x 105 Parasiten zu bestimmen, die Konzentration, die Hemmung der Parasit Wachstum von 50 % (IC50) hinzugefügt. Dosis-Wirkungs-Kurven bei 24 Stunden von Kultur. Fehlerbalken repräsentieren den Standardfehler des Mittelwerts von 5 unabhängigen Experimenten. Bitte klicken Sie hier für eine größere Version dieser Figur.
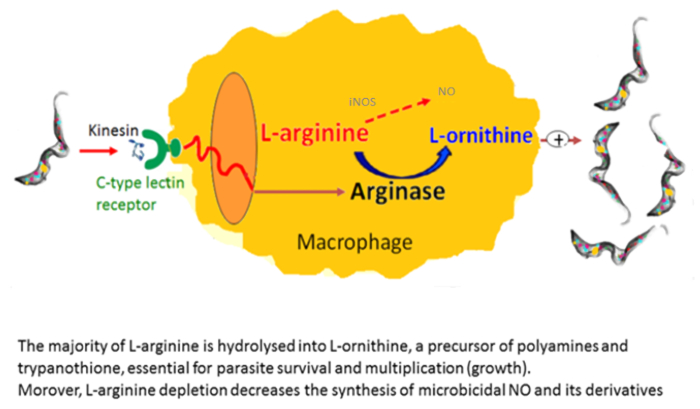
Abbildung 2 : Trypanosomen-vermittelten Arginase Induktion. Ein Kinesin veröffentlicht von Trypanosomen bindet an C-Art Lectin Rezeptoren führt zu Arginase Induktion. Dies führt zu erhöhte Produktion von L-Ornithin und Polyamine, essentiell für Parasiten Wachstum und Differenzierung, und L-Arginin Erschöpfung, was zu niedrigeren Produktion von zytotoxischen NO durch Makrophagen Nein II. Bitte klicken Sie hier für eine größere Version dieser Figur.
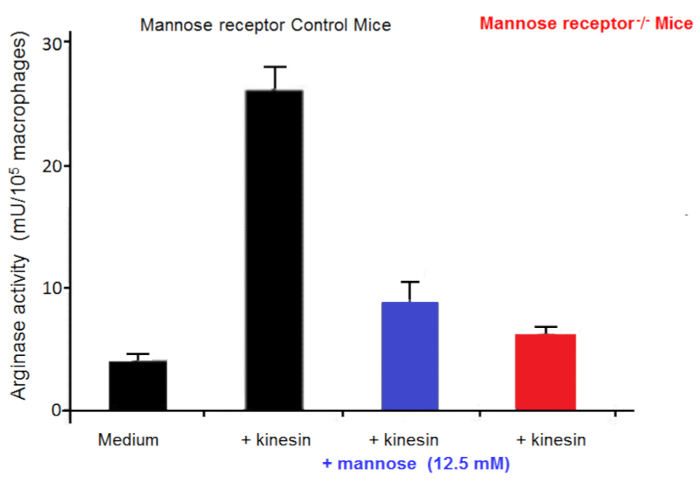
Abbildung 3 : Aktivität der Makrophagen Arginase. Arginase Aktivität in Makrophagen aus Kontroll-Mäusen und Mannose-Rezeptor Knock-out Mäuse (KO) in Vitro im Medium für 48 Stunden, mit oder ohne Kinesin oder Mannose kultiviert. Fehlerbalken repräsentieren den Standardfehler des Mittelwerts von 5 unabhängigen Experimenten. Bitte klicken Sie hier für eine größere Version dieser Figur.

Abbildung 4 : TB BILBO1 Kennzeichnung von einer Blutbahn form Trypanosomen Trypanosomen Trypanosomen Zelle (A) Immunfluoreszenz Kennzeichnung von einer Blutbahn, Kultur Form, 427-90-13-Zelle, die mit Anti-BILBO1 monoklonalen Antikörper sondiert wurde durch einen FITC-markierte Anti-Maus-Antikörper gefolgt und mit UV-Licht, (Tb visualisiert BILBO1 sind die grünen ringförmigen Signale) und die DNA bindenden Farbstoff DAPI (blaue Signale) (B) A merge DAPI, Anti-BILBO1 und Phase Kontrast-Bilder von A. Skala Bar entspricht 10 µm. Anti-BILBO1 Maus monoklonalen verdünnter 01:10 in PBS und der Sekundärantikörper war ( Anti-Maus IgM FITC) wurde verdünnt 1: 100. Bilder wurden auf einem Mikroskop mit einer Digitalkamera ausgestattet. Bitte klicken Sie hier für eine größere Version dieser Figur.

Abbildung 5 : Schematische Darstellung der Glucose und Threonin Stoffwechsel Trypanosomen Blutbahn Form. Ausgeschiedenen Endprodukte aus Glukose und Threonin Stoffwechsel sind boxed. Die Dicke blaue Pfeile zeigen enzymatische Schritte des Metabolismus von Glukose führt zu Pyruvat-Produktion, die die wichtigsten Endprodukt aus Glykolyse ausgeschieden ist. Schwarze Pfeile repräsentieren übersehen kleinere Stoffwechselwege von Glukose und Threonin Abbau, die essentiell für das Wachstum des Parasiten sind. Der Beitrag der angegebenen Enzyme experimentell validiert: ACH, Acetyl-CoA Thioesterase (EG 3.1.2.1); ASCT, Acetat: Succinat CoA-Transferase (EC 2.8.3.18); AUF, 2-amino-3-Ketobutyrate-Coenzym-A Ligase (EG 2.3.1.29); PEPCK, Phosphoenolpyruvat-Carboxykinase (EG 4.1.1.49); PDH, Pyruvat Dehydrogenase Komplex (EG 1.2.4.1.); TDH, Threonin 3-Dehydrogenase (EC 1.1.1.103). Abkürzungen: AcCoA, Acetyl-CoA; AOB, amino Oxobutyrate; DHAP, Dihydroxyacetone Phosphat; G3P, Glyceraldehyde-3-Phosphat; MAL, Malat; OA, Oxalacetat; PEP, Phosphoenolpyruvat; PYR, Pyruvat. Bitte klicken Sie hier für eine größere Version dieser Figur.
Diskussion
Gereinigte Trypanosomen sind ein mächtiges Mittel, Immunologie, Biochemie, zelluläre und molekulare Biologie zu studieren. Große Flächen von Daten und Ergebnissen erhielten von Trypanosomen, die hat dann dazu beigetragen, andere eukaryotische Zellen30Informationen einzuholen. Trypanosomen sind auch Gegenstand der Forschung wichtig und interessant, weil sie zahlreiche Mechanismen, die ihnen ermöglichen entwickelt haben, zu überleben und wachsen in zwei sehr unterschiedlichen Umgebungen: die Tsetse-Fliege-Vektor und der Säugetier-Wirt23, 31. verschiedene Techniken zu isolieren, Trypanosomen gemeldet wurden, und eine Überprüfung auf Mikrofluidik-basierte Ansätze wurde vor kurzem veröffentlichten32. Daher ist eine reproduzierbare und robuste Mittel der Parasit Isolation wichtig.
DEAE Zellulose Vorbereitung ist ein unverzichtbarer Schritt in diesem Parasit-Vorbereitung-Protokoll. Waschen-Bedingungen müssen vorsichtig durchgeführt werden, um die feinen Partikel zu beseitigen, und das Harz equilibrate, und der pH-Wert genau eingestellt werden muss (pH 8.0 ist passend für die meisten Trypanosomen-Arten). Alle Schritte müssen angepasst werden, um Parasiten Reinigung verbessern und unter Beibehaltung der Parasit Lebensfähigkeit und zellulären Eigenschaften ergeben. Wichtig ist, wurden Parasiten Lebensfähigkeit und Infektiosität nach Reinigung durch eine DEAE-Zellulose-Spalte beibehalten. Jedoch einige Stämme sind empfindlicher als andere und möglicherweise weniger infektiös nach Reinigung33. Daher die Auswirkungen der Trennung Bedingungen auf einzigartige Membran Komponenten, Parasit Stoffwechsel, Signaltechnik, Nukleinsäure-Funktionen und tierischen Infektiosität müssen bewertet werden und Trennung Bedingungen müssen entsprechend angepasst werden.
Einschränkungen für diese Technik sind, dass dieses Verfahren muss für die einzelnen Trypanosomen-Arten in einem bestimmten Wirt angepasst werden und ist auch sehr zeitaufwändig. Darüber hinaus ist DEAE Zellulose jetzt teuer. Vorläufige Tests sind notwendig, um die Trennung Bedingungen, insbesondere die Medien, optimieren die unterschiedlichen Ionischen stärken und eine genaue pH-Wert haben können. Pre-Spalte Schritte, einschließlich Antikoagulans Wahl, vorherige Zentrifugation zu entfernen, die Mehrheit der Erythrozyten, buffy Mantel Verwendung und lyse der Erythrozyten, werden nach jedem Experiment ausgewählt. Präzise Änderungen auf einen einzelnen Parameter (Puffer, Temperatur im gesamten Protokoll, Zentrifugation Parameter) könnte erheblich erhöhen Sie die Anzahl, Grad der Reinigung und Lebensfähigkeit der Parasiten erhalten33. Entwicklung neuer Trennung Parameter nach Parasiten Art und Säugetier-Zellen getrennt werden, kann erforderlich sein. Anpassungen des ersten Lanham und Godfreys Protokolls ermöglichte die Reinigung von biologisch und antigenetisch erhaltenen T. Trypanosoma aus Blut34. Neue Harze können auch getestet und mit geeigneten Bedingungen für verschiedene Arten35verwendet werden.
Die wichtige Rolle der ausgeschieden/abgesondert Faktoren (ES) von Trypanosomatids wurde kürzlich betonte16. ES enthält Moleküle beteiligt, Pathologie und Immunmodulation, wie Kinesin, der unter den Trypanosomen24konserviert ist. ES Vorbereitung von gereinigten Parasiten erfordert besondere Sorgfalt zur Vermeidung von Kontaminationen durch Elution Medienkomponenten und lysierten Parasiten.
Ein ES-basierten Impfstoff wirksam gegen Leishmaniose, eine verwandte Parasiten bereits vorhanden und ist verfügbar (CaniLeish Virbac)36. Zuordnung der konservierte Moleküle spielen wichtige Rollen in der Parasiten überleben und Wachstum könnte die Grundlage für einen künftigen Impfstoff gegen Trypanosomen, für Mensch und Tier, in einer One-Health-Ansatz darstellen. Reinigung des afrikanischen Trypanosomen aus Blut durch DEAE-Zellulose Spalten, mit Verbesserungen, bleibt der Goldstandard für die Trypanosomen-Erkennung in natürlichen Wirte mit niedrigen Parasitemias in endemischen Gebieten und die Notwendigkeit für Parasiten in großer Zahl für experimentelle Untersuchungen.
Offenlegungen
Die Autoren haben nichts preisgeben.
Danksagungen
Wir danken allen Mitgliedern der UMR 177 INTERTRYP IRD CIRAD Université de Bordeaux. Diese Forschung wurde unterstützt durch die interne Finanzierung von Universität von Bordeaux und Unterstützung durch die ANR, LABEX ParaFrap ANR-11-LABX-0024, und von der Association pour le Développement De La recherche de Parasitologie et Médecine Tropicale und der Service de Coopération et d ' Action Culturelle de l'Ambassade de France À Bangui (Centrafrique).
Materialien
| Name | Company | Catalog Number | Comments |
| 10 mL Pipettes | Falcon | 357,551 | |
| 2 mL Pipettes | Falcon | 352,507 | |
| Centrifugation tube 50 mL | Falcon | 352,070 | |
| Centrifuge | Sigma Aldrich | 4K15 | |
| DEAE cellulose | Santa Cruz | s/c- 211213 | 100 G |
| filter paper | Whatman | 1,001,125 | |
| Flat bottom flask narrow neck | Duran | 21 711 76 | 6000 mL |
| Glucose | VWR | 101174Y | 500 G |
| Heparin | Sigma Aldrich | H3149-50KU | 5 000 U |
| KH2PO4 | VWR | 120 26936.260 | 500 G |
| Microscope | Olympus | CH-20 | |
| Microscope coverslips | Thermofisher scientific | CB00100RA020MNT0 | |
| Microscope slides | Thermofisher scientific | AGAA000001 | |
| Na2HPO4 | VWR | 100 28026;260 | 500 G |
| NaCl | VWR | 27800.291 | 1 KG |
| NaH2PO4 | VWR | 110 33616;262 | 500 G |
| Nalgene Plastic Media Bottles size 125 mL | Thermofisher scientific | 342024-0125 | |
| Nalgene Plastic Media Bottles size 500 mL | Thermofisher scientific | 342024-0500 | |
| Pasteur Pipette | VWR | BRND125400 | |
| Penicillin 10,000 UI/Streptomycin 10,000 µg | EUROBIO | CABPES01 OU | 100 mL |
| Phenol red | Sigma Aldrich | P0290 | 100 mL |
| Syringue | Dutscher | SS+10S21381 | |
| Tissue culture hood | Thermoelectro Corporation | MSC-12 | |
| Trypanosoma brucei brucei | Institute of Tropical Medicine (Antwerp, Belgium). | ANTAT 1.1 | |
| Trypanosoma brucei gambiense | Institute of Tropical Medicine (Antwerp, Belgium). | ITMAP 1893 | |
| Trypanosoma musculi | London School of Hygiene and Tropical Medicine (UK) | Partinico II |
Referenzen
- Büscher, P., Cecchi, G., Jamonneau, V., Priotto, G. Human African trypanosomiasis. Lancet. 390 (10110), 2397-2409 (2017).
- Lejon, V., Bentivoglio, M., Franco, J. R. Human African trypanosomiasis. Handbook of Clinical Neurology. 114, 169-181 (2013).
- Giordani, F., Morrison, L. J., Rowan, T. G., De Koning, H. P., Barrett, M. P. The animal trypanosomiases and their chemotherapy: a review. Parasitology. 143 (14), 1862-1889 (2016).
- Aksoy, S., Buscher, P., Lehane, M., Solano, P., Van Den Abbeele, J. Human African trypanosomiasis control: Achievements and challenges. PLoS Neglected Tropical Diseases. 11 (4), e0005454(2017).
- Büscher, P., Deborggraeve, S. How can molecular diagnostics contribute to the elimination of human African trypanosomiasis? Expert Review of Molecular Diagnostics. 15 (5), 607-615 (2015).
- Truc, P., et al. Atypical human infections by animal trypanosomes. PLoS Neglected Tropical Diseases. 7 (9), e2256(2013).
- Lumsden, W. H., Kimber, C. D., Evans, D. A., Doig, S. J. Trypanosoma brucei: miniature anion-exchange centrifugation technique for detection of low parasitaemias: adaptation for field use. Transactions of the Royal Society of Tropical Medicine and Hygiene. 73 (3), 312-317 (1979).
- Büscher, P., et al. Improved Models of Mini Anion Exchange Centrifugation Technique (mAECT) and Modified Single Centrifugation (MSC) for sleeping sickness diagnosis and staging. PLoS Neglected Tropical Diseases. 3 (11), e471(2009).
- Lanham, S. M. Separation of trypanosomes from the blood of infected rats and mice by anion-exchangers. Nature. 218 (5148), 1273-1274 (1968).
- Lanham, S. M., Godfrey, D. G. Isolation of salivarian trypanosomes from man and other mammals using DEAE-cellulose. Experimental Parasitology. 28 (3), 521-534 (1970).
- Humphrey, P. A., Ashraf, M., Lee, C. M. Growth of trypanosomes in vivo, host body weight gains, and food consumption in zinc-deficient mice. Journal of the National Medical Association. 89 (1), 48-56 (1997).
- Lowry, J. E., Leonhardt, J. A., Yao, C., Belden, E. L., Andrews, G. P. Infection of C57BL/6 mice by Trypanosoma musculi modulates host immune responses during Brucella abortus cocolonization. Journal of Wildlife Diseases. 50 (1), 11-20 (2014).
- Vincendeau, P., Daëron, M., Daulouede, S. Identification of antibody classes and Fc receptors responsible for phagocytosis of Trypanosoma musculi by mouse macrophages. Infection and Immunity. 53 (3), 600-605 (1986).
- Vincendeau, P., Daëron, M. Trypanosoma musculi co-express several receptors binding rodent IgM, IgE, and IgG subclasses. Journal of Immunology. 142 (5), 1702-1709 (1989).
- Holzmuller, P., et al. Virulence and pathogenicity patterns of Trypanosoma bruceigambiense field isolates in experimentally infected mouse: differences in host immune response modulation by secretome and proteomics. Microbes and Infections. 10 (1), 79-86 (2008).
- Holzmuller, P., et al. How do parasites and their excreted-secreted factors modulate the inducible metabolism of L-arginine in macrophages? Frontiers in Immunology. 9, 778(2018).
- Abrahamson, I. A., Da Silva, W. D. Antibody-dependent cytotoxicity against Trypanosoma cruzi. Parasitology. 75 (3), 317-323 (1977).
- Herbert, W. J., Lumsden, W. H. Trypanosoma brucei: a rapid "matching" method for estimating the host's parasitemia. Experimental Parasitology. 40 (3), 427-431 (1976).
- Dauchy, F. A., et al. Trypanosoma brucei CYP51: Essentiality and Targeting Therapy in an Experimental Model. PLoS Neglected Tropical Diseases. 10 (11), e0005125(2016).
- Raz, B., Iten, M., Grether-Bühler, Y., Kaminsky, R., Brun, R. The Alamar Blue assay to determine drug sensitivity of African trypanosomes (T. b. rhodesiense and T. b. gambiense) in vitro. Acta Tropica. 68 (2), 139-147 (1997).
- Albright, J. W., Albright, J. F. In vitro growth of Trypanosoma musculi in cell-free medium conditioned by rodent macrophages and mercaptoethanol. International Journal for Parasitology. 10 (2), 137-142 (1980).
- Gobert, A. P., et al. L-Arginine availability modulates local nitric oxide production and parasite killing in experimental trypanosomiasis. Infection and Immunity. 68 (8), 4653-4657 (2000).
- De Muylder, G., et al. A Trypanosoma brucei kinesin heavy chain promotes parasite growth by triggering host arginase activity. PLoS Pathogens. 9 (10), e1003731(2013).
- Nzoumbou-Boko, R., et al. Trypanosoma musculi Infection in Mice Critically Relies on Mannose Receptor-Mediated Arginase Induction by a TbKHC1 Kinesin H Chain Homolog. Journal of Immunology. 199 (5), 1762-1771 (2017).
- Bonhivers, M., Nowacki, S., Landrein, N., Robinson, D. R. Biogenesis of the trypanosome endo-exocytotic organelle is cytoskeleton mediated. PLoS Biology. 6 (5), e105(2008).
- Albisetti, A., et al. Interaction between the flagellar pocket collar and the hook complex via a novel microtubule-binding protein in Trypanosoma brucei. PLoS Pathogens. 13 (11), e1006710(2017).
- Cross, G. A. M., Klein, R. A., Linstead, D. J. Utilization of amino acids by Trypanosoma brucei in culture: L-threonine as a precursor for acetate. Parasitology. 71 (2), 311-326 (1975).
- Bringaud, F., Rivière, L., Coustou, V. Energy metabolism of trypanosomatids: adaptation to available carbon sources. Molecular and Biochemical Parasitology. 149 (1), 1-9 (2006).
- Mazet, M., et al. Revisiting the central metabolism of the bloodstream forms of Trypanosoma brucei: production of acetate in the mitochondrion is essential for the parasite viability. PLoS Neglected Tropical Diseases. 7 (12), e2587(2013).
- Coutton, C., et al. Mutations in CFAP43 and CFAP44 cause male infertility and flagellum defects in Trypanosoma and human. Nature Communications. 9 (1), 686(2018).
- Cnops, J., Magez, S., De Trez, C. Escape mechanisms of African trypanosomes: Why trypanosomosis is keeping us awake. Parasitology. 142 (3), 417-427 (2015).
- Barrett, M. P., et al. Microfluidics-Based Approaches to the Isolation of African Trypanosomes. Pathogens. 6 (4), (2017).
- Taylor, A. E., Lanham, S. M., Williams, J. E. Influence of methods of preparation on the infectivity, agglutination, activity, and ultrastructure of bloodstream trypanosomes. Experimental Parasitology. 35 (2), 196-208 (1974).
- Gutteridge, W. E., Cover, B., Gaborak, M. Isolation of blood and intracellular forms of Trypanosoma cruzi from rats and other rodents and preliminary studies of their metabolism. Parasitology. 76 (2), 159-176 (1978).
- Cruz-Saavedra, L., et al. Purification of Trypanosoma cruzi metacyclic trypomastigotes by ion exchange chromatography in sepharose-DEAE, a novel methodology for host-pathogen interaction studies. Journal of Microbiological Methods. 142, 27-32 (2017).
- Lemesre, J. L., et al. Long-lasting protection against canine visceral leishmaniasis using the LiESAp-MDP vaccine in endemic areas of France: double-blind randomised efficacy field trial. Vaccine. 25 (21), 4223-4234 (2007).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten