Method Article
Измерение температуры тела мыши с помощью пирометр инфракрасный пассивный системный анафилаксии и пищевой аллергии оценки
В этой статье
Резюме
Здесь мы представляем новый метод для точного измерения перепадов температур тела в пассивный системный анафилаксии (PSA) и пищевой аллергии мыши модели с помощью инфракрасный термометр. Эта процедура точно дублируется в предыдущие результаты PSA.
Аннотация
Измерение температуры тела мышь имеет первостепенное значение для расследования анафилактический симптомы аллергии и. Ректальные зонды для показания температуры является общим, и они доказали быть точным и неоценимое значение в этом отношении. Однако этот способ измерения температуры требует мышей наркоз для того, чтобы вставить зонд без ущерба для животного. Это ограничивает способность наблюдать другие фенотипы мыши одновременно. Для того, чтобы исследовать другие фенотипы при измерении температуры, Ректальные зонды не являются идеальными, и другой метод. Здесь мы представляем неинвазивный метод измерения температуры, которая отказывается требование для мыши анестезии при сохранении равной надежности Ректальные зонды для измерения температуры тела. Мы используем инфракрасный термометр, который обнаруживает тела температуры поверхности в диапазоне от 2 до 150 мм. Этот метод измерения температуры тела является успешным в надежно реплицировать тенденции изменения температуры во время пассивной системой анафилаксии эксперименты на мышах. Мы покажем, что температура поверхности тела около 2,0 ° C ниже, чем ректальный датчик измерения, но степень падение температуры ниже ту же тенденцию. Кроме того мы используем тот же метод соблюдать мышей в продовольственной специальные модели для оценки температуры и деятельности уровнях одновременно.
Введение
Измерение температуры тела была неотъемлемой частью мониторинга воздействия анафилактический симптомов в животных моделей1,2. Перепады температур традиционно измеряется ректальный датчик термометры в мышей3,4. С этими измерениями следователи надежно изображали различия в температуре между переменными; Однако этот метод является длительная процедура и вызывает бедствие для мышей, которые могут увеличить температуру тела. Ректальное исследование может также вызвать слизистой срывать и инфекции3. Кроме того следует под наркозом мышей чтобы гуманно вставить ректального зонда для измерения температуры3. Это медленный процесс, и он запрещает измерения последовательных температур в течение короткого периода времени. Кроме того фенотипы активность мышей не могут быть соблюдены в это время, до тех пор, пока цистит является полностью стерлась, который является еще один трудоемкий процесс. Совсем недавно другие надежные методы для измерения температуры тела использовали Теги подкожно имплантированных инфракрасный пассивный транспондер или радио передатчиков, которые включают датчик температуры3,5,6. Хотя они принимаются как идеальный практике некоторыми исследователями, эти методы не используются широко из-за высоких первоначальных издержек и страданиями для мышей, из-за хирургической имплантации датчика температуры под кожу или другой частью тела.
Для того, чтобы продемонстрировать, что разница температур является точным отражением симптомов болезни модель1,2, мышей должны бодрствовать во время измерения температуры и иметь возможность вернуться к их нормальной деятельности фенотипические непосредственно перед и после измерения. С этой целью мы искали метод, в которой это может быть достигнуто.
Нашей целью было недорого и точно измерить температуру тела мыши, без необходимости для анестезии и без ограничений на деятельность, чтобы включить наблюдение за поведенческих фенотипов во время и после времени измерения температуры. Для достижения этой цели, стало очевидно, что менее инвазивный метод чем стандартный ректальной температуры зонды не требуется. Инфракрасные термометры использовали на протяжении десятилетий в клинической медицине, особенно в педиатрии, для получения точной температуры. Это был альтернативный метод, который позволяет врачам быстро и качественно получить измерения температуры у младенцев и детей суетливый, которые активно мобильных. Мы реализовали эту же технику в мышах и разработали успешный метод для получения температур без анестезии. Важно отметить, что мы показываем, что этот метод способен тиражирование устоявшихся пассивный системный анафилаксии результаты относительно изменений температуры, а также в состоянии наблюдать действие мыши на протяжении всего измерения. Кроме того, мы используем тот же метод для оценки температуры тела еда аллергические мышей, одновременно исследуя другие симптомы, чтобы продемонстрировать, что температура тела действительно является точным отражением уровня активности и общей фенотип мыши.
протокол
Все эксперименты на животных были утверждены животное уход и использование Комитета Ла Хойя института аллергии и иммунологии.
1. мышь измерение температуры тела во время анестезии
- Поместите указатель мыши в поле индукции анестезии. Анестезировать с помощью 1 Л/мин поток кислорода с 5% изофлюрановая.
Примечание: Анестезии подтверждается, когда мышь перестает добровольного движения и был неподвижным более 30 в качестве альтернативы, s. Монитор дыхания, и когда мышей дыхание в дыхание 1 за каждые 2 s или дольше, подтверждается анестезии. - Удерживайте кнопку мыши на затылке шеи с указательным и большим пальцем и удерживайте хвост с pinky пальца чтобы разоблачить в нижней части живота.
- Поместите инфракрасный термометр датчик ниже нижней части живота удерживая мышь с ее тело параллельно земле.
Примечание: Внешней плоской поверхности термометр (не поверхности датчика) должна быть около 2-5 мм от поверхности живота. Эта репликация результаты температур измерены пока мышей не находятся под наркозом (описано в разделе 2). Важно определить целевой сайт живота. Направленный между двух верхних соски позволяет последовательные результаты. - Нажмите и удерживайте для измерения температуры. Обеспечить стабильное проведение мыши и термометр.
2. мыши измерение температуры тела без анестезии
- Возьмите мышь в середине хвост.
-
Разоблачить брюшко мыши.
- Позволяет мыши, чтобы держаться прямо края поверхности, например губы открытой клетки или клетки Топ с ее передними лапами.
Примечание: Это позволяет мыши растянуть его верхней части тела и разоблачить живота. - Кроме того позволяют мыши провести на краю верхней прямой термометра и сидеть на внешней плоской поверхности термометр с ее живот чуть больше инфракрасного датчика мыши.
Примечание: Каждый раз, когда задние лапы отдыхают на поверхности термометр, убедитесь, что ноги не препятствует датчик от брюшной поверхности. Термометры с ног препятствий будет измерять температуру ниже чем у живота.
- Позволяет мыши, чтобы держаться прямо края поверхности, например губы открытой клетки или клетки Топ с ее передними лапами.
- Нажмите и удерживайте для измерения температуры.
Примечание: Мышей, как правило, двигаться; Будьте осторожны при измерении же расположение тела последовательно принимая измерения температуры, когда мыши относительно менее мобильных.
3. пассивный системный анафилаксии7
-
День 0: Ознакомления с иммуноглобулина Е (IgE).
- Подготовка 200 мкл (на мышь) анти dinitrophenyl (DNP) IgE в концентрации 100 мкг/мл в PBS.
- Внутрибрюшинно придать 200 мкл МГЭ анти dinitrophenyl (DNP), подготовленный на этапе 3.1.1 или PBS только (PBS-только отрицательный контроль). Используйте 26 G иглой для инъекций. Выполнение инъекции Просто латеральнее от средней линии, приблизительно между двух самых низших соски.
-
День 1: Заставить анафилаксии с DNP-HSA.
- Подготовка 100 мкл (на мышь) DNP-HSA в концентрации 10 мг/мл 0,9% NaCl.
- Анестезировать мышей, как описано в шаге 1.1.
- Измерение температуры тела, с помощью метода, описанного в шаге 1.
- Внутривенно вводить 100 мкл DNP-HSA, подготовленную на этапе 3.2.1. Используйте иглой 30 G для инъекций. Выполнение инъекции на retroorbital венозного синуса. Вставьте иглу на медиальной стороне глаза в неглубокой угол, направленных за глаза.
- После инъекции место мышей в индивидуальных клетках. Убедитесь, что мышей оправиться от анестезии. Отмечают, что они пробуждают и стать добровольно мобильных.
- Измерение температуры тела, используя инфракрасный термометр и наблюдать их деятельности каждые 10 мин для 70 мин.
4. мыши модель пищи специальные8,9
Примечание: Схема показана на рисунке 2.
-
День 0: Информирования мышей с OVA/квасцов.
- Подготовка 100 мкл OVA (0.5 мг/мл) и квасцы (10 мг/мл) вместе в PBS (на мышь). Вихрь на низкое значение для 30 мин.
- Анестезировать мышей, как описано в шаге 1.1.
- С помощью иглы 26 G, внутрибрюшинно придать каждой мыши с 100 мкл смеси OVA/квасцов, подготовленную на этапе 4.1.1.
Примечание: Vortex OVA/квасцов смесь снова, кратко перед каждой инъекцией, наилучшим образом обеспечить Гомогенизированные смеси. Смотрите Шаг 3.1.3 для деталей на месте инъекции. - После инъекции место мышей обратно в их оригинальных клеток. Убедитесь, что мышей оправиться от анестезии. Отмечают, что они пробуждают и стать добровольно мобильных.
-
День 14: Выполните второй сенсибилизация с OVA/квасцов.
- Повторите шаги 4.1.1, 4.1.2 и 4.1.3.
-
Дни 28-46: вызов мышей с OVA каждый день.
- Подготовка 100 мкл (на мышь) OVA в концентрации 250 мг/мл в PBS.
Примечание: Смесь должны быть сделаны мягко покачиваясь вручную, а не с вихревой для минимизации образования пузыря.- Если с продовольственная Специальные ингибиторы, подготовьте ингибиторы9. Подготовка 100 мкл (на мышь) ингибитора в концентрации 1 мг/мл в PBS. Это позволяет поставку 100 мкг ингибитора для каждой мыши.
Примечание: Не превышать 100 мкл ингибитора на мышь, как только мышей способны обрабатывать 200 мкл объема общего кормления в течение дня один вызов. Как для вызов OVA также необходимы 100 мкл, 100 мкл является максимальная рекомендуемая тома для использования ингибитора.
- Если с продовольственная Специальные ингибиторы, подготовьте ингибиторы9. Подготовка 100 мкл (на мышь) ингибитора в концентрации 1 мг/мл в PBS. Это позволяет поставку 100 мкг ингибитора для каждой мыши.
- Анестезировать мышей, как описано в шаге 1.1.
- Устно затравки каждой мыши с 100 мкл раствора OVA (25 мг OVA в 100 мкл PBS gavaged на мышь), был подготовлен на шаге 4.3.1.
- Если использование ингибиторов, используют те же методы, описанные в следующих шагах для затравки ингибитора (или PBS управления), подготовленный в шаге 4.3.1.1 30 минут до вызов OVA. После 30 мин перейти к следующему шагу.
- Используйте иголка калийную с 1 мл шприц. Занять до 100 мкл OVA в шприц.
- Вставить иглу в рот; затем указывая иглы к левой или правой стороны горла, аккуратно вставьте иглу через пищевод. Придать 100 мкл OVA.
Примечание: Чтобы гарантировать, что игла не трахеи, соблюдайте активного дыхания перед инъекцией OVA. Вставки иглы также быть сопротивление рано, если он вошел трахеи, вместо того, чтобы пищевода.
- Поместите мышей в их индивидуальных клетках. Для легко наблюдения стул качества используйте клетки без постельных принадлежностей.
- Обеспечение восстановления от анестезии. Отмечают, что мышей пробудить и стать добровольно мобильных.
- Измерение температуры тела мышей в timepoints, 10, 20, 40 и 60 мин с использованием методики, описанной в разделе 2.
- Подготовка 100 мкл (на мышь) OVA в концентрации 250 мг/мл в PBS.
Результаты
Пассивная системная анафилаксии: для инъекций iv, 10 неделя старый самок мышей BALB/c были под наркозом. До инъекции мы измерили их тела температуры (1 видео), как описано в шаге 1. Рисунок 1 показывает тренд температуры обоих населения после iv инъекции. IgE сенсибилизированных мышь, показали снижение максимальной температуры 3.0 ° c в 20 мин, в то время как мышь управления PBS имел максимальное падение 1.1 ° C на 20 минут7. Кроме того на протяжении всего этого процесса, оценки деятельности были оценены на основании мобильности каждого мыши. Мышей были впервые замечены без каких-либо агитации. Затем они были замечены с перемешиванием, представляя оценщика руки в клетку и делая мягкие контакт с помощью мыши. Основываясь на их реакции, мышей оцениваются и забил на шкале от 1 до 3. Оценка 1 указывает мышь, которая является неподвижным или минимально мобильных с и без агитации; Оценка 2 указывает мыши, неподвижные без агитации и мобильный телефон с агитации без быстрого уклончивыми движениями; и оценка 3 указывает, мобильных или неподвижной без агитации и мобильных с перемешиванием и делает быстрый уклончивыми движениями мыши. Видео 2 и 3 приводятся примеры двух групп, которые иллюстрируют методы измерения температуры, а также соответствующие измерения уровня активности. Использование инфракрасный термометр для измерения температуры без анестезии, которая в свою очередь позволило для оценки поведенческих фенотип до, во время и после измерения температуры; в отличие от традиционных ректальный датчик будет требует анестезии и поэтому исключает любой поведенческих оценки в течение нескольких минут, окружающих измерения температуры.
Модель мыши пищевой аллергии8: Схема модели мыши это показано на рисунке 2. Мышей являются самок мышей BALB/c возрастов 8 до 10 недель на момент сенсибилизации. Мышей наблюдалось в 10, 20, 40 и 60 мин после каждой задачей для температуры тела и активность. Представитель результат показан на рисунке 3 изменения температуры во время вызова 7. Мышей показало падение максимальной температуры в 10 мин; Таким образом температур 10 мин были использованы для корреляции с температурой тела на 10 мин уровни активности (с скоринга, основанные на критериях, изображенные выше). Оценка активности и температуры падение показали статистически значимые корреляции (рис. 4). Как уже упоминалось в разделе пассивная системная анафилаксии, поведенческие наблюдения были выполнены из-за отсутствия анестезии, и использовать инфракрасный термометр. В противоположность этому Ректальные зонды бы предупредить любой поведенческих замечания или оценки во время измерения температуры. Любое время температуры и другой деятельности, которые должны быть записаны фенотипов, важно использовать систему измерения температуры, которая не требует анестезии.
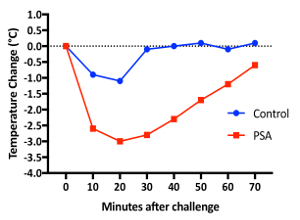
Рисунок 1 : Пассивный системный анафилаксии мышей BALB/c. Две мыши были ip вводится с анти DNP МГЭ на день 0, а затем iv вводится с физиологическим или DNP-HSA на 1 день. Температура тела была измерена с помощью инфракрасный термометр перед инъекцией и каждые 10 мин после инъекции для 70 мин пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
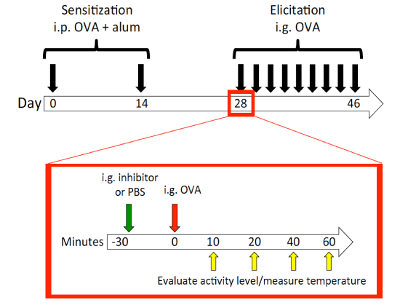
Рисунок 2 : Пищевой аллергии мыши модели схема. В день 0 мышей BALB/c были сенсибилизированных ip с OVA и квасцы и снова на 14 день. День 28, 30 мин до каждый вызов, мышей были устно gavaged с PBS управления или ингибитор пищевой аллергии (HRF-2CArecombinant гистамин Рилизинг-фактор с его двумя которым обменялся с alanines)9. Затем были оспорены мышей ig с 25 мг OVA. Задачи были выполнены каждый день 9 задач. Мышей наблюдались для измерения температуры тела и активность, забив в 10, 20, 40 и 60 мин после вызов. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
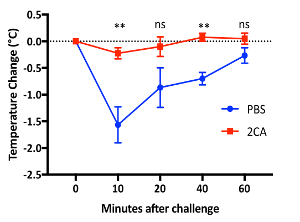
Рисунок 3 : Пищевой аллергии модели мышей BALB/c. Изменение температуры после 7 вызов OVA контролируется инфракрасный термометр. Типичные результаты отображаются от по крайней мере четырех независимых экспериментах (**, p < 0.01 между PBS и 2CA лечения, t критерия Стьюдента; ns: не значительные). Планки погрешностей = SEM. пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.

Рисунок 4 : Корреляция между активностью и температуры на 10 мин в пищевой аллергии экспериментов. Эти результаты отражают измерений из 4 отдельных наборов экспериментов. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
Видео 1: тела измерения температуры, в то время как мыши находятся под наркозом. Измерения температуры тела мыши могут быть приняты с или без анестезии. Для последовательного измерения важно всегда стремиться термометр в том же месте тела. Пожалуйста нажмите здесь, чтобы посмотреть это видео. (Правой кнопкой мыши для загрузки.)

Видео 2: уровень активности в 40 мин после инъекции DNP-HSA iv. Мышей наблюдаются без агитации первоначально, затем с перемешиванием. Основываясь на их реакции, мышей были оценены и забил на масштабах деятельности от 1 до 3. Мыши на левой стороне (анти DNP сенсибилизированных мышь) дается оценка 1, в то время как мыши справа (PBS мышь управления) дается оценка 3. Пожалуйста нажмите здесь, чтобы посмотреть это видео. (Правой кнопкой мыши для загрузки.)

Видео 3: тела измерения температуры в 40 мин после инъекции DNP-HSA iv. Эта цифра демонстрирует способность инфракрасный термометр, чтобы точно и неинвазивно измерения температуры тела без анестезии. Кроме того результаты деятельности, продемонстрирована в видео 2 отражают степень падение температуры, измеренные в этом видео. Пожалуйста нажмите здесь, чтобы посмотреть это видео. (Правой кнопкой мыши для загрузки.)

Видео 4: ошибки температуры чтения, Задние лапы непроходимость датчика. Это видео демонстрирует разницу в температурах с и без следа в пределах окружности датчика. Пожалуйста нажмите здесь, чтобы посмотреть это видео. (Правой кнопкой мыши для загрузки.)
Обсуждение
Протокол, в описанный был создан с целью измерения температуры тела без применения анестезии. Несмотря на его относительной легкостью, с какой температуры могут быть получены чтений есть несколько предостережений, которые разместить эту технику, в дополнение к более очевидные эффекты, такие как обработка стресс и различных температурах.
Во-первых для поддержания постоянной температуры на протяжении всего эксперимента, место, где время измеряется температура необходимо заранее с помощью анатомические ориентиры, и следователи должны иметь возможность повторить измерение сказал тела Местоположение. Путем обеспечения мыши передними лапами на поверхности линейка, например губы клетку или край термометра, живота подвергается легко инфракрасный датчик термометр. Как правило живота является большой площадью поверхности, что позволяет некоторую гибкость для устойчивых результатов. Кроме того живот редкой волос, чем на дорсальной поверхности мыши и таким образом позволяет для более точного чтения температуры тела.
Во-вторых задние лапы всегда должны контролироваться при принятии измерения температуры. Когда термометр находится недалеко от живота, мышей, как правило, место их ноги на термометр, сам. Когда ноги или ног в пределах окружности датчика, показания температуры может быть ниже, чем в животе, как показано в видео 4. Важно позволить мыши колебаться с ноги по обе стороны от датчика, при сохранении свободной от каких-либо частей тела или объектов помимо брюшной поверхности окружности.
В-третьих брюшной поверхности мыши не может быть мокрой, когда замеры. Мокрой поверхности будет изменить способность термометр для измерения температуры точно; как правило измеренная температура будет ниже, чем фактическое значение. Этой проблемы можно избежать, сохраняя мышей в клетках с свежим постельным бельем в течение периода наблюдений. Это также гарантирует, что сухость поверхности живота является стандартным каждый раз, когда температура измеряются.
И наконец, инфракрасные термометры имеют большие погрешности чем Ректальные зонды, хотя и незначительно. Погрешность измерений с Ректальные зонды является ± 0,1 ° C, тогда как для Инфракрасные термометры, это ± 0,2 ° C. Эта погрешность была минимальной по сравнению с общей различия в перепад температур между населением в эксперименте PSA. Что еще более важно проект, требующий разница, как тонкие, как ± 0,1 ° C может также предусматривать другие разницы ошибка проблемы, вне зависимости от инфракрасный термометр используется ли или ректального зонда. В ходе подготовки настоящего Протокола также было показано, что существует очень хорошая корреляция между основной температуры тела измеряется транспондеров имплантируемые температуры и температуры поверхности тела измеряется Инфракрасные термометры во время Липополисахарид индуцированной гипотермии6.
Падение температуры в пищевой аллергии модели используется не было ранее отмечено8,10. Стандарт для оценки ранее был определить серьезность фенотип, забив диарея; Однако этот метод не хватает объективности. С помощью инфракрасного термометра, мы показали, что тонкие температуру капли могут быть обнаружены. Мы были тогда могли соотнести их с уровней активности, как мышей не были под наркозом во время процедуры. Этот метод позволяет для быстрый, точный, easy-to-use, неинвазивный и недорогой способ измерения температуры тела в мышей, находясь в состоянии соблюдать другие фенотипы, которые иначе бы быть пропущены, если мышей наркоз для ректального зонда измерения.
Раскрытие информации
Авторы не имеют ничего сообщать.
Благодарности
Исследования в лаборатории был поддержан NIH Каваками грантов: R01 AR064418-01A1, R01 HL124283-01, R21 AI 115534-01 и R41AI124734-01.
Материалы
| Name | Company | Catalog Number | Comments |
| Non-contact infrared thermometer | SinoPie | DT-8861 | |
| Anti-dinitrophenyl (DNP) IgE | Sigma Aldrich | D8406-.2MG | |
| PrecisionGlide 30 G needle | BD | 305128 | |
| PrecisionGlide 26 G needle | BD | 305111 | |
| 1 mL syringe | BD | 309659 | |
| Dinitrophenyl - human serum albumin | Biosearch Technologies | D-5059-10 | |
| Ovalbumin from chicken egg white | Sigma Aldrich | A5503-50G | |
| Imject Alum | ThermoFisher Scientific | 77161 | |
| Animal Feeding Needles, disposable | Fisher Scientific | 01-208-87 |
Ссылки
- Finkelman, F. D. Anaphylaxis: lessons from mouse models. The Journal of Allergy and Clinical Immunology. 120 (3), 506-515 (2007).
- Lee, J. K., Vadas, P. Anaphylaxis: mechanisms and management. Clinical and Experimental Allergy: Journal of the British Society for Allergy and Clinical Immunology. 41 (7), 923-938 (2011).
- Newsom, D. M., Bolgos, G. L., Colby, L., Nemzek, J. A. Comparison of body surface temperature measurement and conventional methods for measuring temperature in the mouse. Contemporary Topics in Laboratory Animal Science. 43 (5), 13-18 (2004).
- Wong, J. P., Saravolac, E. G., Clement, J. G., Nagata, L. P. Development of a murine hypothermia model for study of respiratory tract influenza virus infection. Laboratory Animal Science. 47 (2), 143-147 (1997).
- Quimby, J. M., Olea-Popelka, F., Lappin, M. R. Comparison of digital rectal and microchip transponder thermometry in cats. Journal of American Association for Laboratory Animal Science. 48 (4), 402-404 (2009).
- Mei, J., Riedel, N., Grittner, U., Endres, M., Banneke, S., Emmrich, J. V. Body temperature measurement in mice during acute illness: implantable temperature transponder versus surface infrared thermometry. Scientific Reports. 8 (1), 3526 (2018).
- Doyle, E., Trosien, J., Metz, M. Protocols for the induction and evaluation of systemic anaphylaxis in mice. Methods in Molecular Biology. 1032, 133-138 (2013).
- Brandt, E. B., et al. Mast cells are required for experimental oral allergen-induced diarrhea. The Journal of Clinical Investigations. 112 (11), 1666-1677 (2003).
- Ando, T., et al. Histamine-releasing factor enhances food allergy. The Journal of Clinical Investigations. 127 (12), 4541-4553 (2017).
- Brandt, E. B., et al. Targeting IL-4/IL-13 signaling to alleviate oral allergen-induced diarrhea. The Journal of Allergy and Clinical Immunology. 123 (1), 53-58 (2009).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены