Method Article
Синтез и определение структуры изомеров PIIIA µ-Conotoxin с различными дисульфида связность
В этой статье
Erratum Notice
Резюме
Цистеин богатые пептиды сложить в собственный трехмерной структуры в зависимости от их соединения дисульфида. При буфера окисления не приведет к желаемой дисульфида подключения требуется целевой синтез отдельных дисульфида изомеров. Протокол касается селективный синтез пептидов, 3-дисульфид стружечные и их структурного анализа с помощью исследования ЯМР и МС/МС.
Аннотация
Пептиды с высокое количество которым находятся обычно под влиянием относительно трехмерной структуры их соединения дисульфида. Он таким образом очень важно, чтобы избежать нежелательных дисульфидными облигаций формирования во время синтеза пептида, потому что это может привести к совершенно разных пептидных структуры и соответственно изменены биологическую. Однако правильное формирование нескольких дисульфидными облигаций в пептид трудно получить с помощью стандартных методов самостоятельной складной как обычного буфера окисления протоколы, потому что могут быть сформированы несколько дисульфида связность. Этот протокол представляет передовые стратегии, необходимые для целенаправленного синтеза нескольких мост дисульфидных пептиды, которые не могут быть синтезированы через буфер окисления в высокое качество и количество. Исследование демонстрирует применение различных защиты группы стратегии для синтеза всех изомеров возможно 3-дисульфид стружечные пептид µ-conotoxin PIIIA в целевой путь. Пептиды подготовленный на основе Fmoc твердой фазы пептидного синтеза с использованием стратегию защиты группы для формирования определенных дисульфидными облигаций. Соответствующих пар которым защищены с trityl (Trt), acetamidomethyl (Acm) и трет-бутила (tбу) защита группы чтобы убедиться, что во время каждого шага окисления только необходимые которым deprotected и связаны. Помимо целенаправленного синтеза сочетание нескольких аналитических методов используется для уточнить правильный складные и поколения желаемого пептид структур. Сравнение различных изомеров 3-дисульфид стружечные указывает на важность точного определения и знание дисульфида подключения для расчета трехмерной структуры и интерпретации биологических деятельность пептида изомеров. Аналитическая характеристика включает точное дисульфида Бонд разяснения через тандем масс-спектрометрия (МС/МС) анализ, который проводится с частично сокращенной и алкилированные производные нетронутыми пептид изомера, подготовлен адаптированный протокол. Кроме того пептид структуры определяются с помощью 2D ядерного магнитного резонанса (ЯМР) эксперименты и знания, полученные от анализа МС/МС.
Введение
Использование биоактивные пептиды в фармацевтических исследований и разработок является признанным, потому что они представляют собой мощный и высокоселективных соединений для конкретных биологических цели1. Для их биологическую однако, трехмерная структура имеет большое значение для того, чтобы выполнять структура активность отношения исследования2,3,4. Помимо первичного аминокислотной последовательности, которая влияет на общую конформации дисульфидными облигаций значительно стабилизации структуры хвоща богатые пептиды5. Несколько мост дисульфидных пептиды включают конотоксины например µ-PIIIA от конус скворец , который содержит шесть которым в своей последовательности. Это высокий хвоща содержимое теоретически позволяет формирование 15 дисульфида изомеров. Правильные дисульфида подключения является очень важным для биологической активности6,7. Однако возникает вопрос есть ли более чем одной биоактивные конформации естественных пептидов и если да, какие из этих изомеров обладает высокой биологической активностью? В случае µ конотоксины, биологической цели являются воротами напряжения натрия ионных каналов, и µ-PIIIA, в частности, является самым мощным для подтиповV1.2, Na Na NaV1.7 иV1.43.
Синтез пептидов, дисульфид мост может быть достигнуто с помощью различных методов. Наиболее удобный способ для образования дисульфидных связей внутри пептид является так называемого оксидативного самостоятельно складной подход. Здесь линейная прекурсора желаемый циклические пептиды синтезируется, сначала с помощью твердофазный пептидного синтеза, который после расщепления от полимерных поддержки подвергается окислению в буферную систему. Редокс активных агентов, таких как восстановленного и окисленного глутатиона (GSH/GSSG) часто добавляются для поощрения образования дисульфидных связей. Основным недостатком буфер поддерживается собственной складывания является, что дисульфидными облигаций формируются в ступенчатой моды не выборочно. По сравнению с родной пептид, для которого часто описывается только один конкретный дисульфида изомер, это можно получить многочисленные другие изомеры с этот подход8. Уже было показано, что мкг-PIIIA привести к по крайней мере три по-разному сложенном изомеров после индивидуальной складывающиеся в предыдущем исследовании3. Разделение такой смеси изомером является довольно трудно из-за аналогичные удержания раз, если с помощью хроматографических очистки методы9. Поэтому выгодно целевых синтез определенных изомеров. Производить специально требуемого изомер с определенными дисульфида связи, специальной стратегии в котором дисульфидными облигаций последовательно закрываются. Таким образом линейной прекурсоров, перевозящих отдельные группы защиты в отдельных хвоща пар синтезируется на поддержку полимера. После ликвидации хвоща пары являются индивидуально и последовательно deprotected и связаны в реакции окисления приносить желаемых дисульфидными облигаций10,11,12,13, 14 , 15 , 16. после синтеза и очистки продукта реакции, он требуется для подтверждения личности и соединения дисульфида подходящих методов анализа. Многочисленные аналитические методы доступны для выяснения основной аминокислотной последовательности, например., МС/МС, в то время как определение дисульфида подключения по-прежнему остается гораздо менее исследованы. Помимо сложности таких несколько дисульфида стружечные пептиды, связанные с продуктом примеси (например., от дисульфида скремблирования), из-за образец подготовки и работы могут еще более усложнить анализ. В этом документе мы покажем, что использование сочетания различных аналитических методов необходимо недвусмысленно разъяснить удостоверение дисульфидных связей в изомеров µ-PIIIA. Мы есть комбинированные методы хроматографии с масс-спектрометрии и же образцы для ЯМР спектроскопии. В desorption/ionization(MALDI) при содействии матрицы лазерный анализ МС/МС мы определили дисульфидными облигаций с помощью частичного сокращения и iodoacetamide деривации, потому что сверху вниз анализ не является возможным для этого пептида. Для того чтобы получить трехмерную структуру каждого изомера были эксперименты 2D ЯМР. Таким образом путем объединения различных сложных аналитических методов, это возможно для выяснения должным образом дисульфида подключения и трехмерной структуры комплекса несколько дисульфида стружечные пептиды7.
протокол
Примечание: Все аминокислоты, используемые в настоящем документе были в L-конфигурации. Согласно рекомендации Комитета IUB номенклатуры и совместной комиссии по биохимической номенклатуры IUPAC-IUB были использованы сокращения аминокислот, и аминокислоты производные.
1. твердофазный пептидного синтеза (ППУ)
Примечание: Осуществляют синтез пептида твердофазный синтезатор. Выполните синтеза линейных пептид прекурсоров общей последовательности ZRLCCGFOKSCRSRQCKOHRCC-NH2 , используя стандартный протокол для химии 9-fluorenylmethyloxycarbonyl (Fmoc). Применить следующие защищенные аминокислоты: Pyr (БПЦ (трет butyloxycarbonyl)), Arg (Pbf (2,2,4,6,7-pentamethyldihydrobenzofuran-5-сульфонил)), Asn(Trt), Asp(tBu), Hyp(tBu), Lys(Boc), Ser(tBu), Gln(Trt), Glu(tBu), Trp(Boc), Tyr(tBu), Thr(tBu) и его (ТРТ). Защищайте хвоща пар с Trt-, Acm- или tБу групп согласно предполагаемого дисульфида подключения.
-
Подготовка
- Сухие смолы Fmoc каток Амид (Загрузка: 0,28 ммоль/г) с использованием лиофилизатор на ночь.
- Введите желаемый пептид последовательности (код 1-письмо) в программу синтезатор. Программа вычисляет необходимую сумму для каждого индивидуального реагента и указывает количество растворителя.
- Весят отдельные реагенты (аминокислоты, HBTU (2-(1H-benzotriazol-1-yl)-1,1,3,3-tetramethyluronium Гексафторофосфат)) согласно протоколу и развести их в диметилформамиде (DMF) до конечной концентрации 2,4 М (аминокислоты) и 0,6 М ( HBTU), соответственно.
- Перевод различных реагентов (аминокислоты, HBTU, N-methylmorpholine (НММ, 50% в DMF), пиперидина (20% в DMF), ДМФ, дихлорметана (DCM)) соответствующих судов и поместите их в соответствующие ракетки твердофазный пептид синтезатор.
- Добавить 100 мг сухой смолы в реакции столбцы и положил их в рэкет синтезатор. Запустите твердофазный пептидного синтеза.
-
ППУ-протокол (предоставляемые синтезатор)
Примечание: Протокол применяется к 100 мг смолы (Загрузка: 0,28 ммоль/г) добавляется к столбцу одной реакции для 28 мкмоль масштаба.- Подготовка смолы
- Промойте смолы с 2500 мкл ДМФ, 1400 мкл DCM и 1400 мкл ДМФ.
- Флеш смолы с воздухом до тех пор, пока удаляется растворителя и промойте смолы с 2500 мкл ДМФ.
- Расщепление Fmoc, защищая группы
- Добавить 20% пиперидина в DMF (1000 мкл) смолы и ждать 6 минут удалите решение из смолы. Повторите шаг 1.2.2.1.
- Дважды промыть DMF (1st 4000 мкл, 2nd1400 мкл), потолочные смолы с воздухом до тех пор, пока удаляется растворителя и дважды промыть 2000 мкл ДМФ.
- Реакции соединения
- Смешайте следующие реагентов в отдельном флаконе: HBTU (450 мкл; 0,6 М в DMF; 270 мкмоль; 9,6 eq.), NMM (125 мкл; 50% ДМФ 568 мкмоль; 20 eq.), Fmoc амино кислоты (420 мкл; 2,4 М в DMF 1.01 ммоль; 36 эквалайзера). Добавить смесь смолы и ждать 13 мин удалить решение из смолы. Повторите шаг 1.2.3.1.
- Вымойте с 3000 мкл ДМФ. Мыть дважды с 1400 мкл ДМФ. Мыть дважды с 2000 мкл ДМФ.
- Повторите шаги 1.2.2 и 1.2.3 согласно количество аминокислот пептидной последовательности.
- Окончательный Fmoc расщепления и смолы мытье
- Добавить 20% пиперидина в DMF (1000 мкл) смолы и ждать 6 минут удалите решение из смолы. Повторите шаг 1.2.4.1.
- Дважды промыть DMF (1st 4000 мкл, 2nd 1400 мкл) и промойте смолы с воздухом. Дважды промыть 2000 мкл ДМФ, 4 раза с 1400 мкл DCM и очистить дважды с воздухом.
- Подготовка смолы
-
Работа вверх
- Lyophilize смолы от реакции, которую столбцы на ночь после завершения синтеза.
2. пептидные расщепления от смолы (рис. 1A)
Примечание: Во время процедуры расщепления, будут deprotected все аминокислоты боковые цепи за исключением Cys(Acm) и Cys (tбу). Протокол применяется к 100 мг смолы.
- Объединить лиофилизированной смолы в 12 мл трубку и охладить его до 0 ° C на льду.
- Добавьте 150 мкл мусорщик смеси (подготовлен от 0,75 г фенола, 0,5 мл thioanisole, ethanedithiol 0,25 мл) и 1 мл trifluoroacetic кислоты (ТФК, 95% в воде (H2O)) на льду смолы. Оставьте, слегка покачивая за 3 ч при комнатной температуре.
- Фильтр смесь через стекло фритты и сбора фильтрата в трубах, индивидуально заполнены с ледяной диэтиловым эфиром (1 мл смеси расщепление на 8-10 мл диэтиловый эфир). Пептида осаждается в виде белого твердого.
- Промойте фильтр торт с дополнительной TFA (95% H2O, примерно 1-3 мл).
- Закройте пробирки, содержащие осадок и центрифуги (3400 x g) суспензии на 1 мин, сцеживаться супернатант и мыть окатышей с 8-10 мл ледяной диэтиловом эфире. Повторите этот шаг 3 раза.
- Оставьте постоять 5 мин удалить оставшиеся следы диэтиловом эфире без пробки гранул. Растворяют гранулы сырой продукт в 1 мл трет-бутанола (80% в H2O). Freeze-Dry пептиды (-80 ° C).
3. Очистка линейной прекурсоров с полу препаративные высокопроизводительных жидкостной хроматографии (ВЭЖХ)
Примечание: Очистить сырой пептиды, полу препаративные обратной фазы (RP) ВЭЖХ, оснащены C18 столбца (размер частиц 5 мкм, 100 Å размер поры, 250 x 32 мм) и 3,6 мл впрыска цикла. Используйте систему градиента элюции 0,1% TFA H2O (элюента A) и 0,1% TFA в ацетонитриле (MeCN) / h2O (9:1, элюента B). Обнаружение пиков на 220 Нм.
- Добавить около 70 мг сырой пептида в 15 мл трубку и растворяют твердые пептида в объеме образца цикла ВЭЖХ (например., 3,6 мл). Используйте смесь 0,1% TFA MeCN/H2O (1:1). Вихревой до полное растворение и центрифуги (3400 x g) решение за 1 мин.
- Разработать образец (3,6 мл) в 5 мл шприц и вставляют образца без каких-либо воздушных пузырей впрыска цикла. Внедрить в системе ВЭЖХ. Разделите смесь пептид, с использованием градиента 0-50% элюента B свыше 120 мин со скоростью потока 10 мл/мин.
- Сбор фракций в отдельных труб, как они появляются. После завершения выполнения подготовки отдельных фракций для ВЭЖХ анализ (шаг 6.1-6.2) и масс-спектрометрия (МС). Freeze-Dry фракций и хранить их при-20 ° C.
- После анализа MS и ВЭЖХ объединить чистой доли линейной пептида и подготовить образцы для первого окисления.
4. избирательное образование дисульфидных связей
-
1 st окисления (Рисунок 1B)
Примечание: В ходе расщепления пептидов из смолы, Cys(Trt) deprotected, ведущих к два незащищенных остатки Cys, которые впоследствии подвергаются окислению сформировать первый дисульфидными облигаций. Следующий протокол применяется к 15 мг очищенного линейного пептида (2864.5 г/моль; 5,2 мкмоль; 1 экв.).- Распустить линейной пептида (15 мг) в 105 мл изопропанол/H2O-смесь (1:2; 0,05 мм; рН 8,5 скорректирована с гидроокиси натрия (NaOH)) и оставить нежно тряска в воздухе в основных условиях для 12-48 ч.
- Контролировать реакции окисления через ВЭЖХ и г-жа подтверждение формирования первого моста iodoacetamide (IAA) деривации (шаг 6).
- Freeze-Dry пептида и использовать его без дальнейшей очистки для 2nd окисления.
-
2-й окисления (Рисунок 1C)
Примечание: Во втором окисление, deprotection которым Acm защитой и формирование второго моста катализируемые йода. Протокол применяется к 15 мг пептида после 1st окисления (2862.5 г/моль; 5,2 мкмоль; 1 экв.)- Растворите пептида (15 мг; конечной концентрации 0,05 мм) в 105 мл изопропанол/Ч2М O/1 смесь соляной кислоты (HCl) (80:12.5:7.5).
- 158 мкл раствора йода 0,1 М в метаноле (метанола) (15,7 мкмоль; 3 экв) в решение. Перемешать реакции при комнатной температуре 3-52 h, т.е., пока не завершится процесс окисления.
- Контролировать реакции окисления через ВЭЖХ и г-жа подтверждение формирования второй дисульфидными облигаций iodoacetamide (IAA) деривации (шаг 6).
- Остановить реакции, добавив 79 мкл раствора аскорбиновой кислоты 1 M в H2O (мкмоль 78.8; 15 экв.). Freeze-Dry реакционной смеси и использовать порошок для 3rd окисления.
-
3rd окисления (Рисунок 1D)
Примечание: Последний окисление приводит к deprotection Бу защищенные которым tи формирование третьего дисульфидных мостика. Протокол применяется к 15 мг пептида после окисления 2nd (2718.3 г/моль; 5,5 мкмоль; 1 экв.).- Растворяют в 5,5 мл TFA пептида (15 мг, конечная концентрация 1 мм). Он содержит мусорщик смесь, состоящую из 11,2 мг diphenylsulfoxide (55 мкмоль; 10 eq.), 60,2 мкл Анизол (0,6 ммоль; 100 экв) и 97,2 мкл trichloromethylsilane (0,8 ммоль; 150 эквалайзера). Перемешайте смесь для 3-5 ч при комнатной температуре.
- Контролировать реакции окисления через ВЭЖХ и г-жа подтверждение формирования третьего дисульфидными облигаций iodoacetamide (IAA) деривации (шаг 6).
- Осадок пептида в пробирки, содержащие холодной диэтиловым эфиром (0 ° C, 1 мл раствора реакции на 8-10 мл диэтиловый эфир).
- Центрифуга для суспензий (3400 x g, 1 мин), сцеживаться супернатанта и мыть гранулы неоднократно (4 раза) с 8-10 мл холодного диэтиловым эфиром (0 ° C). Пусть гранулы сушат на воздухе (3 мин).
- Растворяют гранулы в 1 мл 80% трет-бутанола (в H2O), freeze-dry пептида и хранить его при-20 ° C.
5. пептидные очистки
Примечание: Очистить окисленных пептиды, полу подготовке RP HPLC оснащены C18 столбец (частиц размером 10 мкм, 300 Å размер поры, 250 x 22 мм) и 3,6 мл инъекционного цикла. Используйте систему градиента элюции 0,1% TFA H2O (элюента A) и 0,1% TFA MeCN/H2O (9:1, элюента B). Обнаружение пиков на 220 Нм.
- Добавьте 15 мг лиофилизированных сырой продукт из шага 4.3.5 в 15 мл. Распустить сырой продукт в объеме образца цикла ВЭЖХ (например., 3,6 мл). Используйте смесь 0,1% TFA MeCN/H2O (1:1). Вихревой до полное растворение и центрифуги (3400 x g) решение за 1 мин.
- Составить 3,6 мл смеси в шприц 5 мл и вставляют образца без каких-либо воздушных пузырей впрыска цикла. Начало впрыска в систему ВЭЖХ. Очищения пептида смесь, с использованием градиента 0-50% элюента B свыше 120 мин со скоростью потока 10 мл/мин.
- Сбор фракций в отдельных труб, как они появляются. После завершения выполнения подготовки отдельных фракций для анализа MS и ВЭЖХ (шаг 6.1 и 6.2). Freeze-Dry всех фракций и хранить их при-20 ° C.
- После завершения выполнения подготовки отдельных фракций для анализа MS и ВЭЖХ (шаг 6.1 и 6.2). Freeze-Dry всех фракций и хранить их при-20 ° C.
6. пептидные аналитика
-
Аналитический ВЭЖХ
Примечание: Подтвердить чистоту пептид, аналитической RP ВЭЖХ, оборудованы со столбцом C18 (размер частиц 5 мкм, 300 Å размер поры, 250 x 4,6 мм) и петли инъекции 500 мкл. Используйте систему градиента элюции 0,1% TFA в H2O (элюента A) и 0,1% TFA в MeCN (элюента B). Обнаружение пиков на 220 Нм.- Передать образец пептидных фракций или реакции управления в ВЭЖХ флакон и растворить его в смесь 0,1% TFA в MeCN/H2O (1:1, 300-500 мкл). Поместите ВЭЖХ флакона в автоматический пробоотборник аналитической RP HPLC.
- Придать 250 мкл каждого образца. Используйте систему градиента элюции 0,1% TFA в H2O (элюента A) и 0,1% TFA в MeCN (элюента B). Очищения пептида, с использованием градиента 10-40% элюента B более 30 минут со скоростью потока 1.0 мл/мин.
-
Масс-спектрометрия MALDI TOF
Примечание: Подтвердите личность пептид, масс-спектрометрия MALDI TOF (время полета) с помощью α- циано-4-Гидроксикоричная кислота как матрица.- Передача видимых количество пептида в пробки microcentrifuge 1,5 мл и растворить его в 10 мкл раствора 37 мм α- циано-4-Гидроксикоричная кислоты в смеси 0,1% TFA H2O/MeCN (1:1).
- Вихревой решение для 10 s, применяются 2 мкл пример ректифицированной стали мишенью и просушите образца.
- Используйте режим отражатель для измерения и пептида эталоном для молярной массы ниже 6000 г/моль.
-
Iodoacetamide деривации
Примечание: Как iodoacetamide реагирует с тиоловых групп, iodoacetamide деривации пептидов указывает бесплатные тиоловых групп. Следовательно отсутствие свободного тиоловых групп служит реакции управления через МС при окислении 1st .- Растворите пептида в 10 мм фосфатного буфера (100 мкл; 0,05 мм; рН 7,8) в пробки microcentrifuge 1,5 мл. 100 мкл iodoacetamide в 10 мм фосфатного буфера (4 мм) в решение пептида и осторожно встряхивайте реакции втечение 2 ч при комнатной температуре в темноте. Freeze-Dry реакционной смеси и хранить его при-20 ° C.
- Использовать наконечник пипетки C18-концентрация фильтр и условие кончик с 10 мкл 80% (3 раза), 50% (3 раза), 30% (3 раза) и 0% (3 раза) MeCN в H2O (+ 0,1% TFA).
- Распустить образца с шагом 0.1% 6.3.1 в 1 мкл TFA H2O и добавить решение в наконечник пипетки фильтра. Пипетка тщательно вверх и вниз так, что пептид связывается с борта. Удаление H2O из кончика пипетки и промойте наконечник пипетки фильтр с 10 мкл 0,1% TFA H2O.
- 2 мкл 0,1% TFA в H2O/MeCN (1:1) с другой кончиком пипетки (без фильтра) на вершине шарик, который содержит пептида. Применить фильтрата в Целевой земли стали и просушите образца.
- Примените 1 мкл раствора 37 мм α-циано-4-Гидроксикоричная кислоты в смеси 0,1% TFA в H2O/MeCN (1:1)-шлифованная сталь целевой с образцом и просушите образца.
- Используйте режим отражатель для измерения и пептида эталоном для молярной массы ниже 6000 г/моль.
-
Амино кислоты анализ
Примечание: Анализ точный пептид концентрации, а также аминокислотный состав с помощью анализатора аминокислоты пептида.- Передать пробки microcentrifuge 1,5 мл 100 мкг чистого пептида (2604 г/моль; 0,04 мкмоль) и растворить порошок в 200 мкл 6 М HCl.
- Перевести 200 мкл раствора в стеклянных ампул и промыть пробки microcentrifuge 1,5 мл два раза с 200 мкл 6 М HCl. передачи промывной раствор в стеклянные ампулы также.
- Закройте ампулы, Отопление шейку ампулы с пламенем горелки Бунзена. Поместите ампулу в стеклянной трубки. Поместите его в блоке Отопление за 24 ч при 110 ° C для гидролиза.
- Откройте ампулы и передача решения в 2-мл пробирку microcentrifuge. Вымойте ампулы (3 x 200 мкл) и крышку (3 x 100 мкл) с двойной дистиллированной H2O и перевести его в пробки microcentrifuge.
- Центрифуга решение для 6 ч, при 60 ° C и 210 g x в ротационные вакуумные концентратор. Распустить гидролизованный продукт в 192 мкл буфера для разведения образцов (200 мкм) и перенесите решения в микро центробежного фильтра.
- Центрифуга образца за 1 мин на 2300 x g и передачи 100 мкл фильтрата в трубу аминокислот анализа образца. Положите трубку в Аминокислотный анализатор и начинайте анализ. Амино кислоты стандарт используется для калибровки.
7. МС/МС анализ дисульфида подключения
-
Частичное уменьшение и алкилирования17
- Распустить 600 мкг чистого пептида (2604 г/моль; 0.23 мкмоль) в 1,2 мл буфера цитрата 0,05 М (рН 3.0; концентрация пептида 0,14 мм) содержит 7,5 мг tris(2-carboxyethyl) фосфин (TCEP; 0,02 М; 0,03 ммоль).
- Инкубировать смесь при комнатной температуре и занять несколько реакции контрольные образцы (100 мкл) от 0 мин до 30 мин.
- Смешать с 300 мкл буфера алкилирования образцы в пробки microcentrifuge 1,5 мл (0,5 М трис ацетат; рН 8,0; 2 мм Этилендиаминтетрауксусная кислота (ЭДТА); iodoacetamide 1,1 М) остановить реакции и выполнять carbamidomethylation бесплатно тиоловых групп.
- Остановить реакции через 5 мин, добавив 100 мкл 10% TFA (H2O) и хранить образцы на сухой лед. Подготовить образцы ВЭЖХ, как описано в шаге 6.1.2 и залить 400 мкл. (рисA)
- Используйте систему градиента элюции 0,1% TFA в H2O (элюента A) и 0,1% TFA в MeCN (элюента B). Анализировать пептиды, используя комбинацию Изократические разделения (элюента B 10% за 15 мин) и затем последующие градиент 10-35% элюента B свыше 25 мин потока со скоростью 10 мл/мин обнаруживать пиков на 220 Нм.
- Сбор фракций в 1,5 мл microcentrifuge трубы и freeze-dry пептидов. (Рис. 2B)
- Небольшое количество каждой фракции передать трубку microcentrifuge 1,5 мл для анализа МС/МС окисленных форм (перейдите к шагу 7.1.12).
- Распустить оставшиеся пептида (10-100 мкг) в 0,1% TFA H2O (10-50 мкл) и добавить соответствующий объем 100 мм TCEP раствора (H2O) для получения конечной концентрации TCEP 10 мм.
- Инкубируйте реакции на 1 ч при 37 ° C (рис. 2C). Freeze-Dry реакционной смеси и хранить его при-20 ° C.
- Подготовка образцов МС/МС, как описано в шаге 6.3.2-6.3.5.
- Выполнения измерений МС/МС на MALDI TOF/TOF масс-спектрометр. МС/МС крышкой (лазерно индуцированным распада) для фрагментации пептида и выберите прекурсоров массы 2 - и 4-раз carbamidomethylated видов. Обрабатывать и оценивать MALDI данные для подтверждения подключения нужного дисульфида.
8. ЯМР экспериментов и анализ структуры
- Растворение приблизительно 0,3-2 мг чистый пептид продукта в 500 мкл2наружного H2O (цвету) и передача смеси в NMR Микропробирка.
- Подготовка образца для измерений на ЯМР-спектрометр
- Запись 2-мерных [1H,1H] - DQF - уютный (двойной квантовой фильтруют спектроскопии корреляции), [1H,1H] - TOCSY (всего коррелированных спектроскопия), [1H,1H] - NOESY (ядерных Оверхаузера повышение спектроскопия) и [1H,13C]-спектры HSQC (гетероядерных одного такта согласованности), с использованием воды подавление.
- Назначьте Протон резонансы записанные спектров и Создайте назначение атом из спектров NOESY. Сравнение интенсивностей в спектрах NOESY чтобы задать верхний предел расстояния ограничений между различными атомами в пептида. Используйте интенсивность зародышевых протонов для калибровки пика интенсивности.
- Выполните вычисление структуры и уточнение с помощью компьютерной программы для молекулярной визуализации и выявленных дисульфида связность шаг 7 как дополнительные удерживающие устройства (рис. 3).
- Выберите структур с низкой энергией и использовать его для моделирования молекулярной динамики (MD).
Результаты
15 различных мост дисульфидных изомеров PIIIA µ-conotoxin синтезированы и характеризуется в деталях (рис. 1). Дисульфидными облигаций определяются путем частичного сокращения и последующего анализа МС/МС (рис. 2). (Рис. 3) выявить отдельных пептид структур проводится ЯМР анализ различных изомеров. В частности сочетание RP ВЭЖХ, МС/МС фрагментации и ЯМР анализ необходим для однозначной идентификации соединения дисульфида.

Рисунок 1 : Формирование Бонд селективного дисульфида родной µ-PIIIA через защитные стратегии группы. (A) deprotection которым Trt защитой во время расщепления пептидов из смолы. (B) первый дисульфида мост формирования незащищенных которым. (C) Deprotection и формирование мост дисульфидных Acm защищены которым. (D) Deprotection и формирование мост дисульфидных tБу защищены которым. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
Рисунок 2 : Частичное сокращение рабочего процесса для назначения Бонд дисульфида МС/МС анализа. (A) частичное сокращение и алкилирования пептида. (B) ВЭЖХ очистка контрольных образцов различных реакции. (C) сокращение очищенный образцов. Частично carbamidomethylated видов (два пептидов в середине) гавань информация о соединения дисульфида, который определяется путем анализа МС/МС. Эта цифра была адаптирована с разрешения Хеймер, P. et al. Конформационные µ-Conotoxin PIIIA изомеры Revisited: влияние хвоща сопряжения на назначение дисульфида Бонд и разяснения структуры. Аналитической химии. 90 (5), 3321-3327 (2018). Авторское право (2018) американского химического общества. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
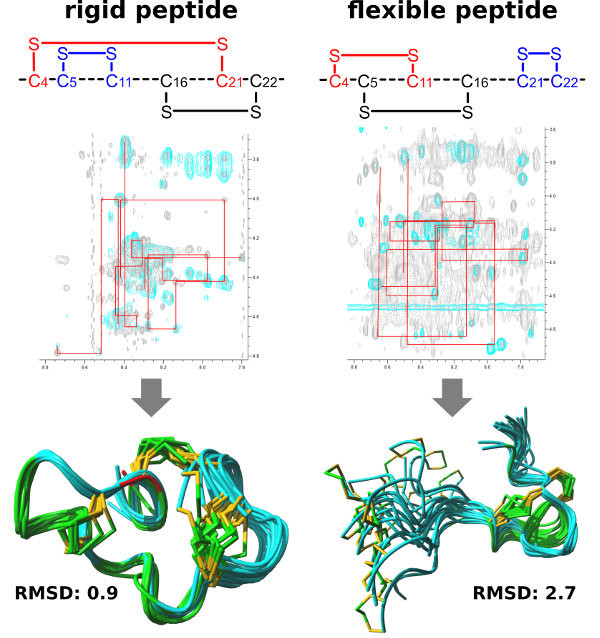
Рисунок 3 : Последовательный ходьбы и Результирующая структура решения ЯМР жесткой (слева) и гибкий (справа) µ-PIIIa изомер. Показано 20 структур с низкой энергии, а также дисульфид подключения различных изомеров. Сравнение значений Среднее квадратическое отклонение (RMSD) разъясняет, что жесткая пептид главным образом приводит к лучше урегулировать NMR структуры. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
Обсуждение
Метод, описанный здесь для синтеза пептидов хвоща богатые, такие как µ-PIIIA представляет возможность производить избирательно дисульфида стружечные изомеров от такую же последовательность аминокислот. Таким образом созданы такие методы, как на основе Fmoc твердых этапа пептидного синтеза18 и определенной стратегии защиты группы региоселективный образования дисульфидных связей были используется16. Пептид Твердофазный синтез может производить аминокислотных последовательностей на опора полимерная (смола) через автоматизированный синтез. Эти аминокислоты защищены от нежелательных побочных реакций во время последовательности Ассамблеи специальные защитные группами на их боковых цепей, которые - в зависимости от протокола используется - deprotected после расщепления пептидов из смолы. Эта защита также относится к хвоща боковые цепи в пределах цепи пептида, например., trityl защиту. Однако, защита отдельных групп для отдельных пар которым такие acetamidomethyl и трет-бутила не расщепляется сопутствующе обстоятельств через этот этап ликвидации. Эти группы защиты можно расщепляется с в условиях, которые позволяют последующих окисления путем формирования дисульфидными облигаций от deprotected тиоловых групп. Таким образом все 15 дисульфида изомеры пептида, содержащий шесть остатков цистеина могут быть выборочно сформированных7,16. Ограничивающим фактором, однако, является то, что с увеличением числа различных групп ортогональных защищая синтетических усилий увеличивается, который имеет большое влияние на урожайность пептид желаемого дисульфида преодолен. Таким образом в отдельных случаях и в частности для менее комплекс пептидов, обладающих только одной или двумя дисульфидными облигаций окислительного самостоятельно складные подход действительно может быть предпочтительным по защите стратегии группы.
Здесь Trt группы одного хвоща пары удаляются под действием TFA после завершения Ассамблеи пептида и окончательный Fmoc-deprotection аминокислот N-терминала. Кислых условиях, однако, оставить Acm и tзащита групп бу на другие две пары остатков цистеина нетронутыми. Впоследствии очистки линейной пептида, содержащий два незащищенных которым осуществляется с помощью препаративные ВЭЖХ слегка кислой условиях для поддержания тиоловых групп в форме протонированных. Протокол продолжается с первого шага окисления после анализа ВЭЖХ и MS успешный синтез и deprotection Trt на пару хвоща интерес. Дальнейшие шаги deprotection и окисления второго и третьего дисульфидными облигаций осуществляются и подтверждено в том же, используя соответствующий протокол для Acm и tБу, соответственно. Таким образом, эти реакции окисления являются простой мокрой химические реакции, выполненных в растворе, не требующих дорогостоящих реагентов. Недостаток, однако, это что определенные реакции, т.е., соединения отдельных хвоща остатков, не гладко и полностью приводит к побочным результатом кинулись соединения дисульфида. Поскольку они не удаляются после завершения реакций отдельных окисления, такие побочные продукты могут накапливаться в смеси сырой продукт. Некоторые из них могут обладать аналогичные физико-химических свойств как фактической пептида, например., элюирование ВЭЖХ, который увеличивает усилия для очистки правильно сложенные пептида. Хотя синтез и очистки может быть сложным, как в случае µ-PIIIA, этот метод может успешно использоваться, но требует хороших навыков руководства и наблюдения. Наконец его необходимо рассматривать что каждый пептид последовательность отличается и поэтому может рассматриваться по-разному для того чтобы быть успешным в создании подключения правильные дисульфида.
В дополнение к сложным синтеза, важно проверить, являются ли дисульфидными облигаций производится правильно, т.е., представляют собой предполагаемой версии соответствующих дисульфида изомер. Это выполняется, здесь с помощью комбинации MALDI MS/MS анализа и ЯМР разяснения структуры. МС/МС анализ проводится с использованием различных частично сокращенной и алкилированные производные (carbamidomethylation) полностью окисляется пептид17. В крышкой МС/МС MALDI TOF/TOF спектры, четное количество carbamidomethylated которым всегда найдены, т.е., 2-, 4 - или 6-раз carbamidomethylated. Это можно объяснить поэтапного сокращения полностью окисляется пептиды, поскольку в каждом случае две функции тиоловых за дисульфидными облигаций всегда сокращаются (открыт) и в situ алкилированные с помощью iodoacetamide. Этот carbamidomethylation двух которым каждый может быть обнаружен в спектрах MALDI MS/MS и, в свою очередь, ссылается на соответствующих дисульфидными облигаций, эти которым занимались в неповрежденной пептид. Например, возникновение четырех carbamidomethylated которым в последовательности с тремя дисульфидными облигаций помогает определить конкретные Бонд, а именно образуются между двумя-алкилированные которым, которые не были открыты во время реакции Частичное уменьшение достаточно открыть два других облигаций. Таким образом MALDI MS/MS анализом различных производных 2 - и 4-раз carbamidomethylated пептид дисульфида изомера, связность дисульфида может быть полностью проясненного и подтверждено.
Еще одна возможность для выяснения дисульфидными облигаций шаблон является МС/МС анализ ферментационно переваривается пептиды, где пептида proteolytically расщепляется на различные аминокислоты для производства небольших фрагментов. Эти короткие фрагменты все еще могут быть связаны через дисульфидных связей, которая является причиной, что дисульфида шаблон можно раскрыты от МС/МС анализа этих связанных фрагментов. В случае µ-PIIIA однако, эта стратегия может не применяться потому, что некоторые которым последовательности непосредственно примыкают друг к другу и поэтому пищеварение пептидов не отделить которым друг от друга. Поэтому трудно идентификация конкретных дисульфидных мостика.
Разяснения структуры 2D ЯМР анализ четко облегчается в случае подключения известных дисульфида, потому что это знание позволяет назначение ядерных эффект Оверхаузера (NOE) для конкретных протонов, т.е., ссылаясь на пространственных Расстояние между двумя атомами, определяется от интенсивности сигналов NOESY (через пространство NMR эксперимент). Анализ, однако, начинается с последовательным ходьбы19 применяется к УЮТНОЙ, TOCSY и NOESY спектры, таким образом, можно назначить конкретный сигнал соответствующий H-атом аминокислот (спин системы) в последовательности. В расчет структуры пептида7используются ограничения вышеупомянутых расстояние от NOESY эксперимент. Больше сигналов выявлены, тем более точным будет структура. Однако сложность этой задачи возрастает с количество аминокислот в пептида и возникновения смежных которым, как увеличивается вероятность того, что сигналы нескольких атомов перекрываются и могут больше не быть назначены именно из-за закрытия близость. Кроме того гибкость цепи пептида имеет решающее значение для того, являются ли легко или трудно идентифицировать сигналы в NMR. Более гибкие пептид региона более конформационные изменения происходят, позволяет несколько сигналов, которые могут быть получены для одного и того же атома. Таким образом интенсивность уменьшается количество конформации, что вызывает сигналы, чтобы исчезнуть в фоновый шум. Это означает, что трехмерная структура разяснения через ЯМР становится намного проще, если последовательность конформационно ограничен.
Наконец этот протокол делает его возможным для создания нескольких мост дисульфидных пептиды, мониторинг дисульфидными облигаций формирования MALDI MS/MS анализ и сопутствующих 2D NMR структуры разяснения7.
Раскрытие информации
Авторы не имеют ничего сообщать.
Благодарности
Мы хотели бы поблагодарить A. Resemann, Майер J. F. и д Suckau от компании Bruker Daltonics GmbH Бремен; D. Титце, а. а. Титце, V. варьете и C. Thiele из технологического университета Дармштадта; O. Ohlenschläger из FLI Jena, м. Engeser из университета Бонна; K. Крамер, A. Harzen и H. Накагами из Института Макса Планка для исследования селекции растений, Кёльн; Susanne Neupert из Института зоологии, Кёльн; биомолекулярных магнитно-резонансная спектроскопия объектов Франкфуртского университета для технической поддержки, учебные модули, и доступ к документам. Финансовой поддержке Боннского университета к д.и. с благодарностью.
Материалы
| Name | Company | Catalog Number | Comments |
| PS PEG2000 Fmoc Rink-amide Resin | Varian, Inc. | PL3867-3764 | AmphiSpheres 40 RAM |
| Pyr(Boc) | Bachem | A-3850 | |
| Arg(Pbf) | Iris Biotech | FSC1010 | |
| Asn(Trt) | Bachem | B-1785 | |
| Asp(tBu) | Iris Biotech | FSP1020 | |
| Hyp(tBu) | Iris Biotech | FAA1627 | |
| Lys(Boc) | Bachem | B-1080 | |
| Ser(tBu) | Iris Biotech | FSC1190 | |
| Gln(Trt) | Iris Biotech | FSC1043 | |
| Glu(tBu) | Iris Biotech | FSP1045 | |
| Trp(Boc) | Iris Biotech | FSC1225 | |
| Tyr(tBu) | Sigma Aldrich | 47623 | |
| Thr(tBu) | Iris Biotech | FSP1210 | |
| His(Trt) | Iris Biotech | FDP1200 | |
| 2-(1H-Benzotriazol-1-yl)-1,1,3,3-tetramethyluroniumhexafluorphosphat | Sigma Aldrich | 8510060 | Flammable |
| DMF | Fisher Scientific | D119 | Flammable, Toxic |
| DCM | Fisher Scientific | D37 | Carcinogenic |
| Piperidine | Alfa Aesar | A12442 | Flammable, Toxic, Corrosive |
| N-Methyl-Morpholin | Sigma Aldrich | 224286 | |
| Cys(Acm) | Iris Biotech | FAA1506 | |
| Cys(Trt) | Bachem | E-2495 | |
| Cys(tBu) | Bachem | B-1220 | |
| trifluoruacetic acid | Sigma Aldrich | 74564 | Toxic, Corrosive |
| phenol | Merck | 1002060 | Toxic |
| thioanisol | Alfa Aesar | A14846 | |
| ethanedithiol | Fluka Analytical | 2390 | |
| diethyl ether | VWR | 100,921 | Flammable |
| tert-butanol | Alfa Aesar | L12338 | Flammable |
| acetonitrile | Fisher Scientific | A998 | Flammable |
| water | Fisher Scientific | W5 | |
| isopropanol | VWR | ACRO42383 | Flammable |
| sodium hydroxide | AppliChem | A6579,1000 | Corrosive |
| iodoacetamide | Sigma Aldrich | I6125 | |
| iodine | Sigma Aldrich | I0385 | |
| Hydrochloric acid | Merck | 110165 | Corrosive |
| ascorbic acid | Sigma Aldrich | A4403 | |
| diphenylsulfoxide | Sigma Aldrich | P35405 | |
| anisol | Sigma Aldrich | 96109 | Flammable |
| trichloromethylsilane | Sigma Aldrich | M85301 | Flammable |
| sample dilution buffer | Laborservice Onken | ||
| sodium dihydrogen phosphate | Sigma Aldrich | 106370 | |
| disodium hydrogen phosphate | Sigma Aldrich | 795410 | |
| (2-carboxyethyl)phosphine hydrochloride | Sigma Aldrich | C4706 | |
| citric acid | Sigma Aldrich | 251275 | |
| sodium citrate dihydrate | Sigma Aldrich | W302600 | |
| tris-acetate | Carl Roth, | 7125 | |
| Ethylenediaminetetraacetic acid | Sigma Aldrich | E26282 | |
| peptide calibration standard II | Bruker Daltonics GmbH | 8222570 | |
| Name of Equipment | Company | ||
| solid-phase peptide synthesizer | Intavis Bioanalytical Instruments AG | EPS 221 | |
| lyophilizer | Martin Christ GmbH | Alpha 1-2 Ldplus | |
| semipreparative HPLC | Jasco | system PV-987 | |
| Eurospher 100 C18 column (RP, 5 µm particle size, 100 Å pore size, 250 x 32 mm) | Knauer | 25QE181E2J | purification of the linear peptide |
| Vydac 218TP1022 column (RP C18, 10 µm particle size, 300 Å pore size, 250 x 22 mm) | Hichrom-VWR | HICH218TP1022 | purification of the oxidized peptide |
| analytical HPLC | Shimadzu | system LC-20AD | |
| Vydac 218TP54 column (C18 RP, 5 µm particle size, 300 Å pore size, 250 x 4.6 mm) | Hichrom-VWR | HICH218TP54 | analytical column |
| ground steel target (MTP 384) | Bruker Daltonics GmbH | NC0910436 | MALDI preparation |
| C18-concentration filter (ZipTip) | Merck KGaA | ZTC18S096 | MALDI preparation |
| MALDI mass spectrometer | Bruker Daltonics GmbH | ultraflex III TOF/TOF | |
| amino acid analyzer | Eppendorf-Biotronik GmbH | LC 3000 system | |
| NMR spectrometer Bruker Avance III | Bruker Daltonics GmbH | Bruker Avance III 600 MHz | |
| computer program for molecular visualising | YASARA Biosciences GmbH | Yasara structures | NMR structure calculation |
| computer program for MALDI data evaluation | Bruker Daltonics GmbH | flexAnalysis, BioTools | MS/MS fragmentation |
| analog vortex mixer | VWR | VM 3000 | |
| Microcentrifuge | Eppendorf | 5410 | |
| Centrifuge | Hettich | EBA 20 | |
| Rotational vacuum concentrator | Christ | 2-18 Cdplus | |
| Analytical Balance | A&D Instruments | GR-202-EC |
Ссылки
- Fosgerau, K., Hoffmann, T. Peptide therapeutics: Current status and future directions. Drug Discovery Today. 20 (1), 122-128 (2015).
- Gongora-Benítez, M., Tulla-Puche, J., Albericio, F. Multifaceted roles of disulfide bonds. peptides as therapeutics. Chemical Reviews. 114 (2), 901-926 (2014).
- Tietze, A. A., et al. Structurally diverse µ-conotoxin PIIIA isomers block sodium channel NaV1.4. Angewandte Chemie - International Edition. 51 (17), 4058-4061 (2012).
- Carstens, B. B., et al. Structure-Activity Studies of Cysteine-Rich α-Conotoxins that Inhibit High-Voltage-Activated Calcium Channels via GABABReceptor Activation Reveal a Minimal Functional Motif. Angewandte Chemie - International Edition. 55 (15), 4692-4696 (2016).
- Zhang, Y., Schulten, K., Gruebele, M., Bansal, P. S., Wilson, D., Daly, N. L. Disulfide bridges: Bringing together frustrated structure in a bioactive peptide. Biophysical Journal. 110 (8), 1744-1752 (2016).
- Nielsen, K. J., et al. Solution structure of µ-conotoxin PIIIA, a preferential inhibitor of persistent tetrodotoxin-sensitive sodium channels. Journal of Biological Chemistry. 277 (30), 27247-27255 (2002).
- Heimer, P., et al. Conformational µ-Conotoxin PIIIA Isomers Revisited: Impact of Cysteine Pairing on Disulfide-Bond Assignment and Structure Elucidation. Analytical Chemistry. 90 (5), 3321-3327 (2018).
- Chang, J. Y. Diverse pathways of oxidative folding of disulfide proteins: Underlying causes and folding models. Biochemistry. 50 (17), 3414-3431 (2011).
- Böhm, M., et al. Novel insights into structure and function of factor XIIIa-inhibitor tridegin. Journal of Medicinal Chemistry. 57 (24), 10355-10365 (2014).
- Postma, T. M., Albericio, F. Disulfide Formation Strategies in Peptide Synthesis. European Journal of Organic Chemistry. 2014 (17), 3519-3530 (2014).
- Albericio, F., Isidro-llobet, A., Mercedes, A. Amino Acid-Protecting Groups. Chemical Reviews. 109 (6), 2455-2504 (2009).
- Annis, I., Hargittai, B., Barany, G. Disulfide bond formation in peptides. Methods in Enzymology. 289 (1988), 198-221 (1997).
- Kamber, B., et al. The Synthesis of Cystine Peptides by Iodine Oxidation of S-Trityl-cysteine and S-Acetamidomethyl-cysteine Peptides. Helvetica Chimica Acta. 63 (4), 899-915 (1980).
- Bosch, D. E., Zielinski, T., Lowery, R. G., Siderovski, D. P. Evaluating Modulators of Regulator of G-Protein Signaling (RGS) Proteins. Current Protocols in Pharmacology. 56 (2.8), 1-15 (2012).
- Mochizuki, M., Tsuda, S., Tanimura, K., Nishiuchi, Y. Regioselective formation of multiple disulfide bonds with the aid of postsynthetic S-tritylation. Organic Letters. 17 (9), 2202-2205 (2015).
- Peigneur, S., et al. δ-conotoxins synthesized using an acid-cleavable solubility tag approach reveal key structural determinants for NaV subtype selectivity. Journal of Biological Chemistry. 289 (51), 35341-35350 (2014).
- Heimer, P., et al. Application of Room-Temperature Aprotic and Protic Ionic Liquids for Oxidative Folding of Cysteine-Rich Peptides. ChemBioChem. 15 (18), 2754-2765 (2014).
- Kates, S. A., Albericio, F. . Solid-Phase Synthesis: A Practical Guide. , (2000).
- Wüthrich, K. NMR studies of structure and function of biological macromolecules (Nobel lecture). Angewandte Chemie - International Edition. 42 (29), 3340-3363 (2003).
Erratum
Formal Correction: Erratum: Synthesis and Structure Determination of µ-Conotoxin PIIIA Isomers with Different Disulfide Connectivities
Posted by JoVE Editors on 11/01/2018. Citeable Link.
An erratum was issued for: Synthesis and Structure Determination of µ-Conotoxin PIIIA Isomers with Different Disulfide Connectivities. The Protocol and Materials sections were updated.
Step 1.1.3 in the Protocol section was updated from:
Weigh the individual reagents (amino acids, HBTU (2-(1H-benzotriazol-1-yl)-1,1,3,3-tetramethyluronium hexafluorophosphate)) according to the protocol and dissolve them in dimethylformamide (DMF) to a final concentration of 2.4 M (amino acids) and 0.6 M (HBTU), respectively.
to:
Weigh the individual reagents (amino acids, HBTU (2-(1H-benzotriazol-1-yl)-1,1,3,3-tetramethyluronium hexafluorophosphate)) according to the protocol and dissolve them in dimethylformamide (DMF) to a final concentration of 0.6 M (amino acids) and 0.6 M (HBTU), respectively.
Step 1.2 in the Protocol section was updated from:
NOTE: The protocol applies to 100 mg of resin (loading: 0.28 mmol/g) added to one reaction column for 28 μmol scale.
to:
NOTE: The standardized protocol usually applies to 100 mg of resin (loading: 0.53 mmol/g) added to one reaction column for 53 μmol scale leading to the following equivalents: 5 eq. HBTU, 10 eq. NMM, 5 eq. amino acid. In case of PIIIA, however, a loading of 0.28 mmol/g (28 µmol scale) is used, which results in the specified higher equivalents.
Step 1.2.3.1 in the Protocol section was updated from:
HBTU (450 µL; 0.6 M in DMF; 270 µmol; 9.6 eq.), NMM (125 µL; 50% in DMF; 568 µmol; 20 eq.), Fmoc-amino acid (420 µL; 2.4 M in DMF; 1.01 mmol; 36 eq.).
to:
HBTU (415 µL; 0.6 M in DMF; 249 µmol; 9 eq.), NMM (112 µL; 50% in DMF; 510 µmol; 18 eq.), Fmoc-amino acid (420 µL; 0.6 M in DMF; 252 µmol; 9 eq.).
The first item in the Materials table was updated from:
| Fmoc Rink amide resin | Novabiochem | 855001 |
to:
| PS PEG2000 Fmoc Rink-amide Resin | Varian, Inc. | PL3867-3764 | AmphiSpheres 40 RAM |
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены