Method Article
Моделирование синаптических микросхемы с 3D Cocultures астроциты и нейроны от человеческих плюрипотентных стволовых клеток
В этой статье
Резюме
В этом протоколе мы стремимся, чтобы описать воспроизводимый метод для объединения отделить человеческих плюрипотентных стволовых клеток получены нейронов и астроциты вместе в 3D шар cocultures, поддержание этих сфер в Свободный плавающий условиях и впоследствии измерение активности синаптических цепи сфер с иммуноанализа и многоэлектродный массив записей.
Аннотация
Барьер для нашего понимания того, как различные типы клеток и сигналы способствует синаптических цепи функции является отсутствие соответствующих моделей для изучения человеческого мозга. Одной из новых технологий для решения этой проблемы является использование три трехмерные (3D) Нейронные клеточных культур, называется «organoids» или «сфероидов», для долгосрочного сохранения включая молекулы внеклеточного адгезии межклеточных взаимодействий. Однако эти системы культуры, много времени и не систематически сгенерированный. Здесь мы подробно метод быстро и последовательно производить 3D cocultures нейронов и астроциты от человеческих плюрипотентных стволовых клеток. Во-первых, предварительно дифференцированной астроциты нейрональных прародителями отделить и рассчитывал. Далее, ячейки объединяются в сфере формирования блюда с Ро-киназы ингибитора и на конкретные показатели производить сферах воспроизводимость размеров. После нескольких недель культуры как плавающий сферы cocultures («астероиды») наконец секционного для иммуноокрашивания или покрытием на многоэлектродный массивы для измерения синаптических плотность и прочность. В целом ожидается, что этот протокол будет выход 3D нейронных сфер, которые отображают зрелых клеток тип ограничен маркеры, формируют функциональные синапсов и проявлять спонтанные синаптических сетевой всплеск активности. Вместе Эта система позволяет наркотиков скрининг и расследования механизмов болезни в более подходящие модели по сравнению с монослоя культур.
Введение
Астроциты являются очень обильные глиальных клеток типа в пределах центральной нервной системы (ЦНС) с целым рядом функциональных обязанностей за пределами структурной поддержки. Через секрецию растворимых synaptogenic факторов и компонентов внеклеточного матрикса (ECM) астроциты помощи в создании и кластеризации зрелых синапсов во время развития1. Они также играют важную роль в поддержании здоровья и пластичности синапсов через внеклеточных сигналов2,3,4,5и способствуют долгосрочной стабильности гомеостаза среды, регулируя внеклеточного калия и глутамата, а также секрецию энергетических субстратов и СПС6,,78. Наконец они могут способствовать синапсах, воздействуя на внесинаптического течения9и может косвенно влиять на активность через другие типы клеток, таких как содействие миелинизации10. Что важно потому что аномалий или дисфункции астроциты может привести к много нервной синдромы и взрослых невропатология, существует очевидная необходимость включить астроциты наряду с нейронов в инженерии нейронных сетей в целях улучшения модели эндогенного мозга окружающей среды. Астроциты является неотъемлемой характеристикой является их способность динамического взаимодействия формы с нейрональных синапсах1,,1112. В отсутствие глии нейроны образуют ограниченное количество синапсов, которые в целом также не хватает функциональной зрелости13.
Человека астроциты морфологических, транскрипционный анализ и функциональные характеристики отображения — например увеличение размера и сложности ветвления, а также вегетационных генов — что не изъятый в грызунов12,14, 15. В результате исследования использования человеческих плюрипотентных стволовых клеток (hPSC)-производных нервные клетки получили широкое признание как средство изучения заболеваний ЦНС в пробирке при разработке Роман терапии, травмы модели и культура парадигмы16 ,17. Кроме того hPSCs разрешения на изучение человека синапса формирования и функции без необходимости в основной ткани18,19.
Барьер для нашего понимания того, как различные типы клеток и сигналы способствует синаптических цепи функции является отсутствие соответствующих моделей человеческого мозга. Существует необходимость для соответствующей платформы для резюмировать его синаптических сетей с высокой точностью и воспроизводимостью. Недавно, интерес возник в производстве систем 3D культуры (широко известный как «organoids», «сфероидов», или «мини-мозги»)20 для моделирования сложных трехмерных (3D) структур на сотовые и макро уровнях. 3D культуры систем сохраняют ECM и ячеек взаимодействия, которые обычно отсутствуют или ограниченные во время типичного 2D coculture парадигмы21,22. Обилие методы существуют для культивирования 3D нейронных сфероидов23,24,25; Однако, многие требуют длительных культуры периодов (месяцев до лет) для спонтанного развития и сохранения слоя, с пользователем выставке очень мало контроля над выходных данных.
Здесь мы иллюстрируем систематический способ быстро и последовательно биоинженер Нейронные взаимодействия среди нескольких типов клеток (предварительно дифференцированной нейронов и астроциты) полученных от hPSCs путем сборки клеток в сфере cocultures («астероиды»)26 , пилки морфологических сложности конкретного человека в 3D. Этой высокой плотности нервная система генерирует равномерно рассеяны нейронных подтипы, которые взять на зрелых свойств с течением времени и может быть показан или assayed в духе высокой пропускной способности. Мы показываем, в первый раз, что человека астроциты побудить синаптических сетевой всплеск активности в этих 3D cocultures. Кроме того этот протокол является легко адаптируется для создания сферы разных размеров, использовать клетки, указанный для различных региональных тождества ЦНС и для изучения взаимодействия нескольких других типов клеток по желанию.
протокол
1. клетки культуры и подготовка реагента
Примечание: Протоколы в этом разделе написаны в том порядке, в котором они появляются в протоколе дифференциации (раздел 2). Смотрите Таблицу материалов для материалов и Каталог номеров.
-
Подготовьте пластины с покрытием для клеточной культуры.
- Разбавьте раствор для нанесения покрытия внеклеточного матрикса (ECM) с СМИ в среде DMEM/F12 подготовить 1 мг/мл, раствор. Аликвота разреженных ECM складе решение в 30 конические трубы 3 мл и сразу же хранить в-20 ° C. Для рабочего раствора Ресуспензируйте 3 мл бульона ECM в 33 мл предварительно охлажденные DMEM/F12 СМИ, в результате чего общий объем 36 мл для концентрации 80 мкг/мл.
- Слой 1 мл на хорошо 6-ну клетки культуры плиты с ECM рабочего раствора. Добавьте дополнительные 1 мл DMEM/F12 на колодец (при необходимости) для обеспечения полного охвата поверхности хорошо. Разрешить покрытием ячейки 6-ну культуры пластин сидеть при комнатной температуре по крайней мере 1 час перед использованием.
Примечание: Пластины с покрытием может храниться в инкубаторе или при температуре 4 ° C на срок до 2 недель.
-
Подготовьте СМИ рецептуры, факторы роста и малых молекул.
- Подготовить 500 мл человеческих плюрипотентных стволовых клеток (hPSC) средний27, добавьте 20 x и 500 x добавки в соответствии с инструкциями производителей.
- Чтобы подготовить 500 мл нейронных среды (Нм), добавьте гепарина конечная концентрация 2 мг/мл, 1 x антибиотик/противогрибковое раствора, дополнение 1 x B27 или 1 x N2 дополнение к 500 мл бутылка DMEM/F12 с L-глютамин добавки как ранее подробные28.
- Подготовить 10 мм (1, 000 x) сток решение Ро-киназы ингибитора Y27632 (Y), добавить 10 мг порошка в 3 мл-фосфатный буфер (PBS). Фильтр стерилизовать, Алиготе и хранить при температуре от-20 ° C. Использовать на 10 мкм рабочие концентрации в средствах массовой информации.
- Подготовить 20 мм (10, 000 x) сток раствор SB431542, добавить 10 мг порошка в 1,3 мл диметилсульфоксида (ДМСО). Подготовить 2 мм (1, 000 x) сток раствор DMH1, добавить 10 мг порошка в 13,1 мл ДМСО. Фильтр стерилизовать, Алиготе и хранить для каждого решения, при-20 ° C. Используйте каждый на 2 мкм рабочие концентрации в средствах массовой информации (Нм + SB431542 + DMH1).
Примечание: Этот протокол рекомендует 2 мкм рабочей концентрации обоих SB431542 и DMH1 основаны на наши замечания и сообщения от других29 , заявив, что эта концентрация эффективно способствует нейронной индукции от hPSCs. Более высокие концентрации были также сообщил30. Кроме того с альтернативных средств массовой информации, она также было показано что малые молекулы не являются необходимыми для высокой нейронной преобразования31. Таким образом рабочие концентрации будет варьироваться в зависимости от альтернативных клетки культуры средах, и оптимальной концентрации должна быть проверена отдельных исследователей. - Для подготовки отдельных 100 мкг/мл (10, 000 x) акций решения эпидермального фактора роста (EGF) и фактор роста фибробластов-2 (FGF2), добавить 1 мг в 10 мл PBS + 0.1% BSA. Аликвота EGF и FGF2 складе решения в 50 мкл аликвоты и хранить при температуре-80 ° C. Использование 10 нг/мл концентрация рабочих в средствах массовой информации; например, добавить 5 мкл EGF и 5 мкл FGF2 до 50 мл Нм (Нм + EGF + FGF2).
- Подготовить раствор Доксициклина гидрохлорид (Dox), сначала растворить порошок в ДМСО до 100 мг/мл и хранить при температуре от-20 ° C. Далее, разбавить его сделать 2 мг/мл (1, 000 x) сток решение в PBS и хранить при температуре от-20 ° C. Использовать на 2 мкг/мл концентрация рабочих в средствах массовой информации; например, добавьте 50 мкл Dox до 50 мл Нм (Нм + Dox).
Примечание: Повторно не замерзают решения после оттаивания.
2. поколение нейронных подтипы из индуцированных плюрипотентных клеток человека (hPSCs)
Примечание: Все клеточных культур следует сохранить в инкубаторе с 5% CO2 при 37 ° C. Эти культуры поддерживаются на номер кислорода уровнях, хотя более низкого уровня могут быть использованы.
-
Создание и поддержание экзоцитоз прародителями (hAstros) из hPSCs.
Примечание: Этот раздел предоставляет краткий и упрощенный дифференциации протокол. Для получения подробного описания (с формирования embryoid тела, розетка отбора и региональных патронирования шаги) относятся к ранее описанных протокол28 (рис. 1A, пунктир зеленом поле).- Семя кластеры hPSCs (Рисунок 1B) на ECM-покрытием 6-ну плиты (см. шаг 1.1) с 2 мл на хорошо hPSC средний + Y. Кормите стволовые клетки каждый день до тех пор, пока они являются около 50% вырожденная и разделить при необходимости.
- Чтобы разделить hPSCs, добавьте 1 mL реагента, пассированый скважин и аспирационная после того, как клетки инкубировать 1 мин при комнатной температуре в течение 5 минут, добавляют 1 мл hPSC среды и разделить агрегаты 1:10 на новые ECM-покрытием скважин в 2 мл на хорошо hPSC средний + Y.
- Сохранить стволовые клетки, до тех пор, пока они являются около 50% притока, то средства массовой информации изменения в Нм + SB431542 + DMH1, с тем чтобы побудить нейронных дифференциации (день 0). Когда клетки являются около 95% притока, разделить 1:6 на новые ECM-покрытием скважины в той же среде.
- На 14 день разбить ячейки с отряд решение и передача-покрытием колба с Y поощрять формирование агрегатов.
Примечание: Дополнение Y используется для содействия ячейку выживания и сферы образования, но не включается во время каждого канала. - Для генерации нейрональных прародителями и нейронов (hNeurons) Используйте эти клетки день-14, как описано ниже. Кроме того используют эти клетки в позднее время точках монослоя или сфере культур перед нейрональных созревания происходит или глиогенез начинается.
Примечание: По умолчанию этот протокол производит спинной корковых астроциты. Однако экзоцитоз подтипы регионарно задается путем добавления кучность morphogens при желании28,32,33. Ретиноевой кислоты (RA) могут быть добавлены к caudalize клетки в спинной фенотипы, в то время как Еж Соник (ТСС), сглаживается агонистов (SAG), или purmorphamine будет производить вентральной фенотипов. - Для поколения экзоцитоз прародителями и астроциты в спонтанно формируется 3D агрегатов (hAstrospheres) перейдите в Нм + EGF + FGF2 и кормить еженедельно (или по мере необходимости для обеспечения стабильного рН) как ранее подробные34.
- Аккуратно отделить hAstro агрегатов с отрядом решения когда темно центров появляются и удалить сфер, которые спонтанно прикрепить. Перерыв сферах аккуратно один раз в неделю для поддержания сфера здоровья и избежание некротические ядер.
Примечание: Не превышает 5 минут лечения с решением отряда. - После 4-6 месяцев экспансии, подтвердить личность клеток и либо заморозить в криоконсервирования средний (согласно инструкциям производителя) или альтернативных хранения условий для долгосрочного сохранения в жидком азоте или использовать немедленно для эксперименты.
- Аккуратно отделить hAstro агрегатов с отрядом решения когда темно центров появляются и удалить сфер, которые спонтанно прикрепить. Перерыв сферах аккуратно один раз в неделю для поддержания сфера здоровья и избежание некротические ядер.
- Чтобы разморозить замороженные запас hAstrospheres, быстро разморозить флакон при комнатной температуре, передачи содержимого в пустой 15 мл конические пробки и центрифуги на 300 x g за 1 мин тщательно аспирационная супернатанта, мыть с DMEM/F12 и повторите для в общей сложности два мыть шаги. Добавить в настой T25 с общим объемом 6 мл Нм, EGF + FGF2 + Y (или масштабировать при необходимости).
- Семя кластеры hPSCs (Рисунок 1B) на ECM-покрытием 6-ну плиты (см. шаг 1.1) с 2 мл на хорошо hPSC средний + Y. Кормите стволовые клетки каждый день до тех пор, пока они являются около 50% вырожденная и разделить при необходимости.
-
Создание и поддержание индуцибельной нейронов (iNeurons) из hPSCs.
- Семя трансгенных hPSCs (с трансген стабильной доксициклин индуцибельной neurogenin 235) на ECM-покрытием 6-ну пластины с 2 мл hPSC средний + Y на хорошо (как описано выше, для не трансгенных линий). Подача каждый день с 2 мл СМИ на хорошо, пока они не готовы поднять на 70% confluency. Разбиение ячеек, как описано в пункте 2.1.2.
- Когда клетки являются около 35% вырожденная, добавить Нм + Dox побудить дифференцировку в iNeurons. Сохранить как монослойном культивировании с Нм + Dox за 2 дня перед переходом к шагу 3.2.
Примечание: Клетки будет переход в нейрональных прародителями но не будет еще продлить невритов (рис. 1 c).
3. Подготовка и поддержание 3D сфере Cocultures
- Отделить hAstros от 3D агрегатов в суспензии (как описано в шаге 2.1.5.1).
-
Отделить hNeurons или iNeurons от 2D монослоя.
- Извлеките из 6-ну пластины и добавьте 500 мкл раствора отряд в каждый хорошо содержащие монослоя культур. Инкубируйте при 37 ° C за 5 минут аккуратно добавить 2-3 мл DMEM/F12 для удаления вложенных клеток.
- Собирать клетки и СМИ в 15 мл Конические трубки и центрифуги на 300 x g за 1 мин аспирата супернатанта, добавьте 1 mL свежих средств массовой информации и Пипетка вверх и вниз осторожно с 1000 мкл микропипеткой достичь одну ячейку подвеска.
-
Формы 3D шары с помощью микрорезервуар культуры пластин.
- Подготовьте пластины, добавив 0,5 мл раствора анти соблюдение ополаскивания для каждой скважины микрорезервуар пластины. Центрифуга пластины на 2000 x g 5 мин аспирата промывной раствор, добавьте 1 mL DMEM/F12 для каждой хорошо помыть, и аспирационная снова.
Примечание: Всегда проверяйте, что центрифуги сбалансирована во время использования. - Количество каждого типа клеток с помощью Горяева или счетчик автоматизированных клеток. Добавьте нужное соотношение диссоциированных hAstros и hNeurons или iNeurons в каждой скважине в общем объеме 2 мл Нм + Y (включая Dox, если используются iNeurons). Центрифуга пластины на 100 g x 3 мин и вернуться в инкубаторе.
Примечание: 24-ну микрорезервуар пластины (см. Таблицу материалов) содержат 300 microwells в колодец. Добавьте как минимум 6 x 105 клеток (для сферы 2 x 103 клеток) и максимум 6 x 106 клеток (для сферы4 ячейки 2 x 10) в 2 мл СМИ за хорошо. Для жизнеспособных сфер плотность в этом диапазоне использовать определенное количество клеток и разделить на 300, чтобы подсчитать количество ячеек на сфере. Альтернативный сфере, формирование методы и инструменты могут быть использованы также при желании. Следуйте инструкциям производителя для приемлемых диапазонов плотностей клеток. - Разрешить клетки самостоятельно собрать в плотно упакованных сфер в микрорезервуар пластины в течение 2 дней (рис. 2A). Замените 50% средств массовой информации, если пожелтение культуры.
Примечание: Обмен только половина средств массовой информации и Пипетка осторожно, когда удаление и Добавление средств массовой информации в порядке, чтобы не мешать сферах. Сферах может поднять вверх от microwells и предохранитель вместе с высших сил. - После 2 дней аккуратно удалите сферах от microwells с 1000 мкл микропипеткой (рис. 1 d). Слегка применяйте силу к нижней части microwells с СМИ, чтобы удалить любые дополнительные придерживался сферы. Пусть сферах поселиться в 15 мл Конические трубки, аспирационная старые средства массовой информации, и добавить свежие средства массовой информации.
- Подготовьте пластины, добавив 0,5 мл раствора анти соблюдение ополаскивания для каждой скважины микрорезервуар пластины. Центрифуга пластины на 2000 x g 5 мин аспирата промывной раствор, добавьте 1 mL DMEM/F12 для каждой хорошо помыть, и аспирационная снова.
-
Настроить систему биореактор колбу счетчика для формирования 3D сферах.
- Очистить поверхность плиты магнитные перемешать с 70% этиловом спирте, поместите его в инкубатор культуры клеток. Автоклав индивидуальный счетчик колбы для стерилизации.
- Добавить сферах с минимум 50-60 мл средства массовой информации для каждого счетчика колбу (рис. 1 d, вставка). Поместите колбу на магнитные перемешать пластину на 60 об/мин. Сферы культуры в колбах спиннер, пока они не готовы для сбора данных.
Примечание: Не менее 3 недель в культуре необходим для формирования синапсов. Если системе биореактор колбу счетчика не желателен, сферах может культивировали в стационарных условиях в колбах культуры клеток или блюда. Сферах могут также быть встроенными в ECM или гидрогеля.
4. Измерение живой синаптических физиологии с массивами многоэлектродный (МЭС)
-
Подготовьте МЭС для клеточной культуры.
- Чистая поверхность каждого МЭС с 1 мл раствора моющего средства на 1 ч. промыть стерильной дейонизированной водой (DI), промыть 70% этанола для стерилизации и затем воздух сухой в области биобезопасности, кабинет под УФ светом.
Примечание: МЭС могут храниться в DI воды при температуре 4 ° C в стерильных условиях до использования. - Подготовьте 0.5 мг/мл раствора поли орнитина (ООП), растворяют 50 мг в 100 мл борной кислотой буфера ООП. Покрыть поверхность каждого МЭС с 1 мл раствора ООП для визуализации поверхности гидрофильных и инкубировать при 37 ° C не менее 4 ч. удалить ООП, промойте поверхность водой ди, добавляют 1 мл ECM (см. шаг 1.1.1) и инкубировать при 37 ° C не менее 4 ч.
- Удаление ECM и сфер в 1,5 мл СМИ на поверхности МПС, обеспечивая, что сферы расположены на вершине массива электрода (цифры 3А, 3а '). Позвольте присоединиться на 2 дня. Измените половина средств массовой информации каждые 2-3 дня (или чаще, если необходимо), обеспечение не нарушается сферах.
Примечание: Добавление факторов роста может улучшить выживания культуры и созревания.
- Чистая поверхность каждого МЭС с 1 мл раствора моющего средства на 1 ч. промыть стерильной дейонизированной водой (DI), промыть 70% этанола для стерилизации и затем воздух сухой в области биобезопасности, кабинет под УФ светом.
-
Мера электрическая активность нервных сфер.
- Создать систему многоэлектродный массив (МПС) с контролируемой температурой headstage. Создание программы с фильтр высоких частот 5 Гц, 200 Гц НЧ-фильтр и Спайк порог 5 x стандартное отклонение (SD).
- Место МПС на headstage и запись спонтанной электрической активности (рис. 3БB'). Сохраните необработанных данных, включая всплеска частоты и амплитуды для статистического анализа.
Примечание: Перфузии системы могут быть использованы с МПС для добавления фармакологических агентов или для увеличения потока свежей СМИ для длительной записи. Дополнительные пост-обработки шипов может выполняться как желаемого36,37.
5. Измерение синаптических плотности с Immunocytochemistry
-
Подготовка реагентов.
- Чтобы сделать 500 мл Стоковый раствор 4% параформальдегида (PFA), добавьте 400 мл ПБС в стеклянный стакан или плитой перемешать в вентилированные капюшон. Добавить движение бар и тепла до 60 ° C во время перемешивания; не кипятить. Добавить 20 г порошка PFA подогревом решение PBS и повысить рН 6,9 каплям добавляя медленно 1 N NaOH.
Примечание: 4% раствор PFA может быть aliquoted и хранить при 4 ° C на срок до одного месяца. - Добавьте 20 г или 30 г сахарозы в 100 мл PBS сделать решения 20% и 30% сахарозы, соответственно.
- Добавьте 1 мл моющего средства до 10 мл PBS приготовить раствор 10% акций. Инвертируйте несколько раз для гомогенизации.
- Добавьте 10 мл PBS подготовить основной блокирующий буфер 250 мкл 10% акций моющим средством (конечная концентрация 0.25%) и 500 мкл коза и осел сывороток (конечной концентрации 5%).
- Добавьте 100 мкл коза и осел сывороток (конечная концентрация 1% каждый) 10 мл PBS подготовить вторичный блокирующий буфер.
- Чтобы сделать 500 мл Стоковый раствор 4% параформальдегида (PFA), добавьте 400 мл ПБС в стеклянный стакан или плитой перемешать в вентилированные капюшон. Добавить движение бар и тепла до 60 ° C во время перемешивания; не кипятить. Добавить 20 г порошка PFA подогревом решение PBS и повысить рН 6,9 каплям добавляя медленно 1 N NaOH.
-
Подготовка образцов.
- Перевести сферы в 15 мл Конические трубки, позволять им селиться в нижней части трубки и аспирационная старые средства массовой информации. Промойте сферах с 500 мкл PBS, пусть урегулировать и аспирационная PBS. Добавьте 500 мкл 4% PFA (или достаточно, чтобы покрыть сферах) и Инкубируйте на 4 ° C на 30 мин.
- Аспирационная ППД и аккуратно мыть дважды с PBS. Добавить 20% раствора сахарозы и Инкубируйте на 4 ° C на несколько часов или на ночь. Тщательно аспирационная, добавить 30% раствора сахарозы и Инкубируйте на 4 ° C на несколько часов или на ночь.
Примечание: Образцы можно хранить при 4 ° C в PBS или сахароза до 1 недели перед переходом к следующему шагу. Если нет нарезки, сохранить как 3D сферы (рис. 4A-C) в 1,5 мл трубку и перейти к шагу 5.3. - Если нарезки сферах, тщательно передать сферы внедрения криогенных плесень на вершине сухого льда. Аспирационная 30% раствор сахарозы и медленно вылейте ткани, внедрение решения в форму до тех пор, пока она полностью покрывает образца, избегая пузырьков воздуха. Подождите, пока раствор замерзает и хранить при температуре-80 ° C до нарезки криостата.
- С помощью криостата в-20 ° C, нарежьте встроенных блоков 30 мкм разделов (или по желанию) и передачи в стеклянных скольжениях. Хранить при температуре-80 ° С до готовности пятно.
-
Имунноконтраст сферах.
- Контур края слайды с гидрофобным Пап пера для предотвращения разлива жидкости. Подготовка первичного и вторичного блокирования решения с антителами (см. Таблицу материалы). 500 мкл первичного блокирующий буфер для каждого слайда или трубки и инкубации при комнатной температуре за 30 мин.
- Удалите жидкость, 500 мкл свежей первичной блокировки буфера с разбавленным первичных антител на каждый слайд или трубы и инкубировать на ночь при 4 ° C. Удаление решения основное антитело и мыть 3 x 10 мин с PBS.
- 500 мкл вторичных блокирующий буфер с разбавленным вторичные антитела на каждый слайд или трубы и Инкубируйте на 4 ° C, 1 ч., удалить раствор вторичных антител и мыть 3 x 10 мин с PBS.
Примечание: В Таблице материаловпредоставляется список рекомендуемых антител. Другие антител или красители могут быть использованы как пожелано. Не подвергайте флуоресцентные образцов для освещения (шаг 5.3.3 вперед). - Добавьте 50 мкл решение каплям для покрытия поверхности и тщательно место coverslip на слайд, избегая пузыри для монтажа. Разрешить слайды сушат при комнатной температуре в течение 24 ч и хранить при 4 ° C.
-
Изображения слайдов.
- Используйте конфокальный или два Фотон флуоресцентный микроскоп с 63 X нефти погружения цель изображения до и после синаптических белков изобилия и colocalization в сфере срезы (рис. 4 d). Использование 20 X или 40 X цель для визуализации морфологические особенности hAstros.
- Файлы изображений в открытых флуоресценции с ImageJ программного обеспечения. Граф до и после синаптических puncta, вручную с помощью плагина, счетчик клеток, используя объективные подсчитывая метод как ранее подробные38, или с альтернативными методами.
Результаты
Когда выполняется должным образом, этот протокол будет производить определенные популяции функциональных cocultures астроциты28,,3334 и нейронов35 из hPSCs (Рисунок 1A-1C), как подробные ранее26 и описано здесь 2.1-2.2. Ожидается, что эта поэтапная процедура с использованием микрорезервуар пластин, выход 3D нейронных сферах последовательного размера и формы (шаг 3.3; Рисунок 1 d) с равномерно рассеянных клеток и без существенных признаков смерти клетки. Широкий спектр начиная с нужного соотношения типов клеток, клеток плотности, будет производить сфер различных размеров. В отсутствие микрорезервуар пластин, клетки будет объединить в форме значительно крупнее и неравномерное агрегатов, чьи диаметры (> 2 мм) превосходят предел распространения (рисунок 2A-2B). Предполагается, что использование счетчика колбу или эквивалент Биореактор будет поддерживать единообразие между сферами и уменьшить слияние (шаг 3.4; Рисунок 2 c). Однако в то время как волчок колбы позволяют культуры сфер для недели, их использование не является необходимым.
Для стабилизации cocultures для электрофизиологических анализа, ECM-подражая субстраты позволяют сферах легко придерживаться при сохранении их 3D структуры (Рисунок 3А, 3а '). Во время записи здоровый сфер iNeurons на МЭС спонтанно вызовет скачков напряжения более чем 40 мкВ ± с частотами последовательного обжига (шаги 4.1-4.2; Рисунок 3B -C, 3F). Ожидается, что coculture сферах отображения более сетевое подключение в присутствии hAstros, что привело к увеличению синхронной сети очередей шипов (рисунок 3B«-3 C»). Применение CNQX35,,3940, антагонистом рецепторов постсинаптической АМПА уменьшает сетевой всплеск синхронности в coculture сферах (рис. 3D'-3E').
Нервные клетки тип ограничен белковых маркеров визуально продемонстрировать равномерно распределенные расположения и зрелость астроциты и нейронов в 3D сферах. Максимальной проекции экзоцитоз морфологии и ветвление показан на рисунке 4A сфере представитель 3D с hAstros, малонаселенных помечены мембраны прыгните GFP. Зрелые hAstros Экспресс маркеры, включая СВМС (рис. 4B), S100B и Glt134, тогда как hNeurons и iNeurons express микротрубочек связанный протеин 2 (MAP2; Рисунок 4 c) и бета-тубулина 3 (Tuj1/TUBB3). Наконец хотя iNeurons Экспресс до и после синаптических белков, включая синапсины 1 (Syn1) и Гомер или PSD95, соответственно, синаптических плотность значительно усиливается в присутствие hAstros в coculture (рис. 4 d)26. Если возможно, альтернативное использование мозга, очистка методов и легких лист микроскопии позволит быстрого изображения нетронутыми сфер.
Взятые вместе, выражение зрелых нейронных маркеры наряду с спонтанной электрической активности подтверждают успех Протокола, описанные выше в производстве 3D cocultures функциональных синаптических микросхемы.
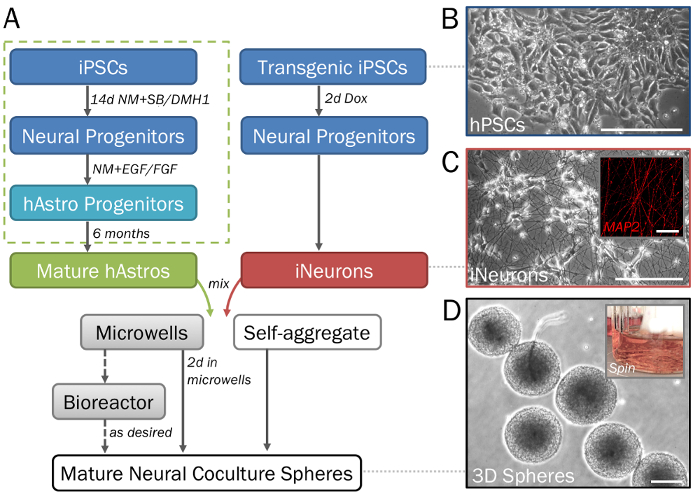
Рисунок 1: поэтапный изображением дифференциация и формирования 3D нейронных сфер, производный от hPSCs. (A) Хронология ключевых шагов в протоколе. (B) чисто популяций нервные клетки могут быть сгенерированы из человека индуцированных плюрипотентных стволовых клеток (hPSCs). Для генерации экзоцитоз прародителями (пунктирная зеленый флажок) увидеть шаг 2.1, а также предложение28. Индуцибельной нейронов (C) (iNeurons; см. раздел 2.2) полученные трансгенные hPSCs через индуцированных Сверхэкспрессия neurogenin 2 продемонстрировать нейрональных морфологии на 2D ECM (7 в день) и являются позитивными для MAP2 (вставка). (D) сферах удалены из микрорезервуар пластины (см. шаги 3.1 – 3.3) демонстрируют постоянный размер для высокопроизводительного скрининга. Сферах может культивировали в биореакторе колбу волчок (вставка; см. шаг 3.4) при необходимости предотвратить фьюжн. Шкалы бар = 50 мкм (C, вставка). Масштаб баров = 200 мкм (A, D). Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
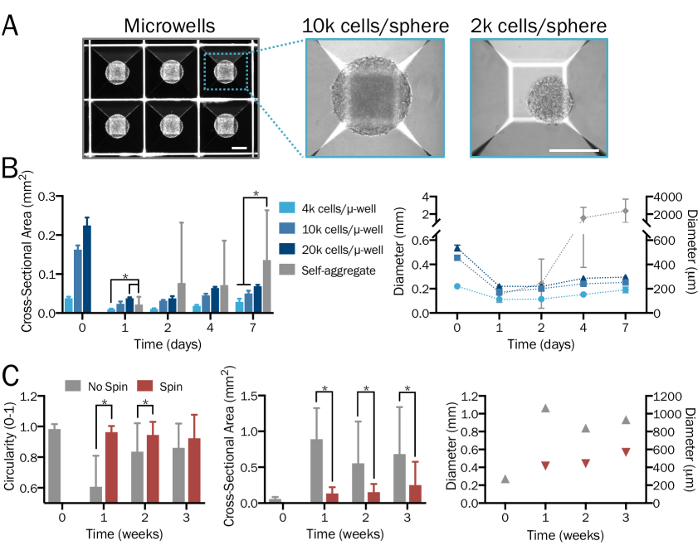
Рисунок 2: систематический и воспроизводимые поколение 3D нейронных сфер биоинженерных. (A) микрорезервуар (µ ну) культуры пластин используются для формирования 3D нейронных сферах желаемой плотности и нейрон экзоцитоз коэффициенты на основе систематического и определяемые пользователем, приносит постоянный размер и форму. Изображения показываются 1 день после сферы образования. Масштаб баров = 200 µm. (B) производит широкий спектр начиная клеток плотности (от3 4 x 10-2 х 104 клетки в микрорезервуар) сфер различных размеров. В отсутствие микрорезервуар пластин, hPSCs объединить формы значительно крупнее и неравномерное агрегатов, чьи диаметры превосходят предел распространения после недели (n = 6-14 сферах каждой группы и времени точки). (C) iNeuron сферах, культивируемых в колбе spinner на 80 об/мин выставлены меньше фьюжн и таким образом были значительно меньше, более единообразного и выставлены более округлости, по сравнению с теми в стационарных культуры в течение трех недель (n = 6-51 сферах каждой группы и времени точки). Земельные участки представляют собой среднее ± SD; * показывает значимость (p < 0,05) между группами, определяется с использованием двустороннее t-тесты. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
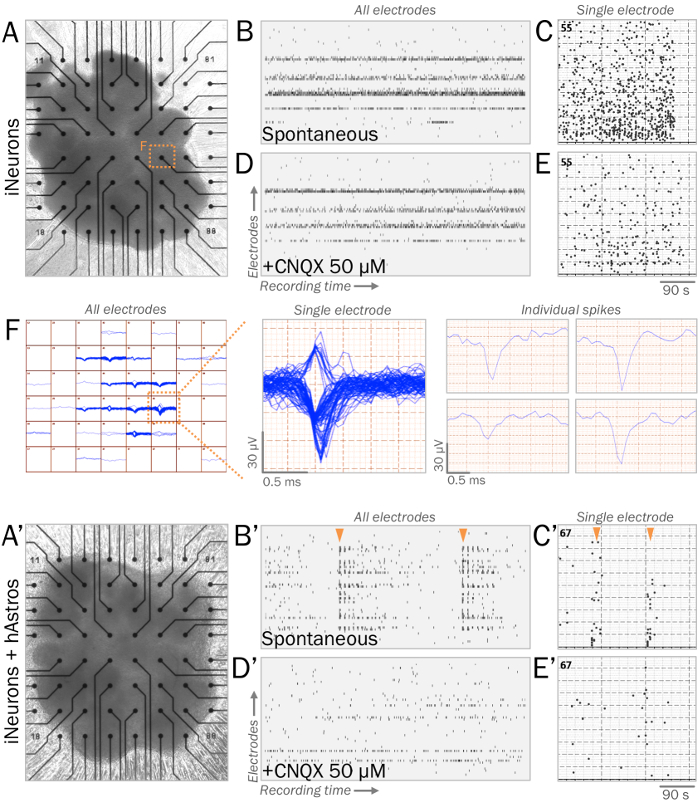
Рисунок 3: представитель живой синаптических физиологии нейронных сфер на многоэлектродный массивы (МЭС). (, A') МЭС используются для измерения живой синаптических физиологии нервной сфер. Сферы iNeurons (A) или cocultures iNeurons и hAstros (A') может быть культивировали на поверхностях МПС с ECM-подражая субстратов (см. шаг 4.1). (B, B') Растровые участков представитель спонтанной электрической активности измеряется во всех электродов (вертикальная ось) во время записи окна (горизонтальная ось). После 4 недель культуры в нейрофизиологических базальной средних41iNeuron сферах (B) отображается спонтанное шипы, в то время как coculture сфер (B) показали увеличение сети очередей синхронной стрельбы шаблонов (оранжевые стрелки). (C, C') Гистограмма шипы измеряется во время МПС записи windows от представителя электродов. (D, D') Растровые участки спонтанной электрической активности измеряется во всех электродов после применения 50 мкм CNQX, антагонист рецепторов АМПА (же масштабе времени как B, B). CNQX исключить наличие синхронного очередей пики наблюдаются в cocultures (D'). (E, E') гистограммы шипов, измеряемый при МПС записи windows от представителя электродов после 50 мкм CNQX приложения (то же время масштаб как C, C'). (F) карта Спайк Прориси сфер iNeuron от всех электродов со временем (слева). Демонстративный одного электрода, отображение нескольких кластерных следы во времени (в центре); Индивидуальные Спайк следы могут быть отсортированы и анализируются индивидуально (справа). Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
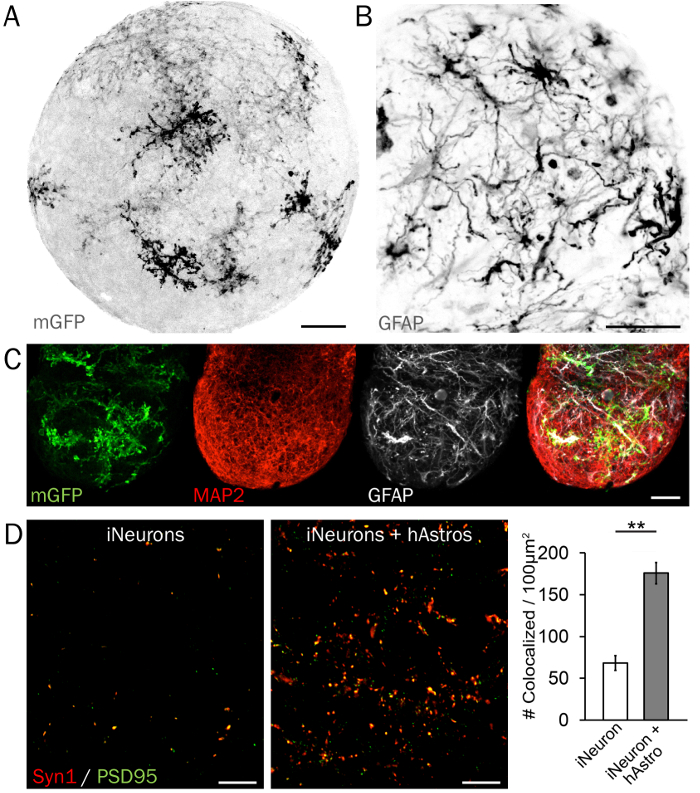
Рисунок 4: характерные иммуногистохимия синаптических микросхемы. Репортер (A) мембраны прыгните GFP (mGFP) является полезным для изучения механизма и морфология hAstros в 3D нейронных сферах. (B) hAstros отличается от hPSCs являются СВМС позитивными. (C) сферах, содержащий hAstros и iNeurons могут быть визуализированы и проанализированы с помощью маркеров ограниченного типа белка клеток как СВМС и MAP2. Масштаб баров = 50 µm. (D) представитель изображения до и после синаптических плотностей (Syn1 и PSD95, соответственно) в сферах iNeurons без (слева) и с (справа) cocultured hAstros. В coculture сферах, по сравнению с iNeuron сферах на день 35, демонстрируя hAstros способность вызывать образование синапсов наблюдался значительно увеличенной плотности colocalized Syn1 и PSD95 (n = 3 независимых реплицирует каждый; данных перепечатано из Ref 26 с разрешения). Масштаб баров = 10 мкм. участок представляет среднее ± SEM; существенные различия (* указывает p < 0,05; ** указывает p < 0.01) между группами были определены с использованием двустороннее t-тесты. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
Обсуждение
В этом протоколе мы описываем систематический метод для производства 3D сфер нейронные cocultures. Сферах состоят из астроцитов и нейроны, которые являются производными независимо от hPSCs. Хотя не в центре внимания настоящего Протокола, поколение чистого популяций астроциты hPSCs28 является важным шагом и может быть технически сложным, если выполняется без предварительного опыта. Этот первый шаг в поколении этих синаптических микросхем должны быть выполнены с тщательной времени и внимания к деталям. Ограничение использования hPSC производные астроциты-это процесс длительный дифференциации; Однако, производство большого количества клеток, которые могут быть заморожены в будущем использовать и размороженным на время экспериментов (см. шаг 2.1.5) устраняет необходимость начать процесс от этапа начального hPSC. Хотя полученные трансгенные hPSCs iNeurons synaptogenic и имеют возможность выставлять спонтанное постсинаптических электрические токи, обе характеристики особенно усиливается наличием глии12,35— включая hAstros подробно в настоящем Протоколе. Таким образом следует отметить, что выбор типа клеток, количество и стадии развития или зрелости является важнейшим компонентом этого протокола, и корректировок может привести к вариации в электрической активности или синапса визуализации. Однако этот протокол также разрешает манипуляции плотность клеток или соотношения в манере, которая отражает гибкость условий или результатов от отдельных исследователя.
Как описано выше, мы воспользоваться инструментами биоинженерии для создания альтернативы нейронных органоид методы42,43, с той оговоркой, что эта система не пилки самоорганизации и наслаивать фенотипы organoids, которые могут быть желаемого20,-44. Одновременное использование микрорезервуар культуры пластин26 и паук колбу биореактор45,46 обеспечить воспроизводимость, таким образом рационализации не только производства, но также изучение и анализ нейронных микросхемы с различные assays культуры клеток. Следует подчеркнуть, что хотя использование счетчика колбу или эквивалент биореактор является необязательным, стационарные культуры сфер в тесном контакте может привести к их взрывательных вместе, таким образом ограничивающие питательные вещества и кислород за пределом распространения в центре сферах47. Примечательно как выше подход пропускную способность по сравнению с большими биореакторов46поступили использование 3D печатные мини биореакторов.
Традиционные инструменты для измерения синаптических формирования включают физиологические методы таких поклеточного патч зажима, МЭС36,48,49и кальция изображений50. Здесь мы решили описать использование МЭС, как они обеспечивают простое и высок объём экспертизы электрической активности в сферах в масштабе короткого промежутка времени. Однако другие методы могут быть использованы.
Ограничение использования микрорезервуар пластин в этот протокол является максимальное количество сфер (~ 300) и клеток в сфере (~ 2 x 104), допускается в каждой скважине. Альтернативный сфере формирования инструменты могут быть использованы для увеличения числа; Однако потребуется большее количество клеток в начальной точке. 24-ну формат был выбран здесь для его способности генерировать больше сфер, которые могут быть обрабатываются для анализа и видимые глазом, ограничивая гибели клеток в центре сферы. В целом Добавление этого шага к протоколу обеспечит надежные и масштабируемые производства единообразных 3D сфер.
Наш протокол также может похвастаться гибкостью регулировать количество и соотношение каждого типа клеток, а также возможность введения других типов клеток в 3D сферы в контролируемых, определенным образом. Использование конкретного региона нейронов и экзоцитоз подтипы позволяет исследование синаптических микросхемы различных регионов центральной нервной системы. Эти coculture сферах может также быть плавленного вместе51 изучение клеточной миграции и дальней дистанции сигнализации. Добавление олигодендроциты, эндотелиальные клетки или микроглии могут оказаться эти 3D сферы, чтобы быть информативным мозга модель повышенной сложности, как перспективное будущее направление для данного метода. Наконец в дополнение к болезни и травмы моделирования, эта система позволяет исследования терапевтических подходов, например клеточной терапии замены или разработки лекарственных препаратов, для повышения neuroregeneration.
Раскрытие информации
Авторы не имеют ничего сообщать.
Благодарности
Мы хотели бы поблагодарить д-р Эрик Ullian (UCSF) за интеллектуальный вклад в разработке этих процедур, д-р Майкл Уорд (НИЗ) для технических консультаций по iNeuron дифференциация и Саба Барлас для анализа предварительных изображений.
Материалы
| Name | Company | Catalog Number | Comments |
| 6 well plate | Fisher Scientific | 08-772-1B | |
| 15 mL conical tubes | Olympus Plastics | 28-101 | |
| Accutase | Sigma | A6964-100ML | Detachment solution |
| AggreWell plate | Stemcell Technologies | 34850 | |
| Anti-Adherence Rinsing Solution | Stemcell Technologies | 7010 | Prevent cell adhesion to microwell plates |
| Anti/anti | Thermofisher | 15240062 | |
| B27 | Thermofisher | 17504044 | Media Supplement |
| BrainPhys neuronal medium | Stemcell Technologies | 5790 | Neurophysiological basal medium alternative |
| Circular glass coverslips | Neuvitro | GG-12-oz | |
| Cryostor CS10 | Stemcell Technologies | 7930 | Cryopreservation medium with 10% DMSO |
| DMEM/F12 | Thermofisher | 10565-042 | With GlutaMAX supplement |
| DMH-1 | Stemcell Technologies | 73634 | HAZARD: Toxic if swallowed. Working concentration: 2 μM |
| Donkey serum | Lampire Biological Laboratories | 7332100 | Working concentration: 5% in primary blocking buffer, 1% in secondary blocking buffer |
| Doxycycline Hydrochloride (Dox) | Sigma | D3072-1ml | HAZARD: Toxic for pregnant women. Working concentration: 2 μg/mL |
| Epidermal growth factor (EGF) | Peprotech | AF-100-15 | Working concentration: 10 ng/mL |
| Fibroblast growth factor-2 (FGF) | Peprotech | 100-18B | Working concentration: 10 ng/mL |
| Fluoromount-G mounting solution | Southern Biotech | 0100-01 | |
| Glass slides | Fisherbrand | 22-037-246 | |
| Goat serum | Lampire Biological Laboratories | 7332500 | Working concentration: 5% in primary blocking buffer, 1% in secondary blocking buffer |
| Hemacytometer or automatic cell counter | Life Technologies | AMQAX1000 | |
| Heparin | Sigma | H3149-50KU | Working concentration: 2 mg/mL |
| Magnetic plate | DLAB | 8030170200 | |
| Matrigel membrane matrix | Corning | 354230 | ECM coating solution. Working concentration: 80 μg/ml. Prepare on ice and ensure that pipettes, tubes, and media are pre-chilled. |
| MEA 2100 System | Multichannel Systems | MEA2100 | |
| Mounting solution | |||
| N2 | Thermofisher | 17502048 | Media Supplement |
| OCT | Tissue-Tek | 4583 | Tissue embedding solution for cryosectioning |
| Pap Pen (Aqua Hold) | Scientific Device Laboratory | 9804-02 | |
| Paraformaldehyde (PFA) | Acros Organics | 169650025 | HAZARD: Toxic if inhaled. Working concentration: 4% in PBS |
| Phosphate buffered saline (PBS) | Stemcell Technologies | CA008-300 | |
| Poly-l-ornithine (PLO) | Sigma | P3655-100MG | Working concentration: 0.5 mg/mL |
| Rectangular glass cover slips | Fisherfinest Premium Superslip | 12-545-88 | |
| ReLeSR | Stemcell Technologies | 5872 | Detachment and passaging reagent |
| Rho-Kinase Inhibitor Y27632- (Y) | Tocris | 1254 | Working concentration: 10 uM |
| SB431542 | Stemcell Technologies | 72234 | Working concentration: 2 μM |
| Spinner flasks | Fisher Scientific | 4500-125 | |
| Sucrose | Fisher Chemical | S5-3 | Working concentration: 20% or 30% in PBS |
| T25 Culture Flask | Olympus Plastics | 25-207 | Vented caps |
| T75 Culture Flask | Olympus Plastics | 25-209 | Vented caps |
| Terg-A-zyme | Sigma | Z273287-1EA | Detergent. Working concentration: 1% |
| TeSR-E8 basal medium | Stemcell Technologies | 5940 | Human pluripotent stem cell (hPSC) medium |
| TeSR-E8 supplements | Stemcell Technologies | 5940 | Supplements for human pluripotent stem cell medium |
| TritonX-100 | Sigma | X100-500ML | Detergent for cell permeabilization. Working concentration: 0.25% in blocking buffer |
| Trypan blue | Invitrogen | T10282 | |
| Antibodies | |||
| AlexaFluor 488 | Thermofisher | A-11029 | Secondary antibody |
| AlexaFluor 594 | Thermofisher | A-11037 | Secondary antibody |
| Ezrin | Thermofisher | MA5-13862 | Primary antibody; astrocytes perisynaptic |
| GFAP | Chemicon | MAB360 | Primary antibody; astrocytes |
| GFP | Aves | GFP-1020 | Primary antibody; astrocytes |
| Glt1 | Gift from Dr. Jeffrey Rothstein | n/a | Primary antibody; astrocytes |
| Homer | Synaptic Systems | 160 011 | Primary antibody; neurons, post-synaptic |
| MAP2 | Synaptic Systems | 188 004 | Primary antibody; neurons |
| PSD95 | Abcam | ab2723 | Primary antibody; neurons, post-synaptic |
| S100 | Abcam | ab868 | Primary antibody; astrocytes |
| Synapsin 1 | Synaptic Systems | 106 103 | Primary antibody; neurons, pre-synaptic |
| TuJ1/β3-tubulin (TUBB3) | Covance | MMS-435P | Primary antibody; neurons |
Ссылки
- Ullian, E. M., Christopherson, K. S., Barres, B. A. Role for Glia in Synaptogenesis. Glia. 47, 209-216 (2004).
- Baldwin, K. T., Eroglu, C. Molecular mechanisms of astrocyte-induced synaptogenesis. Current Opinion in Neurobiology. 45, 113-120 (2017).
- Molofsky, A. V., et al. Astrocyte-encoded positional cues maintain sensorimotor circuit integrity. Nature. 509 (7499), 189-194 (2014).
- Sultan, S., et al. Synaptic Integration of Adult-Born Hippocampal Neurons Is Locally Controlled by Astrocytes. Neuron. 88, 957-972 (2015).
- Clarke, L. E., Barres, B. A. Emerging roles of astrocytes in neural circuit development. Nat Rev Neuroscience. 14 (5), 311-321 (2013).
- Cheung, G., Sibille, J., Zapata, J., Rouach, N. Activity-Dependent Plasticity of Astroglial Potassium and Glutamate Clearance. Neural Plasticity. , 109106(2015).
- Ghezali, G., Dallerac, G., Rouach, N. Perisynaptic astroglial processes dynamic processors of neuronal information. Brain Struct Funct. 221, 2427-2442 (2016).
- Kimelberg, H. K., Nedergaard, M. Functions of Astrocytes and their Potential As Therapeutic Targets. Neurotherapeutics. 7, 338-353 (2010).
- Pál, B. Astrocytic Actions on Extrasynaptic Neuronal Currents. Frontiers in Cellular Neuroscience. 9, 474(2015).
- Kiray, H., Lindsay, S. L., Hosseinzadeh, S., Barnett, S. C. The multifaceted role of astrocytes in regulating myelination. Experimental Neurology. 283, 541-549 (2016).
- Allen, N. J., Eroglu, C. Cell Biology of Astrocyte-Synapse Interactions. Neuron. 96 (3), 697-708 (2017).
- Krencik, R., van Asperen, J. V., Ullian, E. M. Human astrocytes are distinct contributors to the complexity of synaptic function. Brain Research Bulletin. 129, 66-73 (2017).
- Ullian, E. M., Sapperstein, S. K., Christopherson, K. S., Barres, B. A. Control of Synapse Number by Glia. Science. 291, 657-662 (2001).
- Oberheim Bush, N. A., Nedergaard, M. Do Evolutionary Changes in Astrocytes Contribute to the Computational Power of the Hominid Brain? Neurochemical Research. 42 (9), 2577-2587 (2017).
- Han, X., et al. Forebrain Engraftment by Human Glial Progenitor Cells Enhances Synaptic Plasticity and Learning in Adult Mice. Cell Stem Cell. 12 (3), 342-353 (2013).
- Inoue, H., Nagata, N., Kurokawa, H., Yamanaka, S. iPS cells: a game changer for future medicine. The EMBO Journal. 33 (5), 409-417 (2014).
- Shi, Y., Inoue, H., Wu, J. C., Yamanaka, S. Induced pluripotent stem cell technology a decade of progress. Nature Reviews Drug Discovery. 16 (2), 115-130 (2017).
- Dodla, M. C., Mumaw, J., Stice, S. L. Role of astrocytes, soluble factors, cells adhesion molecules and neurotrophins in functional synapse formation: implications for human embryonic stem cell derived neurons. Stem Cell Res Ther. , 251-260 (2010).
- Krencik, R., Ullian, E. M. A cellular star atlas: using astrocytes from human pluripotent stem cells for disease studies. Frontiers in Cellular Neuroscience. 7, 1-10 (2013).
- Pasca, S. P. The rise of three-dimensional human brain cultures. Nature. 553 (7689), 437-445 (2018).
- Huch, M., Knoblich, J. A., Lutolf, M. P., Martinez-arias, A. The hope and the hype of organoid research. Development. 144, 938-941 (2017).
- Mason, J. O., Price, D. J. Building Brains in a Dish: Prospects for Growing Cerebral Organoids from Stem Cells. Neuroscience. 334, 105-118 (2016).
- Kelava, I., Lancaster, M. A. Dishing out mini-brains: Current progress and future prospects in brain organoid research. Developmental Biology. 420 (2), 199-209 (2016).
- Kelava, I., Lancaster, M. A. Stem Cell Models of Human Brain Development. Cell Stem Cell. 18 (6), 736-748 (2016).
- Sloan, S. A., et al. Human Astrocyte Maturation Captured in 3D Cerebral Cortical Spheroids Derived from Pluripotent Stem Cells. Neuron. , 779-790 (2017).
- Krencik, R., et al. Systematic three-dimensional coculture rapidly recapitulates interactions between human neurons and astrocytes. Stem Cell Reports. 9 (6), 1745-1753 (2017).
- Chen, G., et al. Chemically defined conditions for human iPSC derivation and culture. Nature Methods. 8 (5), 424-429 (2011).
- Krencik, R., Zhang, S. -C. Directed differentiation of functional astroglial subtypes from human pluripotent stem cells. Nature Protocols. 6 (11), 1710-1717 (2011).
- Du, Z. -W., et al. Generation and expansion of highly pure motor neuron progenitors from human pluripotent stem cells. Nature Communications. 6, 6626(2015).
- Neely, M. D., et al. DMH1, a highly selective small molecule BMP inhibitor promotes neurogenesis of hiPSCs: Comparison of PAX6 and SOX1 expression during neural induction. ACS Chemical Neuroscience. 3 (6), 482-491 (2012).
- Lippmann, E. S., Estevez-Silva, M. C., Ashton, R. S. Defined Human Pluripotent Stem Cell Culture Enables Highly Efficient Neuroepithelium Derivation Without Small Molecule Inhibitors. Stem Cells. 32, 1032-1042 (2014).
- Eggan, K., Kawada, J., Kaneda, S., Kirihara, T., Maroof, A. Generation of a Motor Nerve Organoid with Human Stem Cell-Derived Neurons. Stem Cell Reports. 9, 1441-1449 (2017).
- Krencik, R., Weick, J. P., Liu, Y., Zhang, Z. -J., Zhang, S. -C. Specification of transplantable astroglial subtypes from human pluripotent stem cells. Nature Biotechnology. 29 (6), 528-534 (2011).
- Krencik, R., et al. Dysregulation of astrocyte extracellular signaling in Costello syndrome. Science Translational Medicine. 7 (286), 286(2015).
- Wang, C., et al. Scalable Production of iPSC-Derived Human Neurons to Identify Tau- Lowering Compounds by High-Content Screening. Stem Cell Reports. 9 (4), 1221-1233 (2017).
- Amin, H., Maccione, A., Marinaro, F., Zordan, S., Nieus, T., Berdondini, L. Electrical Responses and Spontaneous Activity of Human iPS-Derived Neuronal Networks Characterized for 3-month Culture with 4096-Electrode Arrays. Frontiers in Neuroscience. 10, (2016).
- Kapucu, F. E., Mäkinen, M. E., Tanskanen, J. M. A., Ylä-Outinen, L., Narkilahti, S., Hyttinen, J. A. K. Joint analysis of extracellular spike waveforms and neuronal network bursts. Journal of Neuroscience Methods. 259, 143-155 (2016).
- Ippolito, D. M., Eroglu, C. Quantifying Synapses: an Immunocytochemistry-based Assay to Quantify Synapse Number. Journal of Visualized Experiments. 45, 2-9 (2010).
- Zhang, Y., et al. Rapid single-step induction of functional neurons from human pluripotent stem cells. Neuron. 78 (5), 785-798 (2013).
- Odawara, A., Katoh, H., Matsuda, N., Suzuki, I. Physiological maturation and drug responses of human induced pluripotent stem cell-derived cortical neuronal networks in long-term culture. Scientific reports. 6, 26181(2016).
- Bardy, C., Hurk,, et al. Neuronal medium that supports basic synaptic functions and activity of human neurons in vitro. PNAS. 112 (25), E2725-E2734 (2015).
- Monzel, A. S., et al. Derivation of Human Midbrain-Specific Organoids from Neuroepithelial Stem Cells. Stem Cell Reports. 8, 1144-1154 (2017).
- Lancaster, M. A., Knoblich, J. A. Generation of cerebral organoids from human pluripotent stem cells. Nature Protocols. 9 (10), 2329-2340 (2014).
- Dutta, D., Heo, I., Clevers, H. Disease Modeling in Stem Cell-Derived 3D Organoid Systems. Trends in Molecular Medicine. 23 (5), 393-410 (2018).
- Lancaster, M. A., et al. Cerebral organoids model human brain development and microcephaly. Nature. 501 (7647), 373-379 (2013).
- Qian, X., et al. Brain-Region-Specific Organoids Using Mini-bioreactors for Modeling ZIKV Exposure. Cell. 165 (5), 1238-1254 (2016).
- Yan, Y., et al. Derivation of Cortical Spheroids from Human Induced Pluripotent Stem Cells in a Suspension Bioreactor. Tissue Engineering Part A. , 1-46 (2016).
- Obien, M. E. J., Deligkaris, K., Bullmann, T., Bakkum, D. J., Frey, U. Revealing neuronal function through microelectrode array recordings. Frontiers in Neuroscience. 9 (JAN), 423(2015).
- Hales, C. M., Rolston, J. D., Potter, S. M. How to Culture, Record and Stimulate Neuronal Networks on Micro-electrode Arrays (MEAs). Journal of Visualized Experiments. (39), 1-7 (2010).
- Shigetomi, E., Patel, S., Khakh, B. S. Probing the Complexities of Astrocyte Calcium Signaling. Trends in Cell Biology. 26 (4), 300-312 (2016).
- Bagley, J. A., Reumann, D., Bian, S., Lévi-strauss, J., Knoblich, J. A. Fused cerebral organoids model interactions between brain regions. Nat Methods. 14 (7), (2017).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены