Method Article
3D Cocultures 이다 인간 만능 줄기 세포에서 신경 세포의 시 냅 스 마이크로 회로 모델링
요약
이 프로토콜에서 결합 해리 인간의 pluripotent 줄기 세포 파생 뉴런에 대 한 재현 방법에 설명 하 고 이다 3D에 범위 cocultures, 무료 부동 조건, 그리고 이후 이러한 분야를 유지 하 immunoanalysis와 multielectrode 배열 녹음 분야의 측정 시 냅 스 회로 활동.
초록
시 냅 스 회로 기능에 기여 하는 다양 한 세포 유형 및 신호에 대 한 우리의 이해에 방 벽은 인간의 뇌 연구 관련 모델의 부족 이다. 이 문제를 해결 하려면 한 신흥 기술을 3 차원 (3D) 신경 세포 배양, 'organoids' 또는 'spheroids', extracellular 접착 분자를 포함 하 여 세포 상호 작용의 장기 보존에 대 한 나의 사용 이다. 그러나, 이러한 문화 시스템은 시간 소모 하 고 체계적으로 생성 된. 여기, 우리 신속 하 고 지속적으로 신경의 3D cocultures을 생산 하는 방법에 자세히 설명 하 고 인간 만능에서 이다 줄기 세포. 첫째, 미리 차별화 이다 신경 창시자는 해리와 계산. 다음으로, 셀 영역을 형성 결합 되어 요리로 키 니 아 제 억제제와 재현 크기의 구체를 생산 하는 특정 비율에. 몇 주 후 문화의 부동 구체로, cocultures ('소행성') 마지막으로 immunostaining에 대 한 구분 또는 시 냅 스 밀도 강도 측정 하는 multielectrode 배열에 따라 도금. 일반적으로,이 프로토콜 표시 성숙한 세포 유형 제한 표식, 기능 시 냅 스를 형성 하 고는 자발적 시 냅 스 네트워크 버스트 활동 전시 3D 신경 분야를 얻을 것입니다 예상 된다. 함께,이 시스템 단층 문화에 비해 더 적합 한 모델에서 약물 검사와 질병의 메커니즘에 대 한 조사를 허용 합니다.
서문
이다는 구조 지원 이상 기능적인 책임의 다양 한 중앙 신경 시스템 (CNS) 내에서 매우 풍부한 glial 세포 유형입니다. 수용 성 synaptogenic 요인의 세포 외 기질 (ECM) 분 비를 통해 이다 설립 및 개발1동안 성숙한 시 냅 스의 클러스터링에 도움이. 그들은 또한 건강과 extracellular 신호2,3,,45, 시 냅 스의가 소성 유지에 중요 한 역할을 하 고 항상성의 장기 안정성을 세포 외 칼륨과 조미료, 뿐만 아니라 에너지 기질과 ATP6,,78의 분 비를 조절 하 여 환경. 마지막으로, 그들은9, extrasynaptic 전류 영향을 미치는 의해 neurotransmission에 기여할 수 있는 고 수 직접 다른 세포 유형 myelination10홍보 등을 통해 활동 영향. 중요 한 것은, 비정상적인 또는 이다의 부전 이어질 수 많은 neurodevelopmental 증후군 성인 neuropathology, 이므로 개선에 대 한 순서로 함께 설계 된 신경망에서 뉴런 이다를 포함 하는 명백한 필요가 내 생 두뇌 환경 모델입니다. 이다의 필수적인 특성 신경 시 냅 스1,,1112양식 동적 상호 작용을 그들의 능력입니다. 명과의 부재에서 신경 시 냅 스, 일반적으로 또한 기능 성숙13부족의 제한 된 수를 형성 한다.
인간의 이다 표시, transcriptional, 형태학 및 기능적 특성-분기, 뿐만 아니라 종의 유전자의 증가 크기와 복잡성 등-는 설치류12,14에 지 하지는 15. 그 결과, 인간의 만능 줄기 세포 (hPSC)를 활용 하 여 연구-파생된 신경 세포 소설 치료, 부상, 모델과 문화 패러다임16 개발 하는 동안 생체 외에서 CNS 관련 질병 검사의 수단으로 널리 수용 되는 ,17. 또한, hPSCs 인간 시 냅 스 형성 및 기본 조직18,19에 대 한 필요 없이 기능 연구를 허용합니다.
시 냅 스 회로 기능에 기여 하는 다양 한 세포 유형 및 신호에 대 한 우리의 이해에 방 벽은 인간 두뇌의 관련 모델의 부족 이다. 높은 정확도와 재현성의 시 냅 스 네트워크를 정리 하는 적절 한 플랫폼에 대 한 필요가 있다. 최근, 관심 3D 문화 시스템의 생산에서 나왔다 ('organoids,'로 널리 알려진 'spheroids,' 또는 '미니 두뇌') 휴대 및 매크로 수준에서 구조 하는 복잡 한 3 차원 (3D)를20 . 3D 문화 시스템은 일반적으로 결 석 하 또는 제한 된 일반적인 2D coculture 패러다임21,22동안 ECM 및 셀 상호 작용을 유지 합니다. 기술의 풍부한 3D 신경 spheroids23,,2425; 경작에 대 한 존재 그러나, 많은 긴 문화 기간 필요 (년 개월) 자연 개발 및 레이어 보존, 사용자 아주 작은 제어할 출력 전시.
여기, 우리가 설명 하는 체계적인 방법을 빠르게 하 고 지속적으로 여러 세포 유형 (사전 차별화 된 뉴런을 이다) 간의 bioengineer 신경 상호 작용 영역 cocultures ('소행성')26으로 셀을 조립 하 여 hPSCs에서 파생 된 는 정리 차원에서 인간의 특정 형태학 복잡. 이 고밀도 신경 시스템 균등 하 게 분산 된 신경 하위 시간이 지남에 성숙한 속성에 걸릴 하 고 상영 하거나 높은 처리량 방식에서 분석을 생성 합니다. 처음으로 인간의 이다 이러한 3D cocultures에서 시 냅 스 네트워크 버스트 활동 유도 대 한 설명 합니다. 또한,이 프로토콜은 다른 크기, CNS의 다른 지역 id에 지정 된 셀을 사용 하 고 여러 다른 종류의 세포로 원하는 상호 작용을 공부 하는 분야를 생성에 쉽게 적응.
프로토콜
1. 세포 문화 및 시 약 준비
참고:이 섹션에서는 프로토콜은 분화 프로토콜 (제 2)에 표시 되는 순서에 따라 작성 됩니다. 재료와 카탈로그 번호에 대 한 테이블의 자료 를 참조 하십시오.
-
세포 배양에 대 한 코팅된 접시를 준비 합니다.
- 세포 외 기질 (ECM) 코팅 솔루션 DMEM/F12 미디어 준비 1 mg/mL 재고 솔루션을 희석. Aliquot 희석된 ECM 솔루션 3 mL의 30 원뿔 관으로 재고 및 즉시-20 ° C에 저장 작업 솔루션에 대 한 80 µ g/mL의 농도 대 한 36 ml 전체 볼륨을 데리고 미리 냉장된 DMEM/F12 미디어의 33 mL에 ECM 주식의 3 mL을 resuspend.
- ECM 작업 솔루션 6-잘 셀 문화 판의 잘 당 1 mL 코트. 우물의 표면 완전히 포함 되도록 잘 당는 추가로 1 mL DMEM/F12 (필요한 경우) 추가 합니다. 코팅된 6 잘 세포 배양 배지를 사용 하기 전에 적어도 1 시간 동안 실내 온도에 앉아 수 있습니다.
참고: 코팅된 접시 수 있습니다 또는 저장 됩니다 인큐베이터에 4 ° C에서 최대 2 주 동안.
-
미디어 공식, 성장 요인, 그리고 작은 분자를 준비 합니다.
- 인간 만능 줄기 세포 (hPSC) 중간27의 500 mL를 준비 하려면 20 배와 제조 업체의 지침에 따라 500 x 보충을 추가 합니다.
- 신경 매체 (NM)의 500 mL를 준비 하려면 이전 상세한282 mg/mL의 최종 농도, 1 x 항생제/antimycotic 솔루션, 1 x B27 보충 또는 L-글루타민 보충과 DMEM/F12의 500 mL 병 1 x N2 보충의 헤 파 린을 추가 합니다.
- 10 m m를 준비 하기 (1, 000 x) 솔루션으로 키 니 아 제 억제 물 Y27632 (Y)의 재고, 버퍼링 하는 인산 염 (PBS)의 3 mL에 분말의 10 mg을 추가. 필터 소독, 약 수, 고-20 ° c.에 저장 미디어에 10 µ M 작업 농도에 사용 합니다.
- 준비는 20 m m (10, 000 x) 재고 SB431542의 솔루션, 디 메 틸 sulfoxide (DMSO)의 1.3 mL에 분말의 10 mg을 추가. 준비 2 m m (1, 000 x) DMH1의 솔루션을 재고, DMSO의 13.1 mL에 분말의 10 mg을 추가. 필터-20 ° c.에 각 솔루션을 저장 하 고 소독, 약 수, 2 µ M 작업 농도에서 각각를 사용 하 여 미디어 (NM + SB431542 + DMH1).
참고:이 프로토콜 권장 두 SB431542의 2 µ M 작업 농도 및 DMH1에 따라 우리의 관찰과 다른 사람들 로부터 보고서29 이 농도 효과적으로 hPSCs에서 신경 유도 촉진 한다는. 높은 농도 보고30도 있다. 또한, 대안 미디어, 그것은 또한 표시 되었습니다 작은 분자는 높은 신경 변환31에 대 한 필요 하지 않습니다. 따라서, 작업 농도 대체 셀 문화 환경에 따라 달라 집니다 그리고 최적 농도 개별 연구자에 의해 시험 되어야 한다. - 개별 100 µ g/mL를 준비 (10, 000 x) 표 피 성장 인자 (EGF) 섬유 아 세포 성장 인자-2 (FGF2)의 재고 솔루션 추가 PBS + 0.1 %BSA 10 mL에 각각의 1 밀리 그램. Aliquot EGF와 FGF2 50 µ L aliquots에 솔루션을 재고-80 ° c.에 저장 10 ng/mL 작업 농도에서 각각을 사용 하 여 미디어; 예를 들어, 추가 5 µ L EGF와 5 µ L FGF2 NM (NM + EGF + FGF2) 50 mL를.
- Doxycycline 염 (Dox)의 재고 솔루션을 준비, 먼저 파우더 100 mg/mL를 DMSO에 녹을-20 ° c.에 저장 추가 2 mg/mL를 만들기 위해 그것을 희석 (1, 000 x) PBS에-20 ° c.에서 저장소 솔루션을 재고 미디어; 2 µ g/mL 작업 농도에서 사용 예를 들어, 추가 50 µ L Dox NM (NM + Dox) 50 mL를.
참고:는 다시 녹고 후 솔루션을 고정 하지 마십시오.
2. 인간 유도 만능 세포 (hPSCs)에서 신경의 생성
참고: 모든 셀 문화는 37 ° c.에 5% CO2 배양 기에서 유지 되어야 한다 저수준 활용 될 수 있습니다 있지만 이러한 문화 방 산소 수준에서 유지 됩니다.
-
생성 하 고 hPSCs에서 사이토 창시자 (hAstros)를 유지 합니다.
참고:이 섹션에서는 간단한 및 단순화 된 분화 프로토콜. (Embryoid 몸 형성, 장미 선택과 지역 모방 단계) 자세한 내용은 앞에서 설명한 프로토콜28 (그림 1A, 곳곳에 녹색 상자)을 참조 하십시오.- 씨 잘 당 hPSC 매체 + Y 2 mL와 ECM 코팅 6 잘 플레이트 (단계 1.1 참조)에 (그림 1B) hPSCs의 클러스터. 줄기 세포를 약 50 %confluent 하 고 필요에 따라 분할 될 때까지 매일 피드.
- HPSCs 분할, 웰 스에 뿌리고 약 1 mL을 추가 하 고 5 분 동안 실내 온도에 1 분 품 셀 hPSC 매체의 1 mL에 추가 하 고 집계 1:10 잘 당 hPSC 매체 + Y 2 mL에 새로운 ECM 코팅 우물에 분할 발음.
- 때까지 그들은 약 50% 합칠 다음 변경 미디어 NM + SB431542 + DMH1 신경 차별화 (0 일)를 유도 하는 줄기 세포를 유지 합니다. 세포의 약 95%는 때 합칠, 동일한 매체의 새로운 ECM 코팅 웰 스 1:6 분할.
- 14 일에 초연 솔루션 및 집계의 형성을 촉진 하는 y-코팅 플라스 크에 세포 분열.
참고: Y의 추가 하지만 세포 생존 및 구체 형성 촉진을 활용 모든 피드 동안 포함 되지 않습니다. - 아래 설명 된 대로 신경 창시자와 뉴런 (hNeurons)의 생성에 대 한이 하루 14 셀을 사용 합니다. 또는 신경 성숙 발생 또는 gliogenesis 개시 전에 단층 또는 구체 문화에서 나중 시간 지점에서 이러한 셀을 사용 합니다.
참고: 기본적으로이 프로토콜 등 대뇌 피 질의 이다 생산. 그러나, 사이토 하위 지역 morphogens28,,3233바란다면 패턴의 추가 의해 지정할 수 있습니다. Retinoic 산 (RA) 척수로 셀 caudalize 하 고기, 소닉 더 헤지호그 (SHH), 동안 흐려져 주 작동 근 (SAG), 또는 purmorphamine 복 부 고기를 생산할 예정 이다 추가할 수 있습니다. - 사이토 창시자 이다 자발적으로 형성 된 3 차원 집계 (hAstrospheres)의 생성에 대 한 NM + EGF + FGF2 전환 하 고 이전 상세한34로 매주 (또는 pH를 안정 되도록 필요한)를 공급 합니다.
- 때 어두운 센터 표시 되 고 자연스럽 게 연결 하는 분야를 제거 부드럽게 분리 솔루션 hAstro 집계 해리. 휴식 영역 부드럽게 일주일에 한 번 구 건강을 유지 하 고 괴 사 성 코어를 피하기 위해.
참고: 분리 솔루션 치료의 5 분을 초과 하지 마십시오. - 확장의 4-6 개월을 확인 한 후 셀 정체성을 동결 (제조 업체의 지침)에 따라 cryopreservation 매체 또는 대체 스토리지 장기 보존을 위한 조건 액체 질소, 또는 즉시 사용 실험입니다.
- 때 어두운 센터 표시 되 고 자연스럽 게 연결 하는 분야를 제거 부드럽게 분리 솔루션 hAstro 집계 해리. 휴식 영역 부드럽게 일주일에 한 번 구 건강을 유지 하 고 괴 사 성 코어를 피하기 위해.
- HAstrospheres의 냉동된 주식, 해 동 신속 하 게 전송 콘텐츠는 빈 15 mL 원뿔 튜브, 그리고 1 분에 대 한 300 x g 에서 원심 분리기를 신중 하 게 상쾌한 발음, DMEM/F12로 씻어 두 세척의 총에 대 한 반복, 실내 온도에 유리병을 녹여 단계입니다. T25 플라스 크의 NM + EGF + FGF2 Y의 6 mL 전체 볼륨을 추가 (하거나 필요에 따라 최대 규모).
- 씨 잘 당 hPSC 매체 + Y 2 mL와 ECM 코팅 6 잘 플레이트 (단계 1.1 참조)에 (그림 1B) hPSCs의 클러스터. 줄기 세포를 약 50 %confluent 하 고 필요에 따라 분할 될 때까지 매일 피드.
-
생성 하 고 hPSCs에서 유도할 수 있는 신경 (iNeurons)를 유지 합니다.
- 씨 잘 (위에서 설명한 비 유전자 변형 라인에 대 한) 당 hPSC 매체 + Y 2 mL 6-잘 접시 ECM 코팅에 (와 함께 안정적인 doxycycline 유도할 수 있는 neurogenin 2 transgene35) 유전자 변형 hPSCs 그들은 70 %confluency 리프트 준비가 될 때까지 잘 당 매일 미디어의 2 개 mL를 피드. 2.1.2 단계에서 설명한 대로 셀을 분할 합니다.
- 때 세포는 약 35%, confluent NM + Dox iNeurons로 분화를 유도 하는 것을 추가. 3.2 단계로 진행 하기 전에 2 일 NM + Dox 단층 문화 유지.
참고: 셀 것 이다 신경 창시자로 전환 하지만 하지 않습니다 아직 확장 neurites (그림 1C).
3. 준비 및 3D 구체 Cocultures의 유지 보수
- HAstros (에서 설명한 대로 단계 2.1.5.1)에 3D 집계에서 해리
-
HNeurons 또는 iNeurons 2D 단층에서 해리.
- 6 잘 플레이트에서 미디어를 제거 하 고 각 잘 단층 문화를 분리 솔루션의 500 µ L를 추가 합니다. 5 분 부드럽게 2-3 mL DMEM/F12 연결 된 셀을 제거 하려면 추가 37 ° C에서 품 어.
- 셀과 1 분 Aspirate는 상쾌한에 대 한 300 x g 에서 원심 분리기에 15 mL 원뿔 튜브 미디어 수집 신선한 미디어의 1 mL을 추가 하 고 단일 세포 현 탁 액을 달성 하기 위해 1000 µ L micropipette와 부드럽게 위아래로 플라스틱.
-
양식 3D 분야 microwell 배양 배지를 사용 하 여입니다.
- Microwell 플레이트의 각 음을 방지 준수 헹 구는 해결책의 0.5 mL를 추가 하 여 접시를 준비 합니다. 2000 x g 5 분 Aspirate rinsing 솔루션에서 격판덮개 원심, 각 잘 세척 하 여 다시 발음을 DMEM/F12의 1 mL를 추가 합니다.
참고: 항상는 원심 분리기는 사용 하는 동안 균형을 확인 합니다. - 각 셀 형식을 hemocytometer 또는 자동화 된 셀 카운터를 사용 하 여 계산 합니다. NM + Y (Dox iNeurons 활용 하는 경우를 포함)의 2 개 mL의 총 볼륨의 각 음에 해리 hAstros, hNeurons 또는 iNeurons의 원하는 비율을 추가 합니다. 플레이트 3 분 100 x g 에서 원심 고 인큐베이터에 반환 합니다.
참고: 24 잘 microwell 접시 ( 테이블의 자료를 참조)에 잘 당 300 microwells 포함 되어 있습니다. 잘 당 미디어의 2 ml에서 (2 x 103 세포는 각각의 분야)에 대 한 6 x 105 셀의 최소 및 최대 (2 x 104 의 세포 각각의 분야)에 대 한 6 x 106 셀을 추가 합니다. 이 범위 내의 특정 밀도의 가능한 분야에 대 한 셀 정의 된 수량을 사용 하 고 300 구 당 셀의 수를 계산 하 여 분할. 원하는 경우 대체 영역 형성 방법 및 도구 또한 이용 될 수 있습니다. 셀 밀도의 허용 범위에 대 한 제조업체의 지침을 따릅니다. - (그림 2A) 다음 2 일 동안 microwell 접시에서 밀도가 포장된 분야에 자체 조립 셀 수 있습니다. 문화 yellowing 경우 50% 미디어를 교체 합니다.
참고: 절반 밖에 미디어를 교환 하 고 플라스틱 부드럽게 제거 하 고 미디어 분야를 방해 하기 위하여 추가 하는 경우. 분야는 microwells에서 들어올려 고 높은 힘 함께 융합할 수 있습니다. - 2 일 후, 부드럽게 1000 µ L micropipette (그림 1D)와 microwells에서 분야를 제거 합니다. 가볍게 어떤 추가 준수 분야를 제거 하려면 미디어와 microwells의 바닥에 힘을 적용 합니다. 분야 15 mL 원뿔 튜브에 정착, 올드 미디어, 발음 및 신선한 미디어를 추가 하자.
- Microwell 플레이트의 각 음을 방지 준수 헹 구는 해결책의 0.5 mL를 추가 하 여 접시를 준비 합니다. 2000 x g 5 분 Aspirate rinsing 솔루션에서 격판덮개 원심, 각 잘 세척 하 여 다시 발음을 DMEM/F12의 1 mL를 추가 합니다.
-
3D 분야를 형성을 위한 회전자 플라스 크 생물 시스템을 설정 합니다.
- 70% 에탄올과 자기 저 판의 표면을 청소, 셀 문화 인큐베이터에 배치. 오토 클레이 브 소독 개별 스피너 플라스 크입니다.
- 각 회전자 플라스 크를 최소 50-60 mL 미디어 분야 추가 (그림 1D, 삽입). 60 rpm 설정 마그네틱 저 어 접시에 플라스 크를 놓습니다. 그들은 데이터 컬렉션에 대 한 준비가 될 때까지 회전자 플라스 크에 분야를 문화.
참고: 최소 3 주 문화에서 시 냅 스 형성 필요 합니다. 스피너 플라스 크 생물 시스템 적절 하지 분야 세포 배양 플라스 크 또는 접시에 고정 조건에서 배양 수 있습니다. 분야 또한 ECM 또는 히드로 포함 될 수 있습니다.
4. Multielectrode 배열 (MEAs)와 라이브 시 냅 스 생리학의 측정
-
MEAs 세포 배양에 대 한 준비.
- 1 헤 살 균 이온 (DI) 물, 린스에 대 한 세제의 1 mL와 함께 각 MEA의 깨끗 한 표면 소독, 70% 에탄올으로 씻어 고 biosafety 캐비닛 UV 빛의 밑에 건조 한 공기.
참고: MEAs 저장할 수 있습니다 메 마른 조건 하에서 4 ° C에서 디 물에 사용까지. - 붕 소의 산 성 버퍼의 100 mL으로 PLO의 50 밀리 그램을 용 해 하 여 폴 리-ornithine (PLO)의 0.5 mg/mL 해결책을 준비 합니다. 코트 표면 친수성 렌더링 및 4 h. 제거 PLO의 최소 37 ° C에서 품 어, 디 물 표면 세척, ECM의 1 mL을 추가 하는 PLO의 1 mL와 함께 각 MEA의 표면 (단계 1.1.1 참조), 그리고 4 h의 최소 37 ° C에서 품 어.
- ECM을 제거 하 고 1.5 ml MEA 표면에, 분야는 전극 배열 위에 위치를 보장 미디어의 분야를 배치 (그림 3A, 3A'). 2 일에 대 한 준수를 허용 합니다. 미디어 2-3 일 마다 (또는 더 자주 필요한 경우), 영역을 방해 하지는 보장의 절반을 변경 합니다.
참고: 문화 생존과 성숙 성장 요인의 추가 향상 시킬 수 있습니다.
- 1 헤 살 균 이온 (DI) 물, 린스에 대 한 세제의 1 mL와 함께 각 MEA의 깨끗 한 표면 소독, 70% 에탄올으로 씻어 고 biosafety 캐비닛 UV 빛의 밑에 건조 한 공기.
-
신경 분야의 전기 활동을 측정 합니다.
- 온도 제어 headstage와 multielectrode 배열 (MEA) 시스템을 설정 합니다. 5 Hz 하이-패스 필터 및 200 Hz 저역 통과 필터와 스파이크 임계값 5 x 표준 편차 (SD)의 소프트웨어 프로그램을 만듭니다.
- Headstage 및 기록 자발적인 전기 활동 (그림 3BB')에 MEA를 놓습니다. 스파이크 주파수와 진폭 통계 분석을 포함 하 여 원시 데이터를 저장 합니다.
참고: 관류 시스템 MEA 약리 에이전트를 추가 하거나 장기 기록에 대 한 신선한 미디어의 흐름을 증가 함께 활용 될 수 있습니다. 원하는36,37로 스파이크의 추가 후 처리를 수행할 수 있습니다.
5입니다. Immunocytochemistry와 시 냅 스 밀도의 측정
-
시 약을 준비 합니다.
- 4 %paraformaldehyde (PFA)의 500 mL 재고 솔루션으로 만들기 위해 유리 비 커 또는 통풍된 후드에 저 어 플레이트 1 x PBS의 400 mL를 추가 합니다. 저 어 바 및 열 교; 동안 60 ° C를 추가 끓여 야 하지 않습니다. 열띤 PBS 솔루션 PFA 가루 20 g을 추가 하 고 천천히 dropwise 1 N NaOH를 추가 하 여 pH 6.9 인상.
참고: 4 %PFA 솔루션 수 aliquoted 4 ° C에서 저장까지 한 달 동안. - 20 g 또는 자당의 30 g 각각 20%와 30%의 자당, 솔루션을 만들기 위해 PBS의 100 mL를 추가 합니다.
- 10% 재고 솔루션을 준비 하는 PBS의 10 mL를 세제의 1 mL를 추가 합니다. 균질을 여러 번 반전.
- 10 mL PBS 기본 차단 버퍼를 준비 하 게 250 µ L 10% 세제 재고 솔루션 (0.25%의 최종 농도)의 500 µ L 각의 염소와 당나귀 세럼 (최종 농도 5%)를 추가 합니다.
- 10 mL PBS 보조 블로킹 버퍼를 준비를 100 µ L 각의 염소와 당나귀 세럼 (최종 농도 1%)를 추가 합니다.
- 4 %paraformaldehyde (PFA)의 500 mL 재고 솔루션으로 만들기 위해 유리 비 커 또는 통풍된 후드에 저 어 플레이트 1 x PBS의 400 mL를 추가 합니다. 저 어 바 및 열 교; 동안 60 ° C를 추가 끓여 야 하지 않습니다. 열띤 PBS 솔루션 PFA 가루 20 g을 추가 하 고 천천히 dropwise 1 N NaOH를 추가 하 여 pH 6.9 인상.
-
샘플을 준비 합니다.
- 15 mL 원뿔 튜브에 영역을 전송 하 고, 튜브의 하단에 정착 하도록 허용 오래 된 미디어를 발음. 린스 500 µ L의 PBS, 정착, 그리고 PBS를 발음 하 게 된 분야. 500 µ L 4의 추가 %PFA (또는 분야를 커버 하는 이젠 그만) 및 30 분 동안 4 ° C에서 품 어.
- PFA 발음 하 고 부드럽게 PBS와 두 번 씻어. 20% 자당 해결책을 추가 하 고 몇 시간 동안 4 ° C에서 품 어 나 밤새. 신중 하 게 발음, 30% 자당 해결책을 추가 하 고 몇 시간 동안 4 ° C에서 품 어 나 밤새.
참고: 샘플 저장 됩니다 PBS 또는 자당에서 4 ° C에서 최대 1 주일 다음 단계로 진행 하기 전에. 그렇지 않으면, 1.5 mL 튜브에 3D 분야 (그림 4A-C)로 유지 자국과 5.3 단계로 진행. - 구체를 자르는 경우 드라이 아이스 위에 포함 저온 금형 분야 전송 신중 하 게. 30% 자당 해결책을 발음 하 고 천천히 부 어 완전히 피하 공기 방울 샘플을 커버 때까지 금형에 솔루션을 포함 하는 조직. 솔루션 동결 cryostat 칼 자국까지-80 ° C에서 저장 될 때까지 기다립니다.
- -20 ° C, 30 µ m 섹션으로 (또는 원하는) 임베디드 블록 조각과 유리 슬라이드에 한 cryostat 사용 하. 얼룩 준비까지-80 ° C에 저장 합니다.
-
Immunostain 구체.
- 액체 흘림을 방지 하기 위해 소수 PAP 펜으로 슬라이드의 가장자리를 설명 합니다. 항 체 ( 테이블의 자료참조)와 함께 기본 및 보조 차단 솔루션을 준비 합니다. 각 슬라이드 또는 튜브 기본 차단 버퍼의 500 µ L을 추가 하 고 30 분 동안 실 온에서 품 어.
- 액체를 제거, 각 슬라이드 또는 튜브, 희석된 주 항 체와 신선한 기본 차단 버퍼의 500 µ L을 추가 하 고 하룻밤 4 ° c.에 품 어 1 차적인 항 체 솔루션을 제거 하 고 씻어 10 분에 대 한 PBS 가진 3 배.
- 각 슬라이드 또는 튜브를 희석된 2 차 항 체로 차단 보조 버퍼의 500 µ L을 추가 하 고 1 h. 이차 항 체 솔루션을 제거 하 고 10 분에 대 한 PBS 가진 3 배 세척 4 ° C에서 품 어.
참고: 권장된 항 체 목록 자료의 테이블에에서 제공 됩니다. 다른 항 체 또는 염료를 사용할 수 있습니다으로 원하는. 형광 샘플 (5.3.3 단계 이후) 빛에 노출 하지 마십시오. - Dropwise 표면 신중 하 게 배치 하는 coverslip 거품을 피하고, 슬라이드를 통해 솔루션을 장착의 50 µ L를 추가 합니다. 슬라이드를 24 시간 실 온에서 건조 하 고 4 ° c.에 저장 허용
-
슬라이드 이미지.
- X 기름 침수 목표 이미지 사전 및 포스트 시 냅 스 단백질 풍부와 영역 조각 (그림 4D) 내의 colocalization 63와 또는 2 광자 공초점 형광 현미경을 사용 합니다. X 20 또는 40 X 목적에 사용 하 여 시각화 형태학 상 특징은 hAstros의.
- ImageJ 소프트웨어와 오픈 형광 이미지 파일입니다. 사전 및 사후 시 냅 스 puncta 이전 상세한38또는 다른 방법으로는 편견된 계산 방법을 사용 하 여 플러그인, 셀 카운터를 사용 하 여 수동으로 계산 합니다.
결과
제대로 수행 하는 경우이 프로토콜으로 이다28,33,34 와 뉴런35 (그림 1A-1C), hPSCs에서 생성 된 기능 cocultures의 정의 된 인구를 생산할 예정 이다 26 이전 상세 하 고 여기에 설명 된 단계 2.1-2.2. 이 단계적 절차, microwell 접시를 사용 하 여 일관성 있는 크기와 모양 (단계 3.3;의 3D 신경 분야를 얻을 것으로 예상 된다 그림 1D) 균등 하 게 분산 된 세포와 세포 죽음의 중요 한 표시 없이. 시작 셀 밀도, 세포 유형의 원하는 비율의 범위는 다양 한 크기의 구체를 생산할 예정 이다. Microwell 플레이트의 부재에서 셀 형태로 상당히 크고 비균일 집계 확산의 한계를 능가 하는 (> 2 mm)의 직경을 결합할 것 이다 (그림 2A-2B). 그것은 회전자 플라스 크 또는 생물 반응 기를 사용 하 여 분야 중 균일성을 유지 하 고 퓨전 (단계 3.4; 감소 예상 그림 2C)입니다. 그러나, 스피너 플라스 크 주에 대 한 분야의 문화에 대 한 허용, 그들의 사용 필요 하지 않습니다.
안정 electrophysiological 분석에 대 한 cocultures, ECM을 흉내 낸 기판 분야의 3 차원 구조를 유지 하면서 쉽게 준수 허용 (그림 3A, 3A'). 녹음 하는 동안 MEAs에 iNeurons의 건강 분야 자발적으로 일관 된 발사 주파수 (단계 4.1-4.2; ± 40 µ V 보다 큰 전압 스파이크 이끌어내는 것입니다. 그림 3B -C, 3 층)입니다. Coculture 분야는 hAstros, 스파이크 (그림 3B'-3 C')의 동기 네트워크 파열의 증가 결과로의 존재와 함께 더 큰 네트워크 연결을 표시 하는으로 예상 된다. CNQX35,,3940는 postsynaptic AMPA 수용 체 길 항 제, 응용 프로그램 coculture 분야에서 네트워크 버스트 synchrony 감소 (그림 3D'-3E').
신경 세포 유형 제한 단백질 마커 균등 하 게 분산된 배치와 이다와 3D 분야에서 뉴런의 성숙에 시각적으로 보여 줍니다. 사이토 형태학 및 분기의 최대 투영 대표적인 3D 구체 hAstros 띄엄띄엄 막 도약 GFP와 함께 표시 그림 4A 에 표시 됩니다. 성숙한 hAstros 익스프레스 마커 GFAP (그림 4B), S100B, 및 Glt1를 포함 하 여34, hNeurons 및 iNeurons 익스프레스 microtubule 관련 단백질 2 (MAP2; 그림 4C) 그리고 tubulin 베타 3 (Tuj1/TUBB3). 마지막으로, iNeurons Synapsin 1 (Syn1)와 호머 또는 PSD95, 각각 포함 하는 사전 및 포스트 시 냅 스 단백질을 표현, 하지만 시 냅 스 밀도 coculture (그림 4D)26에 hAstros의 존재에 의해 크게 향상 됩니다. 가능한 경우, 두뇌 기술와 빛 시트 현미경의 대체 사용 그대로 분야의 급속 한 영상 수 있게 된다.
함께 찍은, 자발적인 전기 활동 함께 성숙한 신경 마커 표현 기능 시 냅 스 칩의 3D cocultures 생산에 위에 상세한 프로토콜의 성공을 확인 합니다.
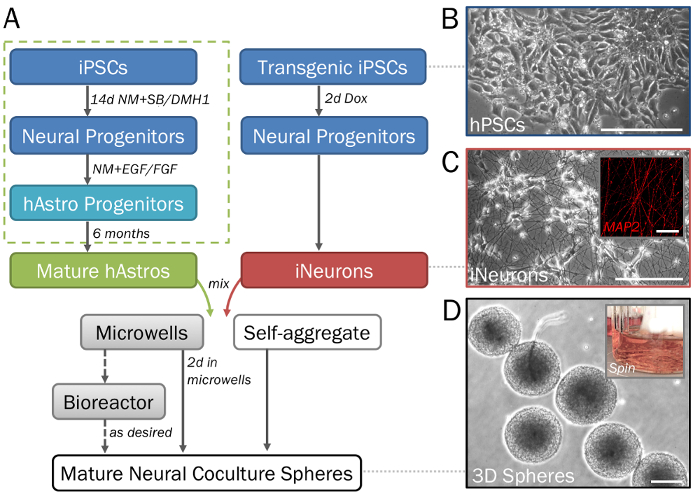
그림 1: 분화의 Stepwise 묘사와 3D 신경 분야의 hPSCs에서 파생 된. 주요 단계는 프로토콜에서의 타임 라인 (A). 신경 세포의 (B) 순수한 인구 인간 유도 만능 줄기 세포 (hPSCs)에서 생성 될 수 있습니다. 사이토 창시자 (녹색 점선된 상자)의 세대, 단계 2.1로 Ref28참조. (C) 유도할 수 있는 신경 (iNeurons; 참조 섹션 2.2) neurogenin 2의 유도 overexpression 통해 유전자 변형 hPSCs에서 생성 된 2D ECM (7 일)에 신경 형태 고 MAP2에 대 한 긍정적인 (삽입). (D) 분야 (단계 3.1-3.3 참조) microwell 플레이트에서 제거 높은 처리량 검열에 대 한 일관성 있는 크기를 보여 줍니다. 분야 스피너 플라스 크 생물에 경작 될 수 있습니다 (삽입; 단계 3.4 참조) 퓨전을 방지 하기 위해 원하는 경우. 눈금 막대 50 µ m = (C, 삽입). 스케일 바 = 200 µ m (A, D). 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
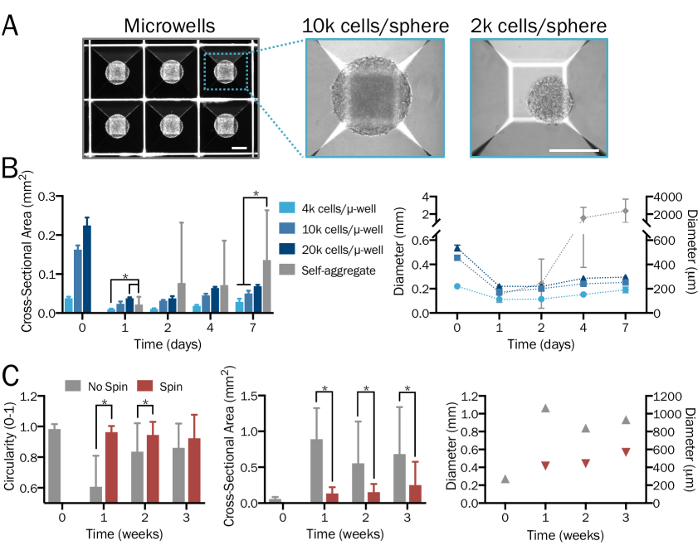
그림 2: bioengineered 3D 신경 분야의 체계적이 고 재현 가능한 세대. (A) Microwell (µ-잘) 배양 배지는 체계적이 고 사용자가 지정한 방식으로, 일관성 있는 크기와 모양 저조한 원하는 밀도 및 신경-사이토 비율의 3D 신경 분야를 형성 하는 데 사용 됩니다. 이미지 영역 형성 후 1 일 표시 됩니다. 스케일 바 = 200 µ m. (B) 다양 한 크기의 구체를 생성 하는 시작 (4 x 103 2 x 104 의 세포 microwell 당)에서 셀 밀도의 범위. HPSCs 양식 상당히 크고 비균일 집계 일주일 후 보급의 한계를 능가 하는 그 직경을 결합 하는 microwell 접시의 부재에서 (n = 그룹 시간 포인트 당 6-14 분야). (C) iNeuron 분야 80 rpm에서 스피너 플라스 크에서 경작 덜 퓨전을 전시 하 고 따라서 훨씬 작은 했다, 3 주 기간 동안 고정 된 문화에 비해 더 많은 유니폼, 그리고 전시 더 큰 순환 (n = 6-51 그룹 및 시간 포인트 당 분야)입니다. 플롯 대표 평균 ± SD; 두 꼬리 t를 사용 하 여 결정 하는 그룹 사이 (p < 0.05) 의미를 나타냅니다-테스트. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
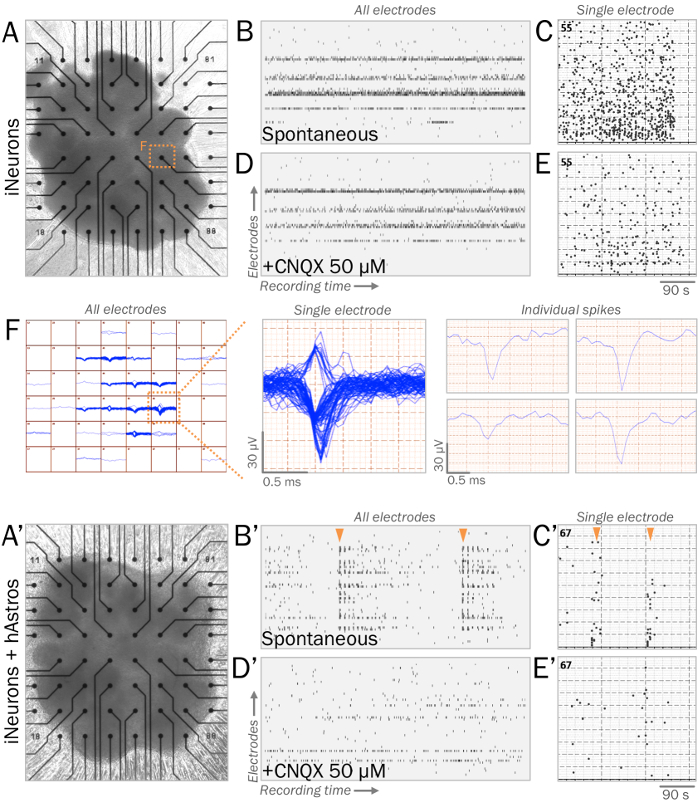
그림 3: multielectrode 배열 (MEAs)에 신경 분야의 대표적인 라이브 시 냅 스 생리학. (A, A') MEAs 라이브 시 냅 스 생리학 신경 분야의 측정에 활용 됩니다. INeurons (A) 또는 iNeurons 및 hAstros의 cocultures의 분야 (A') MEA (단계 4.1 참조) ECM을 흉내 낸 기판 표면에 경작 될 수 있다. (B, B') 래스터 대표 자발적인 전기 활동 기록 창 (수평 축) 동안 모든 전극 (세로 축)에 걸쳐 측정의 플롯 합니다. Coculture 분야 (B') 동안 표시 neurophysiological 기저 중간41, iNeuron 분야 (B)에 문화 자발적인 스파이크, 계시 된 네트워크 버스트 동기 발사 패턴 (주황색 화살표)의 4 주 후 (C, C') 스파이크의 히스토그램 대표적인 전극에서 MEA 녹음 창 동안 측정. (D, D') 자발적인 전기 활동의 래스터 플롯 50 µ M CNQX는 AMPA 수용 체 길 항 제 (B, B'로 같은 시간 규모)의 신청 후 모든 전극에서 측정. CNQX cocultures에서 관찰 하는 스파이크의 동기 파열의 존재를 제거 (D'). (E, E') 스파이크의 히스토그램 50 µ M CNQX 응용 프로그램 후 대표적인 전극에서 MEA 녹음 창 동안 측정 (같은 시간 규모에 c, C'). (F) (왼쪽) 동안 모든 전극에서 iNeuron 분야의 스파이크 경시의 지도. 여러 클러스터 된 흔적 (가운데); 시간이 지남에 표시 실증 단일 전극 개별 스파이크 흔적을 정렬 하 고 개별적으로 분석 수 (오른쪽). 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
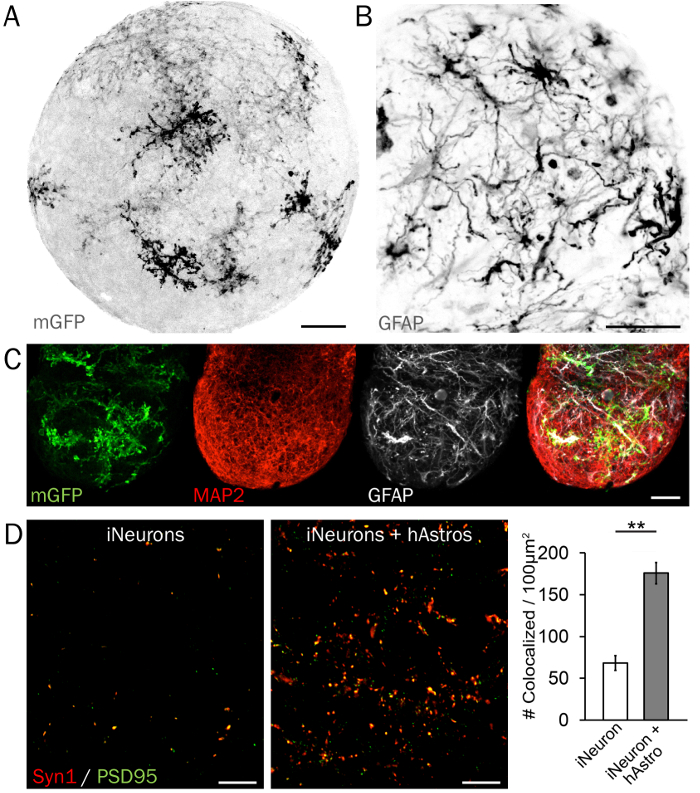
그림 4: 시 냅 스 칩의 특성 immunohistochemistry. (A) 막 도약 GFP (mGFP) 기자는 배열 3D 신경 분야에서 hAstros의 형태를 검사 하는 데 유용. (B) hAstros hPSCs에서 분화 GFAP 양성입니다. HAstros 및 iNeurons를 포함 하는 (C) 분야 구상 될 수 있다 그리고 GFAP MAP2 등 셀 유형 제한 단백질 마커를 사용 하 여 분석. 바 규모 50 µ m. (D) 대표 이미지의 사전 및 사후 시 냅 스 밀도 = (Syn1와 PSD95, 각각) (왼쪽) 없이 iNeurons의 분야에서 (오른쪽)와 cocultured hAstros와. Colocalized Syn1와 PSD95의 크게 증가 밀도 하루 35, 시 냅 스의 형성을 유발 하는 hAstros의 기능을 보여주는 iNeuron 분야에 비해 coculture 분야에서 관찰 되었다 (n = 3 독립적인 복제 각; Ref에서 증 쇄 하는 데이터 26 허가)입니다. 스케일 바 = 10 µ m. 플롯 나타냅니다 평균 ± SEM; 중요 한 차이 (* p < 0.05;를 나타냅니다 * * p < 0.01 나타냅니다) 그룹 사이 양측 t를 사용 하 여 결정 했다-테스트. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
토론
이 프로토콜에서 우리는 신경 cocultures의 3D 분야의 생산을 위한 체계적인 방법을 설명합니다. 분야 이다와는 독립적으로 파생 hPSCs에서 뉴런으로 구성 됩니다. 비록 하지이 프로토콜의 초점, 이다 hPSCs28 에서 순수한 인구의 세대는 중요 한 단계 이며 사전 경험 없이 수행 하는 경우에 기술적으로 도전적 일 수 있다. 이러한 시 냅 스 칩의 세대에서이 첫 번째 단계는 세심 한 타이밍 및 세부 사항에 주의로 수행 되어야 한다. HPSC에서 파생 된 이다의 사용의 한계는 긴 차별화 과정; 그러나 미래에 대 한 동결 수 있습니다 셀의 대량 생산 사용 하 고에서 해 동 하는, 실험의 시간 (단계 2.1.5 참조) 하지 않아도 초기 hPSC 단계에서 프로세스를 시작. 두 특성 명과12,35의 존재에 의해 현저 하 게 향상 된 유전자 변형 hPSCs에서 생성 된 iNeurons synaptogenic는 하 고 있지만 자발적인 postsynaptic 전기 전류를 전시 하는 기능이 있다,- 이 프로토콜에 자세히는 hAstros를 포함 하 여. 따라서, 세포 유형, 번호, 및 발달 단계 또는 만기의 선택이이 프로토콜의 중요 한 구성 요소 이며 조정 전기 활동 또는 냅 시각화에 변화가 발생할 수 있습니다 주목 되어야 한다. 그러나,이 프로토콜 또한 셀 밀도의 비율 조작 가능한 조건 또는 개별 연구에서 결과의 유연성을 반영 하는 방식으로 허용 합니다.
위에서 설명한 대로 우리 공학 도구 활용 신경 organoid 방법42,43,이 시스템의 자기 조직화와 레이어 링 고기를 정리 하지 않습니다 경고와 대안을 생산 하 될 수 있는 organoids20,44원하는. Microwell 문화 접시26 , 스피너 플라스 크 생물45,46 의 동시 사용 보장 재현성, 따라서 생산 뿐만 아니라 검사와 신경 칩의 분석 간소화 세포 배양 분석 실험의 다양 한 스피너 플라스 크 또는 생물 반응 기의 사용은 선택 사항, 비록 가까운 접촉에서 분야의 고정 문화 그들의 융합 함께, 따라서 제한 영양분과 산소는 센터에 보급의 한계 저쪽에 발생할 수 있습니다는 강조 한다 분야47 특히, 3D 인쇄 미니-생물 반응 기를 사용 하 여 큰 bioreactors46에 비해 더 높은 처리량 방법으로 보고 되었습니다.
시 냅 스 형성을 측정 하는 전통적인 도구 등 생리 적 방법 같은 전체 셀 패치 클램핑, MEAs36,,4849, 칼슘50영상. 여기, 우리는 짧은 시간 규모에 대 한 간단 하 고 높은 처리량 검사 분야에서 전기 활동의 제공으로 MEAs의 사용을 설명 하기 위해 선택 합니다. 그러나, 다른 기술도 활용 수 있습니다.
이 프로토콜에서 microwell 플레이트의 사용의 한계는 분야 (~ 300) 및 분야 당 셀의 최대 수 (2 ~ 10 배4)는 각 잘에서 허용 됩니다. 증가 숫자; 대체 영역 형성 도구를 사용할 수 있습니다. 그러나, 높은 셀 수 시작 점에서 필요한 것입니다. 24 잘 포맷 될 수 있는 분석에 대 한 처리 및 표시 눈, 분야의 센터 내 세포 죽음을 제한 하는 동안 더 큰 구체를 생성 하는 기능에 대 한 여기 선정 되었다. 전반적으로,이 단계는 프로토콜의 추가 균일 한 3D 분야의 강력 하 고 확장 가능한 생산을 보장 합니다.
우리의 프로토콜 또한 수와 각 세포 유형의 비율 뿐만 아니라 3D 분야에 제어, 정의 된 방식으로 하는 다른 세포 유형 도입의 가능성을 조정의 유연성을 자랑 합니다. 지역별 신경 및 사이토 하위 사용 하 여 중앙 신경 시스템의 다른 영역의 시 냅 스 칩의 연구를 허용합니다. 이러한 coculture 분야 수 융합 함께51 셀룰러 마이그레이션 및 장거리 신호를 공부 하. Oligodendrocytes, 내 피 세포, 또는 microglia의 증가 복잡성이 메서드에 대 한 유망한 미래 방향으로 유익한 뇌 모델 이러한 3D 분야를 증명할 수 있습니다. 마지막으로, 질병 및 상해 모델링,이 시스템 치료 접근, 세포 대체 요법 또는 neuroregeneration를 향상 시키기 위해 약물 개발 등의 연구를 허용 합니다.
공개
저자는 공개 없다.
감사의 말
우리는 박사 마이클 워드 (NIH)에 대 한 기술적인 조언 iNeuron 차별화, 그리고 사바 Barlas 예비 이미지 분석에 대 한 이러한 절차의 디자인에 지적 입력을 위한 박사 에릭 Ullian (UCSF)를 감사 하 고 싶습니다.
자료
| Name | Company | Catalog Number | Comments |
| 6 well plate | Fisher Scientific | 08-772-1B | |
| 15 mL conical tubes | Olympus Plastics | 28-101 | |
| Accutase | Sigma | A6964-100ML | Detachment solution |
| AggreWell plate | Stemcell Technologies | 34850 | |
| Anti-Adherence Rinsing Solution | Stemcell Technologies | 7010 | Prevent cell adhesion to microwell plates |
| Anti/anti | Thermofisher | 15240062 | |
| B27 | Thermofisher | 17504044 | Media Supplement |
| BrainPhys neuronal medium | Stemcell Technologies | 5790 | Neurophysiological basal medium alternative |
| Circular glass coverslips | Neuvitro | GG-12-oz | |
| Cryostor CS10 | Stemcell Technologies | 7930 | Cryopreservation medium with 10% DMSO |
| DMEM/F12 | Thermofisher | 10565-042 | With GlutaMAX supplement |
| DMH-1 | Stemcell Technologies | 73634 | HAZARD: Toxic if swallowed. Working concentration: 2 μM |
| Donkey serum | Lampire Biological Laboratories | 7332100 | Working concentration: 5% in primary blocking buffer, 1% in secondary blocking buffer |
| Doxycycline Hydrochloride (Dox) | Sigma | D3072-1ml | HAZARD: Toxic for pregnant women. Working concentration: 2 μg/mL |
| Epidermal growth factor (EGF) | Peprotech | AF-100-15 | Working concentration: 10 ng/mL |
| Fibroblast growth factor-2 (FGF) | Peprotech | 100-18B | Working concentration: 10 ng/mL |
| Fluoromount-G mounting solution | Southern Biotech | 0100-01 | |
| Glass slides | Fisherbrand | 22-037-246 | |
| Goat serum | Lampire Biological Laboratories | 7332500 | Working concentration: 5% in primary blocking buffer, 1% in secondary blocking buffer |
| Hemacytometer or automatic cell counter | Life Technologies | AMQAX1000 | |
| Heparin | Sigma | H3149-50KU | Working concentration: 2 mg/mL |
| Magnetic plate | DLAB | 8030170200 | |
| Matrigel membrane matrix | Corning | 354230 | ECM coating solution. Working concentration: 80 μg/ml. Prepare on ice and ensure that pipettes, tubes, and media are pre-chilled. |
| MEA 2100 System | Multichannel Systems | MEA2100 | |
| Mounting solution | |||
| N2 | Thermofisher | 17502048 | Media Supplement |
| OCT | Tissue-Tek | 4583 | Tissue embedding solution for cryosectioning |
| Pap Pen (Aqua Hold) | Scientific Device Laboratory | 9804-02 | |
| Paraformaldehyde (PFA) | Acros Organics | 169650025 | HAZARD: Toxic if inhaled. Working concentration: 4% in PBS |
| Phosphate buffered saline (PBS) | Stemcell Technologies | CA008-300 | |
| Poly-l-ornithine (PLO) | Sigma | P3655-100MG | Working concentration: 0.5 mg/mL |
| Rectangular glass cover slips | Fisherfinest Premium Superslip | 12-545-88 | |
| ReLeSR | Stemcell Technologies | 5872 | Detachment and passaging reagent |
| Rho-Kinase Inhibitor Y27632- (Y) | Tocris | 1254 | Working concentration: 10 uM |
| SB431542 | Stemcell Technologies | 72234 | Working concentration: 2 μM |
| Spinner flasks | Fisher Scientific | 4500-125 | |
| Sucrose | Fisher Chemical | S5-3 | Working concentration: 20% or 30% in PBS |
| T25 Culture Flask | Olympus Plastics | 25-207 | Vented caps |
| T75 Culture Flask | Olympus Plastics | 25-209 | Vented caps |
| Terg-A-zyme | Sigma | Z273287-1EA | Detergent. Working concentration: 1% |
| TeSR-E8 basal medium | Stemcell Technologies | 5940 | Human pluripotent stem cell (hPSC) medium |
| TeSR-E8 supplements | Stemcell Technologies | 5940 | Supplements for human pluripotent stem cell medium |
| TritonX-100 | Sigma | X100-500ML | Detergent for cell permeabilization. Working concentration: 0.25% in blocking buffer |
| Trypan blue | Invitrogen | T10282 | |
| Antibodies | |||
| AlexaFluor 488 | Thermofisher | A-11029 | Secondary antibody |
| AlexaFluor 594 | Thermofisher | A-11037 | Secondary antibody |
| Ezrin | Thermofisher | MA5-13862 | Primary antibody; astrocytes perisynaptic |
| GFAP | Chemicon | MAB360 | Primary antibody; astrocytes |
| GFP | Aves | GFP-1020 | Primary antibody; astrocytes |
| Glt1 | Gift from Dr. Jeffrey Rothstein | n/a | Primary antibody; astrocytes |
| Homer | Synaptic Systems | 160 011 | Primary antibody; neurons, post-synaptic |
| MAP2 | Synaptic Systems | 188 004 | Primary antibody; neurons |
| PSD95 | Abcam | ab2723 | Primary antibody; neurons, post-synaptic |
| S100 | Abcam | ab868 | Primary antibody; astrocytes |
| Synapsin 1 | Synaptic Systems | 106 103 | Primary antibody; neurons, pre-synaptic |
| TuJ1/β3-tubulin (TUBB3) | Covance | MMS-435P | Primary antibody; neurons |
참고문헌
- Ullian, E. M., Christopherson, K. S., Barres, B. A. Role for Glia in Synaptogenesis. Glia. 47, 209-216 (2004).
- Baldwin, K. T., Eroglu, C. Molecular mechanisms of astrocyte-induced synaptogenesis. Current Opinion in Neurobiology. 45, 113-120 (2017).
- Molofsky, A. V., et al. Astrocyte-encoded positional cues maintain sensorimotor circuit integrity. Nature. 509 (7499), 189-194 (2014).
- Sultan, S., et al. Synaptic Integration of Adult-Born Hippocampal Neurons Is Locally Controlled by Astrocytes. Neuron. 88, 957-972 (2015).
- Clarke, L. E., Barres, B. A. Emerging roles of astrocytes in neural circuit development. Nat Rev Neuroscience. 14 (5), 311-321 (2013).
- Cheung, G., Sibille, J., Zapata, J., Rouach, N. Activity-Dependent Plasticity of Astroglial Potassium and Glutamate Clearance. Neural Plasticity. , 109106 (2015).
- Ghezali, G., Dallerac, G., Rouach, N. Perisynaptic astroglial processes dynamic processors of neuronal information. Brain Struct Funct. 221, 2427-2442 (2016).
- Kimelberg, H. K., Nedergaard, M. Functions of Astrocytes and their Potential As Therapeutic Targets. Neurotherapeutics. 7, 338-353 (2010).
- Pál, B. Astrocytic Actions on Extrasynaptic Neuronal Currents. Frontiers in Cellular Neuroscience. 9, 474 (2015).
- Kiray, H., Lindsay, S. L., Hosseinzadeh, S., Barnett, S. C. The multifaceted role of astrocytes in regulating myelination. Experimental Neurology. 283, 541-549 (2016).
- Allen, N. J., Eroglu, C. Cell Biology of Astrocyte-Synapse Interactions. Neuron. 96 (3), 697-708 (2017).
- Krencik, R., van Asperen, J. V., Ullian, E. M. Human astrocytes are distinct contributors to the complexity of synaptic function. Brain Research Bulletin. 129, 66-73 (2017).
- Ullian, E. M., Sapperstein, S. K., Christopherson, K. S., Barres, B. A. Control of Synapse Number by Glia. Science. 291, 657-662 (2001).
- Oberheim Bush, N. A., Nedergaard, M. Do Evolutionary Changes in Astrocytes Contribute to the Computational Power of the Hominid Brain?. Neurochemical Research. 42 (9), 2577-2587 (2017).
- Han, X., et al. Forebrain Engraftment by Human Glial Progenitor Cells Enhances Synaptic Plasticity and Learning in Adult Mice. Cell Stem Cell. 12 (3), 342-353 (2013).
- Inoue, H., Nagata, N., Kurokawa, H., Yamanaka, S. iPS cells: a game changer for future medicine. The EMBO Journal. 33 (5), 409-417 (2014).
- Shi, Y., Inoue, H., Wu, J. C., Yamanaka, S. Induced pluripotent stem cell technology a decade of progress. Nature Reviews Drug Discovery. 16 (2), 115-130 (2017).
- Dodla, M. C., Mumaw, J., Stice, S. L. Role of astrocytes, soluble factors, cells adhesion molecules and neurotrophins in functional synapse formation: implications for human embryonic stem cell derived neurons. Stem Cell Res Ther. , 251-260 (2010).
- Krencik, R., Ullian, E. M. A cellular star atlas: using astrocytes from human pluripotent stem cells for disease studies. Frontiers in Cellular Neuroscience. 7, 1-10 (2013).
- Pasca, S. P. The rise of three-dimensional human brain cultures. Nature. 553 (7689), 437-445 (2018).
- Huch, M., Knoblich, J. A., Lutolf, M. P., Martinez-arias, A. The hope and the hype of organoid research. Development. 144, 938-941 (2017).
- Mason, J. O., Price, D. J. Building Brains in a Dish: Prospects for Growing Cerebral Organoids from Stem Cells. Neuroscience. 334, 105-118 (2016).
- Kelava, I., Lancaster, M. A. Dishing out mini-brains: Current progress and future prospects in brain organoid research. Developmental Biology. 420 (2), 199-209 (2016).
- Kelava, I., Lancaster, M. A. Stem Cell Models of Human Brain Development. Cell Stem Cell. 18 (6), 736-748 (2016).
- Sloan, S. A., et al. Human Astrocyte Maturation Captured in 3D Cerebral Cortical Spheroids Derived from Pluripotent Stem Cells. Neuron. , 779-790 (2017).
- Krencik, R., et al. Systematic three-dimensional coculture rapidly recapitulates interactions between human neurons and astrocytes. Stem Cell Reports. 9 (6), 1745-1753 (2017).
- Chen, G., et al. Chemically defined conditions for human iPSC derivation and culture. Nature Methods. 8 (5), 424-429 (2011).
- Krencik, R., Zhang, S. -. C. Directed differentiation of functional astroglial subtypes from human pluripotent stem cells. Nature Protocols. 6 (11), 1710-1717 (2011).
- Du, Z. -. W., et al. Generation and expansion of highly pure motor neuron progenitors from human pluripotent stem cells. Nature Communications. 6, 6626 (2015).
- Neely, M. D., et al. DMH1, a highly selective small molecule BMP inhibitor promotes neurogenesis of hiPSCs: Comparison of PAX6 and SOX1 expression during neural induction. ACS Chemical Neuroscience. 3 (6), 482-491 (2012).
- Lippmann, E. S., Estevez-Silva, M. C., Ashton, R. S. Defined Human Pluripotent Stem Cell Culture Enables Highly Efficient Neuroepithelium Derivation Without Small Molecule Inhibitors. Stem Cells. 32, 1032-1042 (2014).
- Eggan, K., Kawada, J., Kaneda, S., Kirihara, T., Maroof, A. Generation of a Motor Nerve Organoid with Human Stem Cell-Derived Neurons. Stem Cell Reports. 9, 1441-1449 (2017).
- Krencik, R., Weick, J. P., Liu, Y., Zhang, Z. -. J., Zhang, S. -. C. Specification of transplantable astroglial subtypes from human pluripotent stem cells. Nature Biotechnology. 29 (6), 528-534 (2011).
- Krencik, R., et al. Dysregulation of astrocyte extracellular signaling in Costello syndrome. Science Translational Medicine. 7 (286), 286 (2015).
- Wang, C., et al. Scalable Production of iPSC-Derived Human Neurons to Identify Tau- Lowering Compounds by High-Content Screening. Stem Cell Reports. 9 (4), 1221-1233 (2017).
- Amin, H., Maccione, A., Marinaro, F., Zordan, S., Nieus, T., Berdondini, L. Electrical Responses and Spontaneous Activity of Human iPS-Derived Neuronal Networks Characterized for 3-month Culture with 4096-Electrode Arrays. Frontiers in Neuroscience. 10, (2016).
- Kapucu, F. E., Mäkinen, M. E., Tanskanen, J. M. A., Ylä-Outinen, L., Narkilahti, S., Hyttinen, J. A. K. Joint analysis of extracellular spike waveforms and neuronal network bursts. Journal of Neuroscience Methods. 259, 143-155 (2016).
- Ippolito, D. M., Eroglu, C. Quantifying Synapses: an Immunocytochemistry-based Assay to Quantify Synapse Number. Journal of Visualized Experiments. 45, 2-9 (2010).
- Zhang, Y., et al. Rapid single-step induction of functional neurons from human pluripotent stem cells. Neuron. 78 (5), 785-798 (2013).
- Odawara, A., Katoh, H., Matsuda, N., Suzuki, I. Physiological maturation and drug responses of human induced pluripotent stem cell-derived cortical neuronal networks in long-term culture. Scientific reports. 6, 26181 (2016).
- Bardy, C., Hurk, , et al. Neuronal medium that supports basic synaptic functions and activity of human neurons in vitro. PNAS. 112 (25), E2725-E2734 (2015).
- Monzel, A. S., et al. Derivation of Human Midbrain-Specific Organoids from Neuroepithelial Stem Cells. Stem Cell Reports. 8, 1144-1154 (2017).
- Lancaster, M. A., Knoblich, J. A. Generation of cerebral organoids from human pluripotent stem cells. Nature Protocols. 9 (10), 2329-2340 (2014).
- Dutta, D., Heo, I., Clevers, H. Disease Modeling in Stem Cell-Derived 3D Organoid Systems. Trends in Molecular Medicine. 23 (5), 393-410 (2018).
- Lancaster, M. A., et al. Cerebral organoids model human brain development and microcephaly. Nature. 501 (7647), 373-379 (2013).
- Qian, X., et al. Brain-Region-Specific Organoids Using Mini-bioreactors for Modeling ZIKV Exposure. Cell. 165 (5), 1238-1254 (2016).
- Yan, Y., et al. Derivation of Cortical Spheroids from Human Induced Pluripotent Stem Cells in a Suspension Bioreactor. Tissue Engineering Part A. , 1-46 (2016).
- Obien, M. E. J., Deligkaris, K., Bullmann, T., Bakkum, D. J., Frey, U. Revealing neuronal function through microelectrode array recordings. Frontiers in Neuroscience. 9 (JAN), 423 (2015).
- Hales, C. M., Rolston, J. D., Potter, S. M. How to Culture, Record and Stimulate Neuronal Networks on Micro-electrode Arrays (MEAs). Journal of Visualized Experiments. (39), 1-7 (2010).
- Shigetomi, E., Patel, S., Khakh, B. S. Probing the Complexities of Astrocyte Calcium Signaling. Trends in Cell Biology. 26 (4), 300-312 (2016).
- Bagley, J. A., Reumann, D., Bian, S., Lévi-strauss, J., Knoblich, J. A. Fused cerebral organoids model interactions between brain regions. Nat Methods. 14 (7), (2017).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유