Method Article
Modelagem de microcircuito sináptica com Cocultures 3D de astrócitos e neurônios de células-tronco pluripotentes humanas
Neste Artigo
Resumo
Neste protocolo, nosso objetivo é descrever um método reprodutível para os neurônios de células-tronco derivadas de pluripotentes humanas combinando dissociado e astrócitos juntos em 3D sphere cocultures, mantendo estas esferas em condições de flutuação livre e, posteriormente medindo a atividade sináptica circuito das esferas com immunoanalysis e gravações de matriz multielectrode.
Resumo
Uma barreira à nossa compreensão de como vários tipos de células e sinais contribuem para a função sináptica circuito é a falta de modelos relevantes para o estudo do cérebro humano. Uma tecnologia emergente para abordar esta questão é o uso de três dimensões (3D) neural as culturas celulares, denominado 'organoids' ou 'esferoides', para a preservação de longo prazo das interações intercelulares incluindo moléculas de adesão extracelular. No entanto, estes sistemas de cultura são demoradas e não sistematicamente gerado. Aqui, detalhamos um método rapidamente e consistentemente produzir cocultures 3D dos neurônios e células-tronco astrócitos de pluripotentes humanas. Primeiros, pre-diferenciados astrócitos progenitores neuronais dissociadas e estão contados. Em seguida, as células são combinadas em esfera-formando pratos com um inibidor de Rho-quinase e em proporções específicas para produzir esferas de tamanho reprodutível. Após várias semanas de cultura como esferas flutuantes, cocultures ('asteroides') são finalmente seccionados por imunocoloração ou chapeados sobre matrizes multielectrode para medir a força e a densidade sináptica. Em geral, espera-se que este protocolo vai render 3D esferas neurais que exibir os marcadores de célula madura-tipo restringido, formam sinapses funcionais e apresentam atividade de explosão espontânea rede sináptica. Juntos, este sistema permite rastreio de drogas e investigações sobre os mecanismos da doença em um modelo mais adequado, em comparação com as culturas monocamada.
Introdução
Astrócitos são um tipo de célula glial altamente abundante no sistema nervoso central (SNC) com uma variedade de responsabilidades funcionais, além de suporte estrutural. Através da secreção de fatores solúveis synaptogenic e componentes da matriz extracelular (ECM), astrócitos ajudar no estabelecimento e clustering de sinapses maduras durante desenvolvimento1. Eles também desempenham um papel fundamental na manutenção da saúde e da plasticidade de sinapses a extracelular sinalização2,3,4,5e contribuam para a estabilidade a longo prazo de homeostático ambientes regulando o potássio extracelular e glutamato, bem como a secreção de substratos de energia e ATP6,7,8. Finalmente, eles podem contribuir para a neurotransmissão, influenciando as correntes extrasynaptic9e indiretamente podem influenciar a atividade através de outros tipos de células, tais como a promoção de mielinização10. Importante, porque a anomalia ou disfunção de astrócitos pode levar a muitas síndromes de desenvolvimento neurológico e neuropatologia adulta, há uma necessidade óbvia de incluem astrócitos ao lado de neurônios dentro engenharia redes neurais em ordem para uma melhoria modelo do ambiente endógeno do cérebro. Uma característica integral de astrócitos é sua capacidade de interações dinâmicas de forma com sinapses neuronais1,11,12. Na ausência da glia, os neurônios formam um número limitado de sinapses, que em geral também falta maturidade funcional13.
Astrócitos humanos apresentam características morfológicas, transcriptional e funcionais — tais como o aumento do tamanho e complexidade de ramificação, bem como espécie-específicos de genes — que não são recapitulada em roedores12,14, 15. Como resultado, estudos utilizando células-tronco pluripotentes humanas (hPSC)-células neurais derivadas tornam-se amplamente aceito como um meio de examinar doenças relacionadas com a CNS em vitro durante o desenvolvimento de novas terapias, lesão modelos e paradigmas de cultura16 ,17. Além disso, o hPSCs permite o estudo da formação humana sinapse e função sem a necessidade de tecido primário18,19.
Uma barreira à nossa compreensão de como vários tipos de células e sinais contribuem para a função sináptica circuito é a falta de modelos relevantes do cérebro humano. Há uma necessidade de uma plataforma adequada recapitular suas redes sinápticas com alta fidelidade e reprodutibilidade. Recentemente, o interesse surgiu na produção de sistemas de cultura 3D (amplamente conhecido como 'organoids', 'esferoides', ou 'mini cérebro')20 para modelar complexo tridimensional (3D) estruturas a nível celular e macro. Sistemas de cultura 3D retém ECM e célula-célula de interações que são normalmente ausente ou limitado durante coculture 2D típico paradigmas21,22. Uma abundância de técnicas existem para cultivo esferoides neural 3D23,24,25; no entanto, muitos exigem períodos longos de cultura (meses a anos) para o desenvolvimento espontâneo e preservação de camada, com o usuário, exibindo muito pouco controle sobre a saída.
Aqui, podemos ilustrar um método sistemático para rapidamente e consistentemente bioengineer neural interações entre vários tipos de células (neurônios pre-diferenciados e astrócitos) derivado de hPSCs pela montagem de células em cocultures de esfera (asteroides)26 que recapitular humanos específicas complexidades morfológicas em 3D. Este sistema neural de alta densidade gera uniformemente dispersa os subtipos neurais que assumir Propriedades maduras ao longo do tempo e podem ser exibidos ou analisados de uma forma de alta produtividade. Demonstramos pela primeira vez que humano astrócitos induzem atividade de explosão rede sináptica nestas cocultures 3D. Além disso, este protocolo é facilmente adaptável para gerar esferas de tamanhos diferentes, utilizam células especificadas para diferentes identidades regionais do SNC e estudar as interações de vários outros tipos de células, como desejado.
Protocolo
1. celular cultura e preparação dos reagentes
Nota: Os protocolos nesta seção são escritos na ordem em que aparecem no protocolo de diferenciação (secção 2). Consulte a Tabela de materiais para materiais e números de catálogo.
-
Prepare placas revestidas para cultura de células.
- Dilua a solução de revestimento de matriz extracelular (ECM) com DMEM/F12 mídia para preparar um 1 mg/mL solução. Alíquota o ECM diluído solução reserva para 30 tubos cônicos de 3 mL cada e armazene imediatamente em-20 ° C. Para uma solução de trabalho, resuspenda 3 mL de caldo de ECM em 33 mL de pre-refrigeradas mídia DMEM/F12, trazendo o volume total de 36 mL para uma concentração de 80 µ g/mL.
- Casaco de 1 mL por bem de uma placa de cultura de células de 6-poços com solução de trabalho de ECM. Adicione um adicional 1ml DMEM/F12 por bem (se necessário) para garantir que a superfície do poço é totalmente coberta. Permitir que a célula 6-poços revestida placas de cultura sentar-se à temperatura ambiente pelo menos 1 h antes do uso.
Nota: Placas revestidas podem ser armazenadas na incubadora ou a 4 ° C por até 2 semanas.
-
Prepare formulações de meios de comunicação, fatores de crescimento e pequenas moléculas.
- Para preparar 500 mL de humano pluripotent stem cell (hPSC) médio27, adicione x 20 e 500 x suplementos, de acordo com as instruções dos fabricantes.
- Para preparar 500 mL de meio neural (NM), acrescentar heparina para uma concentração final de 2 mg/mL, 1 x solução de antibiótico/antimicótico, 1 suplemento de x B27 ou 1 suplemento x N2 uma garrafa de 500 mL de DMEM/F12 com suplemento de L-glutamina como anteriormente detalhada28.
- Para preparar uma 10mm (1, 000 x) solução de Rho-quinase inibidor Y27632 (Y) de ações, adicionar 10 mg de pó em 3 mL de salina tampão fosfato (PBS). Filtro de esterilizar, alíquota e armazenar a-20 ° C. Use em uma concentração de trabalho 10 µM em mídia.
- Para preparar uma 20 mM (10, 000 x) solução de SB431542 de ações, adicionar 10 mg de pó em 1,3 mL de Dimetilsulfóxido (DMSO). Para preparar um 2mm (1, 000 x) solução de DMH1 de ações, adicionar 10 mg de pó em 13,1 mL de DMSO. Filtro de esterilizar, alíquota e armazenar cada solução a-20 ° C. Use cada um em uma concentração de trabalho 2 µM em mídia (NM + SB431542 + DMH1).
Nota: Este protocolo recomenda 2 concentrações de trabalho µM de ambos os SB431542 e DMH1 com base em nossas observações e relatos de outros29 , afirmando que esta concentração efetivamente promove indução neural do hPSCs. Concentrações mais elevadas foram também relatados30. Além disso, com meios de comunicação alternativos, ficou também demonstrado que pequenas moléculas não são necessárias para alta conversão neural31. Assim, as concentrações de trabalho variam de acordo com ambientes de cultura celular alternativo e optimal concentrações devem ser testadas por pesquisadores individuais. - Para preparar individuais 100 µ g/mL (10, 000 x) soluções estoque de fator de crescimento epidérmico (EGF) e fator de crescimento de fibroblastos-2 (FGF2), adicionar 1 mg de cada um em 10 mL de PBS + 0,1% BSA. Alíquota EGF e FGF2 estoque soluções em 50 alíquotas µ l e armazenam a-80 ° C. Use cada um em uma concentração de trabalho 10 ng/mL na mídia; por exemplo, adicionar 5 µ l EGF e 5 µ l FGF2 a 50 mL de NM (NM + FGF2 EGF).
- Para preparar uma solução de cloridrato de doxiciclina (Dox), primeiro dissolver o pó em DMSO a 100 mg/mL e armazenar a-20 ° C. Ainda mais, dilui-lo para fazer um 2 mg/mL (1, 000 x) solução em PBS e loja a-20 ° C. Use a concentração de trabalho 2 µ g/mL na mídia; por exemplo, adicionar 50 µ l Dox a 50 mL de NM (NM + Dox).
Nota: Não congele novamente soluções após o descongelamento.
2. geração de Neural subtipos de células pluripotentes humanas induzidas (hPSCs)
Nota: Todas as culturas celulares devem ser mantidas em uma incubadora com 5% CO2 a 37 ° C. Estas culturas são mantidas em níveis de oxigênio da sala, apesar de níveis inferiores podem ser utilizados.
-
Gerar e manter progenitores astrocyte (hAstros) de hPSCs.
Nota: Esta seção fornece um protocolo de diferenciação breve e simplificada. Para uma descrição detalhada (com a formação do corpo do embryoid, seleção de Roseta e etapas de padronização regional) referir-se o protocolo descrito anteriormente28 (figura 1A, pontilhado caixa verde).- Clusters de sementes de hPSCs (figura 1B) nas chapas de 6-Poços revestidos ECM (consulte a etapa 1.1) com 2 mL de hPSC médio + Y por bem. Alimentam as células-tronco todos os dias até eles são cerca de 50% confluentes e dividir conforme necessário.
- Para dividir hPSCs, adicionar 1 mL do reagente de passagem para poços e aspirar depois células de incubar 1 min. à temperatura ambiente por 5 min, adicionar 1 mL de meio de hPSC e dividir agregados 01:10 em novos poços revestidos ECM em 2 mL de hPSC médio + Y por bem.
- Manter as células-tronco, até que eles são cerca de 50% de confluencia, então a mudança de mídia para NM + SB431542 + DMH1 para induzir a diferenciação neural (dia 0). Quando as células são cerca de 95% confluente, dividir 1:6 em novos poços revestidos ECM no mesmo meio.
- No dia 14, dissocia as células com solução de destacamento e transferência para um balão não revestidos com Y para promover a formação de agregados.
Nota: A adição de Y é utilizada para promover a formação de células de sobrevivência e a esfera, mas não está incluída durante cada alimentação. - Para a geração dos progenitores neuronais e neurônios (hNeurons), use estas células dia-14 conforme descrito abaixo. Como alternativa, utilize estas células em pontos de tempo posteriores de culturas monocamada ou esfera antes de maturação neuronal ocorre ou gliogenesis começa.
Nota: Por padrão, este protocolo produz astrócitos dorsal-cortical. No entanto, os subtipos de astrocyte podem ser especificados regionalmente pela adição de padronização morphogens se desejar28,32,33. Ácido retinoico (RA) pode ser adicionado para caudalize células na medula espinhal fenótipos, enquanto sonic hedgehog (SHH), smoothened agonista (SAG), ou purmorphamine irá produzir fenótipos ventrais. - Para a geração dos progenitores astrocyte e astrócitos em formado espontaneamente 3D agregados (hAstrospheres), alterne para NM + EGF + FGF2 e alimentar semanal (ou sempre que necessário para garantir o pH estável) como anteriormente detalhada34.
- Suavemente se dissociam hAstro agregados com solução de desprendimento quando centros escuros aparecem e remova as esferas que espontaneamente anexar. Quebre as esferas delicadamente uma vez por semana para manter a saúde de esfera e evitar núcleos necróticos.
Nota: Não exceda 5 min de tratamento com solução de desprendimento. - Depois de 4-6 meses de expansão, confirmar identidade de célula e também congelar em meio de criopreservação (de acordo com as instruções do fabricante) ou armazenamento alternativo condições para preservação a longo prazo em nitrogênio líquido, ou o uso imediatamente experimentação.
- Suavemente se dissociam hAstro agregados com solução de desprendimento quando centros escuros aparecem e remova as esferas que espontaneamente anexar. Quebre as esferas delicadamente uma vez por semana para manter a saúde de esfera e evitar núcleos necróticos.
- Para descongelar um estoque congelado de hAstrospheres, descongelar rapidamente um frasco à temperatura ambiente, transferência o conteúdo para um tubo cônico vazio 15 mL e centrifugar 300 x g por 1 min. cuidadosamente Aspire o sobrenadante, lava com DMEM/F12 e repete para um total de duas lavagem passos. Adicionar um balão de T25 com um volume total de 6 mL de NM EGF + FGF2 + Y (ou scale-up conforme necessário).
- Clusters de sementes de hPSCs (figura 1B) nas chapas de 6-Poços revestidos ECM (consulte a etapa 1.1) com 2 mL de hPSC médio + Y por bem. Alimentam as células-tronco todos os dias até eles são cerca de 50% confluentes e dividir conforme necessário.
-
Gerar e manter os neurônios inducible (iNeurons) de hPSCs.
- Sementes transgênicas hPSCs (com um transgene estável neurogenin doxiciclina-inducible 235) em placas de 6 boas ECM-revestido com 2 mL de hPSC médio + Y por bem (como descrito acima para linhas não-transgênicos). Alimente todos os dias com 2 mL de mídia por alvéolo até que estejam prontos para levantar na confluência de 70%. Dividir células conforme descrito na etapa 2.1.2.
- Quando as células são cerca de 35% confluentes, adicionar NM + Dox para induzir a diferenciação em iNeurons. Manter-se como uma cultura de monocamada com NM + Dox para 2 dias antes de prosseguir para a etapa 3.2.
Nota: Células serão transição em progenitores neuronais, mas não vai ainda estender neuritos (Figura 1).
3. preparação e manutenção da esfera 3D Cocultures
- Dissocia a hAstros dos agregados 3D em suspensão (conforme descrito na etapa 2.1.5.1).
-
Dissocia o hNeurons ou iNeurons de uma monocamada 2D.
- Remover a mídia da placa de 6 e adicione 500 µ l de solução de destacamento a cada bem contendo culturas monocamada. Incube a 37 ° C por 5 min. suavemente adicionar 2-3 mL DMEM/F12 para remover células anexadas.
- Coletar as células e mídia em um tubo cônico de 15 mL e centrifugar a 300 x g por 1 min. Aspire o sobrenadante, adicionar 1 mL de mídia fresca e pipetar subindo e descendo suavemente com uma micropipeta de 1.000 µ l para conseguir uma suspensão de célula única.
-
Forma esferas 3D usando placas de cultura de microplacas.
- Prepare o prato adicionando-se 0,5 mL da solução de lavagem antiaderência a cada poço da placa de micropoços. Centrifugue a placa a 2.000 x g por 5 min. aspirado de solução de lavagem, adicione 1 mL de DMEM/F12 a cada poço para lavar e aspirar novamente.
Nota: Certifique-se sempre de que o centrifugador é equilibrado durante a utilização. - Conte cada tipo de célula, usando um hemocytometer ou contador automatizado de células. Adicione a proporção desejada de dissociada de hAstros e hNeurons ou iNeurons a cada poço em um volume total de 2 mL de NM + Y (incluem Dox se iNeurons são utilizados). Centrifugue a placa a 100 x g por 3 min e retornar para a incubadora.
Nota: placas de 24 poços de microplacas (consulte a Tabela de materiais) contêm 300 micropoços por bem. Adicione um mínimo de 6 x 105 células (para esferas de 2 x 103 células cada) e um máximo de 6 x 106 células (para esferas de 2 x 104 células cada) em 2 mL de mídia por bem. Para esferas viáveis de uma densidade específica dentro desta escala, usar uma quantidade definida de células e dividir por 300 para calcular o número de células por esfera. Alternativa esfera formando métodos e ferramentas também pode ser utilizada se desejado. Siga as instruções do fabricante para intervalos aceitáveis de densidades de célula. - Permitir que as células de auto-montagem em esferas densamente dentro de microplacas placas durante os próximos 2 dias (Figura 2A). Substitua a mídia de 50% se a cultura é amarelinho.
Nota: Trocar a mídia só metade e pipetar suavemente quando remover e adicionar mídia em ordem para não perturbar as esferas. Esferas podem levantar de micropoços e fusível juntamente com maior força. - Depois de 2 dias, suavemente remova esferas de poços da microplaca com uma micropipeta de 1.000 µ l (Figura 1). Levemente aplique força ao fundo dos poços da microplaca com mídia para remover qualquer adicionais esferas aderidas. Deixe as esferas instalar-se em um tubo cônico de 15 mL, aspirar a velha mídia e adicionar mídia fresca.
- Prepare o prato adicionando-se 0,5 mL da solução de lavagem antiaderência a cada poço da placa de micropoços. Centrifugue a placa a 2.000 x g por 5 min. aspirado de solução de lavagem, adicione 1 mL de DMEM/F12 a cada poço para lavar e aspirar novamente.
-
Configure o sistema de biorreator de balão girador para formando esferas 3D.
- Limpar a superfície de uma placa de agitação magnética com 70% de etanol, colocá-lo em uma incubadora de cultura de células. Frascos de girador individuais de autoclave para esterilizar.
- Adicionar as esferas com um mínimo de meios de comunicação de 50 – 60 mL para cada frasco de girador (Figura 1, inserir). Coloque o frasco na placa de agitação magnética, fixado em 60 rpm. Esferas da cultura em frascos de girador até que estejam prontos para coleta de dados.
Nota: Um mínimo de 3 semanas na cultura é necessária para a formação de sinapses. Se o sistema de biorreator de balão girador não é desejado, as esferas podem ser cultivadas em condições estacionárias em frascos de cultura celular ou pratos. Esferas podem também ser incorporadas em ECM ou hidrogel.
4. medida da fisiologia sináptica ao vivo com matrizes Multielectrode (ama)
-
Prepare MEAs para cultura de células.
- Limpar a superfície de cada MEA com 1 mL de detergente para 1 h. Enxágue com água deionizada estéril de (DI), enxaguar com etanol a 70% para esterilizar e então ar seca em Biossegurança do armário sob a luz UV.
Nota: MEAs podem ser armazenados em DI água a 4 ° C, sob condições estéreis, até o uso. - Prepare uma solução de 0,5 mg/mL de poli-ornitina (PLO) dissolvendo-se 50 mg de PLO em 100 mL de tampão de ácido bórico. Revestir a superfície de cada MEA com 1 mL de PLO para renderizar a superfície hidrofílica e incubar a 37 ° C por um período mínimo de 4 h. Retire a OLP, lave a superfície com água, adicione 1 mL do ECM (consulte a etapa 1.1.1) e incubar a 37 ° C por um período mínimo de 4h.
- Remover o ECM e colocar as esferas em 1,5 mL de mídia sobre uma superfície MEA, garantindo que as esferas estão posicionadas no topo da matriz de eletrodo (figuras 3A, 3A'). Permita a aderir por 2 dias. Mude metade dos meios de comunicação a cada 2-3 dias (ou mais frequentemente se necessário), garantindo que as esferas não são perturbadas.
Nota: A adição de fatores de crescimento pode melhorar o amadurecimento e a sobrevivência da cultura.
- Limpar a superfície de cada MEA com 1 mL de detergente para 1 h. Enxágue com água deionizada estéril de (DI), enxaguar com etanol a 70% para esterilizar e então ar seca em Biossegurança do armário sob a luz UV.
-
Medir a atividade elétrica de esferas neurais.
- Criar um sistema de matriz multielectrode (MEA) com um headstage de temperatura controlada. Crie um programa de software com um filtro passa-altas de 5 Hz e um filtro passa-baixo de 200 Hz e um limite de aumento de 5 x desvio-padrão (SD).
- Coloque o MEA headstage e registro de atividade de elétrica espontânea (Figura 3BB'). Salve dados brutos, incluindo o pico de frequência e amplitude para a análise estatística.
Nota: Um sistema de perfusão pode ser utilizado com o MEA para adicionar agentes farmacológicos ou para aumentar o fluxo de mídia fresco para gravação a longo prazo. Adicional pós-processamento de picos pode ser realizado como desejado36,,37.
5. medida da densidade sináptica com imunocitoquímica
-
Prepare os reagentes.
- Para tornar um 500 mL de solução de paraformaldeído 4% (PFA), adicione 400 mL de 1X PBS para um copo de vidro ou uma placa de agitação em uma campânula ventilada. Adicionar barra de agitação e calor a 60 ° C, agitando; Não ferva. Adicionar 20 g de pó PFA para a solução de PBS aquecida e elevar o pH para 6,9 lentamente adicionando 1 N NaOH gota a gota.
Nota: solução PFA 4% pode ser aliquotadas e armazenado a 4 ° C por até um mês. - Adicione 20 g ou 30 g de sacarose para 100 mL de PBS tornar soluções de 20% e 30% de sacarose, respectivamente.
- Adicione 1 mL de detergente a 10 mL de PBS para preparar uma solução de reserva de 10%. Inverta várias vezes para homogeneizar.
- Adicione 250 µ l de solução detergente de 10% (concentração final de 0,25%) e 500 µ l cada de soros de cabra e o burro (concentração final de 5% cada) de 10 mL de PBS para preparar o tampão de bloqueio primário.
- Adicione 100 µ l cada de soros de cabra e o burro (concentração final de 1% cada) de 10 mL de PBS para preparar o tampão de bloqueio secundário.
- Para tornar um 500 mL de solução de paraformaldeído 4% (PFA), adicione 400 mL de 1X PBS para um copo de vidro ou uma placa de agitação em uma campânula ventilada. Adicionar barra de agitação e calor a 60 ° C, agitando; Não ferva. Adicionar 20 g de pó PFA para a solução de PBS aquecida e elevar o pH para 6,9 lentamente adicionando 1 N NaOH gota a gota.
-
Prepare as amostras.
- Transferir as esferas em um tubo cônico de 15 mL, permitir-lhes a acertar na parte inferior do tubo e aspire a velha mídia. Enxague as esferas com 500 µ l de PBS, deixe resolver e aspire a PBS. Adicionar 500 µ l de 4% PFA (ou o suficiente para cobrir as esferas) e incube a 4 ° C por 30 min.
- Aspirar o PFA e delicadamente lave duas vezes com PBS. Adicionar a solução de sacarose 20% e incubar a 4 ° C por várias horas ou durante a noite. Cuidadosamente Aspire, adicionar 30% de solução de sacarose e incubar a 4 ° C por várias horas ou durante a noite.
Nota: As amostras podem ser armazenadas a 4 ° C em PBS ou sacarose por até 1 semana antes de prosseguir para a próxima etapa. Se não cortar, manter-se como esferas 3D (Figura 4A-C) em um tubo de 1,5 mL e prossiga para a etapa 5.3. - Se cortar as esferas, transferi com cuidado, esferas para um molde criogênico encastre em cima do gelo seco. Aspirar a solução de sacarose de 30% e derrame lentamente o tecido incorporação solução no molde até cobrir totalmente a amostra, evitando bolhas de ar. Aguarde até solução congela e armazenar a-80 ° C até criostato fatiar.
- Usando um criostato-20 ° C, fatia os blocos incorporados em 30 seções µm (ou como desejar) e traslado para lâminas de vidro. Loja a-80 ° C até que esteja pronto para manchar.
-
Delgados das esferas.
- Contorne as bordas dos slides com uma caneta PAP hidrofóbica para evitar derramamento de líquido. Prepare soluções de bloqueio primárias e secundárias com anticorpos (ver a Tabela de materiais). Adicionar 500 µ l de tampão de bloqueio primário para cada slide ou tubo e incubar a temperatura ambiente por 30 min.
- Retire o líquido, adicionar 500 µ l de tampão de bloqueio primário fresco com anticorpos primários diluídos para cada slide ou tubo e incubar durante a noite a 4 ° C. Remover a solução de anticorpo primário e lavar 3x com PBS por 10 min cada.
- Adicionar 500 µ l de tampão de bloqueio secundário com anticorpos secundários diluídos para cada slide ou tubo e incubar a 4 ° C por 1 h. Retire a solução anticorpo secundário e lavar 3x com PBS por 10 min cada.
Nota: É fornecida uma lista de anticorpos recomendados na Tabela de materiais. Anticorpos ou outros corantes podem ser utilizados como desejado. Não exponha amostras fluorescentes para luz (5.3.3 passo em diante). - Adicione 50 µ l de solução gota a gota para cobrir a superfície e coloque cuidadosamente uma lamela sobre a lâmina, evitando bolhas de montagem. Permitir que os slides secar à temperatura ambiente por 24 h e armazenar a 4 ° C.
-
Os slides da imagem.
- Use um microscópio fluorescente confocal ou dois fotões com uma 63 X objetivo de imersão óleo de imagem pré e abundância de proteína pós-sináptica e colocalization dentro de fatias de esfera (Figura 4). Use um X de 20 ou 40 objetivo X Visualizar características morfológicas do hAstros.
- Arquivos de imagem de fluorescência aberto com software ImageJ. Pré e pós-sináptica partitura manualmente usando o contador de célula plug-in, usando um método de contagem imparcial como anteriormente detalhada38, ou com métodos alternativos de contagem.
Resultados
Quando executado corretamente, este protocolo irá produzir populações definidas de cocultures funcionais de astrócitos28,33,34 e neurônios35 gerados a partir de hPSCs (figura 1A-1C), como detalhados anteriormente26 e aqui descrito em passos 2.1 – 2.2. Este procedimento passo a passo, com o uso de placas de micropoços, é esperado para render 3D neurais esferas de tamanho consistente e de forma (passo 3.3; Figura 1.) com células uniformemente dispersas e sem sinais significativos de morte celular. Uma variedade de densidades de célula, a começar com uma relação desejada entre tipos de células, irá produzir esferas de tamanhos variados. Na ausência de placas de micropoços, células combinará de forma significativamente maiores e não-uniforme agregados cujos diâmetros (> 2mm) ultrapassam o limite de difusão (Figura 2A-2B). Prevê-se que a utilização de um biorreator de balão ou equivalente de girador irá manter a uniformidade entre as esferas e reduzir a fusão (passo 3.4; A Figura 2). No entanto, enquanto frascos de girador permitam cultura das esferas por semanas, seu uso não é necessário.
Para estabilizar o cocultures para análise eletrofisiológica, ECM-imitando substratos permitem esferas prontamente aderir, mantendo sua estrutura 3D (Figura 3A, 3A'). Durante as gravações, saudáveis esferas de iNeurons colocados no MEAs espontaneamente irão provocar picos de tensão superior a ± 40 MV com frequências de disparo consistente (etapas 4.1 – 4.2; Figura 3B -C, 3F). Coculture esferas são esperadas para exibir maior conectividade de rede com a presença de hAstros, resultando em um aumento de explosões de rede síncrona de picos (Figura 3B' C -3 '). A aplicação de CNQX35,39,40, um antagonista dos receptores pós-sinápticos Leandro, reduz a rede explosão sincronia nas esferas coculture (Figura 3D'-3E').
Marcadores de proteína da célula neural-tipo restringido demonstram visualmente o arranjo uniformemente disperso e maturidade de astrócitos e neurônios dentro de esferas 3D. Uma projeção máxima de morfologia astrocyte e ramificação é mostrada na Figura 4A em uma esfera 3D representativa com hAstros escassamente rotulada com membrana-limite GFP. HAstros maduras expressar marcadores incluindo GFAP (Figura 4B), S100B e Glt134, enquanto hNeurons e iNeurons expressam a proteína microtubule-associado 2 (MAP2; A Figura 4) e beta tubulina 3 (Tuj1/TUBB3). Finalmente, embora iNeurons expressam proteínas pré e pós-sináptica, incluindo 1 Synapsin (Syn1) e Homero ou PSD95, respectivamente, densidade sináptica é significativamente reforçada pela presença de hAstros em coculture (Figura 4)26. Se disponível, o uso alternativo do cérebro limpando técnicas e microscopia de luz folha permitirá rápida imagem de esferas intactas.
Tomados em conjunto, a expressão de marcadores neurais maduros juntamente com atividade elétrica espontânea confirmam o sucesso do Protocolo detalhado acima em produzir cocultures 3D de microcircuitos sinápticos funcionais.
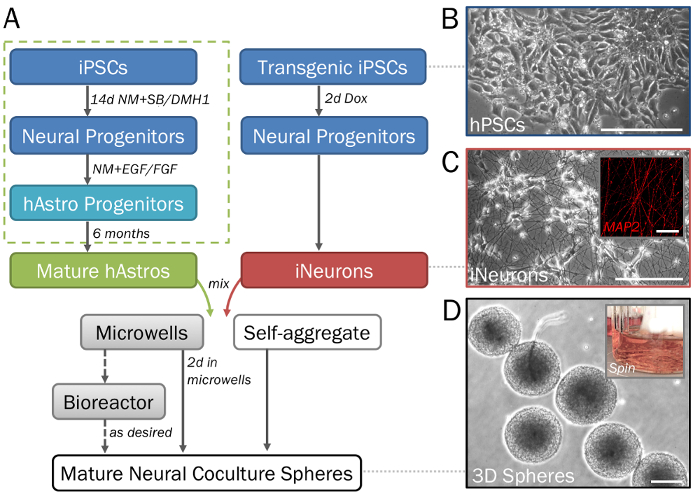
Figura 1: representação gradual da diferenciação e formação de esferas neurais 3D derivado de hPSCs. (A) cronograma de etapas-chave no protocolo. (B) as populações puras de células neurais podem ser geradas a partir de células-tronco pluripotentes induzidas humana (hPSCs). Para a geração dos progenitores astrocyte (caixa verde pontilhada), consulte o passo 2.1, bem como Ref28. (C) Inducible neurônios (iNeurons; ver seção 2.2) gerados a partir de transgênicos hPSCs através do induzido superexpressão de neurogenin 2 demonstrar morfologia neuronal em 2D ECM (dia 7) e são positivos para MAP2 (inserir). (D) esferas retiradas placas de microplacas (ver passos 3.1-3.3) demonstram tamanho consistente para seleção da elevado-produção. As esferas podem ser cultivadas em um bioreator de balão girador (margem interna; ver passo 3.4) se desejar impedir a fusão. Barra de escala = 50 µm (C, inserir). Escala de barras = 200 µm (A, D). Clique aqui para ver uma versão maior desta figura.
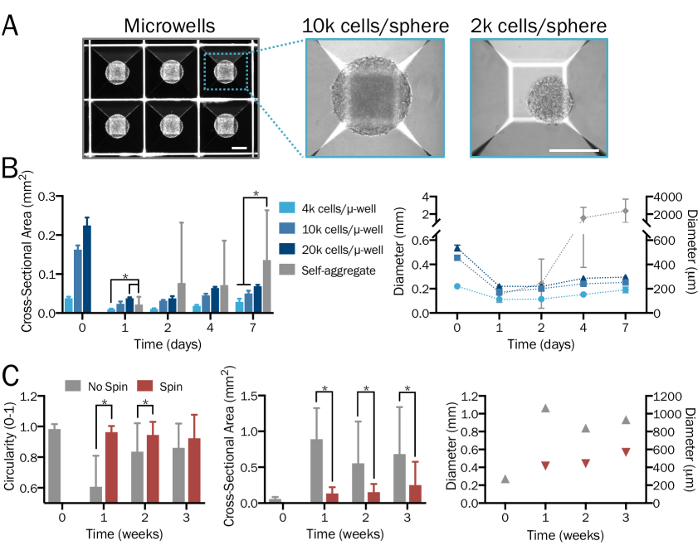
Figura 2: geração sistemática e reprodutível de bioengenharia 3D esferas neural. (A) placas de cultura de microplacas (µ-bem) são usadas para formar o 3D esferas neurais da densidade desejada e rácios de neurônio-para-astrocyte de forma sistemática e especificado pelo usuário, gerando consistente tamanho e forma. Imagens são mostradas 1 dia após a formação da esfera. Escala de barras = 200 µm. (B) uma variedade de densidades de célula (de 4 x 103 a 2 x 104 células por microplacas) a começar produz esferas de tamanhos variados. Na ausência de placas de micropoços, hPSCs combinam para agregados de significativamente maiores e não-uniforme de formulário cujos diâmetros ultrapassam o limite de difusão depois de uma semana (n = 6-14 esferas por ponto de grupo e tempo). (C) iNeuron esferas cultivadas num balão de girador a 80 rpm exibiram menos fusão e, portanto, foram significativamente menores, mais uniforme e exposta circularidade maior em comparação com aqueles na cultura estacionária durante um período de três semanas (n = 6-51 esferas por ponto de grupo e tempo). Parcelas representam média ± SD; * indica significância (p < 0,05) entre os grupos, determinado usando bicaudal t-testes. Clique aqui para ver uma versão maior desta figura.
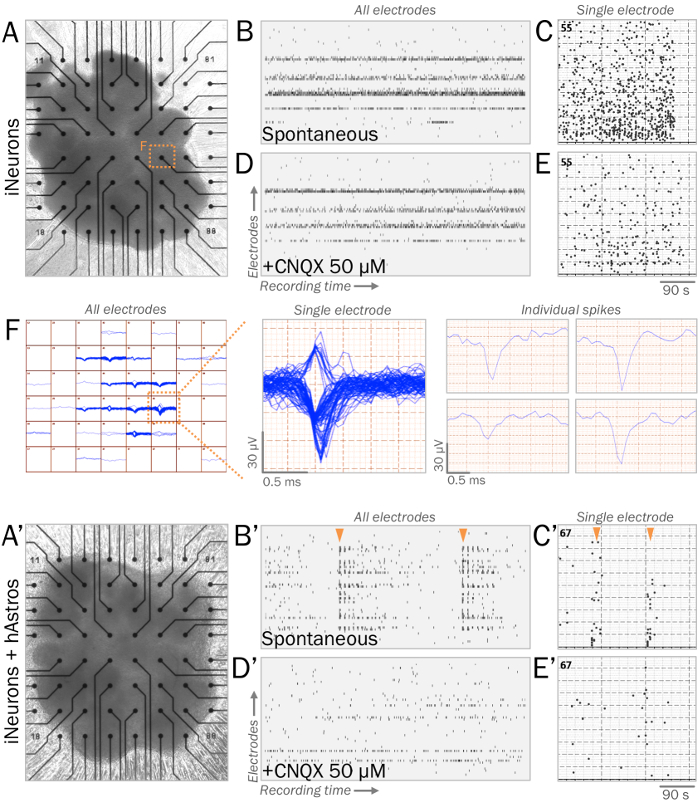
Figura 3: representante fisiologia sináptica ao vivo das esferas neurais em matrizes multielectrode (MEAs). (A, A') MEAs são utilizados para medir a fisiologia sináptica ao vivo das esferas neurais. Esferas de iNeurons (A) ou cocultures de iNeurons e hAstros (A') podem ser cultivadas em superfícies MEA com substratos ECM-imitando (consulte a etapa 4.1). (B, B') Raster parcelas de representante atividade elétrica espontânea, medida através de todos os eletrodos (eixo vertical) durante uma janela de gravação (eixo horizontal). Após 4 semanas da cultura no médio basal neurofisiológica41, esferas de iNeuron (B) exibido picos espontâneos, enquanto coculture esferas (B) revelou maior rede rajadas de padrões de acionamento síncrono (setas laranja). (C, C') Histograma de pontos medidos durante as janelas de gravação MEA de eletrodos representativas. (D, D') Parcelas de raster da atividade elétrica espontânea medido através de todos os eletrodos após a aplicação de 50 µM CNQX, um antagonista dos receptores GABA (mesma escala de tempo, como B, B'). CNQX eliminou a presença de explosões síncronos de picos observados no cocultures (D'). (E, E') histograma de pontos medidos durante as janelas de gravação MEA de eletrodos representativos após aplicação de CNQX 50 µM (mesma hora escala como C, C'). (F) mapa de traçados de pico de iNeuron esferas de todos os eletrodos ao longo do tempo (à esquerda). Demonstrativo eletrodo único exibindo vários vestígios agrupados ao longo do tempo (médio); vestígios de espiga individual podem ser classificados e analisados individualmente (à direita). Clique aqui para ver uma versão maior desta figura.
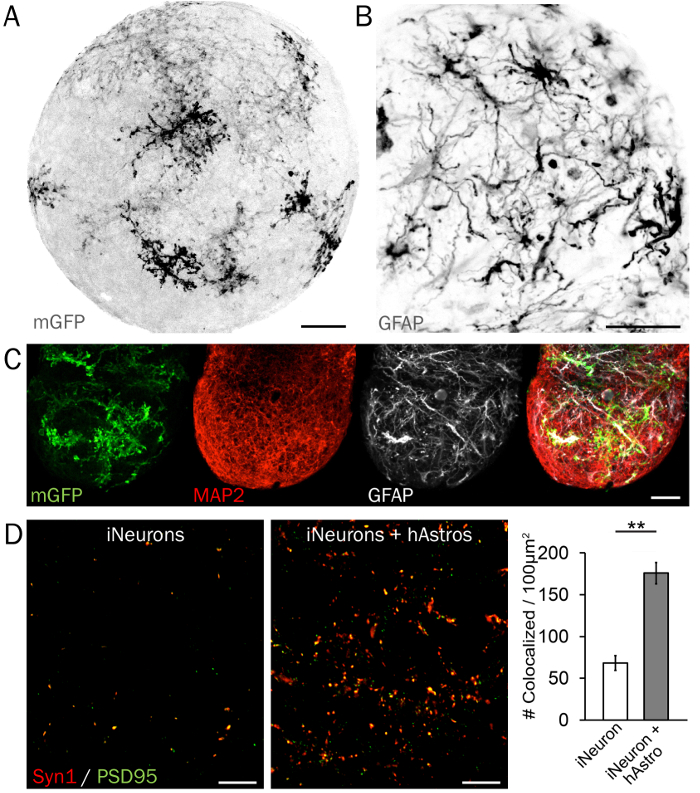
Figura 4: imuno-histoquímica característico de microcircuitos sinápticos. Repórter (A), uma membrana-limite GFP (mGFP) é útil para examinar o arranjo e a morfologia de hAstros nas esferas neurais 3D. (B) hAstros diferenciadas de hPSCs são GFAP positivo. (C) esferas contendo hAstros e iNeurons podem ser visualizadas e analisaram usando marcadores de proteínas tipo restrito de célula como GFAP e MAP2. Barras de escala = 50 µm. (D) imagens representativas das densidades de pré e pós-sinápticas (Syn1 e PSD95, respectivamente) em esferas de iNeurons sem (esquerda) e com (direita) cocultured hAstros. Observou-se uma densidade significativamente aumentada de colocalized Syn1 e PSD95 nas esferas coculture comparadas com esferas de iNeuron no dia 35, demonstrando a capacidade de hAstros para induzir a formação de sinapse (n = 3 repetições independentes cada; dados reproduzido da Ref 26 com permissão). Barras de escala = 10 µm. trama representa a média ± SEM; diferenças significativas (* indica p < 0,05; * * indica p < 0,01) entre os grupos foram determinados utilizando bicaudal t-testes. Clique aqui para ver uma versão maior desta figura.
Discussão
Neste protocolo, descrevemos um método sistemático para a produção de esferas 3D de cocultures neurais. As esferas são compostas de astrócitos e neurônios, que são derivados independentemente de hPSCs. Embora não o foco do presente protocolo, a geração das populações puras de astrócitos de hPSCs28 é uma etapa crítica e pode ser tecnicamente desafiador se realizada sem experiência prévia. Este primeiro passo na geração destes microcircuitos sinápticos deve ser realizado com sincronismo meticuloso e atenção aos detalhes. Uma limitação do uso de astrócitos hPSC-derivado é o processo de diferenciação longa; no entanto, a produção de grandes quantidades de células que podem ser congeladas para futuro uso e descongelados no momento da experimentação (consulte a etapa 2.1.5) elimina a necessidade de iniciar o processo desde a fase inicial do hPSC. Embora os iNeurons gerados a partir de transgênicos hPSCs são synaptogenic e têm a capacidade de exposição espontâneas pós-sináptica correntes elétricas, ambas as características são notavelmente reforçadas pela presença de glia12,35— incluindo o hAstros detalhadas no presente protocolo. Assim, deve notar-se que a escolha do tipo de célula, número e grau de desenvolvimento ou maturidade é um componente crítico do presente protocolo, e ajustes podem resultar em variações na atividade elétrica ou visualização de sinapse. No entanto, este protocolo também permite manipulação de densidade celular ou rácios de uma forma que reflete a flexibilidade de condições possíveis ou resultados do pesquisador individual.
Conforme descrito acima, podemos tirar vantagem dessa ferramentas de bioengenharia para produzir uma alternativa a42,neural organoides métodos43, com a ressalva de que este sistema não recapitular os fenótipos de auto-organização e camadas de organoids que pode ser desejado de20,44. A utilização simultânea de micropoços cultura chapas26 e um girador balão biorreator45,46 garantir reprodutibilidade, simplificando, assim, não só a produção, mas também o exame e análise de microcircuitos neurais com uma variedade de ensaios de cultura de células. Deve-se ressaltar que embora a utilização de um biorreator de balão ou equivalente de girador é opcional, uma cultura estacionária de esferas em contato pode resultar em sua fusão, assim limitante nutrientes e oxigênio além do limite de difusão no centro de esferas47. Nomeadamente, a utilização de impressos 3D minibiorreatores foram relatados como uma abordagem de taxa de transferência maior em comparação com grandes biorreatores46.
Ferramentas tradicionais para medir formação sináptica incluem métodos fisiológicos tais células inteiras remendo aperto MEAs36,,48,49e cálcio50de imagem. Aqui, nós escolhemos descrever o uso de MEAs como eles fornecem um exame simples e de alto rendimento da atividade elétrica nas esferas em uma escala de tempo breve. No entanto, outras técnicas também podem ser utilizadas.
Uma limitação do uso de placas de micropoços neste protocolo é o número máximo de esferas (~ 300) e células por esfera (~ 2 x 104) que são permitidos em cada poço. Ferramentas de formação esfera alternativo podem ser usadas para um número maior; no entanto, um número maior de células será exigido no ponto de partida. O formato de 24-bem foi escolhido aqui para sua capacidade de gerar maiores esferas que podem ser manipulados para análise e visível a olho nu, limitando a morte celular dentro do centro das esferas. Em geral, a adição desta etapa do protocolo irá garantir uma produção robusta e escalável de esferas 3D uniformes.
Nosso protocolo também possui a flexibilidade de ajustar o número e a proporção de cada tipo de célula, bem como a possibilidade de introduzir as esferas 3D outros tipos de células, de forma controlada, definida. O uso do específico da região neuronal e subtipos astrocyte permite o estudo de microcircuitos sinápticos das diferentes regiões do sistema nervoso central. Estes coculture esferas também podem ser fundidos junto51 para estudar a migração celular e sinalização de longo alcance. A adição de oligodendrócitos, células endoteliais ou microglia poderia provar essas esferas 3D para ser um modelo de cérebro informativo com maior complexidade, como uma direção de futura promissor para este método. Finalmente, além de doenças e lesões de modelagem, este sistema permite o estudo de abordagens terapêuticas, como terapia de reposição celular ou o desenvolvimento de drogas, para melhorar a Epilepsias.
Divulgações
Os autores não têm nada para divulgar.
Agradecimentos
Gostaríamos de agradecer o contributo intelectual sobre o design desses procedimentos, Dr. Michael Ward (NIH) para aconselhamento técnico na diferenciação de iNeuron e Saba Barlas para análise preliminar de imagens Dr. Erik Uliano (UCSF).
Materiais
| Name | Company | Catalog Number | Comments |
| 6 well plate | Fisher Scientific | 08-772-1B | |
| 15 mL conical tubes | Olympus Plastics | 28-101 | |
| Accutase | Sigma | A6964-100ML | Detachment solution |
| AggreWell plate | Stemcell Technologies | 34850 | |
| Anti-Adherence Rinsing Solution | Stemcell Technologies | 7010 | Prevent cell adhesion to microwell plates |
| Anti/anti | Thermofisher | 15240062 | |
| B27 | Thermofisher | 17504044 | Media Supplement |
| BrainPhys neuronal medium | Stemcell Technologies | 5790 | Neurophysiological basal medium alternative |
| Circular glass coverslips | Neuvitro | GG-12-oz | |
| Cryostor CS10 | Stemcell Technologies | 7930 | Cryopreservation medium with 10% DMSO |
| DMEM/F12 | Thermofisher | 10565-042 | With GlutaMAX supplement |
| DMH-1 | Stemcell Technologies | 73634 | HAZARD: Toxic if swallowed. Working concentration: 2 μM |
| Donkey serum | Lampire Biological Laboratories | 7332100 | Working concentration: 5% in primary blocking buffer, 1% in secondary blocking buffer |
| Doxycycline Hydrochloride (Dox) | Sigma | D3072-1ml | HAZARD: Toxic for pregnant women. Working concentration: 2 μg/mL |
| Epidermal growth factor (EGF) | Peprotech | AF-100-15 | Working concentration: 10 ng/mL |
| Fibroblast growth factor-2 (FGF) | Peprotech | 100-18B | Working concentration: 10 ng/mL |
| Fluoromount-G mounting solution | Southern Biotech | 0100-01 | |
| Glass slides | Fisherbrand | 22-037-246 | |
| Goat serum | Lampire Biological Laboratories | 7332500 | Working concentration: 5% in primary blocking buffer, 1% in secondary blocking buffer |
| Hemacytometer or automatic cell counter | Life Technologies | AMQAX1000 | |
| Heparin | Sigma | H3149-50KU | Working concentration: 2 mg/mL |
| Magnetic plate | DLAB | 8030170200 | |
| Matrigel membrane matrix | Corning | 354230 | ECM coating solution. Working concentration: 80 μg/ml. Prepare on ice and ensure that pipettes, tubes, and media are pre-chilled. |
| MEA 2100 System | Multichannel Systems | MEA2100 | |
| Mounting solution | |||
| N2 | Thermofisher | 17502048 | Media Supplement |
| OCT | Tissue-Tek | 4583 | Tissue embedding solution for cryosectioning |
| Pap Pen (Aqua Hold) | Scientific Device Laboratory | 9804-02 | |
| Paraformaldehyde (PFA) | Acros Organics | 169650025 | HAZARD: Toxic if inhaled. Working concentration: 4% in PBS |
| Phosphate buffered saline (PBS) | Stemcell Technologies | CA008-300 | |
| Poly-l-ornithine (PLO) | Sigma | P3655-100MG | Working concentration: 0.5 mg/mL |
| Rectangular glass cover slips | Fisherfinest Premium Superslip | 12-545-88 | |
| ReLeSR | Stemcell Technologies | 5872 | Detachment and passaging reagent |
| Rho-Kinase Inhibitor Y27632- (Y) | Tocris | 1254 | Working concentration: 10 uM |
| SB431542 | Stemcell Technologies | 72234 | Working concentration: 2 μM |
| Spinner flasks | Fisher Scientific | 4500-125 | |
| Sucrose | Fisher Chemical | S5-3 | Working concentration: 20% or 30% in PBS |
| T25 Culture Flask | Olympus Plastics | 25-207 | Vented caps |
| T75 Culture Flask | Olympus Plastics | 25-209 | Vented caps |
| Terg-A-zyme | Sigma | Z273287-1EA | Detergent. Working concentration: 1% |
| TeSR-E8 basal medium | Stemcell Technologies | 5940 | Human pluripotent stem cell (hPSC) medium |
| TeSR-E8 supplements | Stemcell Technologies | 5940 | Supplements for human pluripotent stem cell medium |
| TritonX-100 | Sigma | X100-500ML | Detergent for cell permeabilization. Working concentration: 0.25% in blocking buffer |
| Trypan blue | Invitrogen | T10282 | |
| Antibodies | |||
| AlexaFluor 488 | Thermofisher | A-11029 | Secondary antibody |
| AlexaFluor 594 | Thermofisher | A-11037 | Secondary antibody |
| Ezrin | Thermofisher | MA5-13862 | Primary antibody; astrocytes perisynaptic |
| GFAP | Chemicon | MAB360 | Primary antibody; astrocytes |
| GFP | Aves | GFP-1020 | Primary antibody; astrocytes |
| Glt1 | Gift from Dr. Jeffrey Rothstein | n/a | Primary antibody; astrocytes |
| Homer | Synaptic Systems | 160 011 | Primary antibody; neurons, post-synaptic |
| MAP2 | Synaptic Systems | 188 004 | Primary antibody; neurons |
| PSD95 | Abcam | ab2723 | Primary antibody; neurons, post-synaptic |
| S100 | Abcam | ab868 | Primary antibody; astrocytes |
| Synapsin 1 | Synaptic Systems | 106 103 | Primary antibody; neurons, pre-synaptic |
| TuJ1/β3-tubulin (TUBB3) | Covance | MMS-435P | Primary antibody; neurons |
Referências
- Ullian, E. M., Christopherson, K. S., Barres, B. A. Role for Glia in Synaptogenesis. Glia. 47, 209-216 (2004).
- Baldwin, K. T., Eroglu, C. Molecular mechanisms of astrocyte-induced synaptogenesis. Current Opinion in Neurobiology. 45, 113-120 (2017).
- Molofsky, A. V., et al. Astrocyte-encoded positional cues maintain sensorimotor circuit integrity. Nature. 509 (7499), 189-194 (2014).
- Sultan, S., et al. Synaptic Integration of Adult-Born Hippocampal Neurons Is Locally Controlled by Astrocytes. Neuron. 88, 957-972 (2015).
- Clarke, L. E., Barres, B. A. Emerging roles of astrocytes in neural circuit development. Nat Rev Neuroscience. 14 (5), 311-321 (2013).
- Cheung, G., Sibille, J., Zapata, J., Rouach, N. Activity-Dependent Plasticity of Astroglial Potassium and Glutamate Clearance. Neural Plasticity. , 109106(2015).
- Ghezali, G., Dallerac, G., Rouach, N. Perisynaptic astroglial processes dynamic processors of neuronal information. Brain Struct Funct. 221, 2427-2442 (2016).
- Kimelberg, H. K., Nedergaard, M. Functions of Astrocytes and their Potential As Therapeutic Targets. Neurotherapeutics. 7, 338-353 (2010).
- Pál, B. Astrocytic Actions on Extrasynaptic Neuronal Currents. Frontiers in Cellular Neuroscience. 9, 474(2015).
- Kiray, H., Lindsay, S. L., Hosseinzadeh, S., Barnett, S. C. The multifaceted role of astrocytes in regulating myelination. Experimental Neurology. 283, 541-549 (2016).
- Allen, N. J., Eroglu, C. Cell Biology of Astrocyte-Synapse Interactions. Neuron. 96 (3), 697-708 (2017).
- Krencik, R., van Asperen, J. V., Ullian, E. M. Human astrocytes are distinct contributors to the complexity of synaptic function. Brain Research Bulletin. 129, 66-73 (2017).
- Ullian, E. M., Sapperstein, S. K., Christopherson, K. S., Barres, B. A. Control of Synapse Number by Glia. Science. 291, 657-662 (2001).
- Oberheim Bush, N. A., Nedergaard, M. Do Evolutionary Changes in Astrocytes Contribute to the Computational Power of the Hominid Brain? Neurochemical Research. 42 (9), 2577-2587 (2017).
- Han, X., et al. Forebrain Engraftment by Human Glial Progenitor Cells Enhances Synaptic Plasticity and Learning in Adult Mice. Cell Stem Cell. 12 (3), 342-353 (2013).
- Inoue, H., Nagata, N., Kurokawa, H., Yamanaka, S. iPS cells: a game changer for future medicine. The EMBO Journal. 33 (5), 409-417 (2014).
- Shi, Y., Inoue, H., Wu, J. C., Yamanaka, S. Induced pluripotent stem cell technology a decade of progress. Nature Reviews Drug Discovery. 16 (2), 115-130 (2017).
- Dodla, M. C., Mumaw, J., Stice, S. L. Role of astrocytes, soluble factors, cells adhesion molecules and neurotrophins in functional synapse formation: implications for human embryonic stem cell derived neurons. Stem Cell Res Ther. , 251-260 (2010).
- Krencik, R., Ullian, E. M. A cellular star atlas: using astrocytes from human pluripotent stem cells for disease studies. Frontiers in Cellular Neuroscience. 7, 1-10 (2013).
- Pasca, S. P. The rise of three-dimensional human brain cultures. Nature. 553 (7689), 437-445 (2018).
- Huch, M., Knoblich, J. A., Lutolf, M. P., Martinez-arias, A. The hope and the hype of organoid research. Development. 144, 938-941 (2017).
- Mason, J. O., Price, D. J. Building Brains in a Dish: Prospects for Growing Cerebral Organoids from Stem Cells. Neuroscience. 334, 105-118 (2016).
- Kelava, I., Lancaster, M. A. Dishing out mini-brains: Current progress and future prospects in brain organoid research. Developmental Biology. 420 (2), 199-209 (2016).
- Kelava, I., Lancaster, M. A. Stem Cell Models of Human Brain Development. Cell Stem Cell. 18 (6), 736-748 (2016).
- Sloan, S. A., et al. Human Astrocyte Maturation Captured in 3D Cerebral Cortical Spheroids Derived from Pluripotent Stem Cells. Neuron. , 779-790 (2017).
- Krencik, R., et al. Systematic three-dimensional coculture rapidly recapitulates interactions between human neurons and astrocytes. Stem Cell Reports. 9 (6), 1745-1753 (2017).
- Chen, G., et al. Chemically defined conditions for human iPSC derivation and culture. Nature Methods. 8 (5), 424-429 (2011).
- Krencik, R., Zhang, S. -C. Directed differentiation of functional astroglial subtypes from human pluripotent stem cells. Nature Protocols. 6 (11), 1710-1717 (2011).
- Du, Z. -W., et al. Generation and expansion of highly pure motor neuron progenitors from human pluripotent stem cells. Nature Communications. 6, 6626(2015).
- Neely, M. D., et al. DMH1, a highly selective small molecule BMP inhibitor promotes neurogenesis of hiPSCs: Comparison of PAX6 and SOX1 expression during neural induction. ACS Chemical Neuroscience. 3 (6), 482-491 (2012).
- Lippmann, E. S., Estevez-Silva, M. C., Ashton, R. S. Defined Human Pluripotent Stem Cell Culture Enables Highly Efficient Neuroepithelium Derivation Without Small Molecule Inhibitors. Stem Cells. 32, 1032-1042 (2014).
- Eggan, K., Kawada, J., Kaneda, S., Kirihara, T., Maroof, A. Generation of a Motor Nerve Organoid with Human Stem Cell-Derived Neurons. Stem Cell Reports. 9, 1441-1449 (2017).
- Krencik, R., Weick, J. P., Liu, Y., Zhang, Z. -J., Zhang, S. -C. Specification of transplantable astroglial subtypes from human pluripotent stem cells. Nature Biotechnology. 29 (6), 528-534 (2011).
- Krencik, R., et al. Dysregulation of astrocyte extracellular signaling in Costello syndrome. Science Translational Medicine. 7 (286), 286(2015).
- Wang, C., et al. Scalable Production of iPSC-Derived Human Neurons to Identify Tau- Lowering Compounds by High-Content Screening. Stem Cell Reports. 9 (4), 1221-1233 (2017).
- Amin, H., Maccione, A., Marinaro, F., Zordan, S., Nieus, T., Berdondini, L. Electrical Responses and Spontaneous Activity of Human iPS-Derived Neuronal Networks Characterized for 3-month Culture with 4096-Electrode Arrays. Frontiers in Neuroscience. 10, (2016).
- Kapucu, F. E., Mäkinen, M. E., Tanskanen, J. M. A., Ylä-Outinen, L., Narkilahti, S., Hyttinen, J. A. K. Joint analysis of extracellular spike waveforms and neuronal network bursts. Journal of Neuroscience Methods. 259, 143-155 (2016).
- Ippolito, D. M., Eroglu, C. Quantifying Synapses: an Immunocytochemistry-based Assay to Quantify Synapse Number. Journal of Visualized Experiments. 45, 2-9 (2010).
- Zhang, Y., et al. Rapid single-step induction of functional neurons from human pluripotent stem cells. Neuron. 78 (5), 785-798 (2013).
- Odawara, A., Katoh, H., Matsuda, N., Suzuki, I. Physiological maturation and drug responses of human induced pluripotent stem cell-derived cortical neuronal networks in long-term culture. Scientific reports. 6, 26181(2016).
- Bardy, C., Hurk,, et al. Neuronal medium that supports basic synaptic functions and activity of human neurons in vitro. PNAS. 112 (25), E2725-E2734 (2015).
- Monzel, A. S., et al. Derivation of Human Midbrain-Specific Organoids from Neuroepithelial Stem Cells. Stem Cell Reports. 8, 1144-1154 (2017).
- Lancaster, M. A., Knoblich, J. A. Generation of cerebral organoids from human pluripotent stem cells. Nature Protocols. 9 (10), 2329-2340 (2014).
- Dutta, D., Heo, I., Clevers, H. Disease Modeling in Stem Cell-Derived 3D Organoid Systems. Trends in Molecular Medicine. 23 (5), 393-410 (2018).
- Lancaster, M. A., et al. Cerebral organoids model human brain development and microcephaly. Nature. 501 (7647), 373-379 (2013).
- Qian, X., et al. Brain-Region-Specific Organoids Using Mini-bioreactors for Modeling ZIKV Exposure. Cell. 165 (5), 1238-1254 (2016).
- Yan, Y., et al. Derivation of Cortical Spheroids from Human Induced Pluripotent Stem Cells in a Suspension Bioreactor. Tissue Engineering Part A. , 1-46 (2016).
- Obien, M. E. J., Deligkaris, K., Bullmann, T., Bakkum, D. J., Frey, U. Revealing neuronal function through microelectrode array recordings. Frontiers in Neuroscience. 9 (JAN), 423(2015).
- Hales, C. M., Rolston, J. D., Potter, S. M. How to Culture, Record and Stimulate Neuronal Networks on Micro-electrode Arrays (MEAs). Journal of Visualized Experiments. (39), 1-7 (2010).
- Shigetomi, E., Patel, S., Khakh, B. S. Probing the Complexities of Astrocyte Calcium Signaling. Trends in Cell Biology. 26 (4), 300-312 (2016).
- Bagley, J. A., Reumann, D., Bian, S., Lévi-strauss, J., Knoblich, J. A. Fused cerebral organoids model interactions between brain regions. Nat Methods. 14 (7), (2017).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados