Method Article
Microcircuito sinaptica modellazione con 3D Cocultures di astrociti e neuroni da cellule staminali pluripotenti umane
In questo articolo
Riepilogo
In questo protocollo, ci proponiamo di descrivere un metodo riproducibile per combinare dissociato pluripotenti umane su cellule staminali neuroni e astrociti insieme in 3D sfera cocultures, mantenendo queste sfere in condizioni galleggiante libera e successivamente misurazione dell'attività sinaptica circuito delle sfere con immunoanalysis e registrazioni di matrice multielettrodo.
Abstract
Una barriera alla nostra comprensione di come i vari tipi di cellule e segnali contribuiscono alla funzione sinaptica circuito è la mancanza di modelli pertinenti per lo studio del cervello umano. Una tecnologia emergente per affrontare questo problema è l'uso di tre dimensionale culture di cellule neurali (3D), definito 'organoids' o 'sferoidi', per la conservazione a lungo termine delle interazioni intercellulari tra molecole di adesione extracellulare. Tuttavia, questi sistemi di coltura sono che richiede tempo e non sistematicamente generato. Qui, abbiamo dettaglio un metodo per rapidamente e costantemente produrre 3D cocultures di neuroni e astrociti da pluripotenti umane cellule staminali. In primo luogo, pre-differenziati astrociti e progenitori neurali sono dissociati e conteggiati. Successivamente, le cellule sono combinate nella formazione di sfera piatti con un inibitore della Rho-chinasi e a rapporti specifici per produrre sfere di dimensioni riproducibili. Dopo diverse settimane di cultura come sfere galleggianti, cocultures ('asteroidi') sono infine cimentarsi per immunostaining o placcato su matrici multielettrodo per misurare la forza e la densità sinaptica. In generale, si prevede che questo protocollo produrrà sfere 3D neurale che visualizzare i marcatori di cellula-tipo maturo limitato, formano delle sinapsi funzionali e presentano attività di rete sinaptica spontanea di scoppio. Insieme, questo sistema permette lo screening di stupefacenti e le indagini sui meccanismi della malattia in un modello più adatto rispetto a colture dello strato monomolecolare.
Introduzione
Gli astrociti sono un tipo molto abbondante delle cellule glial all'interno del sistema nervoso centrale (SNC) con una varietà di responsabilità funzionali di là di sostegno strutturale. Attraverso la secrezione di fattori solubili synaptogenic e componenti della matrice extracellulare (ECM), astrociti aiutano di clustering delle sinapsi mature durante sviluppo1e l'istituzione. Anche giocano un ruolo critico nel mantenimento della salute e la plasticità delle sinapsi attraverso segnalazione extracellulare2,3,4,5e contribuire alla stabilità a lungo termine di omeostatico ambienti regolando la concentrazione extracellulare del potassio e del glutammato, come pure la secrezione di substrati energetici e ATP6,7,8. Infine, essi possono contribuire alla neurotrasmissione influenzando le correnti extrasynaptic9e indirettamente possono influenzare l'attività attraverso altri tipi di cellule come la promozione della mielinizzazione10. Cosa importante, perché l'anomalia o disfunzione dei astrocytes può portare a molte sindromi dello sviluppo neurologico e neuropatologia adulto, c'è un'evidente necessità di includere astrociti a fianco di neuroni all'interno di reti neurali ingegnerizzati in ordine per una migliore modello dell'ambiente endogeno del cervello. Una caratteristica integrante degli astrociti è la loro capacità di interazioni dinamiche di forma con le sinapsi neuronali1,11,12. In assenza della glia, i neuroni formano un numero limitato di sinapsi, che in generale anche la mancanza di maturità funzionale13.
Gli astrociti umani visualizzano caratteristiche morfologiche, trascrizionale e funzionale — come aumento delle dimensioni e della complessità di ramificazione, così come specie-specifici geni — che non sono si ricapitola in roditori12,14, 15. Di conseguenza, gli studi che utilizzano cellule staminali pluripotenti umane (hPSC)-cellule neurali derivate hanno diventare ampiamente accettate come mezzo di esaminare malattie CNS-relative in vitro durante lo sviluppo di nuove terapie, lesioni modelli e paradigmi della cultura16 ,17. Inoltre, hPSCs consente lo studio della formazione della sinapsi umana e funzione senza l'esigenza primaria del tessuto18,19.
Una barriera alla nostra comprensione di come i vari tipi di cellule e segnali contribuiscono alla funzione sinaptica circuito è la mancanza di modelli pertinenti del cervello umano. C'è bisogno di una piattaforma adeguata di ricapitolare le sue reti sinaptiche con alta fedeltà e riproducibilità. Recentemente, l'interesse è emerso nella produzione di sistemi di coltura 3D (largamente conosciuto come 'organoids', 'sferoidi', o 'mini cervelli')20 per modellare complessi tridimensionali (3D) strutture a livello cellulare e macro. Sistemi di coltura 3D mantengono interazioni ECM e cellula-cellula che sono normalmente assente o limitata durante coculture 2D tipici paradigmi21,22. Esiste una grande varietà di tecniche per la coltura di sferoidi neurale 3D23,24,25; Tuttavia, molti richiedono cultura lunghi periodi (mesi-anni) per sviluppo spontaneo e la conservazione di strato, con l'utente che esibiscono molto poco controllo sull'output.
Qui, vi illustriamo un metodo sistematico per rapidamente e costantemente bioingegnere neurale interazioni tra più tipi di cellule (neuroni pre-differenziati e astrociti) derivato da hPSCs assemblando cellule in cocultures sfera (asteroidi)26 che ricapitolano umane specifiche complessità morfologica in 3D. Questo sistema ad alta densità neuronale genera sottotipi neurali uniformemente dispersi che assumere proprietà matura nel tempo e possono essere schermati o analizzati in un modo ad alta velocità. Dimostriamo per la prima volta che gli astrociti umani inducono attività di burst di rete sinaptica in questi cocultures 3D. Inoltre, questo protocollo è facilmente adattabile per generare sfere di diverse dimensioni, di utilizzare celle specificate per diverse identità regionali del SNC e per studiare le interazioni di più altri tipi di cellulari come desiderato.
Protocollo
1. cellula cultura e preparazione dei reagenti
Nota: I protocolli in questa sezione sono scritti nell'ordine in cui appaiono nel protocollo di differenziazione (sezione 2). Vedere la Tabella dei materiali per i materiali e i numeri di catalogo.
-
Preparare piastre per colture cellulari.
- Diluire la soluzione di rivestimento di matrice extracellulare (ECM) con DMEM/F12 media per preparare un 1 mg/mL soluzione di riserva. Aliquotare ECM diluito soluzione di riserva in 30 provette coniche da 3 ml e immediatamente conservare a-20 ° C. Per una soluzione di lavoro, risospendere 3 mL di brodo di ECM in 33 mL di pre-refrigerati DMEM/F12 media, portando il volume totale a 36 mL per una concentrazione di 80 µ g/mL.
- Cappotto 1 mL / pozzetto di una piastra di coltura delle cellule 6-pozzetti con soluzione di lavoro di ECM. Aggiungere un ulteriore 1 mL DMEM/F12 per pozzetto (se necessario) per garantire che la superficie del pozzo è completamente coperto. Consentire la cella 6 pozzetti rivestite con piastre di coltura a riposare a temperatura ambiente per almeno 1 h prima dell'uso.
Nota: Piastre possono essere conservati nell'incubatore o a 4 ° C fino a 2 settimane.
-
Preparare formulazioni media, fattori di crescita e piccole molecole.
- Per preparare 500 mL di pluripotenti umane della cellula formativa (hPSC) medio27, aggiungere x 20 e 500 x integratori secondo le indicazioni del produttore.
- Per preparare 500 mL di terreno neurale (NM), è necessario aggiungere eparina a una concentrazione finale di 2 mg/mL, 1 x della soluzione di antibiotico/antimicotico, 1 x B27 o il 1 x N2 supplemento ad una bottiglia di 500 mL di DMEM/F12 con supplemento di L-glutammina come precedentemente dettagliata28.
- Per preparare un 10mm (1, 000 x) soluzione di Rho-chinasi inibitore Y27632 (Y), aggiungere 10 mg di polvere in 3 mL di tampone fosfato salino (PBS). Filtro sterilizzare, aliquota e conservare a-20 ° C. Utilizzare ad una concentrazione di lavoro 10 µM nei media.
- Per preparare un 20 mM (10, 000 x) soluzione di SB431542, aggiungere 10 mg di polvere in 1,3 mL di solfossido dimetilico (DMSO). Per preparare un 2mm (1, 000 x) soluzione di DMH1, aggiungere 10 mg di polvere in 13,1 mL di DMSO. Filtro sterilizzare, aliquota e conservare ogni soluzione a-20 ° C. Utilizzare ciascuno ad una concentrazione di lavoro 2 µM in media (NM + SB431542 + DMH1).
Nota: Questo protocollo raccomanda 2 concentrazioni di lavoro µM di entrambi SB431542 e DMH1 basate su nostre osservazioni e segnalazioni da altri29 affermando che questa concentrazione promuove efficacemente induzione neurale da hPSCs. Concentrazioni più elevate sono stati anche segnalati30. Inoltre, con media alternativi, esso ha anche dimostrato che piccole molecole non sono necessari per conversione neurali ad alta31. Così, le concentrazioni di lavoro variano a seconda di ambienti di cultura alternativa cellulare e concentrazioni ottimali dovrebbero essere testate da singoli ricercatori. - Per preparare singole 100 µ g/mL (10, 000 x) soluzioni di riserva di fattore di crescita epidermico (EGF) e fattore di crescita del fibroblasto-2 (FGF2), aggiungere 1 mg di ciascuno in 10 mL di PBS + 0.1% BSA. Aliquotare EGF e FGF2 soluzioni di riserva in aliquote di 50 µ l e conservare a-80 ° C. Utilizzare ciascuno ad una concentrazione di lavoro 10 ng/mL nei media; ad esempio, aggiungere 5 µ l EGF e 5 µ l FGF2 a 50 mL di nanometro (NM + EGF e FGF2).
- Per preparare una soluzione stock di doxiciclina cloridrato (Dox), prima di sciogliere la polvere in DMSO a 100 mg/mL e conservare a-20 ° C. Diluire ulteriormente per fare un 2 mg/mL (1, 000 x) soluzione in PBS e conservare a-20 ° C. Utilizzare alla concentrazione di lavoro 2 µ g/mL nei media; ad esempio, aggiungere 50 µ l Dox a 50 mL di nanometro (NM + Dox).
Nota: Non ricongelare soluzioni dopo lo scongelamento.
2. generazione dei sottotipi neurali da umano cellule pluripotenti indotte (hPSCs)
Nota: Tutte le colture delle cellule dovrebbero essere mantenute in un incubatore con 5% CO2 a 37 ° C. Queste culture sono mantenute a livelli di ossigeno di camera, anche se i livelli più bassi possono essere utilizzati.
-
Generare e mantenere dei progenitori di astrociti (hAstros) da hPSCs.
Nota: Questa sezione fornisce un protocollo di differenziazione breve e semplificata. Per una descrizione dettagliata (con formazione embryoid body, selezione di Rosetta e passaggi regionali patterning) fare riferimento al protocollo descritto in precedenza28 (Figura 1A, verde riquadro tratteggiato).- Cluster di seme di hPSCs (Figura 1B) su piastre da 6 pozzetti rivestite con ECM (Vedi punto 1.1) con 2 mL di medium di hPSC + Y per pozzetto. Nutrire le cellule staminali ogni giorno fino a quando essi sono circa il 50% confluenti e suddividere secondo le necessità.
- Per dividere hPSCs, aggiungere 1 mL di reagente di passaggio a pozzetti ed aspirare dopo 1 min. cellule di incubare a temperatura ambiente per 5 minuti, aggiungere 1 mL di mezzo di hPSC e dividere aggregati 01:10 su nuovi pozzi rivestite con ECM in 2 mL di medium di hPSC + Y per pozzetto.
- Mantenere le cellule staminali fino a quando essi sono circa 50% confluenti, quindi la media di cambiamento a NM + SB431542 + DMH1 per indurre la differenziazione neurale (giorno 0). Quando le cellule sono circa il 95% confluenti, dividere 1:6 in nuovi pozzi rivestite con ECM sullo stesso supporto.
- Il giorno 14, dissociare le cellule con soluzione di distacco e trasferimento a un pallone non rivestiti con Y per promuovere la formazione di aggregati.
Nota: L'aggiunta di Y è utilizzato per promuovere la formazione delle cellule della sopravvivenza e sfera ma non è incluso nel corso di ogni feed. - Per la generazione di progenitori neurali e neuroni (hNeurons), è necessario utilizzare queste cellule di giorno-14 come descritto di seguito. In alternativa, utilizzare queste cellule a intervalli di tempo più tardi da colture monostrato o sfera prima maturazione neuronale si verifica o gliogenesis comincia.
Nota: Per impostazione predefinita, questo protocollo produce dorsale-cortical astrocytes. Sottotipi di astrociti possono tuttavia essere regionalmente specificati tramite l'aggiunta di patterning morfogeni volendo28,32,33. Acido retinoico (RA) può essere aggiunto per caudalize le cellule nel midollo spinale fenotipi, mentre sonic hedgehog (SHH), lisciate agonista (SAG), o purmorphamine producono fenotipi ventrali. - Per la generazione dei progenitori di astrociti e astrociti formatisi spontaneamente 3D degli aggregati (hAstrospheres), passare a NM + EGF + FGF2 e alimentare settimanale (o come necessario per garantire il pH stabile) come precedentemente dettagliate34.
- Delicatamente dissociare hAstro aggregati con soluzione di distacco quando scuri centri appaiono e rimuovere le sfere che spontaneamente allegare. Rompere sfere delicatamente una volta alla settimana per mantenere la salute sfera ed evitare Core necrotici.
Nota: Non superare i 5 min di trattamento con soluzione di distacco. - Dopo 4-6 mesi di espansione, confermare identità cellulare e sia congelare in mezzo di crioconservazione (secondo le istruzioni del produttore) o archiviazione alternativo condizioni per la conservazione a lungo termine in azoto liquido, o utilizzare immediatamente per sperimentazione.
- Delicatamente dissociare hAstro aggregati con soluzione di distacco quando scuri centri appaiono e rimuovere le sfere che spontaneamente allegare. Rompere sfere delicatamente una volta alla settimana per mantenere la salute sfera ed evitare Core necrotici.
- Per scongelare un azione congelate di hAstrospheres, scongelare rapidamente una fiala a temperatura ambiente, trasferimento il contenuto in un tubo conico vuoto 15 mL e centrifugare a 300 x g per 1 min. aspirare il supernatante, lavare accuratamente con DMEM/F12 e ripetizione per un totale di due wash a pochi passi. Aggiungere un matraccio T25 con un volume totale di 6 mL di EGF, NM + Y + FGF2 (o scalare come necessario).
- Cluster di seme di hPSCs (Figura 1B) su piastre da 6 pozzetti rivestite con ECM (Vedi punto 1.1) con 2 mL di medium di hPSC + Y per pozzetto. Nutrire le cellule staminali ogni giorno fino a quando essi sono circa il 50% confluenti e suddividere secondo le necessità.
-
Generare e mantenere neuroni inducibili (iNeurons) da hPSCs.
- Semi transgenici hPSCs (con un transgene stabile doxiciclina-inducible neurogenina 235) su rivestite con ECM 6-pozzetti con 2 mL di medium di hPSC + Y per pozzetto (come descritto sopra per le linee non transgenici). Avanzamento con 2 mL di media di tutti i giorni per bene finché non sono pronti a sollevare al 70% confluency. Dividere le celle come descritto al punto 2.1.2.
- Quando le cellule sono circa il 35% confluenti, aggiungere NM + Dox per indurre la differenziazione in iNeurons. Mantenere come coltura monostrato con NM + Dox per 2 giorni prima di procedere al punto 3.2.
Nota: Le cellule saranno di transizione nei progenitori neuronali ma non sarà ancora estendere neurites (Figura 1).
3. preparazione e manutenzione della sfera 3D Cocultures
- Dissociare hAstros da 3D aggregati in sospensione (come descritto nel passaggio 2.1.5.1).
-
Dissociare hNeurons o iNeurons da un monostrato 2D.
- Rimuovere il supporto da 6 pozzetti e aggiungere 500 µ l di soluzione di distacco a ciascuno contenente ben culture dello strato monomolecolare. Incubare a 37 ° C per 5 min. delicatamente, aggiungere 2-3 mL DMEM/F12 per rimuovere cellule allegate.
- Raccogliere le cellule e i media in una provetta conica da 15 mL e centrifugare a 300 x g per 1 min. aspirare il supernatante, aggiungere 1 mL di terreno fresco e pipetta su e giù delicatamente con una micropipetta di 1.000 µ l per ottenere una sospensione di singola cellula.
-
Sfere 3D forma utilizzando piastre microtiter per colture.
- Preparare il piatto aggiungendo 0,5 mL di soluzione per sciacqui anti-aderenza in ciascun pozzetto della piastra microtiter. Centrifugare la piastra a 2.000 x g per 5 min, soluzione per sciacqui aspirato, aggiungere 1 mL di DMEM/F12 ad ogni pozzetto per lavare e aspirare nuovamente.
Nota: Assicurarsi sempre che la centrifuga sia bilanciata durante l'uso. - Contare ogni tipo di cellula utilizzando un emocitometro o contatore di cellule automatizzato. Aggiungere desiderato rapporto di dissociata hAstros e hNeurons o iNeurons ad ogni pozzetto in un volume totale di 2 mL di NM + Y (includere Dox se iNeurons sono utilizzate). Centrifugare la piastra a 100 x g per 3 min e riporre nell'incubatore.
Nota: piastre microtiter 24 pozzetti (vedere la Tabella materiali) contengono 300 micropozzetti per pozzetto. Aggiungere un minimo di 6 x 105 celle (per sfere di 2 x 103 celle ciascuna) e un massimo di 6 x 106 celle (per sfere di 2 x 104 celle ciascuna) in 2 mL di media per pozzetto. Per le sfere vitali di una densità specifica all'interno di questo intervallo, utilizzare una quantità definita di cellule e dividere per 300 per calcolare il numero di cellule per sfera. Alternativa sfera formando i metodi e gli strumenti può essere utilizzato anche se lo si desidera. Seguire le istruzioni del produttore per intervalli accettabili di densità delle cellule. - Consentire alle cellule di assemblarsi in sfere densamente imballati all'interno di piastre microtiter oltre i 2 giorni successivi (Figura 2A). Sostituire 50% media se la cultura è ingiallimento.
Nota: Scambiano supporti solo la metà e pipettare delicatamente durante la rimozione e aggiunta di file multimediali in modo da non disturbare le sfere. Sfere possono sollevare dai micropozzetti e si fondono insieme con maggiore forza. - Dopo 2 giorni, rimuovere delicatamente sfere da pozzetti con una micropipetta di 1.000 µ l (Figura 1). Il fondo dei micropozzetti con supporti per rimuovere eventuali ulteriori sfere aderite leggermente applicare forza. Lasciate che sfere stabilirsi in una provetta conica da 15 mL, aspirare i vecchi media e aggiungere contenuti multimediali fresco.
- Preparare il piatto aggiungendo 0,5 mL di soluzione per sciacqui anti-aderenza in ciascun pozzetto della piastra microtiter. Centrifugare la piastra a 2.000 x g per 5 min, soluzione per sciacqui aspirato, aggiungere 1 mL di DMEM/F12 ad ogni pozzetto per lavare e aspirare nuovamente.
-
Impostare il sistema di bioreattore spinner flask per formare sfere 3D.
- Pulire la superficie di una piastra magnetica con etanolo al 70%, metterlo in un'incubatrice di coltura cellulare. Boccette individuale filatore di autoclave per sterilizzare.
- Aggiungere sfere con un minimo di media di 50 – 60 mL per ciascuna beuta spinner (Figura 1, inserto). Collocare la beuta sulla piastra magnetica impostata su 60 rpm. Sfere di cultura in boccette spinner finché non sono pronti per la raccolta dati.
Nota: Un minimo di 3 settimane in cultura è necessaria per la formazione della sinapsi. Se non è desiderato il sistema spinner flask bioreattore, sfere possono essere coltivate in condizioni stazionarie in coltura o piatti. Sfere possono anche essere incorporati nella ECM o idrogel.
4. misurazione della fisiologia sinaptica dal vivo con matrici multielettrodo (MEA)
-
Preparare MEAs per colture cellulari.
- Pulire la superficie di ogni MEA con 1 mL di detergente per 1 h. risciacquo con acqua deionizzata sterile di (DI), sciacquare con etanolo al 70% per sterilizzare e poi asciugare in biosicurezza ai raggi UV.
Nota: MEAs possono essere memorizzati in acqua distillata a 4 ° C in condizioni di sterilità fino all'utilizzo. - Preparare una soluzione di 0,5 mg/mL di poli-ornitina (PLO) sciogliendo 50 mg di PLO in 100 mL di tampone di acido borico. Rivestire la superficie di ogni MEA con 1 mL di PLO per rendere la superficie idrofila e incubare a 37 ° C per un minimo di 4 h. Rimuovi l'OLP, lavare la superficie con dell'acqua distillata, aggiungere 1 mL di ECM (Vedi punto 1.1.1) e incubare a 37 ° C per un minimo di 4 h.
- Rimuovere ECM e posizionare le sfere in 1,5 mL di media su una superficie MEA, assicurandosi che le sfere siano posizionate in cima l'array di elettrodi (figure 3A, 3A'). Consentono di aderire per 2 giorni. Cambiare la metà dei media ogni 2 – 3 giorni (o più spesso se necessario), garantendo che le sfere non sono disturbate.
Nota: Aggiunta di fattori di crescita può migliorare la maturazione e la sopravvivenza della cultura.
- Pulire la superficie di ogni MEA con 1 mL di detergente per 1 h. risciacquo con acqua deionizzata sterile di (DI), sciacquare con etanolo al 70% per sterilizzare e poi asciugare in biosicurezza ai raggi UV.
-
Misurare l'attività elettrica delle sfere neurale.
- Impostare un sistema di matrice multielettrodo (MEA) con un headstage a temperatura controllata. Creare un programma con un filtro passa-alto di 5 Hz, un filtro passa-basso di 200 Hz e una soglia di spike di deviazione di 5 x standard (SD).
- Posizionare il MEA headstage e record di attività elettrica spontanea (Figura 3BB'). Salvare dati grezzi tra cui spike frequenza e ampiezza per l'analisi statistica.
Nota: Un sistema di perfusione può essere utilizzato con il MEA per aggiungere agenti farmacologici o per aumentare il flusso di mezzi freschi per registrazione a lungo termine. Post-elaborazione aggiuntiva di picchi devono essere eseguito come desiderato36,37.
5. misurazione della densità sinaptica con immunocitochimica
-
Preparare i reagenti.
- Per rendere un 500 mL di soluzione madre di paraformaldeide al 4% (PFA), aggiungere 400 mL di 1X PBS per un bicchiere di vetro o un piatto di mescolare in un cappuccio ventilato. Aggiungere ancoretta e calore a 60 ° C mescolando; non bollire. Aggiungere 20 g di polvere PFA per la soluzione di PBS riscaldata e alzare il pH 6,9 aggiungendo lentamente 1 N NaOH goccia a goccia.
Nota: la soluzione al 4% PFA può essere aliquotati e conservati a 4 ° C fino ad un mese. - Aggiungere 20 o 30 g di saccarosio per 100 mL di PBS per fare 20% e 30% soluzioni di saccarosio, rispettivamente.
- Aggiungere 1 mL di detergente a 10 mL di PBS per preparare una soluzione di riserva del 10%. Invertire più volte per omogeneizzare.
- Aggiungere 250 µ l di soluzione di riserva detergente 10% (concentrazione finale di 0,25%) e 500 µ l di sieri di capra e asino (concentrazione finale del 5% ciascuno) a 10 mL di PBS per preparare il tampone di bloccaggio primario.
- Aggiungere 100 µ l di sieri di capra e asino (concentrazione finale di 1% ciascuno) a 10 mL di PBS per preparare il tampone di bloccaggio secondario.
- Per rendere un 500 mL di soluzione madre di paraformaldeide al 4% (PFA), aggiungere 400 mL di 1X PBS per un bicchiere di vetro o un piatto di mescolare in un cappuccio ventilato. Aggiungere ancoretta e calore a 60 ° C mescolando; non bollire. Aggiungere 20 g di polvere PFA per la soluzione di PBS riscaldata e alzare il pH 6,9 aggiungendo lentamente 1 N NaOH goccia a goccia.
-
Preparare i campioni.
- Trasferire le sfere in una provetta conica da 15 mL, permesso di stabilirsi nella parte inferiore del tubo e aspirare i vecchi media. Sciacquare le sfere con 500 µ l di PBS, lasciare depositare ed aspirare PBS. Aggiungere 500 µ l di 4% PFA (o abbastanza per coprire le sfere) e incubare a 4 ° C per 30 min.
- Aspirare il PFA e delicatamente lavare due volte con PBS. Aggiungere la soluzione di saccarosio al 20% e incubare a 4 ° C per diverse ore o durante la notte. Aspirare accuratamente, aggiungere la soluzione di saccarosio al 30% e incubare a 4 ° C per diverse ore oppure solo pernottamento.
Nota: I campioni possono essere conservati a 4 ° C in PBS o saccarosio per fino a 1 settimana prima di procedere al passaggio successivo. Se non affettare, mantenere come sfere 3D (fig. 4A-C) in una provetta da 1,5 mL e passare al punto 5.3. - Se affettando le sfere, trasferire con cautela sfere per un incorporamento stampo criogenico in cima a ghiaccio secco. Aspirare la soluzione di saccarosio 30% e versare lentamente il tessuto che soluzione nello stampo fino a coprire completamente il campione, evitando bolle d'aria. Attendere fino a quando la soluzione si blocca e conservare a-80 ° C fino al criostato affettare.
- Utilizzando un criostato a-20 ° C, affettare i blocchi incorporati in 30 µm sezioni (o come desiderato) e trasferimento a vetrini. Conservare a-80 ° C fino al momento di macchia.
-
Immunostain le sfere.
- Delineare i bordi delle diapositive con una penna PAP idrofobica per evitare fuoriuscite di liquida. Preparare soluzioni blocchi primari e secondari con gli anticorpi (Vedi la Tabella materiali). Aggiungere 500 µ l di tampone bloccante primario a ogni diapositiva o tubo e incubare a temperatura ambiente per 30 min.
- Rimuovere il liquido, aggiungere 500 µ l di tampone bloccante primario fresco con gli anticorpi primari diluiti a ogni diapositiva o tubo e incubare per una notte a 4 ° C. Rimuovere la soluzione di anticorpo primario e lavare 3 volte con PBS per 10 minuti ciascuno.
- Aggiungere 500 µ l di tampone di bloccaggio secondario con anticorpi secondari diluiti a ogni diapositiva o tubo e incubare a 4 ° C per 1 h. soluzione di anticorpo secondario di rimuovere e lavare 3 volte con PBS per 10 minuti ciascuno.
Nota: Viene fornito un elenco degli anticorpi consigliati nella Tabella materiali. Altri anticorpi o coloranti possono essere utilizzati come desiderato. Non esporre campioni fluorescenti alla luce (poi passo 5.3.3). - Aggiungere 50 µ l di soluzione goccia a goccia per coprire la superficie e posizionare un vetrino coprioggetto sopra la diapositiva, evitando bolle di montaggio. Lasciare i vetrini asciugare a temperatura ambiente per 24 h e conservare a 4 ° C.
-
Le diapositive di immagini.
- Utilizzare un microscopio a fluorescenza confocale o due fotoni con un 63 X obiettivo a immersione in olio a immagine pre- e post-sinaptico proteina abbondanza e colocalizzazione entro fette sfera (Figura 4). Utilizzare un 20x o obiettivo 40x per visualizzare le caratteristiche morfologiche della hAstros.
- File di immagine di fluorescenza aperta con software ImageJ. Contare pre- e post-sinaptica puncta manualmente utilizzando il contatore di cellule plug-in, utilizzando un metodo di conteggio imparziale come precedentemente dettagliate38, o con metodi alternativi.
Risultati
Quando eseguita correttamente, questo protocollo produrrà popolazioni definite di cocultures funzionale di astrociti28,33,34 e neuroni35 generato da hPSCs (Figura 1A-1C), come dettagliate in precedenza26 e qui descritto ai punti 2.1-2.2. Questa procedura graduale, con l'uso di piastre microtiter, è previsto per produrre sfere 3D neurale di consistenti dimensioni e la forma (punto 3.3; Figura 1) con cellule disperse uniformemente e senza significativi segni di morte delle cellule. Una gamma di densità delle cellule, a cominciare un rapporto desiderato di tipi cellulari, produrrà sfere di varie dimensioni. In assenza di piastre microtiter, le cellule si combinano per formare aggregati significativamente più grandi e non uniforme cui diametri (> 2 mm) superano il limite di diffusione (Figura 2A-2B). Si prevede che l'utilizzo di un bioreattore filatore di pallone o equivalente sarà mantenere uniformità tra sfere e ridurre la fusione (punto 3.4; Figura 2). Tuttavia, mentre boccette spinner permettono per la cultura delle sfere per settimane, il loro uso non è necessario.
Per stabilizzare cocultures per analisi elettrofisiologica, che imita ECM substrati consentono sfere aderire prontamente pur mantenendo la loro struttura 3D (Figura 3A, 3A'). Durante le registrazioni, sani sfere di iNeurons immessi sul MEAs susciterà spontaneamente picchi di tensione maggiore di ± 40 µV con frequenze di infornamento coerente (passaggi 4.1 – 4.2; Figura 3B -C, 3F). Coculture sfere sono previsto per visualizzare una maggiore connettività di rete con la presenza di hAstros, con un conseguente aumento di burst di rete sincrona di picchi (Figura 3B' C -3 '). L'applicazione di CNQX35,39,40, un antagonista del recettore AMPA postsinaptico, riduce rete burst sincronia nelle sfere coculture (Figura 3D'-3E').
Marcatori delle proteine neurali cellula-tipo limitato dimostrano visivamente la disposizione uniformemente dispersi e la maturità di astrociti e neuroni all'interno di sfere 3D. Una sporgenza massima di astrociti morfologia e ramificazione è mostrato in Figura 4A in una sfera 3D rappresentanza con hAstros scarsamente etichettati con membrana-limitano GFP. Maturo hAstros esprimono marcatori tra cui GFAP (Figura 4B), S100B e Glt134, mentre hNeurons e iNeurons esprimono la proteina microtubule-collegata 2 (MAP2; Figura 4) e tubulina beta 3 (Tuj1/TUBB3). Infine, anche se iNeurons esprimere proteine pre- e post-sinaptiche, tra cui la sinapsina 1 (Syn1) e Homer o PSD95, rispettivamente, densità sinaptica è migliorata significativamente dalla presenza di hAstros in coculture (Figura 4)26. Se disponibile, l'uso alternativo del cervello foglio leggero microscopia e tecniche di compensazione permetterà rappresentazione rapida delle sfere intatti.
Presi insieme, l'espressione di marcatori neurali maturi insieme a un'attività elettrica spontanea confermano il successo del protocollo dettagliato sopra nella produzione 3D cocultures di microcircuiti sinaptici funzionali.
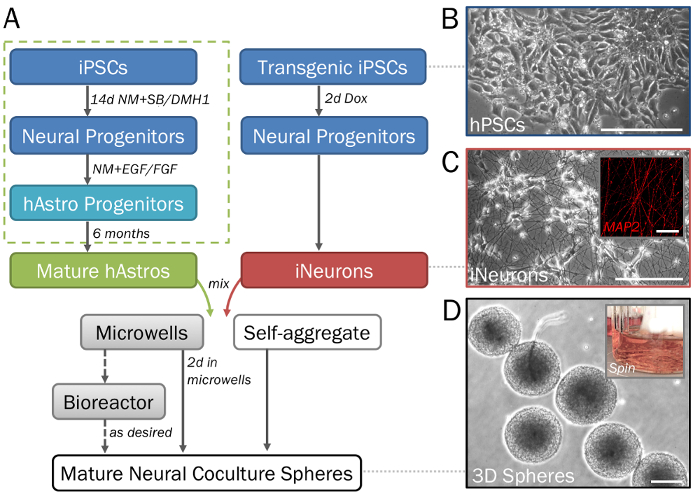
Figura 1: raffigurazione graduale della differenziazione e formazione delle sfere 3D neurale derivato da hPSCs. (A) Timeline dei passaggi chiave nel protocollo. (B) popolazioni Pure di cellule neurali possono essere generati da cellule staminali pluripotenti indotte umane (hPSCs). Per la generazione dei progenitori di astrociti (casella verde punteggiata), vedere passaggio 2.1 nonché Ref28. (C) neuroni inducibile (iNeurons; si veda sezione 2.2) generati da transgenici hPSCs via indotta sovraespressione di neurogenina 2 dimostrare morfologia neuronale su 2D ECM (giorno 7) e sono positivi per MAP2 (da incasso). Sfere (D) rimossi dalle piastre microtiter (Vedi punti 3.1-3.3) dimostrano la dimensione coerente per high throughput screening. Sfere possono essere coltivate in un bioreattore di boccetta di spinner (inset; Vedi punto 3.4) se si desidera impedire la fusione. Barra della scala = 50 µm (C, interno). Scala bar = 200 µm (A, D). Clicca qui per visualizzare una versione più grande di questa figura.
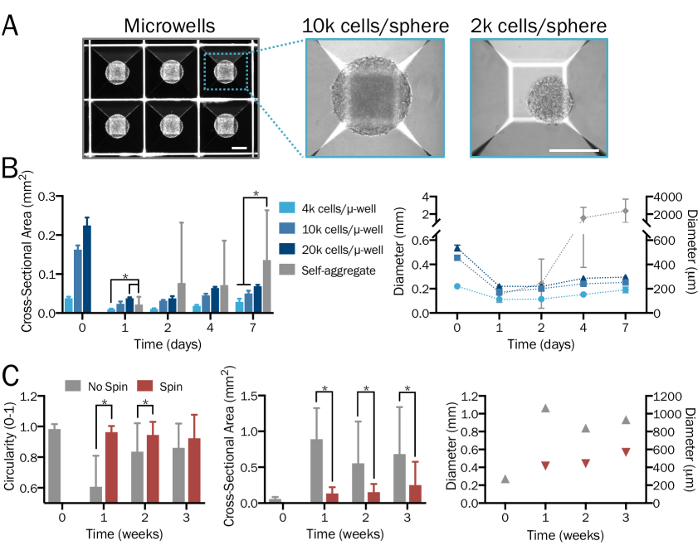
Figura 2: generazione sistematica e riproducibile delle sfere neurale 3D bioingegnerizzati. (A) piastre di coltura microtiter (µ-bene) vengono utilizzati per formare sfere 3D neurale della densità desiderata e rapporti del neurone-a-astrocyte in modo sistematico e specificato dall'utente, dando forma e dimensioni costanti. Immagini vengono mostrate 1 giorno dopo la formazione della sfera. Scala bar = 200 µm. (B) produce una gamma di a partire di densità delle cellule (da 4 x 103 a 2 x 104 cellule per microtiter) sfere di varie dimensioni. In assenza di piastre microtiter, hPSCs si combinano per formare aggregati significativamente più grandi e non uniforme cui diametri superano il limite di diffusione dopo una settimana (n = 6-14 sfere per ogni punto di tempo e di gruppo). (C) Tatal sfere coltivate in una boccetta di spinner a 80 giri ha esibito meno fusione e così erano significativamente più piccoli, più uniforme ed esibita una maggiore circolarità rispetto a quelli nella cultura stazionario per un periodo di tre settimane (n = 6-51 sfere per ogni punto di tempo e di gruppo). Appezzamenti rappresentano la media ± SD; * indica il significato (p < 0,05) tra gruppi, determinato utilizzando due code t-test. Clicca qui per visualizzare una versione più grande di questa figura.
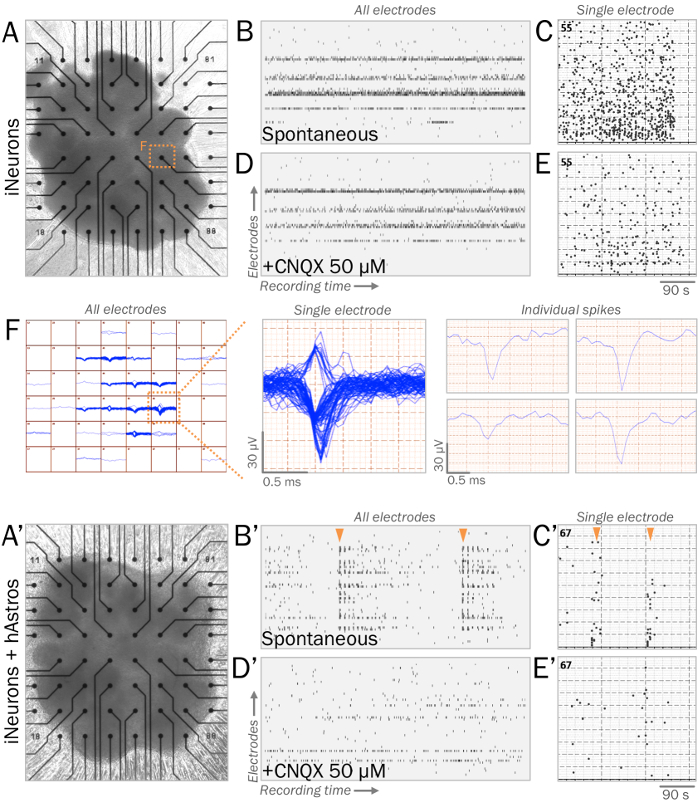
Figura 3: fisiologia sinaptica diretta rappresentanza delle sfere neurale su matrici multielettrodo (MEAs). (A, A') MEAs sono utilizzati per misurare la fisiologia sinaptica diretta delle sfere neurale. Sfere di iNeurons (A) o cocultures di iNeurons e hAstros (A') possono essere coltivati su superfici MEA con substrati che imita ECM (Vedi punto 4.1). (B, B') Raster trame di attività elettrica spontanea rappresentative misurate attraverso tutti gli elettrodi (asse verticale) durante una finestra di registrazione (asse orizzontale). Dopo 4 settimane di cultura medio basale neurofisiologici41, Tatal sfere (B) visualizzato picchi spontanee, mentre coculture delle sfere (B) ha rivelato scoppi di rete maggiore di schemi di attivazione sincrona (frecce arancioni). (C, C') Istogramma di picchi misurati durante windows registrazione MEA dagli elettrodi rappresentativi. (D, D') Appezzamenti di raster di attività elettrica spontanea misurato attraverso tutti gli elettrodi dopo l'applicazione di 50 µM CNQX, un antagonista del recettore AMPA (stessa scala del tempo come B, B'). CNQX eliminato la presenza di burst sincrono di picchi osservati in cocultures (D'). (E, E') istogramma di picchi misurati durante windows registrazione MEA dagli elettrodi rappresentante dopo l'applicazione di CNQX 50 µM (stesso tempo scala come C, C'). (F) mappa di tracciati di spike di Tatal sfere da tutti gli elettrodi nel corso del tempo (a sinistra). Dimostrativo singolo elettrodo visualizzati da più cluster tracce nel tempo (al centro); tracce di spike individuali possono essere ordinate e analizzate singolarmente (a destra). Clicca qui per visualizzare una versione più grande di questa figura.
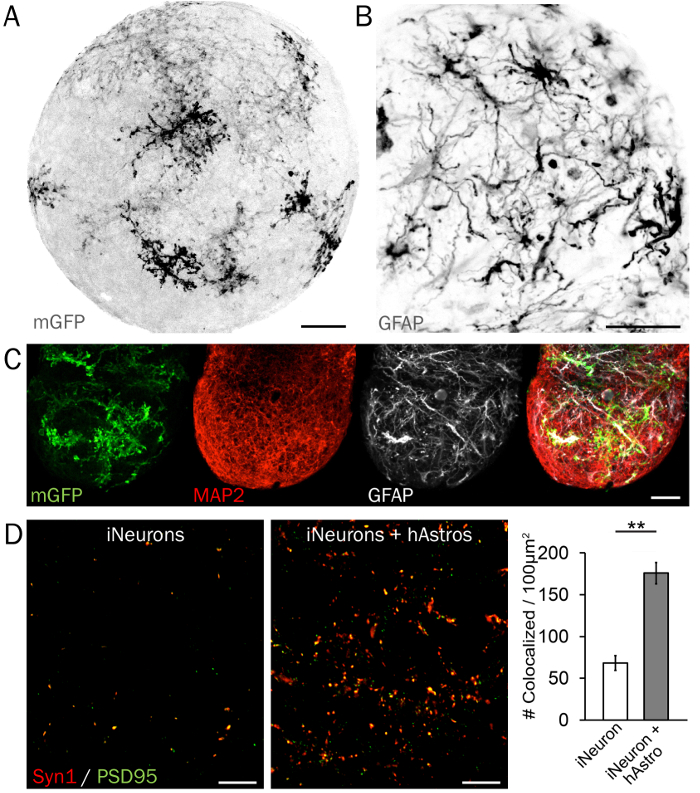
Figura 4: caratteristico immunohistochemistry di microcircuiti sinaptici. (A), un membrana-limitano GFP (EGFP) reporter è utile per esaminare la disposizione e la morfologia dei hAstros in sfere 3D neurale. (B) hAstros differenziato da hPSCs sono GFAP-positive. (C) sfere contenenti hAstros e iNeurons possono essere visualizzati e analizzati utilizzando gli indicatori di tipo-limitata proteina delle cellule come GFAP e MAP2. Scala bar = 50 µm. (D) immagini rappresentative delle densità di pre- e post-sinaptici (Syn1 e PSD95, rispettivamente) in sfere di iNeurons senza (sinistra) e con (destra) cocultured hAstros. Una densità significativamente aumentata di colocalized Syn1 e PSD95 è stata osservata in sfere di coculture rispetto a sfere Tatal al giorno 35, dimostrando la capacità di hAstros di indurre la formazione di sinapsi (n = 3 ripetizioni indipendenti ciascuna; dati ristampato da Ref 26 con il permesso). Barre di scala = 10 µm. trama rappresenta media ± SEM; differenze significative (* indica p < 0.05; * * indica p < 0.01) tra i gruppi sono stati determinati utilizzando due code t-test. Clicca qui per visualizzare una versione più grande di questa figura.
Discussione
In questo protocollo, descriviamo un metodo sistematico per la produzione di sfere 3D di cocultures neurale. Le sfere sono composti da astrociti e neuroni, che sono derivati in modo indipendente da hPSCs. Anche se non il fuoco di questo protocollo, la generazione delle popolazioni puri dei astrocytes da hPSCs28 è un passo fondamentale e può essere tecnicamente impegnativa se eseguita senza precedente esperienza. Questo primo passo per la generazione di questi microcircuiti sinaptici deve essere eseguito con temporizzazione meticolosa e attenzione al dettaglio. Una limitazione dell'uso di astrociti hPSC-derivato è il processo di differenziazione lungo; Tuttavia, la produzione di grandi quantità di cellule che possono essere congelate per futuro utilizzare e scongelato al momento della sperimentazione (Vedi punto 2.1.5) Elimina la necessità di iniziare il processo dalla fase iniziale hPSC. Anche se il iNeurons generato da hPSCs transgenici sono synaptogenic e hanno la capacità di esibire spontanee postsinaptiche correnti elettriche, entrambe le caratteristiche sono in particolare arricchite dalla presenza di cellule gliali12,35— tra cui il hAstros dettagliate nel presente protocollo. Così, si deve osservare che la scelta del tipo di cellulare, numero e fase inerente allo sviluppo o maturità è una componente critica del presente protocollo, e regolazioni possono provocare variazioni nell'attività elettrica o visualizzazione di sinapsi. Tuttavia, questo protocollo anche consente la manipolazione di densità delle cellule o rapporti in un modo che riflette la flessibilità di condizioni possibili o esiti dal singolo ricercatore.
Come descritto sopra, ci avvaliamo di strumenti di bioingegneria per produrre un'alternativa a42,metodi neurale organoid43, con l'avvertenza che questo sistema non ricapitolare i fenotipi di auto-organizzazione e stratificazione di organoids che può essere desiderato20,44. L'uso simultaneo di micropozzetti cultura piastre26 e un filatore boccetta bioreattore45,46 garantire riproducibilità, semplificando così non solo la produzione ma anche l'esame e l'analisi di microcircuiti neurali con una varietà di saggi di cultura cellulare. Va sottolineato che anche se l'utilizzo di un bioreattore a pallone o equivalente spinner è facoltativo, una cultura stazionaria di sfere a contatto può provocare loro fondendo insieme, così limitante nutrienti e ossigeno oltre il limite di diffusione nel centro di sfere47. In particolare, l'uso di 3D stampati mini-bioreattori sono stati segnalati come un approccio di throughput superiore rispetto ai grandi bioreattori46.
Tradizionali strumenti per misurare la formazione sinaptica includono metodi fisiologici tali cellule intere patch di bloccaggio, MEAs36,48,49e50di imaging del calcio. Qui, abbiamo scelto di descrivere l'uso di MEAs in quanto forniscono un esame semplice e di alto-rendimento dell'attività elettrica nelle sfere su una scala di tempo breve. Tuttavia, altre tecniche possono anche essere utilizzati.
Una limitazione dell'uso di piastre microtiter in questo protocollo è il numero massimo di celle per sfera e sfere (~ 300) (~ 2 x 104) che sono consentiti in ciascun pozzetto. Strumenti di formazione sfera alternativi possono essere utilizzati per un numero aumentato; Tuttavia, un numero maggiore di cellule sarà richiesto presso il punto di partenza. Qui, per la sua capacità di generare sfere più grandi che possono essere manipolati per analisi e visibile dall'occhio, limitando la morte delle cellule all'interno del centro delle sfere, è stato scelto il formato di 24 pozzetti. Nel complesso, l'aggiunta di questo passaggio al protocollo garantirà una produzione affidabile e scalabile delle sfere 3D uniforme.
Il nostro protocollo vanta anche la flessibilità di regolare il numero e il rapporto di ogni tipo di cellula, così come la possibilità di introdurre altri tipi di cella nelle sfere 3D in maniera controllata, definito. L'uso di regione-specific neuronale e sottotipi di astrociti permette lo studio di microcircuiti sinaptici delle diverse regioni del sistema nervoso centrale. Questi coculture sfere possono anche essere fusi insieme51 per studiare la migrazione cellulare e la segnalazione di lungo raggio. L'aggiunta di oligodendrociti, cellule endoteliali o microglia potrebbe dimostrare queste sfere 3D per essere un modello informativo cerebrale con maggiore complessità, come una promettente direzione futura per questo metodo. Infine, oltre alla malattia e infortunio di modellazione, questo sistema permette lo studio di approcci terapeutici, come terapia di sostituzione cellulare o lo sviluppo di farmaci, per migliorare la neurorigenerazione.
Divulgazioni
Gli autori non hanno nulla a rivelare.
Riconoscimenti
Vorremmo ringraziare Dr. Erik Ulliano (UCSF) per l'input intellettuale la progettazione di queste procedure, Dr. Michael Ward (NIH) consulenza tecnica sulla differenziazione Tatal e Saba Barlas per analisi preliminare delle immagini.
Materiali
| Name | Company | Catalog Number | Comments |
| 6 well plate | Fisher Scientific | 08-772-1B | |
| 15 mL conical tubes | Olympus Plastics | 28-101 | |
| Accutase | Sigma | A6964-100ML | Detachment solution |
| AggreWell plate | Stemcell Technologies | 34850 | |
| Anti-Adherence Rinsing Solution | Stemcell Technologies | 7010 | Prevent cell adhesion to microwell plates |
| Anti/anti | Thermofisher | 15240062 | |
| B27 | Thermofisher | 17504044 | Media Supplement |
| BrainPhys neuronal medium | Stemcell Technologies | 5790 | Neurophysiological basal medium alternative |
| Circular glass coverslips | Neuvitro | GG-12-oz | |
| Cryostor CS10 | Stemcell Technologies | 7930 | Cryopreservation medium with 10% DMSO |
| DMEM/F12 | Thermofisher | 10565-042 | With GlutaMAX supplement |
| DMH-1 | Stemcell Technologies | 73634 | HAZARD: Toxic if swallowed. Working concentration: 2 μM |
| Donkey serum | Lampire Biological Laboratories | 7332100 | Working concentration: 5% in primary blocking buffer, 1% in secondary blocking buffer |
| Doxycycline Hydrochloride (Dox) | Sigma | D3072-1ml | HAZARD: Toxic for pregnant women. Working concentration: 2 μg/mL |
| Epidermal growth factor (EGF) | Peprotech | AF-100-15 | Working concentration: 10 ng/mL |
| Fibroblast growth factor-2 (FGF) | Peprotech | 100-18B | Working concentration: 10 ng/mL |
| Fluoromount-G mounting solution | Southern Biotech | 0100-01 | |
| Glass slides | Fisherbrand | 22-037-246 | |
| Goat serum | Lampire Biological Laboratories | 7332500 | Working concentration: 5% in primary blocking buffer, 1% in secondary blocking buffer |
| Hemacytometer or automatic cell counter | Life Technologies | AMQAX1000 | |
| Heparin | Sigma | H3149-50KU | Working concentration: 2 mg/mL |
| Magnetic plate | DLAB | 8030170200 | |
| Matrigel membrane matrix | Corning | 354230 | ECM coating solution. Working concentration: 80 μg/ml. Prepare on ice and ensure that pipettes, tubes, and media are pre-chilled. |
| MEA 2100 System | Multichannel Systems | MEA2100 | |
| Mounting solution | |||
| N2 | Thermofisher | 17502048 | Media Supplement |
| OCT | Tissue-Tek | 4583 | Tissue embedding solution for cryosectioning |
| Pap Pen (Aqua Hold) | Scientific Device Laboratory | 9804-02 | |
| Paraformaldehyde (PFA) | Acros Organics | 169650025 | HAZARD: Toxic if inhaled. Working concentration: 4% in PBS |
| Phosphate buffered saline (PBS) | Stemcell Technologies | CA008-300 | |
| Poly-l-ornithine (PLO) | Sigma | P3655-100MG | Working concentration: 0.5 mg/mL |
| Rectangular glass cover slips | Fisherfinest Premium Superslip | 12-545-88 | |
| ReLeSR | Stemcell Technologies | 5872 | Detachment and passaging reagent |
| Rho-Kinase Inhibitor Y27632- (Y) | Tocris | 1254 | Working concentration: 10 uM |
| SB431542 | Stemcell Technologies | 72234 | Working concentration: 2 μM |
| Spinner flasks | Fisher Scientific | 4500-125 | |
| Sucrose | Fisher Chemical | S5-3 | Working concentration: 20% or 30% in PBS |
| T25 Culture Flask | Olympus Plastics | 25-207 | Vented caps |
| T75 Culture Flask | Olympus Plastics | 25-209 | Vented caps |
| Terg-A-zyme | Sigma | Z273287-1EA | Detergent. Working concentration: 1% |
| TeSR-E8 basal medium | Stemcell Technologies | 5940 | Human pluripotent stem cell (hPSC) medium |
| TeSR-E8 supplements | Stemcell Technologies | 5940 | Supplements for human pluripotent stem cell medium |
| TritonX-100 | Sigma | X100-500ML | Detergent for cell permeabilization. Working concentration: 0.25% in blocking buffer |
| Trypan blue | Invitrogen | T10282 | |
| Antibodies | |||
| AlexaFluor 488 | Thermofisher | A-11029 | Secondary antibody |
| AlexaFluor 594 | Thermofisher | A-11037 | Secondary antibody |
| Ezrin | Thermofisher | MA5-13862 | Primary antibody; astrocytes perisynaptic |
| GFAP | Chemicon | MAB360 | Primary antibody; astrocytes |
| GFP | Aves | GFP-1020 | Primary antibody; astrocytes |
| Glt1 | Gift from Dr. Jeffrey Rothstein | n/a | Primary antibody; astrocytes |
| Homer | Synaptic Systems | 160 011 | Primary antibody; neurons, post-synaptic |
| MAP2 | Synaptic Systems | 188 004 | Primary antibody; neurons |
| PSD95 | Abcam | ab2723 | Primary antibody; neurons, post-synaptic |
| S100 | Abcam | ab868 | Primary antibody; astrocytes |
| Synapsin 1 | Synaptic Systems | 106 103 | Primary antibody; neurons, pre-synaptic |
| TuJ1/β3-tubulin (TUBB3) | Covance | MMS-435P | Primary antibody; neurons |
Riferimenti
- Ullian, E. M., Christopherson, K. S., Barres, B. A. Role for Glia in Synaptogenesis. Glia. 47, 209-216 (2004).
- Baldwin, K. T., Eroglu, C. Molecular mechanisms of astrocyte-induced synaptogenesis. Current Opinion in Neurobiology. 45, 113-120 (2017).
- Molofsky, A. V., et al. Astrocyte-encoded positional cues maintain sensorimotor circuit integrity. Nature. 509 (7499), 189-194 (2014).
- Sultan, S., et al. Synaptic Integration of Adult-Born Hippocampal Neurons Is Locally Controlled by Astrocytes. Neuron. 88, 957-972 (2015).
- Clarke, L. E., Barres, B. A. Emerging roles of astrocytes in neural circuit development. Nat Rev Neuroscience. 14 (5), 311-321 (2013).
- Cheung, G., Sibille, J., Zapata, J., Rouach, N. Activity-Dependent Plasticity of Astroglial Potassium and Glutamate Clearance. Neural Plasticity. , 109106 (2015).
- Ghezali, G., Dallerac, G., Rouach, N. Perisynaptic astroglial processes dynamic processors of neuronal information. Brain Struct Funct. 221, 2427-2442 (2016).
- Kimelberg, H. K., Nedergaard, M. Functions of Astrocytes and their Potential As Therapeutic Targets. Neurotherapeutics. 7, 338-353 (2010).
- Pál, B. Astrocytic Actions on Extrasynaptic Neuronal Currents. Frontiers in Cellular Neuroscience. 9, 474 (2015).
- Kiray, H., Lindsay, S. L., Hosseinzadeh, S., Barnett, S. C. The multifaceted role of astrocytes in regulating myelination. Experimental Neurology. 283, 541-549 (2016).
- Allen, N. J., Eroglu, C. Cell Biology of Astrocyte-Synapse Interactions. Neuron. 96 (3), 697-708 (2017).
- Krencik, R., van Asperen, J. V., Ullian, E. M. Human astrocytes are distinct contributors to the complexity of synaptic function. Brain Research Bulletin. 129, 66-73 (2017).
- Ullian, E. M., Sapperstein, S. K., Christopherson, K. S., Barres, B. A. Control of Synapse Number by Glia. Science. 291, 657-662 (2001).
- Oberheim Bush, N. A., Nedergaard, M. Do Evolutionary Changes in Astrocytes Contribute to the Computational Power of the Hominid Brain?. Neurochemical Research. 42 (9), 2577-2587 (2017).
- Han, X., et al. Forebrain Engraftment by Human Glial Progenitor Cells Enhances Synaptic Plasticity and Learning in Adult Mice. Cell Stem Cell. 12 (3), 342-353 (2013).
- Inoue, H., Nagata, N., Kurokawa, H., Yamanaka, S. iPS cells: a game changer for future medicine. The EMBO Journal. 33 (5), 409-417 (2014).
- Shi, Y., Inoue, H., Wu, J. C., Yamanaka, S. Induced pluripotent stem cell technology a decade of progress. Nature Reviews Drug Discovery. 16 (2), 115-130 (2017).
- Dodla, M. C., Mumaw, J., Stice, S. L. Role of astrocytes, soluble factors, cells adhesion molecules and neurotrophins in functional synapse formation: implications for human embryonic stem cell derived neurons. Stem Cell Res Ther. , 251-260 (2010).
- Krencik, R., Ullian, E. M. A cellular star atlas: using astrocytes from human pluripotent stem cells for disease studies. Frontiers in Cellular Neuroscience. 7, 1-10 (2013).
- Pasca, S. P. The rise of three-dimensional human brain cultures. Nature. 553 (7689), 437-445 (2018).
- Huch, M., Knoblich, J. A., Lutolf, M. P., Martinez-arias, A. The hope and the hype of organoid research. Development. 144, 938-941 (2017).
- Mason, J. O., Price, D. J. Building Brains in a Dish: Prospects for Growing Cerebral Organoids from Stem Cells. Neuroscience. 334, 105-118 (2016).
- Kelava, I., Lancaster, M. A. Dishing out mini-brains: Current progress and future prospects in brain organoid research. Developmental Biology. 420 (2), 199-209 (2016).
- Kelava, I., Lancaster, M. A. Stem Cell Models of Human Brain Development. Cell Stem Cell. 18 (6), 736-748 (2016).
- Sloan, S. A., et al. Human Astrocyte Maturation Captured in 3D Cerebral Cortical Spheroids Derived from Pluripotent Stem Cells. Neuron. , 779-790 (2017).
- Krencik, R., et al. Systematic three-dimensional coculture rapidly recapitulates interactions between human neurons and astrocytes. Stem Cell Reports. 9 (6), 1745-1753 (2017).
- Chen, G., et al. Chemically defined conditions for human iPSC derivation and culture. Nature Methods. 8 (5), 424-429 (2011).
- Krencik, R., Zhang, S. -. C. Directed differentiation of functional astroglial subtypes from human pluripotent stem cells. Nature Protocols. 6 (11), 1710-1717 (2011).
- Du, Z. -. W., et al. Generation and expansion of highly pure motor neuron progenitors from human pluripotent stem cells. Nature Communications. 6, 6626 (2015).
- Neely, M. D., et al. DMH1, a highly selective small molecule BMP inhibitor promotes neurogenesis of hiPSCs: Comparison of PAX6 and SOX1 expression during neural induction. ACS Chemical Neuroscience. 3 (6), 482-491 (2012).
- Lippmann, E. S., Estevez-Silva, M. C., Ashton, R. S. Defined Human Pluripotent Stem Cell Culture Enables Highly Efficient Neuroepithelium Derivation Without Small Molecule Inhibitors. Stem Cells. 32, 1032-1042 (2014).
- Eggan, K., Kawada, J., Kaneda, S., Kirihara, T., Maroof, A. Generation of a Motor Nerve Organoid with Human Stem Cell-Derived Neurons. Stem Cell Reports. 9, 1441-1449 (2017).
- Krencik, R., Weick, J. P., Liu, Y., Zhang, Z. -. J., Zhang, S. -. C. Specification of transplantable astroglial subtypes from human pluripotent stem cells. Nature Biotechnology. 29 (6), 528-534 (2011).
- Krencik, R., et al. Dysregulation of astrocyte extracellular signaling in Costello syndrome. Science Translational Medicine. 7 (286), 286 (2015).
- Wang, C., et al. Scalable Production of iPSC-Derived Human Neurons to Identify Tau- Lowering Compounds by High-Content Screening. Stem Cell Reports. 9 (4), 1221-1233 (2017).
- Amin, H., Maccione, A., Marinaro, F., Zordan, S., Nieus, T., Berdondini, L. Electrical Responses and Spontaneous Activity of Human iPS-Derived Neuronal Networks Characterized for 3-month Culture with 4096-Electrode Arrays. Frontiers in Neuroscience. 10, (2016).
- Kapucu, F. E., Mäkinen, M. E., Tanskanen, J. M. A., Ylä-Outinen, L., Narkilahti, S., Hyttinen, J. A. K. Joint analysis of extracellular spike waveforms and neuronal network bursts. Journal of Neuroscience Methods. 259, 143-155 (2016).
- Ippolito, D. M., Eroglu, C. Quantifying Synapses: an Immunocytochemistry-based Assay to Quantify Synapse Number. Journal of Visualized Experiments. 45, 2-9 (2010).
- Zhang, Y., et al. Rapid single-step induction of functional neurons from human pluripotent stem cells. Neuron. 78 (5), 785-798 (2013).
- Odawara, A., Katoh, H., Matsuda, N., Suzuki, I. Physiological maturation and drug responses of human induced pluripotent stem cell-derived cortical neuronal networks in long-term culture. Scientific reports. 6, 26181 (2016).
- Bardy, C., Hurk, , et al. Neuronal medium that supports basic synaptic functions and activity of human neurons in vitro. PNAS. 112 (25), E2725-E2734 (2015).
- Monzel, A. S., et al. Derivation of Human Midbrain-Specific Organoids from Neuroepithelial Stem Cells. Stem Cell Reports. 8, 1144-1154 (2017).
- Lancaster, M. A., Knoblich, J. A. Generation of cerebral organoids from human pluripotent stem cells. Nature Protocols. 9 (10), 2329-2340 (2014).
- Dutta, D., Heo, I., Clevers, H. Disease Modeling in Stem Cell-Derived 3D Organoid Systems. Trends in Molecular Medicine. 23 (5), 393-410 (2018).
- Lancaster, M. A., et al. Cerebral organoids model human brain development and microcephaly. Nature. 501 (7647), 373-379 (2013).
- Qian, X., et al. Brain-Region-Specific Organoids Using Mini-bioreactors for Modeling ZIKV Exposure. Cell. 165 (5), 1238-1254 (2016).
- Yan, Y., et al. Derivation of Cortical Spheroids from Human Induced Pluripotent Stem Cells in a Suspension Bioreactor. Tissue Engineering Part A. , 1-46 (2016).
- Obien, M. E. J., Deligkaris, K., Bullmann, T., Bakkum, D. J., Frey, U. Revealing neuronal function through microelectrode array recordings. Frontiers in Neuroscience. 9 (JAN), 423 (2015).
- Hales, C. M., Rolston, J. D., Potter, S. M. How to Culture, Record and Stimulate Neuronal Networks on Micro-electrode Arrays (MEAs). Journal of Visualized Experiments. (39), 1-7 (2010).
- Shigetomi, E., Patel, S., Khakh, B. S. Probing the Complexities of Astrocyte Calcium Signaling. Trends in Cell Biology. 26 (4), 300-312 (2016).
- Bagley, J. A., Reumann, D., Bian, S., Lévi-strauss, J., Knoblich, J. A. Fused cerebral organoids model interactions between brain regions. Nat Methods. 14 (7), (2017).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon