Method Article
Лактатдегидрогеназа Assay поглощение — Простой и надежный метод для определения активности сыпучих Autophagic поглощения в клетках млекопитающих
В этой статье
Резюме
Здесь описан простой и хорошо проверенных протокол для измерения активности сыпучих autophagic поглощения в mammalian клетках. Метод основан на количественной оценки доли Лактатдегидрогеназа (LDH) в sedimentable клеток фракций по сравнению с общей сотовой уровня ЛДГ.
Аннотация
Основная autophagy характеризуется поглощение значительная часть цитоплазмы в двойной/multi-membrane структуры, называют autophagosomes. Здесь описан простой протокол для контролировать этот процесс. Кроме того предоставляются типичные результаты и экспериментальной проверки метода autophagy склонение в условиях различных видов культивируемых клеток млекопитающих. Во время массовых autophagy autophagosomes секвестрировать в цитозоле и таким образом также растворимые цитозольной белков, наряду с другими autophagic груза. LDH является стабильной и очень обильные, растворимые цитозольной фермента, который неизбирательно поглощенных в autophagosomes. Таким образом, количество ЛДГ поглощение отражает количество массовых autophagic поглощения. Эффективно и точно определить уровень ЛДГ поглощения в клетках, мы используем протокол на основе electrodisruption фракционирования, который эффективно отделяет sedimentable от цитозольной ЛДГ, следуют измерения ферментативной активности в sedimentable фракции против поклеточного образцы. Autophagic поглощение определяется путем вычитания доли sedimentable ЛДГ в необработанной клеток из что в обработанных клеток. Преимущество пробирного поглощение ЛДГ, что это дает количественную меру autophagic поглощения эндогенного грузов, в отличие от других методов либо привлекать внематочная выражение связывания зондов или полуколичественного протеазы анализ защиты autophagy маркеры или рецепторов.
Введение
Autophagy (по-гречески «самостоятельной питания») является эволюционным процессом сохранены для вакуолярной/лизосомальных деградации внутриклеточных материала. После обнаружения связанных с autophagy («ГПТ») генов, которые являются важными для autophagy дрожжей и людей, и реализации что autophagy играет значительную роль в здоровье и болезни (подтверждено 2016 Нобелевской премии в области медицины или физиологии, чтобы Ёсинори Ohsumi), autophagy быстро стал одним из наиболее интенсивно изучаемых процессов в ячейки биологии1,2.
Macroautophagy (в дальнейшем именуемый «autophagy») характеризуется расширением и складной из межклеточная внутриклеточные мембраны («phagophores») в запечатанных, двойной или multi membrane структуры («autophagosomes»), которые эффективно поглощать enwrapped материал от остальной части цитоплазме. После слияния autophagosomes с лизосомы внутренний autophagosomal мембраны и поглощенных груз деградации и переработанных. Autophagosomes может поглощать цитоплазматических материал в случайных (неизбирательной autophagy) и манеры селективный (селективный autophagy). Основная autophagy скорее представляет собой смесь неизбирательной и селективного autophagy.
В 1960-х и 70-х годов («морфологические эра» autophagy исследований) autophagic поглощение оценивалось главным образом через ультраструктурных анализы. В 1980-х и начале 1990-х годов («биохимических эра») в Seglen и коллегами — кто изучал autophagy в первичной крыса гепатоцитов — разработал первый методы количественно измерить autophagic поглощение деятельности3. С помощью этих анализов, Seglen определены и охарактеризовал различные шаги autophagic лизосомальных пути4,5, обнаружил и придумал amphisome6 (продукт синтеза endosome-autophagosome) и был первым Опишите роль фосфорилирование белков в autophagy регулирование7. Однако, после обнаружения АТГС в 1990-х годов («молекулярная эра») и первая характеристика млекопитающих ATG8 белка, микротрубочки связанные белком 1A/1B-свет цепь 3 (LC3) в 2000 году8, использование ГПТ белков в качестве маркеров для autophagic процесс быстро завоевал популярность, и старше и более трудоемкий биохимические методы были выйдены позади. В самом деле, за последние 18 лет, Западная помарка и анализ микроскопии флуоресцирования LC3 стали на сегодняшний день наиболее популярные (и во многих случаях единственным) средства изучения autophagy в клетках млекопитающих. Преимуществом является относительная простота, в которой может осуществляться эти методы. Недостатком является то, что один учится корзину компонент (LC3) вместо фактических autophagic грузов. Это довольно серьезный недостаток, потому что отношения между государствами и/или потока LC3 через путь против поглощения и потока грузов весьма неясным. В самом деле, мы показали, что потока сыпучих грузов может поддерживаться на высоком уровне в условиях там, где нет LC3 потока, несмотря на присутствие конъюгированных LC3 в клетки9. Кроме того мы показали, что основная autophagy не зависит от эффективной LC3 истощения и таким образом вероятно LC3-независимые9. Этот вывод был позднее подтвержден LC3 исследования нокаут-10,11, которые также указывают, что Паркин зависимой mitophagy (селективный autophagy митохондрий) является независимым от LC310,11 .
Таким образом, существует явная необходимость грузов на основе анализов для мониторинга autophagic активности. Оптимально такие анализы должны быть широко применимы, четкие и легко выполнять. За последние несколько лет мы имели особый интерес в assay поглощение ЛДГ, который был разработан в Seglen в 1980-х12и основан на измерении передачи цитозольной ЛДГ sedimentable, autophagic вакуоль содержащих клеток фракции. LDH является стабильной, растворимые цитозольной белок, который легко совместно поглощенных при phagophores завертывать цитоплазматических грузов. Поглощение ЛДГ поэтому является мерой общего autophagic поглощения. LDH исключительно деградации autophagic лизосомальных пути12. Таким образом, в присутствии ингибиторов лизосомальных деградации, например, bafilomycin A1 (Baf)13, экспериментальное лечение эффекты непосредственно отражают изменения в деятельности autophagic поглощения. В отсутствие деградации ингибиторы чистый эффект изменений в ЛДГ поглощение и деградация может быть измерена.
Assay поглощение ЛДГ широко применимым, поскольку ЛДГ выражается высоко и повсеместно, во всех типах клеток, и ЛДГ уровни могут быть точно количественно ферментативные пробирного14,15. Однако, оригинал протокола12 — в первичной крыса гепатоцитов — довольно много времени и требует большого количества начиная материала, а также по индивидуальному заказу электрического разряда конденсатора. На основе поэтапного мы постепенно превратили assay в легкий и универсальный метод. Во-первых оригинальный протокол был адаптирован для использования в mammalian клетки линии16. Во-вторых метод был значительно уменьшенным разрешением3,9. В-третьих, несколько шагов в протоколе были ликвидированы, включая трудоемкий плотность подушке шаг17. Это одновременно позволило еще больше разукрупнение метода, от оригинального отправной точкой использованием плита 10 см за образец16 один колодец от 12-ну пластины на сэмпл (то есть, около 15 раз меньше начиная материал)17. В-четвертых мы определили коммерческий электропорации аппарат, который может заменить на заказ электрическим разрядом конденсатора17.
Здесь представлены наши самые современные протокол assay поглощение ЛДГ, который включает в себя некоторые дальнейшего упрощения метода по сравнению с ранее опубликованной17 . Кроме того показан набор типичных результаты, полученные в ряде различных типов клеток, и главное, предоставляются несколько строк экспериментальной проверки метода с использованием фармакологических, а также генетические сногсшибательно и нокаут подходы. Общая схема всего протокола см. Рисунок 1.
протокол
1. клетки посева и лечение
-
Культура адэрентных клеток в колбах культуры ткани2 75 см в увлажненные инкубатор с 5% CO2 при 37 ° C, с использованием предпочтительного питательной среды для типа ячейки в вопросе. Позволяют клеткам расти до тех пор, пока они достигают слоя клеток вблизи притока.
Примечание: Используйте RPMI 1640 среднего дополнена 10% плода бычьим сывороточным (ФБС) для LNCaP, HEK293, мышь эмбриональных фибробластов (MEFs), BJ, MCF-7 и клетки ПЭС-1.- Вымойте клетки с рН 7,4 3 мл 37 ° C фосфат амортизированное saline (PBS). Заменить PBS с 3 мл 0,25% (w/v) трипсина тетранатрия (ЭДТА) и инкубировать колбу в увлажненные инкубатор с 5% CO2 при 37 ° C, пока клетки (2-5 мин).
- Ресуспензируйте отдельные клетки с 7 мл питательной среды, содержащие 10% FBS. Смешайте 10 мкл клеток подвеска Алиготе с 10 мкл 0,4% Трипановый синий в пробки microcentrifuge, с помощью кончика пипетки 0,5 – 20 мкл. Использовать же наконечник пипетки, чтобы немедленно заполнить Счетной палаты слайд и подсчитать количество ячеек в счетчик автоматизированной клеток.
-
Подготовить подходящий разрежения (см. Примечание ниже) суспензии клеток от шаг 1.1.2 использование культуры средний, содержащие 10% FBS и семян 1 мл суспензии разреженных клеток в каждой скважине пластины (площадь поверхности ~3.8 см2) 12-ну тканевые культуры с помощью асептического техника. Позволяют роста в увлажненные инкубатор с 5% CO2 при 37 ° C, пока не будет достигнуто желаемого клеток плотность, например, 60-90% слияния в момент сбора урожая.
Примечание: Соответствующие разбавления суспензии клеток, которые дадут нужной ячейки confluency в момент сбора урожая будет отличаться от типа ячейки, тип клеток, а также зависимости от продолжительности и типа экспериментальное лечение. Таким образом это должно эмпирически оцениваться в каждом конкретном случае.- Для экспериментов, которые должны быть как лечить и собирают 2 дней после посева, семян 2,5 x 105 LNCaP, HEK293, или MCF-7 клетки, MEFs4 5 x 10, 4 x 105 BJ или 1,5 x 105 ПЭС-1 клеток в каждой скважине 12-ну пластины.
- Для клеток, которые придерживаются слабо пальто плит с типом покрытия, рекомендуется для типа ячейки в вопросе. Для LNCaP (и HEK293) клетки используют пластины, покрытые поли D-Лизин (PDL).
- Для этого добавьте 500 мкл PDL в 2,5 мкг/мл в стерильных H2O для каждой скважины, и инкубировать и пластины в стерильных условиях на 30 минут при комнатной температуре (20-25 ° C). Удаление PDL с всасывания и мыть каждый хорошо кратко с 1 мл стерильного H2O.
Примечание: Как правило, шаг 1.2.1 делается без каких-либо экспериментальное лечение. Однако если интерференции, это может быть удобно начать обратный трансфекции с посевной9.
-
Выполните экспериментальные методы лечения в двойные или тройные скважин в состояние.
- Например, обработать клетки с 50 Нм Torin1 МТОР ингибитор, который обычно является эффективным индуктором autophagic поглощения, или подвергать острого голода сыворотки - и аминокислоты клетки путем промывания клетки с 1 мл раствора свободных аминокислот Эрл сбалансированный Соли раствора (EBSS) среднего и впоследствии инкубации клеток в 1 мл EBSS в увлажненные инкубатор с 5% CO2 при 37 ° C.
- Оставьте один набор лечить для того чтобы определить фоновый уровень ЛДГ sedimentable скважин.
- Добавьте насыщения количество после поглощения ингибиторы bafilomycin A1 (Baf)3,13,,1618 в отсутствие или наличие экспериментальное лечение, 3-4 ч до ячейки урожай. Инкубировать клетки в увлажненные инкубатор с 5% CO2 при 37 ° C.
- Использование 100 Нм КБА для LNCaP, HEK293, BJ, MCF-7 и клетки ПЭС-1 и 10 Нм КБА для MEFs.
- Экспериментальные методы лечения, которые имеют продолжительность только 3-4 ч (как обычно имеют те свидетельствует в шаг 1.3.1), добавить Baf одновременно с лечения. Для более экспериментальное лечение ждать до 3-4 ч до сбора урожая и добавить 2 мкл 500 x сосредоточены Baf фондовой непосредственно в среду.
- Смешать, агитируя пластину сразу же после добавления Baf. На данный момент это также рекомендуется, чтобы добавить macroautophagic поглощения ингибиторы как элементы управления, например, 10 мм Пан phosphoinositide 3-киназы ингибитора (PI3K) 3-метил аденин (3MA)19или 10 мкм селективного PI3K класса III ингибитор САР-405-20.
2. ячейка урожай и подготовка к Electrodisruption
- В конце периода лечения аспирационная средних с всасывания и добавить 200 мкл клеток отряд решение (предварительно нагревают до 37 ° C) в каждой скважине. Инкубируйте при 37 ° C, пока клетки (обычно около 5 мин).
Примечание: 0,25% (w/v) трипсина-ЭДТА может использоваться вместо решения отряд клеток, в то время как последний содержит DNase, который помогает уменьшить вязкость отдельных клеток. До тех пор, как носитель тщательно наддува, это не надо мыть ячейки перед добавлением решения отряд трипсина-ЭДТА или ячейки. - Добавьте 500 мкл PBS комнатной температуре (20-25 ° C), рН 7,4, содержащий 2% (w/v), бычьим сывороточным альбумином (БСА) для каждой скважины и Ресуспензируйте с пипеткой, до тех пор, пока не скопления клеток являются видимыми. Немедленно перевести суспензию клеток в 1,5 мл microcentrifuge трубы на льду.
Примечание: Если не указано иное, выполняют все последующие шаги на льду. - Отложения клетки центрифугированием при 400 x g 5 мин при 4 ° C.
- Тщательно удалить супернатант (с всасывания) покинуть ячейку гранулы как можно более сухой.
- Добавьте 400 мкл 10% (w/v) сахарозы (в сверхчистого H2O) к каждой трубе.
3. плазматической мембраны Electrodisruption и разделение клеток Sedimentable и общей фракций
- Ресуспензируйте клетки лепешка с пипеткой получить вблизи подвеска одноклеточных и передача его в кювет электропорации 4 мм.
Примечание: Дозирование прихваченного ~ 10-15 раз, используя кончик пипетки 100-1000 мкл, обычно достаточно. - Поместите кювету в экспоненциальный распад electroporator волны и выполнять один электрического импульса на 800 V, 25 МКФ и 400 Ω; Эти параметры производят пульс продолжительностью ~ 8 мс.
-
Использовать новый наконечник пипетки для передачи disruptate клеток на трубу microcentrifuge 1,5 мл, содержащих 400 мкл ледяной фосфат амортизированное сахарозы решение (монофосфат натрия 100 мм, 2 мм Дитиотреитол (DTT), 2 мм ЭДТА и 1,75% сахарозы, рН 7,5) и перемешать кратко дозирование.
- Необязательно: Чтобы проверить эффективного плазматической мембраны electrodisruption17, смешать 10 мкл разбавленного клеток disruptate из шага 3.3 с 10 мкл 0,4% Трипановый синий в пробки microcentrifuge 1,5 мл. Передача в Счетной палате и убедитесь, что процент положительных клеток Трипановый синий > 99%.
- Оставьте образец в Счетной палате за 30 мин при комнатной температуре (20-25 ° C) и убедитесь, что доля Трипановый синий позитивных клеток оставалась > 99%.
- Необязательно: Чтобы проверить, что electrodisruption не были слишком жесткими, то есть, он не нарушил внутриклеточных органелл, выполните шаги 1.1-3.3, как описано выше, но использовать больше исходного материала (ну от 6-ну пластины с слоем вырожденная клеток ~ 80%), и использовать 150 мкл 10% сахарозы в шаг 2,5 и 150 мкл раствора сахарозы, фосфат амортизированное без DTT в шаге 3.3.
- Использование пипетки для тщательно слой 200 мкл разбавленного клеток disruptate решения поверх подушки плотностью 1,2 мл фосфат амортизированное 8% (w/v) плотность градиента среды (например, 8% Nycodenz, 50 мм натрия фосфат, 2,2%-ая сахароза, 1 мм ЭДТА) в центрифугу 2 мл трубка. Центрифуга на 20000 x g 45 мин при температуре 4 ° C в microcentrifuge с мягкой-режим (для мягкое ускорение и замедление) и тщательно положить трубы на льду.
- Осторожно удалите 60 мкл ~ 200 мкл Топ фракции, не забудьте подобрать любое решение средний градиент плотности и передать свежие microcentrifuge трубки.
Примечание: Это должно содержать цитозоль исключительной чистоты, называют «ячейки sap»21. - Тест на чистоту фракции полученные на предыдущем шаге, выполняя Вестерн-блот анализ органеллы содержатся белки, с использованием стандартных методов и 4 – 20% градиента гели16.
- Например выполните immunoblotting катепсин B21, цитохром с, и глюкозоизомеразная дисульфида белка, чтобы убедиться, что электрическим током на шаге 3.2 не нарушил лизосомы, митохондрии или эндоплазматического ретикулума, соответственно, immunoblot для ЛДГ для проверки наличия цитозольной белка в ячейке sap.
- Параллельно выполняют immunoblotting на белок выдержки из решения disruptate ячейке16 для подтверждения, что антитела, которые используются может обнаружить органеллы содержатся белки, которые оцениваются.
- Необязательно: Чтобы проверить эффективного плазматической мембраны electrodisruption17, смешать 10 мкл разбавленного клеток disruptate из шага 3.3 с 10 мкл 0,4% Трипановый синий в пробки microcentrifuge 1,5 мл. Передача в Счетной палате и убедитесь, что процент положительных клеток Трипановый синий > 99%.
- Повторите шаги 3.1 – 3.3 для каждого образца.
- Удаление 550 мкл из каждого решения disruptate разбавленным клеток (полученное на шаге 3.3) 2 мл microcentrifuge пробирки, содержащие 900 мкл ледяной ресуспендирования буфера (монофосфат натрия 50 мм, 1 мм DTT, 1 мм ЭДТА и 5,9% сахарозы, pH 7.5) дополнена 0,5% BSA и 0,01% Tween-20 и перемешать кратко, закупорить.
- Центрифуга на 18,000 x g 45 мин при температуре 4 ° C для производства гранулы, содержащие «осажденный ЛДГ». Тщательно удалить супернатант (с всасывания) оставить гранулы как можно более сухой. Поместите образцы в морозильной камере-80 ° С.
- Передать новые трубы 150 мкл от каждого решения disruptate разбавленным клеток (полученных на шагу 3.3) и место образцы в морозильной камере-80 ° С. Используйте эти образцы для определения уровней «всего ЛДГ» в клетках.
Примечание: На данном этапе эксперимента может быть приостановлена для до тех пор, как хотелось.
4. ЛДГ добыча и измерение ферментативной активности ЛДГ
- Оттепель «Отложившейся ЛДГ» (из шага 3.6) и «всего ЛДГ» образцы (из шага 3.7) на льду.
- Добавьте 300 мкл ледяной ресуспендирования буфера, содержащего 1,5% Тритон X-405 для «Всего ЛДГ» образцы (уступая окончательный Тритон X-405 концентрации 1%). Вращайте пробы на ролик в холодной комнате (4 – 8 ° C) за 30 мин.
- 750 мкл буфера ледяной ресуспендирования с 1% тритон X-405 к «Осажденный ЛДГ» образцы и Ресуспензируйте окатышей с пипеткой, пока не будет достигнуто однородный раствор.
- Центрифугуйте образцы из шага 4.2 и 4.3 на 18,000 x g 5 минут при температуре 4 ° C для отложения сжимающих сотовой мусора.
- Смешайте 4 части холодного 65 мм имидазола (рН 7.5)/0.75 мм пирувата с одной частью имидазола холодной 65 мм (рН 7,5) / 1,8 мм NADH для получения рабочей решение, которое является стабильным, по крайней мере три недели при 4 ° C.
- Смешайте 3 – 30 мкл supernatants из шага 4.4 с 200 мкл рабочего раствора шаг 4.5.
- Определить количество ЛДГ, измеряя ферментативную активность ЛДГ как снижение Никотинамидадениндинуклеотид (в сокращенной форме) (NADH) поглощения на 340 Нм при 37 ° C по сравнению с Стандартный с известной концентрацией ЛДГ. Выполнение измерений оптической плотности до тех пор, пока Реакция подошел завершения, т.е. до поглощения на 340 Нм больше не меняется со временем.
Примечание: Это классический биохимический метод для измерения активности ЛДГ. Хотя текущий протокол выполняет реакции при 37 ° C, она может также выполняться при комнатной температуре (20-25 ° C), который является желательным, если делать вручную спектрофотометрии. Текущий протокол использует роботов multianalyzer инструмент, который в автоматическом режиме смеси образцы с рабочего раствора в 96-луночных тарелку и меры поглощения на 340 Нм при 37 ° C каждые 20 s на 3 мин. После этого, инструмент программное обеспечение вычисляет концентрацию ЛДГ, выраженные в единицах (U) / L, сравнивая склона измерения оптической плотности с течением времени, по сравнению с калибровочной кривой получены путем калибровки с стандартом известных ЛДГ концентрация. Линейная дальность обнаружения, этот подход является 30 – 1.500 U/л. В качестве альтернативы существует широкий спектр коммерчески доступные наборы для определения ЛДГ. Некоторые из них основаны на муфты ферментативные реакции на поколение продуктов колориметрического или флуоресцентные, Включение обнаружения другими средствами, чем УФ-спектрофотометрии и с других линейных рядов обнаружения.
5. Расчет поглощения ЛДГ
- Рассчитайте процент отложившейся ЛДГ в целом ЛДГ для каждого образца, принимая разведений и выборки во внимание:
Осажденный ЛДГ (%) =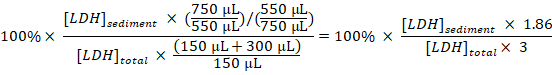
Примечание: Во время действия 3.1 – 3.3 приблизительно 50 мкл теряется из-за передачи в и из кювета электропорации. Таким образом Вычислите из в общей сложности 750 мкл (вместо 800 мкл) из разбавленных ячейки disruptate в шаге 3.3. - Вычесть процент отложившейся ЛДГ, полученные в образцах из необработанной клеток (шаг 1.3.2) от процент отложившейся ЛДГ, полученные в пробах экспериментально обработанные клетки и разделить время лечения с Baf получить процент поглощенный ЛДГ в час в период выборки:
Поглощенный ЛДГ (% / ч) =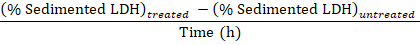
Результаты
С помощью протокола описанных здесь, основная autophagic поглощение активности в ряде различных млекопитающих клеточных линий, включая LAPC4, DU145, Huh7, PNT2A, HeLa, VCaP, H3122, Hec1A, MCF-7, T47D, U2OS, PC3, G361, мышь эмбриональных фибробластов (MEFs), ПЭС-1, HEK293, BJ и LNCaP клетки была измерена. Поглощение оценены в базальных условиях (в полной, богатые питательными веществами средний), или в клетках остро нехватку сыворотки и аминокислоты ( bona fide вызывая autophagy-состояние22). Результаты показали, что активность ЛДГ поглощения в условиях голода широко варьируется в различных клеточных линий, начиная от едва заметных уровней в LAPC4, DU145, Huh7 и PNT2 клетки (данные не показаны) для ~1.6%/h в LNCaP клетках (Рисунок 2 A). Наблюдается в гепатоцитах голодали первичной крыса стоимость выше, чем в клеточных линий, упомянутых выше и обычно колеблется от 2.5–4%/h23. В базальных условиях, ЛДГ поглощение было практически обнаружить в половине клеточных линий были протестированы и варьируются от ~0.2%/h до ~0.5%/h в другой половине (данные не показаны). В клеточных линий, которые показывают активность обнаружению базальной autophagic поглощения острого голода сыворотки и аминокислот обычно индуцирует 3 – 4 раза увеличение ЛДГ поглощения (см., например, эксперимент LNCaP, показан на рисунке 2A). В строках протестированные клеток (упомянутых выше) фон процент отложившейся ЛДГ, полученные в пробах из необработанной клеток (шаг 1.3.2) обычно составляет около 2-3%. От 22 независимых эксперименты, проведенные в различных клеточных линий, внутри экспериментально коэффициент вариации (CV) между отложившейся ЛДГ значения (% осажденной ЛДГ) лечения реплицирует было 5,8% ± 1,7% (средний % CV ± стандартное отклонение), начиная с 3.0 – 9,0%. Вместе эти цифры дают представление о том, чего ожидать при выполнении анализа секвестрации ЛДГ в mammalian клетках.
Использование химических ингибиторов как хорошо как генетические сногсшибательно и нокаут подходов, широко проверяет, что поглощение пробирного ЛДГ надежно меры autophagic поглощение активности. Autophagosome образование требует активного PI3K класса III (PIK3C3) и Unc-51 как autophagy активации киназы (УЛК)24, а также баланс в внутриклеточного Ca2 + гомеостаза16. Как показано в рисунке 2A, базальную и голод индуцированной ЛДГ что поглощение полностью упразднена, Пан PI3K ингибитор 3MA, селективный ингибитор PIK3C3 САР-40520, или ER Ca2 + насоса ингибитор увеличивается (TG) 25 в LNCaP клетках. LDH поглощения в условиях голода (переключатель свободных аминокислот Эрл сбалансированный соли раствора (EBSS) средний) также сильно снижается TG, или УЛК ингибитор MRT67307 в HEK293 клетках (рис. 2B). Кроме того, голод индуцированной ЛДГ поглощения постоянно тормозится 3MA в MEFs (рис. 2C), BJ (Рисунок 2D), MCF-7 (Рисунок 2E) и ПЭС-1 (рис. 2F) клетки. Как правило инкубации клеток в одиночку EBSS среде (то есть, в отсутствие Baf или другие после поглощения ингибиторы) не приводит к измерению накопление поглощенных ЛДГ (см., например, эксперимент LNCaP, показан на рисунке 2 A). это, вероятно, потому, что острый аминокислоты голода приводит к ускоренному autophagic лизосомальных поток, что приводит к быстрой и непрерывной деградации поглощенных ЛДГ.
Далее, различных генов ГПТ, которую MEFs нокаут (KO) были использованы для проверки ли ЛДГ связывания требует autophagy связанных генов, сообщается, что существенно важное значение для формирования autophagosome. Действительно в ATG5 KO MEFs26 (рис. 3А), подтверждает наши предыдущие выводы9отменена голода индуцированной ЛДГ поглощения. Кроме того как показано на рисунке 3B и 3 C, ATG7 KO MEFs27 и28ATG9A KO MEFs является также затуплены голода индуцированной ЛДГ поглощения.
Наконец ЛДГ поглощение пробирного был протестирован по отношению к ли опосредованного системой РНК-интерференции глушителей ключевых транскриптов гена ГПТ будет препятствовать голода индуцированной поглощение активности. Действительно transfection ATG9A-таргетинг siRNA, или комбинированные на ULK1 и ULK2, сильно уменьшенным ЛДГ поглощения в условиях голода в LNCaP клеток (рис. 3D). Кроме того мы подтвердили наши предыдущие выводы3,9 , что ориентация фокуса адгезии киназы семьи взаимодействия протеина kDa 200 (FIP200) или комбинированные ориентации γ-аминомасляной кислоты типа (рецептор связанные белком (ДЕСЕНСИТИЗАЦИИ) Члены семьи GABARAP) подавляет голод индуцированной ЛДГ поглощения (рис. 3D).

Рисунок 1 : Общий поток схема протокола поглощение ЛДГ. Протокол основан на формате пластины 12-ну культуры ткани, используя указанные объемы на сэмпл (из одной скважины). Протокол assay можно удобно разделить на два отдельных рабочих дней, как указано. Однако это также возможно для выполнения всей процедуры в один день. Сокращения: ABB, после взрыва буфера (см. шаг 3.3 в протоколе для ингредиентов); РСБ, ресуспендирования буфера (см. шаг 3.5 в протоколе для ингредиентов). Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
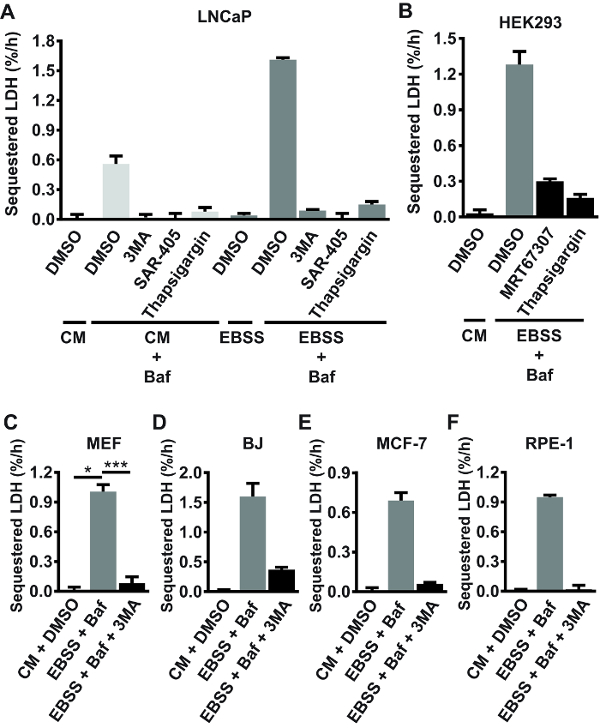
Рисунок 2 : Проверка с помощью ингибирования autophagy соединений анализа секвестрации ЛДГ. (A) LNCaP клетки либо остались без лечения (с целью вычитание фона: шаг 1.3.2) в полный рост среднего (см; RPMI 1640 + 10% плода бычьим сывороточным (ФБС)), или они были обработаны с ДМСО транспортное средство (0,1%) или 100 Нм Baf в см или в сыворотке - и аминокислоты свободной среде (EBSS). Кроме того, некоторые клетки обрабатывали 3MA (10 мм), САР-405 (10 мкм), или увеличивается (300 Нм), как указано. После 3 h лечения клетки были собраны, и поглощение ЛДГ, что ставки были определены как подробно в текущем протоколе. (B) HEK293 клетки относились с ДМСО транспортного средства (0,1%) в см, или 100 Нм Baf в EBSS, как указано. Кроме того, некоторые из клеток получил 10 мкм MRT67307 (ингибитор УЛК) или 300 Нм увеличивается. LDH поглощения ставки были определены после 3 h лечения. (C-F) MEF (C), BJ (D), MCF-7 (E) или ПЭС-1 (F) клетки относились с ДМСО транспортного средства (0,1%) в см, или Baf (10 Нм в C, 100 Нм в D-F) в EBSS с или без 3MA 10 мм, как указано. LDH поглощения ставки были определены после 3 h лечения. A, B, D, E и F показывают средние значения из трех биологических реплицирует (тройные скважин) от одного эксперимента (n = 1), с погрешностей, представляющий стандартное отклонение. C показывает средние значения из трех независимых экспериментов (n = 3), с погрешностей, представляющие Среднеквадратичная ошибка среднего значения. p < 0,05, ***p < 0,001, неоднократные примеры односторонний дисперсионный анализ.

Рисунок 3 : Проверка анализа секвестрации ЛДГ нокаут (A-C) или подходы нокдаун (D). (A-C) ATG5 дикого типа (WT) или нокаут (KO) MEFs (A), ATG7 WT или KO MEFs (B), или ATG9A WT или KO MEFs (C) относились с ДМСО транспортного средства (0,01%) в см или 10 Нм Baf в EBSS, как указано. LDH поглощения ставки были определены после 3 h лечения. Средние значения от четырех (A; n = 4) или три (B и C; n = 3) независимых экспериментов, с погрешностей, представляющие Среднеквадратичная ошибка среднего значения. p < 0,05, неоднократные примеры двусторонней ANOVA. Н.с., не значительные. (D) LNCaP клетки были обратный transfected с 5 Нм siRNA nontargeting управления (siCtrl), или с 5 Нм каждый ATG9A-, FIP200-, ULK1-, ULK2-, GABARAP-, GABARAPL1- или GABARAPL2-таргетинг siRNA oligoes, как указано. После 48 ч, клетки либо относились с ДМСО транспортного средства (0,1%) в см, или 100 Нм Baf в EBSS, как указано. LDH поглощения ставки были определены после 3 h лечения. Приведены средние значения из трех биологических реплицирует (тройные скважин) от одного эксперимента (n = 1), с погрешностей, представляющий стандартное отклонение.
Обсуждение
В резюме протокол, описанные здесь представляет собой надежный и широко применяется метод для мониторинга активности сыпучих autophagic поглощения в mammalian клетках. По сравнению с оригинальной метод12,16, мы удалены несколько лишних шагов, упрощенный несколько оставшихся шагов и внедрили существенное разукрупнение. В результате протокол значительно возрастает по отношению к стоимости - и время эффективность, и такое же количество образцов теперь могут быть обработаны в менее половины времени по сравнению с протоколом. Для 24 пробы, шаги 2 – 3 (1 день) требует около ½ ч подготовки плюс 3 h эффективной работы, тогда как шаг 4 (день 2) могут быть выполнены в ~ 2 h (время оценкам, учитывая, что все необходимые буферы готовятся заранее). После пробу на день 1 обычно предшествует клетки лечения, включая 3 – 4 ч инкубации с Baf или других ингибиторов autolysosomal ЛДГ деградации удобно разделить assay в течение двух дней подряд. Однако это также можно выполнить весь assay в один и тот же день. В этом случае это позволит сэкономить время для оснастки замораживание образцов в жидком азоте в шаге, 3,6 и 3,7. Хотя не проверял с нынешним протоколом, вполне вероятно, что замораживания оттаивания шаг может быть пропущен вообще, поскольку более разработать версию assay в первичной крыса гепатоцитов было сделано без этот шаг23.
Протокола, представленные здесь могут быть выполнены с относительной легкостью. Следует отметить важно быть точным в закупорить, так как assay включает несколько этапов отбора проб и разрежения. Кроме того супернатанта чаяния должны быть сделано тщательно, так что минимальное количество ионов присутствуют в суспензию клеток сахарозы в шаге 2.5 и таким образом, чтобы как мало цитозольной ЛДГ максимально загрязнять отложившейся материала на шаге 3.6. Assay как описано здесь является гибким, для широкого круга исходного материала. Например в LNCaP клетках, мы успешно использовали assay с целого ряда различных количество клеток во время сбора урожая, охватывающих до десятикратного разница (от 2,5 x 105 клеток до 2,5 х 106 клеток). Минимальный начальный материал, необходимый определяется, насколько чувствительным обнаружения является метод ферментативную активность ЛДГ. Весьма вероятно может масштабироваться протокол значительно дальше вниз, путем масштабирования вниз тома, используемые на шагах 2.5, 3.3, 3.5, 3.7, 4.2 и 4.3.
Electrodisruption шагом является важнейшим фактором и техническую проблему с assay. Сильный, но краткий, электрическим током клеток в результаты свободных ионов, изотонический раствор в единообразной и избирательного нарушения плазматической мембраны, оставляя внутриклеточные структуры и органелл (включая autophagic вакуоли) нетронутым12, 29. При использовании адэрентных клеток, важно, что они терпеть ферментативные и механических лечения в шагах 2,1-3,1 (мобильный отряд, центрифугирование и ресуспендирования). Для шага 3.1 не важно для получения совершенно одноклеточных подвеска. Например это очень трудно достичь с LNCaP клетками. Тем не менее успешно electrodisruption в почти 100% клеток всегда получается, даже внутри клеток скопления, содержащие несколько десятков физически прилагаемый клеток. При тестировании нового типа ячейки, то целесообразно проверить эффективность electrodisruption (см. шаг 3.3.1)17. Близка к 100% клеток должен быть постоянно Трипановый синий положительным после electrodisruption шаг17. Если это не так, electroporator параметры скорее должны быть изменены. Используя assay в 20 различных млекопитающих типов клеток, у нас не было для изменения параметров electroporator. Таким образом после того, как были найдены правильные настройки для одной линии клеток млекопитающих, это может работать для всех других типов клеток млекопитающих. Чтобы убедиться, что electrodisruption условия не являются слишком жесткими, то есть,что нарушена только плазматической мембраны и не мембраны внутриклеточных органелл, выполните шаг 3.3.2.
Основная autophagy осуществляется autophagosomes, который совместно поглощать значительное количество цитозоль вместе с другими грузами. Это может произойти через сугубо неизбирательной autophagy часть цитоплазмы, или таким образом, представляет собой смесь селективного и неселективной autophagy. На сегодняшний день он не ясно ли и в какой степени селективного и неселективной autophagy сосуществуют как два различных режима autophagy, или ли autophagosomes как правило одновременно секвестр грузов в избирательный и неселективной манеры. Важно однако, недавнее исследование сообщили, что активаторы селективного autophagy вызвать аналогичные увеличение массовых цитозольной грузов поглощения как поглощение конкретного груза30. Результаты от нашей собственной лаборатории, по согласованию с это (неопубликованные результаты). Анализируя связывание растворимых цитозольной белков (например, ЛДГ) поэтому вероятно имеет потенциал, чтобы обнаружить изменения в macroautophagic поглощение деятельность под многие, если не все условия. Однако хотя он по-прежнему остается быть доказанным, нельзя исключать возможность, что некоторые виды условий однозначно побудить тип селективного эксклюзивные autophagy, где груз так плотно завернута в phagophore что даже цитозоль исключается из будучи поглощенных в autophagosome. Для проверки ли может существовать такое условие, массовых анализов autophagy как assay поглощение ЛДГ должны выполняться параллельно с выборочной autophagy анализов.
Одним из главных преимуществ пробирного поглощение ЛДГ является, что он измеряет поглощение эндогенного грузов, таким образом делая его широко применимым методом. Кроме того assay меры поглощение активности в весьма количественном выражении. LDH поглощение пробирного является важным инструментом для изучения механизмов и регулирование формирования autophagosome, с открытым phagophores не может поглощать ЛДГ. Это весьма громоздким и сложным, если не невозможно оценить ли autophagosome как структуры запечатанном сущности или нет, электронной микроскопии. Другой метод, который используется для анализа ли закрыты autophagosomes является для тестирования чувствительности autophagy маркеров (например, LC3) или рецепторов (например, sequestosome 1 (p62/SQSTM1) или точка ядерных белков 52 (NDP52)) чтобы протеаз10 ,,31-32. Недостатком этот assay является то, что один учится протеазы защиты компонентов корзину, а не autophagic грузов. Кроме того поскольку проба основана на Западный blotting, это только полуколичественного.
В то время как способность анализировать autophagy эндогенного грузов является преимуществом, свойственны ограничения с Пробирной поглощение ЛДГ и любые другие анализы, которые оценки секвестрации эндогенного грузов, является, что ингибитор деградации должны быть включены для того чтобы выявить специфические эффекты на autophagic связывания, а не чистой эффекты поглощения и деградации. Эффективных ингибиторов ЛДГ деградации относятся ингибиторы протонного насоса как Baf или concanamycin3,16,18и lysosomotropic агенты, как хлорохин и хлорид аммония33. Leupeptin ингибитор протеазы хорошо работает в первичной крыса гепатоцитов23, но в целом неэффективно в линии клеток млекопитающих, мы проверили. Мы регулярно использовать Baf13, который действует быстро и очень эффективна в доброкачественные и злокачественные клетки. Однако важно иметь в виду, что ни один из ингибиторов деградации ЛДГ совершенно конкретные, и предполагаемый эффект ингибиторов на autophagy не может быть исключена. Чтобы свести к минимуму риск влияния неспецифической, рекомендуется использовать концентрации ингибитора, которые находятся только в насыщения уровней и включить ингибитор только за последние несколько часов (3-4 h) эксперимента. Насыщения концентрация Baf должны определяться для каждого типа клеток. Как гид, 50 – 100 Нм насыщения для большинство линий культивируемых клеток млекопитающих, мы проверили, в то время как некоторые ячейки такие типы, как MEFs требует только 10 Нм КБА для полного блока в ЛДГ деградации.
Очевидным ограничением с assay поглощение ЛДГ является, что она может быть выполнена только на живых клеток, таким образом исключая его использования для анализа autophagy в фиксированных клеток и тканей. С другой стороны, есть в настоящее время без анализов установлено, что можно измерить функциональной активности autophagic в стационарных клетках. Хотя не проверял с нынешним протоколом, должно быть вполне возможно использовать пробирного поглощение ЛДГ для оценки в vivo активности autophagic поглощения в экспериментальной организмов. Ограничение было бы что организм должен терпеть лечение ингибитором лизосомальных ЛДГ деградации, и что период времени между такими лечения и производительность assay должны быть относительно короткими, чтобы свести к минимуму потенциальные последствия неспецифической ингибитор. Интересно, что ранние исследования, Kominami et al., указала, что 3-6 ч лечение крыс с leupeptin (внутрибрюшинного введения 2 мг/100 г массы тела) соответствующие соблюдать эффективное накопление autophagically поглощенных ЛДГ в печени субцеллюлярные фракций, обогащенные для autophagic вакуоли34.
Внематочная выражение флуоресцентные депонирования рН чувствительных зондов например розелла35 или36 Keima может использоваться для визуализации autophagic поглощения без необходимости включения деградации ингибиторов. Кроме того в отличие от анализа секвестрации ЛДГ, такие подходы может использоваться для визуализации autophagic поглощения в одиночных клетках. Кроме того слияние зонда к органелле ориентации последовательности могут быть использованы для мониторинга поглощение определенных органелл. Мощного микроскопическое платформ может также предусматривать анализ высокопроизводительного скрининга. Недостатки являются, что внематочной зонд выражение, а также накопление зонда в системе лизосомальных могут повлиять autophagic путь. Кроме того в отличие от анализа секвестрации ЛДГ, один зависит клетки, которые могут эффективно transfected. Наконец, в то время как assay поглощение ЛДГ обеспечивает прямой количественной выход процент поглощенный в цитозоле, методы, основанные на изображение обычно не может предоставить этот тип вывода, абсолютное количественных. Было бы целесообразно, чтобы сделать использование обоих типов подходов на взаимодополняющей основе. Другой отличный метод изучения autophagic поглощения без необходимости для деградации ингибиторов является введение radiolabeled Рафиноза в клетки реверсивные электро permeabilization3,23,37, 38. Рафиноза является мембрана impermeant и метаболически инертного сахара, который устойчив к лизосомальных ферментов. Таким образом его autophagic поглощение может сопровождаться разделение цитозольной из sedimentable клеток фракции3,23,,3738. Этот подход является, однако, больше времени, чем поглощение пробирного ЛДГ и требует дополнительных мер предосторожности вследствие использования радиоактивности. Наконец в итоге основная autophagic поглощения и беспрепятственный autophagic грузовой поток, деградации долгоживущих белков, может быть точно измерено устоявшихся белка на основе маркировки метод39,40 ,,4142,43. Однако, в отличие от анализа секвестрации ЛДГ, этот метод не предусматривает конкретных считывания autophagic деятельности, поскольку долгоживущих белки деградации также другие механизмы, чем autophagy, прежде всего в системе протеосомной (тогда как ЛДГ поглощение происходит только в результате autophagy). Таким образом, включен ряд контроля лечения необходимо быть регулярно, например, химические ингибиторы autophagic лизосомальных или протеосомной деградации и генетического вмешательства с autophagy3,16.
LDH поглощение пробирного можно сравнить с часто используемые LC3 потока анализов, которые измеряют уровни LC3-II Западный blotting или LC3 puncta формирования у Вообразимый флуоресценции в отсутствие или наличие ингибиторов лизосомальных LC3 деградации (Baf наиболее часто используется), или переход дневно тегами LC3 вариантов в кислой среде22. Хотя эти анализы на основе LC3 может предоставить полезную информацию, они могут быть трудно интерпретировать, в частности потому, что отношения между степень LC3 потока и количество и тип грузового потока неизвестна. Как уже упоминалось во введении, autophagy сыпучих и Паркин зависимой mitophagy не требуют LC3 семьи белки9,10,,1144. Кроме того, в гепатоцитах голодали крыса, ЛДГ поглощение и деградации продолжается непрерывный периоды времени там, где нет autophagic лизосомальных LC3 потока9. Таким образом в этом случае поток грузов может быть полностью отделена от LC3 потока. Необходимы дополнительные исследования, сравнивая LC3 потока с различными видами грузовых потоков лучше интерпретировать результаты, полученные с LC3 потока анализов.
В его нынешнем виде ЛДГ поглощение пробирного сопоставима с Западный blotting с точки зрения требуемых практический время и затраты. С точки зрения измерения массовых autophagy, это по крайней мере так же эффективно, как на основе Рафиноза поглощение пробирного или деградации assay долгоживущих протеина, описанных выше. Для конкретного измерения активности сыпучих autophagic поглощения и формирование закрытого autophagosomes это гораздо более эффективным и прямо вперед чем LC3 потока анализов или анализы защиты протеазы LC3 или autophagy рецепторов, начиная с последних анализов мера корзину компоненты, а не фактические грузов. Даже несмотря на то, что мы существенно улучшили пропускную способность пробирного поглощение ЛДГ, это далеко не высок объём пробирного, и он не может конкурировать с эффективностью анализов на основе образов, описанных выше. Однако анализов на основе изображений и анализа секвестрации ЛДГ имеют свои преимущества и недостатки, и таким образом оба вида анализов имеют свои собственные значения. Это вероятно возможно через будущих корректировок сделать ЛДГ поглощение пробирного полу высокой пропускной способности. Например можно выполнять electrodisruption в формате 96-хорошо, и это мыслимо, что цитозольной ЛДГ могут быть отделены от поглощенных ЛДГ путем фильтрации вместо центрифугирования, или что центрифугирования шаг может быть выполнена в 96- хорошо формате. Кроме того анализы для измерения активности ЛДГ, которые гораздо более чувствительны, чем используемый в текущий протокол были разработаны и коммерчески доступны. Другие интересные будущих потенциалов assay являются его предполагаемого использования в других типах клеток, чем клетки млекопитающих, например в дрожжи или другие одноклеточные организмы, или даже завод клеток, а также его использования в естественных условиях измерений autophagic поглощение деятельность в тканях экспериментальной организмов.
В заключение мы считаем, что поглощение пробирного ЛДГ в его улучшения и возродил форме будет важным инструментом в будущих исследованиях, связанных с autophagy.
Раскрытие информации
Авторы имеют никакого конфликта интересов.
Благодарности
Эта работа была финансовую поддержку научно-исследовательский совет Норвегии, в Университете Осло, фонда Anders Jahre, Фонд Нансена и наследие в памяти Хенрик Homan. Мы благодарим д-р Нобору Mizushima для ATG5 +/ + MEFs и ATG5-/-MEFs, доктор Масааки Komatsu для ATG7 +/ + MEFs и ATG7/MEFs и доктор Сидзуо Akira для ATG9A +/ + MEFs и ATG9A/MEFs. Мы благодарим Фрэнк Sætre для оказания технической помощи и д-р за Seglen O. для конструктивного обсуждения методологических.
Материалы
| Name | Company | Catalog Number | Comments |
| 1.5 mL and 2 mL microcentrifuge tubes | Eppendorf | 211-2130 and 211-2120 | |
| 12-well plates | Falcon | 353043 | |
| Accumax cell detachment solution | Innovative Cell Technologies | A7089 | Keep aliquots at -20 °C for years, and in fridge for a few months |
| Bafilomycin A1 | Enzo | BML-CM110-0100 | Dissolve in DMSO |
| BJ cells | ATCC | CRL-2522 | use at passage <30 |
| Bovine serum albumin (BSA) | VWR | 422361V | |
| Burker counting chamber | Fisher Scientific | 139-658585 | |
| Countess Cell Counting Chamber Slides | ThermoFisher Scientfic | C10228 | |
| Countess II Automated Cell Counter | ThermoFisher Scientfic | AMQAX1000 | |
| Cover glass for the Burker counting chamber | Fisher Scientific | 139-658586 | |
| Criterion Tris-HCl Gel, 4–20%, 26-well, 15 µL, 13.3 cm x 8.7 cm (W x L) | Bio-Rad | 3450034 | |
| DTT | Sigma-Aldrich | D0632 | |
| Earle's balanced salt solution (EBSS) | Gibco | 24010-043 | conatains 0.1% glucose |
| EDTA | Sigma-Aldrich | E7889 | |
| Electroporation cuvette (4 mm) | Bio-Rad | 1652088 | |
| Exponential decay wave electroporator | BTX Harvard Apparatus | EMC 630 | |
| Fetal bovine serum (FBS) | Sigma | F7524 | 10% final concentration in RPMI 1640 medium |
| HEK293 cells | ATCC | CRL-1573 | |
| Imidazole | Sigma-Aldrich | 56750 | Autoclave a 65 mM solution and keep in fridge for months |
| Incubator; Autoflow IR Direct Heat CO2 incubator | NuAire | NU-5510E | |
| Lipofectamine RNAiMAX Transfection Reagent | ThermoFisher | 13778150 | |
| LNCaP cells | ATCC | CRL-1740 | use at passage <30 |
| 3-Methyl Adenine (3MA) | Sigma-Aldrich | M9281 | Stock 100 mM in RPMI in -20 °C. Heat stock to 65 °C for 10 min, and use at 10 mM final concentration |
| Refridgerated Microcentrifuge | Beckman Coulter Life Sciences | 368831 | |
| Refridgerated Microcentrifuge with soft-mode function | Eppendorf | Eppendorf 5417R | |
| MRT67307 hydrochloride (ULKi) | Sigma-Aldrich | SML0702 | Inhibits ULK kinase activity. Dissolve in DMSO. |
| MaxMat Multianalyzer instrument | Erba Diagnostics | PL-II | |
| MCF7 cells | ATCC | HTB-22 | |
| NADH | Merck-Millipore | 1.24644.001 | |
| Nycodenz | Axis-Shield | 1002424 | |
| Opti-MEM Reduced Serum Medium | ThermoFisher | 31985062 | |
| Phosphate-buffered saline (PBS) | Gibco | 20012-019 | |
| Pipette tips 3 (0.5-20 µL) | VWR | 732-2223 | Thermo Fischer ART Barrier tips |
| Pipette tips (1-200 µL) | VWR | 732-2207 | Thermo Fischer ART Barrier tips |
| Pipette tips (100-1,000 µL) | VWR | 732-2355 | Thermo Fischer ART Barrier tips |
| Pipettes | ThermoFisher | 4701070 | Finnpipette F2 GLP Kit |
| Poly-D-lysine | Sigma-Aldrich | P6407-10X5MG | Make a 1 mg/mL stock solution in sterile H2O. This solution is stable at -20 °C for at least 1 year. |
| Pyruvate | Merck-Millipore | 1066190050 | |
| RPE-1 cells (hTERT RPE-1) | ATCC | CRL-4000 | |
| RPMI 1640 | Gibco | 21875-037 | |
| SAR-405 | ApexBio | A8883 | Inhibits phosphoinositide 3-kinase class III (PIK3C3). Dissolve in DMSO. |
| Silencer Select Negative Control #1 (siCtrl) | ThermoFisher/Ambion | 4390843 | |
| Silencer Select ATG9-targeting siRNA (siATG9A) | ThermoFisher/Ambion | s35504 | |
| Silencer Select FIP200-targeting siRNA (siFIP200) | ThermoFisher/Ambion | s18995 | |
| Silencer Select ULK1-targeting siRNA (siULK1) | ThermoFisher/Ambion | s15964 | |
| Silencer Select ULK2-targeting siRNA (siULK2) | ThermoFisher/Ambion | s18705 | |
| Silencer Select GABARAP-targeting siRNA (siGABARAP) | ThermoFisher/Ambion | s22362 | |
| Silencer Select GABARAPL1-targeting siRNA (siGABARAPL1) | ThermoFisher/Ambion | s24333 | |
| Silencer Select GABARAPL2-targeting siRNA (siGABARAPL2) | ThermoFisher/Ambion | s22387 | |
| Sodium phosphate monobasic dihydrate (NaH2PO4 • 2H2O) | Merck-Millipore | 1.06580.1000 | |
| Sodium phosphate dibasic dihydrate (Na2HPO4 • 2H2O ) | Prolabo | 28014.291 | |
| Sucrose | VWR | 443816T | 10% final concentration in water; filter through 0.45 µm filter and keep in fridge for months |
| Thapsigargin | Sigma-Aldrich | T9033 | Inhibits the SERCA ER Ca2+ pump. Dissolve in DMSO. |
| Triton X-405 | Sigma-Aldrich | X405 | 1% final |
| Trypan Blue stain 0.4% | Molecular Probes | T10282 | |
| Trypsin-EDTA (0.25% w/v Trypsin) | Gibco | 25200-056 | |
| Tween-20 | Sigma-Aldrich | P2287 | 0.01% final |
Ссылки
- Rubinsztein, D. C., Frake, R. A. Yoshinori Ohsumi's Nobel Prize for mechanisms of autophagy: from basic yeast biology to therapeutic potential. J R Coll Physicians Edinb. 46 (4), 228-233 (2016).
- Mizushima, N. The exponential growth of autophagy-related research: from the humble yeast to the Nobel Prize. FEBS Lett. 591 (5), 681-689 (2017).
- Seglen, P. O., et al. Macroautophagic cargo sequestration assays. Methods. 75, 25-36 (2015).
- Hoyvik, H., Gordon, P. B., Seglen, P. O. Use of a hydrolysable probe, [14C]lactose, to distinguish between pre-lysosomal and lysosomal steps in the autophagic pathway. Exp Cell Res. 166 (1), 1-14 (1986).
- Plomp, P. J., Gordon, P. B., Meijer, A. J., Hoyvik, H., Seglen, P. O. Energy dependence of different steps in the autophagic-lysosomal pathway. J Biol Chem. 264 (12), 6699-6704 (1989).
- Gordon, P. B., Seglen, P. O. Prelysosomal convergence of autophagic and endocytic pathways. Biochem Biophys Res Commun. 151 (1), 40-47 (1988).
- Holen, I., Gordon, P. B., Seglen, P. O. Protein kinase-dependent effects of okadaic acid on hepatocytic autophagy and cytoskeletal integrity. Biochem J. 284, 633-636 (1992).
- Kabeya, Y., et al. LC3, a mammalian homologue of yeast Apg8p, is localized in autophagosome membranes after processing. Embo j. 19 (21), 5720-5728 (2000).
- Szalai, P., et al. Autophagic bulk sequestration of cytosolic cargo is independent of LC3, but requires GABARAPs. Exp Cell Res. 333 (1), 21-38 (2015).
- Nguyen, T. N., et al. Atg8 family LC3/GABARAP proteins are crucial for autophagosome-lysosome fusion but not autophagosome formation during PINK1/Parkin mitophagy and starvation. J Cell Biol. , (2016).
- Pontano Vaites, L., Paulo, J. A., Huttlin, E. L., Harper, J. W. Systematic analysis of human cells lacking ATG8 proteins uncovers roles for GABARAPs and the CCZ1/MON1 regulator C18orf8/RMC1 in macro and selective autophagic flux. Mol Cell Biol. , (2017).
- Kopitz, J., Kisen, G. O., Gordon, P. B., Bohley, P., Seglen, P. O. Nonselective autophagy of cytosolic enzymes by isolated rat hepatocytes. J Cell Biol. 111 (3), 941-953 (1990).
- Bowman, E. J., Siebers, A., Altendorf, K. Bafilomycins: a class of inhibitors of membrane ATPases from microorganisms, animal cells, and plant cells. Proc Natl Acad Sci U S A. 85 (21), 7972-7976 (1988).
- Hadjivassiliou, A. G., Rieder, S. V. The enzymatic assay of pyruvic and lactic acids. A definitive procedure. Clin Chim Acta. 19 (3), 357-361 (1968).
- Bergmeyer, H. U., Bernt, E., Bergmeyer, H. U. . Methods of enzymatic analysis (2nd English ed). 2, 574-579 (1974).
- Engedal, N., et al. Modulation of intracellular calcium homeostasis blocks autophagosome formation. Autophagy. 9 (10), 1475-1490 (2013).
- Luhr, M., et al. A Simple Cargo Sequestration Assay for Quantitative Measurement of Nonselective Autophagy in Cultured Cells. Methods Enzymol. 587, 351-364 (2017).
- Mousavi, S. A., et al. Effects of inhibitors of the vacuolar proton pump on hepatic heterophagy and autophagy. Biochim Biophys Acta. 1510 (1-2), 243-257 (2001).
- Seglen, P. O., Gordon, P. B. 3-Methyladenine: specific inhibitor of autophagic/lysosomal protein degradation in isolated rat hepatocytes. Proc Natl Acad Sci U S A. 79 (6), 1889-1892 (1982).
- Ronan, B., et al. A highly potent and selective Vps34 inhibitor alters vesicle trafficking and autophagy. Nat Chem Biol. 10 (12), 1013-1019 (2014).
- Saetre, F., Hagen, L. K., Engedal, N., Seglen, P. O. Novel steps in the autophagic-lysosomal pathway. Febs j. 282 (11), 2202-2214 (2015).
- Klionsky, D. J., et al. Guidelines for the use and interpretation of assays for monitoring autophagy (3rd edition). Autophagy. 12 (1), 1-222 (2016).
- Seglen, P. O., Overbye, A., Saetre, F. Sequestration assays for mammalian autophagy. Methods Enzymol. 452, 63-83 (2009).
- Hurley, J. H., Young, L. N. Mechanisms of Autophagy Initiation. Annu Rev Biochem. 86, 225-244 (2017).
- Thastrup, O., Cullen, P. J., Drobak, B. K., Hanley, M. R., Dawson, A. P. Thapsigargin, a tumor promoter, discharges intracellular Ca2+ stores by specific inhibition of the endoplasmic reticulum Ca2(+)-ATPase. Proc Natl Acad Sci U S A. 87 (7), 2466-2470 (1990).
- Kuma, A., et al. The role of autophagy during the early neonatal starvation period. Nature. 432 (7020), 1032-1036 (2004).
- Komatsu, M., et al. Impairment of starvation-induced and constitutive autophagy in Atg7-deficient mice. J Cell Biol. 169 (3), 425-434 (2005).
- Saitoh, T., et al. Atg9a controls dsDNA-driven dynamic translocation of STING and the innate immune response. Proc Natl Acad Sci U S A. 106 (49), 20842-20846 (2009).
- Gordon, P. B., Seglen, P. O. Autophagic sequestration of [14C]sucrose, introduced into rat hepatocytes by reversible electro-permeabilization. Exp Cell Res. 142 (1), 1-14 (1982).
- An, H., Harper, J. W. Systematic analysis of ribophagy in human cells reveals bystander flux during selective autophagy. Nat Cell Biol. 20 (2), 135-143 (2018).
- Fass, E., Shvets, E., Degani, I., Hirschberg, K., Elazar, Z. Microtubules support production of starvation-induced autophagosomes but not their targeting and fusion with lysosomes. J Biol Chem. 281 (47), 36303-36316 (2006).
- Velikkakath, A. K., Nishimura, T., Oita, E., Ishihara, N., Mizushima, N. Mammalian Atg2 proteins are essential for autophagosome formation and important for regulation of size and distribution of lipid droplets. Mol Biol Cell. 23 (5), 896-909 (2012).
- Øverbye, A., Sætre, F., Hagen, L. K., Johansen, H. T., Seglen, P. O. Autophagic activity measured in whole rat hepatocytes as the accumulation of a novel BHMT fragment (p10), generated in amphisomes by the asparaginyl proteinase, legumain. Autophagy. 7 (9), 1011-1027 (2011).
- Kominami, E., Hashida, S., Khairallah, E. A., Katunuma, N. Sequestration of cytoplasmic enzymes in an autophagic vacuole-lysosomal system induced by injection of leupeptin. J Biol Chem. 258 (10), 6093-6100 (1983).
- Rosado, C. J., Mijaljica, D., Hatzinisiriou, I., Prescott, M., Devenish, R. J. Rosella: a fluorescent pH-biosensor for reporting vacuolar turnover of cytosol and organelles in yeast. Autophagy. 4 (2), 205-213 (2008).
- Katayama, H., Kogure, T., Mizushima, N., Yoshimori, T., Miyawaki, A. A sensitive and quantitative technique for detecting autophagic events based on lysosomal delivery. Chem Biol. 18 (8), 1042-1052 (2011).
- Ogier-Denis, E., et al. A heterotrimeric Gi3-protein controls autophagic sequestration in the human colon cancer cell line HT-29. J Biol Chem. 270 (1), 13-16 (1995).
- Seglen, P. O., Gordon, P. B., Tolleshaug, H., Hoyvik, H. Use of [3H]raffinose as a specific probe of autophagic sequestration. Exp Cell Res. 162 (1), 273-277 (1986).
- Luhr, M., Sætre, F., Engedal, N. The Long-lived Protein Degradation Assay: an Efficient Method for Quantitative Determination of the Autophagic Flux of Endogenous Proteins in Adherent Cell Lines. Bio-protocol. 8 (9), e2836 (2018).
- Ronning, O. W., Pettersen, E. O., Seglen, P. O. Protein synthesis and protein degradation through the cell cycle of human NHIK 3025 cells in vitro. Exp Cell Res. 123 (1), 63-72 (1979).
- Seglen, P. O., Grinde, B., Solheim, A. E. Inhibition of the lysosomal pathway of protein degradation in isolated rat hepatocytes by ammonia, methylamine, chloroquine and leupeptin. Eur J Biochem. 95 (2), 215-225 (1979).
- Seglen, P. O., Solheim, A. E. Valine uptake and incorporation into protein in isolated rat hepatocytes. Nature of the precursor pool for protein synthesis. Eur J Biochem. 85 (1), 15-25 (1978).
- Bauvy, C., Meijer, A. J., Codogno, P. Assaying of autophagic protein degradation. Methods Enzymol. 452, 47-61 (2009).
- Engedal, N., Seglen, P. O. Autophagy of cytoplasmic bulk cargo does not require LC3. Autophagy. 12 (2), 1-3 (2016).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены