Method Article
젖 산 효소 격리 분석 결과-간단 하 고 신뢰할 수 있는 결정 하는 방법을 포유류 세포에서 대량 Autophagic 격리 활동
요약
여기 포유류 세포에서 대량 autophagic 격리 활동을 측정 하기 위한 간단 하 고 잘 검증 된 프로토콜을 설명 합니다. 메서드를 사용 하면 전체 셀룰러 LDH 수준에 비해 sedimentable 셀 분수에 젖 산 효소 (LDH)의 비율을 측정에 기반.
초록
대량 autophagy 더블/멀티 membrane 구조에 autophagosomes 되 나 큰 부분의 세포질의 격리에 의해 특징입니다. 여기이 프로세스를 모니터링 하는 간단한 프로토콜을 설명 합니다. 또한, 일반적인 결과 및 경작된 한 포유류 세포의 다양 한 종류에서 autophagy 유도 조건 방법의 실험적인 검증 제공 됩니다. 대량 autophagy, 동안 autophagosomes cytosol, 그리고 그로 인하여 또한 다른 autophagic 화물 함께 녹는 cytosolic 단백질 격리. LDH는 안정적이 고 높은 비 선택적으로 autophagosomes에 분리 된 풍부 하 고, 녹는 cytosolic 효소 이다. LDH 격리의 양에 따라서 대량 autophagic 격리의 양을 반영합니다. 우리 cytosolic LDH, sedimentable의 효소 활동의 측정에 의해 뒤에서 sedimentable를 효과적으로 분리 하는 분류 electrodisruption-기반 프로토콜을 사용 하는 효율적이 고 정확 하 게 확인 하려면 LDH 격리 셀에, 전체 셀 샘플 대의 분수 Autophagic 격리 sedimentable 그에서 치료 세포 치료 셀에 LDH의 비율을 빼서 결정 됩니다. LDH 격리 분석 결과의 장점은 그것은 다른 방법에 반대 생 화물의 autophagic 격리의 양적 측정 하거나 격리 프로브 또는 반 양적 protease의 소성 식 포함 제공 autophagy 마커 또는 수용 체의 보호 분석입니다.
서문
Autophagy ("먹는 자"에 대 한 그리스어) 세포내 물질의 vacuolar lysosomal 저하에 대 한 진화 보존된 과정 이다. 효 모와 인간 autophagy 중요 autophagy 관련 ("ATG") 유전자의 발견 즉시 실현 그 autophagy 인류 건강 및 질병 (의학 또는 생리학에 있는 노벨상 2016에 의해 인정에 중요 한 역할을 담당 요시노 리 Ohsumi) autophagy 빠르게 되고있다 세포 생물학1,2에서 가장 심각 하 게 공부 과정 중 하나.
Macroautophagy ("autophagy" 라 함)은와 효과적으로 격리 하는, 이중 또는 다중 membrane 구조 ("autophagosomes")에 세포내 막 cisternae ("phagophores")의 접는 확장 특징은 휩 싸이 세포질의 나머지에서 자료. Autophagosomes와 리소좀의 융합에 내부 autophagosomal 막과 분리 된 화물은 저하 고 재활용. Autophagosomes 무작위 (비 선택적 autophagy)와 선택적 (선별 autophagy) 매너 세포질 물질을 격리 수 있습니다. 대량 autophagy 대부분 비 선택적이 고 선택적 autophagy의 혼합을 나타냅니다.
1960 년대와 70 년대 ("형태"의 시대 autophagy 연구)에서 autophagic 격리 주로 ultrastructural 분석을 통해 평가 했다. 1980 년대에서 1990 년대 ("생 화 확 적인 시대") 당 Seglen와 동료의 시작-누가 주 쥐 hepatocytes에서 autophagy 공부-양적 autophagic 격리 활동3를 측정 하는 첫 번째 방법을 개발. 이 분석 실험을 사용 하 여, Seglen 정의 autophagic lysosomal 통로가4,5의 다른 단계를 특징, 발견 만들어낸 amphisome6 (endosome autophagosome 퓨전의 제품), 그리고 처음 autophagy 조절7인 산화 단백질의 역할을 설명 합니다. 그러나, 1990 년대에서 ATGs ("분자 시대")의 발견과 포유류 ATG8 단백질의 첫 번째 특성, 후 microtubule 관련 단백질 1A/1B-라이트 체인 3 (LC3) 20008, ATG 단백질에 대 한 표식으로의 사용에에서는 autophagic 과정 신속 하 게 얻은 인기, 그리고 더 오래 되 고 더 힘 드는 생 화 확 적인 방법 뒤에 남았다. 사실, 지난 18 년 동안, 서쪽 오 점 및 LC3의 형광 현미경 분석 되었다 지금까지 가장 인기 있는 (그리고 많은 경우에) 공부 하는 포유류 세포에서 autophagy의 의미. 장점은 상대적으로 완화는 이러한 방법을 밖으로 실행 될 수 있다입니다. 단점은 저거 카트 구성 요소 (LC3)을 공부 하 고 실제 autophagic 화물 보다는. 이 상태 또는 격리 대 통로 통해 LC3의 유량과 화물의 유량의 관계를 매우 명확 하지 때문에 오히려 심각한 단점입니다. 사실, 우리는 대량 화물 유동 조건에서 높은 수준에서 유지 될 수 있다 나타났습니다 셀9에 활용 된 LC3의 존재에도 불구 하 고 아무 LC3 플럭스입니다. 또한, 우리는 대량 autophagy 효율적인 LC3 고갈에 의해 영향을 받지 않습니다 이며 따라서 가능성이 LC3 독립적인9시연. 이 찾는 나중 LC3 노크 아웃 연구10,11, 또한 나타낼 Parkin 종속 mitophagy (미토 콘 드리 아의 선택적 autophagy) LC310,11의 독립에 의해 확인 됐다 .
요약 하자면, 분명 있다 autophagic 활동을 모니터링 하 화물 기반 분석에 대 한 필요. 최적으로 적용, 정의 그리고 수행 하기 쉬운 이러한 분석 광범위 하 게 되어야 합니다. 지난 몇 년 동안 우리는 198012, 당 Seglen에 의해 개발 되었다 sedimentable, autophagic 공포 포함 된 셀을 cytosolic LDH의 전송 측정 기반 LDH 격리 분석 결과에 특별 한 관심을가지고 분수입니다. LDH는 안정, 수용 성 cytosolic 단백질 phagophores enwrap 세포질 화물 때에 압수 쉽게 공동. LDH의 격리 따라서 autophagic 격리의 일반적인 척도 이다. LDH는 autophagic lysosomal 통로가12에 의해 독점적으로 저하 됩니다. 따라서, lysosomal 저하 억제제, 예를 들어, bafilomycin A1 존재 (Baf)13, 실험적인 치료 효과 직접 autophagic 격리 활동에 변경 반영. 저하 억제제의 부재, LDH 격리와 저하에 변경의 그물 효과 측정할 수 있습니다.
LDH는 매우 고 편 모든 세포 유형에 표현 때문에 효소 분석 결과14,15LDH 수준을 정확 하 게 정해질 수 LDH 격리 분석 결과 광범위 하 게 적용 됩니다. 그러나, 원래12 프로토콜-기본 쥐 hepatocytes에 설립-오히려 소모 되었고 시작 물자로 만든 전기 방전 커패시터의 높은 금액을 요구. 단계별 방식으로, 우리는 점차적으로 변형 분석 결과 쉽고 다양 한 방법으로. 첫째, 원래 프로토콜 포유류 세포 라인16에 사용 하기 위해 적응 시켰다. 둘째, 방법은 실질적으로 downscaled3,9이었다. 셋째, 프로토콜의 여러 단계에서 탈락 했다,17단계 힘 드는 밀도 쿠션을 포함 하 여. 이 동시에 샘플 (즉, 적은 약 15 시작 당 12-잘 접시에서 한 우물을 사용 하 여 샘플16 당 10 cm 접시를 사용 하 여 원래 시작 지점에서 메서드의 더욱 상세화를 사용 소재)17. 넷째, 우리는 주문 품 전기 방전 커패시터17를 대체할 수 있는 상업 electroporation 기구 발견.
여기 우리의 최신 프로토콜의 LDH 격리 분석 결과, 이전에 게시17 비교 방법의 몇 가지 더 단순화를 포함 하는 제공 됩니다. 또한, 다른 세포 유형의 수에서 얻은 전형적인 결과 집합이 표시 되 고 중요 한 것은, 유전자 뿐 아니라 약리 최저 및 녹아웃 접근을 사용 하 여 메서드의 실험적인 검증의 여러 줄 제공 됩니다. 전체 프로토콜의 전체 흐름 체계를 위해 그림 1을 참조 하십시오.
프로토콜
1. 셀 시드 및 치료
-
셀에 대 한 선호 문화 매체를 사용 하 여 37 ℃에서 5% CO2 습도 인큐베이터에서 75 cm2 조직 배양 플라스 크에 문화 부착 셀에 입력 합니다. 근처 합칠 셀 계층에 도달할 때까지 성장 하는 세포 수 있습니다.
참고: 사용 하 여 10% 태아 둔감 한 혈 청 (FBS) LNCaP, HEK293, 마우스 미 발달 섬유 아 세포 (MEFs), 비제이에 대 한 보충 RPMI 1640 매체 MCF-7 및 RPE-1 셀.- 워시 3 mL 37 ° C 인산 염 버퍼 식 염 수 (PBS), pH 7.4와 셀. 3 mL 0.25% (w/v) 트립 신-ethylenediaminetetraacetate (EDTA), PBS를 장착 하 고 세포 분리 (2-5 분) 때까지 37 ° C에서 5% CO2 습도 인큐베이터에 플라스 크를 품 어.
- 10%를 포함 하는 7 mL 문화 매체와 분리 된 셀 resuspend FBS. 혼합 10 µ L 셀 서 스 펜 션 약 수 10 µ L 0.4 %Trypan 파랑 microcentrifuge 튜브에서 0.5-20 µ L 피 펫 팁을 사용 하 여. 동일한 피 펫 팁을 사용 하 여 즉시 계산 챔버 슬라이드를 작성 하 고 자동화 된 셀 카운터에 셀.
-
준비는 적합 한 희석 (아래 참고 참조) 단계 1.1.2 사용 하 여 셀 서 스 펜 션의 문화 매체 포함 10 %FBS, 고 씨는 희석된 세포 현 탁 액의 사용 하 여 12 음 조직 배양 플레이트 (표면적 ~3.8 cm2)의 각 음에 무 균 1 mL 기술입니다. 원하는 셀 밀도 도달 했습니다, 예를 들어, 60-90% 합류 수확에서 때까지 37 ° C에서 5% CO2 습도 인큐베이터에 성장을 수 있습니다.
참고: 원하는 셀 confluency 수확에 줄 것 이다 세포 현 탁 액의 적절 한 희석 달라 집니다 셀 형식에서 셀 형식 뿐만 아니라 기간 및 실험적 치료의 유형. 따라서,이 해야 합니다 실험적으로 평가 되어야 각 케이스에서.- 실험을 위해 둘 다 취급 하 고 수확 후에 시드, 시드 2.5 x 105 LNCaP, HEK293, MCF-7 셀, 5 x 104 MEFs, 4 × 105 BJ, 또는 1.5 x 10 2 일5 RPE-1 셀에 12-잘 접시의 각 잘.
- 느슨하게 고착 하는 셀에 대 한 셀 형식에 대 한 권장 하는 코팅의 종류와 판 코트. LNCaP (및 HEK293) 셀에 대 한 폴 리-D-리 (PDL)와 코팅 접시를 사용 합니다.
- 이 위해, 각 음에 살 균 H2O 2.5 µ g/mL에서 500 µ L PDL를 추가 하 고 실내 온도 (20-25 ° C)에서 30 분 멸 균 환경에서 접시를 품 어. 흡입, PDL를 제거 하 고 각각 1 mL 균 H2o. 짧게 잘 씻어
참고: 일반적으로, 단계 1.2.1 이루어집니다 어떤 실험적 치료 없이. 그러나, RNAi를 수행 하는 경우 역방향 transfection 시드9시작 편리할 수 있습니다.
-
조건 당 중복 되거나 triplicate 우물에 실험적 치료를 수행 합니다.
- 예를 들어 50 셀 치료의 일반적으로 autophagic 격리의 효율적인 유도 또는 아미노산 무료 얼의 1 mL로 세포 세척 하 여 급성 혈 청-및 아미노산 기아에 셀 제목 mTOR 억제제 Torin1 nM의 균형 솔루션 (EBSS) 매체, 소금과 후 37 ° c.에 5% CO2 습도 인큐베이터에서 EBSS의 1 mL에 셀을 품 어
- 웰 스 sedimentable LDH의 배경 수준을 정의 하는 데 치료의 한 세트를 남겨 주세요.
- 금액을 추가할 saturating 후 격리 억제제 bafilomycin A1 (Baf)3,13,,1618 셀 전에 3-4 h 실험적 치료의 존재 또는 부재에 수확. 37 ° c.에 5% CO2 습도 인큐베이터에 셀을 품 어
- 사용 100 nM LNCaP, HEK293, BJ, MCF-7과 RPE-1 셀, Baf와 10 nM Baf MEFs에 대 한.
- 만 3-4 h (같은 그의 exemplified 단계 1.3.1 일반적으로)의 기간이 실험적 치료 추가 Baf 동시에 치료. 실험적 치료 더 이상에 대 한 3-4 h, 수확 하기 전에 때까지 기다려야 하 고 500 x 2 µ L 매체에 직접 Baf 주식을 집중 추가.
- Baf의 추가 후 바로 접시를 교 반에 의해 혼합. 이 시점에서 그것은 또한 컨트롤, 예를 들어, 팬-phosphoinositide 3 키 니 아 제 (PI3K) 억제제 3-메 틸 아데닌 (3MA)19, 10 m m 또는 선택적 PI3K 클래스 III의 10 µ M로 macroautophagic 격리 억제제를 추가 추천 억제제 특별 행정구-40520.
2. 세포 수확 및 Electrodisruption에 대 한 준비
- 치료 기간의 끝에, 보통 흡입으로 발음 하 고 각 잘 하 200 µ L 세포 분리 솔루션 (37 ° C에 미리가 열)를 추가 합니다. 세포 분리 (일반적으로 약 5 분) 때까지 37 ° C에서 품 어.
참고: 0.25% (w/v) 트립 신-EDTA는 세포 분리 솔루션 대신 사용할 수 있습니다, 반면 후자는 DNase 분리 된 세포의 점성을 감소 하는 데 도움이 있습니다. 매체는 철저 하 게 발음 하 고로 트립 신-EDTA 또는 셀 분리 솔루션의 추가 하기 전에 셀을 씻어 필요는 없습니다. - 500 µ L 실내 온도 (20-25 ° C) PBS, pH 7.4, 2% (w/v) 소 혈 청 알 부 민 (BSA)를 포함 하는 각 음을 추가 하 고 피펫으로와 resuspend 때까지 아니 세포 덩어리를 볼 수 있습니다. 얼음에 세포 현 탁 액 1.5 mL microcentrifuge 튜브를 즉시 전송.
참고: 달리 명시 하지 않는 한 얼음에 모든 후속 단계를 수행 합니다. - 침전 물 4 ° c.에서 5 분에 대 한 400 x g 에서 원심 분리 하 여 세포
- 철저 하 게 건조 가능한 셀 펠 릿을 떠나 (흡입)과 상쾌한 발음.
- 각 튜브를 400 µ L 10% (w/v) 자당 (초순 H2O)에 추가 합니다.
3. 플라즈마 멤브레인 Electrodisruption 및 Sedimentable 및 총 셀 분수의 분리
- Resuspend 근처 단일 셀 서 스 펜 션을 얻기 위해 피 펫과 셀 펠 릿 그리고 4mm electroporation 베트에 그것을 전송.
참고: Pipetting 위아래 ~ 10-15 번, 100-1000 µ L 피 펫 팁, 사용 하는 일반적으로 충분 한. - 지 수 감퇴 웨이브 electroporator에는 베트를 놓고 800 단일 전기 펄스 방전 V, 25 µ F, 및 400 Ω; 이러한 설정은 ~ 8 ms의 펄스를 생성합니다.
-
새로운 피 펫 팁을 사용 하 여 포함 하는 400 µ L 얼음 인산 염 버퍼 자당 솔루션 (100 m m 나트륨 monophosphate, 2 m m dithiothreitol (DTT), 2 mM EDTA, 그리고 1.75% 자당, pH 7.5), 1.5 mL microcentrifuge 튜브 셀 disruptate 전송 하 고 간단히 혼합 함으로써 pipetting.
- 선택 사항: 효율적인 플라즈마 멤브레인 electrodisruption17를 확인 하려면 혼합 10 µ L로 단계 3.3에서에서 희석된 셀 disruptate의 10 µ L 0.4 %Trypan 파랑 1.5 mL microcentrifuge 튜브에서. 세 실로 전송 하 고 Trypan 블루 긍정적인 세포의 비율 인지 확인 > 99%.
- 실내 온도 (20-25 ° C)에서 30 분 동안 세 실에 샘플을 두고 Trypan 블루 긍정적인 세포의 비율 남아 있다 확인 > 99%.
- 선택 사항:는 electrodisruption 너무 가혹 하지 않은, 즉, 그것은 세포내 세포를 교란 했다를 확인 하려면 위에서 설명한 대로 1.1-3.3 단계를 수행 하지만 (음 ~ 80 %confluent 셀 레이어와 6 잘 플레이트에서), 더 큰 시작 물자를 사용 하 여 고 단계 2.5 및 150 µ L 자당 인산 염 버퍼 솔루션 단계 3.3에서에서 DTT 없이 150 µ L 10% 자당을 사용 합니다.
- 2 mL 원심 분리기에 인산 염 버퍼 8% (w/v) 밀도 그라데이션 매체 (예를 들어, 8 %Nycodenz, 50 m m 인산 나트륨, 2.2% 자당, 1 mM EDTA)의 1.2 mL 밀도 쿠션 위에 희석된 셀 disruptate 솔루션의 신중 하 게 레이어 200 µ L 피 펫을 사용 하 여 튜브입니다. 20000 x g 는 microcentrifuge에서 4 ° C에서 45 분 (대 한 부드러운 가속 및 감속), 소프트 모드 기능에서 centrifuge 그리고 신중 하 게 얼음에 튜브를 넣어.
- 신중 하 게 어떤 밀도 그라데이션 중간 솔루션을 선택 하 고 신선한 microcentrifuge 튜브를 전송 하지 않도록 하는 ~ 200 µ L 최고 분수의 60 µ L을 제거 합니다.
참고:이 "세포 수액"21라고 뛰어난 순도의 cytosol을 포함 되어야 합니다. - 테스트는 분수의 순도 표준 기술 및 4-20% 그라데이션 젤16를 사용 하 여 세포 기관이 포함 된 단백질의 서쪽 오 점 분석을 수행 하 여 위의 단계에서 얻은.
- 예를 들어 cathepsin B21, 시 토 크롬 c, 및 단백질 이황화 isomerase는 3.2 단계에서 전기 충격은 방해 하지 리소좀, 미토 콘 드리 아, 또는 바인딩과 그물, 각각, 확인을 위한 immunoblot immunoblotting 수행 LDH 셀 sap에서 cytosolic 단백질의 존재를 확인 합니다.
- 병렬로 immunoblotting 단백질 추출 물에 게 총 셀 disruptate 솔루션16 에서 사용 하는 항 체 평가 되 고 세포 기관이 포함 된 단백질을 검출할 수 있다 확인에 수행 합니다.
- 선택 사항: 효율적인 플라즈마 멤브레인 electrodisruption17를 확인 하려면 혼합 10 µ L로 단계 3.3에서에서 희석된 셀 disruptate의 10 µ L 0.4 %Trypan 파랑 1.5 mL microcentrifuge 튜브에서. 세 실로 전송 하 고 Trypan 블루 긍정적인 세포의 비율 인지 확인 > 99%.
- 각 샘플에 대 한 3.1-3.3 단계를 반복 합니다.
- 2 mL microcentrifuge 튜브 포함 900 µ L 얼음 물의 resuspension 버퍼 (나트륨 monophosphate 50 mM, 1 mM DTT, 1 mM EDTA 및 5.9% 자당, pH 7.5) 0.01%와 0.5 %BSA 보충을 550 µ L (단계 3.3에서 취득) 각 희석된 셀 disruptate 솔루션에서 제거 트윈-20, 그리고 짧게 pipetting으로 혼합.
- 생산 4 ° C에서 45 분 18000 x g 에서 원심 분리기 "sedimented LDH" 포함 된 펠 릿. 철저 하 게 알 약을 가능한 건조 떠나 (흡입)과 상쾌한 발음. -80 ° C 냉동 실에 샘플을 놓습니다.
- 새로운 튜브 (단계 3.3에서 취득) 각 희석된 셀 disruptate 솔루션에서 150 µ L를 전송 하 고-80 ° C 냉동 실에 샘플을 배치. 이 샘플을 사용 하 여 셀에 "총 LDH" 수준을 결정.
참고:이 시점에서 실험 수 수 일시 중지에 대 한 원하는 만큼.
4. LDH 추출 및 LDH 효소 활동의 측정
- 해빙 (3.6 단계)에서 "sedimented LDH" 그리고 "총 LDH" 샘플 (단계 3.7) 얼음에.
- (최종 트리톤 X-405 농도 1%의 저조한) 1.5% 트리톤 X-405 "총 LDH" 샘플을 포함 하는 얼음 처럼 차가운 물의 resuspension 버퍼의 300 µ L를 추가 합니다. 30 분 동안 콜드 룸 (4-8 ° C)에 롤러에 샘플을 회전 합니다.
- 1% 트라이 톤 X-405 "sedimented LDH" 샘플, 얼음 처럼 차가운 물의 resuspension 버퍼의 750 µ L을 추가 하 고 동일한 솔루션에이 때까지 피 펫으로 펠 릿을 resuspend.
- 4.2와 4.3 18000 x g 4 ° C에서 5 분 동안에 단계에서 샘플 앙금으 세포질 파편을 원심
- 찬 65 m m 이미의 믹스 4 부분 (찬 65 m m 이미 (pH 7.5)의 한 부분으로 pH 7.5)/0.75 mM pyruvate / 1.8 m m는 4 ° c.에 적어도 3 주 동안 안정 작업 솔루션을 얻기 위해 NADH
- 4.5 단계 작업 솔루션의 200 µ L 4.4 단계에서 supernatants의 3-30 µ L를 혼합.
- 니코틴아미드 아데닌 디뉴클레오티드 (감소 모양) 하락으로 LDH 효소 활동을 측정 하 여 LDH의 금액을 결정 (NADH) 흡 광도 340 nm 알려진된 LDH 농도와 표준에 비해 37 ° C에서. 반응 완료, 즉 흡 광도 340까지 접근 했다 때까지 흡 광도 측정을 수행 nm 이상 시간 변경.
참고: LDH 활동을 측정 하는 클래식 생 화 확 적인 방법입니다. 비록 현재 프로토콜 수행 37 ° C에서 반응, 그것은 또한 수행할 수 있습니다 실내 온도 (20-25 ° C)에 수동 분 광 광도 법 하 고는 것이 좋습니다. 현재 프로토콜 사용 하는 자동화 된 방식에서 작업 솔루션 96 잘 접시에서 샘플을 혼합 하 고 340에서 흡 광도 측정 로봇 multianalyzer 악기를 37 ° C에서 nm 모든 20 3 분에 대 한 s. 그 후, 악기 소프트웨어 계산 단위 (U)로 표현, LDH 농도 / L, 알려진된 LDH의 표준 교정을 통해 얻은 흡 광도 측정의 경사가 표준 곡선에 비해 시간이 지남에 비교 하 여 농도입니다. 이 접근 방식에 의해 탐지의 선형 범위는 30-1500 U/l. 대신, 다양 한 상용 키트 LDH 측정 존재 한다. 그들 중 일부는 커플링 색도계 또는 형광 탐지 탐지의 다른 선형 범위와 UV 분 광 광도 법, 보다 다른 방법으로 활성화 제품의 세대에 효소 반응을 기반으로 합니다.
5입니다. LDH 격리의 계산
- 희석 하 고 계정에 샘플링 각 샘플에 대 한 총 LDH sedimented LDH의 비율을 계산:
Sedimented LDH (%) =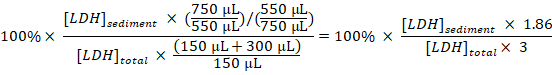
참고: 단계 동안 3.1-3.3 약 50 µ L electroporation 베트 안팎으로 전송 손실 이다. 따라서, 단계 3.3에서에서 희석된 셀 disruptate의 (대신 800 µ L) 750 µ L의 총에서 계산 합니다. - 빼기의 비율을 얻기 위해 Baf와 처리 시간에 의해 실험적으로 치료 셀 나누기에서 샘플에서 얻은 sedimented LDH의 비율에서 치료 세포 (1.3.2 단계)에서 샘플에서 얻은 sedimented LDH의 비율 샘플링 기간에 시간당 LDH를 압수:
분리 된 LDH (% / h) =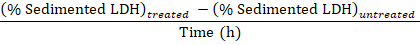
결과
프로토콜을 사용 하 여 여기에 설명 된, LAPC4, DU145, Huh7, PNT2A, 헬러, VCaP, H3122, Hec1A를 포함 하 여 다른 포유류 세포 선의 수에 대량 autophagic 격리 활동 MCF-7, T47D, U2OS, PC3, G361, 마우스 미 발달 섬유 아 세포 (MEFs), RPE-1, HEK293, BJ, 및 LNCaP 세포 측정 했다. 격리 (에 완전 한, 영양분이 풍부한 매체), 기저 조건 평가 또는 셀에 심하게 굶 어 혈 청 및 아미노산 (한 보 나 fide autophagy 유도 조건22). 결과 표시 LDH 격리 활동 기아 상태에서 다른 셀 라인, LAPC4, DU145, Huh7에서 거의 감지 수준에서 배열에 걸쳐 광범위 하 게 다릅니다 PNT2 LNCaP 셀 (그림 2에에서 ~1.6%/h를 (데이터 표시 되지 않음) 세포 A). 굶 어 주 쥐 hepatocytes에서 관찰 하는 속도에 셀 라인, 위에서 언급 한 일반적으로 2.5–4%/h23에서 범위 보다 높습니다. 기저 상태에서 LDH 격리 테스트 하 고 나머지 절반에 ~0.5%/h ~0.2%/h에서 배열 했다 셀 라인의 절반에서 거의 감지 되지 않았습니다 (데이터 표시 되지 않음). 셀 라인 감지 기저 autophagic 격리 활동에서 급성 혈 청 및 아미노산 기아 일반적으로 (예를 들어 그림 2ALNCaP 실험 참조) LDH 격리 요금에 3-4 배 증가 유도 합니다. (위에서 언급 한) 테스트 셀 라인에서 치료 세포 (1.3.2 단계)에서 샘플에서 얻은 sedimented LDH의 배경 비율 일반적으로 약 2-3%입니다. 다양 한 셀 라인, sedimented LDH 값 사이의 편차 (CV)의 내부 실험 계수에서 22 독립적인 실험에서 (% sedimented LDH) 치료 복제의 5.8% ± 1.7% (평균 % 이력서 ± 표준 편차), 3.0-에서 배열 했다 9.0 %입니다. 함께, 이러한 숫자 줄 포유류 세포에서 LDH 격리 분석을 수행할 때 기대 해야할지의 표시.
잘 유전 최저 및 녹아웃으로 화학 억제제의 사용 접근, 광범위 하 게 LDH 격리 분석 결과 안정적으로 autophagic 격리 활동을 측정 하는 것을 확인 합니다. Autophagosome 형성 필요 활성 PI3K 활성화 키 (ULK)24, autophagy 같은 클래스 III (PIK3C3) 및 Unc-51로 세포내 캘리포니아2 + 항상성16에 균형. 같이 그림 2A, 기저와 기아 유도 된 LDH에에서 격리 팬 PI3K 억제제 3MA로 완전히 폐지, 선택적 PIK3C3 억제제 특별 행정구-40520또는 응급실 캘리포니아2 + 펌프 억제제 thapsigargin (TG) LNCaP 셀에 25 . 기아 조건 (아미노산 무료 얼의 균형 소금 솔루션 (EBSS) 중간 스위치) LDH 격리는 또한 강력 하 게 안내, 또는 HEK293 세포 (그림 2B)에 ULK 억제제 MRT67307에 의해 감소 됩니다. 또한, 기아 유도 된 LDH 격리 3MA BJ (그림 2D), (그림 2C), MEFs에 의해 저해 지속적으로 MCF-7 (그림 2E), 및 RPE-1 (그림 2F) 셀입니다. 일반적으로, (즉, Baf 또는 다른 후 격리 억제제의 부재에) 혼자 EBSS 매체에 있는 세포의 외피 리드 하지 않습니다 분리 된 LDH의 어떤 측정 축적 (참조 그림 2 LNCaP 실험 예 A). 이것은 급성 아미노산 기아 리드 가속된 autophagic lysosomal 플럭스, 분리 된 LDH의 신속 하 고 지속적인 저하에서 발생 하기 때문에.
다음, 다양 한 ATG 유전자 녹아웃 (KO) MEFs LDH 격리 필요 autophagy 관련 유전자 autophagosome 형성을 위한 필수적인 것으로 보고 된 여부를 테스트 하려면 고용 했다. 실제로, 기아 유도 된 LDH 격리 ATG5 코 MEFs26 그림 3(A), 확인 하는 우리의 이전 연구 결과9에서 폐지입니다. 또한, 그림 3B 와 C 3에서와 같이, ATG7 코 MEFs27 에 ATG9A 코 MEFs28기아 유도 된 LDH 격리 또한 무딘입니다.
마지막으로, LDH 격리 분석 결과 주요 ATG 유전자 성적표의 입을 RNAi 중재 기아 유도 격리 활동을 억제 것 이라고 여부에 관하여 테스트를 했다. 실제로, transfection ATG9A을 대상으로 siRNA, 또는 결합 된 ULK1와 ULK2, LNCaP 셀 (그림 3D)에서 기아 상태에서 강하게 감소 된 LDH 격리의 대상으로. 또한, 우리가 우리의 이전 연구 결과3,9 초점 접착 키 니 아 제 가족 200 kDa (FIP200)의 단백질 상호 작용의 대상으로 그를 확인 또는 γ-aminobutyric 산 성 유형 A (GABAA) 수용 체 관련 된 단백질 (의 결합 GABARAP) 가족 구성원 억제 기아 유도 된 LDH 격리 (그림 3D).

그림 1 : LDH 격리 프로토콜의 구조 전반적 흐름. 프로토콜 (한 우물)에서 샘플 당 지정 된 볼륨을 사용 하 여 12 음 조직 배양 플레이트 포맷을 기반으로 합니다. 표시 된 대로 분석 결과 프로토콜 편리 하 게 두 가지 별도 작업 일,으로 나눌 수 있습니다. 그러나, 그것은 또한 하루에 모든 절차를 수행할 수입니다. 약어: ABB, 폭발 버퍼 후 (재료에 대 한 프로토콜의 단계 3.3 참조); RSB, 물의 resuspension 버퍼 (재료에 대 한 프로토콜의 단계 3.5 참조). 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
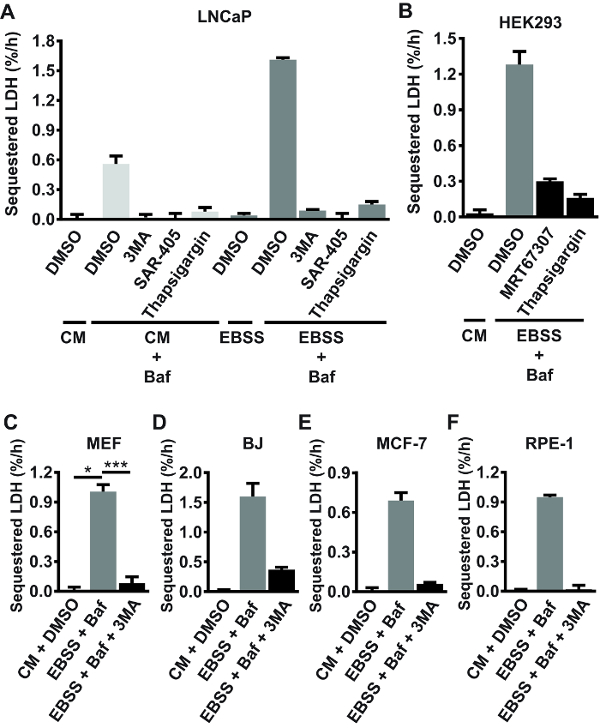
그림 2 : Autophagy 억제 화합물을 사용 하 여 LDH 격리 분석 결과의 유효성 검사. (A) LNCaP 셀도 남았다 치료 (배경 빼기 위해: 단계 1.3.2 참조) 완전 한 성장 매체 (CM; RPMI 1640 + 10% 태아 둔감 한 혈 청 (FBS)), 또는 그들은 DMSO 차량 (0.1%) 또는 100로 치료 했다 nM Baf CM 또는 혈 청-및 아미노산 무료 매체 (EBSS). 또한, 일부 셀 3MA로 치료 했다 (10 m m), 특별 행정구-405 (10 µ M), 또는 Thapsigargin (300 nM), 표시 된 대로. 치료의 3 h 후 세포 수확 했다, 그리고 현재 프로토콜에 대 한 자세한 LDH 격리 요금으로 결정 되었다. (B) HEK293 세포 치료 또는 100 cm, DMSO 차량 (0.1%)와 EBSS, 표시 된 대로에서 Baf nM. 또한, 일부 셀 받은 10 µ M MRT67307 (ULK 억제제) 또는 300 nM Thapsigargin. LDH 격리 요금 처리의 3 h 후 결정 했다. (C F) Baf 또는 cm, DMSO 차량 (0.1%)와 MEF (C), BJ (D), MCF-7 (E), 또는 RPE-1 (F) 세포 치료 (10 c, 100 nM nM D-f에서) 또는 10 m m 3MA, 표시 없이 EBSS에. LDH 격리 요금 처리의 3 h 후 결정 했다. 한 실험에서 3 개의 생물 복제 (triplicate 우물)에서 평균 값을 표시 하는 A, B, D, E 및 F (n = 1), 표준 편차를 나타내는 오차 막대와 함께. 3 개의 독립적인 실험에서 평균 값을 표시 하는 C (n = 3), 의미의 표준 오차를 나타내는 오차 막대와 함께. p < 0.05, * * *p < 0.001, 반복 일방통행 ANOVA를 샘플링.

그림 3 : 녹아웃 (A-C) 또는 (D)의 최저 접근 LDH 격리 분석 결과의 유효성 검사. (A C) ATG5 야생 타입 (WT) 또는 녹아웃 (KO) MEFs (A), 또는 10 cm, DMSO 차량 (0.01%)와 코 MEFs (C) 또는 ATG9A WT 또는 코 MEFs (B), ATG7 WT 치료 nM Baf EBSS, 표시에. LDH 격리 요금 처리의 3 h 후 결정 했다. 4 값을 의미 (A; n = 4) 또는 3 (B와 C n = 3)는 뜻의 표준 오차를 나타내는 오차 막대와 독립적인 실험. p < 0.05, 반복 양방향 ANOVA를 샘플링. N.S., 중요 하지입니다. 셀은 5 페 역 (D) LNCaP nontargeting 제어 siRNA (siCtrl), 또는 5 nM nM 각 ATG9A, FIP200-, ULK1-, ULK2-, GABARAP-, GABARAPL1 또는 GABARAPL2를 대상으로 siRNA oligoes, 표시 된 대로. 48 h 후 셀 중 대우 되었다 DMSO 차량 (0.1%) cm, 또는 100 nM Baf EBSS, 표시에. LDH 격리 요금 처리의 3 h 후 결정 했다. 한 실험에서 3 개의 생물 복제 (triplicate 우물)에서 평균 값은 (n = 1), 표준 편차를 나타내는 오차 막대와 함께.
토론
요약, 여기에 설명 된 프로토콜 포유류 세포에서 대량 autophagic 격리 활동을 모니터링 하는 안정적이 고 광범위 하 게 적용 메서드를 나타냅니다. 원래 방법12,16에 비해, 우리 몇 가지 불필요 한 단계를 제거, 몇몇 나머지 단계를 단순화 하 고 상당한 상세화 도입. 결과적으로, 프로토콜은 크게 관련 비용 및 시간-효율성, 향상 하 고 같은 양의 샘플 이제 원래 프로토콜에 비해 절반 이하로 시간에 처리 될 수 있습니다. 24 샘플에 대 한 2-3 단계 (주 1) 필요 더하기 준비의 약 ½ h 효율적인 작업의 3 h ~ 2 h에서 4 (주 2) 단계를 수행할 수 있습니다 반면 (시간 견적을 모든 필요한 버퍼 미리 준비). 1 일반적으로 앞에 세포 치료, Baf 가진 3-4 h 외피 또는 autolysosomal LDH 저하의 다른 억제제를 포함 하 여 하루에 분석 결과 이후 이틀 연속에 분석 결과 분할 편리 하다. 그러나, 그것은 또한 한 같은 날에 모든 시험을 수행할 수입니다. 그 경우에, 그것 스냅-동결 샘플 단계 3.6 및 3.7에서에서 액체 질소에서에 시간을 절약할 것 이다. 테스트 하지 않지만 현재 프로토콜, 그것은 가능성이 동결-해 동 단계 모두 생략 될 수 있습니다, 때문에 더 정교한 기본 쥐 hepatocytes에 분석 결과의 버전이 단계23없이 완료 되었습니다.
여기에 제시 된 프로토콜은 상대적으로 쉽게 수행할 수 있습니다. 메모의 pipetting, 분석 결과 여러 샘플링 및 희석 단계를 포함 하기 때문에 정확 하 게 중요 하다. 또한, 표면에 뜨는 열망 할 수 철저 하 게, 최소한의 양의 이온 단계 2.5에서에서 자당 세포 현 탁 액에 존재 하 고 가능한 작은 cytosolic LDH로 단계 3.6에서에서 sedimented 물질을 오염. 여기에 설명 된 대로 분석 결과 시작 물자의 넓은 범위에 대 한 유연 합니다. 예를 들어 LNCaP 셀에 우리는 성공적으로 사용 분석 결과 수확에서 세포의 다른 금액의 범위 (105 셀 106 셀 x 2.5 x 2.5)에서 10 차이까지 확장. 필요한 재료를 시작 하는 최소 LDH 효소 활동의 방법은 이다 얼마나 민감한 감지에 의해 정의 됩니다. 프로토콜 확장 가능성이 매우 수 2.5, 3.3, 3.5, 3.7, 4.2 및 4.3 단계에서 사용 하는 볼륨을 축소 하 여, 실질적으로 더.
가장 중요 한 요소 및 분석 결과와 기술적 도전 electrodisruption 단계입니다. 셀 이온, isotonic 솔루션에 강한, 하지만, 전기 충격 발생 하면서 세포 구조와 세포 (autophagic 그들을 포함 하 여) 그대로12, 원형질 막의 균일 하 고 선택적 중단 29. 부착 세포를 사용 하 여 때 그들은 효소 및 기계적 치료 단계 2.1-3.1에에서 (셀 분리, 원심 분리, 및 물의 resuspension) 용납 필수적 이다. 3.1 단계, 완벽 하 게 단일 세포 현 탁 액을 얻기 위해 중요 한 아니다. 예를 들어 이것은 LNCaP 세포와 달성 하기 매우 어렵다입니다. 그럼에도 불구 하 고, 거의 100% 성공적인 electrodisruption는 항상 획득, 물리적으로 연결 된 셀의 여러 수십을 포함 하는 셀 덩어리 내 에서도 새로운 셀 유형 테스트, 그것은 electrodisruption의 효율성을 확인 하는 것이 좋습니다 (단계 3.3.1 참조)17. 셀의 100% 해야 합니다 영구적으로 Trypan 블루 긍정적인는 electrodisruption 단계17후. 없는 경우 electroporator 설정은 대부분 변경 해야 합니다. 분석 결과 20 다른 포유류 세포 유형을 사용 하 여, 우리는 결코 했다 electroporator 설정을 변경. 따라서, 일단 바로 설정을 한 포유류 세포 라인에 대 한 발견 되었습니다, 포유류 세포의 다른 유형 모든을 위해 일 것입니다. Electrodisruption 조건이 너무 가혹 되는지 확인 하려면 단계 3.3.2 따라 즉,그 플라즈마 막만과 하지 세포내 세포의 세포 막 중단 되어 있다.
대량 autophagy 공동 다른 화물 함께 cytosol의 상당한 금액을 격리 하는 autophagosomes에 의해 수행 됩니다. 이 세포질의 일부의 순전히 비 선택적 autophagy 통해 발생할 수 있습니다 또는 방식으로 나타내는 선택적이 고 비 선택적인 autophagy의 혼합. 그것을 현재까지 불분명 하다 여부 또는 어느 정도 선택적이 고 비 선택적인 autophagy 공존 autophagy의 두 개의 다른 모드 또는 여부는 원칙적으로 autophagosomes 동시에 선택적이 고 선택적 비 매너에 화물을 격리. 그러나 중요 한 것은,, 최근 연구는 선택적 autophagy의 활성 유도 특정 화물30의 격리에서 대량 cytosolic 화물 격리에 유사한 증가 보고. 우리 자신의 실험실에서 결과이 계약 (게시 되지 않은 결과). 녹는 cytosolic 단백질의 격리를 분석 (예를 들어, LDH) 따라서 가능성이 많은, 아래 macroautophagic 격리 활동 하지 않을 경우 모든 조건 변경 감지 가능성이 있다. 그러나, 그것은 아직 입증 될, 조건의 특정 유형을 고유 하 게 어디 화물 너무 밀접 하 게에 의해 래핑되는 phagophore는 심지어 cytosol 선택적 독점 autophagy 유형의 유도 가능성을 제외할 수 없습니다 남아 있지만에서 제외 됩니다. autophagosome로 격리 되 고. 같은 조건이 있을 수 있습니다 여부를 조사, 하 선택적 autophagy 분석 실험 병행에서 LDH 격리 분석 결과 같은 대량 autophagy 분석 실험을 실행 해야 합니다.
LDH 격리 분석 결과의 주요 장점 중 하나는 광범위 하 게 적용 가능한 메서드 내 생 화물의 격리 조치 이다. 또한, 분석 결과 매우 양적으로 격리 활동을 측정합니다. LDH 격리 분석 결과 기계 장치를 공부 하 고 오픈 이후 autophagosome 형성의 규칙에 대 한 중요 한 도구 phagophores LDH 격리 수 없습니다. 그건 매우 복잡 하 고 어려운, 불가능 한, autophagosome-같은 구조는 봉인 여부 전자 현미경 검사 법을 평가 하기 위해. Autophagosomes 폐쇄 여부를 분석 하는 데 사용 되는 또 다른 방법은 autophagy 마커 (예를 들어, LC3)의 감도 또는 수용 체를 테스트 하는 (예를 들어, sequestosome 1 (p62/SQSTM1) 또는 핵 점 단백질 52 (NDP52)) 프로 테아 제10에 ,,3132. 이 분석 결과의 단점은 저거 카트 구성 요소 보다는 autophagic 화물의 효소 보호 공부 하 고입니다. 또한, 분석 결과 부 럽에 기반을, 그것은 반 정량 만입니다.
반면 생 화물의 autophagy 분석 기능은 장점, 제한을 LDH 격리 분석 결과와 내 생 화물의 격리를 평가 하는 다른 분석 실험은 저하 억제 물에 포함 되어야 합니다. 분별 autophagic 격리에 대 한 특정 효과 보다 저하 및 격리의 그물 효과. LDH 저하의 효율적인 억제제는 클로로퀸과 염화 암모늄33같은 Baf와 concanamycin3,,1618, lysosomotropic 에이전트 같은 양성자 펌프 억제제를 포함합니다. 프로 테아 제 억제 물 leupeptin 기본 쥐 hepatocytes23에서 잘 작동 하지만 일반적으로 우리는 테스트 하는 포유류 세포 라인에 효율적입니다. 우리는 정기적으로 Baf13, 빠르게 행위 이며 고효율 아 고 악성 세포를 사용 합니다. 그러나, LDH 저하 억제제의 완전히 특정 하 고 autophagy에는 억제제의 상 상속 효과 제외할 수 없습니다 염두에 중요 하다. 일반적인 영향의 위험을 최소화 하기 위해 그것은 포화 수준에 단지는 억제제의 농도 사용 하 고 실험의 마지막 몇 시간 (3-4 h)에 대해서만 억제제를 포함 하도록 추천. 각 세포 유형에 대 한 Baf의 saturating 농도 결정 한다. 가이드로, 50-100 nM은 포화 대부분 우리는 테스트, 경작된 한 포유류 세포 라인의 일부 셀 유형 MEFs 필요한만 10와 같은 반면 nM Baf LDH 저하에서 전체 블록에 대 한.
LDH 격리 분석 결과 분명 한 한계는 그것만 수행할 수 있습니다 살아있는 세포에 따라서 고정된 세포와 조직에서 autophagy의 분석에 대 한 그것의 사용을 제외입니다. 다른 한편으로, 거기는 현재 아무 분석 설립 그 고정 셀에서 기능 autophagic 활동을 측정할 수 있습니다. 테스트 하지 않지만 현재 프로토콜, 그것은 전적으로 평가 실험 유기 체에 있는 autophagic 격리 활동 vivo에서 LDH 격리 분석 결과 사용 하 여 가능 해야 합니다. 유기 체 lysosomal LDH 저하의 억제제로 치료를 용납 해야 합니다와 같은 치료 및 분석 결과의 성능 사이 시간 간격의 잠재적인 비 특정 효과 최소화 하기 위해 상대적으로 짧은 되어야 제한 될 것 이라고 억제제입니다. 흥미롭게도, Kominami 그 외 여러분에 의해 한 이른 연구는 leupeptin (복 주입의 2 mg/100 g의 몸 무게)와 쥐의 3-6 h 치료에 적합 하다 간 autophagically 분리 된 LDH의 효율적인 축적 관찰 표시 subcellular 분수 autophagic 그들34농축.
PH에 민감한 형광 격리의 소성 식 윈저35 같은 프로브 또는 Keima36 저하 억제제를 포함 하는 필요 없이 autophagic 격리를 시각화 하는 데 사용할 수 있습니다. 또한, LDH 격리 분석 결과는 달리 이러한 접근 단일 셀에 있는 autophagic 격리를 시각화 하기 위해 사용할 수 있습니다. 또한, 융합 세포 기관이 대상 시퀀스에 프로브 특정 세포의 격리를 모니터링 하는 데 활용할 수 있습니다. 강력한 현미경 플랫폼 또한 높은 처리량 검열 분석에 대 한 수 있습니다. 불리는 lysosomal 시스템에서 프로브의 축적으로 소성 프로브 식 autophagic 통로 좌우할 지도 모른다. 또한, LDH 격리 분석 결과는 달리 하나 효율적으로 페 수 있습니다 셀에 따라 달라 집니다. 마지막으로, 반면에 LDH 격리 분석 결과 백분율 압수 cytosol의 양적으로 출력을 제공 한다, 이미지 기반 방법 일반적으로 제공할 수 없습니다 절대 양적 출력의이 유형은. 그것은 확인 하는 것이 좋습니다 것입니다 상호 보완적인 방식으로 접근의 두 종류의 사용. Autophagic 격리 저하 억제제를 위한 필요 없이 공부를 또 다른 우수한 방법은 가역 전기-permeabilization3,,2337에 의해 세포에 방사선된 유를 소개 하는 38. 유 막 impermeant metabolically 비활성 설탕 lysosomal 효소에 저항 하는 이다. 따라서, 자사의 autophagic 격리 sedimentable 셀 분수3,23,,3738에서 cytosolic의 분리에 의해 다음 수 있습니다. 그러나이 접근은,, LDH 격리 분석 결과 보다 더 많은 시간이 걸리는 방사능의 사용으로 인해 추가적인 안전 조치가 필요 합니다. 마지막으로, 대량 autophagic 격리와 가리지 autophagic 화물 유출, 수명이 긴 단백질의 분해의 최종 결과 측정 될 수 있다 정확 하 게는 잘 설립 단백질 라벨 기반 방법39,40 여 ,41,,4243. 그러나, LDH 격리 분석 결과는 달리이 방법은 제공 하지 않습니다 특정 읽어 autophagic 활동, 이후 수명이 긴 단백질 또한 autophagy, 보다 다른 메커니즘에 의해 proteasomal 시스템에서 가장 현저 하 게 저하는 (반면에 LDH 격리만 발생 합니다 autophagy의 결과로). 따라서, 치료는 정기적으로 해야 하는 컨트롤의 수 포함, 예를 들어, 화학 억제제 autophagic lysosomal 또는 proteasomal 저하, 그리고 유전 방해가 autophagy3,16.
LDH 격리 분석 결과 측정 LC3 II 수준 부 럽 또는 LC3 puncta 형성 형광 영상에 의해 부재 또는 lysosomal LC3 저하 (Baf가 대부분의 억제제의 존재에 일반적으로 사용 되 LC3 유량 분석와 비교 될 수 있다 자주 사용 하는), 또는 산 성 환경22에 붙일 태그가 LC3 이체의 전환. 이러한 LC3 기반 분석은 유용한 정보를 제공할 수 있습니다, 하지만 그들은 해석, 특히 LC3 플럭스의 정도 및 양과 화물 플럭스의 종류 사이 관계는 알려져 있기 때문에 어려울 수 있습니다. 소개에서 설명 했 듯이, 대량 autophagy와 Parkin 종속 mitophagy LC3 가족 단백질9,10,,1144필요 하지 않습니다. 또한, 굶 어 쥐 hepatocytes에서 LDH 격리와 저하 진행 중단 기간 동안 어디에 더 autophagic lysosomal LC3 유출9. 따라서,이 경우에, 화물 유출 분리 수 있습니다 완전히 LC3 유동. LC3 플럭스 화물 유동의 다른 종류를 비교 하는 더 많은 연구가 더 나은 LC3 플럭스 분석 실험으로 얻은 결과 해석 하는 필요 합니다.
그것의 현재 모양에서 LDH 격리 분석 결과 필요한 실습 시간 및 비용의 점에서 부 럽 비교입니다. 대량 autophagy 측정 점에서 적어도 효율적 유 기반 격리 분석 결과 또는 긴 단백질 저하 분석 결과 위에서 설명한. 대량 autophagic 격리 활동의 특정 측정 및 닫힌된 autophagosomes의 형성, 그것은 훨씬 더 효율적이 고 직선-앞으로 LC3 유량 분석 실험 또는 LC3 또는 autophagy 수용 체의 프로 테아 제 보호 분석 실험 보다 후자의 분석 실험 이후 카트 구성 요소 보다는 실제 화물을 측정 합니다. 우리가 실질적으로 LDH 격리 분석 결과의 처리량을 개선, 비록 그것은 높은 처리량 분석 결과, 멀리 하 고 위에서 설명한 이미지 기반 분석 실험의 효율성과 경쟁할 수 없습니다. 그러나, 이미지 기반 분석 및 LDH 격리 분석 결과 그들의 장점과 단점, 그리고 따라서 분석의 두 종류는 그들의 자신의 가치. 그것은 미래 조정 LDH 격리 분석 결과 세미 높은 처리량을 통해 가능성이 가능 합니다. 예를 들어 96-잘 형식에서 electrodisruption를 수행할 수 있어야 하 고 그것은 cytosolic LDH 대신 원심 분리, 여과 의해 분리 된 LDH에서 분리 될 수 있었다 또는 96-원심 분리 단계를 수행할 수 있습니다. 잘 형식입니다. 또한, 현재 프로토콜에서 사용 하는 것 훨씬 더 민감한 LDH 활동 측정 분석 실험 개발 되었습니다, 그리고 상업적으로 사용할 수 있습니다. 분석 결과의 다른 재미 있는 미래 잠재력은 다른 세포 유형 보다 포유류 세포, 예를 들어 효 모 또는 다른 단 세포 유기 체에서에서 상 상속의 사용 또는 심지어 식물 세포, vivo에서 autophagic의 측정에 대 한 사용 격리 실험 생물의 조직에 활동입니다.
결론적으로, 우리는 개선 하 고 부활 형태로 LDH 격리 분석 결과 미래 autophagy 관련 연구에 중요 한 도구를 있을 것입니다 믿습니다.
공개
저자는 전혀 충돌의 관심이 없다.
감사의 말
이 작품 연구 위원회 노르웨이, 오슬로의 대학, 앤 더 스 년 재단, 난센 재단, 그리고 헨릭 Homan의 메모리에 유산에 의해 재정적으로 지원 되었다. 우리 박사 벅 미즈시마는 ATG5에 대 한 감사 + + MEFs와 ATG5-/-MEFs, 박사 마사 아키 고마쓰는 ATG7에 대 한 + + MEFs 및 ATG7/MEFs, 및 박사 시즈 아키라는 ATG9A에 대 한 + + MEFs 및 ATG9A/MEFs. 우리는 건설적인 방법 론 적 토론에 대 한 기술 지원과 O. Seglen 당 박사에 대 한 프랭크 Sætre을 감사합니다.
자료
| Name | Company | Catalog Number | Comments |
| 1.5 mL and 2 mL microcentrifuge tubes | Eppendorf | 211-2130 and 211-2120 | |
| 12-well plates | Falcon | 353043 | |
| Accumax cell detachment solution | Innovative Cell Technologies | A7089 | Keep aliquots at -20 °C for years, and in fridge for a few months |
| Bafilomycin A1 | Enzo | BML-CM110-0100 | Dissolve in DMSO |
| BJ cells | ATCC | CRL-2522 | use at passage <30 |
| Bovine serum albumin (BSA) | VWR | 422361V | |
| Burker counting chamber | Fisher Scientific | 139-658585 | |
| Countess Cell Counting Chamber Slides | ThermoFisher Scientfic | C10228 | |
| Countess II Automated Cell Counter | ThermoFisher Scientfic | AMQAX1000 | |
| Cover glass for the Burker counting chamber | Fisher Scientific | 139-658586 | |
| Criterion Tris-HCl Gel, 4–20%, 26-well, 15 µL, 13.3 cm x 8.7 cm (W x L) | Bio-Rad | 3450034 | |
| DTT | Sigma-Aldrich | D0632 | |
| Earle's balanced salt solution (EBSS) | Gibco | 24010-043 | conatains 0.1% glucose |
| EDTA | Sigma-Aldrich | E7889 | |
| Electroporation cuvette (4 mm) | Bio-Rad | 1652088 | |
| Exponential decay wave electroporator | BTX Harvard Apparatus | EMC 630 | |
| Fetal bovine serum (FBS) | Sigma | F7524 | 10% final concentration in RPMI 1640 medium |
| HEK293 cells | ATCC | CRL-1573 | |
| Imidazole | Sigma-Aldrich | 56750 | Autoclave a 65 mM solution and keep in fridge for months |
| Incubator; Autoflow IR Direct Heat CO2 incubator | NuAire | NU-5510E | |
| Lipofectamine RNAiMAX Transfection Reagent | ThermoFisher | 13778150 | |
| LNCaP cells | ATCC | CRL-1740 | use at passage <30 |
| 3-Methyl Adenine (3MA) | Sigma-Aldrich | M9281 | Stock 100 mM in RPMI in -20 °C. Heat stock to 65 °C for 10 min, and use at 10 mM final concentration |
| Refridgerated Microcentrifuge | Beckman Coulter Life Sciences | 368831 | |
| Refridgerated Microcentrifuge with soft-mode function | Eppendorf | Eppendorf 5417R | |
| MRT67307 hydrochloride (ULKi) | Sigma-Aldrich | SML0702 | Inhibits ULK kinase activity. Dissolve in DMSO. |
| MaxMat Multianalyzer instrument | Erba Diagnostics | PL-II | |
| MCF7 cells | ATCC | HTB-22 | |
| NADH | Merck-Millipore | 1.24644.001 | |
| Nycodenz | Axis-Shield | 1002424 | |
| Opti-MEM Reduced Serum Medium | ThermoFisher | 31985062 | |
| Phosphate-buffered saline (PBS) | Gibco | 20012-019 | |
| Pipette tips 3 (0.5-20 µL) | VWR | 732-2223 | Thermo Fischer ART Barrier tips |
| Pipette tips (1-200 µL) | VWR | 732-2207 | Thermo Fischer ART Barrier tips |
| Pipette tips (100-1,000 µL) | VWR | 732-2355 | Thermo Fischer ART Barrier tips |
| Pipettes | ThermoFisher | 4701070 | Finnpipette F2 GLP Kit |
| Poly-D-lysine | Sigma-Aldrich | P6407-10X5MG | Make a 1 mg/mL stock solution in sterile H2O. This solution is stable at -20 °C for at least 1 year. |
| Pyruvate | Merck-Millipore | 1066190050 | |
| RPE-1 cells (hTERT RPE-1) | ATCC | CRL-4000 | |
| RPMI 1640 | Gibco | 21875-037 | |
| SAR-405 | ApexBio | A8883 | Inhibits phosphoinositide 3-kinase class III (PIK3C3). Dissolve in DMSO. |
| Silencer Select Negative Control #1 (siCtrl) | ThermoFisher/Ambion | 4390843 | |
| Silencer Select ATG9-targeting siRNA (siATG9A) | ThermoFisher/Ambion | s35504 | |
| Silencer Select FIP200-targeting siRNA (siFIP200) | ThermoFisher/Ambion | s18995 | |
| Silencer Select ULK1-targeting siRNA (siULK1) | ThermoFisher/Ambion | s15964 | |
| Silencer Select ULK2-targeting siRNA (siULK2) | ThermoFisher/Ambion | s18705 | |
| Silencer Select GABARAP-targeting siRNA (siGABARAP) | ThermoFisher/Ambion | s22362 | |
| Silencer Select GABARAPL1-targeting siRNA (siGABARAPL1) | ThermoFisher/Ambion | s24333 | |
| Silencer Select GABARAPL2-targeting siRNA (siGABARAPL2) | ThermoFisher/Ambion | s22387 | |
| Sodium phosphate monobasic dihydrate (NaH2PO4 • 2H2O) | Merck-Millipore | 1.06580.1000 | |
| Sodium phosphate dibasic dihydrate (Na2HPO4 • 2H2O ) | Prolabo | 28014.291 | |
| Sucrose | VWR | 443816T | 10% final concentration in water; filter through 0.45 µm filter and keep in fridge for months |
| Thapsigargin | Sigma-Aldrich | T9033 | Inhibits the SERCA ER Ca2+ pump. Dissolve in DMSO. |
| Triton X-405 | Sigma-Aldrich | X405 | 1% final |
| Trypan Blue stain 0.4% | Molecular Probes | T10282 | |
| Trypsin-EDTA (0.25% w/v Trypsin) | Gibco | 25200-056 | |
| Tween-20 | Sigma-Aldrich | P2287 | 0.01% final |
참고문헌
- Rubinsztein, D. C., Frake, R. A. Yoshinori Ohsumi's Nobel Prize for mechanisms of autophagy: from basic yeast biology to therapeutic potential. J R Coll Physicians Edinb. 46 (4), 228-233 (2016).
- Mizushima, N. The exponential growth of autophagy-related research: from the humble yeast to the Nobel Prize. FEBS Lett. 591 (5), 681-689 (2017).
- Seglen, P. O., et al. Macroautophagic cargo sequestration assays. Methods. 75, 25-36 (2015).
- Hoyvik, H., Gordon, P. B., Seglen, P. O. Use of a hydrolysable probe, [14C]lactose, to distinguish between pre-lysosomal and lysosomal steps in the autophagic pathway. Exp Cell Res. 166 (1), 1-14 (1986).
- Plomp, P. J., Gordon, P. B., Meijer, A. J., Hoyvik, H., Seglen, P. O. Energy dependence of different steps in the autophagic-lysosomal pathway. J Biol Chem. 264 (12), 6699-6704 (1989).
- Gordon, P. B., Seglen, P. O. Prelysosomal convergence of autophagic and endocytic pathways. Biochem Biophys Res Commun. 151 (1), 40-47 (1988).
- Holen, I., Gordon, P. B., Seglen, P. O. Protein kinase-dependent effects of okadaic acid on hepatocytic autophagy and cytoskeletal integrity. Biochem J. 284, Pt 3 633-636 (1992).
- Kabeya, Y., et al. LC3, a mammalian homologue of yeast Apg8p, is localized in autophagosome membranes after processing. Embo j. 19 (21), 5720-5728 (2000).
- Szalai, P., et al. Autophagic bulk sequestration of cytosolic cargo is independent of LC3, but requires GABARAPs. Exp Cell Res. 333 (1), 21-38 (2015).
- Nguyen, T. N., et al. Atg8 family LC3/GABARAP proteins are crucial for autophagosome-lysosome fusion but not autophagosome formation during PINK1/Parkin mitophagy and starvation. J Cell Biol. , (2016).
- Pontano Vaites, L., Paulo, J. A., Huttlin, E. L., Harper, J. W. Systematic analysis of human cells lacking ATG8 proteins uncovers roles for GABARAPs and the CCZ1/MON1 regulator C18orf8/RMC1 in macro and selective autophagic flux. Mol Cell Biol. , (2017).
- Kopitz, J., Kisen, G. O., Gordon, P. B., Bohley, P., Seglen, P. O. Nonselective autophagy of cytosolic enzymes by isolated rat hepatocytes. J Cell Biol. 111 (3), 941-953 (1990).
- Bowman, E. J., Siebers, A., Altendorf, K. Bafilomycins: a class of inhibitors of membrane ATPases from microorganisms, animal cells, and plant cells. Proc Natl Acad Sci U S A. 85 (21), 7972-7976 (1988).
- Hadjivassiliou, A. G., Rieder, S. V. The enzymatic assay of pyruvic and lactic acids. A definitive procedure. Clin Chim Acta. 19 (3), 357-361 (1968).
- Bergmeyer, H. U., Bernt, E. Methods of enzymatic analysis (2nd English ed). Bergmeyer, H. U. 2, Verlag Chemie. 574-579 (1974).
- Engedal, N., et al. Modulation of intracellular calcium homeostasis blocks autophagosome formation. Autophagy. 9 (10), 1475-1490 (2013).
- Luhr, M., et al. A Simple Cargo Sequestration Assay for Quantitative Measurement of Nonselective Autophagy in Cultured Cells. Methods Enzymol. 587, 351-364 (2017).
- Mousavi, S. A., et al. Effects of inhibitors of the vacuolar proton pump on hepatic heterophagy and autophagy. Biochim Biophys Acta. 1510 (1-2), 243-257 (2001).
- Seglen, P. O., Gordon, P. B. 3-Methyladenine: specific inhibitor of autophagic/lysosomal protein degradation in isolated rat hepatocytes. Proc Natl Acad Sci U S A. 79 (6), 1889-1892 (1982).
- Ronan, B., et al. A highly potent and selective Vps34 inhibitor alters vesicle trafficking and autophagy. Nat Chem Biol. 10 (12), 1013-1019 (2014).
- Saetre, F., Hagen, L. K., Engedal, N., Seglen, P. O. Novel steps in the autophagic-lysosomal pathway. Febs j. 282 (11), 2202-2214 (2015).
- Klionsky, D. J., et al. Guidelines for the use and interpretation of assays for monitoring autophagy (3rd edition). Autophagy. 12 (1), 1-222 (2016).
- Seglen, P. O., Overbye, A., Saetre, F. Sequestration assays for mammalian autophagy. Methods Enzymol. 452, 63-83 (2009).
- Hurley, J. H., Young, L. N. Mechanisms of Autophagy Initiation. Annu Rev Biochem. 86, 225-244 (2017).
- Thastrup, O., Cullen, P. J., Drobak, B. K., Hanley, M. R., Dawson, A. P. Thapsigargin, a tumor promoter, discharges intracellular Ca2+ stores by specific inhibition of the endoplasmic reticulum Ca2(+)-ATPase. Proc Natl Acad Sci U S A. 87 (7), 2466-2470 (1990).
- Kuma, A., et al. The role of autophagy during the early neonatal starvation period. Nature. 432 (7020), 1032-1036 (2004).
- Komatsu, M., et al. Impairment of starvation-induced and constitutive autophagy in Atg7-deficient mice. J Cell Biol. 169 (3), 425-434 (2005).
- Saitoh, T., et al. Atg9a controls dsDNA-driven dynamic translocation of STING and the innate immune response. Proc Natl Acad Sci U S A. 106 (49), 20842-20846 (2009).
- Gordon, P. B., Seglen, P. O. Autophagic sequestration of [14C]sucrose, introduced into rat hepatocytes by reversible electro-permeabilization. Exp Cell Res. 142 (1), 1-14 (1982).
- An, H., Harper, J. W. Systematic analysis of ribophagy in human cells reveals bystander flux during selective autophagy. Nat Cell Biol. 20 (2), 135-143 (2018).
- Fass, E., Shvets, E., Degani, I., Hirschberg, K., Elazar, Z. Microtubules support production of starvation-induced autophagosomes but not their targeting and fusion with lysosomes. J Biol Chem. 281 (47), 36303-36316 (2006).
- Velikkakath, A. K., Nishimura, T., Oita, E., Ishihara, N., Mizushima, N. Mammalian Atg2 proteins are essential for autophagosome formation and important for regulation of size and distribution of lipid droplets. Mol Biol Cell. 23 (5), 896-909 (2012).
- Øverbye, A., Sætre, F., Hagen, L. K., Johansen, H. T., Seglen, P. O. Autophagic activity measured in whole rat hepatocytes as the accumulation of a novel BHMT fragment (p10), generated in amphisomes by the asparaginyl proteinase, legumain. Autophagy. 7 (9), 1011-1027 (2011).
- Kominami, E., Hashida, S., Khairallah, E. A., Katunuma, N. Sequestration of cytoplasmic enzymes in an autophagic vacuole-lysosomal system induced by injection of leupeptin. J Biol Chem. 258 (10), 6093-6100 (1983).
- Rosado, C. J., Mijaljica, D., Hatzinisiriou, I., Prescott, M., Devenish, R. J. Rosella: a fluorescent pH-biosensor for reporting vacuolar turnover of cytosol and organelles in yeast. Autophagy. 4 (2), 205-213 (2008).
- Katayama, H., Kogure, T., Mizushima, N., Yoshimori, T., Miyawaki, A. A sensitive and quantitative technique for detecting autophagic events based on lysosomal delivery. Chem Biol. 18 (8), 1042-1052 (2011).
- Ogier-Denis, E., et al. A heterotrimeric Gi3-protein controls autophagic sequestration in the human colon cancer cell line HT-29. J Biol Chem. 270 (1), 13-16 (1995).
- Seglen, P. O., Gordon, P. B., Tolleshaug, H., Hoyvik, H. Use of [3H]raffinose as a specific probe of autophagic sequestration. Exp Cell Res. 162 (1), 273-277 (1986).
- Luhr, M., Sætre, F., Engedal, N. The Long-lived Protein Degradation Assay: an Efficient Method for Quantitative Determination of the Autophagic Flux of Endogenous Proteins in Adherent Cell Lines. Bio-protocol. 8 (9), e2836(2018).
- Ronning, O. W., Pettersen, E. O., Seglen, P. O. Protein synthesis and protein degradation through the cell cycle of human NHIK 3025 cells in vitro. Exp Cell Res. 123 (1), 63-72 (1979).
- Seglen, P. O., Grinde, B., Solheim, A. E. Inhibition of the lysosomal pathway of protein degradation in isolated rat hepatocytes by ammonia, methylamine, chloroquine and leupeptin. Eur J Biochem. 95 (2), 215-225 (1979).
- Seglen, P. O., Solheim, A. E. Valine uptake and incorporation into protein in isolated rat hepatocytes. Nature of the precursor pool for protein synthesis. Eur J Biochem. 85 (1), 15-25 (1978).
- Bauvy, C., Meijer, A. J., Codogno, P. Assaying of autophagic protein degradation. Methods Enzymol. 452, 47-61 (2009).
- Engedal, N., Seglen, P. O. Autophagy of cytoplasmic bulk cargo does not require LC3. Autophagy. 12 (2), 1-3 (2016).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유
당사 웹 사이트에서는 사용자의 경험을 향상시키기 위해 쿠키를 사용합니다.
당사 웹 사이트를 계속 사용하거나 '계속'을 클릭하는 것은 당사 쿠키 수락에 동의하는 것을 의미합니다.