Method Article
Il dosaggio di sequestro di lattato deidrogenasi — Un metodo semplice e affidabile per determinare l'attività autofagica sequestro Bulk in cellule di mammifero
* Questi autori hanno contribuito in egual misura
In questo articolo
Riepilogo
Qui è descritto un protocollo semplice ed e validato per la misurazione di massa autofagica sequestro attività in cellule di mammifero. Il metodo si basa su quantificare la percentuale di lattato deidrogenasi (LDH) in frazioni cellulari sedimentabili rispetto ai livelli LDH cellulari totali.
Abstract
L'autofagia alla rinfusa è caratterizzato tramite il sequestro di grandi porzioni di citoplasma in doppio/multi-membrane strutture definite autofagosomi. Qui è descritto un semplice protocollo per monitorare questo processo. Inoltre, sono disponibili i risultati tipici e validazione sperimentale del metodo in condizioni che inducono autofagia in vari tipi di cellule di mammiferi coltivate. Durante l'autofagia alla rinfusa, autofagosomi sequestrano il citosol e quindi anche proteine citosoliche solubili, a fianco di altri carichi autofagici. LDH è una stabile e altamente solubile, abbondante enzima citosolico che è non-selettivamente sequestrata in autofagosomi. La quantità di sequestro di LDH pertanto riflette la quantità di sequestro autofagica alla rinfusa. Per efficientemente ed esattamente determinare sequestro di LDH in cellule, ci avvaliamo di un protocollo basato su electrodisruption frazionamento che separa efficacemente sedimentabili da citosolico LDH, seguita dalla misurazione dell'attività enzimatica in sedimentabili frazioni contro campioni di cellule intere. Autofagica sequestro è determinato sottraendo la proporzione di sedimentabili LDH in cellule non trattate da quello nelle cellule trattate. Il vantaggio del dosaggio di sequestro di LDH è che dà una misura quantitativa del sequestro autophagic del carico endogeno, al contrario di altri metodi che sia coinvolgere l'espressione ectopica di sequestro sonde o semi-quantitativa della proteasi analisi di protezione di autofagia marcatori o recettori.
Introduzione
Autofagia (greco per "auto-eating") è un processo evolutivo conservato per vacuolar/lysosomal degradazione di materiale intracellulare. Al momento della scoperta dei geni autophagy-relative ("ATG"), che sono importanti per autofagia in lievito ed in esseri umani, e la realizzazione che autophagy svolge un ruolo significativo nella salute e nella malattia (riconosciuto dal premio Nobel 2016 in medicina o fisiologia di Yoshinori Ohsumi), l'autofagia è rapidamente diventato uno dei processi più intensamente studiati in biologia cellulare1,2.
Macroautophagy (in appresso denominato "autofagia") è caratterizzata dall'espansione e pieghevole di cisterne intracellulare membrana ("phagophores") in strutture sigillate, doppio - o multi - membrane ("autofagosomi") che sequestrano efficacemente il materiale avvolto dal resto del citoplasma. Al momento della fusione di autofagosomi con i lisosomi, membrana dell'autofagosoma interiore e il carico sequestrato è degradato e riciclato. Autofagosomi possono sequestrare materiale citoplasmico sia casuale (non-selettivi dell'autofagia) e le buone maniere selettiva (selective autofagia). Bulk autofagia molto probabilmente rappresenta un mix di autofagia selettivo e non selettivi.
Negli anni ' 60 e 70 ("la morfologica era" della ricerca di autofagia), sequestro autofagica principalmente è stato valutato attraverso analisi ultrastrutturali. Negli anni ottanta e inizio anni ' 90 ("l'era di biochimica") Per Seglen e colleghi di lavoro — che ha studiato l'autofagia in epatociti primari del ratto — ha sviluppato i primi metodi per misurare quantitativamente autofagica sequestro attività3. Utilizzando queste analisi, Seglen definito e caratterizzato diverse fasi del pathway autofagico-lisosomiale4,5, scoperto e coniato il amphisome6 (il prodotto della fusione di endosome-autofagosoma) e fu il primo a descrivere il ruolo della fosforilazione della proteina nell'autofagia regolamento7. Tuttavia, dopo la scoperta dell'ATG nel 1990 ("l'era molecolare") e la prima caratterizzazione di una proteina di ATG8 dei mammiferi, proteina microtubule-collegata 1A/1B-luce catena 3 (LC3) nel 20008, l'uso di proteine ATG come marcatori per la processo autofagico rapidamente guadagnato popolarità, e i più vecchi e più laboriosi metodi biochimici sono stati lasciati indietro. Infatti, sopra gli ultimi 18 anni, western blot e analisi di microscopia di fluorescenza di LC3 sono diventati di gran lunga più popolari (e in molti casi l'unico) mezzi di studiare l'autofagia in cellule di mammifero. Il vantaggio è la relativa facilità con cui questi metodi possono essere effettuati. Lo svantaggio è che uno sta studiando un componente carrello (LC3) piuttosto che di effettivo carico autofagico. Questo è uno svantaggio piuttosto grave, perché il rapporto tra gli Stati e/o flusso di LC3 attraverso la via contro il sequestro e il flusso di merci è molto chiaro. Infatti, abbiamo dimostrato che il flusso di merci alla rinfusa può essere mantenuta ad alti livelli in condizioni dove non c'è nessun flusso di LC3, nonostante la presenza di LC3 coniugati in cellule9. Inoltre, abbiamo dimostrato che autophagy di massa non è influenzato da efficiente LC3 svuotamento e quindi probabilmente è LC3-indipendente9. Ciò che trova è stata confermata più tardi da LC3 knock-out studi10,11, che inoltre indicano che mitophagy Parkin-dipendente (l'autofagia selettiva dei mitocondri) è indipendente di LC310,11 .
In sintesi, c'è una chiara esigenza di analisi del carico-based monitorare attività autofagica. In modo ottimale tali dosaggi dovrebbero essere ampiamente applicabili, ben definito e facile da eseguire. Negli ultimi anni abbiamo preso un particolare interesse nell'analisi di sequestro della LDH, che è stato sviluppato da Per Seglen nei12anni ' 80 e si basa sulla misurazione del transfer di LDH citosolico a sedimentabili, cella contenenti vacuolo autophagic frazioni. LDH è una proteina citosolica stabile, solubile che co-è prontamente sequestrata quando phagophores enwrap citoplasmico del carico. Sequestro di LDH è pertanto una misura generale di sequestro autofagico. LDH è esclusivamente degradata dalla via autofagica lysosomal12. Così, in presenza di inibitori di degradazione lisosomiale, ad es., methyladenine A1 (Baf)13, direttamente gli effetti del trattamento sperimentale riflettono le alterazioni nell'attività di sequestro autofagici. In assenza di inibitori di degradazione, l'effetto netto delle alterazioni nel sequestro di LDH e degradazione può essere misurata.
Il dosaggio di sequestro di LDH è largamente applicabile, poiché LDH è altamente e ubiquitariamente espressa in tutti i tipi di cellule, e livelli di LDH possono essere quantificati con precisione da un dosaggio enzimatico14,15. Tuttavia, l'originale protocollo12 — stabilito in epatociti primari del ratto — piuttosto che richiede tempo e necessitava di una quantità elevata di inizio materiale nonché un condensatore scarico elettrico su misura. In maniera graduale, abbiamo trasformato gradualmente il dosaggio in un metodo facile e versatile. In primo luogo, il protocollo originale è stato adattato per l'uso in cellule di mammifero linee16. In secondo luogo, il metodo era sostanzialmente ridimensionato3,9. Terzo, sono stati eliminati diversi passaggi nel protocollo, tra cui un cuscino di densità laborioso passo17. Questo permesso simultaneamente un downscaling ulteriormente del metodo, il punto di partenza originale di usando un piatto di 10 cm per esempio16 all'utilizzo di un singolo pozzo da una piastra 12-pozzetti per campione (vale a dire, circa 15 volte meno a partire materiale)17. In quarto luogo, abbiamo identificato un'apparecchiatura di elettroporazione commerciale che potrebbe sostituire il condensatore scarica elettrica su misura17.
Qui è presentato il nostro protocollo più aggiornata del dosaggio di sequestro di LDH, che comprende alcune ulteriori semplificazioni del metodo rispetto al precedentemente pubblicato il17 . Inoltre, viene presentata una serie di tipici risultati ottenuti in un certo numero di diversi tipi di cellule, e soprattutto, più righe di convalide sperimentali del metodo utilizzando farmacologica nonché genetica atterramento e knockout approcci sono forniti. Per uno schema globale di flusso del protocollo intero, Vedi Figura 1.
Protocollo
1. cellula semina e trattamento
-
Cellule aderenti di cultura in recipienti di coltura del tessuto2 75 cm in un incubatore con 5% CO2 a 37 ° C, utilizzando il comodo mezzo di coltura per il tipo di cella in questione. Permettono alle cellule di crescere fino a raggiungere uno strato di cellule vicino-confluenti.
Nota: Utilizzare RPMI 1640 supplementato con 10% siero bovino fetale (FBS) per LNCaP, HEK293, fibroblasti embrionali del mouse (MEFs), BJ, MCF-7 e cellule RPE-1.- Lavare le cellule con soluzione da 3 mL Tampone fosfato 37 ° C (PBS), pH 7,4. Sostituire il PBS con 3 mL 0,25% (p/v) tripsina-acido etilendiamminotetraacetico (EDTA) e incubare la beuta in un incubatore con 5% CO2 a 37 ° C fino a staccano le cellule (2 – 5 min).
- Risospendere le cellule indipendente con 7 mL terreno di coltura contenente 10% FBS. Mescolare un'aliquota di sospensione cellulare 10 µ l con 10 µ l 0,4% Trypan Blue in un tubo del microcentrifuge, utilizzando un puntale di 0,5 – 20 µ l. Utilizzare la stessa punta della pipetta per riempire immediatamente una conteggio diapositiva di camera e contare le celle in un contatore di cellule automatizzato.
-
Preparare un'adeguata diluizione (Vedi nota sotto) della sospensione delle cellule dal punto 1.1.2 using cultura media contenente 10% FBS ed il seme di 1 mL di sospensione cellulare diluito in ciascun pozzetto di una piastra (superficie ~3.8 cm2) di coltura del tessuto 12-pozzetti utilizzando asettica tecnica. Consentono la crescita in un incubatore con 5% CO2 a 37 ° C fino a quando la densità di cella desiderata è stata raggiunta, ad esempio, 60 – 90% confluenza al momento del raccolto.
Nota: La diluizione appropriata della sospensione delle cellule che darà il confluency di cella desiderata al momento del raccolto variano dal tipo delle cellule di tipo delle cellule, così come secondo la durata e il tipo di trattamenti sperimentali. Così, questo deve essere valutato empiricamente in ogni caso.- Per gli esperimenti che devono essere entrambi trattati e raccolto 2 giorni dopo la semina, seme 2.5 x 105 LNCaP, HEK293, o MCF-7 celle, 5 x 104 MEFs, 4 x 105 BJ o 1.5 x 105 RPE-1 cellule in ciascun pozzetto della piastra 12-pozzetti.
- Per le cellule che aderiscono liberamente, ricoprire le piastre con il tipo di rivestimento consigliato per il tipo di cella in questione. Per le cellule di LNCaP (e HEK293) utilizzare piastre rivestite con poli-D-lisina (PDL).
- A tal fine, aggiungere 500 µ l PDL a 2,5 µ g/mL in sterile H2O ad ogni pozzetto e incubare le piastre in un ambiente sterile per 30 min a temperatura ambiente (20 – 25 ° C). Rimuovere il PDL con aspirazione e lavare ogni bene brevemente con 1 mL sterile H2O.
Nota: In generale, punto 1.2.1 è fatto senza trattamenti sperimentali. Tuttavia, se si esegue RNAi, può essere conveniente per iniziare un transfection inverso con la semina9.
-
Eseguire trattamenti sperimentali a wells duplicate o triplicate per condizione.
- Ad esempio, trattare le cellule con 50 nM di Torin1 l'inibitore di mTOR, che generalmente è un induttore efficiente del sequestro autofagica o sottoporre le cellule a acuta inedia dell'aminoacido e siero - lavando le cellule con 1 mL di amino acidi Earle di equilibrato Mezzo di soluzione (EBSS) di sale e successivamente Incubare le cellule in 1 mL di EBSS in un incubatore con 5% CO2 a 37 ° C.
- Lasciare una serie di pozzi non trattata al fine di definire livelli di fondo di sedimentabili LDH.
- Aggiungere una quantità saturante del post-sequestro inibitore methyladenine A1 (Baf)3,13,16,18 nell'assenza o nella presenza dei trattamenti sperimentali, 3 – 4 h prima cella vendemmia. Incubare le cellule in un'incubatrice umidificata con 5% CO2 a 37 ° C.
- Uso 100 nM Baf per LNCaP, HEK293, BJ, MCF-7 e cellule RPE-1 e 10 nM Baf per MEFs.
- Per trattamenti sperimentali che hanno una durata di solo 3 – 4 h (come quelli esemplificati in punto 1.3.1 hanno in genere), aggiungere Baf simultaneamente con i trattamenti. Per trattamenti più sperimentali, attendere 3-4 ore prima della raccolta e aggiungere 2 µ l di una 500 x concentrato Baf stock direttamente nel terreno.
- Mescolare agitando la piastra immediatamente dopo l'aggiunta di Baf. A questo punto è anche raccomandabile per aggiungere gli inibitori macroautophagic sequestro come controlli, ad esempio, il pan-fosfoinositide 3-chinasi (PI3K) inibitore della 3-metil adenina (3MA)19di 10 mM o 10 µM della classe selettiva di PI3K III inibitore di SAR-40520.
2. raccolta e preparazione per Electrodisruption delle cellule
- Alla fine del periodo di trattamento, aspirare il mezzo con aspirazione e aggiungere 200 µ l cella distacco di soluzione (pre-riscaldata a 37 ° C) in ciascun pozzetto. Incubare a 37 ° C fino a staccano le cellule (in genere circa 5 min).
Nota: Considerando che 0,25% (p/v) tripsina-EDTA può essere usato anziché la soluzione di distacco delle cellule, quest'ultimo contiene DNasi, che aiuta a ridurre la viscosità delle cellule indipendente. Fino a quando il mezzo è accuratamente aspirato, non è necessario lavare le cellule prima dell'aggiunta della soluzione di distacco di tripsina-EDTA o cella. - Aggiungere 500 µ l temperatura ambiente (20-25 ° C) PBS, pH 7.4, contenente 2% (p/v) albumina di siero bovino (BSA) in ciascun pozzetto e risospendere con la pipetta fino a quando non ciuffi di cella sono visibili. Trasferire immediatamente la sospensione cellulare per provette per microcentrifuga da 1,5 mL sul ghiaccio.
Nota: Se non diversamente specificato, è possibile eseguire tutti i passaggi successivi sul ghiaccio. - Sedimenti le cellule mediante centrifugazione a 400 x g per 5 min a 4 ° C.
- Aspirare il supernatante (con aspirazione) per lasciare il pellet cellulare più asciutto possibile.
- Aggiungere 400 µ l 10% (p/v) di saccarosio (in ultrapura H2O) ad ogni provetta.
3. membrana plasmatica Electrodisruption e separazione delle frazioni di totale-cellula e sedimentabili
- Risospendere il pellet cellulare con una pipetta per ottenere una sospensione unicellulare nei pressi e trasferirlo in una cuvetta di elettroporazione di 4 mm.
Nota: Pipettaggio altalenante ~ 10 – 15 volte, utilizzando una punta di pipetta 100 – 1.000 µ l, è in genere sufficiente. - Disponga la provetta in un decadimento esponenziale onda electroporator e Scarica un singolo impulso elettrico a 800 V, 25 µF e 400 Ω; Queste impostazioni producono un impulso di durata ~ 8 ms.
-
Utilizzare un nuovo puntale per trasferire la disruptate di cella a una provetta da microcentrifuga da 1,5 mL contenente 400 µ l di soluzione ghiacciata saccarosio di tampone fosfato (monofosfato di sodio 100 mM, 2 mM dithiothreitol (DTT), 2 mM EDTA e 1,75% saccarosio, pH 7.5) e mescolare brevemente di pipettaggio.
- Facoltativo: Per verificare l'efficiente membrana plasmatica electrodisruption17, mescolare 10 µ l della disruptate cella diluito dal punto 3.3 con 10 µ l 0,4% Trypan blu in una provetta da microcentrifuga da 1,5 mL. Trasferire in una camera di conteggio e verificare che la percentuale di cellule positive Trypan Blue è > 99%.
- Lasciare il campione nella camera di conteggio per 30 min a temperatura ambiente (20 – 25 ° C) e verificare che la percentuale di cellule positive tripan blu è rimasta > 99%.
- Facoltativo: Per verificare che il electrodisruption non è stato troppo duro, che è, esso non ha perturbato organelli intracellulari, eseguire passaggi 1.1 – 3.3 come descritto sopra, ma utilizzare un materiale di partenza più grande (un bene da una piastra a 6 pozzetti con uno strato di cellule confluenti ~ 80%), e utilizzare 150 µ l 10% di saccarosio in passo 2.5 e 150 µ l tampone fosfato saccarosio soluzione senza DTT in fase 3.3.
- Utilizzare una pipetta a attentamente strato 200 µ l della soluzione diluita cella disruptate sopra un cuscino di densità 1,2 mL di mezzo gradienti di densità 8% (p/v) di tampone fosfato (ad es., 8% Nycodenz, fosfato di sodio di 50 mM, 2,2% saccarosio, 1 mM EDTA) in una centrifuga di 2 mL tubo. Centrifugare a 20.000 x g per 45 min a 4 ° C in una microcentrifuga con funzione soft-mode (per dolce accelerazione e decelerazione) e con attenzione mettere i tubi sul ghiaccio.
- Rimuovere delicatamente 60 µ l della frazione superiore ~ 200 µ l, facendo attenzione a non prendere qualsiasi soluzione di medio gradiente di densità e trasferire ad un tubo del microcentrifuge fresco.
Nota: Questo dovrebbe contenere citosol di eccezionale purezza, definito "cella sap"21. - Prova la purezza della frazione ottenuta nel passaggio precedente, eseguendo analisi western blot di proteine contenute organello, utilizzando tecniche standard e 4 – 20% gel gradiente16.
- Eseguire ad esempio immunoblotting per catepsina B21, citocromo c e isomerasi del bisolfuro della proteina, per verificare che l'elettroshock nel passaggio 3.2 non ha sconvolto i lisosomi, mitocondri o reticolo endoplasmico di massima, rispettivamente e immunoblot per LDH per verificare la presenza di una proteina citosolica nella linfa delle cellule.
- In parallelo, è possibile eseguire immunoblotting su estratti proteici fatti dal totale delle cellule disruptate soluzione16 per confermare che gli anticorpi utilizzati in grado di rilevare le proteine contenute in organelli che sono in fase di valutazione.
- Facoltativo: Per verificare l'efficiente membrana plasmatica electrodisruption17, mescolare 10 µ l della disruptate cella diluito dal punto 3.3 con 10 µ l 0,4% Trypan blu in una provetta da microcentrifuga da 1,5 mL. Trasferire in una camera di conteggio e verificare che la percentuale di cellule positive Trypan Blue è > 99%.
- Ripetere i passaggi da 3.1-3.3 per ogni campione.
- Rimuovere 550 µ l da ogni soluzione di disruptate cella diluito (ottenuta al punto 3.3) per microcentrifuga 2 mL contenente 900 tampone di risospensione ghiacciata µ l (monofosfato di sodio di 50 mM, 1 mM DTT, 1 mM EDTA e 5,9% saccarosio, pH 7.5) completati con BSA 0.5% e 0,01% Tween-20 e mescolare brevemente di pipettaggio.
- Centrifuga a 18.000 x g per 45 min a 4 ° C per produrre il pellet contenente "sedimentato LDH". Aspirare il supernatante (con aspirazione) per lasciare i pellet più asciutto possibile. Posizionare i campioni in un congelatore a-80 ° C.
- Trasferire 150 µ l di ogni soluzione di disruptate cella diluito (ottenuta al punto 3.3) in nuove provette e posizionare i campioni in un congelatore a-80 ° C. Utilizzare questi esempi per determinare i livelli di "totale LDH" nelle cellule.
Nota: A questo punto l'esperimento può essere sospeso per fino a quando lo si desidera.
4. LDH estrazione e misurazione dell'attività enzimatica di LDH
- Disgelo "LDH sedimentato" (dal punto 3.6) e "totale LDH" campioni (punto 3.7) sul ghiaccio.
- Aggiungere 300 µ l di tampone di risospensione ghiacciata contenente 1,5% Triton X-405 a "LDH totale" campioni (producendo una concentrazione finale di Triton X-405 dell'1%). Ruotare i campioni su un rullo in una cella frigorifera (4 – 8 ° C) per 30 min.
- Aggiungere 750 µ l di tampone di risospensione ghiacciata con 1% Triton X-405 a "LDH sedimentato" campioni e risospendere il pellet con una pipetta, fino a quando non raggiunge una soluzione omogenea.
- Centrifugare i campioni dal punto 4.2 e 4.3 a 18.000 x g per 5 min a 4 ° C a detriti cellulari sedimento non disciolto.
- Mix 4 parti di imidazolo freddo 65 mM (piruvato di pH 7.5)/0.75 mM con una parte dell'imidazolo freddo 65 mM (pH 7,5) / 1,8 mM NADH per ottenere una soluzione di lavoro è stabile per almeno tre settimane a 4 ° C.
- Mescolare 3 – 30 µ l di surnatanti dal passaggio 4.4 con 200 µ l di soluzione di lavoro il passaggio 4.5.
- Determinare la quantità di LDH misurando l'attività enzimatica LDH come il calo di nicotinamide adenindinucleotide (forma ridotta) assorbanza (NADH) a 340 nm a 37 ° C, rispetto ad uno standard con una concentrazione nota di LDH. Eseguire misure di assorbanza fino a quando la reazione si è avvicinato completamento, cioè fino a quando l'assorbanza a 340 nm non cambia con il tempo.
Nota: Questo è il metodo classico di biochimico per misurare l'attività LDH. Anche se l'attuale protocollo esegue la reazione a 37 ° C, può anche essere eseguita a temperatura ambiente (20 – 25 ° C), che è consigliabile se facendo manuale spettrofotometria. L'attuale protocollo utilizza uno strumento di multianalyzer robotico, che in modo automatico mescola campioni con soluzione di lavoro in una piastra a 96 pozzetti e misura l'assorbanza a 340 nm a 37 ° C ogni 20 s per 3 min. Da allora in poi, il software dello strumento calcola la concentrazione di LDH, espressa come unità (U) / L, confrontando la pendenza delle misurazioni assorbanza nel tempo rispetto ad una curva standard ottenuta attraverso la calibrazione con standard di LDH noto concentrazione. La gamma lineare di rilevamento di questo approccio è 30 – 1.500 U/L. In alternativa, esiste una vasta gamma di kit commercialmente disponibili per misurare LDH. Alcuni di loro sono basati sulla reazione enzimatica per la generazione di prodotti colorimetrici o fluorescente, che permette la rilevazione di altri mezzi di spettrofotometria UV e con altre gamme lineari di rilevazione di accoppiamento.
5. calcolo del sequestro di LDH
- Calcolare la percentuale di LDH sedimentato di LDH totale per ciascun campione, prendendo le diluizioni e campionamento in considerazione:
Sedimentato LDH (%) =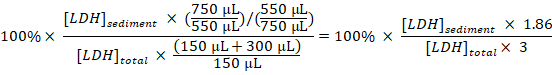
Nota: Durante le fasi 3.1-3.3 circa 50 µ l è perso a causa di trasferimento dentro e fuori la cuvetta di elettroporazione. Così, calcolare da avere un totale di 750 µ l (invece di 800 µ l) di disruptate di cella diluito al punto 3.3. - Sottrarre la percentuale di LDH sedimentato ottenuti nei campioni da cellule non trattate (punto 1.3.2) dalla percentuale di LDH sedimentato ottenuta nei campioni di cellule trattate sperimentalmente e dividere il tempo di trattamento con Baf per ottenere la percentuale di LDH sequestrato all'ora nel periodo di campionamento:
Sequestrato LDH (% / h) =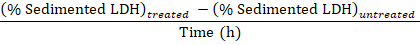
Risultati
Utilizzando il protocollo descritto qui, attività di sequestro autofagica alla rinfusa in un certo numero di linee cellulari di mammifero diversi, tra cui LAPC4, DU145, Huh7, PNT2A, HeLa, VCaP, H3122, Hec1A, MCF-7, T47D, U2OS, PC3, G361, fibroblasti embrionali (MEFs) il mouse, RPE-1, Cellule HEK293, BJ e LNCaP è stata misurata. Sequestro è stato valutato in condizioni basali (in mezzo completo, ricco di sostanze nutritive), o in cellule acutamente affamato per il siero e gli aminoacidi (una bona fide che inducono autofagia condizione22). I risultati hanno indicato che attività di sequestro di LDH in condizioni di inedia varia ampiamente tra linee cellulari differenti, che vanno da livelli a mala pena rilevabili in LAPC4, DU145, Huh7 e PNT2 cellule (dati non mostrati) per ~1.6%/h in cellule di LNCaP (Figura 2 A). La frequenza osservata in epatociti primari di ratto affamato è superiore in linee cellulari di cui sopra e in genere varia da 2.5–4%/h23. In condizioni basali, sequestro di LDH era praticamente inosservabile nella metà delle linee cellulari testati e variava da ~0.2%/h a ~0.5%/h l'altra metà (dati non mostrati). Nelle linee cellulari che mostrano attività rilevabile sequestro autofagica basale, inedia del siero e dell'aminoacido acuta in genere induce un aumento di 3 – 4 volte nel tasso di sequestro di LDH (Vedi ad esempio l'esperimento di LNCaP illustrato nella Figura 2A). Nelle linee cellulari testati (già citata), la percentuale di sfondo di LDH sedimentato ottenuti in campioni da cellule non trattate (punto 1.3.2) è in genere circa 2 – 3%. Da 22 esperimenti indipendenti eseguiti in varie linee cellulari, l'intra-sperimentale coefficiente di variazione (CV) tra i valori LDH sedimentati (% sedimentato LDH) delle ripetizioni di trattamento era 5,8% ± 1,7% (Media % CV ± deviazione standard), che vanno da 3.0 – 9,0%. Insieme, questi numeri danno un'indicazione di cosa aspettarsi quando si esegue il test di sequestro di LDH in cellule di mammifero.
Uso di inibitori chimici come bene come genetica atterramento e knockout si avvicina, ampiamente verifica che il dosaggio di sequestro di LDH in modo affidabile misura l'attività di sequestro autofagici. La formazione dell'autofagosoma richiede attiva PI3K di classe III (PIK3C3) e Unc-51 come autofagia attivazione di chinasi (ULK)24, come pure di equilibrio intracellulare Ca2 + omeostasi16. Come illustrato nella Figura 2A, LDH sia basale che indotta da inedia sequestro è completamente abolito dalla padella-PI3K inibitore 3MA, PIK3C3 selettivo inibitore SAR-40520, o ER Ca2 + pompa inibitore thapsigargin (TG) 25 in cellule di LNCaP. Sequestro di LDH in condizioni di inedia (interruttore per mezzo di soluzione salina bilanciata (EBSS) di amino acidi Earle) è anche fortemente ridotta da TG, o il MRT67307 di ULK-inibitore in cellule HEK293 (Figura 2B). Inoltre, indotta da inedia sequestro di LDH è costantemente inibito da 3MA in MEFs (Figura 2C), BJ (Figura 2D), MCF-7 (Figura 2E) e RPE-1 (Figura 2F) cellule. Generalmente, l'incubazione delle cellule nel mezzo di EBSS da solo (cioè, in assenza di Baf o altri inibitori post-sequestro) non porta a qualsiasi accumulo misurabile di LDH sequestrati (Vedi ad esempio l'esperimento di LNCaP illustrato nella Figura 2 A). questo è probabilmente perché inedia dell'aminoacido acuta conduce-accelerato flusso autofagici lisosomiali, con conseguente rapido e continuo degrado della LDH sequestrati.
Avanti, vari gene ATG MEFs knockout (KO) sono stati impiegati per verificare se il sequestro di LDH richiede autophagy-relative geni segnalati per essere essenziale per la formazione dell'autofagosoma. Infatti, indotta da inedia sequestro di LDH è abolito nel ATG5 KO MEFs26 (Figura 3A), confermando i nostri precedenti risultati9. Inoltre, come illustrato nella Figura 3B e 3 C, indotta da inedia sequestro di LDH è smussato anche ATG7 KO MEFs27 e ATG9A KO MEFs28.
Infine, il dosaggio di sequestro di LDH è stato testato in relazione se RNAi-mediata silenziamento delle trascrizioni del gene chiave ATG sarebbe inibiscono l'attività di sequestro indotta da inedia. Infatti, trasfezione con siRNA ATG9A-targeting o combinato di targeting di ULK1 e ULK2, sequestro di LDH fortemente ridotto in condizioni di inedia in cellule di LNCaP (Figura 3D). Inoltre, abbiamo confermato i nostri precedenti risultati3,9 che il targeting della famiglia delle chinasi focale di adesione l'interazione della proteina di kDa 200 (FIP200) o combinato di targeting del tipo acido γ-aminobutirrico (proteina associata al recettore A (GABAA) I membri della famiglia GABARAP) inibisce la fame-indotta di sequestro di LDH (Figura 3D).

Figura 1 : Nel complesso flusso schema del protocollo sequestro LDH. Il protocollo si basa su un formato di piastra di coltura del tessuto 12-pozzetti, utilizzando i volumi indicati per campione (da un pozzetto). Il protocollo di dosaggio può essere convenientemente diviso in due giorni di lavoro separati, come indicato. Tuttavia, è anche possibile eseguire l'intera procedura in un giorno. Abbreviazioni: ABB, dopo buffer di esplosione (Vedi punto 3.3 nel protocollo per ingredienti); RSB, tampone di risospensione (Vedi punto 3.5 nel protocollo per gli ingredienti). Clicca qui per visualizzare una versione più grande di questa figura.
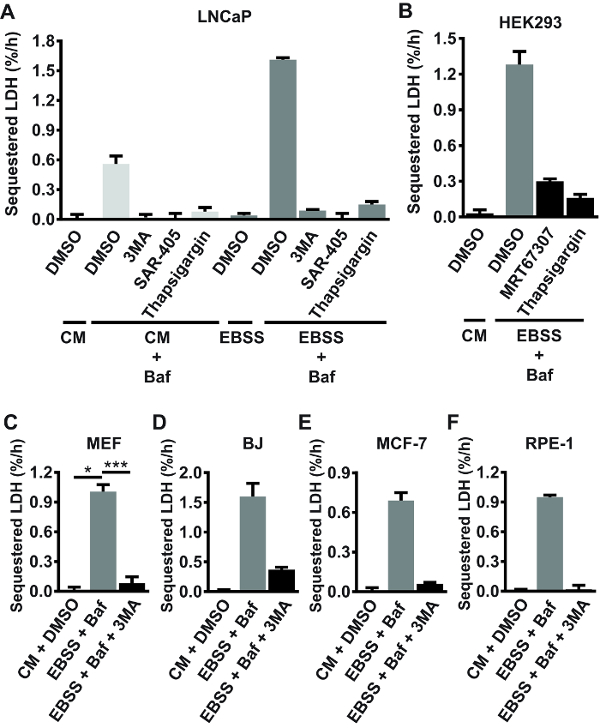
Figura 2 : Convalida del dosaggio LDH sequestro utilizzando composti d'inibizione dell'autofagia. (A) LNCaP, cellule o sono state lasciate non trattati (ai fini della sottrazione di sfondo: vedere il punto 1.3.2) nel mezzo di crescita completa (CM; RPMI 1640 + 10% siero bovino fetale (FBS)), o sono stati trattati con DMSO veicolo (0,1%) o 100 nM Baf in CM o in mezzo libero del siero - e dell'aminoacido (EBSS). Inoltre, alcune delle cellule sono stati trattati con 3MA (10 mM), SAR-405 (10 µM), o Thapsigargin (300 nM), come indicato. Dopo 3 ore di trattamento, le cellule sono state raccolte e sequestro di LDH tassi sono stati determinati come dettagliato nel protocollo corrente. (B) HEK293 cellule sono state trattate con veicolo di DMSO (0,1%) in CM o con 100 nM Baf in EBSS, come indicato. Inoltre, alcune delle cellule ricevuti 10 µM MRT67307 (un inibitore ULK) o 300 nM Thapsigargin. LDH sequestro tassi sono stati determinati dopo 3 ore di trattamento. (C-F) Cellule MEF (C), BJ (D), MCF-7 (E) o RPE-1 (F) sono state trattate con veicolo di DMSO (0,1%) in CM o con Baf (10 nM in C, 100 nM in D-F) in EBSS con o senza 3MA 10mm, come indicato. LDH sequestro tassi sono stati determinati dopo 3 ore di trattamento. A, B, D, E e F Visualizza valori medi da tre replicati biologici (triplice copia pozzi) da un esperimento (n = 1), con barre di errore che rappresenta la deviazione standard. C sono i valori medi da tre esperimenti indipendenti (n = 3), con barre di errore rappresenta l'errore standard della media. p < 0,05, * * *p < 0,001, ripetuto campioni one-way ANOVA.

Figura 3 : Convalida del dosaggio LDH sequestro per KO (A-C) o approcci di atterramento (D). (A-C) Atg5 wild type (WT) o MEFs knockout (KO) (A), ATG7 WT o KO MEFs (B), o ATG9A WT o KO MEFs (C) sono stati trattati con veicolo di DMSO (0,01%) in CM o 10 nM Baf in EBSS, come indicato. LDH sequestro tassi sono stati determinati dopo 3 ore di trattamento. Valori da quattro medi (A; n = 4) o tre (B e C; n = 3) esperimenti indipendenti, con barre di errore rappresenta l'errore standard della media. p < 0,05, ripetuto campioni ANOVA a due vie. N.S., non significativo. (D) LNCaP cellule erano inversione transfected con 5 nM di un siRNA di controllo nontargeting (siCtrl), o con 5 nM ogni di ATG9A-, FIP200-, ULK1-, ULK2-, GABARAP-, GABARAPL1- o GABARAPL2-targeting siRNA oligoes, come indicato. Dopo 48 h, le cellule sono state trattate con veicolo di DMSO (0,1%) in CM o con 100 nM Baf in EBSS, come indicato. LDH sequestro tassi sono stati determinati dopo 3 ore di trattamento. Vengono mostrati i valori medi da tre replicati biologici (triplice copia pozzi) da un esperimento (n = 1), con barre di errore che rappresenta la deviazione standard.
Discussione
In sintesi, il protocollo descritto qui rappresenta un metodo affidabile e ampiamente applicabile per monitorare l'attività di sequestro autofagica alla rinfusa in cellule di mammifero. Rispetto per l'originale metodo12,16, abbiamo rimosso una serie di passaggi inutili, semplificato molti dei passaggi rimanenti e presentare un downscaling sostanziale. Di conseguenza, il protocollo è notevolmente migliorato in relazione alla efficienza di costi e tempo, e la stessa quantità di campioni ora possono essere gestite in meno di metà del tempo rispetto al protocollo originale. Per 24 campioni, i passaggi 2-3 (giorno 1) richiede circa ½ h di preparazione plus 3 h di lavoro efficiente, mentre passo 4 (giorno 2) può essere eseguita in ~ 2 h (tempo stima dato che tutti i buffer necessari sono preparati in anticipo). Poiché il dosaggio il giorno 1 è solitamente preceduta da trattamenti con le cellule, tra cui un 3 – 4 h di incubazione con Baf o altri inibitori della degradazione di LDH autolysosomal, conviene suddividere il dosaggio in due giorni consecutivi. Tuttavia, è anche possibile eseguire il dosaggio intero in uno stesso giorno. In tal caso, si potrebbe risparmiare tempo per snap-congelare i campioni in azoto liquido nel passaggio 3.6 e 3.7. Anche se non testato con il protocollo attuale, è probabile che il passo di gelo-disgelo può essere saltato tutto, poiché più elaborare versione del dosaggio in epatociti primari del ratto è stato fatto senza questo passaggio23.
Il protocollo qui presentato possa essere eseguito con relativa facilità. Da notare, è importante essere precisi nel pipettaggio, poiché l'analisi include diversi passaggi di campionamento e diluizione. Inoltre, le aspirazioni di surnatante dovrebbero essere fatto accuratamente, in modo che minime quantità di ioni sono presenti in sospensione delle cellule di saccarosio al punto 2.5 e che come LDH citosolico piccolo come possibile è contaminando il materiale sedimentato nel passaggio 3.6. Il test come descritto qui è flessibile per una vasta gamma di materiale di partenza. Ad esempio, in cellule di LNCaP, abbiamo con successo usato il dosaggio con una gamma di diverse quantità di cellule al momento del raccolto, si estende fino a una differenza di 10 volte (da 2,5 x 105 celle a 2,5 x 106 cellule). Il minimo bisogno di materiale di partenza è definito da quanto sensibile il rilevamento è metodo di attività enzimatica di LDH. Il protocollo può essere scalato molto probabilmente sostanzialmente più in basso, scalando verso il basso i volumi usati a passi, 2.5, 3.3, 3.5, 3.7, 4.2 e 4.3.
Il fattore più critico e sfida tecnica nell'esecuzione del test è il passo di electrodisruption. Il forte, ma breve, scosse elettriche delle cellule in soluzione isotonica, privo di ioni, si traduce in una rottura uniforme e selettiva della membrana plasmatica, pur lasciando la struttura intracellulare e organelli (compresi i vacuoli autofagici) intatto12, 29. Quando si utilizza cellule aderenti, è essenziale che essi tollerano i trattamenti enzimatici e meccanici nei passaggi 2.1 – 3.1 (distacco cellulare, centrifugazione e risospensione). Per passo 3.1, non è fondamentale per ottenere una sospensione unicellulare perfettamente. Ad esempio, questo è molto difficile da ottenere con cellule di LNCaP. Tuttavia, electrodisruption successo in quasi 100% delle cellule è sempre ottenuto, anche all'interno di ciuffi di cella contenente diverse decine di cellule fisicamente allegate. Quando si verifica un nuovo tipo di cella, si consiglia di verificare l'efficienza dell'electrodisruption (Vedi punto 3.3.1)17. Quasi il 100% delle cellule dovrebbe essere permanentemente tripan blu positivo dopo il electrodisruption passo17. Se questo non è il caso, le impostazioni di electroporator molto probabilmente devono essere modificate. Non usando l'analisi in 20 tipi differenti delle cellule dei mammiferi, abbiamo mai modificare le impostazioni di electroporator. Così, una volta sono state trovate le impostazioni corrette per una linea di cellule di mammifero, è probabile che il lavoro per tutti gli altri tipi di cellule di mammifero. Per verificare che le condizioni di electrodisruption non sono troppo dure, cioè,che solo la membrana plasmatica e non le membrane degli organelli intracellulari sono stati interrotti, attenersi alla seguente passaggio 3.3.2.
L'autofagia bulk viene eseguita da autofagosomi che co-sequestrano quantità notevoli di citosol insieme ad altre merci. Questo può avvenire attraverso l'autofagia puramente non-selettivo di porzioni di citoplasma, o in un modo che rappresenta un mix di autofagia selettivo e non selettivi. A tutt'oggi non è chiaro se o in quale misura l'autofagia selettivo e non selettivi coesistere come due diverse modalità di autofagia, o se autofagosomi come regola contemporaneamente sequestrano il carico in maniere sia selettive e non selettivi. D'importanza, tuttavia, uno studio recente ha segnalato che attivatori dell'autofagia selettiva inducono un aumento simile sequestro citosolico del carico alla rinfusa come il sequestro del carico specifico30. Risultati dal nostro laboratorio sono d'accordo con questo (nostri dati non pubblicati). Analizzando il sequestro delle proteine citosoliche solubili (ad es., LDH) quindi probabilmente ha il potenziale per rilevare alterazioni nell'attività di sequestro di macroautophagic sotto molti, se non tutte le condizioni. Tuttavia, anche se resta ancora da dimostrare, non si può escludere la possibilità che alcuni tipi di condizioni inducono in modo univoco un tipo dell'autofagia selettivo esclusivo dove il carico è così strettamente avvolto dal phagophore quello cytosol anche viene escluso dal essere sequestrate in autofagosoma. Per sondare per se tale condizione può esistere, alla rinfusa autofagia saggi come il dosaggio LDH sequestro devono essere eseguiti in parallelo con dosaggi di autofagia selettiva.
Uno dei principali vantaggi del dosaggio di sequestro di LDH è che misura il sequestro del carico endogeno, rendendo così un metodo ampiamente applicabile. Inoltre, il test misura l'attività di sequestro in un modo altamente quantitativo. Il dosaggio di sequestro di LDH è un importante strumento per studiare i meccanismi e il regolamento di formazione dell'autofagosoma, quanto phagophores non può sequestrare LDH. È molto ingombrante e difficile, se non impossibile, valutare se autofagosoma-come le strutture sono entità sigillate o non da microscopia elettronica. Un altro metodo che viene utilizzato per analizzare se autofagosomi sono chiusi è quello di testare la sensibilità dei marcatori di autofagia (ad es., LC3) o recettori (ad es., sequestosome 1 (p62/SQSTM1) o la proteina nucleare dot 52 (NDP52)) alle proteasi10 ,31,32. Lo svantaggio di questo test è che uno sta studiando protezione proteasi del carrello componenti anziché carico autofagico. Inoltre, poiché il dosaggio è basato su macchiarsi occidentale, è solo semi-quantitativa.
Considerando che la capacità di analizzare l'autofagia di carico endogeno è un vantaggio, un limite intrinseco con il dosaggio di sequestro di LDH e qualsiasi altri test che valutano il sequestro del carico endogeno, è che un inibitore di degradazione deve essere incluso al fine di discernere gli effetti specifici sul sequestro autofagica piuttosto che effetti netti di sequestro e di degradazione. Gli inibitori di efficienti di degradazione di LDH includono inibitori della pompa protonica come agenti Baf o concanamycin un3,16,18e lysosomotropic come clorochina e cloruro di ammonio33. La leupeptina inibitore di proteasi funziona bene in epatociti di ratto primario23, ma è generalmente inefficiente nelle linee cellulari di mammifero che abbiamo testato. Utilizziamo abitualmente Baf13, che agisce rapidamente ed è altamente efficiente nelle cellule sia benigne che maligne. Tuttavia, è importante tenere a mente che nessuno degli inibitori della degradazione di LDH sono completamente specifici, e non si possono escludere effetti presunti degli inibitori l'autofagia. Per ridurre al minimo il rischio di influenza non specifico, si consiglia di utilizzare concentrazioni dell'inibitore che sono solo a livelli di saturazione e di includere l'inibitore solo per le ultime ore (3 – 4 h) dell'esperimento. La concentrazione saturante di Baf dovrebbe essere determinata per ogni tipo di cellula. Come guida, 50 – 100 nM è saturare per la maggior parte delle linee cellulari di mammifero coltivate che abbiamo testato, mentre alcune cellule tipi quali MEFs richiedono solo 10 nM Baf per un blocco completo nella degradazione di LDH.
Un'evidente limitazione con il dosaggio di sequestro di LDH è che essa può essere eseguita solo su cellule viventi, escludendo quindi il suo utilizzo per l'analisi dell'autofagia in cellule fisse e tessuti. D'altra parte, ci sono attualmente nessun saggi stabilito che può misurare l'attività funzionale autofagici in celle fisse. Anche se non testato con il protocollo attuale, dovrebbe essere interamente permette di valutare in vivo attività autofagica sequestro negli organismi sperimentali usando il dosaggio di sequestro di LDH. La limitazione sarebbe che l'organismo deve tollerare il trattamento con un inibitore della degradazione lisosomiale di LDH, e che il periodo di tempo tra tale trattamento e la prestazione del dosaggio dovrebbe essere relativamente breve, per ridurre al minimo i potenziali effetti non specifici di l'inibitore. Interessante, uno studio iniziale di Kominami et al., indicato che il trattamento dei ratti con leupeptina (iniezione intraperitoneale di 2 mg/100 g di peso corporeo) 3 – 6 h è opportuno osservare efficiente accumulo di LDH autophagically sequestrato nel fegato frazioni subcellulari arricchite per i vacuoli autofagici34.
L'espressione ectopica di sequestro fluorescente pH sensibili sonde come Rosella35 o Keima36 può essere utilizzato per visualizzare autofagica sequestro senza la necessità di compresi gli inibitori della degradazione. Inoltre, a differenza del saggio di sequestro di LDH, tali approcci possono essere usati per visualizzare autofagica sequestro in singole cellule. Inoltre, fusione della sonda e sequenze organello-targeting può essere utilizzato per monitorare il sequestro degli organelli specifici. Potenti piattaforme microscopiche potrebbero consentire anche per analisi di screening ad alta resa. Gli svantaggi sono che espressione ectopica sonda, così come accumulazione della sonda nel sistema lisosomiale, può influenzare il pathway autofagico. Inoltre, a differenza del saggio di sequestro di LDH, uno è dipenda sulle cellule che possono essere transfected in modo efficiente. Infine, considerando che il dosaggio di sequestro di LDH fornisce un'uscita diretta quantitativa della percentuale sequestrato cytosol, i metodi basati su immagine generalmente non possono fornire questo tipo di output quantitativa assoluta. Sarebbe consigliabile fare uso di entrambi i tipi di approcci in modo complementare. Un altro ottimo metodo per studiare autofagica sequestro senza bisogno di inibitori di degradazione è quello di introdurre il raffinosio radiomarcato nelle cellule di electro-permeabilizzazione reversibile3,23,37, 38. Il raffinosio è uno zucchero della membrana-impermeant e metabolicamente inerte che è resistente agli enzimi lisosomiali. Di conseguenza, suo sequestro autofagica può essere seguito da separazione di citosolico da sedimentabili cella frazioni3,23,37,38. Questo approccio è, tuttavia, richiede più tempo rispetto il dosaggio di sequestro di LDH e richiede misure di sicurezza aggiuntive dovute all'uso di radioattività. Infine, il risultato finale di massa autofagica sequestro e sgomberata carico autofagico flux, la degradazione delle proteine longeve, può essere accuratamente misurato da una proteina ben consolidata metodo basato sull'etichettatura39,40 ,41,42,43. Tuttavia, a differenza del saggio di sequestro di LDH, questo metodo non fornisce una lettura specifica per attività autofagica, poiché proteine longeve sono degradati anche da altri meccanismi di autofagia, in particolare dal sistema proteasomal (considerando che LDH il sequestro si verifica solo a seguito di autofagia). Di conseguenza, un numero di controllo i trattamenti devono essere regolarmente inclusi, ad esempio, inibitori chimici di autofagia lisosomiale o degradazione proteasomica e genetica interferenza con l'autofagia3,16.
Il dosaggio di sequestro di LDH può essere confrontato con i dosaggi di flusso LC3 comunemente utilizzati, quali misurano i livelli di LC3-II di macchiarsi occidentale o LC3 puncta formazione da formazione immagine di fluorescenza in assenza o in presenza di inibitori di degradazione lisosomiale LC3 (Baf è più usato frequentemente), o la transizione di fluorescente contrassegnati LC3 varianti a ambienti acidi22. Anche se queste analisi LC3-based possono fornire informazioni utili, possono essere difficili da interpretare, in particolare perché la relazione tra il grado di cambiamento continuo LC3 e la quantità e il tipo di cambiamento continuo del carico è sconosciuta. Come accennato nell'introduzione, l'autofagia alla rinfusa e Parkin-dipendente mitophagy non richiedono LC3 proteine della famiglia9,10,11,44. Inoltre, negli epatociti di ratto affamato, sequestro di LDH e degradazione procede senza interruzioni durante i periodi di tempo dove c'è no autofagici lisosomiali LC3 flux9. Così, in questo caso, flusso di carico possa essere completamente separato da LC3 flux. Più ricerca confrontando LC3 flusso con diversi tipi di flusso di carico è necessaria per meglio interpretare i risultati ottenuti con dosaggi di flusso LC3.
Nella sua forma attuale, il dosaggio di sequestro di LDH è paragonabile a macchiarsi occidentale in termini di tempo richiesto hands-on e costi. In termini di misurazione dell'autofagia alla rinfusa, è almeno efficace come il dosaggio basato su raffinosio sequestro o l'analisi di degradazione della proteina longevo descritto sopra. Per misura specifica di massa autofagica sequestro attività e formazione di autofagosomi chiusi, è molto più efficiente e semplice di analisi di flusso LC3 o analisi di protezione di proteasi di recettori LC3 o autofagia, poiché i saggi di quest'ultimi componenti di misura carrello anziché carico effettivo. Anche se abbiamo notevolmente migliorato la velocità effettiva del dosaggio LDH sequestro, è lontano da un'analisi di alto-rendimento, e non può competere con l'efficienza dei saggi basati su immagine sopra descritto. Tuttavia, sia le analisi basate su immagini e il dosaggio di sequestro di LDH hanno i loro vantaggi e svantaggi, e così entrambi i tipi di analisi sono i propri valori. È probabilmente possibile tramite futuri adeguamenti per rendere il LDH sequestro dosaggio semi ad alta velocità. Ad esempio, dovrebbe essere possibile eseguire electrodisruption in un formato a 96 pozzetti, ed è immaginabile che citosolico LDH potrebbe essere separato da LDH sequestrati mediante filtrazione invece di centrifugazione, o che il passo di centrifugazione può essere eseguito in un 96- ben formato. Inoltre, le analisi per misurare l'attività LDH che sono molto più sensibili rispetto a quella utilizzata nel protocollo attuale sono state sviluppate e sono disponibili in commercio. Altri interessanti potenzialità future del dosaggio sono suo presunto uso in altri tipi cellulari di cellule di mammifero, ad esempio in lievito o altri organismi unicellulari, o persino pianta cellule, così come l'uso per la misura in vivo di autophagic attività di sequestro nei tessuti degli organismi sperimentali.
In conclusione, crediamo che il dosaggio LDH sequestro nella sua forma migliore e rilanciata sarà uno strumento importante nella ricerca futura autophagy-relative.
Divulgazioni
Gli autori non hanno alcun conflitto di interessi.
Riconoscimenti
Questo lavoro è stato sostenuto finanziariamente dal Consiglio norvegese della ricerca, dell'Università di Oslo, il Anders Jahre Foundation, la Fondazione di Nansen e l'eredità nella memoria di Henrik Homan. Ringraziamo il dottor Noboru Mizushima per il ATG5 + / + MEFs e ATG5-/-MEFs, Dr. Masaaki Komatsu per il ATG7 + / + MEFs e ATG7-/-MEFs e Dr. Shizuo Akira per il ATG9A + + MEFs e ATG9A-/-MEFs. Ringraziamo Frank Sætre per assistenza tecnica e Dr. Per O. Seglen per discussioni costruttive metodologiche.
Materiali
| Name | Company | Catalog Number | Comments |
| 1.5 mL and 2 mL microcentrifuge tubes | Eppendorf | 211-2130 and 211-2120 | |
| 12-well plates | Falcon | 353043 | |
| Accumax cell detachment solution | Innovative Cell Technologies | A7089 | Keep aliquots at -20 °C for years, and in fridge for a few months |
| Bafilomycin A1 | Enzo | BML-CM110-0100 | Dissolve in DMSO |
| BJ cells | ATCC | CRL-2522 | use at passage <30 |
| Bovine serum albumin (BSA) | VWR | 422361V | |
| Burker counting chamber | Fisher Scientific | 139-658585 | |
| Countess Cell Counting Chamber Slides | ThermoFisher Scientfic | C10228 | |
| Countess II Automated Cell Counter | ThermoFisher Scientfic | AMQAX1000 | |
| Cover glass for the Burker counting chamber | Fisher Scientific | 139-658586 | |
| Criterion Tris-HCl Gel, 4–20%, 26-well, 15 µL, 13.3 cm x 8.7 cm (W x L) | Bio-Rad | 3450034 | |
| DTT | Sigma-Aldrich | D0632 | |
| Earle's balanced salt solution (EBSS) | Gibco | 24010-043 | conatains 0.1% glucose |
| EDTA | Sigma-Aldrich | E7889 | |
| Electroporation cuvette (4 mm) | Bio-Rad | 1652088 | |
| Exponential decay wave electroporator | BTX Harvard Apparatus | EMC 630 | |
| Fetal bovine serum (FBS) | Sigma | F7524 | 10% final concentration in RPMI 1640 medium |
| HEK293 cells | ATCC | CRL-1573 | |
| Imidazole | Sigma-Aldrich | 56750 | Autoclave a 65 mM solution and keep in fridge for months |
| Incubator; Autoflow IR Direct Heat CO2 incubator | NuAire | NU-5510E | |
| Lipofectamine RNAiMAX Transfection Reagent | ThermoFisher | 13778150 | |
| LNCaP cells | ATCC | CRL-1740 | use at passage <30 |
| 3-Methyl Adenine (3MA) | Sigma-Aldrich | M9281 | Stock 100 mM in RPMI in -20 °C. Heat stock to 65 °C for 10 min, and use at 10 mM final concentration |
| Refridgerated Microcentrifuge | Beckman Coulter Life Sciences | 368831 | |
| Refridgerated Microcentrifuge with soft-mode function | Eppendorf | Eppendorf 5417R | |
| MRT67307 hydrochloride (ULKi) | Sigma-Aldrich | SML0702 | Inhibits ULK kinase activity. Dissolve in DMSO. |
| MaxMat Multianalyzer instrument | Erba Diagnostics | PL-II | |
| MCF7 cells | ATCC | HTB-22 | |
| NADH | Merck-Millipore | 1.24644.001 | |
| Nycodenz | Axis-Shield | 1002424 | |
| Opti-MEM Reduced Serum Medium | ThermoFisher | 31985062 | |
| Phosphate-buffered saline (PBS) | Gibco | 20012-019 | |
| Pipette tips 3 (0.5-20 µL) | VWR | 732-2223 | Thermo Fischer ART Barrier tips |
| Pipette tips (1-200 µL) | VWR | 732-2207 | Thermo Fischer ART Barrier tips |
| Pipette tips (100-1,000 µL) | VWR | 732-2355 | Thermo Fischer ART Barrier tips |
| Pipettes | ThermoFisher | 4701070 | Finnpipette F2 GLP Kit |
| Poly-D-lysine | Sigma-Aldrich | P6407-10X5MG | Make a 1 mg/mL stock solution in sterile H2O. This solution is stable at -20 °C for at least 1 year. |
| Pyruvate | Merck-Millipore | 1066190050 | |
| RPE-1 cells (hTERT RPE-1) | ATCC | CRL-4000 | |
| RPMI 1640 | Gibco | 21875-037 | |
| SAR-405 | ApexBio | A8883 | Inhibits phosphoinositide 3-kinase class III (PIK3C3). Dissolve in DMSO. |
| Silencer Select Negative Control #1 (siCtrl) | ThermoFisher/Ambion | 4390843 | |
| Silencer Select ATG9-targeting siRNA (siATG9A) | ThermoFisher/Ambion | s35504 | |
| Silencer Select FIP200-targeting siRNA (siFIP200) | ThermoFisher/Ambion | s18995 | |
| Silencer Select ULK1-targeting siRNA (siULK1) | ThermoFisher/Ambion | s15964 | |
| Silencer Select ULK2-targeting siRNA (siULK2) | ThermoFisher/Ambion | s18705 | |
| Silencer Select GABARAP-targeting siRNA (siGABARAP) | ThermoFisher/Ambion | s22362 | |
| Silencer Select GABARAPL1-targeting siRNA (siGABARAPL1) | ThermoFisher/Ambion | s24333 | |
| Silencer Select GABARAPL2-targeting siRNA (siGABARAPL2) | ThermoFisher/Ambion | s22387 | |
| Sodium phosphate monobasic dihydrate (NaH2PO4 • 2H2O) | Merck-Millipore | 1.06580.1000 | |
| Sodium phosphate dibasic dihydrate (Na2HPO4 • 2H2O ) | Prolabo | 28014.291 | |
| Sucrose | VWR | 443816T | 10% final concentration in water; filter through 0.45 µm filter and keep in fridge for months |
| Thapsigargin | Sigma-Aldrich | T9033 | Inhibits the SERCA ER Ca2+ pump. Dissolve in DMSO. |
| Triton X-405 | Sigma-Aldrich | X405 | 1% final |
| Trypan Blue stain 0.4% | Molecular Probes | T10282 | |
| Trypsin-EDTA (0.25% w/v Trypsin) | Gibco | 25200-056 | |
| Tween-20 | Sigma-Aldrich | P2287 | 0.01% final |
Riferimenti
- Rubinsztein, D. C., Frake, R. A. Yoshinori Ohsumi's Nobel Prize for mechanisms of autophagy: from basic yeast biology to therapeutic potential. J R Coll Physicians Edinb. 46 (4), 228-233 (2016).
- Mizushima, N. The exponential growth of autophagy-related research: from the humble yeast to the Nobel Prize. FEBS Lett. 591 (5), 681-689 (2017).
- Seglen, P. O., et al. Macroautophagic cargo sequestration assays. Methods. 75, 25-36 (2015).
- Hoyvik, H., Gordon, P. B., Seglen, P. O. Use of a hydrolysable probe, [14C]lactose, to distinguish between pre-lysosomal and lysosomal steps in the autophagic pathway. Exp Cell Res. 166 (1), 1-14 (1986).
- Plomp, P. J., Gordon, P. B., Meijer, A. J., Hoyvik, H., Seglen, P. O. Energy dependence of different steps in the autophagic-lysosomal pathway. J Biol Chem. 264 (12), 6699-6704 (1989).
- Gordon, P. B., Seglen, P. O. Prelysosomal convergence of autophagic and endocytic pathways. Biochem Biophys Res Commun. 151 (1), 40-47 (1988).
- Holen, I., Gordon, P. B., Seglen, P. O. Protein kinase-dependent effects of okadaic acid on hepatocytic autophagy and cytoskeletal integrity. Biochem J. 284, 633-636 (1992).
- Kabeya, Y., et al. LC3, a mammalian homologue of yeast Apg8p, is localized in autophagosome membranes after processing. Embo j. 19 (21), 5720-5728 (2000).
- Szalai, P., et al. Autophagic bulk sequestration of cytosolic cargo is independent of LC3, but requires GABARAPs. Exp Cell Res. 333 (1), 21-38 (2015).
- Nguyen, T. N., et al. Atg8 family LC3/GABARAP proteins are crucial for autophagosome-lysosome fusion but not autophagosome formation during PINK1/Parkin mitophagy and starvation. J Cell Biol. , (2016).
- Pontano Vaites, L., Paulo, J. A., Huttlin, E. L., Harper, J. W. Systematic analysis of human cells lacking ATG8 proteins uncovers roles for GABARAPs and the CCZ1/MON1 regulator C18orf8/RMC1 in macro and selective autophagic flux. Mol Cell Biol. , (2017).
- Kopitz, J., Kisen, G. O., Gordon, P. B., Bohley, P., Seglen, P. O. Nonselective autophagy of cytosolic enzymes by isolated rat hepatocytes. J Cell Biol. 111 (3), 941-953 (1990).
- Bowman, E. J., Siebers, A., Altendorf, K. Bafilomycins: a class of inhibitors of membrane ATPases from microorganisms, animal cells, and plant cells. Proc Natl Acad Sci U S A. 85 (21), 7972-7976 (1988).
- Hadjivassiliou, A. G., Rieder, S. V. The enzymatic assay of pyruvic and lactic acids. A definitive procedure. Clin Chim Acta. 19 (3), 357-361 (1968).
- Bergmeyer, H. U., Bernt, E., Bergmeyer, H. U. . Methods of enzymatic analysis (2nd English ed). 2, 574-579 (1974).
- Engedal, N., et al. Modulation of intracellular calcium homeostasis blocks autophagosome formation. Autophagy. 9 (10), 1475-1490 (2013).
- Luhr, M., et al. A Simple Cargo Sequestration Assay for Quantitative Measurement of Nonselective Autophagy in Cultured Cells. Methods Enzymol. 587, 351-364 (2017).
- Mousavi, S. A., et al. Effects of inhibitors of the vacuolar proton pump on hepatic heterophagy and autophagy. Biochim Biophys Acta. 1510 (1-2), 243-257 (2001).
- Seglen, P. O., Gordon, P. B. 3-Methyladenine: specific inhibitor of autophagic/lysosomal protein degradation in isolated rat hepatocytes. Proc Natl Acad Sci U S A. 79 (6), 1889-1892 (1982).
- Ronan, B., et al. A highly potent and selective Vps34 inhibitor alters vesicle trafficking and autophagy. Nat Chem Biol. 10 (12), 1013-1019 (2014).
- Saetre, F., Hagen, L. K., Engedal, N., Seglen, P. O. Novel steps in the autophagic-lysosomal pathway. Febs j. 282 (11), 2202-2214 (2015).
- Klionsky, D. J., et al. Guidelines for the use and interpretation of assays for monitoring autophagy (3rd edition). Autophagy. 12 (1), 1-222 (2016).
- Seglen, P. O., Overbye, A., Saetre, F. Sequestration assays for mammalian autophagy. Methods Enzymol. 452, 63-83 (2009).
- Hurley, J. H., Young, L. N. Mechanisms of Autophagy Initiation. Annu Rev Biochem. 86, 225-244 (2017).
- Thastrup, O., Cullen, P. J., Drobak, B. K., Hanley, M. R., Dawson, A. P. Thapsigargin, a tumor promoter, discharges intracellular Ca2+ stores by specific inhibition of the endoplasmic reticulum Ca2(+)-ATPase. Proc Natl Acad Sci U S A. 87 (7), 2466-2470 (1990).
- Kuma, A., et al. The role of autophagy during the early neonatal starvation period. Nature. 432 (7020), 1032-1036 (2004).
- Komatsu, M., et al. Impairment of starvation-induced and constitutive autophagy in Atg7-deficient mice. J Cell Biol. 169 (3), 425-434 (2005).
- Saitoh, T., et al. Atg9a controls dsDNA-driven dynamic translocation of STING and the innate immune response. Proc Natl Acad Sci U S A. 106 (49), 20842-20846 (2009).
- Gordon, P. B., Seglen, P. O. Autophagic sequestration of [14C]sucrose, introduced into rat hepatocytes by reversible electro-permeabilization. Exp Cell Res. 142 (1), 1-14 (1982).
- An, H., Harper, J. W. Systematic analysis of ribophagy in human cells reveals bystander flux during selective autophagy. Nat Cell Biol. 20 (2), 135-143 (2018).
- Fass, E., Shvets, E., Degani, I., Hirschberg, K., Elazar, Z. Microtubules support production of starvation-induced autophagosomes but not their targeting and fusion with lysosomes. J Biol Chem. 281 (47), 36303-36316 (2006).
- Velikkakath, A. K., Nishimura, T., Oita, E., Ishihara, N., Mizushima, N. Mammalian Atg2 proteins are essential for autophagosome formation and important for regulation of size and distribution of lipid droplets. Mol Biol Cell. 23 (5), 896-909 (2012).
- Øverbye, A., Sætre, F., Hagen, L. K., Johansen, H. T., Seglen, P. O. Autophagic activity measured in whole rat hepatocytes as the accumulation of a novel BHMT fragment (p10), generated in amphisomes by the asparaginyl proteinase, legumain. Autophagy. 7 (9), 1011-1027 (2011).
- Kominami, E., Hashida, S., Khairallah, E. A., Katunuma, N. Sequestration of cytoplasmic enzymes in an autophagic vacuole-lysosomal system induced by injection of leupeptin. J Biol Chem. 258 (10), 6093-6100 (1983).
- Rosado, C. J., Mijaljica, D., Hatzinisiriou, I., Prescott, M., Devenish, R. J. Rosella: a fluorescent pH-biosensor for reporting vacuolar turnover of cytosol and organelles in yeast. Autophagy. 4 (2), 205-213 (2008).
- Katayama, H., Kogure, T., Mizushima, N., Yoshimori, T., Miyawaki, A. A sensitive and quantitative technique for detecting autophagic events based on lysosomal delivery. Chem Biol. 18 (8), 1042-1052 (2011).
- Ogier-Denis, E., et al. A heterotrimeric Gi3-protein controls autophagic sequestration in the human colon cancer cell line HT-29. J Biol Chem. 270 (1), 13-16 (1995).
- Seglen, P. O., Gordon, P. B., Tolleshaug, H., Hoyvik, H. Use of [3H]raffinose as a specific probe of autophagic sequestration. Exp Cell Res. 162 (1), 273-277 (1986).
- Luhr, M., Sætre, F., Engedal, N. The Long-lived Protein Degradation Assay: an Efficient Method for Quantitative Determination of the Autophagic Flux of Endogenous Proteins in Adherent Cell Lines. Bio-protocol. 8 (9), e2836 (2018).
- Ronning, O. W., Pettersen, E. O., Seglen, P. O. Protein synthesis and protein degradation through the cell cycle of human NHIK 3025 cells in vitro. Exp Cell Res. 123 (1), 63-72 (1979).
- Seglen, P. O., Grinde, B., Solheim, A. E. Inhibition of the lysosomal pathway of protein degradation in isolated rat hepatocytes by ammonia, methylamine, chloroquine and leupeptin. Eur J Biochem. 95 (2), 215-225 (1979).
- Seglen, P. O., Solheim, A. E. Valine uptake and incorporation into protein in isolated rat hepatocytes. Nature of the precursor pool for protein synthesis. Eur J Biochem. 85 (1), 15-25 (1978).
- Bauvy, C., Meijer, A. J., Codogno, P. Assaying of autophagic protein degradation. Methods Enzymol. 452, 47-61 (2009).
- Engedal, N., Seglen, P. O. Autophagy of cytoplasmic bulk cargo does not require LC3. Autophagy. 12 (2), 1-3 (2016).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon