Method Article
Фокуса Macropatch записи синаптических токов от дрозофилы личиночной нервно-Джанкшен
В этой статье
Резюме
Синаптических токи могут быть записаны централизовано от визуализированных синаптической boutons на перекрестке дрозофилы третьего instar личинки нервно. Этот метод позволяет осуществлять мониторинг деятельности единого синаптических бутона.
Аннотация
Дрозофилы нервно-Джанкшен (NMJ) это отличная модель система изучение глутаматергические синаптической передачи. Мы опишем технику записи фокуса macropatch синаптических токов от визуализированных boutons в личиночной NMJ дрозофилы . Этот метод требует индивидуальные изготовления записи micropipettes, а также составной микроскоп с высоким увеличением, междугородной воды погружение цель, дифференциальной помехи контраст (DIC) Оптика и люминесцентные вложение. Запись электрод располагается на вершине выбранного синаптических бутона, визуализируется с DIC Оптика, epi флуоресценции или оба. Преимущество этого метода является то, что позволяет мониторинг синаптической активности ограниченное количество сайтов релиза. Запись электрод имеет диаметр несколько микрон, и выпуска сайты размещены за пределами края электродов существенно не влияет на записанные течений. Записанные синаптических течения имеют быструю кинетику и может быть легко решена. Эти преимущества особенно важны для исследования мутант летать линии с расширенной спонтанное или асинхронные синаптической активности.
Введение
Дрозофилы является система отличная модель для изучения молекулярных механизмов, контролирующих синаптической передачи. Нервно-мышечной системы у дрозофилы является глутаматергические и поэтому нервно перекрестка дрозофилы (NMJ) может использоваться для изучения функции сохранены глутаматергические выпуска. С тех пор Ян и Ян исследование1третьего возраста личинок широко используется для изучения вызвала и спонтанное синаптической передачи путем мониторинга возбуждающим Джанкшен потенциалов (EJPs) или токов (ОЕК). EJPs обычно записываются внутриклеточно резкое стекло микро-электродом, и они отражают деятельность всей NMJ, включая все boutons, делая синапсов в данной мышечные волокна.
В отличие от деятельности ограниченного числа мест выпуска может быть записан централизовано, поместив кончик микропипеткой вблизи нейрональных терминалы или синаптических варикоз. Этот метод был первоначально нанят Кац и Миледи2, и фокуса внеклеточного записи успешно применялись на несколько NMJ препараты, включая лягушка3,4,5, мыши6 , 7 , 8, ракообразное9,10,11,12,13,14,,1516и Дрозофила17,18,19,20,21,22,23. Далее этот подход был разработан Dudel, который оптимизирован перекодирование электроды24,25macropatch. В Dudel в осуществлении эта техника тесно совпадают потерять патч зажим метод26.
Дрозофилы личиночной NMJ четко определены синаптической boutons и трансгенных линий с генетически закодированный нейрональных флуоресцентные метки (см. Таблицу материалы) легко доступны. Эти преимущества позволили нам записать ОЕК и mEJCs от выбранной синаптических бутона20,21,22. Здесь мы опишем эту технику в деталях.
протокол
1. изготовление запись электродов
- , потянув Электроды стеклянные
- используйте следующий протокол для съемник микроэлектродные (см. Таблицу материалы):
- линия 1: тепла 510 тянуть - скорость 30 время 250; Строка 2: Тепло 490 Pull - скорость 30 время 250.
Примечание: Единицы времени соответствуют 0,5 мс на единицу; другие единицы являются относительными. Значение тепла следует скорректировать для каждой нити после того, как проводится испытание рамп.
- линия 1: тепла 510 тянуть - скорость 30 время 250; Строка 2: Тепло 490 Pull - скорость 30 время 250.
- Использовать микроскоп (35 x увеличение), чтобы гарантировать, что внутренний диаметр электрода, вытащил находится в диапазоне от 7-10 мкм ( Рисунок 1A). Хранить в хорошо запечатанных контейнерах для предотвращения скопления пыли капилляров.
- используйте следующий протокол для съемник микроэлектродные (см. Таблицу материалы):
- Огонь полировка
- огонь польский капилляров (80-90% от стоимости максимум тепла для 1-2 секунд) с помощью микро Кузница (см. Таблицу материалы). Обеспечивает окончательное внутренний диаметр электрода, полированный 5 мкм ( рис. 1A) 27.
- Изгиб
Примечание: два изгибы производятся для того, чтобы положение электрода на вершине мышцы под большим увеличением цели.- Использования аппарата, показано на рисунке 1B. Исправьте электрода в манипулятор и поместите кончик нити накаливания, не касаясь его
- Набор тепла значение 60-70% от максимального и нажмите педаль микро Кузница для 1-2 s (см. Таблицу материалы) для обогрева нити накала. Используйте осторожно опустите кончик электрода ( рис. 1B расширен) L-образный иглы. Сделать изгиб в приблизительно 90 o ( рис. 1 c).
- Держите электрод над пламенем горелки вручную с использованием щипцов и сделать второй сгиба на расстоянии 7-10 мм от первого изгиба и под углом примерно 120 o ( рис. 1 c).

на рисунке 1. Заключительные шаги изготовления микропипеткой. (A) электрода советы после потянув и полировки огонь. (В.1) установки для гибки подсказка. (В.2) в штучной упаковке области показан расширенный справа. Так что электрода расположены чуть выше провод и не касаясь фиксируются электрода и нити накала. (С.1) записи электрода. (С.2) в штучной упаковке области показан расширенный справа. Первый излучине имеет угол примерно 90°, и расстояние между первым коленом и наконечник электрода около 1 мм. Шкала бар = 3 mm. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
2. дополнительные подготовительные шаги
- heamolymph как подготовить (HL3) раствор (в мм): 70 NaCl, 5 KCl, 20 MgCl 2, 10 NaHCO 3, 5 Трегалоза, 115 сахарозы, 5 HEPES и 1 мм CaCl 2; скорректировать рН 7.3 - 7.4. Держите раствор в холодильнике и сделать его свежие каждую неделю.
- Сделать стимуляции пипец же путь, как запись стеклянные пипетки, за исключением того, не нужно согнуть их.
Примечание: Подготовка электродов стимуляции подробно описан в 28 и 27. Окончательный диаметр после полировки огонь должен быть в диапазоне от 5-7 мкм. - Вставка стимуляции пипетки в микроэлектродные держатель подключен к шприц.
- Производство рассечение пластины от малых чашек Петри (35 x 10 мм) покрыты эпоксидной резины силикон (см. Таблицу материалы), как описано в 28.
Примечание: Силиконовая резина должна быть полностью закаленные перед использованием. - Выбрать блуждающих третьего возраста личинок и вскрыть его, как описано в 27 , 28 , 29 , 30.
Примечание: Для визуализации boutons, используйте летать штамм CD8-GFP (см. Таблицу материалы)- с помощью щипцов (см. Таблицу материалы), выбрать 3 rd instar личинок из флакона.
- Pin личинки, поместив первый контакт задней и другой контактный передней (близко к рот крючки).
- Раствор добавить HL3.
- Сделать разрез с помощью ножниц Весна (см. Таблицу материалы) весь путь от верхней PIN-код на дно, один на спинной стороне личинок.
- Pin личинки филе, размещение 2 дополнительных контактов на левой и правой сторон личинок.
- Удаление кишки и трахеи, используя пинцет.
- Вырезать нервы просто вне шнур воспалении брюшины, используя ножницы весной.
3. Электрические записи ОЕК

Рисунок 2. Настройка записи. Образце NMJ возлагали на кремний, покрытой Петри (стрелка) располагается над передвижные подмости вертикальный составной микроскоп с эпифлуоресцентного возможности, высокого увеличения цель и два микроманипуляторов. Микроскоп дислоцируется на таблицу вибрации. пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
- Запись
- место Петри с подготовкой на микроскопа ( рис. 2). Вставить ссылку электрода в ванну.
- Заполнить записи электрод с HL3 решения. В рамках цели 10 x (см. Таблицу материалы), погружать электрода в ванну и поместите его над мышцы 6 и 7 брюшной сегментов, 2, 3 или 4, используя микроманипулятор () (см. Таблицу материалы) Рисунок 3 А.1 и а.2).
- Цель переключиться в 60 x (см. Таблицу материалы). Сосредоточить внимание на области интересов, с помощью epi флуоресценции или DIC оптика. Место кончике электрода на верхней части синаптического бутона (в.1-3 рис. 3).
- Нажмите электрода очень мягко на мышцы. Излишнее давление может повредить NMJ или вызвать увеличение спонтанное синаптической активности. Убедитесь, что наконечник электрода не забиты - если это так, заменить it.
- Переключение усилителя, Совет A/D и на компьютере.
- Выбрать режим зажим напряжения на усилителе.
- Начать приобретение программного обеспечения и выберите ' бесплатно разрыв ' режим.
- Наблюдать появление на экране компьютера mEJCs.
- Убедитесь, что амплитуда mEJCs находится в диапазоне 0,2 - 0,7 nA.
Примечание: Меньше ОЕК указывают что запись электрод имеет дефекты или что он установлен правильно.
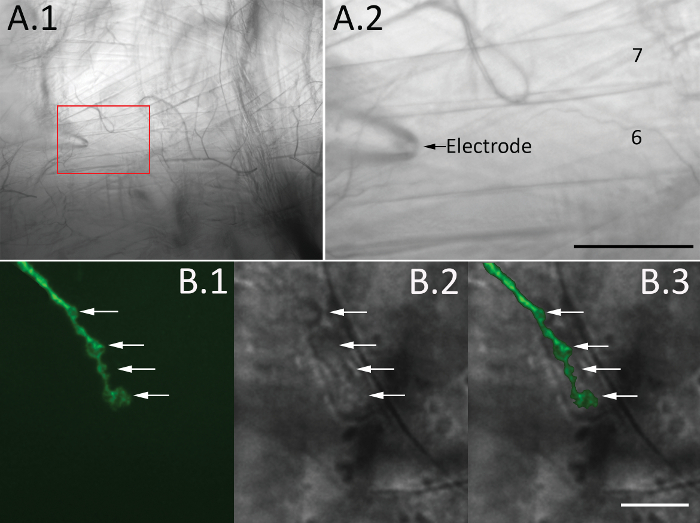
на рисунке 3. Визуализация синаптической boutons. (A) A brightfield изображение hemi-сегмента до 10 x увеличение (A.1) и увеличенной в штучной упаковке области показаны мышцы 6 и 7 (A.2, стрелку марки электрода записи). Шкалы бар = 50 µm. (B) синаптической boutons визуализируются в дрозофилы линию с маркером генетически закодированный нейронов (CD8-GFP) с помощью изображений epi флуоресценция (в.1) или DIC оптика (в.2). Изображения взяты с 60 x цель и фильтр куб для GFP изображений (см. Таблицу материалы). Synaptic boutons, отмеченные стрелками, и наложение люминесцентных и DIC изображений отображается в B.3. Шкалы бар = 10 мкм. пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
- стимуляции
- с помощью микроманипулятор, под визуальный контроль, место электрод стимуляции вблизи аксона, иннервирующих абдоминальные сегменты 2-4.
- Применить отрицательное давление, потянув поршень шприца подключен к держатель электрода, так что аксон вытягивано внутри электрода ( рис. 2).
- Включение стимулятора. Поверните ручку на единицу изоляции (см. Таблицу материалы), чтобы задать нулевой ток, а затем осторожно увеличить его, пока не появятся ОЕК (или пока не будет достигнут порог).
- Выполнять стимуляции в suprathreshold режиме, с текущей стимуляции увеличилось приблизительно дважды, по сравнению с порога для наблюдения ОЕК.
Примечание: В наш опыт, такой интенсивности стимуляции является оптимальным, чтобы избежать сбоев действий потенциал и потенциал действия стрельбы. Например, если ОЕК появляются в стимуляции тока 0,2 мА, используйте тока 0,4 мА на протяжении всего эксперимента.
- Уплотнение сопротивления
- измерить сопротивление Печать записи macropatch электрода, повернув переключатель сопротивление электродов усилителя для " печать тест " позиции. Наблюдать, что будет отображаться значение сопротивления печать в GΩ в " текущий " окно.
- Убедитесь, что уплотнение сопротивления в диапазоне 0,5 - 2 М Ω. Значения вне этого диапазона указывают что электрод должным образом не полированный или позиционируется неправильно.
- Контролировать печать сопротивления во время записи, убедившись, что он остается постоянным на протяжении всего эксперимента.
4. Анализ
- Анализ записей используя подгонять программного обеспечения для анализа (см. Таблицу материалы).
Примечание: Наша лаборатория использует внутренний программное обеспечение Quantan 31, который настраивается для обнаружения ОЕК и mEJCs Записанная централизовано ( рис. 4). Это программное обеспечение включает в себя цифровой фильтр Гаусса и позволяет обнаружить квантовый пиков в перекрывающихся мульти квантовый события ( рис. 4A). Другие подходы описаны в 17.

Рисунок 4. Квантильного анализ. Обнаружения mEJCs (A) и ОЕК (B) Quantan программного обеспечения. Области событий помечен зеленым цветом, и пики помечены красной стрелки. пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
Результаты
Фокуса macropatch записи включить мониторинга синаптической активности от выбранных синаптической boutons (рис. 5). Когда электрод располагается на вершине синаптических бутона (Рисунок 5A, сайт 1), записанных mEJCs (рис. 5 c, сайт 1) имеют амплитуд, значительно превышающий уровень шума и резким ростом фаз (в диапазоне суб миллисекунды). Когда запись электрод перемещается от синаптических бутона несколько микрон (Рисунок 5A, сайт 2), амплитуд записанных mEJCs снижение почти до уровня шума (Рисунок 5B, сайт 2). Записанные ОЕК едва можно отличить от шума и они продлили ростом фаз (рис. 5 c, сайт 2 против сайта 1).
Ограниченное количество сайтов выпуска, способствуя записанные ОЕК и mEJCs, а также быстрое кинетики синаптических токов записал централизовано, позволяет точное обнаружение событий выхода в мутантов с повышенными синаптической активности. Это может быть ясно проиллюстрирована записи mEJCs от complexin null мутант (рис. 6A). Спонтанная активность резко поднимается в этот мутант32, и поэтому mEJPs, записанная внутриклеточно перекрываются и не может быть четко отличать друг от друга (Рисунок 6B), а точного фокуса записи22 Обнаружение событий Самопроизвольный отпуск (рис. 4A).

Рисунок 5. Записи ОЕК и mEJCs от выбранного бутона. (A) размещения электрода над выбранной бутона (сайт 1) и отход от бутона (узел 2). Изображения показывают тегами NMJ визуализированы с epi флуоресценции (A.1), запись электрода над мышечных волокон (A.2), CD8-GFP и накладки (а.3, а.4), с электродом наведении сайта 1 (а.3) или сайт 2 ( A.4). шкалы бар = 10 мкм. (B) mEJCs, записанных с бутона (сайт 1) четко отграничены от шума записи и быстрого роста фаз. В отличие от mEJCs, записанная с сайта 2 нельзя надежно отличить от шума записи, их амплитуды уменьшаются в несколько раз, и они имеют медленнее время курс. (C) амплитуды в из ОЕК Записанная от бутона (сайт 1) превышают амплитуд ОЕК, записанный с сайта 2 во много раз, и они также имеют более быстрое кинетики. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
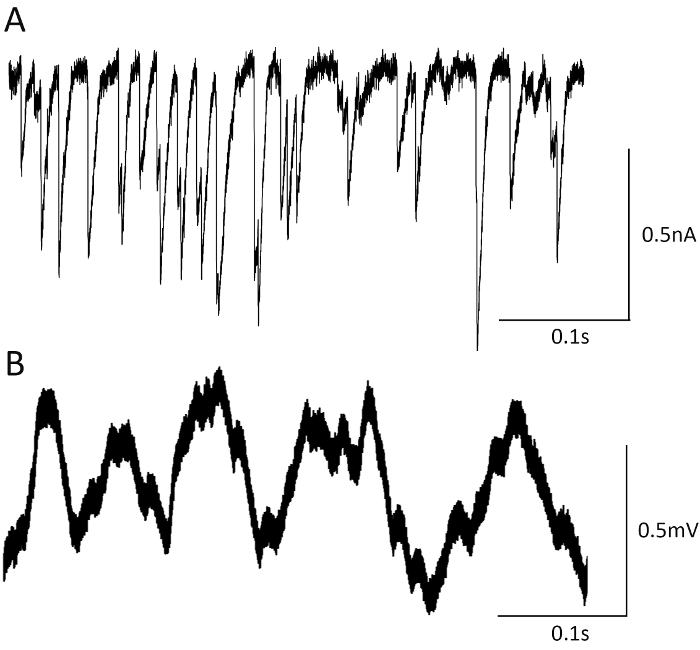
Рисунок 6. Фокуса macropatch против внутриклеточных записей. Фокуса записи позволяют точное обнаружение mEJCs в complexin null мутант (A), в то время как внутриклеточных записи (B) от мутантов выставке освободить события, которые перекрываются и не может быть обнаружен надежно. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
Обсуждение
Дрозофилы представляет организма выгодные модели для изучения синаптической передачи. В личиночной NMJ, в том числе внутриклеточный записи синаптических потенциалов, записи синаптических токов с двумя электродами напряжение зажим33,34и фокуса macropatch были использованы несколько запись конфигурации записи синаптических токов, описанных здесь. Последний метод позволяет точную количественную оценку синаптической передачи в визуализированных boutons.
Успех описанных протокола критически зависит от способности четко визуализировать области интересов и настройки подготовки записи электродов. Таким образом качество оптики DIC, цель погружения воды высокое увеличение с рабочим расстоянием и нестандартного оборудования для тушения полировки и гибки записи электроды являются критически важными.
Преимуществом этого подхода является то, что позволяет мониторинг активности несколько синапсы, которые расположены под электродом записи. Следует отметить, однако, boutons, расположены вблизи обода электрода может также способствовать записанные деятельность. Таким образом, очень важно, что положение электрода, а также печать сопротивления, не изменяется в ходе эксперимента.
Возможность контролировать деятельность одного бутона потенциально может сочетаться с последних технологий визуализации. Например оптического обнаружения деятельности отдельных активных зон35 могут быть объединены с фокуса записи ОЕК и mEJC, и это может пара пространственное разрешение оптического обнаружения с временным разрешением электрических записей.
Раскрытие информации
Авторы не имеют ничего сообщать.
Благодарности
Поддержке гранта NIH R01 MH 099557
Материалы
| Name | Company | Catalog Number | Comments |
| Sutter P-97 | Sutter instrument | P-97 | Microelectrode puller |
| Narishige MF-830 | Narishige | MF-830 | Microforge |
| WPI MF200 | WPI | MF200 | Microforge |
| Glass capilaries | WPI | B150-86-10 | Glass capilaries |
| Microtorch 1WG61 | Grainer | 1WG61 | Microtorch |
| Sylgard 184 Silicone Elastomer Kit | Dow Corning | SYLGARD 184 | Silicone for dissection plates preparation |
| Dissection pins | Amazon | B00J5PMPJA | Pins for larvae positioning |
| Tweezers | WPIINC | 500342 | Tweezers for placing pins, removing the guts and tracheas. |
| Scissors | WPIINC | 501778 | Scissors for cutting the cuticula of the larvae and nerves. |
| Olympus BX61WI | Olympus | BX61WI | Upright microscope |
| Olympus Lumplan FL N 60x | Olympus | UPLFLN 60X | Microscope objective 60X |
| Olympus UPlan FL N 10x | Olympus | Uplanfl N 10X | Microscope objective 10X |
| Narishige Micromanipulator | Narishige | MHW-3 | Three-axis Water Hydraulic Micromanipulator |
| npi Electronic GmbH ELC-03XS | npi Electronic GmbH | ELC-03XS | Electrophysiological amplifier |
| A.M.P.I Master 8 | A.M.P.I. | Master 8 | Electrical stimulator |
| A.M.P.I Iso-Flex | A.M.P.I. | Iso-Flex | Stimulus isolator |
| TMC antivibration table | TMC | 63-9090 | Antivibration table |
| TMC Faraday cage | TMC | 81-333-90 | Faraday cage |
| Digidata 1322A | Axon Instruments | Digidata 1322A | Digidata |
| Computer | Dell | Dell Dimension 5150 | Computer with Win XP OS |
| Electrode holder | WPI | MEH3SW | Electrode holder |
| Optical filter | Omega optical | XF 115-2 | Filter cube for Green Fluorescent Protein (GFP) detection |
| pCLAMP 8 | Axon Instruments | 8.0.0.81 | Software for signal recording |
| Quantan | In-house software | - | Software for signal processing |
| Canton-S (Wildtype) | Bloomington Stock Center | 64349 | Control fly line |
| cpx SH1 | Generous Gift of J.T. Littleton | - | Complexin knock-out fly line with increased spontaneous exocytosis |
| CD8-GFP | Bloomington Stock Center | 5137 | Fly line with neuronal fluorescent (GFP) Tag |
Ссылки
- Jan, L. Y., Jan, Y. N. Properties of the larval neuromuscular junction in Drosophila melanogaster. J Physiol. 262 (1), 189-214 (1976).
- Katz, B., Miledi, R. The effect of temperature on the synaptic delay at the neuromuscular junction. J Physiol. 181 (3), 656-670 (1965).
- Macleod, G. T., Gan, J., Bennett, M. R. Vesicle-associated proteins and quantal release at single active zones of amphibian (Bufo marinus) motor-nerve terminals. J Neurophysiol. 82 (3), 1133-1146 (1999).
- Macleod, G. T., Farnell, L., Gibson, W. G., Bennett, M. R. Quantal secretion and nerve-terminal cable properties at neuromuscular junctions in an amphibian (Bufo marinus). J Neurophysiol. 81 (3), 1135-1146 (1999).
- Zefirov, A., Benish, T., Fatkullin, N., Cheranov, S., Khazipov, R. Localization of active zones. Nature. 376 (6539), 393-394 (1995).
- Macleod, G. T., Lavidis, N. A., Bennett, M. R. Calcium dependence of quantal secretion from visualized sympathetic nerve varicosities on the mouse vas deferens. J Physiol. 480 (Pt 1), 61-70 (1994).
- Samigullin, D., Bill, C. A., Coleman, W. L., Bykhovskaia, M. Regulation of transmitter release by synapsin II in mouse motor terminals. J Physiol. 561 (Pt 1), 149-158 (2004).
- Coleman, W. L., Bykhovskaia, M. Rab3a-mediated vesicle recruitment regulates short-term plasticity at the mouse diaphragm synapse. Mol Cell Neurosci. 41 (2), 286-296 (2009).
- Atwood, H. L., Parnas, H., Parnas, I., Wojtowicz, J. M. Quantal currents evoked by graded intracellular depolarization of crayfish motor axon terminals. J Physiol. 383, 587-599 (1987).
- Parnas, H., Dudel, J., Parnas, I. Neurotransmitter release and its facilitation in crayfish. I. Saturation kinetics of release, and of entry and removal of calcium. Pflugers Arch. 393 (1), 1-14 (1982).
- Wojtowicz, J. M., Marin, L., Atwood, H. L. Activity-induced changes in synaptic release sites at the crayfish neuromuscular junction. J Neurosci. 14 (6), 3688-3703 (1994).
- Zucker, R. S. Crayfish neuromuscular facilitation activated by constant presynaptic action potentials and depolarizing pulses. J Physiol. 241 (1), 69-89 (1974).
- Zucker, R. S. Changes in the statistics of transmitter release during facilitation. J Physiol. 229 (3), 787-810 (1973).
- Worden, M. K., Bykhovskaia, M., Hackett, J. T. Facilitation at the lobster neuromuscular junction: a stimulus-dependent mobilization model. J Neurophysiol. 78 (1), 417-428 (1997).
- Bykhovskaia, M., Hackett, J. T., Worden, M. K. Asynchrony of quantal events in evoked multiquantal responses indicates presynaptic quantal interaction. J Neurophysiol. 81 (5), 2234-2242 (1999).
- Bykhovskaia, M., Polagaeva, E., Hackett, J. T. Mechnisms underlying different facilitation forms at the lobster neuromuscular synapse. Brain Res. 1019 (1-2), 10-21 (2004).
- Cooper, R. L., Stewart, B. A., Wojtowicz, J. M., Wang, S., Atwood, H. L. Quantal measurement and analysis methods compared for crayfish and Drosophila neuromuscular junctions, and rat hippocampus. J Neurosci Methods. 61 (1-2), 67-78 (1995).
- Stewart, B. A., Atwood, H. L., Renger, J. J., Wang, J., Wu, C. F. Improved stability of Drosophila larval neuromuscular preparations in haemolymph-like physiological solutions. J Comp Physiol A. 175 (2), 179-191 (1994).
- Pawlu, C., DiAntonio, A., Heckmann, M. Postfusional control of quantal current shape. Neuron. 42 (4), 607-618 (2004).
- Akbergenova, Y., Bykhovskaia, M. Synapsin maintains the reserve vesicle pool and spatial segregation of the recycling pool in Drosophila presynaptic boutons. Brain Res. 1178, 52-64 (2007).
- Akbergenova, Y., Bykhovskaia, M. Enhancement of the endosomal endocytic pathway increases quantal size. Mol Cell Neurosci. 40 (2), 199-206 (2009).
- Vasin, A., Volfson, D., Littleton, J. T., Bykhovskaia, M. Interaction of the Complexin Accessory Helix with Synaptobrevin Regulates Spontaneous Fusion. Biophys J. 111 (9), 1954-1964 (2016).
- Wong, K., Karunanithi, S., Atwood, H. L. Quantal unit populations at the Drosophila larval neuromuscular junction. J Neurophysiol. 82 (3), 1497-1511 (1999).
- Dudel, J. The effect of reduced calcium on quantal unit current and release at the crayfish neuromuscular junction. Pflugers Arch. 391 (1), 35-40 (1981).
- Dudel, J. Contribution of Ca2+ inflow to quantal, phasic transmitter release from nerve terminals of frog muscle. Pflugers Arch. 422 (2), 129-142 (1992).
- Marrero, H. G., Lemos, J. R. Loose-Patch-Clamp method. , 2 ed, Humana Press. (2007).
- Wu, W. H., Cooper, R. L. Physiological recordings of high and low output NMJs on the crayfish leg extensor muscle. J Vis Exp. (45), (2010).
- Verstreken, P., Ohyama, T., Bellen, H. J. FM 1-43 labeling of synaptic vesicle pools at the Drosophila neuromuscular junction. Methods Mol Biol. 440, 349-369 (2008).
- Brent, J. R., Werner, K. M., McCabe, B. D. Drosophila larval NMJ dissection. J Vis Exp. (24), (2009).
- Imlach, W., McCabe, B. D. Electrophysiological methods for recording synaptic potentials from the NMJ of Drosophila larvae. J Vis Exp. (24), (2009).
- Bykhovskaia, M. Making quantal analysis more convenient, fast, and accurate: user-friendly software QUANTAN. J Neurosci Methods. 168 (2), 500-513 (2008).
- Huntwork, S., Littleton, J. T. A complexin fusion clamp regulates spontaneous neurotransmitter release and synaptic growth. Nat Neurosci. 10 (10), 1235-1237 (2007).
- Zhong, Y., Wu, C. F. Altered synaptic plasticity in Drosophila memory mutants with a defective cyclic AMP cascade. Science. 251 (4990), 198-201 (1991).
- Delgado, R., Maureira, C., Oliva, C., Kidokoro, Y., Labarca, P. Size of vesicle pools, rates of mobilization, and recycling at neuromuscular synapses of a Drosophila mutant, shibire. Neuron. 28 (3), 941-953 (2000).
- Melom, J. E., Akbergenova, Y., Gavornik, J. P., Littleton, J. T. Spontaneous and evoked release are independently regulated at individual active zones. J Neurosci. 33 (44), 17253-17263 (2013).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
ISSN 1940-087X
Авторские права © 2025 MyJoVE Corporation. Все права защищены
Мы используем файлы cookie для улучшения качества работы на нашем веб-сайте.
Продолжая пользоваться нашим веб-сайтом или нажимая кнопку «Продолжить», вы соглашаетесь принять наши файлы cookie.