Method Article
Fokale Macropatch Aufnahmen der synaptischen Ströme aus der Drosophila larvalen neuromuskulären Synapse
In diesem Artikel
Zusammenfassung
Synaptische Ströme können fokal aus visualisierten synaptischen Boutons bei der Drosophila dritte Instar Larven neuromuskulären Synapse aufgenommen werden. Diese Technik ermöglicht die Überwachung der Tätigkeit von einem einzigen synaptische Bouton.
Zusammenfassung
Drosophila neuromuskulären Synapse (NMJ) ist ein ausgezeichnetes Modell, glutamatergen synaptische Übertragung zu studieren. Wir beschreiben die Technik der fokalen Macropatch Aufnahmen der synaptischen Ströme von visualisierten Boutons bei der Drosophila Larven NMJ. Diese Technik erfordert maßgeschneiderte Herstellung von Aufnahme Mikropipetten sowie ausgestattet mit einer hohen Vergrößerung, Fernverkehr Wasser eintauchen Ziel, differential Interferenz Kontrast (DIC) Optik und eine fluoreszierende Verbindung Mikroskop Anlage. Die Aufnahme-Elektrode befindet sich auf der Oberseite eine ausgewählte synaptische Bouton visualisiert mit DIC Optik, Epi-Fluoreszenz oder beides. Der Vorteil dieser Technik ist, dass es ermöglicht die Überwachung der synaptischen Aktivität von einer begrenzten Anzahl von Standorten der Veröffentlichung. Die Aufnahme-Elektrode hat einen Durchmesser von mehreren Mikrometern und die Freigabe-Websites außerhalb der Elektrode Felge beeinflussen nicht signifikant die aufgezeichneten Strömungen. Die aufgezeichneten synaptische Ströme haben schnelle Kinetik und können leicht gelöst werden. Diese Vorteile sind besonders wichtig für das Studium der mutierten Fliegenschnüre mit verstärkten spontan oder asynchronen synaptische Aktivität.
Einleitung
Drosophila ist ein ausgezeichnetes Modell, die molekularen Mechanismen, die Kontrolle der synaptischen Übertragung zu studieren. Das neuromuskuläre System in Drosophila ist glutamatergen und die Drosophila neuromuskuläre Synapse (NMJ) kann daher verwendet werden, um die konservierten Funktionen des glutamatergen Release zu studieren. Seit Jan und Jan Studie1die dritte Instar Larven weitgehend genutzt, evozierte und spontane synaptische Übertragung durch die Überwachung der exzitatorischen Kreuzung Potentiale (EJPs) oder Strömungen (EJCs) zu studieren. EJPs werden häufig mit einem scharfen Mikro-Glaselektrode intrazellulär aufgezeichnet, und sie reflektieren die Aktivität der gesamten NMJ, einschließlich alle Boutons Synapsen bei der gegebenen Muskelfaser machen.
Im Gegensatz dazu kann die Aktivität von einer begrenzten Anzahl von Standorten der Veröffentlichung fokal durch die Positionierung eines Mikropipette Tipp in der Nähe von neuronalen Terminals oder synaptischen Krampfadern aufgezeichnet werden. Diese Technik wurde ursprünglich von Katz und Miledi2eingesetzt und fokale extrazelluläre Aufnahmen haben erfolgreich an mehreren NMJ Vorbereitungen, einschließlich Frosch3,4,5, Maus6 eingesetzte , 7 , 8, Krustentier9,10,11,12,13,14,15,16und Drosophila17,18,19,20,21,22,23. Dieser Ansatz wurde von Dudel, weiterentwickelt, die Umkodierung Elektroden24,25Macropatch optimiert. Diese Technik abgestimmt Dudel Umsetzung eng locker-Patch-Clamp-Methode26.
Die Drosophila Larven NMJ hat klar definierte synaptischen Boutons und transgene Linien mit genetisch codierte neuronalen fluoreszierende Tags (siehe Tabelle der Materialien) sind leicht zugänglich. Diese Vorteile konnten wir EJCs und mEJCs aus einer ausgewählten synaptische Bouton20,21,22aufnehmen. Hier beschreiben wir diese Technik im Detail.
Protokoll
1. Herstellung der Aufnahme Elektroden
- Gebrauch der folgenden ziehen die Glaselektroden Protokoll für die Mikroelektrode Puller (siehe Tabelle der Materialien):
- Linie 1: Wärme 510 ziehen - Geschwindigkeit 30 mal 250; Linie 2: Erhitzen 490 Pull - Geschwindigkeit 30 mal 250.
Hinweis: Zeiteinheiten entsprechen 0,5 ms pro Einheit; die anderen Geräte sind relativ. Der Wert der Wärme sollte für jedes Filament angepasst werden, nachdem die Rampe-Test durchgeführt wird.
- Linie 1: Wärme 510 ziehen - Geschwindigkeit 30 mal 250; Linie 2: Erhitzen 490 Pull - Geschwindigkeit 30 mal 250.
- Mikroskop (35 X Vergrößerung) verwenden, um sicherzustellen, dass der Innendurchmesser der gezogenen Elektrode im Bereich von 7 bis 10 µm ( Abbildung 1A). Speichern Sie die Kapillaren in dicht verschlossenen Behältern, Staub zu verhindern.
- Gebrauch der folgenden ziehen die Glaselektroden Protokoll für die Mikroelektrode Puller (siehe Tabelle der Materialien):
- Polieren Feuer
- Fire Polnisch Kapillaren (80-90 % der maximalen Heizwert für 1-2 s) mit einer Mikro-Schmiede (siehe Tabelle der Materialien). Sicherzustellen, dass der endgültige Innendurchmesser der polierten Elektrode 5 µm ( Abbildung 1A) 27.
- Biegen
Hinweis: zwei Biegungen werden vorgenommen, um die Elektrode an der Oberseite des Muskels unter einer hohen Vergrößerung Ziel zu positionieren.- Verwendung der Apparat in Figur 1 b gezeigt. Korrigieren Sie die Elektrode in der Manipulator und positionieren Sie die Spitze über den Faden, nicht berühren, it.
- Set Erhitzen zu 60-70 % der maximalen Wert und drücken Sie das Pedal der Mikro-Schmiede für 1-2 s (siehe Tabelle der Materialien), das Filament zu heizen. Verwenden Sie eine L-förmigen Nadel vorsichtig herunterziehen der Elektrodenspitze ( Abbildung 1 b vergrößert). Die Biegemarkierung bei ca. 90 o ( Abbildung 1).
- Halten die Elektrode über die Flamme des Brenners von Hand mit Pinzette und machen die zweite Kurve in einem Abstand von 7-10 mm aus der ersten Kurve und in einem Winkel von ca. 120 o ( Abbildung 1).

Abbildung 1. Letzte Schritte der Herstellung Mikropipette. (A) Elektrode Tipps nach ziehen und Feuer zu polieren. (B. 1) die Einrichtung für Spitze biegen. (B. 2) Box Bereich ist auf der rechten Seite vergrößert dargestellt. Die Elektrode und das Filament sind fixiert, so dass die Elektrodenspitze leicht über den Draht und nicht berührend ist. (C. 1) die Aufnahme-Elektrode. (C. 2) Box Bereich ist auf der rechten Seite vergrößert dargestellt. Die erste Kurve hat einen Winkel von etwa 90 Grad, und der Abstand zwischen der ersten Kurve und die Spitze der Elektrode ist ca. 1 mm. Maßstab bar = 3 mm. Bitte klicken Sie hier für eine größere Version dieser Figur.
2. zusätzliche vorbereitende Schritte
- Prepare Heamolymph erinnernden (HL3) Lösung (in mM): 70 NaCl, 5 KCl, 20 MgCl 2 10 Nahco3 3, 5 Trehalose, 115 Saccharose, 5 HEPES und 1 mM CaCl 2; Einstellung des pH-Wertes auf 7,3 - 7.4. die Lösung im Kühlschrank aufbewahren und machen es jede Woche frisch.
- Stimulation Mehrkanalpipette die gleiche Art und Weise wie Aufnahme Glas machen Mehrkanalpipette, außer es keine Notwendigkeit gibt, sie verbiegen.
Hinweis: Die Vorbereitung der Stimulation Elektroden ist in 28 und 27 detailliert beschrieben. Den endgültigen Durchmesser nach Feuer polieren sollte im Bereich von 5 bis 7 µm. - Insert eine Stimulation-Pipette in einer Mikroelektrode Halterung mit einer Spritze verbunden.
- Herstellung Dissektion Platten aus kleinen Petrischalen (35 x 10 mm) mit Silikon-Kautschuk-Epoxid beschichtet (siehe Tabelle der Materialien), wie unter 28.
Hinweis: Silikon-Kautschuk sollte vor Gebrauch vollständig ausgehärteten. - Wählen Sie einen wandernden Larven dritte Instar und sezieren, wie beschrieben in 27 , 28 , 29 , 30.
Hinweis: Um Boutons visualisieren, verwenden die Fliege Belastung CD8-GLP (siehe Tabelle der Materialien)- mit Zange (siehe Tabelle der Materialien), wählen Sie die 3 rd Instar Larven aus einem Fläschchen.
- Pin die Larven, die Platzierung des ersten Pins posterior und anderen pin anterior (Nähe Mund Haken).
- Lösung hinzufügen HL3.
- Machen Sie einen Schnitt mit Feder Schere (siehe Tabelle der Materialien) ganz aus den oberen Bolzen an der Unterseite eines an der dorsalen Seite der Larven.
- Pin-Larven-Filet, platzieren 2 zusätzliche Pins auf der linken und rechten Seiten der Larven.
- Die Eingeweide und Tracheas mit Pinzette entfernen.
- Die Nerven direkt vor den ventralen Nervenstrang mit Feder Schere geschnitten.
3. Elektrische Aufnahmen von EJCs

Abbildung 2. Die Recording-Setup. Die Probe NMJ angeheftet, das Silizium beschichteten Petrischale (Pfeil) über die bewegliche Bühne des aufrechten Verbindung Mikroskops ausgestattet mit Epifluoreszenz Fähigkeiten, eine hohe Vergrößerung Objektive und zwei Mikromanipulatoren positioniert ist. Das Mikroskop ist auf eine Anti-Vibrationstisch stationiert. Bitte klicken Sie hier für eine größere Version dieser Figur.
- Aufnahme
- Ort der Petrischale mit der Vorbereitung auf den Mikroskoptisch ( Abbildung 2). Legen Sie die Bezugselektrode in der Badewanne.
- Füllen Sie die Aufnahme-Elektrode mit HL3 Lösung. Unter dem Objektiv 10 X (siehe Tabelle der Materialien), die Elektrode in die Wanne Tauchen und legen Sie es über Muskeln 6 und 7 der Abdominalsegmente 2, 3 oder 4 verwenden der Mikromanipulator () (siehe Tabelle der Materialien) Abbildung 3 A. 1 und a. 2).
- Schalten Sie das Ziel auf 60 X (siehe Tabelle der Materialien). Konzentrieren Sie sich auf den gewünschten Bereich mit Epi-Fluoreszenz oder DIC Optik. Setzen Sie die Spitze der Elektrode auf synaptische Bouton ( Abbildung 3 b. 1-3).
- Drücken Sie die Elektrode sehr sanft auf den Muskel. Übermäßiger Druck kann den NMJ beschädigen oder induzieren eine Erhöhung in spontane synaptische Aktivität. Sicherstellen, dass die Spitze der Elektrode ist nicht verstopft - wenn es it. ersetzen,
- Schalten Sie den Verstärker, A/D-Board und dem Computer.
- Klemme Spannungsmodus am Verstärker wählen.
- Software zur Datenerfassung starten und wählen Sie die ' spaltfreie ' Modus.
- Das Aussehen der mEJCs auf dem Computerbildschirm zu beobachten.
- Stellen Sie sicher, das ist die Amplitude der mEJCs im Bereich von 0,2 - 0,7 na
Hinweis: Kleinere EJCs anzugeben, dass die Aufnahme Elektrode Mängel hat oder es nicht richtig positioniert ist.
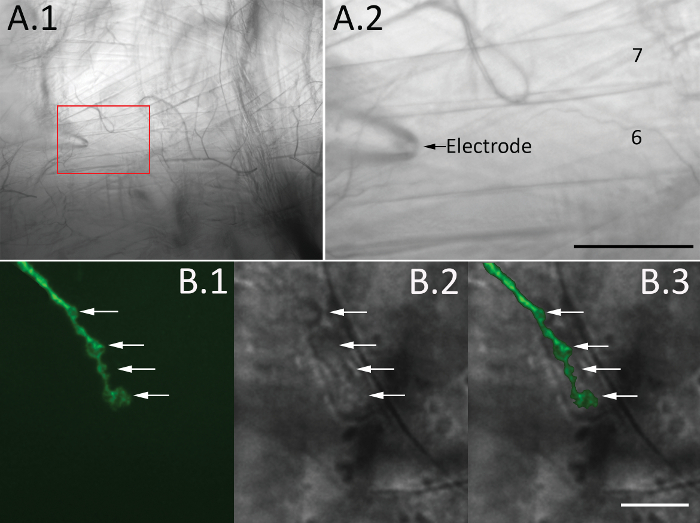
Abbildung 3. Visualisierung der synaptischen Boutons. (A) A Hellfeld Bild eines Hemi-Segments unter 10 x Vergrößerung (a. 1) und den erweiterten Box Bereich zeigt Muskeln 6 und 7 (a. 2, der Pfeil markiert die Aufnahme-Elektrode). Maßstabsleiste = 50 µm. (B) synaptischen Boutons sind in eine Drosophila-Linie mit einem genetisch codierte neuronalen Marker (CD8-GFP) visualisiert mit Epi-Fluoreszenz-Bildgebung (b. 1) oder DIC Optik (b. 2). Bilder sind mit 60 x Objektive und Filter-Cube für die GFP Bildgebung genommen (siehe Tabelle der Materialien). SynaptiC Boutons sind mit Pfeilen gekennzeichnet, und eine Überlagerung von Leuchtstofflampen und DIC Bildern zeigt sich in b. 3. Maßstabsleiste = 10 µm. Bitte klicken Sie hier für eine größere Version dieser Figur.
- Stimulation
- mit einem Mikromanipulator unter Sichtkontrolle, legen Sie die Stimulationselektrode in der Nähe der Axon innervieren Abdominalsegmente 2-4.
- Anwenden Unterdruck durch ziehen den Kolben der Spritze, Elektrodenhalter, verbunden, so dass das Axon, im Inneren der Elektrode ( Abbildung 2 gezogen wird).
- Schalten Sie den Stimulator. Drehen Sie den Knopf am Gerät isoliert (siehe Tabelle der Materialien) einen Null Strom festlegen und dann vorsichtig erhöhen, bis EJCs erscheinen (oder der Schwellenwert erreicht ist).
- Führen die Stimulation in einem überschwelligen Regime, mit dem Reizstrom ca. zweimal erhöht, im Vergleich zu den Schwellenwert für die Beobachtung der EJCs.
Hinweis: Nach unserer Erfahrung ist solche Reizintensität optimal zur Vermeidung von Aktionspotential Ausfälle und Aktionspotential ausgelöst. Zum Beispiel, wenn EJCs erscheinen bei der Stimulation Strom von 0,2 mA, verwenden Sie einen Strom von 0,4 mA während des Experiments.
- Dichtung Widerstand
- messen Sie den Siegel-Widerstand der Aufnahme Macropatch Elektrode durch Drehen des Elektrode Widerstand Schalters des Verstärkers zu " Dichtung Test " Position. Beachten Sie, dass der Dichtung Widerstandswert in GΩ in angezeigt wird die " aktueller " Fenster.
- Sicherstellen, dass die Dichtung Widerstand ist im Bereich von 0,5 - 2 M Ω. Werte außerhalb dieses Bereichs zeigen, dass die Elektrode nicht richtig poliert oder nicht richtig positioniert ist.
- Dichtung Widerstand während der Aufnahme zu überwachen, damit es während des Experiments konstant bleibt.
4. Analyse
- Analyze Aufnahmen beschäftigt maßgeschneiderte Software für die Analyse (siehe Tabelle der Werkstoffe).
Hinweis: Unser Labor verwendet eigenen Software Quantan 31, die für die Erkennung von EJCs und mEJCs fokal aufgenommen ( Abbildung 4) angepasst ist. Diese Software beinhaltet eine Gaußsche Digitalfilter und ermöglicht die Erkennung von Quanten Gipfeln in überlappenden Multi-Quanten Ereignisse ( Abb. 4A). Andere Ansätze sind beschrieben im 17.

Abbildung 4. Quanten-Analyse. Erkennung von mEJCs (A) und (B) EJCs von Quantan Software. Das Veranstaltungsgelände ist grün markiert, und Spitzen zeichnen sich durch roten Pfeilspitzen. Bitte klicken Sie hier für eine größere Version dieser Figur.
Ergebnisse
Fokale Macropatch Aufnahmen ermöglichen Überwachung synaptische Aktivität von ausgewählten synaptischen Boutons (Abbildung 5). Wenn die Elektrode an der Oberseite eine synaptische Bouton (Abbildung 5A, Seite 1) positioniert ist, die aufgenommenen mEJCs (Abbildung 5, Seite 1) haben eine Amplituden, die deutlich über den Geräuschpegel und scharf steigende Phasen (bei einer Sub-Millisekunden-Bereich). Wenn die Aufnahme Elektrode entfernt die synaptische Bouton von mehreren Mikrometern (Abbildung 5A, Seite 2), die Amplituden der aufgezeichneten mEJCs Rückgang fast zu den Geräuschpegel (Abbildung 5 b, Seite 2) bewegt wird. Die aufgezeichneten EJCs unterschieden sich kaum vom Lärm und sie haben steigende Phasen (Abbildung 5, Seite 2 versus Seite 1) verlängert.
Die begrenzte Anzahl von Freisetzungsstandorten zur aufgenommenen EJCs und mEJCs sowie schnelle Kinetik der synaptischen Ströme fokal aufgenommen, ermöglicht eine genaue Erfassung von Release Events in Mutanten mit erhöhten synaptische Aktivität. Dies kann durch Aufnahmen von mEJCs von Complexin null Mutant (Abb. 6A) verdeutlicht. Spontane Aktivität ist in diesem mutierten32drastisch erhöht, und deshalb mEJPs intrazellulär aufgenommen überlappen und nicht eindeutig voneinander unterscheiden (Abbildung 6 b), unterschieden werden, während fokale Aufnahmen22 ermöglichen genaue Erkennung der spontane Freisetzung Ereignisse (Abb. 4A).

Abbildung 5. Aufnahmen von EJCs und mEJCs aus einer ausgewählten Bouton. (A) die Elektrode über eine ausgewählte Bouton (Standort 1) und Abkehr der Bouton (Seite 2). Die Bilder zeigen die CD8-GFP tagged NMJ Elektrode über die Muskelfaser (a. 2), Aufnahme mit Epi-Fluoreszenz (a. 1), visualisiert und Overlays (a. 3, a. 4), mit der Elektrode positioniert über Seite 1 (a. 3) oder () Seite 2 A. 4). Maßstabsleiste = 10 µm. (B) mEJCs, aufgezeichnet von Bouton (Standort 1) unterscheiden sich deutlich von der Aufnahme-Lärm und rapide steigende Phasen haben. Im Gegensatz dazu mEJCs von Seite 2 erfasst nicht vom Lärm Aufnahme zuverlässig unterschieden werden, deren Amplituden sind um ein Vielfaches reduziert und sie haben einen langsameren Zeit-Kurs. (C) die Amplituden der EJCs aufgezeichnet von Bouton (Standort 1) überschreiten durch Vielfaches nahm die Amplituden der EJCs von Seite 2, und sie haben auch eine raschere Kinetik. Bitte klicken Sie hier für eine größere Version dieser Figur.
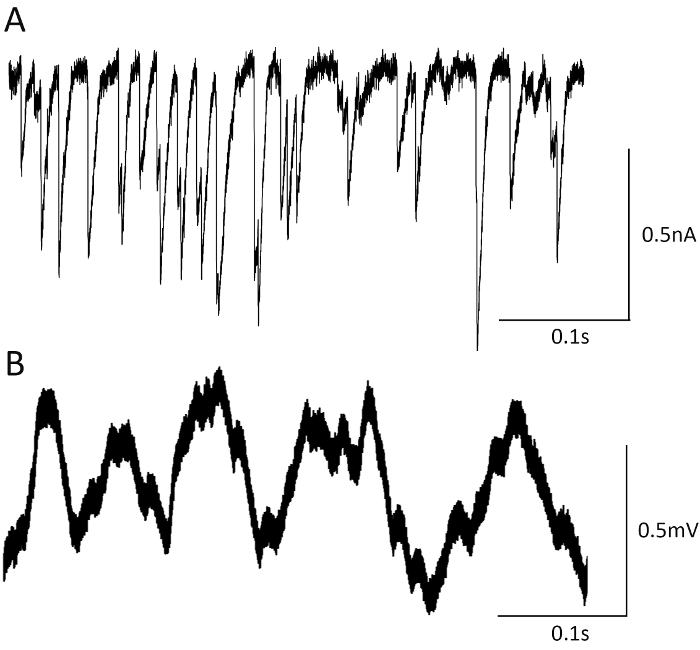
Abbildung 6. Fokale Macropatch gegen intrazelluläre Aufnahmen. Fokale Aufnahmen ermöglichen präzise Erkennung von mEJCs in die Complexin null-Mutante (A), während intrazelluläre Aufnahmen (B) von dieser mutierten Ausstellung Veranstaltungen veröffentlichen, die sich überschneiden und nicht zuverlässig erkannt werden. Bitte klicken Sie hier für eine größere Version dieser Figur.
Diskussion
Drosophila ist eine vorteilhafte Modellorganismus synaptische Übertragung zu studieren. Mehrere Aufnahme Konfigurationen wurden bei den Larven NMJ, einschließlich intrazelluläre Aufnahmen der synaptischen Potentiale, Aufnahmen der synaptischen Ströme mit zwei Elektroden Spannung Klemme33,34und fokale Macropatch verwendet Aufnahmen der synaptischen Ströme, die hier beschrieben. Diese Technik ermöglicht die präzise Quantifizierung der synaptischen Übertragung bei visualisierte Boutons.
Der Erfolg des beschriebenen Protokolls hängt entscheidend von der Fähigkeit, den gewünschten Bereich deutlich sichtbar zu machen und die Vorbereitung der Aufnahme Elektroden anzupassen. Qualität-DIC-Optik, ein hoher Vergrößerung Wasser eintauchen Ziel mit einem langem Arbeitsabstand und angepasste Ausrüstung für Feuer polieren und biegen von Aufnahme Elektroden sind daher von entscheidender Bedeutung.
Der Vorteil dieses Ansatzes ist, dass es ermöglicht die Überwachung der Tätigkeit von ein paar Synapsen, die unter der Aufnahme Elektrode positioniert sind. Es sei darauf hingewiesen, jedoch können Boutons positioniert in der Nähe der Felge der Elektrode auch aufgezeichneten Aktivität beitragen. Es ist wichtig, daher, dass die Position der Elektrode, sowie der Dichtung Widerstand, im Laufe des Versuchs nicht ändert.
Die Fähigkeit, die Aktivität einer einzigen Bouton überwachen kann möglicherweise mit den letzten imaging-Technologien kombiniert werden. Z. B. optische Erkennung der Tätigkeit bei einzelnen aktiven Zonen35 kombinierbar mit fokalen EJCs und mEJC, und dies könnte die räumliche Auflösung der optischen Erkennung mit einer zeitlichen Auflösung von elektrische Aufnahmen koppeln.
Offenlegungen
Die Autoren haben nichts preisgeben.
Danksagungen
Unterstützt von der NIH Grant R01 MH 099557
Materialien
| Name | Company | Catalog Number | Comments |
| Sutter P-97 | Sutter instrument | P-97 | Microelectrode puller |
| Narishige MF-830 | Narishige | MF-830 | Microforge |
| WPI MF200 | WPI | MF200 | Microforge |
| Glass capilaries | WPI | B150-86-10 | Glass capilaries |
| Microtorch 1WG61 | Grainer | 1WG61 | Microtorch |
| Sylgard 184 Silicone Elastomer Kit | Dow Corning | SYLGARD 184 | Silicone for dissection plates preparation |
| Dissection pins | Amazon | B00J5PMPJA | Pins for larvae positioning |
| Tweezers | WPIINC | 500342 | Tweezers for placing pins, removing the guts and tracheas. |
| Scissors | WPIINC | 501778 | Scissors for cutting the cuticula of the larvae and nerves. |
| Olympus BX61WI | Olympus | BX61WI | Upright microscope |
| Olympus Lumplan FL N 60x | Olympus | UPLFLN 60X | Microscope objective 60X |
| Olympus UPlan FL N 10x | Olympus | Uplanfl N 10X | Microscope objective 10X |
| Narishige Micromanipulator | Narishige | MHW-3 | Three-axis Water Hydraulic Micromanipulator |
| npi Electronic GmbH ELC-03XS | npi Electronic GmbH | ELC-03XS | Electrophysiological amplifier |
| A.M.P.I Master 8 | A.M.P.I. | Master 8 | Electrical stimulator |
| A.M.P.I Iso-Flex | A.M.P.I. | Iso-Flex | Stimulus isolator |
| TMC antivibration table | TMC | 63-9090 | Antivibration table |
| TMC Faraday cage | TMC | 81-333-90 | Faraday cage |
| Digidata 1322A | Axon Instruments | Digidata 1322A | Digidata |
| Computer | Dell | Dell Dimension 5150 | Computer with Win XP OS |
| Electrode holder | WPI | MEH3SW | Electrode holder |
| Optical filter | Omega optical | XF 115-2 | Filter cube for Green Fluorescent Protein (GFP) detection |
| pCLAMP 8 | Axon Instruments | 8.0.0.81 | Software for signal recording |
| Quantan | In-house software | - | Software for signal processing |
| Canton-S (Wildtype) | Bloomington Stock Center | 64349 | Control fly line |
| cpx SH1 | Generous Gift of J.T. Littleton | - | Complexin knock-out fly line with increased spontaneous exocytosis |
| CD8-GFP | Bloomington Stock Center | 5137 | Fly line with neuronal fluorescent (GFP) Tag |
Referenzen
- Jan, L. Y., Jan, Y. N. Properties of the larval neuromuscular junction in Drosophila melanogaster. J Physiol. 262 (1), 189-214 (1976).
- Katz, B., Miledi, R. The effect of temperature on the synaptic delay at the neuromuscular junction. J Physiol. 181 (3), 656-670 (1965).
- Macleod, G. T., Gan, J., Bennett, M. R. Vesicle-associated proteins and quantal release at single active zones of amphibian (Bufo marinus) motor-nerve terminals. J Neurophysiol. 82 (3), 1133-1146 (1999).
- Macleod, G. T., Farnell, L., Gibson, W. G., Bennett, M. R. Quantal secretion and nerve-terminal cable properties at neuromuscular junctions in an amphibian (Bufo marinus). J Neurophysiol. 81 (3), 1135-1146 (1999).
- Zefirov, A., Benish, T., Fatkullin, N., Cheranov, S., Khazipov, R. Localization of active zones. Nature. 376 (6539), 393-394 (1995).
- Macleod, G. T., Lavidis, N. A., Bennett, M. R. Calcium dependence of quantal secretion from visualized sympathetic nerve varicosities on the mouse vas deferens. J Physiol. 480 (Pt 1), 61-70 (1994).
- Samigullin, D., Bill, C. A., Coleman, W. L., Bykhovskaia, M. Regulation of transmitter release by synapsin II in mouse motor terminals. J Physiol. 561 (Pt 1), 149-158 (2004).
- Coleman, W. L., Bykhovskaia, M. Rab3a-mediated vesicle recruitment regulates short-term plasticity at the mouse diaphragm synapse. Mol Cell Neurosci. 41 (2), 286-296 (2009).
- Atwood, H. L., Parnas, H., Parnas, I., Wojtowicz, J. M. Quantal currents evoked by graded intracellular depolarization of crayfish motor axon terminals. J Physiol. 383, 587-599 (1987).
- Parnas, H., Dudel, J., Parnas, I. Neurotransmitter release and its facilitation in crayfish. I. Saturation kinetics of release, and of entry and removal of calcium. Pflugers Arch. 393 (1), 1-14 (1982).
- Wojtowicz, J. M., Marin, L., Atwood, H. L. Activity-induced changes in synaptic release sites at the crayfish neuromuscular junction. J Neurosci. 14 (6), 3688-3703 (1994).
- Zucker, R. S. Crayfish neuromuscular facilitation activated by constant presynaptic action potentials and depolarizing pulses. J Physiol. 241 (1), 69-89 (1974).
- Zucker, R. S. Changes in the statistics of transmitter release during facilitation. J Physiol. 229 (3), 787-810 (1973).
- Worden, M. K., Bykhovskaia, M., Hackett, J. T. Facilitation at the lobster neuromuscular junction: a stimulus-dependent mobilization model. J Neurophysiol. 78 (1), 417-428 (1997).
- Bykhovskaia, M., Hackett, J. T., Worden, M. K. Asynchrony of quantal events in evoked multiquantal responses indicates presynaptic quantal interaction. J Neurophysiol. 81 (5), 2234-2242 (1999).
- Bykhovskaia, M., Polagaeva, E., Hackett, J. T. Mechnisms underlying different facilitation forms at the lobster neuromuscular synapse. Brain Res. 1019 (1-2), 10-21 (2004).
- Cooper, R. L., Stewart, B. A., Wojtowicz, J. M., Wang, S., Atwood, H. L. Quantal measurement and analysis methods compared for crayfish and Drosophila neuromuscular junctions, and rat hippocampus. J Neurosci Methods. 61 (1-2), 67-78 (1995).
- Stewart, B. A., Atwood, H. L., Renger, J. J., Wang, J., Wu, C. F. Improved stability of Drosophila larval neuromuscular preparations in haemolymph-like physiological solutions. J Comp Physiol A. 175 (2), 179-191 (1994).
- Pawlu, C., DiAntonio, A., Heckmann, M. Postfusional control of quantal current shape. Neuron. 42 (4), 607-618 (2004).
- Akbergenova, Y., Bykhovskaia, M. Synapsin maintains the reserve vesicle pool and spatial segregation of the recycling pool in Drosophila presynaptic boutons. Brain Res. 1178, 52-64 (2007).
- Akbergenova, Y., Bykhovskaia, M. Enhancement of the endosomal endocytic pathway increases quantal size. Mol Cell Neurosci. 40 (2), 199-206 (2009).
- Vasin, A., Volfson, D., Littleton, J. T., Bykhovskaia, M. Interaction of the Complexin Accessory Helix with Synaptobrevin Regulates Spontaneous Fusion. Biophys J. 111 (9), 1954-1964 (2016).
- Wong, K., Karunanithi, S., Atwood, H. L. Quantal unit populations at the Drosophila larval neuromuscular junction. J Neurophysiol. 82 (3), 1497-1511 (1999).
- Dudel, J. The effect of reduced calcium on quantal unit current and release at the crayfish neuromuscular junction. Pflugers Arch. 391 (1), 35-40 (1981).
- Dudel, J. Contribution of Ca2+ inflow to quantal, phasic transmitter release from nerve terminals of frog muscle. Pflugers Arch. 422 (2), 129-142 (1992).
- Marrero, H. G., Lemos, J. R. . Loose-Patch-Clamp method. , (2007).
- Wu, W. H., Cooper, R. L. Physiological recordings of high and low output NMJs on the crayfish leg extensor muscle. J Vis Exp. (45), (2010).
- Verstreken, P., Ohyama, T., Bellen, H. J. FM 1-43 labeling of synaptic vesicle pools at the Drosophila neuromuscular junction. Methods Mol Biol. 440, 349-369 (2008).
- Brent, J. R., Werner, K. M., McCabe, B. D. Drosophila larval NMJ dissection. J Vis Exp. (24), (2009).
- Imlach, W., McCabe, B. D. Electrophysiological methods for recording synaptic potentials from the NMJ of Drosophila larvae. J Vis Exp. (24), (2009).
- Bykhovskaia, M. Making quantal analysis more convenient, fast, and accurate: user-friendly software QUANTAN. J Neurosci Methods. 168 (2), 500-513 (2008).
- Huntwork, S., Littleton, J. T. A complexin fusion clamp regulates spontaneous neurotransmitter release and synaptic growth. Nat Neurosci. 10 (10), 1235-1237 (2007).
- Zhong, Y., Wu, C. F. Altered synaptic plasticity in Drosophila memory mutants with a defective cyclic AMP cascade. Science. 251 (4990), 198-201 (1991).
- Delgado, R., Maureira, C., Oliva, C., Kidokoro, Y., Labarca, P. Size of vesicle pools, rates of mobilization, and recycling at neuromuscular synapses of a Drosophila mutant, shibire. Neuron. 28 (3), 941-953 (2000).
- Melom, J. E., Akbergenova, Y., Gavornik, J. P., Littleton, J. T. Spontaneous and evoked release are independently regulated at individual active zones. J Neurosci. 33 (44), 17253-17263 (2013).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten