Method Article
На основе RANKL остеокластов культуры Assay из мыши костного расследовать роль mTORC1 в формировании остеокластов
* Эти авторы внесли равный вклад
В этой статье
Резюме
Эта рукопись описывает протокол к изоляции и культуры остеокласты в пробирке из костного мозга мыши и для изучения роли млекопитающих/механистический цель rapamycin комплекс 1 в формировании остеокластов.
Аннотация
Остеокласты являются уникальные кости resorbing клеток, которые отличают от линии моноцитов/макрофагов костного мозга. Дисфункция остеокластов может привести к серии метаболических заболеваний костей, включая остеопороза. Для разработки фармацевтических целей для профилактики патологических костной потери массы, необходимо понимать механизмы, которыми остеокласты дифференцировать от прекурсоров. Способность изолировать и культуры большое число остеокластов в vitro имеет решающее значение для того, чтобы определить роль конкретных генов в дифференциации остеокластов. Инактивация млекопитающих/механистический цель rapamycin комплекс 1 (TORC1) в остеокластов может уменьшить число остеокластов и увеличения костной массы; Однако основные механизмы требуют дальнейшего изучения. В настоящем исследовании описан RANKL-протокол на основе изолировать и культуры остеокласты из костного мозга мыши и изучить влияние инактивирование mTORC1 на формирование остеокластов. Этот протокол успешно привели в большое количество гигантских остеокласты, обычно в течение одной недели. Удаление Raptor нарушения формирования остеокластов и снизилась активность секреторной тартрата стойкие кислая фосфатаза, означающее что mTORC1 имеет решающее значение для формирования остеокластов.
Введение
Кости является постоянно меняющейся органом и перестроенный остеобластов и остеокласты на протяжении всей жизни. Остеокласты отвечают для рассасывания минерализованных матрицы и остеобластов синтезировать и выделяют новые костной матрицы1. Баланс между костную резорбцию и формирования костей имеет решающее значение для здоровья костей, включая поддержание костной массы и ответ на стимуляцию и травмы. Если этот баланс нарушается, может возникнуть ряд метаболических заболеваний костей, включая остеопороза и заболеваний пародонта. В этих заболеваний костной массы потери в результате osteoclastic костную резорбцию превышает костей, образующих потенциал остеобластов2,3. Таким образом в целях разработки фармацевтических целей для лечения скелетных расстройств, таких как остеопороз, важно понять поколения и биологии остеокласты4.
Остеокласты уникальный гигантские многоядерные клетки, расположенные на или вблизи поверхности кости и принадлежат к моноцитов/макрофагов семьи1. Ibbotson K. J. и др. сообщил метод для создания остеокластов подобных клеток в пробирке с средой, содержащей 1,25-дигидрокси витамин D35. Выявление макрофагальный колонии стимулирующий фактор (M-CSF) и рецепторов активатор для ядерного фактора κ B лиганда (RANKL) как основные факторы формирования остеокластов резко повысило эффективность osteoclastogenesis в пробирке 1 , 6 , 7. способность культуры остеокласты в vitro улучшилось наше понимание поколения и регулирование остеокластов.
Млекопитающих/механистический цель rapamycin (mTOR) функций в двух структурно и функционально различных комплексов, а именно mTORC1 и mTORC28,9. Два различных белковых комплексов отличаются друг от друга из-за их различных компонентов и ниже по течению субстратов. mTORC1 содержит уникальные регулирования связанных белков mTOR (хищника), а mTORC2 rapamycin нечувствительным компаньон mTOR (Rictor)9. mTORC1 можно интегрировать и передавать важные сигналы регулировать рост клеток, пролиферации и дифференцировки. Недавно мы продемонстрировали, что mTORC1 играет ключевую роль в сети катаболических костную резорбцию путем удаления Raptor для инактивации mTORC1 в остеокласты10. Однако основные механизмы требуют дальнейшего изучения. В настоящем исследовании на основе RANKL osteoclastogenic метод был использован для создания остеокласты из костного мозга, полученных макрофагов (BMMs) одичал типа (WT) и рэпCtsk мышей, а также изучить влияние инактивирование mTORC1 на остеокластов формирование.
протокол
Все процедуры, связанные с животными, были выполнены в соответствии с протоколом, утвержденным в Стэнфордском административной панели на лабораторных животных уход (APLAC); и были одобрены животное уход и использование Комитета Шанхайского института биохимии и ячейки Биология.
1. Подготовка
- Генерировать остеокластов конкретных Raptor удаления мышей (Raptorfl/fl; Ctsk-cre, далее, рэпCtsk) путем скрещивания Raptorfl/fl мышей с Ctsk-cre мышей. Используйте мышь Raptorfl/fl как WT управления в данном исследовании.
- Иметь контейнер со льдом, чтобы держать изолированных кости.
-
Подготовка питательной среды.
- Подготовьте α-MEM питательной среды, дополняющего минимальных основных средних альфа (α-MEM) с 1 x глутамина, пенициллин стрептомицином и 10% плода телячьей сыворотки.
- Подготовьте костного макрофагов индукции среднего, состоящий из 50 мл α-MEM средних и M-CSF в 20 нг/мл.
- Подготовка среднего индукции остеокластов, состоящий из M-CSF и RANKL на 20 нг/мл, соответственно, 50 мл α-MEM среды.
-
Подготовьте следующие буферы до окрашивания ЛОВУШКУ.
- Подготовьте исправление раствор, состоящий из 6,5 мл ацетона, 2,5 мл раствора цитрата и 0,8 мл раствора формальдегида (vol/vol) 37%.
- Подготовьте ловушек, окрашиванию решение.
- Prewarm деионизованной воды 37 ° C.
- Добавить 100 мкл быстро граната GBC базового решения и 100 мкл раствора нитрита натрия в 1,5 мл микропробирок и смешивать, нежный инверсии для 30 s. оставить смесь стоять за 2 мин.
- Prewarm 9 мл деионизованной воды 37 ° C. Добавьте 200 мкл diazotized быстро граната GBC базового решения от шага 1.4.2.2, 100 мкл раствора фосфат Нафтол AS-би, 400 мкл раствора ацетата и 200 мкл тартрата раствор.
- Держите ЛОВУШКУ, окрашивание раствора смесь на водяной бане при температуре 37 ° C.
-
Подготовьте следующие буфера перед ЛОВУШКУ активности количественная оценка питательной среды.
- Подготовить тартрата буфера (50 мл): 2 мл L-винной кислоты 0,33 М, 48 мл 0,33 М натрия тартрата двуосновной обезвоживанию. Отрегулируйте значение pH 4,9.
- Подготовка 4-нитрофенил фосфат динатрия (pNPP) буфера (200 мл): 1.502 g глицина, 41 мг MgCl2, 27,2 мг ZnCl2и 180 мл деионизованной воды. Отрегулируйте значение пэ-аша для 10.4 с 3 M NaOH и объем до 200 мл деионизированной водой.
- Подготовка pNPP буфер с фосфатазы субстрата (для одного 96-луночных Латы): 49.37 мг фосфатазы субстрат и 175 мкл буфера pNPP шага 1.5.2.
- Подготовка субстрата буфера (9 мл/96-луночных Латы): 6.24 мл деионизированной воды, 360 мкл раствора ацетата, а 2,4 мл тартрата буфера. Mix вихря и разогреть при 37 ° C перед использованием.
- Добавление 9 мл разогретой субстрата buffer(1.5.4) сделать смеси субстрата и вихревые для 10 90 мкл буфера pNPP с фосфатазы substrate(1.5.3) s.
2. Вскрытие (день -1)
- Усыпить 3 1 месяц старый самок мышей WT и рэпCtsk CO2 отдельно. Выполняйте CO2 ингаляции с соответствующим оборудованием, квалифицированным персоналом.
- Погружайте 6 мышей в стакан с 100 мл 75% этанола (vol/vol) 5 мин для предотвращения бактериального загрязнения и затем разместить на доске рассечение в лежачем положении. Сделать надрез на дистальном голени вертикально и вскрыть кожу вдоль задних конечностей офтальмологический ножницами.
- Вырезать суставных связок тазобедренного сустава с ножницами и вывихнуть задних конечностей из ствола.
- Вырезать суставных связок коленного сустава и аккуратно отделить голени и бедра от коленного сустава. Аккуратно удалите мягких тканей с ножницами.
- Поместите все кости одной генотипа в одной мыши в каждой скважине шести хорошо плита с 2 мл α-MEM на льду.
Примечание: Для сохранения жизнеспособности клеток, кости должны храниться в этих условиях для менее 1 ч.
3. изоляция (день -1)
- Заполните одно также шесть ну плиты с 75% этанола (3 мл) и другие 5 скважин с α-MEM среднего (3 мл).
- Положите все кости одной генотипа в этанол мыть за 15 s и мыть кости 5 раз с α-MEM средой для 10 s каждый раз.
- Cut off эпифизов с ножницами и вставьте иглу шприца 0,45 мм в полости и флеш костного мозга, с α-MEM среднего в 50-мл пластиковых пробирок.
- Промойте полость кости, используя тот же метод из другого конца кости. Повторите по крайней мере дважды, чтобы вымыть полость кости до тех пор, пока кости бледно.
- Центрифуга костного мозга для получения клеток лепешки на 800 x g и 4 ° C за 5 мин аспирата супернатант.
- Добавьте 3 мл буфера lysis красных кровяных клеток в пластиковых пробирок и очистка нежно ресуспензируйте костного мозга. Держите пластиковых пробирок на льду на 8 минут, чтобы лизировать красных кровяных клеток.
- Добавьте 6 мл α-MEM среды в пластиковых пробирок остановить лизис клеток. Центрифуга 500 x g и 4 ° C на 10 минут и удалить супернатант.
- Ресуспензируйте в 3 мл α-MEM питательной среды и место клетки в шести ну плиту (обычно один мышь за хорошо).
- Инкубируйте при 37 ° C в 5% CO2 инкубатора на ночь.
4. обшивка (день 0)
- Передать супернатант пластиковых пробирок 15мл собирать неприсоединенной клетки на следующее утро.
- Центрифуга на 800 x g и 4 ° C на 5 мин и удалить супернатант.
- Ресуспензируйте в 4 мл α-MEM питательной среды.
- Возьмите 20 мкл раствора клеток и смешать с 20 мкл Трипановый синий. Добавить 10 мкл смеси в Счетной палате и получить количество клеток в мл раствора.
- Добавьте соответствующий объем α-MEM питательной среды для получения клеток решение 500000 клеток/мл.
- Добавьте 500 мкл и 50 мкл костного макрофагов индукции среды в каждой скважине 24-Ну и 96-луночных крышку, соответственно.
- Добавьте 500 мкл и 50 мкл раствора клеток в каждой скважине 24-Ну и 96-луночных крышку, соответственно.
- Инкубируйте 3 дней при 37 ° C в 5% CO2 инкубатора.
5. Дифференциация (3-7 дней)
- Через три дня после покрытия, собирать 50 мкл среднего от каждой скважины 96-хорошо пластины и заморозить при температуре-20 ° C, затем аспирационная остаточного среднего.
- Добавьте 1 мл и 100 мкл остеокластов индукции среднего в каждую лунку 24-ну плиты и плиты 96-луночных, соответственно.
- Инкубируйте при 37 ° C в течение 2 дней.
- Собирать 50 мкл среды от каждой скважины и аспирационная остаточного среднего.
- Добавьте остеокластов индукции среднего в каждой скважине.
- Инкубируйте при 37 ° C, за 1 день.
Примечание: В этот момент времени, большие, многоядерные остеокласты следует рассматривать под инвертированным микроскопом (рис. 2A). - Если не видны остеокласты, измените среднего индукции остеокластов и наблюдать ежедневно, пока не видел остеокластов.
- Соберите 50 мкл среды от каждой скважины 96-луночных пластины после того, как сформировались остеокластов.
6. тартрата пятнать устойчивостью кислой фосфатазы (ловушка)
Примечание: Зрелые остеокластов может присутствовать после 6-7 дней в vitro культуры (шаг 4).
- Аспирационная среднего и мыть нежно 3 раза с ПБС.
- Исправить ячейки в каждой скважине 96-луночных пластины с 100 мкл раствора исправление для 30 s при комнатной температуре.
- После фиксации аспирационная решения и мыть нежно 3 раза с деионизированную воду подогретую до 37 ° C. Аспирационная деионизированную воду.
- 100 мкл ЛОВУШКУ пятно в каждой скважине 96-луночных пластины и место пластину в инкубаторе при 37 ° C 30 мин и щит от света.
- После окрашивания, аспирационная ЛОВУШКУ пятно и осторожно промойте деионизованной воды 3 раза.
- Остеокласты изображения с помощью инвертированного микроскопа при 40 кратном.
7. ЛОВУШКУ активности количественная оценка питательной среды
- Сбор 30 мкл культуры супернатанта от каждой скважины 96-луночных пластины из шага 5.1, 5.4 и 5.8; Используйте 30 мкл-культивированный остеокластов индукции среды как отрицательный контроль. Поместите образцы в новой 96-луночных пластины.
- Добавление 90 мкл mixture(1.5.5) субстрата в каждой скважине 96-луночных пластины.
- Место пластину в инкубаторе при 37 ° C 1 h и щит от света.
- Остановите реакции, добавляя 50 мкл 3 M NaOH в каждой скважине 96-луночных пластины.
- Измерения theabsorbance на длине волны 405 нм.
8. западный Blotting
Примечание: После 6-7 дней в vitro культуры в пластину 24-Ну, Зрелые остеокласты должны быть видны.
- Аспирационная среды.
- Мыть нежно с предварительно охлажденный 1 x PBS 3 раза.
- Аспирационная PBS.
- 100 мкл 1 x SDS лизис буфера содержащий ингибитор протеазы коктейль.
- Лизатов тепла при 105 ° C 10 мин и центрифуги на 12 000 × g и 4 ° C на 10 мин собирать supernatants, содержащие белки.
- Отдельные лизатов, содержащие 30 мкг белка на 10% SDS-PAGE11 и затем передать винилидена фторида (PVDF) мембраны.
- Блокировать мембраны с 5% обезжиренное молоко за 30 мин.
- Инкубации мембран с анти ящера, анти P-S6, анти S6, анти β-актина в 1:1,000 разрежения в 5% обезжиренное молоко при температуре 4 ° C на ночь.
- Вымойте мембраны с трис буфер солевой с Tween-20 (TBST) для 10 мин при комнатной температуре.
- Повторите шаг 8,9 дважды.
- Инкубации мембран с пероксидазой хрена (ПХ)-конъюгированных IgG антитела анти мыши или кролика на 1:5,000 разрежения в 5% обезжиренное молоко в течение 1 ч при комнатной температуре.
- Вымойте мембраны 3 раза с TBST 10 мин при комнатной температуре.
- Хемилюминесцентный детектор добавить Западной Хемилюминесцентный субстрат HRP на мембранах и инкубировать в течение 5 мин при комнатной температуре. Слейте излишки субстрата и разоблачить помарки для рентгеновской пленки.
Результаты
Используя настоящий Протокол, большое количество гигантских остеокласты были замечены на день 6; Если не видны гигантских остеокласты, еще один день дифференцировки остеокластов может быть необходимо (рис. 1). Формирование успешных остеокластов был подтвержден ловушек, окрашиванию (рисунок 2A). Остеокласты были гигантские клетки вино красный/фиолетовый с более чем 3 ядрами. Более чем 250 остеокласты были получены в каждой скважине 96-луночных пластины в WT BMMs (рис. 4A).
Удаление Raptor было подтверждено западных blotting анализа и инактивации mTORC1 было обусловлено снижением фосфорилирования рибосомных белка S6 (P-S6), который широко используется как индикации для mTORC1 (рис. 3).
Число остеокластов ловушка положительных уменьшилось в рэпCtsk BMMs по сравнению с группой WT (рис. 4A), который указал, что Raptor дефицит нарушение формирования остеокластов.
Активность секреторной Ловушка имеет важное значение для костной резорбции, и ловушка деятельность в среде культуры были проанализированы в настоящем исследовании. Как показано на рисунке 4В, ловушка активность возросла благодаря стимуляции RANKL WT и рэпCtsk BMMs. Кроме того, ловушка активность снизилась в рэпCtskBMMs по сравнению с соответствующей группой WT (P < 0,05).
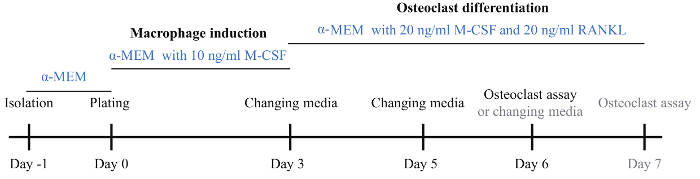
Рисунок 1: Схема протокола индукции остеокластов. BMMs были изолированы на 1 день и инкубировали с основными α-MEM среднего ночь. В день 0 BMMs были собраны и покрытием на 96-луночных и 24-ну крышку после инкубации в α-MEM среде с 10 нг/мл M-CSF. День 3 средство было изменено на α-MEM средний с 20 нг/мл M-CSF и 20 нг/мл RANKL для индукции дифференцировки остеокластов. На 5 день было изменено дифференциации среднего остеокластов. На 6 день большое количество остеокласты были видны и остеокластов анализов были выполнены. Если остеобласты были не видны, средний индукционный остеокластов было изменено и инкубации продолжались еще один день. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.

Рисунок 2: представительный вид остеокластов. (A) гигант остеокласты наблюдается в яркие области на 6 день. Красная линия изложил границы остеокластов. (B) обычно гигант, многоядерные, ловушка положительным (Винно-красный) остеокластов. Черной стрелкой указано два ядра многоядерные остеокластов. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
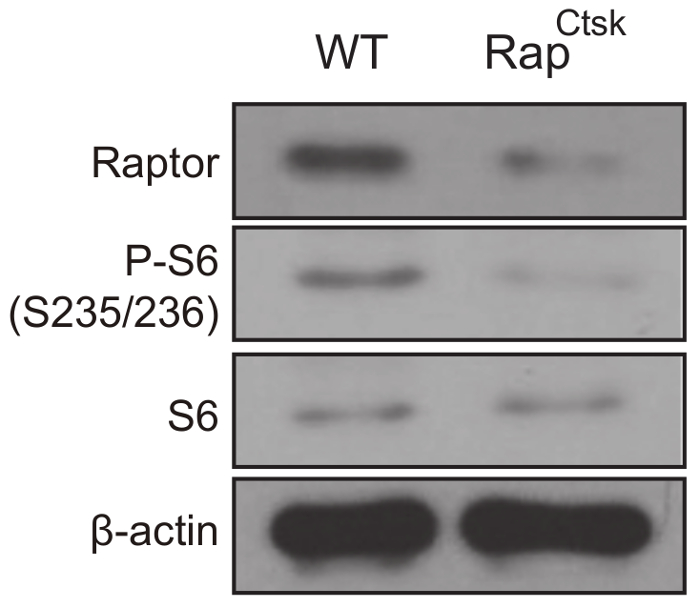
Рисунок 3: mTORC1 инактивации в рэп-Ctsk BMMs. Западной blotting анализ экспрессии Raptor, P-S6 и S6 WT и рэпCtsk BMMs на 6 день. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.

Рисунок 4: Исключить Raptor нарушение формирования остеокластов. (A) ЛОВУШКУ окрашивание BMMs на 6 день. Высокое увеличение изображения квадратов в WT и рэпCtsk групп показали, соответственно. Там были меньше гигант, ловушка позитивные остеокласты, образованная в рэпCtsk BMMs по сравнению с группой WT. (B) ЛОВУШКУ активности культивированный WT и рэпCtsk BMMs. данных представляют означает ± S.D.* P < 0,05, n = 3. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
Обсуждение
Osteoclastogenic assay является наиболее широко используемый метод, чтобы изолировать и культуры остеокласты в пробирке12,13. Хотя несколько основанных на RANKL остеокластов индукции были описаны13,14,15, настоящее исследование описал протокол с некоторыми изменениями, на основе предыдущих методов.
В предыдущем исследовании сразу же после изоляции14,15покрытие BMMs. Мы рекомендовали, что BMMs были культивируемых с базовой средой на ночь перед обшивкой изолировать BMMs от мезенхимальных стволовых клеток и фибробластов, которые сразу же придерживаться блюдо. M-CSF может способствовать распространение моноцитов к прекурсорам остеокластов и стимулировать остеокластов прекурсоров выразить ранга, которая связывает RANKL и затем индуцирует образование пожилые остеокласты6,16,17. Таким образом в нашем исследовании, BMMs были индуцированной с 10 нг/мл M-CSF за 3 дня до остеокластов индукции, вместо остеокластов индукции на второй день после покрытия15. Плотность клеток имеет решающее значение для формирования остеокластов в пробирке. Рекомендуется, что 25000 BMMs были посеяны в каждой скважине ниже 96-луночных пластины от 3 дней инкубации с 10 нг/мл M-CSF. Когда слияния клеток достигла 80 – 90%, это подходящее время для индукции RANKL остеокластов. Как правило пожилые остеокласты формы на 6 день. Наиболее распространенной причиной для нескольких остеокласты является плотность субоптимальные клеток, которое может быть результатом низкой плотности посева или жизнеспособности низкой клеток. BMMs тонкие клетки первичной и нужно относиться осторожно. Сохраняя кости на льду долгое время или resuspending энергично уменьшается жизнеспособность BMMs и впоследствии препятствует формированию остеокластов. Таким образом оптимального заполнения плотность жизнеспособных BMMs имеет решающее значение для получения большое число остеокластов.
Активность секреторной Ловушка имеет решающее значение для osteoclastic костную резорбцию. В этом исследовании мы описываем метод количественного анализа секреторную активность ЛОВУШКУ в среде культуры. Изменение активности ЛОВУШКУ в среде культуры может быть результатом изменения числа остеокластов или секреторной ЛОВУШКУ остеокластов или сочетанием обоих. Таким образом это может быть полезным методом для анализа остеокластов функции в пробирке совместно с Пробирной рассасывания остеокластов, описанных ранее18.
mTOR является эволюционно сохраняется протеинкиназы, можно регулировать метаболизм и дифференциации клеток9. В этом исследовании мы обнаружили, что mTORC1 играет важную роль в костную резорбцию, регулируя формирования остеокластов. mTORC1 может быть потенциальным фармакологических мишенью для лечения костных метаболических расстройств, таких как остеопороз в будущем.
Таким образом наш протокол для индукции остеокластов успешно привело к большое количество гигантских остеокласты в пробирке и наши данные показывают, что mTORC1 имеет решающее значение для формирования остеокластов.
Раскрытие информации
Все авторы заявляют, что они имеют без конфликта интересов.
Благодарности
Авторы благодарят доктор Minghan Тонг и S. Като за любезно предоставление реагентов и мышей. Мы благодарим членов Цзоу лаборатории для полезных обсуждений. Эта работа частично поддержали грантов из 973 программы из китайского министерства науки и технологии (большинство) [2014CB964704 и 2015CB964503], программы клинических исследований 9 людей больницы, Шанхай Jiao Tong школы медицины университета. Спасибо за помощь Фонда основной клеточной биологии и основной объект для химической биологии, CAS центр передового опыта в области науки для молекулярной клеток, Шанхайский Институт биохимии и клеточной биологии, Китайской академии наук.
Материалы
| Name | Company | Catalog Number | Comments |
| Raptorfl/fl mice | The Jackson Laboratory | 013188 | |
| Ctsk-cre mice | a gift from S. Kato, University of Tokyo, Tokyo, Japan | ||
| α-MEM | Corning | 10-022-CVR | |
| Glutamine | Gibico | 25030081 | |
| Penicillin streptomycin | Gibico | 15140122 | |
| Fetal calf serum | BioInd | 04-001-1A | |
| Recombinant mouse M-CSF protein | R&D | Q3U4F9 | |
| Recombinant mouse RANKL protein | R&D | Q3TWY5 | |
| RBC lysis buffer | Beyotime | C3702 | |
| Trypan blue | Sigma-Aldrich | 302643 | |
| Acetone | Shanghai Chemical Co. Ltd. | ||
| Citrate solution | Sigma-Aldrich | 915 | |
| Formaldehyde solution | Shanghai Chemical Co. Ltd. | ||
| Acid Phosphatase, Leukocyte (TRAP) Kit | Sigma-Aldrich | 387A-1KT | |
| Fast Garnet GBC Base solution | Sigma-Aldrich | 3872 | |
| Sodium Nitrite Solution | Sigma-Aldrich | 914 | |
| Naphthol AS-BI Phosphate Solution | Sigma-Aldrich | 3871 | |
| Acetate solution | Sigma-Aldrich | 3863 | |
| Tartrate solution | Sigma-Aldrich | 3873 | |
| Dulbecco's phosphate-buffered saline | Corning | 21-031-CVR | |
| L-tartaric acid | Sigma-Aldrich | 251380 | |
| Sodium tartrate dibasic dehydrate | Sigma-Aldrich | s4797 | |
| Glycine | Shanghai Chemical Co. Ltd. | ||
| MgCl2 | Shanghai Chemical Co. Ltd. | ||
| ZnCl2 | Shanghai Chemical Co. Ltd. | ||
| NaOH | Shanghai Chemical Co. Ltd. | ||
| Phosphatase substrate | Sigma-Aldrich | P4744 | |
| anti-Raptor | Cell Signaling Technology | 2280 | |
| anti-P-ribosomal protein S6 (S235/236) | Cell Signaling Technology | 2317 | |
| anti-ribosomal protein S6 | Cell Signaling Technology | 2211 | |
| anti-β-actin | Santa Cruz Biotechnology | sc-130300 | |
| 37% formaldehyde | Xilong scientific | ||
| polyvinylidene fluoride (PVDF) membrane | Bio-Rad | ||
| Western Chemiluminescent HRP Substrate (ECL) | Millipore | 00000367MSDS | |
| IX71 | Olympus | ||
| Envision | Perkin Elmer | ||
| 0.45-mm Syringe | |||
| Scissor | |||
| Mosquito forcep |
Ссылки
- Boyle, W. J., Simonet, W. S., Lacey, D. L. Osteoclast differentiation and activation. Nature. 423 (6937), 337-342 (2003).
- Jaenisch, R., Bird, A. Epigenetic regulation of gene expression: how the genome integrates intrinsic and environmental signals. Nature Genetics. 33, 245-254 (2003).
- Feng, X., McDonald, J. M. Disorders of bone remodeling. Annu Rev Pathol. 6, 121-145 (2011).
- Boyce, B. F. Advances in osteoclast biology reveal potential new drug targets and new roles for osteoclasts. J Bone Miner Res. 28 (4), 711-722 (2013).
- Ibbotson, K. J., Roodman, G. D., McManus, L. M., Mundy, G. R. Identification and characterization of osteoclast-like cells and their progenitors in cultures of feline marrow mononuclear cells. J Cell Biol. 99 (2), 471-480 (1984).
- Lacey, D. L., et al. Osteoprotegerin ligand is a cytokine that regulates osteoclast differentiation and activation. Cell. 93 (2), 165-176 (1998).
- Wong, B. R., et al. TRANCE is a novel ligand of the tumor necrosis factor receptor family that activates c-Jun N-terminal kinase in T cells. J Biol Chem. 272 (40), 25190-25194 (1997).
- Zoncu, R., Efeyan, A., Sabatini, D. M. mTOR: from growth signal integration to cancer, diabetes and ageing. Nat Rev Mol Cell Biol. 12 (1), 21-35 (2011).
- Bhaskar, P. T., Hay, N. The two TORCs and Akt. Dev Cell. 12 (4), 487-502 (2007).
- Dai, Q., et al. Inactivation of Regulatory-associated Protein of mTOR (Raptor)/Mammalian Target of Rapamycin Complex 1 (mTORC1) Signaling in Osteoclasts Increases Bone Mass by Inhibiting Osteoclast Differentiation in Mice. J Biol Chem. 292 (1), 196-204 (2017).
- Sambrook, J., Fritsch, E. F., Maniatis, T. . Molecular cloning: a laboratory manual. , (1989).
- Weischenfeldt, J., Porse, B. Bone Marrow-Derived Macrophages (BMM): Isolation and Applications. CSH Protoc. 2008, (2008).
- Bradley, E. W., Oursler, M. J. Osteoclast culture and resorption assays. Methods Mol Biol. 455, 19-35 (2008).
- Tevlin, R., et al. Osteoclast derivation from mouse bone marrow. J Vis Exp. (93), e52056 (2014).
- Xing, L., Boyce, B. F. RANKL-based osteoclastogenic assays from murine bone marrow cells. Methods Mol Biol. 1130, 307-313 (2014).
- Hsu, H., et al. Tumor necrosis factor receptor family member RANK mediates osteoclast differentiation and activation induced by osteoprotegerin ligand. Proc Natl Acad Sci U S A. 96 (7), 3540-3545 (1999).
- Underwood, J. C. From where comes the osteoclast?. J Pathol. 144 (4), 225-226 (1984).
- Wein, M. N., et al. Control of bone resorption in mice by Schnurri-3. Proc Natl Acad Sci U S A. 109 (21), 8173-8178 (2012).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены