Method Article
Una base de RANKL osteoclasto cultura ensayo de médula ósea de ratón para investigar el papel de mTORC1 en la formación de osteoclastos
* Estos autores han contribuido por igual
En este artículo
Resumen
Este manuscrito describe un protocolo para aislar y la cultura osteoclastos en vitro de médula ósea de ratón y para estudiar el papel de lo mamíferos/mecanicista Diana de la rapamicina 1 complejo en la formación de osteoclastos.
Resumen
Los osteoclastos son único hueso-resorbing células que diferencian del linaje monocito/macrófago de la médula ósea. Disfunción de los osteoclastos puede resultar en una serie de enfermedades metabólicas del hueso, incluyendo la osteoporosis. Para desarrollar objetivos de productos farmacéuticos para la prevención de pérdida de masa ósea patológica, se deben entender los mecanismos por el cual los osteoclastos diferencian de precursores. La capacidad de aislar y un gran número de osteoclastos en vitro la cultura es fundamental para determinar el papel de genes específicos en la diferenciación de los osteoclastos. Inactivación del mecanicista/mamíferos objetivo de rapamicina complejo 1 (TORC1) en osteoclastos puede disminuir el número de osteoclastos y aumenta la masa ósea; sin embargo, los mecanismos subyacentes requieren estudio adicional. En el presente estudio, se describe un protocolo basado en RANKL para aislar y cultura osteoclastos de médula ósea de ratón y estudiar la influencia de mTORC1 inactivación en la formación de osteoclastos. Este protocolo con éxito dio lugar a un gran número de osteoclastos gigantes, normalmente dentro de una semana. Supresión de Raptor deterioró la formación de osteoclastos y disminución de la actividad de la fosfatasa ácida tartrato resistente secretor, indicando que eso mTORC1 es fundamental para la formación de osteoclastos.
Introducción
El hueso es un órgano siempre-que cambia y es remodelado por osteoblastos y osteoclastos durante toda la vida. Osteoclastos se encargan de la resorción de la matriz mineralizada y osteoblastos sintetizan y secretan nuevo hueso matrices1. El equilibrio entre la reabsorción ósea y formación ósea es crucial para la salud de los huesos incluyendo el mantenimiento del hueso masa y respuesta a la estimulación y lesiones. Si este equilibrio se interrumpe, puede ocurrir una serie de enfermedades metabólicas óseas, incluyendo osteoporosis y enfermedades periodontales. En estas enfermedades, pérdida de masa ósea resultante de la resorción ósea osteoclástica supera el hueso formando capacidad de osteoblastos2,3. Así, con el fin de desarrollar objetivos farmacéuticos para tratar trastornos esqueléticos como la osteoporosis, es fundamental para entender la generación y la biología de osteoclastos4.
Osteoclastos son las células multinucleated gigante únicas localizadas en o cerca de la superficie del hueso y pertenecen a la familia de monocito/macrófago1. Ibbotson K. J., et al. informó un método para generar células similares a osteoclastos en vitro con medio que contiene 1,25-dihidroxi-vitamina D35. La identificación del factor estimulante de colonias de macrófagos (M-CSF) y el receptor activador del ligando de factor nuclear-κ B (RANKL) como factores esenciales de la formación de osteoclastos ha aumentado dramáticamente la eficiencia de la osteoclastogénesis in vitro 1 , 6 , 7. la capacidad de cultura osteoclastos en vitro ha mejorado nuestra comprensión de la generación y regulación de los osteoclastos.
El mecanicista/mamíferos objetivo de rapamicina (mTOR) funciones en dos complejos estructuralmente y funcionalmente distintos, a saber mTORC1 y mTORC28,9. Los dos complejos son distintos unos de otros debido a sus diferentes componentes y sustratos aguas abajo. mTORC1 contiene la única proteína reguladoras asociadas de mTOR (Raptor), mientras mTORC2 contiene al rapamicina insensible compañero de mTOR (Powder)9. mTORC1 pueden integrar y transmitir señales importantes para regular la diferenciación, proliferación y crecimiento celular. Recientemente, hemos demostrado que eso mTORC1 desempeña un papel clave en la red de la resorción ósea catabólica por la eliminación de Raptor para inactivar mTORC1 en osteoclastos10. Sin embargo, los mecanismos subyacentes requieren estudio adicional. En el presente estudio, se utilizó un método basado en RANKL osteoclastogenic generar osteoclastos macrófagos derivados de médula ósea (BMMs) de tipo salvaje (WT) y ratones RapCtsk y estudiar la influencia de mTORC1 inactivación en osteoclastos formación.
Protocolo
Todos los procedimientos relativos a los animales se realizaron según el protocolo aprobado por el Panel administrativo de Stanford en el laboratorio Animal Care (APLAC) y fueron aprobados por el cuidado de animales y uso del Instituto de Shanghai de Bioquímica y celular Biología.
1. preparación
- Generar ratones de eliminación específicas de Raptor en osteoclastos (Raptorfl/fl; Ctsk-cre, en adelante RapCtsk) apareamiento Raptorfl/fl ratones ratones de Ctsk-cre . Usar los ratones Raptorfl/fl como el control de peso en este estudio.
- Tener un recipiente con hielo para mantener el hueso aislado.
-
Preparar medio de cultivo.
- Preparar medio de cultivo MEM α complementando alfa medio esencial mínimo (α-MEM) con 1 x glutamina, penicilina-estreptomicina y 10% de suero de ternero fetal.
- Preparar el medio de inducción de macrófagos de médula ósea consisten en 50 mL de medio MEM α y M-CSF 20 ng/ml.
- Preparar el medio de inducción de osteoclastos que consta de M-CSF y RANKL a 20 ng/mL, respectivamente, en 50 mL de medio de α-MEM.
-
Preparar los siguientes buffers antes de la tinción de la trampa.
- Preparar la solución de fix de 6,5 mL de acetona, 2,5 mL de solución de citrato y 0,8 mL de solución de formaldehído (vol/vol) de 37%.
- Preparar solución de tinción de la trampa.
- Precaliente agua desionizada a 37 ° C.
- Añadir 100 μl de solución de base de GBC rápido granate y 100 μl de solución de nitrito de sodio en un microtubo de 1,5 mL y mezclar por inversión suave para 30 s. deje la mezcla reposar 2 minutos.
- Precalentamiento 9 mL de agua desionizada a 37 ° C. Añadir 200 μL de la solución base de GBC diazotado rápido granate de paso 1.4.2.2, 100 μl de solución de fosfato de naftol AS-BI, 400 μL de solución de acetato y 200 μL de solución de tartrato.
- Mantener la trampa de coloración de la solución de la mezcla en un baño de agua a 37 ° C.
-
Preparar el siguiente buffer antes de cuantificación de actividad de trampa del medio de cultivo.
- Preparar el tampón tartrato (50 mL): 2 mL de ácido L-tartárico de 0,33 M, 48 mL de tartrato de sodio de 0,33 M dibásico deshidratar. Ajustar el pH a 4.9.
- Preparar (200 mL) de tampón 4-nitrofenil fosfato disódico (pNFF): 1,502 g de glicina, 41 mg de MgCl2, 27,2 mg de vivencias2y 180 mL de agua desionizada. Ajustar el pH a 10.4 con 3 M NaOH y el volumen a 200 mL con agua desionizada.
- Preparar pNFF buffer con un sustrato de la fosfatasa (para una placa de 96 pocillos): 49,37 mg de sustrato de la fosfatasa y 175 μl de tampón de pNFF de paso 1.5.2.
- Preparación de buffer de sustrato (9 mL/96-well plate): 6,24 mL de agua desionizada, 360 μL de solución de acetato y 2,4 mL de buffer de tartrato. Mezclar por vortex y precaliente a 37 ° C antes de usar.
- Agregar 90 μL de tampón de pNFF con fosfatasa substrate(1.5.3) a 9ml de sustrato precalentado buffer(1.5.4) para hacer una mezcla de sustrato y de vortex por 10 s.
2. disección (día -1)
- Eutanasia por separado 3 one-month-old WT y RapCtsk ratones femeninos por CO2 . Realizar la inhalación de CO2 con el equipo adecuado por personal capacitado.
- Sumerja 6 ratones en un vaso de precipitados con 100 mL de etanol al 75% (vol/vol) durante 5 min evitar la contaminación bacteriana y luego colocar en una mesa de disección en una posición supina. Hacer una incisión en la parte distal de la tibia vertical y disecar la piel a lo largo de las extremidades con las tijeras oftálmicas.
- Cortar el ligamento intraarticular de la articulación de la cadera con unas tijeras y dislocar los miembros posteriores del tronco.
- Cortar el ligamento articular de la articulación de la rodilla y disociar cuidadosamente la tibia y el fémur de articulación de la rodilla. Retire con cuidado el tejido suave con las tijeras.
- Colocar todos los huesos de un genotipo en de un ratón en cada pocillo de una placa de 6 pozos con 2 mL de α-MEM en el hielo.
Nota: Para preservar la viabilidad celular, el hueso debe ser mantenido en estas condiciones por menos de 1 h.
3. aislamiento (día -1)
- Llenar un pocillo de una placa de seis pozos con etanol al 75% (3 mL) y los otros 5 pozos con medio de α-MEM (3 mL).
- Poner todos los huesos de un genotipo en el lavado de etanol para 15 huesos s y lavar 5 veces con medio de α-MEM de 10 s cada vez.
- Cortar las epífisis con la tijera e Inserte una aguja de jeringa 0.45 mm en la cavidad y lavado médula hacia fuera con medio MEM de α en un tubo de centrífuga de 50 mL.
- Limpie la cavidad del hueso utilizando el mismo método desde el otro extremo del hueso. Repetir al menos dos veces para lavar la cavidad ósea completamente hasta que el hueso es pálido.
- La médula ósea para obtener un pellet de células a 800 x g y 4 ° C por 5 min aspirar el sobrenadante de la centrífuga.
- Añadir 3 mL de tampón de lisis de glóbulos rojos en el tubo de centrífuga y la pipeta suavemente para Resuspender la médula ósea. Mantenga el tubo de centrífuga en el hielo durante 8 min a lyse células de sangre rojas.
- Añadir 6 mL de medio MEM de α en el tubo de la centrífuga para detener la lisis celular. Centrifugar a 500 x g y 4 ° C por 10 min y aspirar el sobrenadante.
- Resuspender en 3 mL de medio de cultivo MEM α y colocar las células en una placa seis-bien (generalmente un ratón por pozo).
- Incubar a 37 ° C en un incubador de 5% CO2 durante la noche.
4. galjanoplastia (día 0)
- Transferir el sobrenadante a un tubo de centrífuga de 15 mL para recoger células sueltas a la mañana siguiente.
- Centrifugue a 800 x g y 4 ° C por 5 min y aspirar el sobrenadante.
- Resuspender en 4 mL de medio de cultivo MEM α.
- Tomar 20 μl de la solución de células y mezclar con 20 μl de azul tripán. Añadir 10 μl de la mezcla a la cámara de conteo y obtener el conteo de células por mL de solución.
- Añadir un volumen adecuado de medio de cultivo MEM α para obtener una solución de celdas de 500.000 células/mL.
- Añadir 500 μl y 50 μl de medio de inducción de macrófagos de médula ósea en cada pocillo de una placa de 24 pozos y placa de 96 pocillos, respectivamente.
- Añadir 500 μl y 50 μl de la solución celular en cada pocillo de una placa de 24 pozos y placa de 96 pocillos, respectivamente.
- Incubar a 37 ° C en un incubador de 5% CO2 durante 3 días.
5. diferenciación (días 3-7)
- Tres días después de la galjanoplastia, recoger 50 μl de medio de cada pocillo de la placa de 96 pozos y congelar a-20 ° C y luego aspirar el medio residual.
- Añadir 1 mL y 100 μl de los osteoclastos inducción de medio en cada pocillo de una placa de 24 pocillos y una placa de 96 pozos, respectivamente.
- Incubar a 37 ° C durante 2 días.
- Recoger 50 μl del medio de cada pozo y aspirar el medio residual.
- Añadir el medio de inducción de osteoclastos en cada pozo.
- Incubar a 37 ° C por 1 día.
Nota: En este momento, grandes, multinucleados osteoclastos puede considerarse bajo un microscopio invertido (figura 2A). - Si no se observan osteoclastos, cambiar el medio de inducción de los osteoclastos y observar todos los días hasta que aparecen los osteoclastos.
- Recoger 50 μl del medio de cada pocillo de la placa de 96 pocillos después de osteoclastos han formado.
6. tartrato fosfatasa ácida resistente (TRAP) tinción
Nota: Los osteoclastos maduros pueden presentar después de 6-7 días de cultivo en vitro (paso 4).
- Medio de aspirar y lavar suavemente 3 veces con 1 x PBS.
- Fijar las células en cada pocillo de la placa de 96 pocillos con 100 μl de solución de solución de 30 s a temperatura ambiente.
- Después de la fijación, Aspire la solución de fix y lavar suavemente 3 veces con agua desionizada precalentada a 37 ° C. Aspire agua desionizada.
- Añada 100 μl de mancha de trampa en cada pocillo de la placa de 96 pocillos y colocar la placa en una incubadora a 37 ° C por 30 min y protector de la luz.
- Después de la tinción, Aspire la mancha trampa y suavemente Lave 3 veces con agua desionizada.
- Osteoclastos de imagen usando un microscopio invertido con 40 aumentos.
7. la trampa cuantificación de actividad de medio de cultivo
- Recoger el sobrenadante de la cultura de 30 μl de cada pocillo de la placa de 96 pocillos en el paso 5.1, 5.4 y 5.8; Utilizar 30 μl de medio de inducción no cultivadas de los osteoclastos como control negativo. Coloque las muestras en una nueva placa de 96 pocillos.
- Agregar 90 μL de substrato mixture(1.5.5) en cada pocillo de la placa de 96 pocillos.
- Colocar la placa en una incubadora a 37 ° C por 1 h y escudo de la luz.
- Detener la reacción agregando 50 μl de NaOH M 3 en cada pocillo de la placa de 96 pocillos.
- Medida theabsorbance en la longitud de onda de 405 nm.
8. Western Blotting
Nota: Después de 6-7 días de cultivo en vitro en la placa de 24 pocillos, osteoclastos maduros deben ser visibles.
- Aspire el medio.
- Lave suavemente con pre-enfriado de 1 x PBS 3 veces.
- Aspire el PBS.
- Añada 100 μl de 1 x SDS lysis buffer que contiene inhibidor de la proteasa cóctel.
- Lisados de calor a 105 ° C por 10 min y centrifugar a 12.000 x g y 4 ° C durante 10 minutos recogen el sobrenadante que contiene las proteínas.
- Separe los lisados que contiene 30 μg de proteína 10% SDS-PAGE11 y luego se transfieren a una membrana de polivinilideno (PVDF) de fluoruro.
- Bloquear las membranas con leche descremada en polvo 5% durante 30 minutos.
- Incubar las membranas con el Raptor, anti-P-S6, S6 anti, anti-β-actina en el 1:1,000 de dilución de leche descremada 5% a 4 ° C durante la noche.
- Lavar las membranas con Tris amortiguada salina con Tween-20 (TBST) por 10 min a temperatura ambiente.
- Repita el paso 8.9 dos veces.
- Incubar las membranas con peroxidasa de rábano (HRP)-conjugado de anticuerpos IgG anti-ratón o conejo en 1:5,000 dilución en la leche descremada en polvo 5% durante 1 h a temperatura ambiente.
- Lavar las membranas 3 veces con TBST durante 10 min a temperatura ambiente.
- Para detección quimioluminiscente, añadir sustrato quimioluminiscente occidental de HRP en las membranas e incubar 5 min a temperatura ambiente. Drenar el sustrato sobrante y exponer la bienvenida a la película de rayos x.
Resultados
Mediante el presente Protocolo, un gran número de osteoclastos gigantes fueron visto el día 6; Si no se observan osteoclastos gigantes, un día más de diferenciación de osteoclastos puede ser necesario (figura 1). Formación de osteoclastos exitosa fue confirmada por trampa de tinción (figura 2A). Osteoclastos son células de color rojo/morado vino gigantes con más de 3 núcleos. Más de 250 osteoclastos se obtuvieron en cada pocillo de la placa de 96 pocillos en WT BMMs (Figura 4A).
Supresión del Raptor fue confirmada por western blot análisis y la inactivación de mTORC1 fue determinada por una disminución en la fosforilación de la proteína ribosomal S6 (P-S6), que es ampliamente utilizada como la lectura de mTORC1 (figura 3).
El número de osteoclastos trampa positivo disminuido en RapCtsk BMMs comparados con el grupo de peso (Figura 4A), que indica que la deficiencia de Raptor deteriorada la formación de los osteoclastos.
La actividad secretora trampa es importante para la resorción del hueso, y actividad de la trampa en el medio de cultivo se analizó en el presente estudio. Como se muestra en la Figura 4B, trampa actividad aumentó debido al estímulo de RANKL en WT y RapCtsk BMMs. Además, trampa actividad disminuida en RapCtskBMMs comparados con el correspondiente grupo WT (P < 0,05).
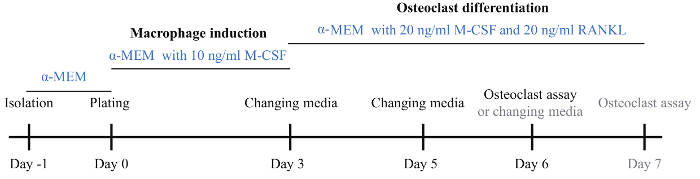
Figura 1: esquema del Protocolo de inducción osteoclasta. BMMs fueron aislados el día 1 y se incubó con medio básico α-MEM durante la noche. En el día 0, BMMs fueron recogidos y plateados sobre una placa de 96 pocillos y placa de 24 pozos seguido por la incubación en medio α-MEM con 10 ng/mL M-CSF. El día 3, el medio fue cambiado por medio de α-MEM con 20 ng/mL M-CSF y 20 ng/mL RANKL para la inducción de la diferenciación de los osteoclastos. El día 5, cambió el medio de diferenciación de osteoclastos. El día 6, un gran número de osteoclastos era visible y se realizaron ensayos de osteoclastos. Si no se veían los osteoblastos, cambió el medio de inducción de los osteoclastos e incubación seguido por un día más. Haga clic aquí para ver una versión más grande de esta figura.

Figura 2: vista representativa de osteoclastos. (A) gigante osteoclastos observaron en campo brillante el día 6. La línea roja indica la frontera de los osteoclastos. (B) A típicamente gigantes, multinucleados, trampa positiva (rojo vino) osteoclastos. La flecha negra indica dos núcleos de los osteoclastos multinucleados. Haga clic aquí para ver una versión más grande de esta figura.
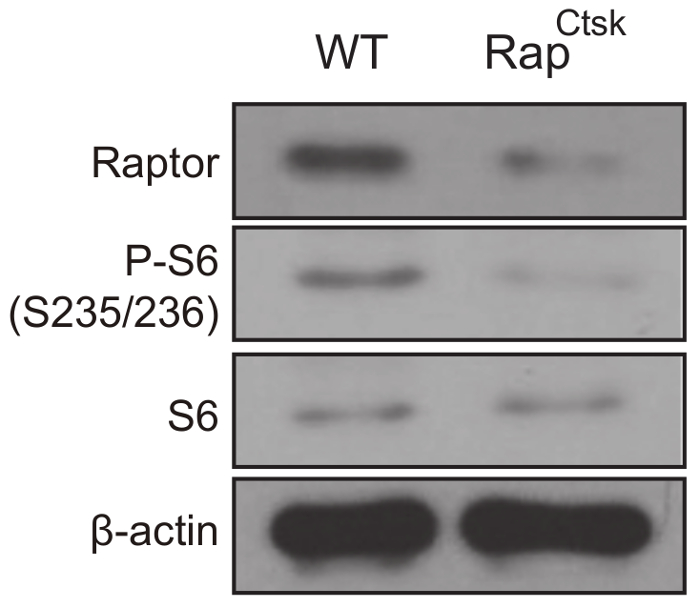
Figura 3: inactivación de mTORC1 en RapCtsk BMMs. Western Blot análisis de expresión de Raptor, P-S6 y S6 en WT y RapCtsk BMMs el día 6. Haga clic aquí para ver una versión más grande de esta figura.

Figura 4: Eliminación de Raptor deteriorada formación osteoclastos. (A) trampa de tinción de BMMs el día 6. Imágenes de gran aumento de las plazas en los grupos de peso y RapCtsk se muestran, respectivamente. Hubo menos gigantes, osteoclastos positivos trampa formados en el RapCtsk BMMs en comparación con el grupo de peso. Actividad (B) trampa de cultivado WT y representan datos BMMs. RapCtsk medios ± tiene P < 0.05, n = 3. Haga clic aquí para ver una versión más grande de esta figura.
Discusión
El ensayo de osteoclastogenic es el método más utilizado para aislar y cultura osteoclastos en vitro12,13. Mientras que varias inducciones basadas en RANKL osteoclasto se han descrito13,14,15, el presente estudio describe un protocolo con algunas modificaciones basadas en los métodos anteriores.
En el estudio anterior, eran placas BMMs inmediatamente después aislamiento14,15. Se recomienda que BMMs fueron cultivadas con medio de base durante la noche antes de galjanoplastia a BMMs aíslan las células madre mesenquimales y los fibroblastos que se adhieren inmediatamente al plato. M-CSF puede promover la proliferación de monocitos a los precursores de los osteoclastos y estimula precursores de osteoclastos para expresar el rango que se une el RANKL y luego induce la formación de osteoclastos maduros6,16,17. Por lo tanto, en nuestro estudio, el BMMs fueron inducidos con 10 ng/mL M-CSF durante 3 días antes de la inducción de los osteoclastos, en cambio para la inducción de osteoclastos en el segundo día después de15de la galjanoplastia. La densidad celular es crítica para la formación de osteoclastos in vitro. Es aconsejable que 25.000 BMMs fueron sembradas en cada pozo de un siguiente placa de 96 pozos de incubación de 3 días con 10 ng/mL M-CSF. Cuando la confluencia celular alcanza 80-90%, es un tiempo adecuado para la inducción de osteoclastos de RANKL. Generalmente, madura forma de osteoclastos en día 6. La razón más común para algunos osteoclastos es densidad subóptima de la célula, que puede ser el resultado de una baja densidad de siembra o de viabilidad celular baja. BMMs son delicadas células primarias y deben tratarse con cuidado. Mantener el hueso en el hielo durante mucho tiempo o resuspender vigorosamente disminuye la viabilidad de BMMs y posteriormente deteriora la formación de osteoclastos. Así, la densidad de siembra óptima de BMMs viables es crítica para la obtención de un gran número de osteoclastos.
La actividad secretora trampa es crítica para la resorción ósea osteoclástica. En este estudio, se describe un método para analizar cuantitativamente la actividad secretora de la trampa en el medio de cultivo. El cambio de actividad de la trampa en el medio de cultivo puede resultar de cambios de número de osteoclastos o trampa secretor de osteoclastos o una combinación de ambos. Así, esto puede ser un método útil para analizar los osteoclastos función en vitro junto con el ensayo de la resorción osteoclasta había descrito previamente18.
mTOR es una evolutivamente conservado proteína quinasa que puede regular el metabolismo y la diferenciación de la célula9. En este estudio, hemos encontrado que mTORC1 desempeñó un papel importante en la resorción ósea mediante la regulación de la formación de los osteoclastos. mTORC1 puede ser una diana potencial farmacológica para el tratamiento de enfermedades metabólicas del hueso como la osteoporosis en el futuro.
En Resumen, nuestro protocolo para la inducción de los osteoclastos con éxito dio lugar a un gran número de osteoclastos gigantes en vitro y nuestros datos sugieren que mTORC1 es fundamental para la formación de osteoclastos.
Divulgaciones
Todos los autores afirman que tienen no hay conflictos de intereses.
Agradecimientos
Los autores agradecen a Dr. Minghan Tong y S. Kato para ratones y reactivos que amablemente. Agradecemos a los miembros del laboratorio de Zou para discusiones útiles. Este trabajo fue apoyado en parte por subvenciones de 973 programa del Ministerio Chino de ciencia y tecnología (MOST) [2014CB964704 y 2015CB964503], programa de investigación clínica del Hospital de 9 personas, Shanghai Jiao Tong University School of Medicine. Gracias por la ayuda de instalaciones centrales para la biología de la célula e instalaciones centrales de Biología química, CAS centro de excelencia en Ciencia Molecular de la célula, Instituto Shanghai de Bioquímica y biología celular, Academia China de Ciencias.
Materiales
| Name | Company | Catalog Number | Comments |
| Raptorfl/fl mice | The Jackson Laboratory | 013188 | |
| Ctsk-cre mice | a gift from S. Kato, University of Tokyo, Tokyo, Japan | ||
| α-MEM | Corning | 10-022-CVR | |
| Glutamine | Gibico | 25030081 | |
| Penicillin streptomycin | Gibico | 15140122 | |
| Fetal calf serum | BioInd | 04-001-1A | |
| Recombinant mouse M-CSF protein | R&D | Q3U4F9 | |
| Recombinant mouse RANKL protein | R&D | Q3TWY5 | |
| RBC lysis buffer | Beyotime | C3702 | |
| Trypan blue | Sigma-Aldrich | 302643 | |
| Acetone | Shanghai Chemical Co. Ltd. | ||
| Citrate solution | Sigma-Aldrich | 915 | |
| Formaldehyde solution | Shanghai Chemical Co. Ltd. | ||
| Acid Phosphatase, Leukocyte (TRAP) Kit | Sigma-Aldrich | 387A-1KT | |
| Fast Garnet GBC Base solution | Sigma-Aldrich | 3872 | |
| Sodium Nitrite Solution | Sigma-Aldrich | 914 | |
| Naphthol AS-BI Phosphate Solution | Sigma-Aldrich | 3871 | |
| Acetate solution | Sigma-Aldrich | 3863 | |
| Tartrate solution | Sigma-Aldrich | 3873 | |
| Dulbecco's phosphate-buffered saline | Corning | 21-031-CVR | |
| L-tartaric acid | Sigma-Aldrich | 251380 | |
| Sodium tartrate dibasic dehydrate | Sigma-Aldrich | s4797 | |
| Glycine | Shanghai Chemical Co. Ltd. | ||
| MgCl2 | Shanghai Chemical Co. Ltd. | ||
| ZnCl2 | Shanghai Chemical Co. Ltd. | ||
| NaOH | Shanghai Chemical Co. Ltd. | ||
| Phosphatase substrate | Sigma-Aldrich | P4744 | |
| anti-Raptor | Cell Signaling Technology | 2280 | |
| anti-P-ribosomal protein S6 (S235/236) | Cell Signaling Technology | 2317 | |
| anti-ribosomal protein S6 | Cell Signaling Technology | 2211 | |
| anti-β-actin | Santa Cruz Biotechnology | sc-130300 | |
| 37% formaldehyde | Xilong scientific | ||
| polyvinylidene fluoride (PVDF) membrane | Bio-Rad | ||
| Western Chemiluminescent HRP Substrate (ECL) | Millipore | 00000367MSDS | |
| IX71 | Olympus | ||
| Envision | Perkin Elmer | ||
| 0.45-mm Syringe | |||
| Scissor | |||
| Mosquito forcep |
Referencias
- Boyle, W. J., Simonet, W. S., Lacey, D. L. Osteoclast differentiation and activation. Nature. 423 (6937), 337-342 (2003).
- Jaenisch, R., Bird, A. Epigenetic regulation of gene expression: how the genome integrates intrinsic and environmental signals. Nature Genetics. 33, 245-254 (2003).
- Feng, X., McDonald, J. M. Disorders of bone remodeling. Annu Rev Pathol. 6, 121-145 (2011).
- Boyce, B. F. Advances in osteoclast biology reveal potential new drug targets and new roles for osteoclasts. J Bone Miner Res. 28 (4), 711-722 (2013).
- Ibbotson, K. J., Roodman, G. D., McManus, L. M., Mundy, G. R. Identification and characterization of osteoclast-like cells and their progenitors in cultures of feline marrow mononuclear cells. J Cell Biol. 99 (2), 471-480 (1984).
- Lacey, D. L., et al. Osteoprotegerin ligand is a cytokine that regulates osteoclast differentiation and activation. Cell. 93 (2), 165-176 (1998).
- Wong, B. R., et al. TRANCE is a novel ligand of the tumor necrosis factor receptor family that activates c-Jun N-terminal kinase in T cells. J Biol Chem. 272 (40), 25190-25194 (1997).
- Zoncu, R., Efeyan, A., Sabatini, D. M. mTOR: from growth signal integration to cancer, diabetes and ageing. Nat Rev Mol Cell Biol. 12 (1), 21-35 (2011).
- Bhaskar, P. T., Hay, N. The two TORCs and Akt. Dev Cell. 12 (4), 487-502 (2007).
- Dai, Q., et al. Inactivation of Regulatory-associated Protein of mTOR (Raptor)/Mammalian Target of Rapamycin Complex 1 (mTORC1) Signaling in Osteoclasts Increases Bone Mass by Inhibiting Osteoclast Differentiation in Mice. J Biol Chem. 292 (1), 196-204 (2017).
- Sambrook, J., Fritsch, E. F., Maniatis, T. . Molecular cloning: a laboratory manual. , (1989).
- Weischenfeldt, J., Porse, B. Bone Marrow-Derived Macrophages (BMM): Isolation and Applications. CSH Protoc. 2008, (2008).
- Bradley, E. W., Oursler, M. J. Osteoclast culture and resorption assays. Methods Mol Biol. 455, 19-35 (2008).
- Tevlin, R., et al. Osteoclast derivation from mouse bone marrow. J Vis Exp. (93), e52056 (2014).
- Xing, L., Boyce, B. F. RANKL-based osteoclastogenic assays from murine bone marrow cells. Methods Mol Biol. 1130, 307-313 (2014).
- Hsu, H., et al. Tumor necrosis factor receptor family member RANK mediates osteoclast differentiation and activation induced by osteoprotegerin ligand. Proc Natl Acad Sci U S A. 96 (7), 3540-3545 (1999).
- Underwood, J. C. From where comes the osteoclast?. J Pathol. 144 (4), 225-226 (1984).
- Wein, M. N., et al. Control of bone resorption in mice by Schnurri-3. Proc Natl Acad Sci U S A. 109 (21), 8173-8178 (2012).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados