Method Article
Время-замедление конфокальной визуализации мигрирующих нейронов в органотипической культуре срезов мозга эмбриональной мыши с использованием
В этой статье
Резюме
Этот протокол содержит инструкции по прямому наблюдению радиально мигрирующих кортикальных нейронов. При внутриутробной электропорации органотипическая культура срезов и временная конфокальная визуализация объединяются для непосредственного и динамического изучения эффектов избыточной экспрессии или снижения регуляции генов, представляющих интерес в мигрирующих нейронах, и анализа их дифференциации во время развития.
Аннотация
В утробе электропорация представляет собой быстрый и мощный подход к изучению процесса радиальной миграции в коре головного мозга развивающихся эмбрионов мыши. Это помогло описать различные этапы радиальной миграции и характеризовать молекулярные механизмы, контролирующие этот процесс. Чтобы напрямую и динамически анализировать миграционные нейроны, их нужно отслеживать с течением времени. В этом протоколе описывается рабочий процесс, который сочетается в электропорации с маточно- органическим строением с органотипической культурой срезов и временным конфокальным отображением, что позволяет провести прямой анализ и динамический анализ радиально мигрирующих кортикальных нейронов. Кроме того, возможна подробная характеристика мигрирующих нейронов, таких как скорость миграции, профили скорости, а также изменения радиальной ориентации. Этот метод может быть легко адаптирован для проведения функционального анализа генов, представляющих интерес для радиально мигрирующих корковых нейронов, путем потери и усиления функции, а также спасательных экспериментов. Промежуток времениВизуализация мигрирующих нейронов - это современная техника, которая когда-то была создана, является мощным инструментом для изучения развития коры головного мозга в моделях нейронов миграции мышц.
Введение
Неокортекс является основным сайтом когнитивных, эмоциональных и сенсомоторных функций. Он состоит из шести горизонтальных слоев, ориентированных параллельно поверхности мозга. Во время развития клетки-предшественники в боковой стенке дорсального telencephalon приводят к появлению проекционных нейронов, которые мигрируют радиально к поверхности пиала и приобретают характер нейронов типа типа. После генерации в желудочковых / субвентрикулярных зонах (VZ / SVZ) эти нейроны становятся кратковременно многополярными и замедляют их миграцию. После короткого пребывания в промежуточной зоне (IZ) они переключаются на биполярную морфологию, прикрепляются к радиальному глиальному каркасу и продолжают радиально ориентированную миграцию в кортикальную пластинку (СР). По достижении конечной целевой проекции нейроны отделяются от процессов радиального глиального процесса и приобретают специфическую для слоя идентичность. Мутации в генах, влияющих на различные стадии миграции нейронов, могут вызывать сильную кортикальную мальформацию, такую как lissencEphaly или гетеротопия белого вещества 1 , 2 .
В утробе электропорация является быстрой и мощной методикой для трансфекции нейронных клеток-предшественников в развивающемся мозге эмбрионов грызунов 3 , 4 . С помощью этой методики можно подвергать нокдаун и / или сверхэкспрессировать гены, чтобы изучить их функции в развитии нейронов. Этот метод специально помог описать морфологические детали и характеризовать молекулярные механизмы процесса радиальной миграции 5 , 6 , 7 , 8 , 9 . Радиально мигрирующие нейроны подвергаются динамическим изменениям в форме клеток, скорости миграции, а также миграционному направлению, которые требуют постоянного и непрерывного наблюдения с течением времени. Органотипический кусочекПовторное и временное конфокальное изображение электропористых головных мозгов позволяют непосредственно наблюдать миграционные нейроны с течением времени. Используя этот комбинированный подход, можно проанализировать отдельные особенности мигрирующих нейронов, которые невозможно исследовать в фиксированных участках ткани электропористых головных мозга.
Недавно мы применяли временную конфокальную визуализацию мигрирующих нейронов в срезах культур электропористых головных мозгов для изучения роли фактора ВЛ-лимфомы 11-й клетки (Bcl11a) транскрипции в процессе развития коры 10 . Bcl11a экспрессируется в молодых мигрирующих кортикальных нейронах, и мы использовали условный мутант Bcl11a allele ( Bcl11a flox ) 11 для изучения его функций. Электропорация рекомбиназы Cre вместе с зеленым флуоресцентным белком (GFP) в корковые предшественники мозга Bcl11a flox / flox позволила нам создать мозаичную мутантную ситуацию, в которой только несколько клеток мутировали вВ противном случае фон дикого типа. Таким образом, можно было изучить автономные функции клеток Bcl11a на уровне отдельных ячеек. Мы обнаружили, что мутантные нейроны Bcl11a демонстрируют пониженную скорость, сдвигают их профили скорости, а также случайные изменения ориентации во время их миграции 10 . В описываемом протоколе мы описываем рабочий процесс для успешной электропорации и подготовки культуры среза 12 мозга мыши, а также временную конфокальную визуализацию культур срезов кортикального слоя.
протокол
Все экспериментальные процедуры были одобрены Комитетом по защите животных (Regierungspräsidium Tübingen) и проводились в соответствии с Законом о благосостоянии Германии и Директивой ЕС 2010/63 / EU.
1. В Утероэлектропорации
- Микроинъекционные иглы
- Потяните капилляры из боросиликатного стекла (наружный диаметр: 1,0 мм, внутренний диаметр: 0,58 мм, длина: 100 мм) в иглы для микроинъекции с помощью съемника микропипетки с коробчатой нитью (2,5 мм х 2,5 мм) и следующей программой: ТЕПЛО: 540, PULL : 125, VELOCITY: 20 и DELAY: 140. Определите значение HEAT для каждой отдельной нити, выполнив тест RAMP (значение HEAT: RAMP + 25).
- Конические иглы под углом 38 ° и скоростью от среднего до высокого оборота с помощью микротрещителя для получения размера наконечника от 20 до 30 мкм для инъекций в эмбриональный день (E) 13,5 или менее и от 30 до 40 мкм для инъекций на более ранних эмбриональныхэтапы. Для хранения, исправьте иглы в коробке или чашке Петри с модельной глиной, чтобы предотвратить повреждение кончиков.
- Решение плазмидной ДНК
- Подготовьте плазмидную ДНК-конструкцию, содержащую флуоресцентный репортерный белок ( например, GFP), используя комплект для подготовки максимума без эндотоксина в соответствии с инструкциями производителя.
- Разбавьте раствор плазмидной ДНК до конечной концентрации 1 - 2 мкг / мкл в бесконтактном буфере Tris-EDTA без эндотоксина, содержащем Fast Green при конечной концентрации 0,01%. Aliquot и хранить при -20 ° C.
- Бактериостатический раствор хлорида натрия
- Подготовьте бактериостатический раствор хлорида натрия, добавив бензиловый спирт до конечной концентрации 0,9% к изотоническому 0,9% раствору хлорида натрия. Стерильный фильтр сразу перед использованием.
- Решение для инъекций Carprofen
- Подготовьте раствор для инъекций карпрофенаДобавление карпрофена до конечной концентрации 0,5 мг / мл до стерильного изотонического 0,9% раствора хлорида натрия. Хранить при температуре 4 ° C в течение 28 дней.
- Анестезия, инъекция ДНК и электропорация
- Взвесьте беременную мышь, рассчитанную на E14.5, и поместите ее в прозрачную камеру для анестезии, соединенную с испарителем и насыщенной 5% изофлураном. Когда животное находится в бессознательном состоянии, перенесите его на обезболивающую маску, прикрепленную к нагревательной пластине 37 ° C, и держите ее под наркозом с 1,8 - 2,2% изофлурана.
Примечание. Оцените развитие хирургического обезболивания путем потери хвостового пинча и педальных рефлексов (пальцевый контакт). - Для обезболивания вводят 100 мкл раствора для инъекций карпрофена на 10 мг массы тела мыши (5 мг / кг тела) подкожно. Поверните мышь спиной вниз и тщательно накройте глаза вазелином, чтобы они не высыхали.
- Мягко разложите конечности и исправьте ихК нагревательной пластине с хирургической лентой. Стерилизуйте брюшную полость с 70% этанолом, а затем раствором йода (7,5 мг / мл) с использованием целлюлозных тампонов. Повторите эту процедуру три раза, чтобы обеспечить надлежащую дезинфекцию.
- Накройте брюшко стерильной марлей, в которой разрез разрезан, чтобы освободить поле (диаметр: 2 - 2,5 см) для абдоминального разреза. Смочите марлю бактериостатическим раствором хлорида натрия.
Осторожно: переоцените развитие хирургической анестезии путем потери педального рефлекса. - Используя щипцы Micro Adson (зубчатые, длина: 12 см) и тонкие ножницы (под углом к боку, длина: 9 см) обрезают кожу примерно на 1,5 см вдоль средней линии живота. Вырежьте основной мышцы вдоль линии альба.
- Удалите один рог матки с помощью круглых щипцов (длина: 9 см, наружный диаметр: 3 мм, внутренний диаметр: 2,2 мм) и аккуратно поместите его на смоченную марлю.
Осторожно: Держите маточный рог с помощью пинцеты только между эмбрионами иD не нарушать плаценты или сосуды снабжения. Держите матку влажной в любое время с бактериостатическим раствором хлорида натрия. - Осторожно поместите эмбрион с пинцетом в кольцо и найдите боковой желудочек, который представляет собой полумесяц в форме тени, параллельной сагиттальному синусу. Место инъекции находится примерно в середине линии между пигментированным глазом и слиянием пазух, где сагиттальный синус отходит на две поперечные пазухи. Вдавите иглу микроинъекции через стенку матки и в боковой желудочек.
Примечание: Если необходимо, глубина впрыска может быть исправлена путем втягивания иглы. - Внесите от 1 до 2 мкл раствора ДНК в боковой желудочек с помощью микроинъектора, который работает с педалью, используя следующие настройки: 25 фунтов на квадратный дюйм, от 10 до 20 мс на импульс и от 5 до 10 импульсов. Успешная инъекция может контролироваться цветным раствором ДНК, который должен заполнять желудочковую систему.
- Поместите пинцетные электроды (диаметр 3 мм для E13.5 или моложе и диаметром 5 мм для E14.5 или старше) таким образом, чтобы «положительный» терминал находился на той же стороне, что и вводимый желудочек, и «отрицательный» Терминал находится на противоположной стороне вводимого желудочка ниже уха головки эмбриона.
- Смочите сайт электропорации несколькими каплями бактериостатического раствора хлорида натрия и примените 5 импульсов электрического тока (35 В для E13.5 или младше и 40 В для E14.5 или старше) продолжительностью 50 мс с интервалами 950 мс.
Примечание: Для успешной электропорации обычно достаточны токи от 60 до 90 мА. Более низкие токи не будут эффективно трансфектировать нейроны, тогда как более высокие токи могут привести к эмбриональной смерти. - Повторите процедуру (см. Шаг 1.5.7 - 1.5.10.) Для каждого эмбриона рога матки и аккуратно поместите его обратно в брюшную полость.
- Удалите рог матки с другой стороны и повторите процедуруКоторое описано в шаге 1.5.7. До 1.5.11.
- Закройте брюшную полость, наложив мышечный слой, прежде чем накладывать шов с помощью щипцов Micro Adson, держателя иглы Mathieu (карбида вольфрама, длина 14 см) и неабсорбируемого хирургического шва (3/8 круга, 13 мм, точки конуса).
Осторожно: будьте осторожны, чтобы не запечатлеть матку или другие органы во время шва. - Осторожно продезинфицируйте шов с раствором йода (7,5 мг / мл) и аккуратно удалите периокулярный избыток вазелина с использованием целлюлозных мазков. Поместите мышь под инфракрасную лампу, пока она не проснется. В течение следующих двух дней внимательно следите за мышью. Повторите лечение анальгезией, как описано в шаге 1.5.2 через 12-24 часа.
- Взвесьте беременную мышь, рассчитанную на E14.5, и поместите ее в прозрачную камеру для анестезии, соединенную с испарителем и насыщенной 5% изофлураном. Когда животное находится в бессознательном состоянии, перенесите его на обезболивающую маску, прикрепленную к нагревательной пластине 37 ° C, и держите ее под наркозом с 1,8 - 2,2% изофлурана.
2. Органотипическая культура среза
- Ламининовый раствор
- Растворить 1 мг лиофилизированного ламинина в стерильной воде с получением 1 мг / мл исходного раствора ламинина. Подготовьте 50 мкл аликвот аИ хранить при -80 ° C.
- Поли-L-лизин
- Растворить 50 мг поли-L-лизина в стерильной воде для получения 1 мг / мл раствора поли-L-лизина. Подготовьте аликвоты по 0,5 мл и храните при -20 ° C.
- Полное сбалансированное солевое решение Хэнка (полный HBSS)
- Подготовьте полный HBSS, объединив 50 мл 10-кратного раствора HBSS, 1,25 мл буфера 1 М HEPES (рН 7,4), 15 мл 1 М раствора D-глюкозы, 5 мл 100 мМ раствора хлорида кальция, 5 мл 100 мМ сульфата магния Раствором и 2 мл 1 М раствора гидрокарбоната натрия. Добавьте стерильную воду до 0,5 л, стерильный фильтр и храните при температуре 4 ° C.
- Культура среза
- Объединить 35 мл базового среднего орла (BME), 12,9 мл полной HBSS (см. Раздел 2.3.1), 1,35 мл 1 М D-глюкозы, 0,25 мл 200 мМ L-глутамина и 0,5 мл пенициллина-стрептомицина до Получают 50 мл культуры срезасредний. Стерильный фильтр и добавьте лошадиную сыворотку до конечной концентрации 5%. Хранить при температуре 4 ° C в течение 4 недель.
- Решение агарозы с низкой точкой плавления (LMP)
- Подготовьте 3% раствор ЛАМ-агарозы путем растворения 1,5 г LMP-агарозы в 50 мл полного HBSS путем нагревания в микроволновой печи в течение 1-2 мин при промежуточной мощности.
Примечание: тщательно нагревайте тепло, чтобы предотвратить переполнение во время кипения. - Разместите раствор на водяной бане при температуре 38 ° C до готовности к использованию. Хранить при температуре 4 ° C и повторно использовать один раз.
- Подготовьте 3% раствор ЛАМ-агарозы путем растворения 1,5 г LMP-агарозы в 50 мл полного HBSS путем нагревания в микроволновой печи в течение 1-2 мин при промежуточной мощности.
- Покрытие мембранных вставок
- Добавьте одну аликвоту исходного раствора ламинина (см. Этап 2.1.1) и одну аликвоту исходного раствора поли-L-лизина (см. Этап 2.2.1) до 6 мл стерильной воды для получения раствора для покрытия (достаточно для 6 вставок) ,
- Поместите мембранные вставки в 6-луночный планшет, содержащий 2 мл стерильной воды в нижней части каждой лунки. Добавить 1 мл раствора для покрытия(См. Шаг 2.6.1.) Поверх каждой мембраны и инкубировать в течение ночи при 37 ° С и 5% атмосфере двуокиси углерода.
Примечание. Используйте только вставки с оптически прозрачными мембранами, такими как мембрана из политетрафторэтилена (PTFE). - Промывайте мембраны три раза 1 мл стерильной воды и высушите. Используйте покрытые мембраны в тот же день или храните в чистой 6-луночной планшете при 4 ° C в течение четырех недель.
- Распространение головного мозга и встраивание
- Через два дня после электропорации поместите мышь в прозрачную камеру, соединенную с испарителем и насыщенной 5% изофлураном. Когда животное находится в бессознательном состоянии, удалите его из камеры и пожертвуйте его шейным вывихом.
- Удалите матку, содержащую эмбрионы, и поместите ее в 10-сантиметровую чашку Петри с ледяным полным HBSS.
Примечание: с этого момента вперед все растворы, эмбрионы и мозги на льду. - Используйте стереомикроскоп, тонкие наконечники (прямые,11 см) и пару пружинных ножниц Vannas Tübingen (под углом, длина: 9,5 см), чтобы отделить каждый эмбрион от матки и перенести его на другую чашку Петри, содержащую ледяной полный HBSS.
- Сделайте разрез на уровне ствола мозга и разрежьте вдоль сагиттальной средней линии. Очистите кожу и хрящ, покрывающие мозг. Затем отрежьте ствол мозга прямо за полушариями и удалите мозг из черепа. Перенесите мозг с помощью шпателя из микро-ложки (185 мм x 5 мм) на 12-луночный планшет, содержащий ледяную полную HBSS. Соберите все мозги из подстилки в 12-луночном планшете.
- Используйте флуоресцентный стереомикроскоп для скрининга мозгов в 12-луночном планшете для яркости флуоресценции, а также размера электропористой области. Выберите от 2 до 4 мозгов с яркими флуоресцентными сигналами в презумптивной соматосенсорной коре для дальнейшей обработки.
- Налейте 3% раствор LAR-агарозы, содержащийся при температуре 38 ° C, в одноразовую форму для отслаивания. убрE мозг из 12-луночного планшета с лопаткой с микро-ложкой и аккуратно слить избыток полного HBSS вокруг мозга, используя тонкую бумагу для тканей.
- Мягко поместите мозг в раствор агарозы, подтолкните его к нижней части формы и тщательно отрегулируйте свое положение с помощью иглы 20-го калибра. Для корональных срезов ориентируйте мозг с обонятельными луковицами, направленными вверх. Держите форму на льду до тех пор, пока раствор агарозы не затвердеет и продолжит разделение мозга.
- Секция вибрации и культивация среза
- Удалите блок агарозы из формы и поместите его на крышку стерильной чашки Петри. Отрежьте избыток агарозы чистым бритвенным лезвием, оставляя примерно на 2 - 3 мм ниже обонятельных луковиц и 1 мм агарозы с другой стороны. Закрепите обрезанный блок агарозы обонятельными луковицами, направленными вниз на образец, используя цианакрилатный клей.
Примечание: стерилизовать инструменты и оборудование с 70% этанономЛ перед разделением. - Перенесите образец образца в камеру для срезания микротома вибрирующего лезвия, содержащего ледяной полный HBSS, и расположите головку с дорзальной стороной к лезвию. Вырезать срединные срезы объемом 250 мкм, содержащие электропористую область с малой и средней амплитудой 0,9 мм и очень медленную скорость среза 0,09-0,12 мм / с. Обычно от каждого успешного электропористого мозга получают от 4 до 6 срезов с ярким флуоресцентным сигналом.
- С помощью изогнутой лопатки с микро-ложкой и тонких наконечников, аккуратно передайте срезы мозга с окружающей агарозой на 6-луночный планшет, содержащий ледяной полный HBSS.
Осторожно: будьте осторожны, чтобы не повредить ткань головного мозга, только касаясь агарозного обода вокруг секций пинцетом во время передачи. - Обработайте все выбранные мозги, как описано в шагах 2.8.1. До 2.8.3.
- Смочите мембранные вставки 100 мкл полного HBSS перед тем, как поместить мозг slЛьда на мембраны для облегчения позиционирования срезов. На 1 мембранную вставку можно разместить до 5 срезов.
- Аккуратно переместите ломтики на мембраны с помощью изогнутой лопатки с микролопами и тонких наконечников. Осторожно потяните ломтик на шпатель, только прикоснувшись к агарозному краю с помощью щипцов и аккуратно надавите ломтик от шпателя на мембрану. Поместите срез с помощью щипцов и продолжайте переносить оставшиеся фрагменты. Удалите избыток полного HBSS с помощью пипетки.
Примечание. Не перекрывайте срезы друг с другом. - С помощью щипцов аккуратно поместите мембранные вставки с ломтиками в 6-луночный планшет, содержащий 1,8 мл срединной культуральной среды (см. Этап 2.4.1), и инкубируйте при 37 ° С и 5% атмосфере углекислого газа до истечения времени изображения.
- Удалите блок агарозы из формы и поместите его на крышку стерильной чашки Петри. Отрежьте избыток агарозы чистым бритвенным лезвием, оставляя примерно на 2 - 3 мм ниже обонятельных луковиц и 1 мм агарозы с другой стороны. Закрепите обрезанный блок агарозы обонятельными луковицами, направленными вниз на образец, используя цианакрилатный клей.
3. Временная съемка
- Настройка микроскопа
- Установите климатическую камеру, расположенную наПеревернутый конфокальный микроскоп до 37 ° С и 5% атмосферы диоксида углерода. Используйте гибридный детектор, чтобы уменьшить интенсивность лазера и улучшить жизнеспособность клеток. Для детального анализа используйте сверхдлинное рабочее расстояние 40X сухого объекта с числовой апертурой 0,6 или выше.
Примечание: Все компоненты микроскопа должны быть предварительно разогреты до 37 ° C в течение 2 - 3 часов до получения изображений, чтобы обеспечить стабильную фокусировку во время процесса визуализации.
- Установите климатическую камеру, расположенную наПеревернутый конфокальный микроскоп до 37 ° С и 5% атмосферы диоксида углерода. Используйте гибридный детектор, чтобы уменьшить интенсивность лазера и улучшить жизнеспособность клеток. Для детального анализа используйте сверхдлинное рабочее расстояние 40X сухого объекта с числовой апертурой 0,6 или выше.
- Изображения срезов
- Выберите срез мозга для получения изображений из 6-луночного планшета, содержащего мембранные вставки с использованием инвертированного флуоресцентного микроскопа.
Предостережение. Избегайте длительного времени воздействия ультрафиолетового света, так как это может вызвать клеточный фотолапаж.
Примечание. Выберите срез с яркими одиночными нейронами в верхнем SVZ, мигрирующим радиально к поверхности пиала среза. Прекрасные флуоресцентные процессы радиальных глиальных клеток, которые охватывают весь ЦП, указывают на неповрежденный радиальный глиальный каркас, который используетсяD радиально мигрирующими кортикальными нейронами. - Перенесите мембранную вставку срезом, который был выбран для визуализации с временным проходом, в стакан с нижним слоем диаметром 50 мм, содержащий 2 мл срезной культуральной среды с помощью щипцов. Поместите блюдо в климатическую камеру конфокального микроскопа.
- Установите разрешение 512 на 512 пикселей и увеличьте скорость сканирования от 400 Гц до 700 Гц, чтобы увеличить частоту кадров от примерно 1,4 до примерно 2,5 кадров в секунду, соответственно. Используйте усреднение не более двух раз. Определите z-стек через электропористую область (обычно 400-100 мкм) с шагом размером 1,5 мкм. В совокупности эти настройки позволяют обеспечить достаточное разрешение и яркость изображения при одновременном сохранении фотопамяти при покупке. Начните серию временного интервала, взяв z-стоп каждые 30 минут.
Примечание. Длительное воздействие среза на лазерный свет вызовет фотодамодействие, уменьшающее жизнеспособность клеток. Отрегулируйте значение expСоответственно, для лазерного излучения. - Проанализируйте временные ряды, используя программное обеспечение ImageJ (https://imagej.nih.gov/iij/) или аналогичное.
- Выберите срез мозга для получения изображений из 6-луночного планшета, содержащего мембранные вставки с использованием инвертированного флуоресцентного микроскопа.
Результаты
Ранее мы показали, что генетическая делеция Bcl11a при внутриутробной электропорации нарушает радиальную миграцию поздних верхних слоев проекционных нейронов 10 . Электропорация ДНК-плазмидного вектора, содержащего Cre-IRES-GFP, эффективно удаляла Bcl11a в условном мозге Bcl11a flox / flox 11 . Когда мы проанализировали электронодонорные мозги E14.5 через три дня после электропорации, большинство контрольных нейронов мигрировали в СР, тогда как многие мутантные нейроны Bcl11a были остановлены вдоль миграционного маршрута в IZ и VZ / SVZ. Более того, мы обнаружили увеличение числа многополюсных клеток за счет биполярных клеток, особенно в IZ при делеции Bcl11a, что указывает на дефекты в поляризации 10 .
Прямой и динамический анализ миграцииТорического поведения мутантных нейронов Bcl11a мы использовали временную конфокальную визуализацию мигрирующих нейронов в органотипической культуре срезов, полученную из электропористых мозгов. Обзор временных рядов с использованием объектива 10X с числовой апертурой 0,4 подтвердил наши результаты, что мутантные проекционные нейроны Bcl11a имеют дефекты в радиальной миграции. В течение 36 ч многие контрольные нейроны мигрировали в СР, тогда как только немногие мутантные нейроны Bcl11a покинули ИЗ и мигрировали в СР. Интересно, что многие мутантные нейроны Bcl11a не мигрировали непосредственно к поверхности пиала головного мозга, но замедлили миграцию и повернулись тангенциально или даже назад к желудочку (фильм 1). Чтобы дополнительно проанализировать эти данные, мы создали серию временных рядов при более высоком увеличении с использованием объектива 40x с числовой апертурой 0,6. Наши данные показывают, что мутантные нейроны Bcl11a не смогли эффективно поляризовать и продолжить радиально ориентированную миграциюИона в СР. В течение 12 ч многие мутантные нейроны Bcl11a не смогли перейти от многополюсной к биполярной морфологии и вместо этого проецировали и отводили многие процессы в окружающую среду (фильм 2, рис. 1А ).
Кроме того, мы проследили пути миграции отдельных нейронов в разных временных рядах и использовали их для расчета конкретных параметров мигрирующих нейронов. Мы обнаружили, что мутантные нейроны Bcl11a повторно подвергаются фазам с продолжительностью в несколько часов с уменьшенной скоростью миграции и случайными изменениями ориентации (фильм 3, рис. 1B , красные наконечники стрел). В частности, профиль скорости мутантных нейронов Bcl11a был сдвинут с более высокой скорости (25 мкм / ч) на более низкую скорость (5 мкм / ч) по сравнению с контрольными нейронами ( рис. 1С ). В соответствии с этим общая скорость миграции Bcl11Мутантные нейроны были значительно снижены с 10,34 ± 0,34 мкм / ч при контроле до 6 ± 0,54 мкм / ч (p = 2,4889E-05) ( рисунок 1D ). Наконец, отклонение от направленной миграции к поверхности пиала головного мозга значительно увеличилось с 17,15 ± 2,13 ° при контроле до 40,16 ± 4,42 ° в мутантных нейронах Bcl11a (p = 0,0002) ( рис. 1E ). Вместе эти результаты показывают, что временная конфокальная визуализация электропористых нейронов GFP в органотипической культуре срезов является ценным методом изучения молекулярных механизмов, контролирующих процесс миграции нейронов.
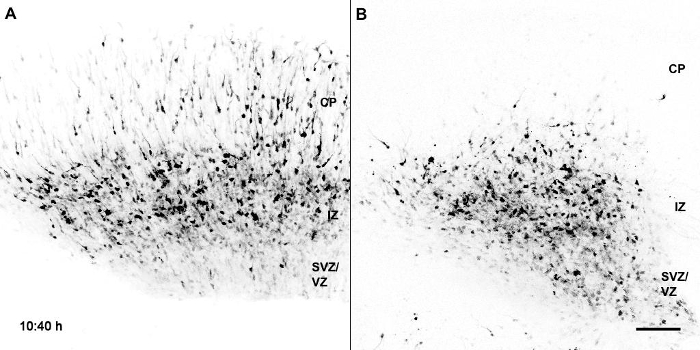
Фильм 1: Миграция GFP маркированного контроля в сравнении с Bcl11a-мутантными нейронами в корковых срезах . Мозги Bcl11a flox / flox были электропорированы приE14.5 с плазмидным вектором, содержащим IRES-GFP (A) или Cre-IRES-GFP (B) и культуры срезов, готовили на E16.5. VZ / SVZ; Желудочковые / субветрикулярные зоны; IZ, промежуточная зона; CP, корковая пластинка. Шкала шкалы = 100 мкм. Фильм состоит из 108 кадров со скоростью 5 кадров / с. Переиздано от Wiegreffe et al. 10 с разрешением от Elsevier. Нажмите здесь, чтобы посмотреть это видео. (Щелкните правой кнопкой мыши, чтобы загрузить.)
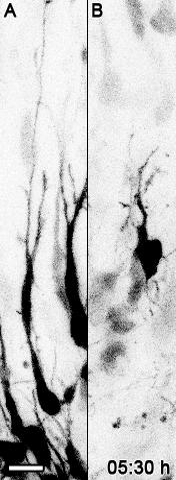
Фильм 2: Поляризация маркированного контроля GFP по сравнению с нейронами мутантов Bcl11a в корковых срезах . Мозги Bcl11a flox / flox электропорировали на E14.5 с помощью плазмидного вектора, содержащего IRES-GFP (A) или Cre-IRES-GFP (B) и культуры срезов Были подготовлены на E16.5. Шкала шкалы = 10 мкм. Фильм состоит из 25 кадров со скоростью 5 кадров / с. Переиздано от Wiegreffe et al. 10 с разрешением от Elsevier. Нажмите здесь, чтобы посмотреть это видео. (Щелкните правой кнопкой мыши, чтобы загрузить.)

Фильм 3: Анимированные следы с интервалом 1 ч. Репрезентативное управление и нейроны Bcl11a Mutant. Следы мигрирующих нейронов были получены из серии временных рядов срединных культур E16.5 из клеток Bcl11a flox / flox, которые были электропориентированы на E14.5 с помощью плазмидного вектора, содержащего IRES-GFP ( A ) или Cre-IRES-GFP ( B ) , Шкала шкалы = 20 мкм. Переиздано от Wiegreffe et al.> 10 с разрешения Elsevier. Нажмите здесь, чтобы посмотреть это видео. (Щелкните правой кнопкой мыши, чтобы загрузить.)

Рисунок 1: Миграционное поведение Bcl11a-мутантных верхних слоев кортикальных нейронов.
( A ) Репрезентативные изображения мигрирующих положительных нейронов GFP в культурах срезов E16.5 из мозгов Bcl11a flox / flox, электропорированных на E14.5 либо с помощью Cre-IRES-GFP, либо с помощью вектора управления в течение всего периода формирования изображения 12 часов. ( B ) Репрезентативные трассы с 1-часовым интервальным разрешением мигрирующих положительных нейронов GFP в культурах срезов E16.5 из мозгов Bcl11a flox / flox, электропорированных на E14.5, с Cre-IRES-GFP или управляющим вектором в течение полных периодов визуализацииДо 22 часов. Мутантные нейроны Bcl11a часто подвергаются повторяющимся фазам с уменьшенной скоростью миграции и случайно измененной ориентацией (отмечены красными наконечниками стрел). ( C ) Профили скорости, рассчитанные по следам мигрирующих нейронов, как показано в B. ( DE ) Количественная оценка скорости ( D ) и угол отклонения от радиальной ориентации ( E ) мигрирующих положительных нейронов GFP в культурах срезов E16.5 из Bcl11a flox / flox Мозги, электропорированные на E14.5, с Cre-IRES-GFP или управляющим вектором (n = 15). Среднее ± с; Тестовый тест ученика; *** p <0,001. Шкала шкалы = 10 мкм. Переиздано от Wiegreffe et al. 10 с разрешением от Elsevier. Нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Обсуждение
Радиальная миграция является ключевым процессом развития неокортекса. Мутации в генах, влияющих на различные этапы этого процесса, могут вызывать сильные корковые пороки развития, в том числе гетеросексуальность lissencephaly и белого вещества 1 , 2 . Недавно мы показали, что Bcl11a, выраженный в молодых мигрирующих проекционных нейронах коры, играет роль в радиальной миграции. Мы использовали временную конфокальную визуализацию мигрирующих нейронов в острых корковых срезах электропористых мозгов, чтобы непосредственно продемонстрировать, что генетическая делеция Bcl11a в мигрирующих нейронах вызывает поляризацию и миграционные дефекты. Временные ряды были использованы для отслеживания путей миграции отдельных нейронов и расчета конкретных параметров мигрирующих нейронов, включая профили скорости, среднюю скорость миграции и направление миграции 10 .
Этот протокол описывает важный подход при изучении молекулыR в радиальной миграции. Путем использования коротких шпилечных РНК или ДНК-экспрессионных плазмид, почти любой интересующий ген может быть сбит или сверхэкспрессирован, соответственно. Это мощный подход к объединению электропорации с системой Cre-LoxP. Трансфекция мозгов мышей условного мутанта («floxed») с Cre recombinase порождает мозаичную мутантную ситуацию и позволяет выборочный анализ одиночных мутантных нейронов, которые окружены клетками дикого типа. Таким образом, можно исследовать клеточные автономные молекулярные механизмы в мигрирующих нейронах. Кроме того, оперативные спасательные эксперименты легко выполняются. Подготовка временных рядов электропористых срезов мозга позволяет динамически анализировать миграционное поведение одиночных мигрирующих нейронов, что дает гораздо больше информации, чем может быть получена из фиксированных разделов мозга. В утробе электропорации 3 , 4 требует начального обучения, но - после освоения - являетсяБыстрый и простой метод для воспроизводимого трансфекции нейронов коры головного мозга in vivo . В протоколе, описанном здесь, мы использовали электротерапию utero при E14.5, когда рождаются нейроны неокортеорных проекций позднего происхождения. Для изучения ранних глубокоуровневых проекционных нейронов в маточной электропорации должны выполняться на ранней стадии развития ( т.е. E12.5) 13 . В принципе, протокол может также использоваться для изучения миграции других нейронных субпопуляций в головном мозге, которые могут быть трансфицированы электропорацией, включая миграцию интернейронов 14 и клеток гранулы мозжечка 15 .
Протокола срез культуры , который мы описываем был адаптирован из Polleux и Гоша 12 и выше, мы использовали его для экс внутриутробно электропорации 16, от 17 до стуDy hippocampal. Самое главное, что кусочки мозга нужно обрабатывать с осторожностью на протяжении всей процедуры, чтобы поддерживать их жизнеспособность. Мы используем перевернутый микроскоп и посуду из стекла с оптическим качеством, чтобы отобразить культуру среза, расположенную на вставке клеточной культуры. Эта конфигурация очень проста в настройке и позволяет стерильные условия, так как цель никогда не контактирует с культурой среза или средой. Однако требуются длинные рабочие расстояния (> 2 мм) с достаточно высокой числовой апертурой (0,6 или выше). Другие исследования поставили мозговой срез непосредственно на дно стекла и использовали коллагеновую матрицу 18 , 19 для фиксации среза на месте, что позволяет использовать цели с более коротким свободным рабочим расстоянием. Однако использование вставок клеточной культуры обеспечивает простоту обработки, воспроизводимые результаты и позволяет исследователю отображать срезы даже через 1-2 дня после их подготовки без coMpromising жизнеспособность среза мозга (данные не показаны). Еще одна важная проблема заключается в повреждении срезов лазерным излучением. Мы использовали высокочувствительный гибридный детектор, который позволил нам свести к минимуму мощность лазера, все еще получая достаточные флуоресцентные сигналы для временного изображения. Использование многофотонной визуализации еще больше уменьшит фотодальность и позволит более глубокое проникновение ткани, а также более эффективное обнаружение света по сравнению с обычной конфокальной микроскопией.
Несмотря на свою полезность для изучения миграции нейронов, протокол имеет ограничения и не может полностью сохранить ситуацию миграции нейронов в интактном мозге. Внеклеточный матрикс, адгезионные межклеточные контакты и сосудистая сеть в миграционной зоне могут динамически влиять на радиально мигрирующие нейроны 20 , 21 . В частности, нейроны верхнего слоя зависят от удлиненных радиальных глиальных процессов дляИх миграция 22 . Поэтому для успешной визуализации важно выбрать срезы мозга с помощью электрофоретических радиальных глиальных клеток GFP, которые расширяют свои процессы через всю ширину коры. «Косые ломтики», в которых радиальный глиальный каркас был срезан до достижения поверхности пиала мозга, следует отбросить из дальнейшего анализа. Иногда на поверхности воздуха среза мозга может происходить гибель клеток, что ограничивает захват изображения в более глубокую область внутри образца. Электропористые нейроны в культивируемых срезах мозга могут мигрировать менее эффективно по сравнению с электропорированными нейронами in vivo , что может быть вызвано недостаточным восстановлением из препарата. Это требует анализа множественных культур срезов как для экспериментальных, так и для контрольных ситуаций и критической интерпретации репрезентативных наборов данных. В некоторых случаях оскорбления, связанные с внутриутробной электропорацией, могут вызывать эмбриональную смерть или структурное изменениеИонами головного мозга, включая увеличенные желудочки, асимметрично истонченную кору головного мозга или образование глиальных рубцов в результате инъекции ДНК. В этих случаях образец следует отбросить из дальнейшего анализа.
В то время как мозговые срезы от эмбриональных доноров хорошо выживают на мембранных вставках 23 , анализы ограничиваются ранними событиями развития, включая миграцию нейронов, и мы не использовали его для изучения более поздних событий, таких как развитие дендрита или синаптогенез. Таким образом, мы предлагаем подробный протокол для непосредственного и динамического изучения миграции нейронов электропористых нейронов в срезах культур, которые могут быть легко адаптированы для анализа функций генов, участвующих в нейроразвивающих расстройствах.
Раскрытие информации
Авторам нечего раскрывать.
Благодарности
Мы благодарим Жаклин Андрашко, Елену Верле, Сачи Такенаку и Маттиаса Тобера за отличную техническую помощь, а также Виктора Тарабикина за полезные обсуждения. Эта работа была поддержана грантом Deutsche Forschungsgemeinschaft для SB (BR-2215).
Материалы
| Name | Company | Catalog Number | Comments |
| isoflurane | Abbott Laboratories | 506949 | Forene |
| 6-well plate | Corning | 351146 | |
| 12-well plate | Corning | 351143 | |
| non-absorbable surgical suture | Ethicon | K890H | 3/8 circle, 13 mm, taper point |
| Micro Adson Forceps | Fine Science Tools | 11018-12 | serrated, length: 12 cm |
| fine scissors | Fine Science Tools | 14063-09 | angled to side, length: 9 cm |
| Mathieu Needle Holder | Fine Science Tools | 12510-14 | tungsten carbide, length: 14 cm |
| fine tipped forceps | Fine Science Tools | 11370-40 | straight, 11 cm |
| Vannas Tübingen Spring Scissors | Fine Science Tools | 15005-08 | angled up, 9.5 cm |
| ring forceps | Fine Science Tools | 11103-09 | OD: 3mm, ID, 2.2 mm, length: 9 cm |
| HBSS (10X) | Gibco | 14180046 | |
| L-Glutamine | Gibco | 25030081 | |
| Penicillin/Streptomycin | Gibco | 15140122 | |
| horse serum | Gibco | 26050088 | |
| BME | Gibco | 41010026 | |
| borosilicate glass capillaries | Harvard Apparatus | 30-0016 | 1.0 OD x 0.58 ID x 100 L mm |
| anesthsesia system | Harvard Apparaus | 72-6471 | |
| anesthetizing chamber | Harvard Apparaus | 34-0460 | |
| fluosorber filter canister | Harvard Apparaus | 34-0415 | |
| low melting point agarose | Invitrogen | 16520100 | |
| vibrating blade microtome | Leica | VT1200 S | |
| fluorescence stereo microscope | Leica | M205 FA | |
| stereo microscope | Leica | M125 | |
| inverted fluorescence tissue culture microscope | Leica | DM IL LED | |
| confocal laser scanning microscope | Leica | TCS SP5II | |
| hybrid detector | Leica | HyD | |
| objective, 40x/0.60 NA | Leica | 11506201 | |
| microscope temperature control system | Life Imaging Services | Cube, Brick & Box | |
| cell culture insert | Millipore | PICM0RG50 | |
| microgrinder | Narishige | EG-45 | use 38° angle for beveling |
| microinjector | Parker Hannifin | 052-0500-900 | Picospritzer III |
| carprofen | Pfizer Animal Health | NDC 61106-8507 | Rimadyl |
| emdedding mold | Polysciences | 18986-1 | |
| endotoxin-free plasmid maxi kit | Qiagen | 12362 | |
| fast green | Sigma | F7252 | |
| laminin | Sigma | L2020 | |
| poly-L-lysine | Sigma | P5899 | |
| HEPES | Sigma | H4034 | |
| D-glucose | Sigma | G6152 | |
| calcium chloride | Sigma | C7902 | |
| magensium sulfate | Sigma | M2643 | |
| sodium bicarbonate | Sigma | S6297 | |
| square wave electroporator | Sonidel | CUY21EDIT | |
| tweezers with 5 mm platinum disk electrodes | Sonidel | CUY650P5 | |
| micropipette puller | Sutter Instrument | P-97 | |
| box filament | Sutter Instrument | FB255B | 2.5 mm x 2.5 mm |
| micro-spoon spatula | VWR | 231-0191 | 185 mm x 5 mm |
| glass bottom dish, 50 mm | World Precision Instruments | FD5040-100 |
Ссылки
- Evsyukova, I., Plestant, C., Anton, E. S. Integrative mechanisms of oriented neuronal migration in the developing brain. Annu Rev Cell Dev Biol. 29, 299-353 (2013).
- Kwan, K. Y., Sestan, N., Anton, E. S. Transcriptional co-regulation of neuronal migration and laminar identity in the neocortex. Development. 139 (9), 1535-1546 (2012).
- Saito, T., Nakatsuji, N. Efficient gene transfer into the embryonic mouse brain using in vivo electroporation. Dev Biol. 240 (1), 237-246 (2001).
- Tabata, H., Nakajima, K. Efficient in utero gene transfer system to the developing mouse brain using electroporation: visualization of neuronal migration in the developing cortex. Neuroscience. 103 (4), 865-872 (2001).
- LoTurco, J. J., Bai, J. The multipolar stage and disruptions in neuronal migration. Trends Neurosci. 29 (7), 407-413 (2006).
- Noctor, S. C., Martinez-Cerdeno, V., Ivic, L., Kriegstein, A. R. Cortical neurons arise in symmetric and asymmetric division zones and migrate through specific phases. Nat Neurosci. 7 (2), 136-144 (2004).
- Tabata, H., Nakajima, K. Multipolar migration: the third mode of radial neuronal migration in the developing cerebral cortex. J Neurosci. 23 (31), 9996-10001 (2003).
- Pacary, E., et al. Proneural transcription factors regulate different steps of cortical neuron migration through Rnd-mediated inhibition of RhoA signaling. Neuron. 69 (6), 1069-1084 (2011).
- Tabata, H., Nagata, K. Decoding the molecular mechanisms of neuronal migration using in utero electroporation. Medical Molecular Morphology. 49 (2), 63-75 (2016).
- Wiegreffe, C., et al. Bcl11a (Ctip1) Controls Migration of Cortical Projection Neurons through Regulation of Sema3c. Neuron. 87 (2), 311-325 (2015).
- John, A., et al. Bcl11a is required for neuronal morphogenesis and sensory circuit formation in dorsal spinal cord development. Development. 139 (10), 1831-1841 (2012).
- Polleux, F., Ghosh, A. The slice overlay assay: a versatile tool to study the influence of extracellular signals on neuronal development. Sci STKE. (136), pl9(2002).
- Greig, L. C., Woodworth, M. B., Galazo, M. J., Padmanabhan, H., Macklis, J. D. Molecular logic of neocortical projection neuron specification, development and diversity. Nat Rev Neurosci. 14 (11), 755-769 (2013).
- De Marco Garcia, N. V., Fishell, G. Subtype-selective electroporation of cortical interneurons. J Vis Exp. (90), e51518(2014).
- Holubowska, A., Mukherjee, C., Vadhvani, M., Stegmuller, J. Genetic manipulation of cerebellar granule neurons in vitro and in vivo to study neuronal morphology and migration. J Vis Exp. (85), (2014).
- Venkataramanappa, S., Simon, R., Britsch, S. Ex utero electroporation and organotypic slice culture of mouse hippocampal tissue. J Vis Exp. (97), (2015).
- Simon, R., et al. A dual function of Bcl11b/Ctip2 in hippocampal neurogenesis. EMBO J. 31 (13), 2922-2936 (2012).
- Youn, Y. H., Pramparo, T., Hirotsune, S., Wynshaw-Boris, A. Distinct dose-dependent cortical neuronal migration and neurite extension defects in Lis1 and Ndel1 mutant mice. J Neurosci. 29 (49), 15520-15530 (2009).
- Nadarajah, B., Brunstrom, J. E., Grutzendler, J., Wong, R. O., Pearlman, A. L. Two modes of radial migration in early development of the cerebral cortex. Nat Neurosci. 4 (2), 143-150 (2001).
- Higginbotham, H., Yokota, Y., Anton, E. S. Strategies for analyzing neuronal progenitor development and neuronal migration in the developing cerebral cortex. Cereb Cortex. 21 (7), 1465-1474 (2011).
- Stubbs, D., et al. Neurovascular congruence during cerebral cortical development. Cereb Cortex. 19, Suppl 1. i32-i41 (2009).
- Ayala, R., Shu, T., Tsai, L. H. Trekking across the brain: the journey of neuronal migration. Cell. 128 (1), 29-43 (2007).
- Humpel, C. Organotypic brain slice cultures: A review. Neuroscience. 305, 86-98 (2015).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены