Method Article
胚性マウス脳の器官型スライス培養における移行ニューロンの経時的共焦点イメージング
要約
このプロトコルは、放射状に移動する皮質ニューロンの直接観察のための指示を提供する。 子宮内でのエレクトロポレーションでは、器官型スライス培養および時間経過共焦点画像化を組み合わせて、移動するニューロンにおける関心対象遺伝子の過剰発現または下方制御の影響を直接かつ動的に研究し、発生時のそれらの分化を分析する。
要約
子宮内でエレクトロポレーションは、発生中のマウス胚の大脳皮質における放射状移動のプロセスを研究するための迅速かつ強力なアプローチである。これは、半径方向移動の異なるステップを記述し、このプロセスを制御する分子メカニズムを特徴付けるのに役立っている。マイニングするニューロンを直接的かつ動的に分析するためには、時間の経過とともに追跡されなければならない。このプロトコールは、 子宮内のエレクトロポレーションと器官型のスライス培養および経時的な共焦点画像化を組み合わせたワークフローを記述しており、放射状に移動する皮質ニューロンの直接的検査および動的分析が可能である。さらに、移動速度、速度プロファイル、および半径方向の変化など、移動するニューロンの詳細な特徴付けが可能である。本方法は、救助実験と同様に、喪失および機能獲得によって、放射状に移動する皮質ニューロンにおける目的の遺伝子の機能的分析を行うために容易に適合させることができる。時間経過移動ニューロンの画像化は、かつて確立された最先端技術であり、ニューロン移動障害のマウスモデルにおける大脳皮質の発達を研究するための有力なツールである。
概要
新皮質は、認知機能、感情機能、および感覚運動機能の主要な部位である。それは、脳の表面に平行に向けられた6つの水平な層で構成されています。発達中、背側終脳の外側壁の前駆細胞は、突起表面に放射状に移動し、層タイプ特異的なニューロンの同一性を獲得する突起ニューロンを生じる。心室/脳室区域(VZ / SVZ)で生成された後、これらのニューロンは過渡的に多極となり、移動を遅らせる。中間ゾーン(IZ)に短時間滞在した後、両極性モルフォロジーに切り替え、放射状グリア骨格に付着させ、皮質プレート(CP)への放射状配向移行を続ける。最終的な標的投影に到達すると、ニューロンは、放射状グリアプロセスから分離し、層特有の同一性を獲得する。ニューロン移動の異なる段階に影響を与える遺伝子の突然変異は、リッスンなどの重度の皮質奇形を引き起こし得るephalyまたは白質heterotopia 1、2。
子宮内エレクトロポレーションではげっ歯類の胚3、4の脳の発達に神経前駆細胞をトランスフェクトするために迅速かつ強力な手法です。この技術により、発達中のニューロンにおけるそれらの機能を研究するために、目的の遺伝子をノックダウンおよび/または過剰発現させることが可能である。この方法は、具体的には、形態学的な詳細を説明し、半径方向の移動5、6、7、8、9のプロセスの分子機構を特徴づけるために役立っています。放射状に移動するニューロンは、細胞の形状、移動速度、および移動方向の動的変化を経るが、時間の経過とともに直接的かつ連続的な観察が必要である。オルガノタイプのスライスカルチャーエレクトロポレーションされた脳の再構成および経時的共焦点画像化は、経時的に移動するニューロンを直接観察することを可能にする。この組み合わされたアプローチを使用して、エレクトロポレーションされた脳の固定された組織切片において調査することができない、移動するニューロンの明確な特徴を分析することが可能である。
私たちは最近、皮質発達中の転写因子B細胞CLL /リンパ腫11a(Bcl11a)の役割を研究するために、エレクトロポレーションされた脳のスライス培養における移動ニューロンの時間経過共焦点画像化を適用した10 。 Bcl11aは、若い移動する皮質ニューロンにおいて発現され、その機能を研究するために条件付き突然変異Bcl11a対立遺伝子( Bcl11a flox ) 11を使用した。緑色蛍光タンパク質(GFP)とともにCreリコンビナーゼをBcl11a flox / flox脳の皮質前駆細胞に電気穿孔することにより、モザイク変異体の状況を作り出した。そうでなければ野生型の背景。このようにして、単一細胞レベルでBcl11aの細胞自律機能を研究することが可能であった。我々は、 Bcl11a突然変異体ニューロンが、移動中の速度の低下、速度プロファイルの変化、およびランダムな向きの変化を示すことを見出した10 。概説されたプロトコールでは、マウス脳のエレクトロポレーションおよびスライス培養調製12の成功のワークフローならびに皮質切片培養の経時的共焦点画像化を記載する。
プロトコル
すべての実験手順は、動物福祉委員会(RegierungspräsidiumTübingen)によって承認され、ドイツ動物福祉法およびEU指令2010/63 / EUに従って実施された。
1. Uteroエレクトロポレーション
- マイクロインジェクション針
- ボックスフィラメント(2.5mm×2.5mm)を備えたマイクロピペットプラーおよび以下のプログラムを使用して、ホウケイ酸ガラス細管(外径:1.0mm、内径:0.58mm、長さ:100mm)をマイクロインジェクション針に引っ張る:HEAT:540、PULL :125、VELOCITY:20、DELAY:140。RAMPテスト(HEAT値:RAMP + 25)を実行して、個々のフィラメントのHEAT値を決定します。
- 胚の日(E)13.5以下で注射するための20〜30μmのチップサイズを得るために、38°の角度および高回転速度の中間の微小針で、より古い胚で注射するために30〜40μmステージ。保管のために、チップへの損傷を防ぐために粘土を模造したボックスまたはペトリ皿に針を固定する。
- プラスミドDNA溶液
- エンドトキシンを含まないマキシ調製キットを使用して、製造者の指示に従って、蛍光レポータータンパク質( 例えば、 GFP)を含むプラスミドDNA構築物を調製する。
- 終濃度0.01%のFast Greenを含むエンドトキシンフリーのTris-EDTAバッファーでプラスミドDNA溶液を1〜2μg/μLの最終濃度に希釈する。 -20℃でアリコート溶液と保存します。
- 静菌性塩化ナトリウム溶液
- 等張性の0.9%塩化ナトリウム溶液に0.9%の最終濃度でベンジルアルコールを加えることによって静菌性塩化ナトリウム溶液を調製する。使用直前に滅菌フィルター溶液。
- カルプロフェン注射液
- カルプロフェン注入液を調製する0.5mg / mLの最終濃度の滅菌等張性0.9%塩化ナトリウム溶液にカルプロフェンを添加する。 4℃で最大28日間保存する。
- 麻酔、DNA注射、エレクトロポレーション
- E14.5妊娠マウスの体重を測定し、気化器に接続した透明な麻酔室に入れ、5%イソフルランで飽和させる。動物が意識不明のときは、37℃の加温プレートに添付されている麻酔マスクに移し、1.8〜2.2%のイソフルランで麻酔をかけたままにしておきます。
注:尾のピンチと脚の痛み(つまみ)の喪失による外科的麻酔の発達を評価する。 - 鎮痛のために、10mgのマウス体重(5mg / kg体重)あたり100μlのカルプロフェン注射液を皮下注射する。後ろにマウスを置いて、石油ゼリーで目を慎重に覆い、乾燥を防ぎます。
- 穏やかに手足を広げて固定する外科用テープで暖かいプレートに貼り付けます。腹部を70%エタノールで滅菌し、次にセルローススワブを用いてヨウ素溶液(7.5mg / mL)を滅菌する。適切な消毒を確実にするために、この手順を3回繰り返します。
- 腹部を滅菌ガーゼで覆い、切開部を切開して腹部切開用の欄(直径2〜2.5cm)を用意します。静菌性塩化ナトリウム溶液でガーゼを湿らせます。
注意:ペダル・リフレックスの喪失による手術麻酔の発生を再評価する。 - マイクロアドソンを使用して鉗子(鋸歯状、長さ:12cm)および細いはさみ(横に角度を付け、長さ:9cm)は、腹部の中心線に沿って約1.5cmの皮膚を切断する。ラインナ・アルバに沿って下の筋肉を切る。
- リング鉗子(長さ:9 cm、外径:3 mm、内径:2.2 mm)で子宮角を1つ取り外し、湿らせたガーゼの上に静かに置きます。
注意:子宮角をリング鉗子で胚と胚の間にのみ保持する胎盤や任意の供給容器を摂動させないでください。静菌性塩化ナトリウム溶液で常に子宮を湿らせてください。 - 慎重にリング鉗子で胚を配置し、矢状洞に平行な三日月形の影として提示側脳室を見つける。注射部位は、色素性眼と副鼻腔の合流部との間の線のほぼ中央に位置し、矢状洞が2つの横鼻に分岐する。マイクロ注射針を子宮壁を通して側脳室に押し込む。
注:必要に応じて、針の引き込みによって注射の深さを補正することができます。 - 25psi、1パルスあたり10〜20ms、および5〜10パルスを使用して、フットペダルで操作されるマイクロインジェクタを用いて、1〜2μLのDNA溶液を側脳室に注入する。成功した注射は、心室系を満たすべき有色DNA溶液によってモニターすることができる。
- 「陽性」末端が注入された心室と同じ側にあり、「陰性」末端が陰性であるようにピンセット型電極(E13.5またはそれ以下の場合は直径3mm、E14.5またはそれ以上の場合は直径5mm)胚の頭の耳の下の注入された心室の反対側にある。
- 電気穿孔部位を数滴の静菌性塩化ナトリウム溶液で湿らせ、950msの間隔で50msの持続時間の5つの電流パルス(E13.5以下では35V、E14.5以上では40V)を印加する。
注:正常なエレクトロポレーションのためには、通常60〜90 mAの電流で十分です。より低い電流はニューロンを効率的にトランスフェクトしないが、より高い電流は胚死につながる可能性がある。 - 子宮角のすべての胚について、手順(手順1.5.7〜1.5.10。)を繰り返し、腹腔内に静かに戻します。
- 子宮角を反対側から取り出して、procを繰り返しますステップ1.5.7で説明したedure。 1.5.11。
- マイクロアドソン鉗子、Mathieu針ホルダー(炭化タングステン、長さ:14cm)、および非吸収性外科縫合糸(3/8円、13mm、テーパー点)を使用して皮膚を縫合する前に、筋層を縫合して腹腔を閉じる。
注意:縫合中に子宮やその他の臓器を摘出しないように注意してください。 - 皮膚縫合糸をヨウ素溶液(7.5 mg / mL)で慎重に消毒し、セルローススワブを使用して眼周囲過剰の石油ゼリーを静かに除去する。マウスが目を覚ますまで赤外線ランプの下に置きます。次の2日間、マウスを密接に監視する。 12〜24時間後に、ステップ1.5.2に記載されているように鎮痛処置を繰り返す。
- E14.5妊娠マウスの体重を測定し、気化器に接続した透明な麻酔室に入れ、5%イソフルランで飽和させる。動物が意識不明のときは、37℃の加温プレートに添付されている麻酔マスクに移し、1.8〜2.2%のイソフルランで麻酔をかけたままにしておきます。
2.有機型スライスの文化
- ラミニンストック溶液
- 1mgの凍結乾燥ラミニンを滅菌水に溶解して、1mg / mLラミニンストック溶液を得る。 50μLのアリコートを調製する-80℃で保管してください。
- ポリ-L-リジンストック溶液
- 滅菌水に50mgのポリ-L-リシンを溶解して、1mg / mLのポリ-L-リジン保存溶液を得る。 0.5 mLのアリコートを調製し、-20°Cで保存する。
- 完全なハンクの平衡塩類溶液(完全なHBSS)
- 50mLの10×HBSS溶液、1.25mLの1M HEPES緩衝液(pH7.4)、15mLの1M D-グルコース溶液、5mLの100mM塩化カルシウム溶液、5mLの100mM硫酸マグネシウム溶液、および1M炭酸水素ナトリウム溶液2mLを加えた。 0.5Lまでの滅菌水、滅菌フィルターを加え、4℃で保存する。
- スライス培養培地
- 基本培地Eagle(BME)35mL、完全HBSS(セクション2.3.1参照)、1M D-グルコース1.35mL、200mM L-グルタミン0.25mLおよびペニシリン - ストレプトマイシン0.5mLを、スライスカルチャー50 mLを得る中。滅菌濾過し、ウマ血清を最終濃度5%になるまで添加する。 4℃で4週間保存してください。
- 低融点(LMP)アガロース溶液
- LMPアガロース1.5gを50mLの完全HBSSに溶解して3%LMPアガロース溶液を調製し、電子レンジで1〜2分間中間出力で加熱する。
注:沸騰中のオーバーフローを防ぐため、熱を注意深く監視してください 。 - 使用準備が整うまで38℃の水浴に入れてください。 4℃で保存し、一度再使用してください。
- LMPアガロース1.5gを50mLの完全HBSSに溶解して3%LMPアガロース溶液を調製し、電子レンジで1〜2分間中間出力で加熱する。
- メンブレンインサートのコーティング
- ラミニン原液(ステップ2.1.1参照)とポリ-L-リシン原液(ステップ2.2.1参照)のアリコートを6 mLの滅菌水に加えてコーティング溶液を得ます(6インサートに十分です) 。
- 各ウェルの底に2mLの滅菌水が入った6穴プレートに膜インサートを入れます。 1mLのコーティング溶液(ステップ2.6.1参照)を各膜の上に置き、37℃および5%二酸化炭素雰囲気下で一晩インキュベートする。
注:ポリテトラフルオロエチレン(PTFE)膜などの光学的に透明なメンブレンを使用したインサートのみを使用してください。 - 膜を1mLの滅菌水で3回洗浄し、乾燥させる。同じ日にコーティングされた膜を使用するか、4℃で4週間、清潔な6ウェルプレートに保存してください。
- 脳の解剖と埋め込み
- エレクトロポレーションの2日後、気化器に接続した透明チャンバーにマウスを置き、5%イソフルランで飽和させる。動物が意識がなくなったら、それをチャンバーから取り出し、子宮頸管脱臼によって犠牲にする。
- 胚を含む子宮を取り出し、氷冷した完全なHBSSを含む10cmのペトリ皿に入れる。
注:この時点以降、すべての溶液、胚、および脳を氷上に保ちます。 - 実体顕微鏡を使用して、細かい先端の鉗子(ストレート、11 cm)とVannasTübingenSpring Scissors(角度をつけて、長さ:9.5 cm)を用いて各胚を子宮から分離し、それを氷冷完全HBSSを含む別のペトリ皿に移す。
- 脳幹のレベルで切開を行い、矢状の中線に沿って切る。脳を覆う皮膚と軟骨を剥がす。脳幹を脳半球のすぐ後ろで切断し、頭蓋骨から脳を取り除く。マイクロスプーンスパチュラ(185mm×5mm)で脳を氷冷完全HBSSを含む12ウェルプレートに移す。 12穴プレートのリターからすべての脳を採取する。
- 蛍光の実体顕微鏡を使用して、エレクトロポレーションされた領域の大きさだけでなく、蛍光の明るさについて12ウェルプレートの脳をスクリーニングする。さらなる処理のために、推定体性感覚皮質の明るい蛍光シグナルを有する2〜4頭の脳を選択する。
- 38℃に保った3%LMPアガロース溶液を剥がして使い捨て可能な埋込み型に注ぎます。リムーバブル脳をマイクロスプーンスパチュラで12ウェルプレートから取り出し、精密ティッシュペーパーを用いて脳周囲の過剰な完全HBSSを注意深く排出する。
- 脳をアガロース溶液に静かに置き、金型の底に押し込み、20ゲージの針を用いてその位置を注意深く調節する。冠状切片の場合、嗅球が上を向くように脳を向ける。金型を氷上に置き、アガロース溶液が凝固し、脳切片化を続ける。
- ビブラトームセクショニングとスライス培養
- 金型からアガロースブロックを取り出し、滅菌ペトリ皿の蓋の上に置きます。余分なアガロースを、嗅球より約2〜3mm、反対側に1mmのアガロースを残す清潔なかみそりの刃で取り除く。シアノアクリレート接着剤を使用して、嗅球を下向きにしてトリムしたアガロースブロックを検体ステージに固定します。
注:70%エタノールで滅菌する機器および機器lである。 - 氷冷した完全なHBSSを含む振動ブレードミクロトームのスライシングチャンバーに試料ステージを移し、背側をブレードに向かって配置する。 0.9mmの低〜中程度の振幅および0.09〜0.12mm /秒の非常に遅い切片化速度を有するエレクトロポレーションされた領域を含む250μm厚の脳スライスを切る。通常、明るい蛍光シグナルを有する4〜6スライスは、うまくエレクトロポレーションされた各脳から得られる。
- 曲がったマイクロスプーンのスパチュラと細かい先端の鉗子で、周囲のアガロースを含む脳スライスを、氷冷した完全なHBSSを含む6ウェルプレートに注意深く移す。
注意:移送中に鉗子で切片周辺のアガロースリムに触れるだけで脳組織を傷つけないように注意してください。 - 手順2.8.1で説明したように、選択したすべての脳を処理します。 2.8.3に。
- 100μLの完全なHBSSでメンブレンインサートを湿らせてから、脳slスライスの位置決めを容易にするために膜上に固定される。 1つのメンブレンインサートに最大5枚のスライスを配置できます。
- 慎重に、曲がったマイクロスプーンのスパチュラと細かい先端のついた鉗子を使用して、スライスをメンブレンに移します。鉗子でアガロースリムに触れるだけで、スパチュラ上のスライスを静かに引っ張り、スパーテルからスライスをメンブレン上に静かに押します。鉗子を使用してスライスを配置し、残りのスライスを引き続き転送します。余分な完全HBSSをピペットで取り除く。
注:スライスを互いに重ならないでください。 - 鉗子の助けを借りて、1.8mLのスライス培地(ステップ2.4.1参照)を含む6ウェルプレートに、スライスを入れた膜インサートを注意深く入れ、37℃および5%二酸化炭素雰囲気下で、時間経過までインキュベートするイメージング。
- 金型からアガロースブロックを取り出し、滅菌ペトリ皿の蓋の上に置きます。余分なアガロースを、嗅球より約2〜3mm、反対側に1mmのアガロースを残す清潔なかみそりの刃で取り除く。シアノアクリレート接着剤を使用して、嗅球を下向きにしてトリムしたアガロースブロックを検体ステージに固定します。
3.タイムラプスイメージング
- 顕微鏡設定
- 気候チャンバーをステージの上に置く倒立共焦点顕微鏡を用いて37℃、5%二酸化炭素雰囲気下で培養した。ハイブリッド検出器を使用してレーザー強度を低減し、細胞生存率を向上させます。詳細な解析を行うには、開口数0.6以上の超長作動距離40X乾式対物レンズを使用してください。
注:顕微鏡のすべてのコンポーネントは、イメージングプロセスの間に安定した焦点を提供するために、イメージング前に2〜3時間37℃に予熱する必要があります。
- 気候チャンバーをステージの上に置く倒立共焦点顕微鏡を用いて37℃、5%二酸化炭素雰囲気下で培養した。ハイブリッド検出器を使用してレーザー強度を低減し、細胞生存率を向上させます。詳細な解析を行うには、開口数0.6以上の超長作動距離40X乾式対物レンズを使用してください。
- スライスイメージング
- 倒立蛍光顕微鏡を使用して膜インサートを含む6ウェルプレートからイメージング用の脳スライスを選択する。
注意:紫外線による長時間の曝露は避けてください。細胞の光損傷を引き起こす可能性があります。
注意:上部SVZの明るい単一ニューロンをスライスのスライス面に向かって放射状に移動させてスライスを選択します。 CP全体にわたる放射状グリア細胞の微細な蛍光プロセスは、無傷の放射状グリア骨格を示し、これは、半径方向に移動する皮質ニューロンによって達成される。 - 鉗子の助けを借りてスライス培地2mlを含む直径50mmのガラス底のディッシュに、タイムラプスイメージングのために選択されたスライスで膜インサートを移す。皿を共焦点顕微鏡の気候室に置く。
- 解像度を512×512ピクセルに設定し、スキャン速度を400 Hzから700 Hzに上げ、フレームレートを毎秒約1.4から約2.5フレームに上げます。平均を2回以上使用しないでください。電気穿孔された領域(通常400〜100μm)に1.5μmのステップサイズでzスタックを定義します。集合的に、これらの設定は、取得中に光損傷を低く保ちながら、画像の十分な解像度および明るさを可能にする。 30分ごとにzスタックを取って、時間経過シリーズを開始します。
注:レーザー光へのスライスの長時間の曝露は、光損傷を誘発し、細胞の生存率を低下させる。 expを調整するそれに応じてレーザ光を照射する。 - ImageJソフトウェア(https://imagej.nih.gov/iij/)または同等のものを使用して、時間経過シリーズを分析する。
- 倒立蛍光顕微鏡を使用して膜インサートを含む6ウェルプレートからイメージング用の脳スライスを選択する。
結果
以前は、 子宮の電気穿孔によるBcl11aの遺伝子欠損は、晩年生まれの上層投射ニューロンの放射状移動を損なうことを示しています10 。 Cre-IRES-GFPを含むDNAプラスミドベクターのエレクトロポレーションは、条件付きBcl11a flox / flox脳11においてBcl11aを効率的に欠失させた。電気穿孔の3日後にE14.5電気穿孔脳を分析したところ、ほとんどのコントロールニューロンはCPに移行したが、多くのBcl11a変異ニューロンはIZおよびVZ / SVZの移動経路に沿って失速した。さらに、 Bcl11a欠損時にIZに特異的なバイポーラ細胞を犠牲にして多極細胞の数が増加することを見出し、分極の欠陥を示唆した10 。
直接および動的にmigraを分析するにはエレクトロポレーションされた脳から調製された器官型スライス培養物中の遊走ニューロンの経時的共焦点イメージングを用いたBcl11a変異体ニューロンの異常行動。概要開口数0.4の10倍対物レンズを用いた経時変化シリーズは、 Bcl11a突然変異投影ニューロンが放射状移動に欠陥を有することを確認した。 36時間以内に多数の制御ニューロンがCPに移行したが、わずかなBcl11a突然変異ニューロンのみがIZを離れてCPに移行した。興味深いことに、多くのBcl11a突然変異体ニューロンは、脳の軟膜表面に直接移動しなかったが、移動が遅くなり、接線方向に、または脳室に戻った(Movie 1)ように見えた。これらの知見をさらに分析するために、開口数0.6の40倍対物レンズを使用して高倍率でタイムラプスシリーズを作成しました。我々のデータは、 Bcl11a突然変異体ニューロンが効率的に分極化しておらず、放射状指向の移行体イオンをCPに導入する。 12時間以内に、多くのBcl11a突然変異ニューロンは、多極形態から双極形態へと切り替えることができず、その代わりに、多くのプロセスを周囲の環境に投影し収縮させた( Movie2 、 図1A )。
さらに、個々のニューロンの移動経路を異なる時間経過の系列で追跡し、これらを用いて移動するニューロンの特定のパラメータを計算した。我々は、 Bcl11α変異体ニューロンが、移動速度およびランダムな向きの変化(Movie 3; 図1B 、赤い矢印)を減少させながら、数時間の期間を繰り返し受けることを見出した。特に、 Bcl11a変異体ニューロンの速度プロファイルは、対照ニューロン( 図1C )と比較して、より高速(25μm/ h)から低速(5μm/ h)にシフトした。これに伴い、 Bcl11の全体的な移動速度変異体ニューロンは、対照において10.34±0.34μm/ hから6±0.54μm/ hに有意に減少した(p = 2.4889E-05)( 図1D )。最後に、脳の足表面に向かう方向性移動からの逸脱は、対照の17.15±2.13°からBcl11a変異ニューロンの40.16±4.42°に有意に増加した(p = 0.0002)( 図1E )。これらの結果は、器官型スライス培養におけるGFPエレクトロポレーションされたニューロンの時間経過共焦点画像化が、ニューロンの移動プロセスを制御する分子メカニズムを研究するための貴重な方法であることを示す。
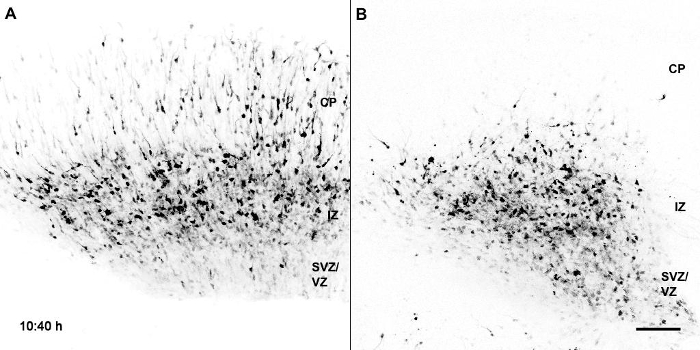
ムービー1:皮質切片におけるBcl11a変異ニューロンとの比較におけるGFP標識対照の移行。 Bcl11a flox / flox脳をエレクトロポレーションしたE14.5をIRES-GFP (A)またはCre-IRES-GFP (B)を含むプラスミドベクターで切断し、スライス培養物をE16.5で調製した。 VZ / SVZ;心室/脳室区; IZ、中間ゾーン; CP、皮質プレート。スケールバー=100μm。ムービーは、5フレーム/秒の割合で108フレームから構成されています。 Wiegreffeらから転載。エルゼビアの許可を得て10 。 このビデオを見るにはここをクリックしてください。 (右クリックしてダウンロードしてください)
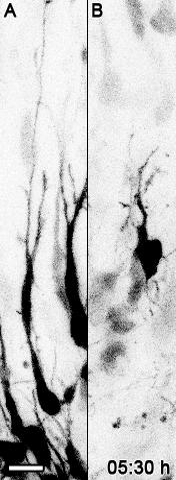
ムービー2:皮質切片におけるBcl11a変異型ニューロンとの比較におけるGFP標識対照の分極。 Bcl11a flox / flox脳をIRES-GFP (A)またはCre-IRES-GFP (B)を含むプラスミドベクターでE14.5に電気穿孔し、培養物をスライスした E16.5で調製した。スケールバー=10μm。ムービーは、5フレーム/秒の割合で25フレームで構成されています。 Wiegreffeらから転載。エルゼビアの許可を得て10 。 このビデオを見るにはここをクリックしてください。 (右クリックしてダウンロードしてください)

ムービー3:代表的なコントロールおよびBcl11a変異型ニューロンの1時間間隔でのアニメーショントレース。痕跡量の移動ニューロンは、 IRES-GFP ( A )またはCre-IRES-GFP ( B )を含むプラスミドベクターでE14.5でエレクトロポレーションされたBcl11a flox / flox脳のE16.5スライス培養物の経時変化シリーズから得られた。 。スケールバー=20μm。 Wiegreffeらから転載。Elsevierの許可を得て> 10。 このビデオを見るにはここをクリックしてください。 (右クリックしてダウンロードしてください)

図1: Bcl11a突然変異上層皮質ニューロンの移動挙動。
( A )E14.5でCre-IRES-GFPまたは対照ベクターを用いて12時間の全撮像期間にわたって電気穿孔したBcl11a flox / flox脳からのE16.5スライス培養における遊走GFP陽性ニューロンの代表的画像。 ( B ) Cre-IRES-GFPまたはコントロールベクターを用いてE14.5でエレクトロポレーションしたBcl11a flox / flox脳からのE16.5スライス培養物中の移動するGFP陽性ニューロンの1時間間隔分解能を有する代表的なトレースは、22時間まで。 Bcl11a変異体ニューロンは、しばしば、移動速度の低下およびランダムに変化した配向(赤矢印で示される)の繰り返しの段階を経る。 FLOX / FLOX Bcl11aからE16.5スライス培養物中のGFP陽性ニューロンの移行の(C)の速度(D)のB.(DE)定量に示すように、移行ニューロンのトレースから計算された速度プロファイル及びラジアル方向(E)からのずれ角Cre-IRES-GFPまたは対照ベクター(n = 15)を用いてE14.5で電気穿孔した脳。平均±SEM;スチューデントt検定; *** p <0.001。スケールバー=10μm。 Wiegreffeらから転載。エルゼビアの許可を得て10 。 この図の拡大版を見るには、ここをクリックしてください。
ディスカッション
放射状移動は、新皮質発達における重要なプロセスである。このプロセスの異なる工程に影響を与える遺伝子の変異は、滑脳症と白質heterotopia 1、2を含む重篤な皮質奇形を引き起こす可能性があります。我々は最近、若い移動する皮質突起ニューロンにおいて発現されるBcl11aが、放射状移動において役割を果たすことを示した。我々は、エレクトロポレーションされた脳の急性皮質切片における移動ニューロンの経時的共焦点イメージングを使用して、移動するニューロンにおけるBcl11aの遺伝子欠失が分極および移動の欠陥を引き起こすことを直接実証した。経時変化シリーズを使用して、個々のニューロンの移動経路を追跡し、速度プロファイル、平均移動速度、および移動方向を含む、移動するニューロンの特定のパラメータを計算した10 。
このプロトコルは、分子を研究する際の重要なアプローチを記述する半径方向の移動における機構。短いヘアピンRNAまたはDNA発現プラスミドを使用することにより、目的のほとんどすべての遺伝子をノックダウンまたは過剰発現させることができる。エレクトロポレーションとCre-LoxPシステムを組み合わせる強力なアプローチです。 Creリコンビナーゼによる条件変異(「floxed」)マウスの脳のトランスフェクションは、モザイク変異体状況を生じ、野生型細胞に囲まれた単一の変異ニューロンの選択的分析を可能にする。このようにして、移動するニューロンにおける細胞自律的分子機構を調べることができる。また、機能的なレスキュー実験も容易に行えます。エレクトロポレーションされた脳スライスの経時的な一連の準備は、固定された脳切片から得られるよりもずっと多くの情報を提供する単一の移動ニューロンの移動挙動を動的に分析することを可能にする。一度習得- - 子宮内エレクトロポレーション3 では 、 図4は、初期トレーニングが必要ですが、Aでありますインビボで大脳皮質のニューロンを再現可能にトランスフェクトする迅速かつ直接的な技術。本明細書に記載されたプロトコールでは、晩年生まれの上層の新皮質投射ニューロンが生まれたときのE14.5の胎内電気穿孔で使用した 。 胎内での早期発達の深層投影ニューロンの研究のために、エレクトロポレーションは、初期発達段階( すなわち、 E12.5)で行われなければならない13 。原理的には、プロトコールを用いて、介在ニューロン14および小脳顆粒細胞15の移動を含む、エレクトロポレーションでトランスフェクトすることができる脳における他のニューロン亜集団の移動を研究することもできる。
我々が記述するスライス培養プロトコルはPolleuxとまあ12から適合させた、以前、我々はSTUに子宮外エレクトロ 16、17のためにそれを使用していますdy海馬の発達。最も重要なことに、脳スライスは、生存能力を維持するために、手順全体を通して慎重に扱われなければならない。我々は、倒立顕微鏡と光学品質のガラス底皿を使用して、細胞培養インサートに載っているスライス培養物をイメージングする。この構成はセットアップが非常に簡単であり、目的がスライス培養または培地と決して接触しないので、無菌状態を可能にする。しかしながら、十分に高い開口数(0.6以上)を有する長い作動距離対物レンズ(> 2mm)が必要である。他の研究では、ガラスの下に直接脳スライスを入れ、可能な短い自由作動距離と目標を使用する代わりにスライスし、修正するためにコラーゲンマトリックス18、19を使用していました。しかし、細胞培養インサートを使用すると、取り扱いが簡単で、再現性のある結果が得られ、研究者は調製後1〜2日でも脳切片の生存能力を亢進させる(データは示さず)。別の重要な問題は、レーザ光によるスライスの損傷に関する。私たちは、高感度のハイブリッド検出器を使用しました。これにより、レーザー出力を最小限に抑えながら、タイムラプスイメージングに十分な蛍光シグナルを得ることができました。多光子イメージングを使用することにより、光損傷がさらに低減され、従来の共焦点顕微鏡と比較してより深い組織浸透ならびにより効率的な光検出が可能になる。
ニューロンの移動を研究することの有用性にもかかわらず、プロトコールには限界があり、インタクトな脳におけるニューロンの移動の状況を完全に保持することはできない。細胞外マトリックス、接着剤間の接点、及び遊走ゾーン内脈管構造は、動的ニューロン20、21の移行半径方向に影響を与えることができます。具体的には、上層ニューロンは、彼らの移動22 。イメージングを成功させるためには、皮質の幅全体を通してそれらのプロセスを拡張するGFPエレクトロポレーションされた放射状グリア細胞を用いて脳スライスを選択することが重要である。放射状グリア骨格が脳の軟膜表面に達する前に切断された「斜面切片」は、さらなる分析から捨てるべきである。場合によっては、脳切片の空気表面で細胞死が起こることがあり、画像取得を試料内のより深い領域に制限することがある。培養された脳スライス中のエレクトロポレーションされたニューロンは、インビボで電気穿孔されたニューロンと比較して効率的に移動しない可能性があり、それは調製からの回復が不十分であることに起因し得る。これには、実験的および制御的状況の両方についての複数のスライス培養物の分析、および代表的なデータセットの重要な解釈が必要である。場合によっては、子宮内電気穿孔に関連する傷害は、胚死または構造変化を引き起こし得る拡大された心室、非対称に薄くされた皮質、またはDNA注入に起因するグリアの瘢痕形成を含む脳のイオン。そのような場合、サンプルはさらなる分析から捨てるべきです。
胚のドナーからの脳スライスは膜挿入物23でよく生き残るが、分析はニューロンの移動を含む早期発生事象に限定されており、樹状突起発達またはシナプス形成のような後の事象の研究には使用していない。要約すると、我々は、神経発達障害に関与する遺伝子の機能を解析するために容易に適合させることができる、スライス培養におけるエレクトロポレーションされたニューロンの神経移動を直接的かつ動的に研究するための詳細なプロトコルを提供する。
開示事項
著者は何も開示することはない。
謝辞
私たちはJacqueline Andratschke、Elena Werle、Sachi Takenaka、Matthias Tobererに優れたテクニカル・アシスタンス、そしてVictor Tarabykinに有益な議論をしてくれたことに感謝します。この作業は、Deutsche ForschungsgemeinschaftのSB(BR-2215)への助成によって支えられました。
資料
| Name | Company | Catalog Number | Comments |
| isoflurane | Abbott Laboratories | 506949 | Forene |
| 6-well plate | Corning | 351146 | |
| 12-well plate | Corning | 351143 | |
| non-absorbable surgical suture | Ethicon | K890H | 3/8 circle, 13 mm, taper point |
| Micro Adson Forceps | Fine Science Tools | 11018-12 | serrated, length: 12 cm |
| fine scissors | Fine Science Tools | 14063-09 | angled to side, length: 9 cm |
| Mathieu Needle Holder | Fine Science Tools | 12510-14 | tungsten carbide, length: 14 cm |
| fine tipped forceps | Fine Science Tools | 11370-40 | straight, 11 cm |
| Vannas Tübingen Spring Scissors | Fine Science Tools | 15005-08 | angled up, 9.5 cm |
| ring forceps | Fine Science Tools | 11103-09 | OD: 3mm, ID, 2.2 mm, length: 9 cm |
| HBSS (10X) | Gibco | 14180046 | |
| L-Glutamine | Gibco | 25030081 | |
| Penicillin/Streptomycin | Gibco | 15140122 | |
| horse serum | Gibco | 26050088 | |
| BME | Gibco | 41010026 | |
| borosilicate glass capillaries | Harvard Apparatus | 30-0016 | 1.0 OD x 0.58 ID x 100 L mm |
| anesthsesia system | Harvard Apparaus | 72-6471 | |
| anesthetizing chamber | Harvard Apparaus | 34-0460 | |
| fluosorber filter canister | Harvard Apparaus | 34-0415 | |
| low melting point agarose | Invitrogen | 16520100 | |
| vibrating blade microtome | Leica | VT1200 S | |
| fluorescence stereo microscope | Leica | M205 FA | |
| stereo microscope | Leica | M125 | |
| inverted fluorescence tissue culture microscope | Leica | DM IL LED | |
| confocal laser scanning microscope | Leica | TCS SP5II | |
| hybrid detector | Leica | HyD | |
| objective, 40x/0.60 NA | Leica | 11506201 | |
| microscope temperature control system | Life Imaging Services | Cube, Brick & Box | |
| cell culture insert | Millipore | PICM0RG50 | |
| microgrinder | Narishige | EG-45 | use 38° angle for beveling |
| microinjector | Parker Hannifin | 052-0500-900 | Picospritzer III |
| carprofen | Pfizer Animal Health | NDC 61106-8507 | Rimadyl |
| emdedding mold | Polysciences | 18986-1 | |
| endotoxin-free plasmid maxi kit | Qiagen | 12362 | |
| fast green | Sigma | F7252 | |
| laminin | Sigma | L2020 | |
| poly-L-lysine | Sigma | P5899 | |
| HEPES | Sigma | H4034 | |
| D-glucose | Sigma | G6152 | |
| calcium chloride | Sigma | C7902 | |
| magensium sulfate | Sigma | M2643 | |
| sodium bicarbonate | Sigma | S6297 | |
| square wave electroporator | Sonidel | CUY21EDIT | |
| tweezers with 5 mm platinum disk electrodes | Sonidel | CUY650P5 | |
| micropipette puller | Sutter Instrument | P-97 | |
| box filament | Sutter Instrument | FB255B | 2.5 mm x 2.5 mm |
| micro-spoon spatula | VWR | 231-0191 | 185 mm x 5 mm |
| glass bottom dish, 50 mm | World Precision Instruments | FD5040-100 |
参考文献
- Evsyukova, I., Plestant, C., Anton, E. S. Integrative mechanisms of oriented neuronal migration in the developing brain. Annu Rev Cell Dev Biol. 29, 299-353 (2013).
- Kwan, K. Y., Sestan, N., Anton, E. S. Transcriptional co-regulation of neuronal migration and laminar identity in the neocortex. Development. 139 (9), 1535-1546 (2012).
- Saito, T., Nakatsuji, N. Efficient gene transfer into the embryonic mouse brain using in vivo electroporation. Dev Biol. 240 (1), 237-246 (2001).
- Tabata, H., Nakajima, K. Efficient in utero gene transfer system to the developing mouse brain using electroporation: visualization of neuronal migration in the developing cortex. Neuroscience. 103 (4), 865-872 (2001).
- LoTurco, J. J., Bai, J. The multipolar stage and disruptions in neuronal migration. Trends Neurosci. 29 (7), 407-413 (2006).
- Noctor, S. C., Martinez-Cerdeno, V., Ivic, L., Kriegstein, A. R. Cortical neurons arise in symmetric and asymmetric division zones and migrate through specific phases. Nat Neurosci. 7 (2), 136-144 (2004).
- Tabata, H., Nakajima, K. Multipolar migration: the third mode of radial neuronal migration in the developing cerebral cortex. J Neurosci. 23 (31), 9996-10001 (2003).
- Pacary, E., et al. Proneural transcription factors regulate different steps of cortical neuron migration through Rnd-mediated inhibition of RhoA signaling. Neuron. 69 (6), 1069-1084 (2011).
- Tabata, H., Nagata, K. Decoding the molecular mechanisms of neuronal migration using in utero electroporation. Medical Molecular Morphology. 49 (2), 63-75 (2016).
- Wiegreffe, C., et al. Bcl11a (Ctip1) Controls Migration of Cortical Projection Neurons through Regulation of Sema3c. Neuron. 87 (2), 311-325 (2015).
- John, A., et al. Bcl11a is required for neuronal morphogenesis and sensory circuit formation in dorsal spinal cord development. Development. 139 (10), 1831-1841 (2012).
- Polleux, F., Ghosh, A. The slice overlay assay: a versatile tool to study the influence of extracellular signals on neuronal development. Sci STKE. (136), pl9 (2002).
- Greig, L. C., Woodworth, M. B., Galazo, M. J., Padmanabhan, H., Macklis, J. D. Molecular logic of neocortical projection neuron specification, development and diversity. Nat Rev Neurosci. 14 (11), 755-769 (2013).
- De Marco Garcia, N. V., Fishell, G. Subtype-selective electroporation of cortical interneurons. J Vis Exp. (90), e51518 (2014).
- Holubowska, A., Mukherjee, C., Vadhvani, M., Stegmuller, J. Genetic manipulation of cerebellar granule neurons in vitro and in vivo to study neuronal morphology and migration. J Vis Exp. (85), (2014).
- Venkataramanappa, S., Simon, R., Britsch, S. Ex utero electroporation and organotypic slice culture of mouse hippocampal tissue. J Vis Exp. (97), (2015).
- Simon, R., et al. A dual function of Bcl11b/Ctip2 in hippocampal neurogenesis. EMBO J. 31 (13), 2922-2936 (2012).
- Youn, Y. H., Pramparo, T., Hirotsune, S., Wynshaw-Boris, A. Distinct dose-dependent cortical neuronal migration and neurite extension defects in Lis1 and Ndel1 mutant mice. J Neurosci. 29 (49), 15520-15530 (2009).
- Nadarajah, B., Brunstrom, J. E., Grutzendler, J., Wong, R. O., Pearlman, A. L. Two modes of radial migration in early development of the cerebral cortex. Nat Neurosci. 4 (2), 143-150 (2001).
- Higginbotham, H., Yokota, Y., Anton, E. S. Strategies for analyzing neuronal progenitor development and neuronal migration in the developing cerebral cortex. Cereb Cortex. 21 (7), 1465-1474 (2011).
- Stubbs, D., et al. Neurovascular congruence during cerebral cortical development. Cereb Cortex. 19, i32-i41 (2009).
- Ayala, R., Shu, T., Tsai, L. H. Trekking across the brain: the journey of neuronal migration. Cell. 128 (1), 29-43 (2007).
- Humpel, C. Organotypic brain slice cultures: A review. Neuroscience. 305, 86-98 (2015).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved