Method Article
Расширение и адипогенез Индукция адипоцитов-предшественников из периваскулярной жировой ткани, изолированной магнитоактивированной сортировкой клеток
В этой статье
Резюме
Здесь мы сообщаем о способе выделения популяций клеток-предшественников Adipocyte (APC) из периваскулярной жировой ткани (PVAT) с использованием магнитно-активированной сортировки клеток (MCS). Этот метод позволяет увеличить выделение APC на грамм жировой ткани по сравнению с флуоресцентно-активированной сортировкой клеток (FACS).
Аннотация
Расширение периваскулярной жировой ткани (PVAT), основного регулятора сосудистой функции через паракринную сигнализацию, напрямую связано с развитием гипертонии во время ожирения. Степень гипертрофии и гиперплазии зависит от местонахождения депо, пола и типа фенотипов клеток-предшественников адипоцитов (APC). Методы, используемые для изоляции APC и преадипоцитов за последние 10 лет, значительно повысили точность, с которой отдельные клетки могут быть идентифицированы на основе определенных маркеров поверхности клеток. Однако выделение APC и адипоцитов может быть проблемой из-за хрупкости клетки, особенно если интактная клетка должна быть сохранена для применений клеточной культуры.
Магнитно-активированная сортировка клеток ( MCS) обеспечивает метод выделения большего числа жизнеспособных APC на единицу веса жировой ткани. APC, собранный MCS, может использоваться для протоколов in vitro для расширения preaДипоциты и дифференцировать их в адипоциты с использованием коктейлей фактора роста, позволяющих анализировать плодовитый и адипогенный потенциал, сохраняемый клетками. Этот эксперимент был сосредоточен на аортальных и брыжеечных складах PVAT, которые играют ключевую роль в развитии сердечно-сосудистых заболеваний во время расширения. Эти протоколы описывают методы выделения, расширения и дифференциации определенной совокупности APC. Этот протокол MCS позволяет использовать изоляцию в любом эксперименте, в котором требуется сортировка ячейки с минимальным оборудованием или обучением. Эти методы могут помочь в дальнейших экспериментах для определения функциональности конкретных популяций клеток на основе присутствия маркеров клеточной поверхности.
Введение
Периваскулярная жировая ткань (PVAT), из-за ее непосредственной близости к кровеносным сосудам, является основным сигнальным компонентом паракрина в функции сосудов. Расширение этой жировой ткани зависит от фенотипа клеток-предшественников Adipocyte (APC), присутствующих 2 , 3 . Выделение клеток из жировых тканей затруднено, поскольку первичные адипоциты являются хрупкими, плавучими и имеют размер. Некоторые методы изоляции также могут изменять фенотип и морфологию клеток путем увеличения синтеза воспалительных белков и уменьшения экспрессии адипогенного гена 4 , подчеркивая важность протокола, который поддерживает целостность клеток.
Культура первичных клеток и специфических субпопуляций преадипоцитов дает редукционистский подход к росту in vivo и поддерживает эквивалентный клеточный генетический состав 5 , хотя работа tiЯ с этими клетками ограничен из-за ухудшения со старением или старения 6 . Preadipocytes из различных жировых складов, в том числе подкожных и оментальных складов, также демонстрируют различия в пролиферации 7 , что подчеркивает важность сбора клеток из конкретных анатомических сайтов. Ячейки-предшественники из не-PVAT белых жировых депо были охарактеризованы в предыдущих исследованиях 7 , 8 , 9 , но меньше известно о фенотипах PVAT APC.
Описанные здесь методы позволяют анализировать конкретные и определенные популяции APC с минимальным воздействием на их морфологию, жизнеспособность и потенциал для пролиферации и дифференциации. Магнитоактивированная сортировка клеток (MCS) применима к нисходящим приложениям, таким как культура, поскольку шарики растворяются без изменения ячейки. MCS также является экономичным, и как только антитело conЦентровки были стандартизированы, потребность в анализе проточной цитометрии минимальна. Исследования in vitro с предшественниками PVAT также могут дать представление о потенциале, который могут иметь эти первичные клетки.
протокол
Все процедуры, описанные в настоящем документе, следуют руководящим принципам, установленным Институтом по уходу и использованию животных (IACUC) Мичиганского государственного университета. Все буферы и медиа должны быть защищены от света.
1. Подготовка буферов, средств массовой информации и инструментов
- Приготовить раствор Кребса Рингера с бикарбонатом-буферным раствором (KRBB): 135 мМ хлорида натрия, 5 мМ хлорида калия, 1 мМ сульфата магния, 0,4 мМ двухосновного фосфата калия, 5,5 мМ глюкозы, 1% антибиотика / антимикотика (10000 единиц / мл пенициллина, 10000 мкг / Мл стрептомицина, 25 мкг / мл амфотерицина В) и 10 мМ HEPES (pH = 7,4). Этот раствор стабилен в течение 3 недель при хранении в стерильном состоянии и при 4 ° С.
- Подготовьте раствор коллагеназы типа 1: 1 мг / мл в KRBB с 4% альбумином бычьей сыворотки (BSA). Этот раствор следует поддерживать при 37 ° C и стабилен в течение 4 часов.
- Подготовьте раствор буфера для лизиса эритроцитов: 154 мМ хлорида аммония, 10 мМ бикарбоната калия, И 0,1 мМ ЭДТА. Хранить при температуре 4 ° C в течение одного месяца.
- Подготовка буферного блока MCS: DMMS / F12, 10% фетальная бычья сыворотка (FBS), 5% нормальная сыворотка осла, 40 мкл / мл F (ab) Фрагмент Donkey Anti-Rat IgG. Хранить при температуре 4 ° C в течение одного месяца.
- Подготовьте буферный раствор MCS: солевой раствор с фосфатным буфером (PBS, pH = 7,5), 0,5% BSA и 2 мМ EDTA. Хранить при температуре 4 ° C в течение одного месяца. Раствор дегаза нагревают до 37 ° С в стеклянном контейнере, а затем применяют вакуум в течение 15 с. Оставьте неиспользованную буферную печать.
- Подготовить основную среду стромальной сосудистой фракции (SVF): модифицированная Дульбекко среда орлов (DMEM): F12, 15% сыворотка плода теленка (FCS), 1% антибиотик / антимикотик (10000 единиц / мл пенициллина, 10000 мкг / мл стрептомицина, 25 мкг / Мл амфотерицина В), 44,05 мМ бикарбоната натрия, 100 мкМ аскорбиновой кислоты, 33 мкМ биотина, 17 мкМ пантотената, 2 мМ L-глутамина и 20 мМ HEPES. Держите стерильным и при 4 ° C в течение 2 недель.
- Подготовьте APC &# 160; медиа: базальная среда с дополнительными факторами роста, включая эпидермальный фактор роста 10 нг / мл), фактор ингибирования лейкемии (10 нг / мл), тромбоцитарный фактор роста BB (10 нг / мл) и основной фактор роста фибробластов ( 5 нг / мл). Держите стерильным и при 4 ° C в течение 2 недель.
- Подготовить Индукционные среды APC: APC Media с 10% FBS, 2,5 мкг / мл инсулина, 0,5 мМ 2-изобутил-1-метилаксантина (IBMX), 1 мкМ дексаметазона и 200 мкМ T3 (трийодтиронин тиреоидный гормон). Держите стерильным и при 4 ° C в течение 2 недель.
2. Изоляция предшественников адипоцитов
- Анестезируйте крысу в соответствии с институциональными руководящими принципами. Поместите крысу в дорзальное положение. Подтвердите глубину анестезии через пальцы и потерю рефлекторного ответа на этот болезненный раздражитель.
ПРИМЕЧАНИЕ. В этом протоколе используются 10-недельные крысы Sprague Dawley и 70 мг / кг пентобарбитала, полученные через внутрибрюшинную инъекцию. - Сделайте вертикальный срединный разрез wС ножницами вдоль грудины в грудной области и в промежностной области. Получите доступ к брюшной полости и выведите верхнюю брыжеечную артерию, небольшие сосуды для брыжеечной инсульт (mPVAT) и грудную аорту (aPVAT).
- Разделите все соединения с брыжейкой и аортой и удалите сосуды с животных. Изолируйте PVAT с помощью рассекающего микроскопа и чашки Петри, заполненной KRBB, для просмотра сосудов и выделения PVAT.
- В этом эксперименте собирайте гонадальную (GON) жировую, чтобы представлять не-PVAT жировое депо. Поместите изолированные жировые накладки на лед в KRBB с 10 мМ HEPES (pH = 7,4).
- В кожухе для биобезопасности перенесите около 50 мг ткани в 1,7 мл пробирку с 1 мл раствора коллагеназы типа I и мице с тканевыми ножницами (1 - 3 мм).
- Дайте образцы, инкубируя при 37 ° C в инкубаторе для гриля (или инкубаторе с орбитальным шейкере) в течение 1 часа. В кожухе для биобезопасности последовательно фильтруйте переваренный материал через 100 и 40 Μm в пробирку объемом 50 мл. Центрифугируют полученный фильтрат при 4 ° С в течение 10 мин при 300 × g.
ПРИМЕЧАНИЕ. Все шаги в этом протоколе вперед должны выполняться в шкафу для биобезопасности, чтобы держать клетки стерильными. - Вылейте супернатант и ресуспендированные гранулы, содержащие клетки SVF, в 1 мл 1X раствора буфера для лизиса эритроцитов и перенесите в микроцентрифужную пробирку объемом 1,7 мл. Инкубируйте клетки в течение 5 мин при комнатной температуре, защищенные от света и центрифугирования при 4 ° С в течение 5 мин при 300 х g.
- Вылейте супернатант и повторно суспендируйте оставшийся осадок клеток в SVF Basal Media. Соберите 20 мкл суб-выборки для подсчета живых клеток с помощью Trypan Blue Solution.
ПРИМЕЧАНИЕ. Количество ячеек SVF, которые могут быть выделены, зависит от сайта. Среднее количество собранных SVF на мг ткани: aPVAT = 5,0 ± 2,0 × 10 3 , mPVAT = 1,04 ± 0,62 × 10 4 , GON = 2,4 ± 1,2 × 10 5 .
3. Магнитоактивированная сортировка клеток
_content "> ПРИМЕЧАНИЕ. Изолируйте APC из SVF на основе маркеров клеточной поверхности CD34 и PDGFRα, выполнив все шаги при 4 ° C.- Спиновые клетки в течение 5 мин при 300 × g. Вылейте супернатант и ресуспендируйте осадок клеток в блокирующем буфере MCS при 1 × 10 6 клеток / мл и инкубируйте в течение 20 мин.
ПРИМЕЧАНИЕ. Клеточные суспензии 1 × 10 6 - 2 × 10 8 клеток / мл можно эффективно отделить. - Инкубируйте клетки с 5 мкл FITC-конъюгированного мышиного анти-CD34 (1 мкг / 1 × 10 6 клеток) в течение 30 минут при 4 ° C. Спиновые клетки в течение 5 мин при 300 xg и 4 ° C.
- Инкубируйте 4 мкл микрочипов против FITC и 96 мкл буфера MCS (общий объем 100 мкл) в течение 5 мин при 4 ° C в темноте для отделения CD34 + и CD34-клеток.
- Прикрепите магнитный сепаратор к подставке и поместите колонку MultiSort (MS) с крыльями колонны спереди, в разделитель. Поместите 5 млСборной трубки под колонкой MS в верхнем держателе трубки.
- Подготовьте колонку MS с помощью промывки буфером MCS. Примените 500 мкл буфера MCS поверх столбца и пропустите буфер. Откажитесь от сточных вод и замените собирающую трубку.
- Загрузите антитело, помеченное клеточной суспензией, на подготовленную колонку MS. Собирайте поток, содержащий немаркированные клетки.
- Вымойте MS колонку с 500 мкл дегазированного буфера MCS 3x. Соберите немаркированные ячейки, которые проходят и соединяются с потоком с предыдущего шага.
- Удалите колонку MS из магнитного сепаратора и поместите ее на новую трубку для сбора. Пипеткой 1 мл буфера MCS на колонку MS. Немедленно промойте фракцию магнитомаркированными ячейками прочно, но медленно, используя плунжер, поставляемый с колонкой, чтобы не допустить избыточного газа в колонну.
ПРИМЕЧАНИЕ. Изолированные номера ячеек будут меняться по сайту. Среднее количество CD34 + APC, выделенное из популяции SVF заМг ткани: aPVAT = 2,6 ± 0,43 × 10 2 , mPVAT = 9,6 ± 1,4 × 10 2 , GON = 1,3 ± 0,22 × 10 3 . - Спиновые клетки в течение 5 мин при 300 × g и 4 ° C. Инкубируйте фракцию CD34 +, собранную в 10 мкл раствора 1: 200/1 × 10 6 клеток Rabbit anti-PDGFR в течение 30 мин при 4 ° C.
- Центрифужные клетки снова в течение 5 мин при 300 xg и 4 ° C. Инкубируйте меченые клетки с помощью 4 мкл микробега с кроличьим IgG и 96 мкл буфера MCS, повторяя этапы с 3.3 по 3.7 для выделения.
ПРИМЕЧАНИЕ. Изолированные номера ячеек будут меняться по сайту. Среднее количество PDGFRα + APC, выделенное из CD34 + популяции на мг ткани, составляет: aPVAT = 2,4 ± 0,64, mPVAT = 8,4 ± 2,4, GON = 10,4 ± 1,9, что составляет 0,5-10% от ранее выделенной популяции.
- Центрифужные клетки снова в течение 5 мин при 300 xg и 4 ° C. Инкубируйте меченые клетки с помощью 4 мкл микробега с кроличьим IgG и 96 мкл буфера MCS, повторяя этапы с 3.3 по 3.7 для выделения.
4. Культура клеток и индукция адипогенеза
- Культура SVFИ APC в 6-луночных планшетах для культивирования тканей в базальной среде с заменой каждые 2 дня. После 3 последовательных проходов пластинку в черных 96-луночных планшетах для культивирования ткани в ячейках 1 ч10 2 ч / лунку для анализов пролиферации, которые оценивают через 8, 24, 48 и 96 ч и 50 000 клеток / лунку в 24-луночных планшетах или 10 000 клеток / лунку в 48-луночных планшетах для культивирования тканей для анализа адипогенеза, которые являются качественными и количественными.
- Дополнить базальную среду APC в течение 48 ч после слияния и до индукции с морфогенным белком кости 4 (3,3 нмоль / л), как указано для дифференциации 10 . Индуцировать клетки через 48 ч 100% слияния (день 0) с использованием Индукционной среды APC для инкубации клеток.
- Через 48 часов смените носитель для поддержания клеток в индукционной среде APC без IBMX и дексаметазона в течение 14 дней с изменениями среды каждые 48 часов.
- Изоляция MCS, подтвержденная FACS.
- Возьмите 50 мкл (50 000 клеток) суб-образец магнитной сепарацииИ промывают раствором FACS.
- Центрифужные клетки и ресуспендируют в 100 мкл 1: 1000 раствора ослиного антикроличного IgG Dylight 405 для маркировки клеток PDGFRα + . Инкубируйте в течение 30 минут, защищенных от света и при 4 ° C.
- Промывают клетки и ресуспендируют в 200 мкл 2% -ного раствора формальдегида до времени для анализа с использованием фильтров 488 нм (FITC) и 405 нм (Dylight 405) на проточном цитометре.
ПРИМЕЧАНИЕ. Накопление липидов культивированными клетками количественно оценивают с использованием анализа флуоресценции липофильного адипогенеза в микропланшет-ридере, измеряющем флуоресценцию, и используют преадипоциты в качестве калибраторов для накопления липидов. Концентрация липидов также качественно измеряется окрашиванием липидным красителем и визуализацией, выполненной на инвертированном микроскопе, оснащенном камерой, что составляет процент от общего количества клеток, которые имеют или не содержат липидного наблюдаемого. Любой считыватель пластинок, способный измерять флуоресценцию с возбуждением при 485 нм и эмиссию при 572Нм подходит для анализа, а также любого микроскопа с камерой, способной захватывать цифровые изображения.
Результаты
Пролиферативная способность преадипоцитов и адипогенный потенциал предшественников адипоцитов являются характеристиками, которые поддерживаются in vitro 11 . Пролиферацию in vitro изолированных SVF и APC из aPVAT, mPVAT и GON самцов крыс оценивали через 8, 24, 48 и 96 ч после нанесения покрытия с использованием количественного анализа ДНК. Никаких различий в частоте расширения SVF не наблюдалось в любой момент времени, за исключением APC из aPVAT, у которого было меньше пролиферации на 96 ч по сравнению с клетками SVF с того же сайта ( рисунок 1 ).
Конфлюентный АРС, стимулированный морфогенным белком костей 4 (BMP4) в течение 48 ч перед стандартной индукцией 12, показал дифференциацию. Это было видно из-за большего накопления липидов в капельках, как оценивалось как методом анализа флуоресцентного липида ( рисунок 2A ) и масляного красного окрашивания ( рисунок 2 B ).
При сравнении выхода APC изоляция MCS обеспечивала большее количество клеток, готовых к культивированию, по сравнению с FACS. ( Рисунок 3 ). Важно отметить, что распределение и жизнеспособность популяций APC (CD34 + и PDGFRα + ) были сходными между MCS и FACS. Жизнеспособность клеток, определяемая окрашиванием Trypan Blue для подсчета постсоединений, была одинаковой для обеих процедур изоляции (FACS = 71,57 ± 11,09, MCS = 79,25% ± 7,47). Эти данные показывают, что изоляция MCS APC дает большее количество жизнеспособных APC по сравнению с MCS.
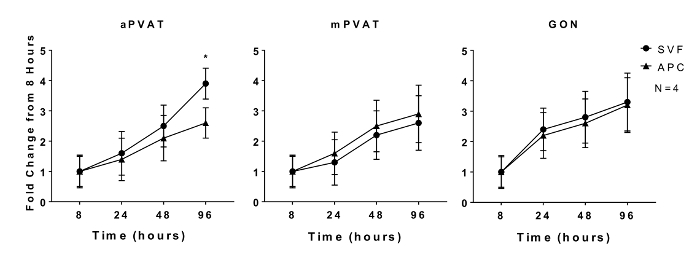
Рисунок 1 : Распространение рекламы in vitroКлетки-предшественники ipocyte (APC) подвержены анатомическому расположению. Стромальная сосудистая фракция (SVF) и APC были выделены из аортальной и брыжеечной периваскулярной жировой ткани (aPVAT и mPVAT соответственно) и гонадальной жировой ткани у 10-недельных самцов крыс. Пролиферацию клеток измеряли с помощью анализа количественной оценки ДНК в моменты времени 8, 24, 48 и 96 часов после посева. Данные выражаются как увеличение складки за 8 ч базовой линии ± SEM (N = 4). Значение обозначается * (P <0,05). Рисунок, измененный от Contreras et al . 2016 13 . Нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.

Рисунок 2 : Аддипоцитарные клетки-предшественники (APC).Способности между депо, но большее накопление липидов по сравнению со стромальной сосудистой фракцией (SVF). Клетки индуцировали через 48 ч слияния и подвергали воздействию BMP4 с последующим 48 ч воздействием дексаметазона и 3-изобутил-1-метилксантина, а затем поддерживали в поддерживающей среде 14 дней с изменением среды каждые 48 часов. ( A ) Анализ поглощения липидов дифференцированного APC с данными, выраженными как отношение недифференцированных преадипоцитов: дифференцированные адипоциты (преадипоциты: адипоциты) в относительных единицах флуоресценции (RFU) ± SEM (N = 4). ( B ) Окрашивание масла Red O (ORO) APC и SVF с данными, выраженными в процентах от клеток с липидом (поглощение ORO) ± SEM (N = 4). Значение обозначается * (P <0,05). Рисунок, измененный от Contreras et al. 2016 13 . Нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.

Рисунок 3 : Выход изолята жизнеспособных клеток-предшественников адипоцитов (APC) улучшается с помощью магнитно-активированной сортировки клеток (MCS). Экспрессия поверхностного маркера CD34 + ( A ) и PDGFRα + ( B ) в SVF, выделенном из периваскулярных жировых тканей (аорта = aPVAT, mesenteric = mPVAT) с использованием MCS и FACS. Данные выражаются в виде среднего количества клеток, выделенных из 50 мг ткани - SEM (N = 4). Значение обозначается * (P <0,05). Нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Обсуждение
Центральным направлением настоящего эксперимента является изоляция, расширение и адипогенная индукция APC из хранилищ PVAT. Здесь мы представляем протокол для выделения APC на основе идентификации клеток, экспрессирующих поверхностные маркеры CD34 и PDGFRα. Эти поверхностные белки были ранее идентифицированы на APC с высокими скоростями пролиферации и возможностью дифференцироваться в белые или коричневые адипоциты в различных жировых депо 14 , 15 . Выбирая клетки на основе этих специфических маркеров, мы смогли выделить похожие популяции APC из нескольких жировых депо, которые соответствуют фенотипу адипоцитов, который наблюдается в выбранном PVAT 13 . В наших экспериментах мы улучшили дифференциацию APC, добавив фактор роста BMP4. Ранее Macotela и его коллеги продемонстрировали, что у конкретных популяций APC из висцеральных жировых складов активность BMP меньше, чем уПодкожные депо при дифференцировке, если культуральная среда не была дополнена адипогенными факторами роста BMP2 или BMP4 12 , 16 , 17 , 18 .
Поскольку выделение отдельных клеток из жировой ткани затруднено из-за хрупкости клеток, использование MCS обеспечивает эффективный метод изоляции клеток при меньшей стоимости расходных материалов, оборудования и учебных ресурсов. Важно отметить, что выход APC может зависеть от возраста или размера животного, а также от изменения температуры среды и неспособности поддерживать стерильную среду изоляции. Культивирование клеток в нормоксии также важно для пролиферации и дифференцировки 19 , поэтому поддержание условий инкубационного воздуха является неотъемлемой частью практики культуры. Скорости центрифугирования могут быть увеличены до 800 xg, если достаточное количество клеточных гранул не образуется в течение tОн изоляционный процесс. Также может потребоваться проверка истечения антител, поскольку конъюгированный флуорохром FITC может со временем ухудшаться. Изменение количества коллагеназы типа I может также потребовать внесения изменений в процедуры пищеварения, поскольку партии могут варьироваться в зависимости от потенции. При использовании другого вида, кроме крысы, специфическая сыворотка и IgG в блокирующем буфере также могут быть необходимы, если виды хозяина антител отличаются от тех, которые используются здесь.
Среди преимуществ MCS над FACS заключается в том, что экономически выгоднее, чем FACS, поскольку комплекты недороги и могут быть легко приобретены. Это также позволяет избежать приобретения, обслуживания и использования проточного цитометра. Использование MCS также допускает специфическое связывание без регулировки ворот для выбора и фоновой флуоресценции.
Ограничением для этого исследования является то, что он полагался на два маркера поверхности preadipocyte. Другие поверхностные маркеры preadipocyte приверженности и различийБыли выявлены инициации, такие как Zfp423, Sca1 и CD24, 20 , 21 . Эти маркеры могут точно идентифицировать выделенные клетки-предшественники адипоцитов конкретных фенотипов; Однако используемые здесь поверхностные маркеры были выбраны, поскольку клетки, экспрессирующие эти маркеры, обладают способностью индуцировать как коричневые, так и белые фенотипы 20 , 21 . Другим ограничением этого исследования было выборочное использование факторов роста в культуре APC. Другие коктейли фактора роста были эффективны при индукции адипогенеза 22 . Клеточная культура в этом исследовании также была ограничена тем фактом, что вся культура была выполнена в двухмерных культуральных планшетах. Хотя это норма культуры, клетки in vivo не размножаются таким образом. Культивирование в трехмерных средах может позволить дальнейшую гипертрофию и гиперплазию, поскольку она реплицирует естественную форму жировой стRucture 23 .
Из-за практичности и эффективности использования MCS этот протокол идеально подходит для изоляции APC, а также других типов ячеек в PVAT. Эта процедура также обеспечивает более эффективный способ индуцировать дифференциацию в культурах преадипоцитов. Минимальные затраты, оборудование и необходимое обучение позволяют использовать этот метод в любой лаборатории, желающей изолировать клетки на основе определенных поверхностных маркеров. Будущие приложения могут позволить изолировать другие популяции клеток или использовать более конкретные клеточные маркеры. Использование коктейлей фактора роста в приверженности клеткам может быть полезно при активации стволовых клеток
Раскрытие информации
Авторам нечего раскрывать.
Благодарности
Лаборатории Контрераса и Ватта и доктора Уильяма Рафаэля. Эти эксперименты поддерживали NHLBI F31 HL128035-01 (стандартизация протокола пищеварения), NHLBI 5R01HL117847-02 и 2P01HL070687-11A1 (животные) и NHLBI 5R01HL117847-02 (выделение клеток и культура).
Материалы
| Name | Company | Catalog Number | Comments |
| Tissue Dissection | |||
| Dissecting Dishes | Handmade with Silicone | ||
| Culture Petri Dish | Pyrex | 7740 Glass | |
| Silicone Elastomer | Dow Corning | Sylgard 170 | Kit |
| Braided Silk Suture | Harvard Apparatus | 51-7615 | SP104 |
| Stereomicroscope MZ6 | Leica | 10447254 | |
| Stereomaster Microscope Fiber-Optic Light Source | Fisher Scientific | 12562-36 | |
| Vannas Scissors | George Tiemann & Co | 160-150 | |
| Splinter Forceps | George Tiemann & Co | 160-55 | |
| Tissue Scissors | George Tiemann & Co | 105-400 | |
| KRBB Solution | |||
| Sodium Chloride | Sigma-Aldrich | 7647-14-5 | |
| Potassium Chloride | Sigma-Aldrich | 7447-40-7 | |
| Magnesium Sulfate | Sigma-Aldrich | 7487-88-9 | |
| Potassium Phosphate Dibasic | Sigma-Aldrich | 7758-114 | |
| Glucose | Sigma-Aldrich | 50-99-7 | |
| Antibiotic/Antimicotic | Corning | 30-004-CI | |
| HEPES | Corning | 25-060-CI | |
| Tissue Digestion | |||
| Collagenase Type 1 | Worthington Biochemical | LS004196 | |
| Bovine Serum Albumin (BSA) | Fisher Scientific | 9048-46-8 | |
| Red Blood Cell Lysis Buffer | BioLegend | 420301 | 1X Working Solution |
| Water Bath | Thermo-Fisher Scientific | 2876 | Reciprocal Shaking Bath |
| Biosafety Cabinet | Thermo-Fisher Scientific | 1385 | |
| Rotisserie Incubator | Daigger | EF4894C | |
| 100 µm Cell Strainer | Thermo-Fisher Scientific | 22-363-549 | Yellow |
| 40 µm Cell Strainer | Thermo-Fisher Scientific | 22-363-547 | Blue |
| Hemocytometer | Cole-Parmer | UX-79001-00 | |
| Trypan Blue | Sigma-Aldrich | 93595 | |
| Cell Isolation | |||
| OctoMACS Kit | Miltenyi Biotech | 130-042-108 | |
| (DMEM):F12 Medium | Corning | 90-090 | Medium Base |
| Fetal Bovine Serum (FBS) | Corning | 35016CV | USA Origins |
| Normal Donkey Serum | AbCam | AB7475 | |
| Anti-CD34 | Santa Cruz | SC-7324 | FITC-conjugated |
| Anti-PDGFRα | Thermo-Fisher Scientific | PA5-17623 | |
| Donkey Anti-Rabbit IgG | Jackson ImmunoResearch | 712-007-003 | |
| Phosphate-Buffered Saline (PBS) 10X | Corning | 46-013-CM | 1X Working Solution |
| EDTA | Fisher Scientific | 15575020 | |
| Cell Culture | |||
| CO2 Cell Incubator | Thermo-Fisher Scientific | 51030285 | Heracell 160i |
| 6-Well Plates | Corning | 3516 | TC-Treated |
| 48-Well Plates | Corning | 3548 | TC-Treated |
| 96-Well Plates, Black Wall | Corning | 353376 | TC-Treated |
| Sodium Bicarbonate | Sigma-Aldrich | 144-55-8 | TC-Treated |
| Fetal Calf Serum (FCS) | Corning | 35011CV | USA Origins |
| Ascorbic Acid | Sigma-Aldrich | 50-81-7 | |
| Biotin | Sigma-Aldrich | 58-85-5 | |
| Pantothenate | Sigma-Aldrich | 137-08-6 | |
| L-Glutamine | Corning | 61-030 | |
| Bone Morphogenic Protein 4 (BMP4) | Prospec Bio | CYT-081 | |
| Epidermal Growth Factor (EGF) | PeproTech | 400-25 | |
| Leukemia Inhibitory Factor | PeproTech | 250-02 | |
| Platelet-derived Growth Factor BB | Prospec Bio | CYT-740 | |
| Basic Fibroblast Growth Factor (bFGF) | PeproTech | 450-33 | |
| Insulin | Corning | 25-800-CR | ITS Solution |
| IBMX | Sigma-Aldrich | 28822-58-4 | |
| Dexamethasone | Sigma-Aldrich | 50-02-2 | |
| T3 (Triiodothyronine) | Sigma-Aldrich | 6893-023 | |
| Cell Analysis | |||
| CyQUANT Proliferation Assay | Thermo-Fisher Scientific | C7026 | |
| AdipoRed Fluorescence Assay Reagent | Lonza | PT-7009 | |
| Oil Red O Lipid Dye Reagent | Sigma-Aldrich | O1391 | In Solution |
| M1000 Microplate Reader | Tecan | ||
| Eclipse Inverted Microscope | Nikon | ||
| Digital Sight DS-Qil Camera | Nikon |
Ссылки
- Watts, S. W., et al. Chemerin connects fat to arterial contraction. Arterioscler Thromb Vasc Biol. 33 (6), 1320-1328 (2013).
- Dodson, M. V., et al. Adipose depots differ in cellularity, adipokines produced, gene expression, and cell systems. Adipocyte. 3 (4), 236-241 (2014).
- Police, S. B., Thatcher, S. E., Charnigo, R., Daugherty, A., Cassis, L. A. Obesity promotes inflammation in periaortic adipose tissue and angiotensin II-induced abdominal aortic aneurysm formation. Arterioscler Thromb Vasc Biol. 29 (10), 1458-1464 (2009).
- Ruan, H., Zarnowski, M. J., Cushman, S. W., Lodish, H. F. Standard isolation of primary adipose cells from mouse epididymal fat pads induces inflammatory mediators and down-regulates adipocyte genes. J Biol Chem. 278 (48), 47585-47593 (2003).
- Stacey, G. . in eLS. , (2001).
- Swim, H. E., Parker, R. F. Culture characteristics of human fibroblasts propagated serially. Am J Hyg. 66 (2), 235-243 (1957).
- Van Harmelen, V., Rohrig, K., Hauner, H. Comparison of proliferation and differentiation capacity of human adipocyte precursor cells from the omental and subcutaneous adipose tissue depot of obese subjects. Metabolism. 53 (5), 632-637 (2004).
- Roncari, D. A., Lau, D. C., Kindler, S. Exaggerated replication in culture of adipocyte precursors from massively obese persons. Metabolism. 30 (5), 425-427 (1981).
- Church, C. D., Berry, R., Rodeheffer, M. S. Isolation and study of adipocyte precursors. Methods Enzymol. 537, 31-46 (2014).
- Fontana, L., Eagon, J. C., Trujillo, M. E., Scherer, P. E., Klein, S. Visceral fat adipokine secretion is associated with systemic inflammation in obese humans. Diabetes. 56 (4), 1010-1013 (2007).
- Tchkonia, T., et al. Fat depot-specific characteristics are retained in strains derived from single human preadipocytes. Diabetes. 55 (9), 2571-2578 (2006).
- Macotela, Y., et al. Intrinsic differences in adipocyte precursor cells from different white fat depots. Diabetes. 61 (7), 1691-1699 (2012).
- Contreras, G. A., Thelen, K., Ayala-Lopez, N., Watts, S. W. The distribution and adipogenic potential of perivascular adipose tissue adipocyte progenitors is dependent on sexual dimorphism and vessel location. Physiol Rep. 4 (19), (2016).
- Lee, Y. H., Petkova, A. P., Granneman, J. G. Identification of an adipogenic niche for adipose tissue remodeling and restoration. Cell Metab. 18 (3), 355-367 (2013).
- Lee, Y. H., Petkova, A. P., Mottillo, E. P., Granneman, J. G. In vivo identification of bipotential adipocyte progenitors recruited by beta3-adrenoceptor activation and high-fat feeding. Cell Metab. 15 (4), 480-491 (2012).
- Ahrens, M., et al. Expression of human bone morphogenetic proteins-2 or -4 in murine mesenchymal progenitor C3H10T1/2 cells induces differentiation into distinct mesenchymal cell lineages. DNA Cell Biol. 12 (10), 871-880 (1993).
- Bowers, R. R., Lane, M. D. A role for bone morphogenetic protein-4 in adipocyte development. Cell Cycle. 6 (4), 385-389 (2007).
- Schulz, T. J., Tseng, Y. H. Emerging role of bone morphogenetic proteins in adipogenesis and energy metabolism. Cytokine Growth Factor Rev. 20 (5-6), 523-531 (2009).
- Choi, J. R., et al. In situ normoxia enhances survival and proliferation rate of human adipose tissue-derived stromal cells without increasing the risk of tumourigenesis. PLoS One. 10 (1), 0115034 (2015).
- Gupta, R. K., et al. Zfp423 expression identifies committed preadipocytes and localizes to adipose endothelial and perivascular cells. Cell Metab. 15 (2), 230-239 (2012).
- Rodeheffer, M. S., Birsoy, K., Friedman, J. M. Identification of white adipocyte progenitor cells in vivo. Cell. 135 (2), 240-249 (2008).
- Scott, M. A., Nguyen, V. T., Levi, B., James, A. W. Current methods of adipogenic differentiation of mesenchymal stem cells. Stem Cells Dev. 20 (10), 1793-1804 (2011).
- Edmondson, R., Broglie, J. J., Adcock, A. F., Yang, L. Three-dimensional cell culture systems and their applications in drug discovery and cell-based biosensors. Assay Drug Dev Technol. 12 (4), 207-218 (2014).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены