Method Article
磁気活性化細胞選別法により単離された血管周囲脂肪組織からの脂肪細胞前駆体の拡大および脂肪生成誘導
要約
ここでは、MCS(Magnetic-Activated Cell Sorting)を用いた脈管内脂肪組織(PVAT)からの脂肪細胞前駆細胞(APC)集団の単離方法を報告する。この方法は、蛍光活性化細胞選別(FACS)と比較した場合、脂肪組織のグラム当たりのAPCの単離の増加を可能にする。
要約
パラクラインシグナリングを介した血管機能の主要調節因子である血管周囲脂肪組織(PVAT)の拡大は、肥満時の高血圧の発症に直接関連する。肥大および過形成の程度は、デポの位置、性別、および存在する脂肪細胞前駆細胞(APC)表現型のタイプに依存する。過去10年間のAPCおよび前脂肪細胞分離のために使用された技術は、個々の細胞が特定の細胞表面マーカーに基づいて同定され得る正確さを大幅に改善した。しかしながら、APCおよび脂肪細胞の単離は、特にインタクトな細胞を細胞培養適用のために保持しなければならない場合、細胞の脆弱性のために困難であり得る。
磁気活性化細胞選別( MCS)は、脂肪組織の重量単位あたりより多くの生存APCを単離する方法を提供する。 MCSによって回収されたAPCは、インビトロプロトコールでプレア成長因子カクテルを使用してそれらを脂肪細胞に分化させ、細胞によって保持された多分性および脂肪生成能の分析を可能にする。この実験は、拡張中の心臓血管疾患の発症において重要な役割を果たす大動脈および腸間膜のPVATデポーに焦点を当てた。これらのプロトコルは、定義されたAPC集団を分離し、拡大し、そして区別するための方法を記載する。このMCSプロトコルは、最小限の設備またはトレーニングで細胞選別が必要なあらゆる実験で分離を使用することを可能にする。これらの技術は、細胞表面マーカーの存在に基づいて特定の細胞集団の機能性を決定するさらなる実験を助けることができる。
概要
脈管周囲脂肪組織(PVAT)は、血管に近接しているため、脈管機能1における主要なパラクリンシグナル伝達成分である。この脂肪組織の拡大は、存在する脂肪細胞前駆細胞(APC)の表現型に依存する2,3 。脂肪組織からの細胞の単離は、主要な脂肪細胞が壊れやすく、浮力があり、大きさの範囲があるため、困難である。特定の単離技術はまた、炎症性タンパク質合成を増加させ、脂肪生成遺伝子発現を減少させることによって細胞表現型および形態を変えることができ、細胞の完全性を維持するプロトコルの重要性を強調する。
初代細胞および特異的前脂肪細胞亜集団の培養は、インビボ増殖に対する還元主義的アプローチを提供し、同等の細胞遺伝的メイクアップ5を維持するが、これらの細胞の私は、老化や老化による劣化のために制限されています6 。皮下および大網デポーを含む様々な脂肪デポーからの前脂肪細胞もまた、特定の解剖学的部位から細胞を集めることの重要性を強調する増殖の差異7を示す。非PVAT白色脂肪細胞由来の前駆細胞は、以前の研究7,8,9において特徴付けられてきたが、PVAT APC表現型についてはあまり知られていない。
ここに記載された技術は、形態学、生存能力、および増殖および分化の可能性に最小限の影響を及ぼしながら、特異的および限定されたAPC集団の分析を可能にする。ビーズが細胞を変えずに溶解するので、磁気活性化細胞選別(MCS)は、培養などの下流の適用に適している。 MCSもまた経済的であり、一旦、抗体の欠点フローサイトメトリーアッセイの必要性は最小限に抑えられています。 PVAT前駆体を用いたインビトロ研究はまた、これらの初代細胞が有する可能性を垣間見ることができる。
プロトコル
本書に記載されているすべての手順は、ミシガン州立大学の機関動物管理および使用委員会(IACUC)によって制定されたガイドラインに従います。すべてのバッファーとメディアを光から保護する必要があります。
緩衝液、培地および器具の調製
- (KRBB):135mM塩化ナトリウム、5mM塩化カリウム、1mM硫酸マグネシウム、0.4mMリン酸二水素カリウム、5.5mMグルコース、1%抗生物質/抗真菌剤(10,000単位/ mLペニシリン、10,000μg / mLのストレプトマイシン、25μg/ mLのアンホテリシンB)、および10mMのHEPES(pH = 7.4)。この溶液は、4℃で滅菌した場合、3週間安定です。
- コラゲナーゼタイプ1溶液を調製する:4%ウシ血清アルブミン(BSA)を含むKRBB中に1mg / mL。この溶液は37℃で保存し、4時間安定です。
- 赤血球溶解緩衝溶液の調製:154mM塩化アンモニウム、10mM重炭酸カリウム、および0.1mMのEDTAを含む。 4℃で1ヶ月間保管してください。
- DMEM / F12培地、10%ウシ胎仔血清(FBS)、5%正常ロバ血清、40μL/ mL F(ab)断片ロバ抗ラットIgGを調製する。 4℃で1ヶ月間保管してください。
- MCS緩衝溶液:リン酸緩衝食塩水(PBS、pH = 7.5)、0.5%BSA、および2mM EDTAを調製する。 4℃で1ヶ月間保管してください。ガラス容器内で37℃に加熱し、次いで15秒間真空を適用することによって、脱ガス溶液。使用しないでください。
- (DMEM):F12,15%ウシ胎児血清(FCS)、1%抗生物質/抗真菌剤(10,000単位/ mLペニシリン、10,000μg/ mLストレプトマイシン、25μgのストレプトマイシン、 / mLアンホテリシンB)、44.05mM重炭酸ナトリウム、100μMアスコルビン酸、33μMビオチン、17μMパントテン酸塩、2mM L-グルタミン、および20mM HEPES。無菌状態で4℃で2週間まで保存してください。
- APC&白血病抑制因子(10 ng / mL)、血小板由来増殖因子BB(10 ng / mL)、および塩基性線維芽細胞増殖因子を含む基礎増殖培地(#160;培地: 5ng / mL)。無菌状態で4℃で2週間まで保存してください。
- APC誘導培地:10%FBS、2.5μg/ mLインスリン、0.5mM 2-イソブチル-1-メチルキサンチン(IBMX)、1μMデキサメタゾン、および200μMT3(トリヨードチロニン甲状腺ホルモン)を含むAPC培地を調製する。無菌状態で4℃で2週間まで保存してください。
2.脂肪細胞前駆細胞の単離
- 施設ガイドラインに従ってラットを麻酔する。ラットを背臥位に置く。つま先のつまみで麻酔の深さを確認し、この痛みを伴う刺激に対する反射応答の喪失を確認します。
注:このプロトコールは、10週齢のSprague Dawleyラットおよび70mg / kgのペントバルビタールを腹腔内注射によって送達する。 - 垂直正中線切開を作る胸骨領域の胸骨に沿って、および会陰領域にi番目のはさみ。腹腔に入り、上腸間膜動脈、小腸腸間膜抵抗性血管(mPVAT)および胸部大動脈(aPVAT)を暴露する。
- 腸間膜および大動脈への接続をすべて切断し、動物から血管を取り除く。解剖顕微鏡とKRBBで満たされたペトリ皿を用いてPVATを分離し、血管を観察し、PVATを単離する。
- この実験では、非PVAT脂肪蓄積を表す生殖腺(GON)脂肪を収集する。 10mMのHEPES(pH = 7.4)を含むKRBBの氷上に単離された脂肪パッドを置く。
- バイオセーフティフードでは、約50mgの組織を、1mLのコラゲナーゼI型溶液を含む1.7mLチューブに移し、組織はさみ(1〜3mm片)で切ります。
- Rotisserieインキュベーター(またはオービタルシェーカーを備えたインキュベーター)で37℃で1時間インキュベートしてサンプルを消化する。バイオセーフティフードでは、消化した物質を100および40 50mLのチューブに移した。得られたろ液を4℃で10分間、300×gで遠心分離する。
注記:ここからのプロトコールの全てのステップは、細胞を無菌状態に保つためにバイオセーフティフード内で実施するものとする。 - 上清を除去し、SVF細胞を含むペレットを1×赤血球溶解緩衝溶液1mLに再懸濁し、1.7mLの微量遠心管に移す。光から保護されたRTで5分間細胞をインキュベートし、4℃で300xgで5分間遠心分離する。
- SVF Basal Mediaに上清を残し、残りの細胞ペレットを再懸濁する。トリパンブルー溶液を用いて生細胞を計数するために20μLのサブサンプルを収集する。
注:隔離可能なSVF細胞の数は、サイトによって異なります。組織1mg当たりに採取されたSVFの平均数は、aPVAT = 5.0±2.0×10 3 、mPVAT = 1.04±0.62×10 4 、GON = 2.4±1.2× 10 5である 。
3.磁気活性セルソーティング
_content ">注:4℃ですべてのステップを実行することにより、CD34およびPDGFRα細胞表面マーカーに基づいてSVFからAPCを単離します。- 細胞を300 x gで5分間スピンします。上清を捨て、細胞ペレットを1×10 6細胞/ mLでMCSブロッキング緩衝液に再懸濁し、20分間インキュベートする。
注:1×10 6〜2×10 8細胞/ mLの細胞懸濁液を効果的に分離することができます。 - 細胞を5μLのFITC結合マウス抗CD34(1μg/ 1×10 6細胞)と共に4℃で30分間インキュベートする。 300 xgおよび4℃で5分間細胞をスピンします。
- 4μLの抗FITCマイクロビーズと96μLのMCSバッファー(全量100μL)と4℃で5分間、暗所でインキュベートし、CD34 +およびCD34 -細胞を分離する。
- 磁気分離器をスタンドに取り付け、列翼を前面に向けてMultiSort(MS)Columnをセパレータに置きます。 5 mL上部チューブホルダー内のMSカラムの下に置いてください。
- MCS Buffer SolutionでリンスしてMSカラムを調製します。カラムの上に500μLのMCS Bufferをアプライし、バッファを通過させます。流出液を廃棄し、回収チューブを交換する。
- 抗体標識された細胞懸濁液を調製したMSカラムにロードする。未標識細胞を含むフロースルーを収集する。
- 脱気したMCS緩衝液3×500μLでMSカラムを洗浄する。前のステップからの流れを通過して結合する非標識細胞を収集する。
- 磁気分離器からMSカラムを取り外し、新しいコレクションチューブ上に置きます。 1mLのMCS緩衝液をMSカラムに注ぎます。直ちに磁気標識した細胞でフラクションをただちに洗い流しますが、カラムに供給されたプランジャーをゆっくりと加えて、余分なガスがカラムに入らないようにしてください。
注:単離された細胞数はサイトによって異なります。 SVF集団から単離されたCD34 + APCの平均数組織のmgは、aPVAT = 2.6±0.43x10 2 、mPVAT = 9.6±1.4x10 2 、GON = 1.3±0.22x10 3である 。 - 細胞を300×gおよび4℃で5分間スピンさせる。 1:200溶液/ 1×10 6細胞ウサギ抗PDGFRα10μL中に集めたCD34 +画分を4℃で30分間インキュベートする。
- 300 xgおよび4℃で5分間細胞を再度遠心する。標識された細胞を抗ウサギIgGマイクロビーズ4μLおよびMCS緩衝液96μLとインキュベートし、3.3から3.7のステップを繰り返して単離する。
注:単離された細胞数はサイトによって異なります。組織1mgあたりのCD34 +集団から単離されたPDGFRα + APCの平均数は、aPVAT = 2.4±0.64、mPVAT = 8.4±2.4、GON = 10.4±1.9であり、これは以前に単離された集団の0.5~10%である。
- 300 xgおよび4℃で5分間細胞を再度遠心する。標識された細胞を抗ウサギIgGマイクロビーズ4μLおよびMCS緩衝液96μLとインキュベートし、3.3から3.7のステップを繰り返して単離する。
4.細胞培養および脂肪生成誘導
- SVFの文化および2日間毎に交換する基礎培地中の6ウェル組織培養プレート中のAPCを含む。 3回の連続継代後、8ウェルプレート、24ウェルプレート、48ウェルプレート、96ウェルプレート、24ウェルプレートで50,000細胞/ウェルで評価される増殖アッセイのために1×10 2細胞/ウェルの黒色96ウェル組織培養プレートにプレートするか、定性的および定量的である脂肪生成アッセイのための48ウェル組織培養プレート中の10,000細胞/ウェル。
- 分化のために示されたように、骨形成タンパク質4(3.3nmol / L)によるコンフルエント後48時間および誘導前のAPC基礎培地の補充。細胞をインキュベートするためにAPC誘導培地を用いて100%コンフルエンシー(0日目)の48時間後に細胞を誘導する。
- 48時間後、培地を交換して、IBMXおよびデキサメタゾンを含まないAPC誘導培地中で、14時間毎に培地を交換し、48時間ごとに細胞を維持する。
- FACSによって検証されたMCS分離。
- 磁気的に分離した50μL(50,000セル)のサブサンプルを取るFACS溶液で洗浄する。
- 細胞を遠心分離し、PDGFRα +細胞を標識するロバ抗ウサギIgG Dylight 405の1:1,000溶液100μL中に再懸濁する。軽く、4℃で30分間インキュベートする。
- フローサイトメーターで488 nm(FITC)および405 nm(Dylight 405)フィルターを使用して解析するまで、細胞を洗浄し、2%ホルムアルデヒド溶液200μLで再懸濁します。
注:培養細胞による脂質蓄積は、蛍光を測定するマイクロプレートリーダーで脂質親和性脂肪生成蛍光アッセイを使用し、脂質蓄積のキャリブレーターとして前脂肪細胞を使用して定量的に評価する。脂質蓄積はまた、脂質色素を染色するかまたは含まない全細胞のパーセンテージを観察可能にする、カメラを備えた倒立顕微鏡で行われる脂質色素染色およびイメージングによって定性的に測定される。 485nmでの励起および572nmでの発光で蛍光を測定することができる任意のプレートリーダーnmは、デジタル画像を取り込むことができるカメラを備えた顕微鏡と同様に、分析にも適しています。
結果
前脂肪細胞の増殖能力および脂肪細胞前駆体の脂肪生成能は、インビトロで維持される特性である11 。定量的DNAアッセイを用いてプレーティングした8,24,48および96時間後に、雄ラットのaPVAT、mPVAT、およびGONから単離したSVFおよびAPCのin vitro増殖を評価した。同じサイトのSVF細胞( 図1 )と比較して96時間の増殖が少ないaPVAT由来のAPCを除いて、SVF増殖率の部位差は、いかなる時点においても観察されなかった。
Bone Morphogenic Protein 4(BMP4)で刺激されたコンフルエントなAPCは、標準的な誘導の48時間前に分化を示した。これは、蛍光脂質取り込みアッセイ( 図2A )およびオイルレッドO染色( 図 2B )。
APCの収量を比較すると、MCS単離は、FACSと比較して、培養のために準備されたより多くの細胞を産生した。 ( 図3 )重要なことに、APC集団(CD34 +およびPDGFRα + )の分布および生存率は、MCSとFACSとで同様であった。ポスト単離を数えるためのトリパンブルー染色によって決定された細胞生存率は、両方の単離手順(FACS = 71.57%±11.09; MCS = 79.25%±7.47)で同様であった。これらのデータは、APCのMCS単離が、MCSと比較してより高い生存APC数をもたらすことを実証する。
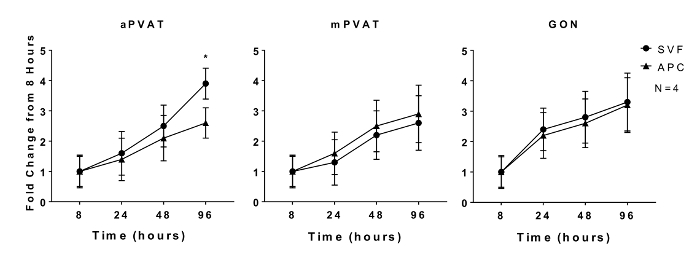
図1 : インビトロ での広告の増殖腹腔内始原細胞(APC)は、解剖学的位置の影響を受ける。 10週齢の雄ラットから大動脈および腸間膜血管周囲脂肪組織(それぞれaPVATおよびmPVAT)および生殖腺脂肪からストローマ血管画分(SVF)およびAPCを単離した。細胞の増殖は、播種後8,24,48および96時間の時点でのDNA定量アッセイによって測定した。データは、ベースライン±SEM(N = 4)の8時間にわたる増加倍数として表される。有意性は*(P <0.05)で示される。 Contreras らから修正された図。 2016 13 。 この図の拡大版を見るには、ここをクリックしてください。

図2 :Adipocyte Progenitor Cells(APC)はDifferentiaに変異を示さない(SVF)と比較して、デポ間の脂質蓄積能力は高まるが、脂質蓄積はより大きい。コンフルエントと48時間のBMP4への曝露の後、48時間のデキサメタゾンおよび3-イソブチル-1-メチルキサンチンへの48時間の曝露後に細胞を誘導し、その後48時間ごとに培地を交換しながら維持培地中で維持した。 ( A )相対蛍光単位(RFU)±SEM(N = 4)における未分化の前脂肪細胞:分化脂肪細胞(前脂肪細胞:脂肪細胞)の比として表されるデータを用いて分化したAPCの脂質取り込みアッセイ。 (BRO)APCおよびSVFのオイルレッドO(ORO)染色。脂質(ORO取り込み)±SEM(N = 4)を有する細胞のパーセントとして表したデータを用いた。有意性は*(P <0.05)で示される。 Contreras らから修正された図。 2016 13 。 この図の拡大版を見るには、ここをクリックしてください。

図3 :生存脂肪細胞前駆細胞(APC)の単離収率は、磁気活性化細胞選別(MCS)によって改善される。 MCSおよびFACSを用いた脈管周囲脂肪組織(大動脈aPVAT;腸間膜静脈= mPVAT)から単離したSVFにおけるCD34 + ( A )およびPDGFRα + ( B )の表面マーカー発現。データは、50mgの組織±SEM(N = 4)から単離された細胞の平均数として表される。有意性は*(P <0.05)で示される。 この図の拡大版を見るには、ここをクリックしてください。
ディスカッション
本実験の中心的な焦点は、PVATデポからのAPCの単離、拡大、および脂肪生成誘発である。ここでは、表面マーカーCD34およびPDGFRαを発現する細胞の同定に基づいて、APCの単離のためのプロトコールを提示する。これらの表面タンパク質は、APC上で、高い増殖速度および様々な脂肪貯蔵庫14,15中の白色または褐色脂肪細胞に分化する可能性を伴って以前に同定された。これらの特異的マーカーに基づいて細胞を選択することにより、我々は選択されたPVATで観察される脂肪細胞表現型と一致する複数の脂肪蓄積から同様のAPC集団を単離することができた。我々の実験では、成長因子BMP4を補充することによってAPCの分化を改善した。これまで、Macotelaらは、内臓脂肪細胞由来の特定のAPC集団が、培養培地に脂肪増殖性成長因子BMP2またはBMP4が補充されない限り、分化した場合の皮下デポー12,16,17,18。
脂肪組織からの個々の細胞の単離は細胞の脆弱性のため困難であるため、MCSを使用することにより、消耗品、機器、およびトレーニングリソースのより少ないコストで効率的な細胞分離方法が提供される。 APC収量は、動物の年齢またはサイズ、および培地の温度の変化および無菌分離環境を維持できないことによって影響され得ることに留意することが重要である。正常酸素中の細胞を培養することは、増殖および分化のためにも重要であり、したがって、インキュベーション空気条件の維持は、培養の実践にとって不可欠である。十分な細胞ペレットがtの間に形成されない場合、遠心分離速度を800xgに増加させることができる彼は孤立プロセス。コンジュゲートされたFITC蛍光色素は経時的に分解することができるので、抗体の有効期限を確認することも必要である。コラゲナーゼタイプIのロットの変更ロットは効力が異なる可能性があるので、消化手順への変更が必要な場合もあります。ラット以外の異なる種を使用する場合、抗体の宿主種がここで使用される種と異なる場合、ブロッキング緩衝液中の特異的血清およびIgGもまた必要であり得る。
FACSと比較してMCSの利点の中には、キットが安価で簡単に購入できるため、FACSよりも経済的に実現可能であるということがあります。これはまた、フローサイトメーターの購入、メンテナンス、および使用トレーニングを回避する。 MCSを使用することにより、選択およびバックグラウンド蛍光関与のためのゲートの調節なしに特異的結合が可能になる。
この研究の限界は、それが2つの前脂肪細胞表面マーカーに依存していることである。コミットメントと差分の他の前脂肪細胞表面マーカーZfp423、Sca1、およびCD24のような増幅は、20,21で同定されている。これらのマーカーは、特定の表現型のコミットされた脂肪細胞前駆細胞を正確に同定し得る;しかし、これらのマーカーを発現する細胞は、褐色表現型および白色表現型の両方を誘導する能力を有するので、ここで使用される表面マーカーが選択された。この研究のもう一つの限界は、APC培養における増殖因子の選択的使用であった。他の成長因子カクテルは、脂肪生成の誘導に有効であった22 。この研究における細胞培養は、すべての培養が二次元培養プレートで行われたという事実によっても制限されていた。これは培養標準であるが、インビボでの細胞はこのように増殖しない。三次元環境で培養することにより、脂肪組織の天然形態を複製するので、さらなる肥大および過形成が可能になり得るructure 23 。
MCSを使用することの実用性および効率のために、このプロトコルは、PVATにおけるAPCならびに他の細胞タイプの単離に理想的である。この手順はまた、前脂肪細胞培養における分化を誘導するより効果的な方法を提供する。必要最小限のコスト、設備、およびトレーニングにより、この方法は、特定の表面マーカーに基づいて細胞を単離することを希望する研究室で使用することができます。将来のアプリケーションは、他の細胞集団の単離またはより特異的な細胞マーカーの使用を可能にし得る。細胞のコミットメントにおける成長因子カクテルの使用は、幹細胞活性化において有用であり得る
開示事項
著者は何も開示することはない。
謝辞
Contreras and Watts Laboratoriesとウィリアム・ラファエル博士。これらの実験は、NHLBI F31 HL128035-01(組織消化プロトコル標準化)、NHLBI 5R01HL117847-02および2P01HL070687-11A1(動物)およびNHLBI 5R01HL117847-02(細胞単離および培養)によって支持された。
資料
| Name | Company | Catalog Number | Comments |
| Tissue Dissection | |||
| Dissecting Dishes | Handmade with Silicone | ||
| Culture Petri Dish | Pyrex | 7740 Glass | |
| Silicone Elastomer | Dow Corning | Sylgard 170 | Kit |
| Braided Silk Suture | Harvard Apparatus | 51-7615 | SP104 |
| Stereomicroscope MZ6 | Leica | 10447254 | |
| Stereomaster Microscope Fiber-Optic Light Source | Fisher Scientific | 12562-36 | |
| Vannas Scissors | George Tiemann & Co | 160-150 | |
| Splinter Forceps | George Tiemann & Co | 160-55 | |
| Tissue Scissors | George Tiemann & Co | 105-400 | |
| KRBB Solution | |||
| Sodium Chloride | Sigma-Aldrich | 7647-14-5 | |
| Potassium Chloride | Sigma-Aldrich | 7447-40-7 | |
| Magnesium Sulfate | Sigma-Aldrich | 7487-88-9 | |
| Potassium Phosphate Dibasic | Sigma-Aldrich | 7758-114 | |
| Glucose | Sigma-Aldrich | 50-99-7 | |
| Antibiotic/Antimicotic | Corning | 30-004-CI | |
| HEPES | Corning | 25-060-CI | |
| Tissue Digestion | |||
| Collagenase Type 1 | Worthington Biochemical | LS004196 | |
| Bovine Serum Albumin (BSA) | Fisher Scientific | 9048-46-8 | |
| Red Blood Cell Lysis Buffer | BioLegend | 420301 | 1X Working Solution |
| Water Bath | Thermo-Fisher Scientific | 2876 | Reciprocal Shaking Bath |
| Biosafety Cabinet | Thermo-Fisher Scientific | 1385 | |
| Rotisserie Incubator | Daigger | EF4894C | |
| 100 µm Cell Strainer | Thermo-Fisher Scientific | 22-363-549 | Yellow |
| 40 µm Cell Strainer | Thermo-Fisher Scientific | 22-363-547 | Blue |
| Hemocytometer | Cole-Parmer | UX-79001-00 | |
| Trypan Blue | Sigma-Aldrich | 93595 | |
| Cell Isolation | |||
| OctoMACS Kit | Miltenyi Biotech | 130-042-108 | |
| (DMEM):F12 Medium | Corning | 90-090 | Medium Base |
| Fetal Bovine Serum (FBS) | Corning | 35016CV | USA Origins |
| Normal Donkey Serum | AbCam | AB7475 | |
| Anti-CD34 | Santa Cruz | SC-7324 | FITC-conjugated |
| Anti-PDGFRα | Thermo-Fisher Scientific | PA5-17623 | |
| Donkey Anti-Rabbit IgG | Jackson ImmunoResearch | 712-007-003 | |
| Phosphate-Buffered Saline (PBS) 10X | Corning | 46-013-CM | 1X Working Solution |
| EDTA | Fisher Scientific | 15575020 | |
| Cell Culture | |||
| CO2 Cell Incubator | Thermo-Fisher Scientific | 51030285 | Heracell 160i |
| 6-Well Plates | Corning | 3516 | TC-Treated |
| 48-Well Plates | Corning | 3548 | TC-Treated |
| 96-Well Plates, Black Wall | Corning | 353376 | TC-Treated |
| Sodium Bicarbonate | Sigma-Aldrich | 144-55-8 | TC-Treated |
| Fetal Calf Serum (FCS) | Corning | 35011CV | USA Origins |
| Ascorbic Acid | Sigma-Aldrich | 50-81-7 | |
| Biotin | Sigma-Aldrich | 58-85-5 | |
| Pantothenate | Sigma-Aldrich | 137-08-6 | |
| L-Glutamine | Corning | 61-030 | |
| Bone Morphogenic Protein 4 (BMP4) | Prospec Bio | CYT-081 | |
| Epidermal Growth Factor (EGF) | PeproTech | 400-25 | |
| Leukemia Inhibitory Factor | PeproTech | 250-02 | |
| Platelet-derived Growth Factor BB | Prospec Bio | CYT-740 | |
| Basic Fibroblast Growth Factor (bFGF) | PeproTech | 450-33 | |
| Insulin | Corning | 25-800-CR | ITS Solution |
| IBMX | Sigma-Aldrich | 28822-58-4 | |
| Dexamethasone | Sigma-Aldrich | 50-02-2 | |
| T3 (Triiodothyronine) | Sigma-Aldrich | 6893-023 | |
| Cell Analysis | |||
| CyQUANT Proliferation Assay | Thermo-Fisher Scientific | C7026 | |
| AdipoRed Fluorescence Assay Reagent | Lonza | PT-7009 | |
| Oil Red O Lipid Dye Reagent | Sigma-Aldrich | O1391 | In Solution |
| M1000 Microplate Reader | Tecan | ||
| Eclipse Inverted Microscope | Nikon | ||
| Digital Sight DS-Qil Camera | Nikon |
参考文献
- Watts, S. W., et al. Chemerin connects fat to arterial contraction. Arterioscler Thromb Vasc Biol. 33 (6), 1320-1328 (2013).
- Dodson, M. V., et al. Adipose depots differ in cellularity, adipokines produced, gene expression, and cell systems. Adipocyte. 3 (4), 236-241 (2014).
- Police, S. B., Thatcher, S. E., Charnigo, R., Daugherty, A., Cassis, L. A. Obesity promotes inflammation in periaortic adipose tissue and angiotensin II-induced abdominal aortic aneurysm formation. Arterioscler Thromb Vasc Biol. 29 (10), 1458-1464 (2009).
- Ruan, H., Zarnowski, M. J., Cushman, S. W., Lodish, H. F. Standard isolation of primary adipose cells from mouse epididymal fat pads induces inflammatory mediators and down-regulates adipocyte genes. J Biol Chem. 278 (48), 47585-47593 (2003).
- Stacey, G. . in eLS. , (2001).
- Swim, H. E., Parker, R. F. Culture characteristics of human fibroblasts propagated serially. Am J Hyg. 66 (2), 235-243 (1957).
- Van Harmelen, V., Rohrig, K., Hauner, H. Comparison of proliferation and differentiation capacity of human adipocyte precursor cells from the omental and subcutaneous adipose tissue depot of obese subjects. Metabolism. 53 (5), 632-637 (2004).
- Roncari, D. A., Lau, D. C., Kindler, S. Exaggerated replication in culture of adipocyte precursors from massively obese persons. Metabolism. 30 (5), 425-427 (1981).
- Church, C. D., Berry, R., Rodeheffer, M. S. Isolation and study of adipocyte precursors. Methods Enzymol. 537, 31-46 (2014).
- Fontana, L., Eagon, J. C., Trujillo, M. E., Scherer, P. E., Klein, S. Visceral fat adipokine secretion is associated with systemic inflammation in obese humans. Diabetes. 56 (4), 1010-1013 (2007).
- Tchkonia, T., et al. Fat depot-specific characteristics are retained in strains derived from single human preadipocytes. Diabetes. 55 (9), 2571-2578 (2006).
- Macotela, Y., et al. Intrinsic differences in adipocyte precursor cells from different white fat depots. Diabetes. 61 (7), 1691-1699 (2012).
- Contreras, G. A., Thelen, K., Ayala-Lopez, N., Watts, S. W. The distribution and adipogenic potential of perivascular adipose tissue adipocyte progenitors is dependent on sexual dimorphism and vessel location. Physiol Rep. 4 (19), (2016).
- Lee, Y. H., Petkova, A. P., Granneman, J. G. Identification of an adipogenic niche for adipose tissue remodeling and restoration. Cell Metab. 18 (3), 355-367 (2013).
- Lee, Y. H., Petkova, A. P., Mottillo, E. P., Granneman, J. G. In vivo identification of bipotential adipocyte progenitors recruited by beta3-adrenoceptor activation and high-fat feeding. Cell Metab. 15 (4), 480-491 (2012).
- Ahrens, M., et al. Expression of human bone morphogenetic proteins-2 or -4 in murine mesenchymal progenitor C3H10T1/2 cells induces differentiation into distinct mesenchymal cell lineages. DNA Cell Biol. 12 (10), 871-880 (1993).
- Bowers, R. R., Lane, M. D. A role for bone morphogenetic protein-4 in adipocyte development. Cell Cycle. 6 (4), 385-389 (2007).
- Schulz, T. J., Tseng, Y. H. Emerging role of bone morphogenetic proteins in adipogenesis and energy metabolism. Cytokine Growth Factor Rev. 20 (5-6), 523-531 (2009).
- Choi, J. R., et al. In situ normoxia enhances survival and proliferation rate of human adipose tissue-derived stromal cells without increasing the risk of tumourigenesis. PLoS One. 10 (1), 0115034 (2015).
- Gupta, R. K., et al. Zfp423 expression identifies committed preadipocytes and localizes to adipose endothelial and perivascular cells. Cell Metab. 15 (2), 230-239 (2012).
- Rodeheffer, M. S., Birsoy, K., Friedman, J. M. Identification of white adipocyte progenitor cells in vivo. Cell. 135 (2), 240-249 (2008).
- Scott, M. A., Nguyen, V. T., Levi, B., James, A. W. Current methods of adipogenic differentiation of mesenchymal stem cells. Stem Cells Dev. 20 (10), 1793-1804 (2011).
- Edmondson, R., Broglie, J. J., Adcock, A. F., Yang, L. Three-dimensional cell culture systems and their applications in drug discovery and cell-based biosensors. Assay Drug Dev Technol. 12 (4), 207-218 (2014).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved