Method Article
Expansion und Adipogenese Induktion von Adipozyten-Progenitoren aus perivaskulärem Fettgewebe, isoliert durch magnetisch aktivierte Zellsortierung
In diesem Artikel
Zusammenfassung
Hier berichten wir über eine Methode zur Isolierung von Adipozyten-Progenitor-Zellen (APC) -Populationen aus perivaskulärem Adipositus (PVAT) mittels magnetisch-aktivierter Zellsortierung (MCS). Diese Methode ermöglicht eine erhöhte Isolierung von APC pro Gramm Fettgewebe im Vergleich zu Fluoreszenz-aktivierter Zellsortierung (FACS).
Zusammenfassung
Die Erweiterung des perivaskulären Adipositus (PVAT), ein wichtiger Regulator der Gefäßfunktion durch parakrine Signalisierung, steht in direktem Zusammenhang mit der Entwicklung von Hypertonie bei Adipositas. Das Ausmaß der Hypertrophie und Hyperplasie hängt von der Depotposition, dem Geschlecht und der Art der Adipocyten-Progenitor-Zelle (APC) -Phänotypen ab. Techniken, die für die APC- und Präadipozyten-Isolierung in den letzten 10 Jahren verwendet wurden, haben die Genauigkeit, mit der einzelne Zellen auf der Basis spezifischer Zelloberflächenmarker identifiziert werden können, drastisch verbessert. Allerdings kann die Isolierung von APC und Adipozyten aufgrund der Zerbrechlichkeit der Zelle eine Herausforderung sein, besonders wenn die intakte Zelle für Zellkulturanwendungen erhalten bleiben muss.
Magnetisch aktivierte Zellsortierung ( MCS) stellt eine Methode zur Isolierung einer größeren Anzahl von lebensfähigen APC pro Gewichtseinheit von Fettgewebe zur Verfügung. APC, das von MCS geerntet wird, kann für in vitro Protokolle verwendet werden, um prea zu erweiternDipozyten und differenzieren sie in Adipozyten durch Verwendung von Wachstumsfaktor-Cocktails, die die Analyse des produktiven und adipogenen Potentials ermöglichen, das von den Zellen zurückgehalten wird. Dieses Experiment konzentrierte sich auf die Aorten- und Mesenterial-PVAT-Depots, die bei der Entwicklung von Herz-Kreislauf-Erkrankungen bei der Expansion eine Schlüsselrolle spielen. Diese Protokolle beschreiben Methoden zur Isolierung, Erweiterung und Differenzierung einer definierten Population von APC. Dieses MCS-Protokoll ermöglicht die Isolierung in jedem Experiment, wo Zellsortierung mit minimaler Ausrüstung oder Training erforderlich ist. Diese Techniken können weitere Experimente unterstützen, um die Funktionalität bestimmter Zellpopulationen basierend auf der Anwesenheit von Zelloberflächenmarkern zu bestimmen.
Einleitung
Perivaskuläres Fettgewebe (PVAT) ist aufgrund seiner Nähe zu den Blutgefäßen eine wichtige Parakrin-Signalisierungskomponente in der Gefäßfunktion 1 . Die Erweiterung dieses Fettgewebes hängt vom Phänotyp der Adipocyten-Progenitor-Zellen (APC) 2 , 3 ab . Die Isolierung von Zellen aus adipösen Geweben ist schwierig, da primäre Adipozyten zerbrechlich, schwimmfähig und reich an Größe sind. Bestimmte Isolationstechniken können auch den Zellphänotyp und die Morphologie verändern, indem sie die entzündliche Proteinsynthese erhöhen und die adipogene Genexpression 4 reduzieren und die Bedeutung eines Protokolls hervorheben, das die Integrität der Zellen beibehält.
Die Kultur der Primärzellen und der spezifischen Präadipozyten-Subpopulationen ergibt einen reduktionistischen Ansatz für das Wachstum von In-vivo und behält das äquivalente zelluläre genetische Make-up 5 beiMich mit diesen Zellen ist begrenzt wegen der Verschlechterung mit Alterung oder Seneszenz 6 . Präadipozyten aus verschiedenen adipösen Depots, einschließlich subkutaner und omentaler Depots, zeigen auch Unterschiede in der Proliferation 7 , was die Bedeutung des Sammelns von Zellen aus spezifischen anatomischen Stellen hervorhebt. Vorläuferzellen aus nicht-PVAT-weißen adipösen Depots wurden in früheren Studien 7 , 8 , 9 charakterisiert, aber weniger ist bekannt über PVAT APC-Phänotypen.
Die hier beschriebenen Techniken erlauben die Analyse spezifischer und definierter APC-Populationen mit minimaler Auswirkung auf ihre Morphologie, ihre Lebensfähigkeit und ihr Potenzial zur Proliferation und Differenzierung. Magnetisch aktivierte Zellsortierung (MCS) ist nachgeschalteten Anwendungen wie Kultur möglich, da sich die Kügelchen auflösen, ohne die Zelle zu verändern. MCS ist auch ökonomisch, und sobald der Antikörper conKonzentrationen wurden standardisiert, die Notwendigkeit für Durchflusszytometrie-Assays ist minimal. In-vitro- Studien mit PVAT-Vorläufern können auch einen Einblick in das Potenzial geben, das diese Primärzellen haben können.
Protokoll
Alle in diesem Papier beschriebenen Verfahren folgen den Richtlinien des Institutional Animal Care and Use Committee (IACUC) der Michigan State University. Alle Puffer und Medien sollten vor Licht geschützt werden.
1. Vorbereitung von Puffern, Medien und Instrumenten
- Kocher Ringer Bicarbonat-gepufferte Lösung (KRBB): 135 mM Natriumchlorid, 5 mM Kaliumchlorid, 1 mM Magnesiumsulfat, 0,4 mM Kaliumphosphat dibasisch, 5,5 mM Glucose, 1% Antibiotikum / Antimykotikum (10.000 Einheiten / ml Penicillin, 10.000 μg / Ml Streptomycin, 25 & mgr; g / ml Amphotericin B) und 10 mM HEPES (pH = 7,4). Diese Lösung ist für 3 Wochen stabil, wenn sie steril gehalten wird und bei 4 ° C.
- Vorbereitung der Kollagenase Typ 1 Lösung: 1 mg / ml in KRBB mit 4% Rinderserumalbumin (BSA). Diese Lösung sollte bei 37 ° C gehalten werden und ist für 4 h stabil.
- Vorbereitung der Erythrozyten-Lyse-Pufferlösung: 154 mM Ammoniumchlorid, 10 mM Kaliumbicarbonat, Und 0,1 mM EDTA. Bei 4 ° C bis zu einem Monat aufbewahren.
- MCS-Blocking-Puffer vorbereiten: DMEM / F12-Medienbasis, 10% fetales Rinderserum (FBS), 5% normales Eselserum, 40 μl / mL F (ab) Fragment-Esel Anti-Ratten-IgG. Bei 4 ° C bis zu einem Monat aufbewahren.
- MCS-Pufferlösung vorbereiten: Phosphat-gepufferte Salzlösung (PBS, pH = 7,5), 0,5% BSA und 2 mM EDTA. Bei 4 ° C bis zu einem Monat aufbewahren. Entgasungslösung durch Erwärmen auf 37 ° C in einem Glasbehälter und anschließendes Anlegen eines Vakuums für 15 s. Unbenutzte gepufferte versiegelt lassen.
- Vorbereiten der Strom-Gefäß-Fraktion (SVF) Basalmedien: Dulbecco's-modifiziertes Eagles Medium (DMEM): F12, 15% Fetales Kalbs Serum (FCS), 1% Antibiotikum / Antimykotikum (10.000 Einheiten / ml Penicillin, 10.000 μg / ml Streptomycin, 25 μg / Ml Amphotericin B), 44,05 mM Natriumbicarbonat, 100 μM Ascorbinsäure, 33 μM Biotin, 17 μM Pantothenat, 2 mM L-Glutamin und 20 mM HEPES. Halten Sie steril und bei 4 ° C für bis zu 2 Wochen.
- Vorbereitung APC &# 160, Medien: Basal Media mit zusätzlichen Wachstumsfaktoren einschließlich epidermalem Wachstumsfaktor 10 ng / ml), Leukämie-Inhibitorfaktor (10 ng / ml), Plättchen-abgeleiteter Wachstumsfaktor BB (10 ng / ml) und basischer Fibroblastenwachstumsfaktor ( 5 ng / ml). Halten Sie steril und bei 4 ° C für bis zu 2 Wochen.
- Vorbereiten von APC-Induktionsmedien: APC-Medien mit 10% FBS, 2,5 μg / ml Insulin, 0,5 mM 2-Isobutyl-1-methylaxanthin (IBMX), 1 μM Dexamethason und 200 pM T3 (Trijodthyronin-Schilddrüsenhormon). Halten Sie steril und bei 4 ° C für bis zu 2 Wochen.
2. Adipozyten-Progenitoren Isolierung
- Anästhesieren Sie die Ratte nach den institutionellen Richtlinien. Lege die Ratte in dorsale Wiederholung. Bestätigen Sie die Tiefe der Anästhesie über eine Zehensperre und den Verlust der Reflexantwort auf diesen schmerzhaften Reiz.
HINWEIS: Dieses Protokoll verwendet 10-wöchige Sprague-Dawley-Ratten und 70 mg / kg Pentobarbital, die über eine intraperitoneale Injektion abgegeben werden. - Machen Sie eine vertikale Mittellinie Inzision wIth Schere entlang des Sternums im Thoraxbereich und zum Dammbereich. Greifen Sie auf die Bauchhöhle zu und setzen Sie die überlegene mesenteriale Arterie, die kleinen mesenterischen Resistenzgefäße (mPVAT) und die Thoraxaorta (aPVAT) aus.
- Trennen Sie alle Verbindungen zum Mesenterium und zur Aorta und entfernen Sie Gefäße aus dem Tier. Isoliere PVAT unter Verwendung eines Sektionsmikroskops und Petrischale, die mit KRBB gefüllt ist, um Gefäße zu sehen und PVAT zu isolieren.
- In diesem Experiment sammeln Sie Gonaden (GON) adipos, um ein Nicht-PVAT-Adipose-Depot zu repräsentieren. Legen Sie isolierte Fettpolster auf Eis in KRBB mit 10 mM HEPES (pH = 7,4).
- In einer Biosicherheitshaube über 50 mg Gewebe in ein 1,7 mL Röhrchen mit 1 mL Kollagenase Typ I-Lösung übergeben und mit Tissue Schere (1 - 3 mm Stück) zerkleinern.
- Digest-Proben durch Inkubieren bei 37 ° C in einem Rotisserie-Inkubator (oder Inkubator mit einem Orbital-Shaker) für 1 h. In einer Biosicherheitshaube nacheinander Filter verdautes Material durch 100 und 40 Μm-Zell-Siebe in ein 50-ml-Röhrchen. Zentrifugen-resultierendes Filtrat bei 4 ° C für 10 min bei 300 × g
ANMERKUNG: Alle Schritte im Protokoll von hier vorwärts sind in einer Biosicherheit Haube durchgeführt, um Zellen steril zu halten. - Den Überstand ausgießen und Pellets, die die SVF-Zellen enthalten, in 1 ml 1X Erythrozyten-Lyse-Pufferlösung resuspendieren und in ein 1,7-ml-Mikrofugenröhrchen überführen. Inkubieren Sie die Zellen für 5 min bei RT vor Licht geschützt und zentrifugieren bei 4 ° C für 5 min bei 300 x g.
- Den Überstand abgießen und das restliche Zellpellet in SVF Basal Media resuspendieren. Sammeln Sie eine 20 μl Unterprobe, um lebende Zellen mit Trypan Blue Solution zu zählen.
HINWEIS: Die Anzahl der zu isolierenden SVF-Zellen variiert je nach Standort. Die durchschnittliche Anzahl der geernteten SVF pro mg Gewebe beträgt: aPVAT = 5,0 ± 2,0 x 10 3 , mPVAT = 1,04 ± 0,62 x 10 4 , GON = 2,4 ± 1,2 x 10 5 .
3. Magnetisch aktivierte Zellsortierung
_content "> HINWEIS: APC von SVF auf Basis von CD34- und PDGFRα-Zelloberflächenmarkern isolieren, indem alle Schritte bei 4 ° C durchgeführt werden.- Spin Zellen für 5 min bei 300 x g. Den Überstand ausgießen und das Zellpellet im MCS-Blockierpuffer bei 1 x 10 6 Zellen / ml resuspendieren und für 20 min inkubieren.
HINWEIS: Zellsuspensionen von 1 x 10 6 - 2 x 10 8 Zellen / ml können effektiv getrennt werden. - Inkubieren von Zellen mit 5 & mgr; l FITC-konjugiertem Maus-anti-CD34 (1 & mgr; g / 1 × 10 6 Zellen) für 30 Minuten bei 4 ° C. Spin-Zellen für 5 min bei 300 xg und 4 ° C.
- Inkubieren mit 4 & mgr; l Anti-FITC-Mikroperlen und 96 & mgr; l MCS-Puffer (Gesamtvolumen von 100 & mgr; l) für 5 min bei 4 ° C im Dunkeln, um CD34 + und CD34-Zellen zu trennen.
- Befestigen Sie den Magnetabscheider am Stand und legen Sie die MultiSort (MS) -Säule mit den Säulenflügeln nach vorne in den Separator. Lege eine 5 mlSammelröhrchen unter der MS Säule im oberen Rohrhalter.
- Vorbereitung der MS-Säule durch Spülen mit MCS-Pufferlösung. Tragen Sie 500 μl MCS-Puffer auf die Spalte und lassen Sie den Puffer durchlaufen. Abwässer abnehmen und Sammelröhrchen wechseln
- Load-Antikörper-markierte Zellsuspension auf die vorbereitete MS-Säule geben. Sammle Durchfluss mit unmarkierten Zellen.
- Waschen MS Säule mit 500 μl entgaste MCS Puffer 3x. Sammeln Sie unmarkierte Zellen, die durchlaufen und mit dem Durchfluss durch den vorherigen Schritt kombinieren.
- Entfernen Sie die MS-Säule aus dem Magnetabscheider und legen Sie sie auf ein neues Sammelrohr. 1 ml MCS-Puffer auf die MS-Säule pipettieren. Sofort die Fraktion mit den magnetisch markierten Zellen durch festes, aber langsames Aufbringen des mit der Säule versorgten Kolbens ausspülen, um kein überschüssiges Gas in die Säule zuzulassen.
HINWEIS: Die isolierten Zellnummern variieren je nach Standort. Durchschnittliche Anzahl CD34 + APC, isoliert aus der SVF-Population proMg Gewebe sind: aPVAT = 2,6 ± 0,43 x 10 2 , mPVAT = 9,6 ± 1,4 x 10 2 , GON = 1,3 ± 0,22 x 10 3 . - Spin-Zellen für 5 min bei 300 × g und 4 ° C. Inkubieren der CD34 + -Fraktion, die in 10 & mgr; l einer 1: 200-Lösung / 1 × 10 6- Zellen Kaninchen-anti-PDGFR & agr; für 30 min bei 4 ° C gesammelt wurde.
- Die Zellen erneut 5 min bei 300 xg und 4 ° C zentrifugieren. Inkubieren markierter Zellen mit 4 & mgr; l Anti-Kaninchen-IgG-Mikroperlen und 96 & mgr; l MCS-Puffer durch Wiederholen der Schritte 3.3 bis 3.7 zum Isolieren.
HINWEIS: Die isolierten Zellnummern variieren je nach Standort. Die durchschnittlichen Zahlen von PDGFRα + APC, die aus der CD34 + -Population pro mg Gewebe isoliert wurden, sind: aPVAT = 2,4 ± 0,64, mPVAT = 8,4 ± 2,4, GON = 10,4 ± 1,9, was 0,5 bis 10% der zuvor isolierten Population beträgt.
- Die Zellen erneut 5 min bei 300 xg und 4 ° C zentrifugieren. Inkubieren markierter Zellen mit 4 & mgr; l Anti-Kaninchen-IgG-Mikroperlen und 96 & mgr; l MCS-Puffer durch Wiederholen der Schritte 3.3 bis 3.7 zum Isolieren.
4. Zellkultur und Adipogenese Induktion
- Kultur der SVFUnd APC in 6-Well Gewebekulturplatten in Basalmedien mit Ersatz alle 2 Tage. Nach 3 seriellen Passagen, Platte in schwarzen 96-Well-Gewebekulturplatten bei 1x10 2 Zellen / Vertiefung für Proliferationsassays, die bei 8, 24, 48 und 96 h ausgewertet werden, und bei 50.000 Zellen / Vertiefung in 24-Well-Platten oder 10.000 Zellen / Vertiefung in 48-Well-Gewebekulturplatten für Adipogenese-Assays, die qualitativ und quantitativ sind.
- Supplement APC basale Medien für 48 h nach der Konfluenz und vor der Induktion mit knochenmorphogenem Protein 4 (3,3 nmol / L), wie angegeben für die Differenzierung. Induzieren Zellen nach 48 h von 100% Konfluenz (Tag 0) mit dem APC Induktionsmedium, um die Zellen zu inkubieren.
- Nach 48 h wechsle die Medien zur Aufbewahrung von Zellen in APC Induktionsmedien ohne IBMX und Dexamethason, für 14 Tage mit Medienwechsel alle 48 Stunden.
- MCS-Isolierung durch FACS validiert.
- Nehmen Sie eine 50 μl (50.000 Zelle) Unterprobe von magnetisch getrenntZellen und waschen mit FACS-Lösung.
- Zentrifugieren und in 100 & mgr ; l einer 1: 1000 Lösung von Esel-Anti-Kaninchen-IgG-Dylight 405 resuspendieren, um die PDGFR & agr; + -Zellen zu markieren. Inkubieren für 30 min vor Licht und bei 4 ° C geschützt.
- Waschen von Zellen und Resuspendieren in 200 μl 2% Formaldehydlösung bis zur Analysezeit mit 488 nm (FITC) und 405 nm (Dylight 405) Filtern auf einem Durchflusszytometer.
ANMERKUNG: Die Lipidakkumulation durch kultivierte Zellen wird quantitativ unter Verwendung eines lipophilen Adipogenese-Fluoreszenzassays in einem Mikroplattenleser gemessen, der Fluoreszenz misst und Präadipozyten als Kalibratoren für die Lipidakkumulation verwendet. Die Lipidakkumulation wird auch qualitativ durch Lipidfärbefärbung und Bildgebung gemessen, die an einem invertierten Mikroskop durchgeführt wird, das mit einer Kamera ausgestattet ist, wobei der Prozentsatz der Gesamtzellen, die das Lipid beobachten oder nicht enthalten, beobachtbar ist. Jeder Plattenleser, der in der Lage ist, Fluoreszenz mit Erregung bei 485 nm und Emission bei 572 zu messenNm eignet sich sowohl für die Analyse als auch für jedes Mikroskop mit einer Kamera, die digitale Bilder erfassen kann.
Ergebnisse
Die Proliferationsfähigkeit von Präadipozyten und das adipogene Potential von Adipozytenvorläufern sind Merkmale, die in vitro beibehalten werden 11 . In vitro- Proliferation von isoliertem SVF und APC aus aPVAT wurden mPVAT und GON von männlichen Ratten bei 8, 24, 48 und 96 h nach dem Plattieren unter Verwendung eines quantitativen DNA-Assays bewertet. Es wurden keine Ortsunterschiede in der SVF-Expansionsrate zu irgendeinem Zeitpunkt beobachtet, mit Ausnahme des APC aus aPVAT, das eine geringere Proliferation um 96 h im Vergleich zu SVF-Zellen von derselben Stelle aufwies ( Abbildung 1 ).
Konfluenter APC, der mit Knochenmorphogenem Protein 4 (BMP4) für 48 Stunden vor der Standardinduktion 12 stimuliert wurde, zeigte eine Differenzierung. Dies zeigte sich durch eine größere Lipidakkumulation in Tröpfchen, wie sie durch den Fluoreszenzlipid-Aufnahme-Assay bewertet wurden ( Abbildung 2A ) und Ölrot O-Färbung ( Abbildung 2 B ).
Beim Vergleich der Ausbeute an APC erzeugte die MCS-Isolation eine größere Anzahl von Zellen, die für die Kultur im Vergleich zu FACS bereit waren. ( Abbildung 3 ) Wichtig ist, dass die Verteilung und Lebensfähigkeit der APC-Populationen (CD34 + und PDGFRα + ) zwischen MCS und FACS ähnlich war. Die durch Trypan-Blau-Färbung bestimmte Zählfähigkeit war für beide Isolationsverfahren ähnlich (FACS = 71,57% ± 11,09; MCS = 79,25% ± 7,47). Diese Daten zeigen, dass die MCS-Isolierung von APC eine höhere Anzahl von lebensfähigen APC im Vergleich zu MCS ergibt.
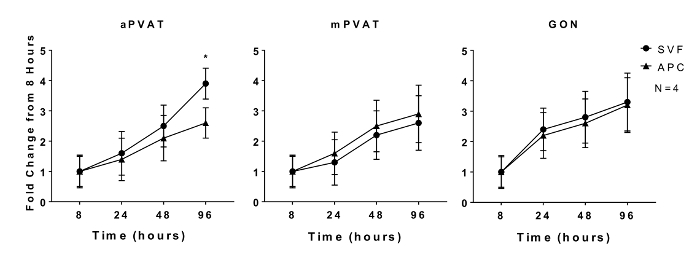
Abbildung 1 : In vitro Proliferation von AdIpocyte Progenitor Cells (APC) wird durch anatomischen Ort beeinflusst. Stromal Vascular Fraction (SVF) und APC wurden aus Aorten- und Mesenterialperivaskulären Fettgewebe (aPVAT & mPVAT) bzw. Gonadenadipose aus 10 Wochen alten männlichen Ratten isoliert. Die Proliferation von Zellen wurde durch einen DNA-Quantifizierungs-Assay bei 8, 24, 48 und 96 h-Zeitpunkten nach dem Aussäen gemessen. Die Daten werden als Faltenzunahme über 8 h Baseline ± SEM (N = 4) ausgedrückt. Die Bedeutung ist mit * (P <0,05) angegeben. Abbildung modifiziert von Contreras et al . 2016 13 Bitte klicken Sie hier, um eine größere Version dieser Figur zu sehen.

Abbildung 2 : Adipozyten-Progenitor-Zellen (APC) Zeigen Sie keine Variation in DifferentiaFähigkeit Fähigkeiten zwischen Depots aber größere Lipid Akkumulation im Vergleich zu Stromal Vascular Fraction (SVF). Die Zellen wurden nach 48 h Konfluenz und Exposition gegenüber BMP4 induziert, gefolgt von 48 h Exposition gegenüber Dexamethason und 3-Isobutyl-1-methylxanthin und dann in Wartungsmedien 14 Tage mit Medienwechsel alle 48 h. ( A ) Lipidaufnahme-Assay von differenziertem APC mit Daten, ausgedrückt als Verhältnis von undifferenzierten Präadipozyten: differenzierte Adipozyten (Präadipozyten: Adipozyten) in relativen Fluoreszenzeinheiten (RFU) ± SEM (N = 4). ( B ) Öl Rot O (ORO) Färbung von APC und SVF mit Daten ausgedrückt als Prozentsatz der Zellen mit Lipid (ORO Uptake) ± SEM (N = 4). Die Bedeutung ist mit * (P <0,05) angegeben. Abbildung modifiziert von Contreras et al. 2016 13 Bitte klicken Sie hier, um eine größere Version dieser Figur zu sehen.

Abbildung 3 : Isolationsausbeute an lebensfähigen Adipozyten-Progenitorzellen (APC) wird durch magnetisch aktivierte Zellsortierung (MCS) verbessert. Surface Marker Expression von CD34 + ( A ) und PDGFRα + ( B ) in SVF, isoliert aus perivaskulären Fettgeweben (Aortic = aPVAT, Mesenteric = mPVAT) unter Verwendung von MCS und FACS. Die Daten werden als mittlere Anzahl von Zellen ausgedrückt, die aus 50 mg Gewebe ± SEM (N = 4) isoliert wurden. Die Bedeutung ist mit * (P <0,05) angegeben. Bitte klicken Sie hier, um eine größere Version dieser Figur zu sehen.
Diskussion
Im Mittelpunkt des vorliegenden Experiments steht die Isolierung, Expansion und adipogene Induktion von APC aus PVAT-Depots. Hier stellen wir ein Protokoll zur Isolierung von APC vor, das auf der Identifizierung von Zellen basiert, die die Oberflächenmarker CD34 und PDGFRα exprimieren. Diese Oberflächenproteine wurden zuvor auf APC mit hohen Proliferationsraten und dem Potential identifiziert, in weiße oder braune Adipozyten in verschiedenen adipösen Depots 14 , 15 zu differenzieren. Durch die Auswahl von Zellen, die auf diesen spezifischen Markern basieren, konnten wir ähnliche APC-Populationen aus multiplen adipösen Depots isolieren, die dem Adipozyten-Phänotyp entsprechen, der in der ausgewählten PVAT beobachtet wird. In unseren Experimenten verbesserten wir die APC-Differenzierung durch Ergänzung des Wachstumsfaktors BMP4. Früher zeigten Macotela und Kollegen, dass spezifische APC-Populationen aus viszeralen adipösen Depots weniger BMP-Aktivitäten hatten als die vonSubkutane Depots, wenn differenziert, es sei denn, Kulturmedien wurden mit den adipogenen Wachstumsfaktoren BMP2 oder BMP4 12 , 16 , 17 , 18 ergänzt .
Da die Isolierung einzelner Zellen aus dem Fettgewebe aufgrund der Zerbrechlichkeit der Zellen schwierig ist, bietet die Verwendung von MCS eine effiziente Methode zur Zellisolation bei geringeren Kosten für Verbrauchsmaterialien, Ausrüstungen und Trainingsressourcen. Es ist wichtig zu beachten, dass die APC-Ausbeute durch das Alter oder die Größe des Tieres und durch Änderungen in der Temperatur der Medien und das Versagen, eine sterile Isolationsumgebung aufrechtzuerhalten, beeinflusst werden kann. Die Kultivierung von Zellen in der Normoxie ist auch für die Proliferation und Differenzierung 19 wichtig, so dass die Aufrechterhaltung der Inkubationsluftbedingungen in die Kulturpraxis integriert ist. Die Zentrifugationsgeschwindigkeiten können auf 800 xg erhöht werden, wenn sich bei t keine ausreichenden Zellpellets bildenEr isolationsprozess Die Überprüfung der Exspiration der Antikörper kann auch notwendig sein, da das konjugierte FITC-Fluorochrom im Laufe der Zeit abgebaut werden kann. Ändern viel Collagenase Typ I kann auch Änderungen an Verdauungsverfahren erfordern, da Lose in der Potenz variieren können. Bei Verwendung einer anderen Spezies als der Ratte kann auch spezifisches Serum und IgG im Blockierungspuffer erforderlich sein, wenn sich die Wirtsspezies der Antikörper von den hier verwendeten unterscheidet.
Unter den Vorteilen von MCS über FACS sind, dass es ökonomisch machbar ist als FACS, da Kits preiswert sind und leicht gekauft werden können. Dies vermeidet auch die Kauf-, Wartungs- und Verwendungsschulung eines Durchflusszytometers. Mit MCS ermöglicht auch eine spezifische Bindung ohne Anpassung der Tore für die Auswahl und Hintergrund Fluoreszenz Beteiligung.
Eine Einschränkung dieser Studie ist, dass sie sich auf zwei Voradipozyten-Oberflächenmarker stützte. Andere Präadipozyten-Oberflächenmarker von Engagement und diffErentiation, wie zfp423, sca1 und CD24, wurden identifiziert 20 , 21 . Diese Marker können genau festgestellte Adipozyten-Vorläuferzellen spezifischer Phänotypen identifizieren; Jedoch wurden die hier verwendeten Oberflächenmarker ausgewählt, da Zellen, die diese Marker exprimieren, die Fähigkeit haben, sowohl die braunen als auch die weißen Phänotypen 20 , 21 zu induzieren. Eine weitere Einschränkung dieser Studie war die selektive Verwendung von Wachstumsfaktoren in der APC-Kultur. Andere Wachstumsfaktor-Cocktails waren bei der Induktion der Adipogenese 22 wirksam. Die Zellkultur in dieser Studie war auch durch die Tatsache begrenzt, dass alle Kultur in zweidimensionalen Kulturplatten durchgeführt wurde. Obwohl dies die Kulturnorm ist, vermehren sich die Zellen in vivo nicht auf diese Weise. Die Kultivierung in dreidimensionalen Umgebungen kann eine weitere Hypertrophie und Hyperplasie ermöglichen, da sie die natürliche Form der adipösen StRuktur 23
Aufgrund der praktischen Anwendbarkeit und Effizienz der Verwendung von MCS ist dieses Protokoll ideal für die Isolierung von APC sowie anderen Zelltypen in PVAT. Dieses Verfahren bietet auch einen effektiveren Weg, um eine Differenzierung in Präadipozytenkulturen zu induzieren. Die minimale Kosten, Ausrüstung und Schulung erfordert, dass diese Methode in jedem Labor verwendet werden kann, um Zellen auf der Grundlage spezifischer Oberflächenmarkierungen zu isolieren. Zukünftige Anwendungen können die Isolierung anderer Zellpopulationen oder die Verwendung von spezifischeren Zellmarkern ermöglichen. Die Verwendung von Wachstumsfaktor-Cocktails im Zell-Engagement kann bei der Stammzell-Aktivierung nützlich sein
Offenlegungen
Die Autoren haben nichts zu offenbaren.
Danksagungen
Die Contreras und Watts Laboratories und Dr. William Raphael. Diese Experimente wurden von NHLBI F31 HL128035-01 (Gewebeverdauungsprotokoll-Standardisierung), NHLBI 5R01HL117847-02 und 2P01HL070687-11A1 (Tiere) und NHLBI 5R01HL117847-02 (Zellisolation und Kultur) unterstützt.
Materialien
| Name | Company | Catalog Number | Comments |
| Tissue Dissection | |||
| Dissecting Dishes | Handmade with Silicone | ||
| Culture Petri Dish | Pyrex | 7740 Glass | |
| Silicone Elastomer | Dow Corning | Sylgard 170 | Kit |
| Braided Silk Suture | Harvard Apparatus | 51-7615 | SP104 |
| Stereomicroscope MZ6 | Leica | 10447254 | |
| Stereomaster Microscope Fiber-Optic Light Source | Fisher Scientific | 12562-36 | |
| Vannas Scissors | George Tiemann & Co | 160-150 | |
| Splinter Forceps | George Tiemann & Co | 160-55 | |
| Tissue Scissors | George Tiemann & Co | 105-400 | |
| KRBB Solution | |||
| Sodium Chloride | Sigma-Aldrich | 7647-14-5 | |
| Potassium Chloride | Sigma-Aldrich | 7447-40-7 | |
| Magnesium Sulfate | Sigma-Aldrich | 7487-88-9 | |
| Potassium Phosphate Dibasic | Sigma-Aldrich | 7758-114 | |
| Glucose | Sigma-Aldrich | 50-99-7 | |
| Antibiotic/Antimicotic | Corning | 30-004-CI | |
| HEPES | Corning | 25-060-CI | |
| Tissue Digestion | |||
| Collagenase Type 1 | Worthington Biochemical | LS004196 | |
| Bovine Serum Albumin (BSA) | Fisher Scientific | 9048-46-8 | |
| Red Blood Cell Lysis Buffer | BioLegend | 420301 | 1X Working Solution |
| Water Bath | Thermo-Fisher Scientific | 2876 | Reciprocal Shaking Bath |
| Biosafety Cabinet | Thermo-Fisher Scientific | 1385 | |
| Rotisserie Incubator | Daigger | EF4894C | |
| 100 µm Cell Strainer | Thermo-Fisher Scientific | 22-363-549 | Yellow |
| 40 µm Cell Strainer | Thermo-Fisher Scientific | 22-363-547 | Blue |
| Hemocytometer | Cole-Parmer | UX-79001-00 | |
| Trypan Blue | Sigma-Aldrich | 93595 | |
| Cell Isolation | |||
| OctoMACS Kit | Miltenyi Biotech | 130-042-108 | |
| (DMEM):F12 Medium | Corning | 90-090 | Medium Base |
| Fetal Bovine Serum (FBS) | Corning | 35016CV | USA Origins |
| Normal Donkey Serum | AbCam | AB7475 | |
| Anti-CD34 | Santa Cruz | SC-7324 | FITC-conjugated |
| Anti-PDGFRα | Thermo-Fisher Scientific | PA5-17623 | |
| Donkey Anti-Rabbit IgG | Jackson ImmunoResearch | 712-007-003 | |
| Phosphate-Buffered Saline (PBS) 10X | Corning | 46-013-CM | 1X Working Solution |
| EDTA | Fisher Scientific | 15575020 | |
| Cell Culture | |||
| CO2 Cell Incubator | Thermo-Fisher Scientific | 51030285 | Heracell 160i |
| 6-Well Plates | Corning | 3516 | TC-Treated |
| 48-Well Plates | Corning | 3548 | TC-Treated |
| 96-Well Plates, Black Wall | Corning | 353376 | TC-Treated |
| Sodium Bicarbonate | Sigma-Aldrich | 144-55-8 | TC-Treated |
| Fetal Calf Serum (FCS) | Corning | 35011CV | USA Origins |
| Ascorbic Acid | Sigma-Aldrich | 50-81-7 | |
| Biotin | Sigma-Aldrich | 58-85-5 | |
| Pantothenate | Sigma-Aldrich | 137-08-6 | |
| L-Glutamine | Corning | 61-030 | |
| Bone Morphogenic Protein 4 (BMP4) | Prospec Bio | CYT-081 | |
| Epidermal Growth Factor (EGF) | PeproTech | 400-25 | |
| Leukemia Inhibitory Factor | PeproTech | 250-02 | |
| Platelet-derived Growth Factor BB | Prospec Bio | CYT-740 | |
| Basic Fibroblast Growth Factor (bFGF) | PeproTech | 450-33 | |
| Insulin | Corning | 25-800-CR | ITS Solution |
| IBMX | Sigma-Aldrich | 28822-58-4 | |
| Dexamethasone | Sigma-Aldrich | 50-02-2 | |
| T3 (Triiodothyronine) | Sigma-Aldrich | 6893-023 | |
| Cell Analysis | |||
| CyQUANT Proliferation Assay | Thermo-Fisher Scientific | C7026 | |
| AdipoRed Fluorescence Assay Reagent | Lonza | PT-7009 | |
| Oil Red O Lipid Dye Reagent | Sigma-Aldrich | O1391 | In Solution |
| M1000 Microplate Reader | Tecan | ||
| Eclipse Inverted Microscope | Nikon | ||
| Digital Sight DS-Qil Camera | Nikon |
Referenzen
- Watts, S. W., et al. Chemerin connects fat to arterial contraction. Arterioscler Thromb Vasc Biol. 33 (6), 1320-1328 (2013).
- Dodson, M. V., et al. Adipose depots differ in cellularity, adipokines produced, gene expression, and cell systems. Adipocyte. 3 (4), 236-241 (2014).
- Police, S. B., Thatcher, S. E., Charnigo, R., Daugherty, A., Cassis, L. A. Obesity promotes inflammation in periaortic adipose tissue and angiotensin II-induced abdominal aortic aneurysm formation. Arterioscler Thromb Vasc Biol. 29 (10), 1458-1464 (2009).
- Ruan, H., Zarnowski, M. J., Cushman, S. W., Lodish, H. F. Standard isolation of primary adipose cells from mouse epididymal fat pads induces inflammatory mediators and down-regulates adipocyte genes. J Biol Chem. 278 (48), 47585-47593 (2003).
- Stacey, G. . in eLS. , (2001).
- Swim, H. E., Parker, R. F. Culture characteristics of human fibroblasts propagated serially. Am J Hyg. 66 (2), 235-243 (1957).
- Van Harmelen, V., Rohrig, K., Hauner, H. Comparison of proliferation and differentiation capacity of human adipocyte precursor cells from the omental and subcutaneous adipose tissue depot of obese subjects. Metabolism. 53 (5), 632-637 (2004).
- Roncari, D. A., Lau, D. C., Kindler, S. Exaggerated replication in culture of adipocyte precursors from massively obese persons. Metabolism. 30 (5), 425-427 (1981).
- Church, C. D., Berry, R., Rodeheffer, M. S. Isolation and study of adipocyte precursors. Methods Enzymol. 537, 31-46 (2014).
- Fontana, L., Eagon, J. C., Trujillo, M. E., Scherer, P. E., Klein, S. Visceral fat adipokine secretion is associated with systemic inflammation in obese humans. Diabetes. 56 (4), 1010-1013 (2007).
- Tchkonia, T., et al. Fat depot-specific characteristics are retained in strains derived from single human preadipocytes. Diabetes. 55 (9), 2571-2578 (2006).
- Macotela, Y., et al. Intrinsic differences in adipocyte precursor cells from different white fat depots. Diabetes. 61 (7), 1691-1699 (2012).
- Contreras, G. A., Thelen, K., Ayala-Lopez, N., Watts, S. W. The distribution and adipogenic potential of perivascular adipose tissue adipocyte progenitors is dependent on sexual dimorphism and vessel location. Physiol Rep. 4 (19), (2016).
- Lee, Y. H., Petkova, A. P., Granneman, J. G. Identification of an adipogenic niche for adipose tissue remodeling and restoration. Cell Metab. 18 (3), 355-367 (2013).
- Lee, Y. H., Petkova, A. P., Mottillo, E. P., Granneman, J. G. In vivo identification of bipotential adipocyte progenitors recruited by beta3-adrenoceptor activation and high-fat feeding. Cell Metab. 15 (4), 480-491 (2012).
- Ahrens, M., et al. Expression of human bone morphogenetic proteins-2 or -4 in murine mesenchymal progenitor C3H10T1/2 cells induces differentiation into distinct mesenchymal cell lineages. DNA Cell Biol. 12 (10), 871-880 (1993).
- Bowers, R. R., Lane, M. D. A role for bone morphogenetic protein-4 in adipocyte development. Cell Cycle. 6 (4), 385-389 (2007).
- Schulz, T. J., Tseng, Y. H. Emerging role of bone morphogenetic proteins in adipogenesis and energy metabolism. Cytokine Growth Factor Rev. 20 (5-6), 523-531 (2009).
- Choi, J. R., et al. In situ normoxia enhances survival and proliferation rate of human adipose tissue-derived stromal cells without increasing the risk of tumourigenesis. PLoS One. 10 (1), 0115034 (2015).
- Gupta, R. K., et al. Zfp423 expression identifies committed preadipocytes and localizes to adipose endothelial and perivascular cells. Cell Metab. 15 (2), 230-239 (2012).
- Rodeheffer, M. S., Birsoy, K., Friedman, J. M. Identification of white adipocyte progenitor cells in vivo. Cell. 135 (2), 240-249 (2008).
- Scott, M. A., Nguyen, V. T., Levi, B., James, A. W. Current methods of adipogenic differentiation of mesenchymal stem cells. Stem Cells Dev. 20 (10), 1793-1804 (2011).
- Edmondson, R., Broglie, J. J., Adcock, A. F., Yang, L. Three-dimensional cell culture systems and their applications in drug discovery and cell-based biosensors. Assay Drug Dev Technol. 12 (4), 207-218 (2014).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten