Method Article
通过磁性活化细胞分选分离的血管周围脂肪组织的脂肪细胞祖细胞的扩增和脂肪生成诱导
摘要
在这里,我们报告了使用磁激活细胞分选(MCS)从血管周围脂肪组织(PVAT)分离脂肪细胞祖细胞(APC)种群的方法。当与荧光活化细胞分选(FACS)相比时,该方法允许APC每克脂肪组织的APC分离增加。
摘要
通过旁分泌信号传导血管功能的主要调节剂血管周围脂肪组织(PVAT)的扩张与肥胖症中高血压的发展直接相关。肥大和增生的程度取决于储存位置,性别和存在的脂肪细胞祖细胞(APC)表型的类型。在过去十年中用于APC和前脂肪细胞分离的技术大大提高了基于特定细胞表面标志物识别个体细胞的准确性。然而,由于细胞的脆弱性,APC和脂肪细胞的分离可能是一个挑战,特别是如果必须保留完整细胞用于细胞培养应用。
磁性细胞分选( MCS)提供了一种分离更多数量的活力APC每重量单位的脂肪组织的方法。通过MCS收获的APC可以用于体外方案扩大prea通过使用生长因子鸡尾酒将其分化成脂肪细胞,从而分析由细胞保留的多产和成脂潜能。该实验主要集中在主动脉和肠系膜PVAT库,其在扩张期间对心血管疾病的发展起关键作用。这些协议描述了分离,扩展和区分定义的APC群体的方法。该MCS协议允许隔离用于需要最少设备或培训的细胞分选的任何实验。这些技术可以帮助进一步的实验以基于细胞表面标志物的存在来确定特定细胞群的功能。
引言
血管周围脂肪组织(PVAT)由于其紧邻血管,是脉管系统功能1中的主要旁分泌信号成分。这种脂肪组织的扩张取决于存在于2,3的脂肪细胞祖细胞(APC)的表型。脂肪组织中细胞的分离是困难的,因为原发性脂肪细胞是脆弱的,浮力的和尺寸范围的。某些分离技术还可以通过增加炎症蛋白质合成和减少脂肪形成基因表达来改变细胞表型和形态,强调维持细胞完整性的协议的重要性。
原代细胞和特异性前脂肪细胞亚群的培养给出体内生长的还原性方法,并保持相当的细胞遗传组成5 ,尽管工作ti我与这些细胞由于老化或老化的恶化而受到限制6 。来自不同脂肪库(包括皮下和网膜库)的前脂肪细胞也表现出增殖7的差异,这强调了从特定解剖部位收集细胞的重要性。来自非PVAT白色脂肪贮库的前体细胞已经在先前的研究7,8,9中进行了表征,但是对于PVAT APC表型已知较少。
这里描述的技术允许对特定和定义的APC群体进行分析,对其形态,生存力以及增殖和分化潜力的影响最小。磁激活细胞分选(MCS)适用于下游应用,如培养,因为珠粒溶解而不改变细胞。 MCS也是经济的,一旦抗体结合浓度已经被标准化,流式细胞术检测的需要很小。使用PVAT前体的体外研究也可以看出这些原代细胞可能具有的潜力。
研究方案
本文中描述的所有程序都遵循密歇根州立大学机构动物护理和使用委员会(IACUC)制定的指南。所有缓冲液和介质均应避光保护。
缓冲液,介质和仪器的制备
- 制备Krebs Ringer碳酸氢盐缓冲溶液(KRBB):135mM氯化钠,5mM氯化钾,1mM硫酸镁,0.4mM磷酸氢二钾,5.5mM葡萄糖,1%抗生素/抗真菌剂(10,000单位/ mL青霉素,10,000μg / mL链霉素,25μg/ mL两性霉素B)和10mM HEPES(pH = 7.4)。该溶液在4℃保存无菌时稳定3周。
- 制备胶原酶1型溶液:在含有4%牛血清白蛋白(BSA)的KRBB中1mg / mL。该溶液应保持在37℃,稳定4小时。
- 制备红细胞裂解缓冲溶液:154 mM氯化铵,10 mM碳酸氢钾,和0.1mM EDTA。保持在4°C长达一个月。
- 制备MCS阻滞缓冲液:DMEM / F12培养基,10%胎牛血清(FBS),5%正常驴血清,40μL/ mL F(ab)片段驴抗鼠IgG。保持在4°C长达一个月。
- 制备MCS缓冲溶液:磷酸盐缓冲盐水(PBS,pH = 7.5),0.5%BSA和2mM EDTA。保持在4°C长达一个月。通过在玻璃容器中加热至37℃,然后施加真空15秒,将脱气溶液。留下未使用的缓冲密封。
- 准备基质血管分数(SVF)基础培养基:Dulbecco's-Modified Eagles培养基(DMEM):F12,15%胎牛血清(FCS),1%抗生素/抗真菌剂(10,000单位/ mL青霉素,10,000μg/ mL链霉素,25μg / mL两性霉素B),44.05mM碳酸氢钠,100μM抗坏血酸,33μM生物素,17μM泛酸盐,2mM L-谷氨酰胺和20mM HEPES。保持无菌,在4℃下长达2周。
- 准备APC&白细胞抑制因子(10ng / mL),血小板衍生生长因子BB(10ng / mL)和碱性成纤维细胞生长因子(10ng / mL)的培养基:具有额外生长因子(包括表皮生长因子10ng / mL) 5ng / mL)。保持无菌,在4℃下长达2周。
- 准备APC感应介质:具有10%FBS,2.5μg/ mL胰岛素,0.5mM 2-异丁基-1-甲基黄嘌呤(IBMX),1μM地塞米松和200pM T3(三碘甲状腺原氨酸甲状腺激素)的APC培养基。保持无菌,在4℃下长达2周。
脂肪细胞祖细胞分离
- 根据制度指导麻醉大鼠。将大鼠置于背侧卧位。通过脚趾压缩确认麻醉深度,并对这种痛苦的刺激失去反射反应。
注意:该方案使用10周龄的Sprague Dawley大鼠和70mg / kg通过腹膜内注射递送的戊巴比妥。 - 做一个垂直的中线切口w沿着胸部胸部和会阴区域的剪刀。进入腹腔并暴露肠系膜上动脉,小肠系膜阻力血管(mPVAT)和胸主动脉(aPVAT)。
- 切断与肠系膜和主动脉的所有连接,并从动物中移除血管。通过使用解剖显微镜和填充KRBB的培养皿分离PVAT以观察血管并分离PVAT。
- 在本实验中,收集性腺(GON)脂肪以代表非PVAT脂肪贮库。将含有10mM HEPES(pH = 7.4)的KRBB中的冰分离的脂肪垫放在冰上。
- 在生物安全罩中,将约50mg的组织转移到具有1mL胶原酶I型溶液的1.7mL管中,并用组织剪刀(1-3mm片)切碎。
- 通过在37℃下在旋转栅栏培养箱(或用轨道振荡器的培养箱)中孵育1小时来摘取样品。在生物安全罩中,通过100和40顺序过滤消化的物质 μm细胞过滤器放入50mL管中。在300℃下,将滤液在4℃下离心10分钟。
注意:从这里向前的协议中的所有步骤都将在生物安全罩中进行,以保持细胞无菌。 - 倒出上清液,将含有SVF细胞的小丸重新悬浮于1 mL红细胞裂解缓冲液溶液中,并转移至1.7 mL离心管中。在室温孵育细胞5分钟保护光,并在300℃下在4℃离心5分钟。
- 倒出上清液,并重新悬浮SVF基础培养基中剩余的细胞沉淀。收集20μL亚样品,用台盼蓝溶液计数活细胞。
注意:可以隔离的SVF单元的数量因地点而异。每毫克组织收获的平均SVF平均数为:aPVAT = 5.0±2.0×10 3 ,mPVAT = 1.04±0.62×10 4 ,GON = 2.4±1.2×10 5 。
磁激活细胞分选
_content">注意:通过在4°C下执行所有步骤,基于CD34和PDGFRα细胞表面标记从SVF分离APC。- 旋转细胞在300×g下5分钟。倒出上清液,以1×10 6个细胞/ mL的方式将细胞沉淀重悬于MCS阻断缓冲液中并孵育20分钟。
注意:1 x 10 6 - 2 x 10 8细胞/ mL的细胞悬浮液可以有效分离。 - 在4℃下,用5μLFITC-偶联的小鼠抗CD34(1μg/ 1×10 6个细胞)孵育细胞30分钟。在300×g和4℃下旋转细胞5分钟。
- 在4℃下在黑暗中孵育4μL抗FITC微珠和96μLMCS缓冲液(总体积为100μL)5分钟以分离CD34 +和CD34-细胞。
- 将磁力分离器连接到支架上,并将MultiSort(MS)色谱柱放置在分离器的前面。放置5 mL收集管在MS柱下方的上管支架中。
- 用MCS缓冲溶液冲洗准备MS柱。在柱顶上加入500μLMCS Buffer,让缓冲液通过。丢弃污水和更换收集管。
- 将抗体标记的细胞悬浮液载载到制备的MS柱上。收集含有未标记细胞的流通。
- 用500μL脱气的MCS Buffer 3x洗涤MS柱。收集通过的未标记细胞,并与前一步骤中的流程结合。
- 从磁选机中取出MS柱,并将其放在新的收集管上。移取1 mL MCS缓冲液到MS柱上。立即用磁性标记的细胞冲洗部分,然后缓慢地施加柱子提供的柱塞,以防止多余的气体进入色谱柱。
注意:隔离的细胞编号将因现场而异。从SVF群体中分离的CD34 + APC的平均数量mg组织是:aPVAT = 2.6±0.43×10 2 ,mPVAT = 9.6±1.4×10 2 ,GON = 1.3±0.22×10 3 。 - 在300×g和4℃下旋转细胞5分钟。在4℃下将10μL的1:200溶液/ 1×10 6细胞兔抗PDGFRα中收集的CD34 +级分孵育30分钟。
- 在300×g和4℃下再次离心细胞5分钟。通过重复步骤3.3至3.7分离,用4μL抗兔IgG微珠和96μLMCS缓冲液孵育标记细胞。
注意:隔离的细胞编号将因现场而异。从每mg组织的CD34 +群体分离的PDGFRα + APC的平均数量是:aPVAT = 2.4±0.64,mPVAT = 8.4±2.4,GON = 10.4±1.9,其为先前分离群体的0.5-10%。
- 在300×g和4℃下再次离心细胞5分钟。通过重复步骤3.3至3.7分离,用4μL抗兔IgG微珠和96μLMCS缓冲液孵育标记细胞。
细胞培养和脂肪生成诱导
- 培养SVF和APC在6-Well组织培养板中的基础培养基中,每2天更换一次。在3次连续传代后,以1×10 2细胞/孔的黑色96孔组织培养板平板扩增测定,其在8,24,48和96小时以及50,000孔/孔在24孔板中评估,或10,000个细胞/孔在48孔组织培养板中用于脂肪形成测定,其是定性和定量的。
- 补充APC基础培养基48 h后融合,诱导之前骨形态发生蛋白4(3.3 nmol / L),如分化所示10 。使用APC感应培养基在100%汇合(第0天)48小时后诱导细胞孵育细胞。
- 48小时后,更换培养基以维持APC Induction培养基中没有IBMX和地塞米松的细胞,持续14天,每48小时更换一次培养基。
- MCS隔离由FACS验证。
- 取50μL(50,000个细胞)的磁分离子样品并用FACS溶液洗涤。
- 离心细胞并重悬于100μL的1,900驴抗兔IgG Dylight 405溶液中,以标记PDGFRα +细胞。孵育30分钟,保护光线和4°C。
- 洗涤细胞并重悬于200μL的2%甲醛溶液中,直到用流式细胞仪分析488nm(FITC)和405nm(Dylight 405)滤膜的时间。
注意:使用亲本脂肪生成荧光测定法在微孔板读数器中测量荧光并使用前脂肪细胞作为脂质积累的校准物,定量评估培养细胞的脂质积累。脂质积累也通过脂质染料染色和在配备有照相机的倒置显微镜上进行的成像进行定量测量,使得可观察到或不含有脂质的总细胞的百分比。任何能够在485nm激发测量荧光并且在572处发射的读板器nm适用于分析以及具有能够捕获数字图像的相机的任何显微镜。
结果
脂肪细胞前脂肪细胞的增殖能力和脂肪细胞前体的脂肪形成潜力是体外维持的特征11 。 在使用定量DNA测定法在8,24,48和96小时后评估雄性大鼠的aVVAT,mPVAT和GON的分离的SVF和APC的体外增殖。在与来自同一位点的SVF细胞相比,与来自aPVAT的APC相比,在96小时时增殖较少的APC,在任何时间点均未观察到SVF扩增率的位置差异( 图1 )。
在标准诱导前48小时,用骨形态发生蛋白4(BMP4)刺激的融合APC表现出分化。通过荧光脂质摄取测定( 图2)评估,通过更大的液滴脂质积累显而易见A )和油红O染色( 图 2B )。
当比较APC的产量时,与FACS相比,MCS分离产生更多数量的准备培养的细胞。 ( 图3 )重要的是,MCS和FACS之间APC群体(CD34 +和PDGFRα + )的分布和活力相似。通过台盼蓝确定的细胞活力用于计数分离后两种分离方法(FACS = 71.57%±11.09; MCS = 79.25%±7.47)是相似的。这些数据表明,与MCS相比,APC的MCS分离产生更高数量的可行APC。
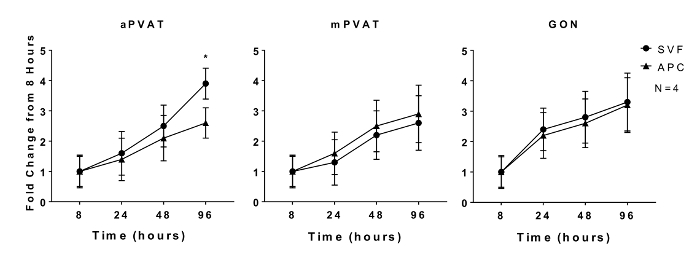
图1 : 体外 增殖皮质细胞祖细胞(APC)受解剖位置的影响。从主动脉和肠系膜血管周围脂肪组织(分别为aPVAT和mPVAT)和10周龄雄性大鼠的性腺脂肪分离基质血管分数(SVF)和APC。在接种后8,24,48和96小时的时间点通过DNA定量测定来测量细胞的增殖。数据表示为8小时基线±SEM(N = 4)的折叠增加。显着性用*表示(P <0.05)。 Contreras 等人修改的图2016 13 。 请点击此处查看此图的较大版本。

图2 :脂肪细胞祖细胞(APC)在差异中无变化与基质血管分数(SVF)相比,药房之间的能力较强,脂质积累较多。在48小时的融合和暴露于BMP4之后诱导细胞,接着暴露于地塞米松和3-异丁基-1-甲基黄嘌呤48小时,然后在维持培养基中持续培养14天,每48小时培养一次。 ( A )以相对荧光单位(RFU)±SEM(N = 4)表示的未分化前脂肪细胞:分化脂肪细胞(前脂肪细胞:脂肪细胞)的比例的数据表达的分化APC的脂质摄取测定。 ( B )APC和SVF的油红O(ORO)染色,数据表示为脂质细胞百分比(ORO摄取)±SEM(N = 4)。显着性用*表示(P <0.05)。 Contreras 等人修改的图2016 13 。 请点击此处查看此图的较大版本。

图3 :通过磁激活细胞分选(MCS)改善了活细胞脂肪细胞祖细胞(APC)的分离产率。使用MCS和FACS从血管周围脂肪组织(主动脉= aPVAT;肠系膜= mPVAT)分离的SVF中CD34 + ( A )和PDGFRα + ( B )的表达标记物表达。数据表示为从50mg组织±SEM分离的细胞的平均数(N = 4)。显着性用*表示(P <0.05)。 请点击此处查看此图的较大版本。
讨论
本实验的中心焦点是PVAT库的APC的分离,扩增和成脂诱导。在这里,我们提出了基于表达表面标志物CD34和PDGFRα的细胞的鉴定来分离APC的方案。这些表面蛋白先前在具有高增殖率的APC上鉴定,并且在各种脂肪贮积14,15中分化成白色或棕色脂肪细胞的潜力。通过选择基于这些特异性标记的细胞,我们能够从与所选择的PVAT中观察到的脂肪细胞表型匹配的多个脂肪库中分离相似的APC群体。在我们的实验中,我们通过补充生长因子BMP4来改善APC分化。之前,Macotela及其同事证明,内脏脂肪库的特异性APC种群的BMP活性比那些分化后的皮下贮库,除非培养基补充有成脂生长因子BMP2或BMP4 12,16,17,18。
由于单细胞从脂肪组织的分离是困难的,因为细胞的脆弱性,使用MCS提供了一种有效的细胞分离方法,以较低成本的消耗品,设备和培训资源。重要的是要注意,APC产量可能受动物的年龄或大小以及培养基温度的变化以及维持无菌隔离环境的影响。正常氧培养细胞对增殖和分化也很重要19 ,因此培养空气条件的维持是培养实践的组成部分。如果在t期间没有形成足够的细胞团,离心速度可以提高到800 x g他的隔离过程。检查抗体的过期也可能是必需的,因为缀合的FITC荧光染料可以随时间降解。改变许多胶原酶I型也可能需要改变消化程序,因为批次可能会有不同的效力。如果使用除大鼠之外的其他物种,如果抗体的宿主种不同于本文所用的抗体,则阻断缓冲液中的特异性血清和IgG也是必需的。
MCS与FACS的优点在于,它比FACS更经济可行,因为套件便宜并且可以容易地购买。这也避免了流式细胞仪的购买,维护和使用培训。使用MCS还允许特异性结合,而不需要调整门以进行选择和背景荧光参与。
这项研究的局限性在于它依赖于两种前脂肪细胞表面标志物。其他前脂肪细胞表面标记的承诺和差异已经确定了诸如Zfp423,Sca1和CD24之类的过程, 20,21 。这些标记物可以准确识别特定表型的确定的脂肪细胞祖细胞;然而,这里使用的表面标记是选择的,因为表达这些标记的细胞具有诱导褐色和白色表型20,21的能力。这项研究的另一个限制是在APC培养中选择性使用生长因子。其他生长因子鸡尾酒在脂肪形成诱导中已有效22 。本研究中的细胞培养也受到所有培养在二维培养板中进行的限制。虽然这是文化规范,但体内细胞不会以这种方式增殖。在三维环境中培养可能会进一步肥大和增生,因为它复制了脂肪的天然形式结构23 。
由于使用MCS的实用性和有效性,该协议非常适用于APC和PVAT中的其他单元格类型的隔离。该方法还提供了更有效的诱导前脂肪细胞培养物分化的方法。所需的最低成本,设备和培训使得该方法可用于希望基于特定表面标记分离细胞的任何实验室。未来的应用可能允许分离其他细胞群体或使用更特异的细胞标记物。在细胞承诺中使用生长因子鸡尾酒可能在干细胞活化中有用
披露声明
作者没有什么可以披露的。
致谢
Contreras和Watts实验室和William Raphael博士。这些实验由NHLBI F31 HL128035-01(组织消化方案标准化),NHLBI 5R01HL117847-02和2P01HL070687-11A1(动物)和NHLBI 5R01HL117847-02(细胞分离和培养)支持。
材料
| Name | Company | Catalog Number | Comments |
| Tissue Dissection | |||
| Dissecting Dishes | Handmade with Silicone | ||
| Culture Petri Dish | Pyrex | 7740 Glass | |
| Silicone Elastomer | Dow Corning | Sylgard 170 | Kit |
| Braided Silk Suture | Harvard Apparatus | 51-7615 | SP104 |
| Stereomicroscope MZ6 | Leica | 10447254 | |
| Stereomaster Microscope Fiber-Optic Light Source | Fisher Scientific | 12562-36 | |
| Vannas Scissors | George Tiemann & Co | 160-150 | |
| Splinter Forceps | George Tiemann & Co | 160-55 | |
| Tissue Scissors | George Tiemann & Co | 105-400 | |
| KRBB Solution | |||
| Sodium Chloride | Sigma-Aldrich | 7647-14-5 | |
| Potassium Chloride | Sigma-Aldrich | 7447-40-7 | |
| Magnesium Sulfate | Sigma-Aldrich | 7487-88-9 | |
| Potassium Phosphate Dibasic | Sigma-Aldrich | 7758-114 | |
| Glucose | Sigma-Aldrich | 50-99-7 | |
| Antibiotic/Antimicotic | Corning | 30-004-CI | |
| HEPES | Corning | 25-060-CI | |
| Tissue Digestion | |||
| Collagenase Type 1 | Worthington Biochemical | LS004196 | |
| Bovine Serum Albumin (BSA) | Fisher Scientific | 9048-46-8 | |
| Red Blood Cell Lysis Buffer | BioLegend | 420301 | 1X Working Solution |
| Water Bath | Thermo-Fisher Scientific | 2876 | Reciprocal Shaking Bath |
| Biosafety Cabinet | Thermo-Fisher Scientific | 1385 | |
| Rotisserie Incubator | Daigger | EF4894C | |
| 100 µm Cell Strainer | Thermo-Fisher Scientific | 22-363-549 | Yellow |
| 40 µm Cell Strainer | Thermo-Fisher Scientific | 22-363-547 | Blue |
| Hemocytometer | Cole-Parmer | UX-79001-00 | |
| Trypan Blue | Sigma-Aldrich | 93595 | |
| Cell Isolation | |||
| OctoMACS Kit | Miltenyi Biotech | 130-042-108 | |
| (DMEM):F12 Medium | Corning | 90-090 | Medium Base |
| Fetal Bovine Serum (FBS) | Corning | 35016CV | USA Origins |
| Normal Donkey Serum | AbCam | AB7475 | |
| Anti-CD34 | Santa Cruz | SC-7324 | FITC-conjugated |
| Anti-PDGFRα | Thermo-Fisher Scientific | PA5-17623 | |
| Donkey Anti-Rabbit IgG | Jackson ImmunoResearch | 712-007-003 | |
| Phosphate-Buffered Saline (PBS) 10X | Corning | 46-013-CM | 1X Working Solution |
| EDTA | Fisher Scientific | 15575020 | |
| Cell Culture | |||
| CO2 Cell Incubator | Thermo-Fisher Scientific | 51030285 | Heracell 160i |
| 6-Well Plates | Corning | 3516 | TC-Treated |
| 48-Well Plates | Corning | 3548 | TC-Treated |
| 96-Well Plates, Black Wall | Corning | 353376 | TC-Treated |
| Sodium Bicarbonate | Sigma-Aldrich | 144-55-8 | TC-Treated |
| Fetal Calf Serum (FCS) | Corning | 35011CV | USA Origins |
| Ascorbic Acid | Sigma-Aldrich | 50-81-7 | |
| Biotin | Sigma-Aldrich | 58-85-5 | |
| Pantothenate | Sigma-Aldrich | 137-08-6 | |
| L-Glutamine | Corning | 61-030 | |
| Bone Morphogenic Protein 4 (BMP4) | Prospec Bio | CYT-081 | |
| Epidermal Growth Factor (EGF) | PeproTech | 400-25 | |
| Leukemia Inhibitory Factor | PeproTech | 250-02 | |
| Platelet-derived Growth Factor BB | Prospec Bio | CYT-740 | |
| Basic Fibroblast Growth Factor (bFGF) | PeproTech | 450-33 | |
| Insulin | Corning | 25-800-CR | ITS Solution |
| IBMX | Sigma-Aldrich | 28822-58-4 | |
| Dexamethasone | Sigma-Aldrich | 50-02-2 | |
| T3 (Triiodothyronine) | Sigma-Aldrich | 6893-023 | |
| Cell Analysis | |||
| CyQUANT Proliferation Assay | Thermo-Fisher Scientific | C7026 | |
| AdipoRed Fluorescence Assay Reagent | Lonza | PT-7009 | |
| Oil Red O Lipid Dye Reagent | Sigma-Aldrich | O1391 | In Solution |
| M1000 Microplate Reader | Tecan | ||
| Eclipse Inverted Microscope | Nikon | ||
| Digital Sight DS-Qil Camera | Nikon |
参考文献
- Watts, S. W., et al. Chemerin connects fat to arterial contraction. Arterioscler Thromb Vasc Biol. 33 (6), 1320-1328 (2013).
- Dodson, M. V., et al. Adipose depots differ in cellularity, adipokines produced, gene expression, and cell systems. Adipocyte. 3 (4), 236-241 (2014).
- Police, S. B., Thatcher, S. E., Charnigo, R., Daugherty, A., Cassis, L. A. Obesity promotes inflammation in periaortic adipose tissue and angiotensin II-induced abdominal aortic aneurysm formation. Arterioscler Thromb Vasc Biol. 29 (10), 1458-1464 (2009).
- Ruan, H., Zarnowski, M. J., Cushman, S. W., Lodish, H. F. Standard isolation of primary adipose cells from mouse epididymal fat pads induces inflammatory mediators and down-regulates adipocyte genes. J Biol Chem. 278 (48), 47585-47593 (2003).
- Stacey, G. . in eLS. , (2001).
- Swim, H. E., Parker, R. F. Culture characteristics of human fibroblasts propagated serially. Am J Hyg. 66 (2), 235-243 (1957).
- Van Harmelen, V., Rohrig, K., Hauner, H. Comparison of proliferation and differentiation capacity of human adipocyte precursor cells from the omental and subcutaneous adipose tissue depot of obese subjects. Metabolism. 53 (5), 632-637 (2004).
- Roncari, D. A., Lau, D. C., Kindler, S. Exaggerated replication in culture of adipocyte precursors from massively obese persons. Metabolism. 30 (5), 425-427 (1981).
- Church, C. D., Berry, R., Rodeheffer, M. S. Isolation and study of adipocyte precursors. Methods Enzymol. 537, 31-46 (2014).
- Fontana, L., Eagon, J. C., Trujillo, M. E., Scherer, P. E., Klein, S. Visceral fat adipokine secretion is associated with systemic inflammation in obese humans. Diabetes. 56 (4), 1010-1013 (2007).
- Tchkonia, T., et al. Fat depot-specific characteristics are retained in strains derived from single human preadipocytes. Diabetes. 55 (9), 2571-2578 (2006).
- Macotela, Y., et al. Intrinsic differences in adipocyte precursor cells from different white fat depots. Diabetes. 61 (7), 1691-1699 (2012).
- Contreras, G. A., Thelen, K., Ayala-Lopez, N., Watts, S. W. The distribution and adipogenic potential of perivascular adipose tissue adipocyte progenitors is dependent on sexual dimorphism and vessel location. Physiol Rep. 4 (19), (2016).
- Lee, Y. H., Petkova, A. P., Granneman, J. G. Identification of an adipogenic niche for adipose tissue remodeling and restoration. Cell Metab. 18 (3), 355-367 (2013).
- Lee, Y. H., Petkova, A. P., Mottillo, E. P., Granneman, J. G. In vivo identification of bipotential adipocyte progenitors recruited by beta3-adrenoceptor activation and high-fat feeding. Cell Metab. 15 (4), 480-491 (2012).
- Ahrens, M., et al. Expression of human bone morphogenetic proteins-2 or -4 in murine mesenchymal progenitor C3H10T1/2 cells induces differentiation into distinct mesenchymal cell lineages. DNA Cell Biol. 12 (10), 871-880 (1993).
- Bowers, R. R., Lane, M. D. A role for bone morphogenetic protein-4 in adipocyte development. Cell Cycle. 6 (4), 385-389 (2007).
- Schulz, T. J., Tseng, Y. H. Emerging role of bone morphogenetic proteins in adipogenesis and energy metabolism. Cytokine Growth Factor Rev. 20 (5-6), 523-531 (2009).
- Choi, J. R., et al. In situ normoxia enhances survival and proliferation rate of human adipose tissue-derived stromal cells without increasing the risk of tumourigenesis. PLoS One. 10 (1), 0115034 (2015).
- Gupta, R. K., et al. Zfp423 expression identifies committed preadipocytes and localizes to adipose endothelial and perivascular cells. Cell Metab. 15 (2), 230-239 (2012).
- Rodeheffer, M. S., Birsoy, K., Friedman, J. M. Identification of white adipocyte progenitor cells in vivo. Cell. 135 (2), 240-249 (2008).
- Scott, M. A., Nguyen, V. T., Levi, B., James, A. W. Current methods of adipogenic differentiation of mesenchymal stem cells. Stem Cells Dev. 20 (10), 1793-1804 (2011).
- Edmondson, R., Broglie, J. J., Adcock, A. F., Yang, L. Three-dimensional cell culture systems and their applications in drug discovery and cell-based biosensors. Assay Drug Dev Technol. 12 (4), 207-218 (2014).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。