Method Article
Подготовка к зачатию кровеносных сосудов мыши
В этой статье
Резюме
Описана процедура приготовления препаратов на лицевой стороне сонной артерии и аорты мышей. Такие препараты, при иммунофлуоресцентном окрашивании специфическими антителами, позволяют нам изучать локализацию белков и идентификацию типов клеток во всей сосудистой стенке с помощью конфокальной микроскопии.
Аннотация
Секции парафиновых включенных тканей обычно используются для изучения гистологии тканей и гистопатологии. Однако трудно определить, что представляет из себя трехмерная морфология ткани. Кроме того, участки исследуемых тканей могут не содержать области внутри ткани, которая необходима для целей текущего исследования. Это последнее ограничение препятствует гистопатологическим исследованиям кровеносных сосудов, поскольку сосудистые поражения развиваются фокально. Это требует метода, который позволяет нам исследовать широкую область стенки кровеносного сосуда, от ее поверхности до более глубоких областей. Этого требует выполнение целого подхода к подготовке кровеносных сосудов. В этой статье мы продемонстрируем, как сделать лицевые препараты мышиной аорты и сонной артерии и иммунофлуоресцентно окрасить их для конфокальной микроскопии и других типов изображений на основе флуоресценции.
Введение
Для гистопатологических исследований с помощью световой микроскопии трехмерные куски биологических тканей обычно обрабатывают для встраивания парафинов с последующим разделением и окрашиванием. Образец ткани, который был встроен в парафин, может иметь размеры в несколько миллиметров во всех трех измерениях. Однако для целей световой микроскопии его необходимо сначала срезать так, чтобы свет мог проходить сквозь него, а затем окрашивался, чтобы тонкая секция получала достаточный контраст для получения изображений. Так как срезанные образцы обычно имеют толщину 5-10 мкм, то можно увидеть только очень небольшую часть всего образца в двух измерениях за один раз. Можно собирать последовательные секции и, после визуализации каждой секции индивидуально, выполнить компьютерную реконструкцию трехмерных изображений, но это действительно утомительная работа. Гистопатология кровеносных сосудов, особенно для изучения патогенеза атеросклероза, представляет уникальные проблемы. Атеросклероз является очаговым заболеванием, которое развиваетсяЛокально в местах, где происходит нарушение кровообращения. Кроме того, болезнь начинается в интиме - тонкой ткани, состоящей из монослоя эндотелиальных клеток и внеклеточного матрикса больших артерий. По этим причинам, найти и изучить ранние поражения с использованием секционных кровеносных сосудов - задача непростая, так как можно легко пропустить раздел поражения. Даже если в разрезе имеется больная область, в средах и адвентициях будет наблюдаться только часть размером 5-10 мкм, содержащая эндотелиальные клетки и другие клетки сосудистой стенки.
Препараты с цельной консистенцией (выраженные в фэс) позволяют нам исследовать широкую область поверхности кровеносных сосудов, такую как вся аорта, от корня аорты вплоть до общих подвздошных артерий. Используя такой образец, окрашенный специфическими антителами и другими специфическими зондами, можно точно определить место повреждения, а также, когда в эндотелиальных клетках происходят различные молекулярные события, в сочетании с wiГо атерогенеза, таких как изменения экспрессии, локализации и посттрансляционные модификации белков. В дополнение к изучению атерогенеза, форма эндотелиальных клеток, наблюдаемая в препаратах на лице, используется в качестве индикатора региональной усредненной по времени картины кровотока. Такие данные важны для изучения механосигнального процесса эндотелиальных клеток in situ. Для этой цели обычные гистологические поперечные срезы крови не пригодны. Таким образом, для сосудистой медицины и биологии особенно важно приобрести методику для подготовки лицевых препаратов кровеносных сосудов, которая позволяет наблюдать большую площадь поверхности сосуда, а также более глубокие подповерхностные области сосуда.
В обзоре Jelev and Surchev 1 , сосудистые биологи разработали различные методы для наблюдения за облицовкой кровеносных сосудов. Некоторые гениальные методы были разработаны в 1940-х и 1950-х годах. Используя эти методы, они Способных изучать фундаментальную организацию эндотелиальных клеток, которые выстилают внутреннюю поверхность кровеносных сосудов. Однако из-за того, как эти препараты готовятся (так называемый метод Hautchen 2 , 3 , 4 или отслоение поверхности сосуда 5 ), а также от того, как образец был окрашен, не всегда можно было получить непрерывную морфологию Информацию с поверхности сосуда в более глубокие области стенки кровеносного сосуда. Препарат для всего гомеопатического сосуда в сочетании с иммунофлуоресцентным окрашиванием позволил нам не только изучить морфологию эндотелиальных клеток, экспрессию и локализацию белка в этих клетках, но и распространить такие исследования на субэндотелиальную область стенки сосуда. Ранние исследования с использованием препаратов для подготовки кровеносных сосудов, окрашенных иммунофлюоресцентно, начали появляться в 80-х годах 6 ,F "> 7. С появлением лазерной сканирующей конфокальной микроскопии и в последнее время многофотонной микроскопии теперь можно получить четкие фокусные изображения структуры стенок кровеносных сосудов в образцах иммунофлуоресцентно окрашенных образцов сосудов, а также сосудистой сети у живых животных 8 , 9 , 10 , 11. Эти компьютерные методы визуализации создают фокусированные оптические секционные изображения, и путем складывания таких изображений можно получить восстановленные трехмерные изображения стенки сосуда и сосудистой сети в тканях. Может генерировать изображения секции, выполненной вдоль оси Z восстановленного изображения 12 , 13 .
В этой статье мы проиллюстрируем способ подготовки лицевых препаратов мышечной аорты и сонной артерии для иммунофлуоресцентного окрашивания. Подготовка к зачарованиюМогут быть сделаны даже после экспериментального манипулирования этими сосудами. Например, сонную артерию можно частично лигировать, а затем получить лицевую подготовку, сделанную после такой операции. По этой причине мы также опишем в этой статье, как мы выполняем частичную перевязку на сонной артерии. По сравнению с приготовлением подобных препаратов у более крупных животных, таких как крысы, кролики и люди, мышечные сосуды небольшие по размеру и более хрупкие, что требует дополнительной осторожности при обращении во время хирургической изоляции сосудов и их приготовления для окрашивания антител и микроскопии. Поскольку наиболее часто используемой моделью животных для генетической модификации является мышь, для многих исследователей критически важно обрабатывать сосуды мыши, не повреждая их. В этой рукописи мы расскажем о том, как обрабатывать кровеносные сосуды мыши при приготовлении лицевых препаратов мышечной аорты и сонной артерии. Для демонстрации мы будем использовать мышей дикого типа C57 / b6.
протокол
Протоколы перевязки частичной сонной артерии мыши и выделения мышечной аорты и сонной артерии для иммуноокрашивания иммунной системы одобрены Комитетом по уходу и использованию институциональных животных (IBT 2014-9231).
1. Перевязка левой части сонной артерии
- Подготовьте хирургическое пространство, поместив на стол нагревательную подушку размером 12 дюймов x 14 дюймов и накройте подушку и верхнюю часть стола большой чистой хирургической драпировкой. Отрегулируйте кронштейн стойки стрелы так, чтобы поле зрения стереомикроскопа находилось в центральной области грелки.
- Включите грелку на столе и установите 3-позиционный диск управления на средний уровень тепла. При такой настройке температура поверхности хирургической панели (см. 1.6.1) будет 38-40 ° C.
- Поместите чистую клетку на другую грелку. Поверните грелку, как описано выше. Эта клетка будет использоваться для восстановления после операции (см. 1.16), а также для жилья.
- На хирургическом столе поместите стерилизационный автоклавированный автоклав, содержащий ножницы для ирисовой диафрагмы (1 пара), щипцы для тканей (1 пара), щипцы для суперсжима (2 пары), пружинные ножницы (1 пара), тупой втягиватель (1 пара, ширина 2,5 мм) (1), стерилизованный шелковый шов 6-0, аппликаторы с хлопковым наконечником, аппликаторы с мини-хлопковым наконечником, хирургические шторы и 2 "x 2" марлевые губки. Также поместите выжимку, содержащую 70% этанола, а другую, содержащую хирургический скраб хлоргексидина, - хирургический стол.
- Взвешивание мыши. Вес тела необходим, чтобы определить соответствующее количество обезболивания, которое будет вводиться непосредственно перед операцией.
- Поместите мышь в индукционную камеру.
- Включите кислородный баллон и анестезирующий испаритель, чтобы обезболивать мышь в индукционной камере. Поддерживайте уровень изофлурана в 2%. Это займет 3-5 минут, прежде чем мышь перестанет двигаться.
- Пока мышь находится под наркозомПоместите меньший кусочек стерильной хирургической драпы (24 дюйма х 24 дюйма) под стереомикроскоп для создания хирургической поверхности. Затем поместите на драпированную поверхность акриловую хирургическую доску (которая была очищена 70% -ным спиртом). Поэтому хирургический щит должен находиться на грелке, но разделен двумя слоями хирургических штор.
- Когда мышь перестает двигаться в индукционной камере, перенесите мышь в область предварительной подготовки и поставьте нос в носовой конус, соединенный с испарителем (2% изофлурана). Удалите волосы вокруг шейного отдела с помощью электрического триммера или лосьона для удаления волос. Мы рекомендуем лосьон для удаления волос, потому что этот метод не даст сыпучих кусочков волос, которые трудно полностью удалить из хирургической области.
- С носовым конусом на месте переместите мышь к хирургической доске.
- Слейте правую и левую передние лапы на хирургическую доску. Намотайте ленту на обе задние ногиTher с правой стороны мыши. Это приводит к небольшому вращению тела мыши, так что левая сторона области шеи мыши становится лучше расположенной для операции.
- Продезинфицируйте область разреза 70% -ным спиртом, хирургическим скрабом хлоргексидина и снова 70% -ным спиртом. Закройте мышь стерилизованной хирургической драпировкой, кроме области разреза шейки матки.
- Подтвердите с ног, что мышь полностью обезболивается и дает обезболивание (Капрофен 3-5 мг / кг) через внутрибрюшинную или подкожную инъекцию.
- Под рассекающим микроскопом сделайте разрез вентральной средней линии вокруг шейного отдела с помощью либо ножниц скальпеля, либо ирисовых диафрагм.
ПРИМЕЧАНИЕ. Мы используем ножницы, потому что рабочее расстояние стереомикроскопа ограничено, что затрудняет использование скальпеля. - Выставьте левую общую сонную артерию (LCCA), оттолкнув и переставив слюнные железы, которые закрывают кровеносные сосуды в левой стороне аНимал.
- Определите все кровеносные сосуды в хирургическом поле ( рис. 1 ). LCCA разветвляется в левую внутреннюю сонную артерию (ICA) и левую наружную сонную артерию (ECA). Поверхностная щитовидная артерия (СТА) возникает из ЭКА на медиальной стороне. Затылочная артерия (ОА) обычно возникает из ЭКА, но у некоторых мышей она возникает из ИКА.
- Перевяжите все ветви артерии, кроме ОА, с помощью стерильного шелого шва 6-0. Для этого сделайте следующие две перевязки.
- Аккуратно удалите соединительную ткань вокруг и под левой внутренней сонной артерии (ICA). Возьмите кусок шелухи 6-0 (6 см) с помощью щипцов и пропустите его под артерию. Используя другую пару щипцов, потяните шов примерно на 1/3 его длины и перевяжите артерию.
- Удалите соединительную ткань вокруг левой внешней сонной артерии (ЭКА) таким же образом, как описано выше, и сделайте перевязку проксимальной к левой верхней тиреоидеD артерии (STA) ( рисунок 1 ). Будьте осторожны, чтобы не повредить нервные волокна, которые проходят в пределах хирургического поля.
- Когда эти лигации были сделаны, вернуть слюнные железы в исходное положение и гидратировать хирургическое поле, поместив 2-3 капли стерильного физиологического раствора. Закройте кожу, используя шовные нити visryl 6-0.
- После операции поместите мышь в предварительно подогретую клетку (см. 1.2.1). Мышка должна проснуться в течение 5 минут и начать ходить. После подтверждения, что мышь ведет себя нормально, принесите клетку в комнату для животных.
- Наблюдайте за мышью ежедневно в течение первых 3 дней восстановления. Мышь может храниться столько времени, сколько требует эксперимент при различных условиях, к которым призывает экспериментальный протокол. Подготовка к зачатию может быть сделана в любое время после операции.
2. En Face Immunostaining
- Эвтаназию мыши с CO 2 путем передозировки при вдыхании.
- Лента мышь в лежачем положении (живот вверх) на рассекающую доску.
- Выставьте брюшную полость, сделав срединный разрез с помощью ножниц диафрагмы.
- Выставьте грудную полость, разрезая ребра латерально на грудную клетку.
- Сделайте ник в полой вене или вырежьте одну из бедренных артерий для слива крови.
- Вставьте иглу 26 G, прикрепленную к установке для гравитационной перфузии (давление воды 120 см), в верхнюю часть левого желудочка и перфузируйте систему кровообращения солевым раствором, содержащим гепарин (40 Ед. / Мл). Продолжайте перфузию, пока солевой раствор, вытекающий из разреза, не станет прозрачным.
- Переключите перфузионную систему из солевого раствора в раствор для фиксации, содержащий 4% параформальдегида в PBS (забуференный фосфатом физиологический раствор), и продолжайте перфузию еще на 5 мин.
- Уплотните аорту и левую и правую сонные артерии с помощью тупоконечных ножниц и пинцет и поместите в коническую пробирку на 50 мл, содержащую фиксатор на льду.
- Переместите сосуд в чашку Петри, содержащую PBS под рассекающим микроскопом, и осторожно удалите жир и соединительные ткани, прикрепленные к аорте и сонной артерии. Разделить и разделить аорту и сонные артерии продольно, чтобы обнажить эндотелий ( рис. 2 ).
- Переведите каждый сосуд отдельно в лунку 12-луночного планшета, содержащего 0,5 мл проницаемого раствора (0,1% Triton X-100 в PBS) на лунку. Проницаемость кровеносных сосудов в течение 10 мин с качанием при комнатной температуре (RT).
- Мойте коротко с PBS.
- Чтобы блокировать сайты неспецифического связывания антител, инкубируйте кровеносные сосуды в 10% нормальной сыворотке из видов животных, в которых были получены вторичные антитела, в TTBS (забуференный трис физиологический раствор (TBS) с 2,5% Tween 20) в течение 30 мин с Качаясь в RT.
- Инкубируйте сосуды с первичными антителами, соответственно разбавленными TTBS 10% нормальной сывороткой (как описано выше) в течение ночи с качанием при 4 ° C. УровеньРазведения должны быть определены для каждого антитела.
- Выполните следующее контрольное окрашивание.
- Инкубируйте сосуды с TTBS вместо первичного антитела с последующей инкубацией со вторичным антителом.
- Инкубируйте сосуды с TTBS, содержащие неиммунную (или преиммунную) сыворотку или Ig одного и того же животного (вида), в котором были сделаны первичные антитела, с последующей инкубацией со вторичным антителом.
- Опустите инкубацию со вторичным антителом. Эти контрольные образцы должны обрабатываться таким же образом и в то же время, когда проводится окрашивание специфическими антителами.
- Промойте кровеносные сосуды 3 раза TTBS в течение 10 мин с качанием при комнатной температуре.
- Инкубируйте с флуоресцентно мечеными вторичными антителами, разведенными соответствующим образом в TTBS с 10% нормальной сывороткой (как описано выше) в течение 1 часа с качанием при комнатной температуре. Ядерное окрашивание DAPI (4 ', 6-диамидино-2-фенилиндолом) может быть одновременно выполненоT эта стадия добавлением 1/5000 об. Основного раствора DAPI, который содержит 5 мг / мл DAPI в H 2 O.
- Промывают 3 раза TTBS в течение 10 мин с качанием при комнатной температуре.
- Промыть кратко в PBS.
- Поместите одну каплю антизатухающего реагента на покровное стекло (22 мм х 50 мм) и поместите кровеносный сосуд на покровное стекло с эндотелием вниз.
- Поместите стеклянное стекло (22 мм x 75 мм) на кровеносный сосуд, избегая образования пузырьков.
- Поместите слайд на чистую лабораторную салфетку ( например, Kimwipe) и закройте слайд двумя частями лабораторной салфетки. Аккуратно поместите 3,5 кг веса ( например , используйте бутылку воды в толстую книгу) на слайде в течение максимум 5 минут, чтобы сгладить образец кровеносного сосуда.
- Удалите вес и вытрите лишний раствор из покровного стекла.
- Нанесите лак для ногтей на 4 угла покровного стекла, поместите слайды в ползунок, покровное покрытие вверх и держите в темноте при комнатной температуре(Или 4 ° С) в течение ночи. Этот процесс еще больше выравнивает ткань и облегчает проведение микроскопии при высоких увеличениях.
- Покройте покровное стекло полностью, используя лак для ногтей.
- Проведите микроскопию, как только лак для ногтей высохнет.
- При необходимости храните слайды при -20 ° C.
Результаты
Типичное изображение иммунофлуоресцентного изображения эндотелия показано на рисунке 3 . На этом снимке изображен одиночный оптический участок аорты мыши, взятый вблизи отверстия межреберной артерии (большая темная область в форме яйца). Аорта была дважды окрашена анти-VE-cadherin (зеленый) и анти-VCAM-1 (молекула адгезии сосудистых клеток-1) (красная). Каждая эндотелиальная клетка выделяется зеленым линейным окрашиванием в месте соединения adherens. Из-за незначительной неравномерности образца, некоторые соединения adherens находятся за пределами этого оптического участка. Окрашивание анти-VCAM-1 сильнее при открытии межреберной артерии, где, как известно, происходит нарушение кровотока. На фиг. 4 показано окрашивание сонной артерии сонной артерии анти-VE-кадгерином (зеленый), анти-VCAM-1 (красный) и DAPI (фиолетовый). Левую сонную артерию (LCA) частично лигировали, тогда как правая сонная артерия (RCA) была нетронута. Образцы сосудов были изготовлены через 1 день после Хирургии и окрашенных. Обратите внимание на увеличение окрашивания анти-VCAM-1 в лигированном сосуде. Образцы, окрашенные иммунофлуоресцентно с различными антителами, можно использовать для исследования уровня экспрессии интересующих белков, степени посттрансляционных модификаций белков-мишеней и, конечно, картины локализации различных белков внутри эндотелиальных клеток, а также в других клетках в пределах Стенки кровеносных сосудов 10 , 11 .
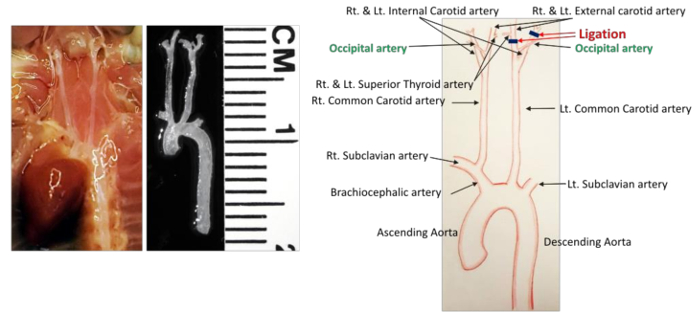
Рисунок 1 : Подробная Анатомия сосудов в области шейки матки. Слева показана сосудистая сеть до и после вскрытия. Все артерии идентифицированы в диаграмме, показанной справа. Черные линии обозначают лигации. Масштаб: 1 деление = 1 мм._blank "> Нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.

Рисунок 2: Диаграмма, показывающая, как сонные артерии и аорта превращаются в препараты для лица . Пунктирные линии вдоль стенки судна указывают на разрезы, которые должны быть сделаны, чтобы открыть сосуды. На цветных микрофотографиях показаны фактические препараты для лица. Масштаб: 1 деление = 1 мм. Нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
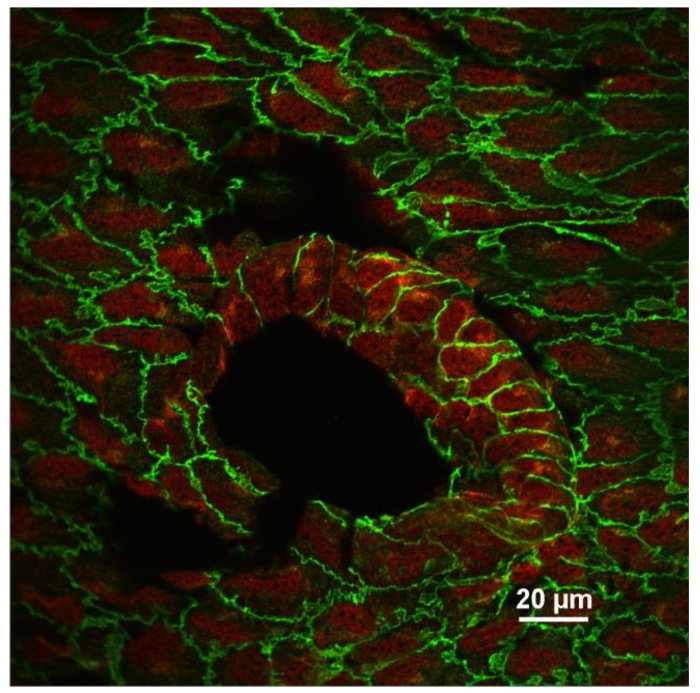
Рисунок 3: En Face Image эндотелия, окрашенного анти-VE-cadherin (зеленый) и анти-VCAM-1 (красный). Конфокальный одиночный оптический участок эндотелиальных клеток вблизи межреберного отверстияпоказано на рисунке. Обратите внимание, что экспрессия VCAM-1 увеличивается в эндотелиальных клетках, расположенных в точке ветвления сосуда, где кровоток не является ламинарным. Изображение было записано с использованием объектива 60X (NA 1,4, масло). Шкала шкалы = 20 мкм. Нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
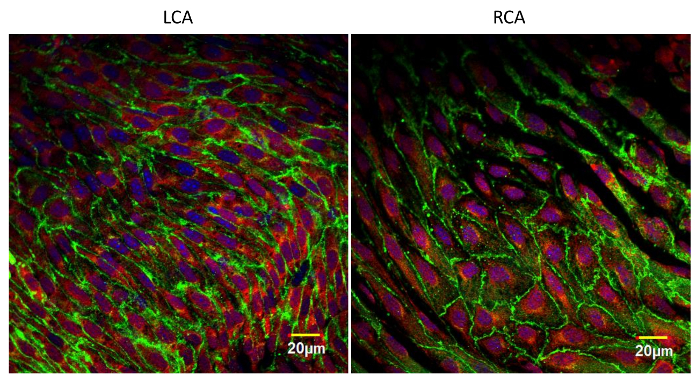
Рисунок 4: En Face Images левой и правой сонных артерий, окрашенных анти-VE-cadherin (зеленый), Anti-VCAM-1 (красный) и DAPI (фиолетовый). Левую сонную артерию частично лигировали и правую сонную артерию оставляли нетронутой. Эти препараты были сделаны через 24 часа после операции. Очевидна повышенная экспрессия VCAM-1 на лигированной стороне по сравнению с интактным сосудом. Эти снимки были сделаны вблизи бифуркации общих сонных артерийИспользуя лазерный сканирующий конфокальный микроскоп с объективом 60Х (NA 1.4, масло). Масштабный стержень = 20 мкм. Нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Обсуждение
При обработке мышечных кровеносных сосудов важно помнить, что эндотелий является хрупким и что любая чрезмерная механическая сила повредит эндотелиальные клетки. Например, эндотелиальные клетки разрушаются или отсоединяются от стенки сосуда, если сосуд слишком интенсивно перфузируется, что может легко произойти при перфузии сосудов с помощью ручного шприца.
Для получения постоянного давления перфузии мы используем гравитационную перфузионную систему с давлением в колонке 120 см. Сообщалось, что среднее артериальное давление мыши, которое отличается деформацией, находится в пределах 130-170 см водного столба. Таким образом, давление перфузии, которое мы используем, немного меньше, чем измеренное артериальное давление. Когда мы фиксировали перфузию аорты крысы, использовали давление колонки 90 см H 2 O 6 .
Энтеотелиальные клетки in situ также повреждаются, если судно растягивается во время уборки, Очистку, продольное расщепление, иммунное окрашивание и монтаж. Фактически, механическое повреждение является одной из распространенных причин потери эндотелиальных клеток в препаратах для лица. Растяжение сосуда может происходить на любом этапе процедуры, но чаще всего это происходит во время уборки сосуда. Также легко растянуть сосуд при удалении жировой ткани, прикрепленной к адвентиции.
Подготовка лицевой поверхности производится путем разрезания сосуда в продольном направлении по всей его длине. Это делается обычно с помощью острых офтальмологических ножниц. Однако кончик ножниц может быть слишком большим, если внутренний диаметр целевого сосуда мал. В этом случае можно использовать трещиноватую тонкую одноразовую лезвию для выполнения разреза. Мы использовали эту методику для приготовления энзимных препаратов брыжейки брыжеечной артерии 15 .
После фиксации перманентные перманентные препараты. Обычно PBS, содержащий Triton X-100, используется дляЭтой цели, но можно использовать другие реагенты для проницаемости, такие как Tween-20, Nonidet P-40, сапонин, дигитонин и Leucomerm. В идеале условие пермеабилизации должно быть оптимизировано в каждой лаборатории. Для мышечной аорты и сонных артерий мы обрабатываем их PBS, содержащим 0,1% Triton X-100 в течение 10 мин при комнатной температуре, и эта обработка достаточна для проницаемости всех клеток в стенке сосуда. Пермеабилизированные пробы затем последовательно обрабатывают сначала первичным антителом, а затем вторичным антителом, которое флуоресцентно мечено. Для окрашивания мышечных сосудов важно, чтобы первичное антитело не было сделано у мыши, потому что сосудистая ткань мыши будет содержать мышиный IgG, который будет мечен флуоресцентно меченным вторичным антимышиным IgG, вызывая высокое окрашивание фона. Для микроскопии образец должен быть как можно более плоским. Нажимаем слайды в течение 5 минут с весом 3,5 кг. Этот удельный вес определяли эмпирически.
WПрепараты куриных эмбрионов помечены иммунофлуоресцентно, их можно изучать с помощью обычного эпифлуоресцентного микроскопа, конфокального микроскопа с лазерным сканированием и многофотонного микроскопа. Конфокальная микроскопия лучше всего получать изображения эндотелия и субэндотелиальной области размером до 50 мкм или около того от поверхности сосуда, а глубокое проникновение света возбуждения, достигаемого многофотонным режимом освещения, позволяет получать фокусные изображения с глубины До 2 мм от поверхности стенки сосуда. Кроме того, многофотонная микроскопия может быть использована для получения изображений второй гармоники, наиболее часто для изучения организации коллагеновых волокон в стенке сосуда. Препараты для лица большие, что позволяет нам осмотреть большую сосудистую область, такую как длина всей аорты. Вот некоторые из преимуществ использования иммунофлуоресцентно окрашенных препаратов для кровеносных сосудов. Однако есть некоторые недостатки этой методики. Прежде всего, метод ограничиваетсяНаличие специфических антител и других флуоресцентно меченных реагентов, таких как флуоресцентный фаллоидин, DAPI и DiI-Ac-LDL (ацетилированный липопротеин низкой плотности, меченный 1,1'-диоктадецил-3,3,3 ', 3'-тетраметилиндокарбоцианином перхлорат). Поскольку визуализация основана на флуоресценции, нефлуоресцентные части образцов не могут быть отображены. В целом образцы образцов в целом обнаруживают аутофлуоресценцию, а волокна эластина, обнаруженные в крупных кровеносных сосудах, флуоресцируют зеленым цветом. Эта флуоресценция особенно проблематична при использовании эпифлуоресцентного микроскопа; Таким образом, визуализация конфокальным микроскопом настоятельно рекомендуется. Однако интерференция этой зеленой аутофлуоресценции может быть значительно снижена при использовании вторичных антител, меченных красным флуоресцентным красителем. И, наконец, поскольку толщина обломочных образцов слишком велика, изображение с помощью проходящего освещения невозможно.
Коммерческие конфокальные и многофотонные микроскопы поставляются с программным обеспечением для анализа изображений, включаяОдин для количественного анализа флуоресцентной интенсивности изображений. Количественные данные более надежны, если сравнения производятся на одном слайде. Это происходит потому, что все условия для иммуноокрашивания одинаковы для образца. Если интенсивность окрашивания должна сравниваться между различными предметными стеклами (например, нормальными или больными сосудами), единственным способом проверки данных является увеличение числа образцов, чтобы можно было усреднить как технические, так и биологические вариации. В целом, измерения интенсивности на конфокальных изображениях, полученных вблизи поверхности сосудов, являются более надежными. Флуоресцентные интенсивности изображений, полученных из более глубоких областей ткани, имеют тенденцию быть более переменными из-за разной степени рассеяния и поглощения как возбуждения, так и испускаемого флуоресцентного света. В общем, нужно быть осторожным в интерпретации тонких различий интенсивности, обнаруженных в глубоких областях образцов. Для улучшения способности получения изображений из более глубоких областей ткани предпринимаются попытки сделать tВопросы полупрозрачны, а некоторые впечатляющие изображения получены (например, см. Недавнюю статью Neckel et al. 16 и работы, цитированные этими авторами). Хотя возможно, что обработки, используемые для получения полупрозрачных тканей, могут экстрагировать определенные антигены и / или денатурировать некоторые эпитопы, этот метод может быть использован для получения более воспроизводимых флуоресцентных сигналов из более глубоких областей ткани.
Использование препаратов для энцефалографии не ограничивается визуализацией с помощью флуоресцентной микроскопии. С помощью стереомикроскопа можно использовать препараты для подготовки поверхности сосудов для изучения степени образования атеросклеротических бляшек после окрашивания их маслянистым красным маслом. Препараты сосудов на лице могут быть сделаны асептически. Такие препараты могут храниться в культуре и могут использоваться в качестве системы ex vivo для изучения взаимодействия лейкоцитарно-эндотелиальных клеток.
Раскрытие информации
Никто
Благодарности
Исследовательская деятельность авторов поддерживается грантами Национального института здравоохранения доктору Абе (HL-130193, HL-123346, HL-118462, HL-108551).
Материалы
| Name | Company | Catalog Number | Comments |
| 0.9% Sodium Chloride injection solution USP 500ml bag | Fisher Scientific | NC9788429 | |
| 12-well plates | Fisher Scientific | 12556005 | |
| 6-0 coated vicryl suture | Ethicon | J833G | |
| AF488 goat anti-rat IgG | Life Technologies | A11006 | |
| AF546 goat anti-rabbit IgG | Life Technologies | A11035 | |
| Anti-CD144 (Ve-Cad) | BD Biosciences | BD555289 | |
| Anti-VCAM-1 (H-276) Rabbit polyclonal IgG | Santa Cruze Biotechnology | Sc-8304 | |
| Aoto Flow System | Braintree Scientific | EZ-AF9000 | |
| Autoclave Wrap. 24x24in | Cardinal Health | 4024 | |
| Blunt retractors, 2.5mm wide | Fine Science Tools | 18200-10 | |
| Caprofen (Rimadyl) | zoetis | NADA#141-199 | |
| Chlorhexidine Scrub, 2% | Med-Vet International | RXCHLOR2-PC | |
| Curity gauze sponges 2x2 | Cardinal Health | KC2146 | |
| Electric heating pad, 12X14 | Fisher Scientific | NC0667724 | |
| Extra Fine Graefe Forceps | Fine Science Tools | 11152-10 | |
| Iris Scissors | Fine Science Tools | 14090-11 | |
| Micro cover glass 22x50mm | VWR | 48393059 | |
| Microscope Slides | Fisher Scientific | 12-550-18 | |
| normal goat serum | Equitech-Bio | GS05 | |
| Paraformaldehyde Solution 4% in PBS | Santa Cruze Biotechnology | SC-281692 | |
| Petri Dishes 100x15mm | Fisher Scientific | FB0875713 | |
| Prolong Gold Antifade mountant with DAPI | Life Technologies | P-36935 | |
| Puritan cortton swabs | VWR | 10806-005 | |
| Puritan Mini cotton tipped aplicators | VWR | 82004-050 | |
| Round handled Needle Holder | Fine Science Tools | 12076-12 | |
| Silk Suture 6/0 | Fine Science Tools | 18020-60 | |
| Spring scissors | ROBOZ | RS-5601 | |
| Strabismus Scissors | Fine Science Tools | 14075-09 | |
| Super Grip Forceps | Fine Science Tools | 00649-11 | |
| Transparent Dressing | Cardinal Health | TD-26C | |
| Triton X-1000 | Fisher Scientific | AC327371000 |
Ссылки
- Jelev, L., Surchev, L. A novel simple technique for en face endothelial observations using water-soluble media -'thinned-wall' preparations. J Anat. 212 (2), 192-197 (2008).
- Neill, J. F. The effect on venous endothelium of alterations in blood flow through the vessels in vein walls, and the possible relation to thrombosis. Ann Surg. 126 (3), 270-288 (1947).
- Rogers, K. A., Kalnins, V. I. A method for examining the endothelial cytoskeleton in situ using immunofluorescence. J Histochem Cytochem. 11 (11), 1317-1320 (1983).
- Poole, J. C. F., Sanders, A. G., Florey, H. W. The regeneration of aortic endothelium. J Pathol Bacteriol. 75, 133-143 (1958).
- Sade, R. M., Folkman, J. En face stripping of vascular endothelium. Microvasc Res. 4, 77-80 (1972).
- White, G. E., Gimbrone, M. A., Fujiwara, K. Factors influencing the expression of stress fibers in vascular endothelial cells in situ. J Cell Biol. 97 (2), 416-424 (1983).
- Kim, D. W., Gotlieb, A. I., Langille, B. L. In vivo modulation of endothelial F-actin microfilaments by experimental alterations in shear stress. Arteriosclero. 9, 439-445 (1989).
- Haka, A., Potteaux, S., Fraser, H., Randolph, G., Maxfield, F. Quantitative analysis of monocyte subpopulations in murine atherosclerotic plaques by multiphoton microscopy. Plos ONE. 7 (9), 244823e (2012).
- Chèvre, R., et al. High-Resolution imaging of intravascular atherogenic inflammation in live mice. Circ Res. 114, 770-779 (2014).
- Heo, K. -. S., et al. Disturbed flow-activated p90RSK kinase accelerates atherosclerosis by inhibiting SENP2 function. J Clin Invest. 125 (3), 1299-1310 (2015).
- Le, N. -. T., et al. A crucial role for p90RSK-mediated reduction of ERK5 transcriptional activity in endothelial dysfunction and atherosclerosis. Circ. 127, 486-499 (2013).
- Kano, Y., Katoh, K., Masuda, M., Fujiwara, K. Macromolecular composition of stress fiber-plasma membrane attachment sites in endothelial cells in situ. Circ Res. 79, 1000-1006 (1996).
- Nigro, P., et al. Cyclophilin A is an inflammatory mediator that promotes atherosclerosis in apolipoprotein E-dependent mice. J Exp Med. 208 (1), 53-66 (2011).
- Mattson, D. L. Comparison of arterial blood pressure in different strains of mice. Am J Hypertens. 14 (5), 405-408 (2001).
- Jinguji, Y., Fujiwara, K. Stress fiber dependent axial organization of fibronectin fibrils in the basal lamina of the chick and mesenteric artery. Endothelium. 2, 35-47 (1994).
- Neckel, P. H., Mattheus, U., Hirt, B., Lust, L., Mack, A. F. Large-scale tissue clearing (PACT): Technical evaluations and new perspectives in immunofluorescence, histology, and ultrastructure. Sci Rep. 6, 34331 (2016).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены