Method Article
הכנת פנים של כלי דם עכבר
In This Article
Summary
נוהל להכנת ההכנות הפנים של העורק הראשי עורקים אבי העורקים מתואר. הכנות כאלה, כאשר מוכתמים immunofluorescently עם נוגדנים ספציפיים, מאפשרים לנו ללמוד לוקליזציה של חלבונים זיהוי של סוגי תאים בתוך הקיר כולו כלי הדם על ידי מיקרוסקופיה confocal.
Abstract
חלקים של רקמות מוטבע פרפין משמשים באופן שגרתי לחקר היסטולוגיה רקמות היסטופתולוגיה. עם זאת, קשה לקבוע מה מורפולוגיה רקמת תלת מימדי הוא מן הסעיפים האלה. בנוסף, קטעים של רקמות שנבדקו לא יכול להכיל את האזור בתוך הרקמה הדרושה לצורך המחקר המתמשך. הגבלה זו מעכבת מחקרים היסטופאתולוגיים של כלי הדם מאז לפתח נגעים וסקולריים באופן ממוקד. זה דורש שיטה המאפשרת לנו לסקור שטח רחב של קיר כלי הדם, מפני השטח שלו לאזורים עמוקים יותר. הר שלם בפנים הכנה של כלי הדם ממלא דרישה זו. במאמר זה, נוכל להדגים כיצד לעשות ההכנות פנים של אבי העורקים בעורק ואת עורק הצוואר כדי כתם immunofluorescently עבור מיקרוסקופיה confocal וסוגים אחרים של הדמיה מבוססי פלואורסצנטי.
Introduction
עבור מחקרים היסטופתולוגיים על ידי מיקרוסקופ אור, שלוש חתיכות ממדי של רקמות ביולוגיות מעובדות באופן שגרתי עבור emaffment פרפין ואחריו חתך מכתים. מדגם רקמה כי כבר מוטבע paraffin עשוי להיות כמה מילימטרים בכל שלושת הממדים. עם זאת, לצורך מיקרוסקופ אור, זה חייב להיות מחולק הראשון, כך האור יכול לעבור ולאחר מכן מוכתמים כך בסעיף דק תשואות בניגוד מספיק הדמיה. בגלל דגימות מחולקים הם בדרך כלל 5-10 מיקרומטר עובי, אחד רואה רק חלק קטן מאוד של הדגימה כולה בשני ממדים בכל פעם. ניתן לאסוף סעיפים עוקבים, לאחר הדמיה כל סעיף בנפרד, לבצע שחזור ממוחשב בסיוע של תמונות 3D, אבל זו עבודה מייגעת אכן. Histopathology של כלי הדם, במיוחד לחקר הפתוגנזה של טרשת עורקים, מציג בעיות ייחודיות. טרשת עורקים היא מחלה מתפתחת שמתפתחתבאופן מקומי באזורים בהם מתרחשת זרימת דם מופרעת. יתר על כן, המחלה היא יזמה בתוך האינטימה, רקמה דקה המורכבת monolayer של תאים אנדותל ו מטריקס תאיים, של העורקים הגדולים. מסיבות אלה, זהו אתגר לאתר ולחקור lesions מוקדם באמצעות כלי הדם מחולק כי אחד יכול בקלות להחמיץ חתך את הנגע. גם אם סעיף כולל אזור חולה, אחד יראה רק חלק 5-10 מיקרומטר המכיל תאים אנדותל ותאי קיר כלי דם אחרים בתקשורת adventitia.
הר שלם בפנים (המובהק än fäs) ההכנות מאפשרות לנו סקר שטח רחב של משטח כלי הדם כגון האאורטה כולה מן שורש אבי העורקים כל הדרך עד לעורקים השד הנפוצים. באמצעות דוגמה כזו מוכתם נוגדנים ספציפיים ובדיקות ספציפיות אחרות, ניתן לאתר את המיקום של נגעים וגם שם אירועים מולקולריים שונים להתרחש בתאי אנדותל יחד עם wiכמו שינויים בביטוי, בלוקליזציה ושינויים פוסט-טראנסציוניים של חלבונים. בנוסף ללימוד אנתרוגנזה, צורת התא האנדותל שנצפתה בהכנות לפנים משמשת אינדיקטור לתבנית זרימת הדם הממוצעת בזמן. נתונים אלה חשובים ללימוד mechanosignaling של תאים אנדותל באתרם. לשם כך, שגרתית היסטולוגית חתך כלי הדם אינם שימושיים. לכן, עבור רפואה וסקולרית וביולוגיה, חשוב במיוחד לרכוש טכניקה להכנת ההכנות הפנים של כלי הדם המאפשר אחד להתבונן שטח רחב של משטח כלי השיט, כמו גם את אזורים תת קרקעיים עמוק יותר של כלי השיט.
כפי שנבדקו על ידי Jelev ו Surchev 1 , ביולוגים כלי הדם פיתחו שיטות שונות כדי לצפות בטנה של כלי הדם על הפנים. כמה שיטות גאוני פותחו בשנות 1940 ו 1950 של. באמצעות שיטות אלה, הם היו מסוגל ללמוד את הארגון הבסיסי של תאים אנדותל כי קו פני השטח הפנימיים של כלי הדם. עם זאת, בגלל הדרך ההכנות האלה מוכנים מוכנים (מה שנקרא שיטת Hautchen 2 , 3 , 4 או קילוף את פני השטח של כלי השיט 5 ) ואת האופן שבו הדגימה היה מוכתם, זה לא תמיד היה ניתן להשיג ללא הפרעה מורפולוגית מידע מכלי השיט אל האזורים העמוקים יותר של דופן כלי הדם. הר שלם בפנים הכנה הכנה בשילוב עם מכתים immunofluorescence אפשרה לנו לא רק ללמוד מורפולוגיה תא האנדותל ביטוי חלבון לוקליזציה בתאים אלה, אלא גם כדי להרחיב מחקרים כאלה לאזור subendothelial של קיר כלי השיט. מחקרים מוקדמים באמצעות ההכנות כלי דם פנים מוכתם immunoflorescently החלו להופיע בשנות ה -1980 של 6 ,F "> 7. עם הופעתו של מיקרוסקופ לייזר סריקת confocal ומיקרוסקופ multiphoton לאחרונה יותר לאחרונה, אחד יכול כעת לקבל תמונות ברורה להתמקד של כלי הדם מבנה הקיר בדגימות כלי רכב מוכתמים immunofluorescently אל פנים, כמו גם את רשת כלי הדם בבעלי חיים חיים 8 , 9 , 10 , 11. אלה מבוססי מחשב טכניקות הדמיה ליצור במיקוד אופטי חתך תמונות, ועל ידי ערימת תמונות כאלה, אפשר לקבל תמונות 3D משוחזרים של קיר כלי הדם ואת רשת כלי הדם ברקמות.בנוסף, אחד יכול ליצור תמונות של קטע שנעשה לאורך ציר ה- Z של התמונה המשוחזרת 12 , 13 .
במאמר זה, נוכל להמחיש שיטה להכנת ההכנות פנים של אבי העורקים העכבר ואת עורק הצוואר מכתים אימונופלורסנט. הכנות פניםיכול להתבצע גם לאחר כלי אלה כבר מניפולציה ניסיונית. לדוגמה, עורק הראש יכול להיות ligated חלקית ולאחר מכן הכנה פנים עשה לאחר ניתוח כזה. מסיבה זו, אנו גם לתאר במאמר זה איך אנחנו עושים קשירת חלקית על עורק הצוואר. בהשוואה להכנת תכשירים דומים מחיות גדולות יותר, כגון עכברושים, ארנבות ובני אדם, כלי העכברים קטנים בגודלם ובריריים יותר, מה שדורש טיפול נוסף לטיפול במהלך בידוד כירורגי של כלי הדם והכנתם לצביעת נוגדן ומיקרוסקופ. בגלל המודל החייתי הנפוץ ביותר עבור שינוי גנטי הוא העכבר, זה הופך להיות קריטי עבור חוקרים רבים להתמודד עם כלי העכבר מבלי לפגוע בהם. בכתב יד זה, נתאר כיצד להתמודד עם כלי הדם העכבר בעת ביצוע ההכנות פנים של אבי העורקים בעורק ואת עורק הצוואר. לצורך ההדגמה, נשתמש בעכברי בר C57 / b6.
Protocol
הפרוטוקולים לעורקים חלקיקים עכבר חלקית קשירת ובידוד של אבי העורקים העכבר ועורק הראש עבור הפנים immunostaining הם מאושרים על ידי טיפול בבעלי חיים מוסדיים ועדת שימוש (IBT 2014-9231).
1. משמאל חלקית עורק הלב הראשי קשירת
- הכן את שטח כירורגי על ידי הנחת 12 אינץ 'x 14 אינץ' כרית חימום על השולחן לכסות את הפנקס ואת שולחן הדף עם וילון כירורגי גדול ונקי. התאם את הזרוע של הדום לעמוד כך שדה stereomicroscope של נוף הוא באזור המרכז של כרית חימום.
- הפעל את כרית החימום על השולחן ולהגדיר את 3 חיוג בקרת חיוג לרמת החום בינוני. בהגדרת טמפרטורה זו, משטח הלוח הכירורגי (ראה 1.6.1) יהיה 38-40 ° C.
- מניחים כלוב נקי על כרית חימום נוספת. הפעל את כרית חימום על מעל. כלוב זה ישמש להתאוששות לאחר הניתוח (ראה 1.16) וכן דיור.
על השולחן הכירורגי, הניחו את שקית עיקור autoclaved המכיל מספריים איריס (זוג אחד), מלקחיים רקמות (1 זוג), מלקחיים אחיזה סופר (2 זוגות), מספריים האביב (1 זוג), מפשק קהה (1 זוג, רוחב 2.5 מ"מ) , עגול מטפל מחזיק מחט (1), מעוקרים 6-0 משי תפר, כותנה היטה applicators, כותנה מיני היטה applicators, וילונות כירורגי, 2 "x 2" גזה ספוגים. גם במקום בקבוק לסחוט המכיל אתנול 70% ועוד המכיל chlorhexidine scrubon כירורגי השולחן כירורגי. - שקלו עכבר. משקל הגוף נדרש כדי לקבוע את הכמות המתאימה של כאבים, אשר ינוהל מיד לפני הניתוח.
- מניחים את העכבר לתוך החדר אינדוקציה.
- הפעל את מיכל החמצן ואת מאדה הרדמה כדי להרדים את העכבר בחדר אינדוקציה. לשמור על רמת isoflurane ב 2%. זה לוקח 3-5 דקות לפני העכבר מפסיק לזוז.
- בעוד העכבר הוא להיות anestheTized, במקום חתיכה קטנה יותר של סטרילית כירורגי drape (24 אינץ '24 אינץ') תחת stereomicroscope כדי ליצור משטח כירורגי. לאחר מכן מקום לוח כירורגי אקרילי (אשר נוקה עם אלכוהול 70%) על משטח וילונות. הלוח כירורגי ולכן צריך להיות על כרית חימום אבל מופרדים על ידי שתי שכבות של וילונות כירורגיים.
- כאשר העכבר מפסיק לנוע בחדר אינדוקציה, להעביר את העכבר לאזור הכנה טרום ניתוחי למקם את האף לתוך חרוט האף מחובר מאדה (2% isoflurane). הסר את השיער סביב אזור צוואר הרחם באמצעות גוזם חשמלי או מסיר שיער. אנו ממליצים על הסרת שיער קרם כי שיטה זו לא לייצר חתיכות שיער רופף, אשר קשה להסיר לחלוטין מן האזור כירורגית.
- עם חרוט האף במקום, להזיז את העכבר ללוח כירורגית.
- קלטת את כפות הרגליים הימנית והשמאלית אל לוח הניתוח. קלטת את שתי רגליה האחוריותבצד ימין של העכבר. זה גורם סיבוב קל של גוף העכבר כך בצד שמאל של אזור הצוואר של העכבר הופך להיות ממוקם טוב יותר לניתוח.
- לחטא את אזור החתך עם אלכוהול 70%, chlorhexidine לשפשף, ושוב עם אלכוהול 70%. לכסות את העכבר עם וילון כירורגי מעוקרים למעט באזור החתך צוואר הרחם.
- אישור על ידי קמצוץ הבוהן כי העכבר הוא הרדים לחלוטין לתת כאבים (Caprofen 3-5 מ"ג / ק"ג) באמצעות הזרקה intraperitoneal או תת עורית.
- תחת מיקרוסקופ לנתח, לעשות חתך קו האמצע הגחון סביב אזור צוואר הרחם באמצעות או אזמל או מספריים איריס.
הערה: אנו משתמשים מספריים כי מרחק העבודה של stereomicroscope מוגבל, מה שהופך אותו קשה להשתמש באזמל. - לחשוף את עורק הצוואר השמאלי השמאלי (LCCA) על ידי דחיפת הצידה repositioning את בלוטות הרוק המכסים את כלי הדם בצד שמאל שלNimal.
- לזהות את כל כלי הדם בשדה כירורגי ( איור 1 ). LCCA bifurcates לתוך עורק הצוואר הפנימי השמאלי (ICA) ואת עורק הצוואר החיצוני השמאלי (ECA). עורק התריס שטחי (STA) עולה ECA בצד המדיאלי. עורק העורקים (OA) עולה בדרך כלל מה- ECA, אך בחלק מהעכברים הוא נובע מה- ICA.
- לקשור את כל ענפי העורק למעט OA באמצעות סטריליזציה 6-0 משי סטרילי. כדי להשיג זאת, להפוך את שתי ligations הבא.
- הסר בעדינות את רקמת החיבור סביב ומתחת עורק הצוואר הפנימי השמאלי (ICA). לתפוס חתיכת precut 6-0 משי תפר (~ 2.5 ס"מ) עם מלקחיים ולהעביר אותו מתחת לעורק. באמצעות זוג אחר של מלקחיים, למשוך את התפר בערך 1/3 אורכו ולקשור את העורק.
- הסר את רקמת החיבור סביב עורק הצוואר החיצוני השמאלי (ECA) באותה הדרך שתוארה לעיל ולעשות פרוקסימלי קשירת שמאל thyroi השמאליעורק ד (STA) ( איור 1 ). היזהר לא לפגוע סיבי העצבים הפועלים בתוך שדה כירורגי.
- כאשר ligations אלה נעשו, להחזיר את בלוטות הרוק למצב המקורי להידד את שדה הניתוח על ידי הצבת 2-3 טיפות של מלח סטרילית. סגור את העור באמצעות sucures 6-0 מצופה vericl.
- לאחר הניתוח, במקום את העכבר בכלוב מחומם מראש (ראה 1.2.1). העכבר צריך להתעורר בתוך 5 דקות ולהתחיל להסתובב. לאחר אישר כי העכבר מתנהג בצורה נורמלית, להביא את הכלוב לחדר הדיור בבעלי חיים.
- שים לב לעכבר במשך 3 הימים הראשונים של ההתאוששות. העכבר יכול להישמר כל עוד הניסוי דורש בתנאים שונים כי פרוטוקול הניסוי קורא. ההכנות פנים יכול להיעשות בכל עת לאחר הניתוח.
2. פנים Immunostaining
- להרדים עכבר עם CO 2 על ידי מנת יתר שאיפה.
- קלטת את העכבר במצב שכיבה (בטן כלפי מעלה) על גבי לוח לנתח.
- לחשוף את חלל הבטן על ידי ביצוע חתך קו האמצע באמצעות מספריים איריס.
- לחשוף את חלל החזה על ידי חיתוך הצלעות רוחבית לחזה.
- לעשות ניק בתוך קאווה הווריד או לחתוך אחד העורקים הירך עבור ניקוז הדם.
- הכנס מחט 26 G המצורפת ההתקנה זלוף הכבידה (120 ס"מ לחץ מים) לתוך השיא של החדר השמאלי ו perfuse את מערכת הדם עם תמיסת מלח המכיל הפרין (40 U / mL). המשך את זלוף עד מלוחים הזורמים מתוך לחתוך הופך ברור.
- החלף את מערכת זלוף מ מלוחים לפתרון קיבעון המכיל paraformaldehyde 4% ב PBS (פוספט שנאגרו מלוחים), ולהמשיך perfusing עבור 5 דקות נוספות.
- קציר את אבי העורקים ואת שני העורקים הימנית ואת ימין ושמאלי באמצעות מספריים מלקחיים בסוף המלקחיים, ומניחים צינור 50 מ"ל חרוטי המכיל את מקבע על הקרח.
- להעביר את כלי לתוך צלחת פטרי המכיל PBS תחת מיקרוסקופ לנתח, בזהירות להסיר את רקמת השומן החיבור המצורפת העורקים אבי העורקים ואת הצוואר. להפריד ולפצל את העורקים אבי העורקים ואת הצוואר ארוך longitudinally לחשוף את האנדותל ( איור 2 ).
- העברת כל כלי בנפרד היטב של צלחת 12 גם המכיל 0.5 מ"ל של פתרון permeabilizing (0.1% Triton X-100 ב PBS) לכל טוב. Permeabilize כלי דם במשך 10 דקות עם נדנדה בטמפרטורת החדר (RT).
- לשטוף בקצרה עם PBS.
- כדי לחסום אתרים שאינם קשורים ספציפית נוגדן, דגירה כלי הדם בסרום 10% נורמלי מן המין החיה שבה נוגדנים משני נעשו, ב TTBS (טריס שנאגרו מלוחים (TBS) עם 2.5% Tween 20) במשך 30 דקות עם נדנדה ב RT.
- דגירה כלי עם נוגדנים ראשוניים בדילול נאות ב TTBS עם סרום 10% נורמלי (כמתואר לעיל) בן לילה עם נדנדה על 4 מעלות צלזיוס. הרמהשל דילול יש לקבוע עבור כל נוגדנים.
- בצע את מכתים הבקרה הבאים.
- דגירה כלי עם TTBS במקום נוגדן ראשוני ואחריו הדגירה עם נוגדנים משני.
- דגירה כלי עם TTBS המכיל לא החיסונית (או מראש החיסון) בסרום או Ig של אותו בעל חיים (מינים) שבו נוגדנים ראשוניים נעשו, ואחריו הדגירה עם נוגדנים משני.
- להשמיט את הדגירה עם נוגדנים משני. דגימות בקרה אלה יש לטפל באותו אופן באותו זמן כאשר מכתים עם נוגדנים ספציפיים מבוצעת.
- לשטוף את כלי הדם 3 פעמים עם TTBS במשך 10 דקות כל עם נדנדה ב RT.
- דגירה עם נוגדנים משני שכותרתו fluorescently מדולל כראוי TTBS עם סרום 10% נורמלי (כמתואר לעיל) במשך 1 שעות עם נדנדה ב RT. מכתים גרעיני עם DAPI (4 ', 6-diamidino-2-phenylindole) עשוי להיות מבוצע בו זמניתT בשלב זה על ידי הוספת 1 / 5,000 על ידי נפח של פתרון מלאי DAPI אשר מכיל 5 מ"ג / מ"ל של DAPI ב H 2 O.
- לשטוף 3 פעמים עם TTBS במשך 10 דקות כל עם נדנדה ב RT.
- שוטפים בקצרה ב- PBS.
- מניחים טיפה אחת של מגיב נגד דהייה על כיסוי זכוכית (22 מ"מ x 50 מ"מ) והניח כלי דם על זכוכית לכסות עם האנדותל מול למטה.
- מניחים כוס שקופיות (22 מ"מ x 75 מ"מ) על כלי הדם, תוך הימנעות בועות השמנה.
- מניחים את השקופית על מעבדה נקייה לנגב ( למשל Kimwipe) ו לכסות את השקופית עם שתי חתיכות של מעבדה לנגב. בעדינות במקום 3.5 ק"ג של משקל ( למשל, השתמש בקבוק מים על ספר עבה.) על השקופית במשך מקסימום של 5 דקות כדי לשטח את מדגם כלי הדם פנים.
- הסר את המשקל ולנגב את פתרון עודף סביב coverslip.
- החל לק ציפור על 4 הפינות של coverslip, במקום שקופיות בתיבת שקופיות, coverslip בצד למעלה, ולשמור בחושך ב RT(או 4 ° C) למשך הלילה. תהליך זה משטחים את הרקמה עוד יותר ומקלה לעשות מיקרוסקופיה בהגדלה גבוהה.
- חותם את coverslip לחלוטין באמצעות לק.
- בצע מיקרוסקופיה ברגע לק ציפורן יבש.
- במידת הצורך, שקופיות חנות ב -20 מעלות צלזיוס.
תוצאות
תמונה טיפוסית הפנים immunofluorescence של האנדותל מוצג באיור 3 . תמונה זו מראה קטע אופטי אחד של אבי העורקים של העכבר נלקח ליד פתיחתו של עורק בין דודי (אזור ביצה כהה גדול). אבי העורקים היו מוכתמים פעמיים עם אנטי VE-cadherin (ירוק) ואנטי-VCAM-1 (דלקת תא הידבקות מולקולה -1) (אדום). כל תא האנדותל מתואר עם מכתים ליניארי ירוק בצומת adherens. בשל חוסר אחידות קטין של הדגימה, כמה צמתים adherens נמצאים מחוץ זה קטע אופטי. אנטי VCAM-1 מכתים חזק יותר בפתיחת עורק interstostal שבו זרם הדם מופרע ידוע להתרחש. איור 4 מראה מכתים פנים של עורקי הראש עם אנטי VE-cadherin (ירוק), נגד VCAM-1 (אדום), DAPI (סגול). עורק הצוואר השמאלי (LCA) היה ligated חלקית בעוד עורק הצוואר הימני (RCA) היה נגע. ספינות הספינה נעשו יום אחד לאחר ניתוח ומוכתמים. הערה גדל אנטי VCAM-1 מכתים בכלי ligated. דגימות מוכתמות immunofluorescently עם נוגדנים שונים ניתן להשתמש כדי לחקור את רמת הביטוי של חלבונים בעלי עניין, את מידת השינויים posttranslational של חלבונים היעד, וכמובן, דפוס של לוקליזציה של חלבונים שונים בתוך תאי האנדותל, כמו גם בתאים אחרים בתוך קיר 10 , 11 .
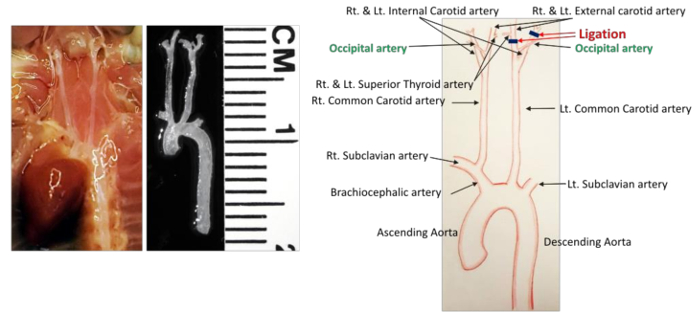
איור 1 : אנטומיה של כלי שיט מפורטים באזור צוואר הרחם של העכבר. רשת כלי הדם לפני ואחרי דיסקציה מוצג בצד שמאל. כל העורקים מזוהים בתרשים שמוצג בצד ימין. קווים שחורים מציינים ליגציות. קנה מידה: 1 חלוקה = 1 מ"מ._blank "> אנא לחץ כאן כדי להציג גרסה גדולה יותר של דמות זו.

איור 2: דיאגרמה מראה כיצד העורקים הראשוניים ואאורטה נעשים ההכנות פנים En . קווים מנוקדים לאורך קיר כלי השיט מצביעים על חתכים שנועדו לפתוח את הכלים. המיקרוגרפים הצבעוניים מראים היערכות פנים. קנה מידה: 1 חלוקה = 1 מ"מ. אנא לחץ כאן כדי להציג גרסה גדולה יותר של דמות זו.
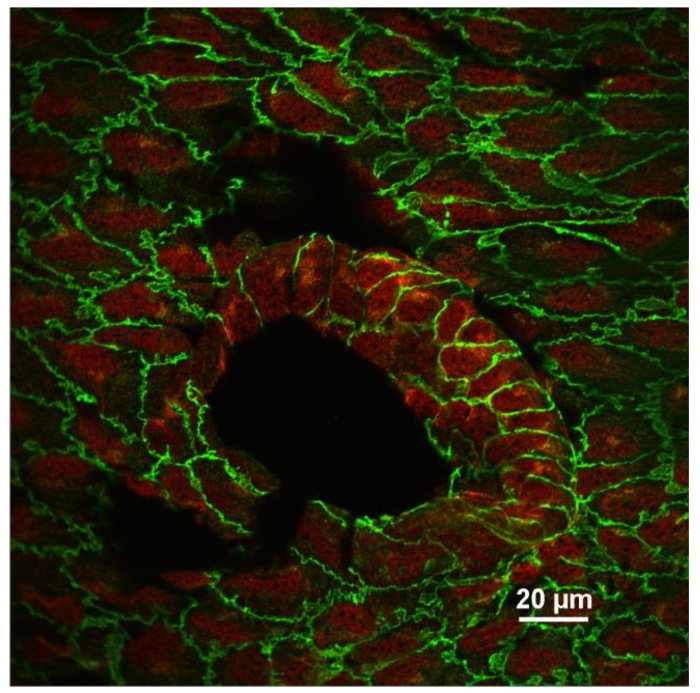
איור 3: תמונה פנים En של אנדותלם מוכתם אנטי VE-Cadherin (ירוק) ו נגד VCAM-1 (אדום). קטע אופקי יחיד confocal של תאים אנדותל ליד פתח intercostal הואמוצג. שים לב כי ביטוי VCAM-1 הוא גדל בתאי האנדותל הממוקם בנקודת סניף שבו זרימת הדם היא לא למינרית. התמונה נרשמה באמצעות עדשה אובייקטיבית 60X (NA 1.4, שמן). סולם בר = 20 מיקרומטר. אנא לחץ כאן כדי להציג גרסה גדולה יותר של דמות זו.
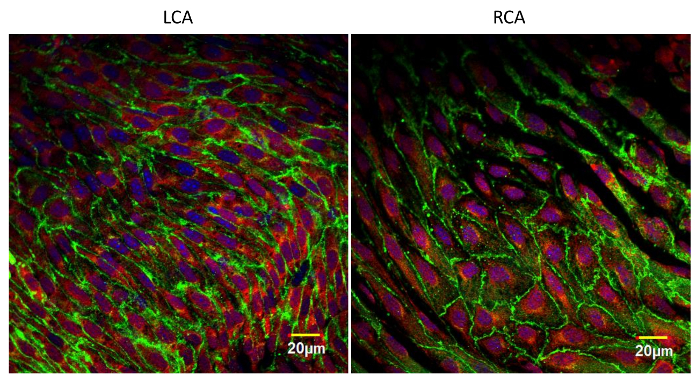
איור 4: תמונות פנים של עורקי הצוואר השמאלי והימני מוכתמים ב- Anti-VE-cadherin (ירוק), אנטי-VCAM-1 (אדום) ו- DAPI (סגול). עורק הצוואר השמאלי היה ligated חלקית ואת הצוואר הימני נותר שלם. ההכנות הללו נעשו 24 שעות לאחר הניתוח. ביטוי מוגבר של VCAM-1 בצד ligated לעומת כלי שלם שלם. דימויים אלה נלקחו ליד ההתפצלות של עורקי הצוואר על ידיבאמצעות מיקרוסקופ לייזר סריקה confocal עם 60X (NA 1.4, שמן) עדשה אובייקטיבית. סולם ברים = 20 מיקרומטר. אנא לחץ כאן כדי להציג גרסה גדולה יותר של דמות זו.
Discussion
כאשר הטיפול בכלי הדם העכבר, חשוב לזכור כי האנדותל הוא שביר וכי כל כוח מכני מוגזם יפגע בתאי אנדותל. לדוגמה, תאים אנדותל לשבור או לנתק מן הקיר כלי אם כלי הוא perfused חזק מדי, אשר יכול לקרות בקלות כאשר vasculature הוא perfused באמצעות מזרק מופעל ביד.
כדי לקבל לחץ זלוף מתמיד, אנו משתמשים במערכת זלוף הכבידה עם לחץ מים 120 ס"מ מים. נמסר כי הלחץ העורקי הממוצע של עכבר, אשר נבדל על ידי זן, נע בין 130 ל 170 ס"מ H 2 O 14 . לכן, הלחץ זלוף אנו משתמשים הוא מעט פחות מאשר לחץ העורקים נמדד. כאשר אנו זלוף קבוע עכברוש עכברוש, 90 ס"מ H 2 O הלחץ בלחץ שימש 6 .
בתאי האנדותל באתרו ניזוקים גם אם הספינה נמתח במהלך הקציר, ניקוי, פיצול אורך, immunostaining, ואת הרכבה. למעשה, נזק מכני הוא אחד הגורמים השכיחים לאבד תאים אנדותל בהכנות פנים. כלי מתיחה יכול להתרחש בכל שלב במהלך ההליך, אבל בדרך כלל, זה קורה בזמן קצירת כלי השיט. זה גם קל למתוח את הכלי בעת הסרת רקמת השומן המצורפת adventitia.
ההכנות פנים נעשים על ידי חיתוך כלי longitudinally לאורך כל אורכו. זה נעשה בדרך כלל באמצעות מספריים עיניים חדות. עם זאת, קצה מספריים עשוי להיות גדול מדי אם הקוטר הפנימי של כלי היעד הוא קטן. במקרה כזה, ניתן להשתמש סכין גילוח דק חד פעמי לחתוך. השתמשנו בטכניקה זו כדי להפוך את ההכנות הפנים של עורק mesenteric חומוס 15 .
לאחר קיבוע, ההכנות פנים הם permeabilized. בדרך כלל, PBS המכיל טריטון X-100 משמשמטרה זו, אך ניתן להשתמש ריאגנטים אחרים permeabilization כגון Tween-20, Nonidet P-40, saponin, digitonin, ו Leucomerm. באופן אידיאלי, מצב permeabilization צריך להיות מותאם בכל מעבדה. עבור אבי העורקים העורקים עורקים, אנו מתייחסים אליהם עם PBS המכיל 0.1% Triton X-100 עבור 10 דקות ב RT, ואת הטיפול הזה מספיק permeabilize כל התאים בתוך הקיר כלי. דגימות Permeabilized אז מטופלים ברצף הראשון עם נוגדן ראשוני ולאחר מכן נוגדנים משני אשר מתויג fluorescently. עבור מכתים כלי העכבר, זה קריטי כי הנוגדן העיקרי אינו נעשה בעכבר כי רקמת כלי הדם העכבר יכיל IgG העכבר אשר ייקרא על ידי fluorescently שכותרתו משני אנטי עכבר IgG, גרימת מכתים רקע גבוהה. עבור מיקרוסקופיה, הדגימה צריכה להיות שטוחה ככל האפשר. אנו לוחצים שקופיות במשך 5 דקות עם 3.5 ק"ג של משקל. משקל ספציפי זה נקבע באופן אמפירי.
Wההכנות פנים en מתויגות immunofluorescently, הם יכולים ללמוד באמצעות מיקרוסקופ epifluorescence רגילים, מיקרוסקופ לייזר סריקה confocal, ומיקרוסקופ multipope. מיקרוסקופיה confocal הוא הטוב ביותר כדי לקבל תמונות של האנדותל באזור subendothelial עד 50 מיקרומטר או כך ממשטח כלי השיט תוך חדירה עמוקה של אור עירור מושגת על ידי מצב multiphoton של תאורה מאפשר אחד לקבל תמונות להתמקד מתוך עומק עד 2 מ"מ מפני משטח כלי השיט. בנוסף, מיקרוסקופית multiphoton ניתן להשתמש הדמיה הרמונית השנייה, בדרך כלל ללמוד ארגון סיבים קולגן בקיר כלי. ההכנות פנים הם גדולים, המאפשר לנו סקר שטח כלי הדם גדול כגון אורך של אבי העורקים. אלה הם חלק מהיתרונות של שימוש immunofluorescently מוכתמים הפנים ההכנות כלי דם. יש, עם זאת, כמה disadvantages של טכניקה זו. קודם כל, השיטה מוגבלתזמינות של נוגדנים ספציפיים ועוד ריאגנטים שכותרתו fluorescently כגון phalloidin פלורסנט, DAPI, ו- DiI-Ac-LDL (ליפופרוטאין בצפיפות נמוכה Acetylated שכותרתו עם 1,1'-dioctadecyl - 3,3,3 ', 3'-tetramethyl-indocarbocyanine פרכלורט). מאז הדמיה מבוססת על פלואורסצנטי, שאינם פלורסנט חלקים של דגימות לא ניתן הדמיה. כל דגימות הר באופן כללי autofluorescence התערוכה, סיבי אלסטין נמצא כלי הדם גדולים ניאון בירוק. זה הקרינה הוא בעייתי במיוחד בעת שימוש במיקרוסקופ epifluorescence; ולכן, הדמיה על ידי מיקרוסקופ confocal מומלץ מאוד. עם זאת, הפרעה של זה autofluorescence ירוק ניתן להפחית באופן משמעותי באמצעות נוגדנים משני שכותרתו עם צבע ניאון אדום. לבסוף, מאז הפנים דגימות הם עבים, הדמיה על ידי תאורה המועבר אינו אפשרי.
מסחרי confocal ו multiphoton מיקרוסקופים לבוא עם תוכנת ניתוח תמונה כוללאחד עבור כמותי ניתוח עוצמת פלואורסצנטי של תמונות. נתונים כמותיים הם אמינים יותר אם השוואות נעשות בתוך אותה שקופית. זה כל כך כי כל התנאים immunostaining זהים עבור הדגימה. אם יש להשוות את עוצמות הכתמים בין שקפים שונים (למשל, כלי דם נורמליים לעומת חולים), הדרך היחידה לאמת את הנתונים היא להגדיל את מספר המדגם כך שניתן יהיה למצות את השונות הטכנית והביולוגית. באופן כללי, מדידות העוצמה על תמונות confocal המתקבל ליד פני כלי השיט הם אמינים יותר. עוצמות פלורסנט של תמונות המתקבל אזורים עמוקים יותר של רקמות נוטים להיות משתנים יותר בשל מעלות שונות של פיזור וקליטה של שניהם עירור ונפלטים פלורסנט. באופן כללי, יש להיזהר בפירוש הבדלים בעוצמה מתוחכמים שזוהו באזורים עמוקים של דגימות. כדי לשפר את יכולת ההדמיה מאזורים עמוקים יותר של רקמות, נעשים ניסיונות לעשות tנושאים שקופים, וכמה תמונות מרשימות הושגו (למשל, ראה מאמר שפורסם לאחרונה על ידי נקל ואח '16 וניירות שצוטטו על ידי מחברים אלה). למרות שזה אפשרי כי טיפולים המשמשים להפוך רקמות שקוף עשוי לחלץ אנטיגנים מסוימים ו / או להכחיש epitopes מסוימים, שיטה זו עשויה לשמש כדי לקבל יותר אותות ניאון לשחזור מאזורים עמוקים יותר של רקמות.
השימוש בהכנות פנים אינו מוגבל הדמיה על ידי מיקרוסקופ פלואורסצנטי. באמצעות מיקרוסקופ סטריאו, ההכנות כלי הפנים ניתן להשתמש כדי ללמוד את היקף היווצרות רובד טרשת עורקים לאחר מכתים אותם עם שמן אדום O. ההכנות כלי פנים en יכול להיעשות aseptically. תכשירים כאלה יכולים להישמר בתרבות עשוי לשמש מערכת vivo לשעבר ללמוד אינטראקציה תא אנדותל ליקוציט.
Disclosures
אף אחד
Acknowledgements
פעילות המחקר של המחברים נתמכים על ידי מענקים מהמכון הלאומי לבריאות לד"ר אייב (HL-130193, HL-123346, HL-118462, HL-108551).
Materials
| Name | Company | Catalog Number | Comments |
| 0.9% Sodium Chloride injection solution USP 500ml bag | Fisher Scientific | NC9788429 | |
| 12-well plates | Fisher Scientific | 12556005 | |
| 6-0 coated vicryl suture | Ethicon | J833G | |
| AF488 goat anti-rat IgG | Life Technologies | A11006 | |
| AF546 goat anti-rabbit IgG | Life Technologies | A11035 | |
| Anti-CD144 (Ve-Cad) | BD Biosciences | BD555289 | |
| Anti-VCAM-1 (H-276) Rabbit polyclonal IgG | Santa Cruze Biotechnology | Sc-8304 | |
| Aoto Flow System | Braintree Scientific | EZ-AF9000 | |
| Autoclave Wrap. 24x24in | Cardinal Health | 4024 | |
| Blunt retractors, 2.5mm wide | Fine Science Tools | 18200-10 | |
| Caprofen (Rimadyl) | zoetis | NADA#141-199 | |
| Chlorhexidine Scrub, 2% | Med-Vet International | RXCHLOR2-PC | |
| Curity gauze sponges 2x2 | Cardinal Health | KC2146 | |
| Electric heating pad, 12X14 | Fisher Scientific | NC0667724 | |
| Extra Fine Graefe Forceps | Fine Science Tools | 11152-10 | |
| Iris Scissors | Fine Science Tools | 14090-11 | |
| Micro cover glass 22x50mm | VWR | 48393059 | |
| Microscope Slides | Fisher Scientific | 12-550-18 | |
| normal goat serum | Equitech-Bio | GS05 | |
| Paraformaldehyde Solution 4% in PBS | Santa Cruze Biotechnology | SC-281692 | |
| Petri Dishes 100x15mm | Fisher Scientific | FB0875713 | |
| Prolong Gold Antifade mountant with DAPI | Life Technologies | P-36935 | |
| Puritan cortton swabs | VWR | 10806-005 | |
| Puritan Mini cotton tipped aplicators | VWR | 82004-050 | |
| Round handled Needle Holder | Fine Science Tools | 12076-12 | |
| Silk Suture 6/0 | Fine Science Tools | 18020-60 | |
| Spring scissors | ROBOZ | RS-5601 | |
| Strabismus Scissors | Fine Science Tools | 14075-09 | |
| Super Grip Forceps | Fine Science Tools | 00649-11 | |
| Transparent Dressing | Cardinal Health | TD-26C | |
| Triton X-1000 | Fisher Scientific | AC327371000 |
References
- Jelev, L., Surchev, L. A novel simple technique for en face endothelial observations using water-soluble media -'thinned-wall' preparations. J Anat. 212 (2), 192-197 (2008).
- Neill, J. F. The effect on venous endothelium of alterations in blood flow through the vessels in vein walls, and the possible relation to thrombosis. Ann Surg. 126 (3), 270-288 (1947).
- Rogers, K. A., Kalnins, V. I. A method for examining the endothelial cytoskeleton in situ using immunofluorescence. J Histochem Cytochem. 11 (11), 1317-1320 (1983).
- Poole, J. C. F., Sanders, A. G., Florey, H. W. The regeneration of aortic endothelium. J Pathol Bacteriol. 75, 133-143 (1958).
- Sade, R. M., Folkman, J. En face stripping of vascular endothelium. Microvasc Res. 4, 77-80 (1972).
- White, G. E., Gimbrone, M. A., Fujiwara, K. Factors influencing the expression of stress fibers in vascular endothelial cells in situ. J Cell Biol. 97 (2), 416-424 (1983).
- Kim, D. W., Gotlieb, A. I., Langille, B. L. In vivo modulation of endothelial F-actin microfilaments by experimental alterations in shear stress. Arteriosclero. 9, 439-445 (1989).
- Haka, A., Potteaux, S., Fraser, H., Randolph, G., Maxfield, F. Quantitative analysis of monocyte subpopulations in murine atherosclerotic plaques by multiphoton microscopy. Plos ONE. 7 (9), 244823e (2012).
- Chèvre, R., et al. High-Resolution imaging of intravascular atherogenic inflammation in live mice. Circ Res. 114, 770-779 (2014).
- Heo, K. -. S., et al. Disturbed flow-activated p90RSK kinase accelerates atherosclerosis by inhibiting SENP2 function. J Clin Invest. 125 (3), 1299-1310 (2015).
- Le, N. -. T., et al. A crucial role for p90RSK-mediated reduction of ERK5 transcriptional activity in endothelial dysfunction and atherosclerosis. Circ. 127, 486-499 (2013).
- Kano, Y., Katoh, K., Masuda, M., Fujiwara, K. Macromolecular composition of stress fiber-plasma membrane attachment sites in endothelial cells in situ. Circ Res. 79, 1000-1006 (1996).
- Nigro, P., et al. Cyclophilin A is an inflammatory mediator that promotes atherosclerosis in apolipoprotein E-dependent mice. J Exp Med. 208 (1), 53-66 (2011).
- Mattson, D. L. Comparison of arterial blood pressure in different strains of mice. Am J Hypertens. 14 (5), 405-408 (2001).
- Jinguji, Y., Fujiwara, K. Stress fiber dependent axial organization of fibronectin fibrils in the basal lamina of the chick and mesenteric artery. Endothelium. 2, 35-47 (1994).
- Neckel, P. H., Mattheus, U., Hirt, B., Lust, L., Mack, A. F. Large-scale tissue clearing (PACT): Technical evaluations and new perspectives in immunofluorescence, histology, and ultrastructure. Sci Rep. 6, 34331 (2016).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved