Method Article
في إعداد الوجه من ماوس سفن الدم
In This Article
Summary
ويرد وصف لإجراء صنع الاستعدادات وجهه من الشريان السباتي الماوس والشريان الأبهر. هذه الاستعدادات، عندما ملطخة إمونوفلورزنتلي مع الأجسام المضادة محددة، تمكننا من دراسة توطين البروتينات وتحديد أنواع الخلايا داخل جدار الأوعية الدموية بأكمله من قبل المجهر متحد البؤر.
Abstract
يتم استخدام أجزاء من الأنسجة جزءا لا يتجزأ من البارافين بشكل روتيني لدراسة الأنسجة الأنسجة والتشريح المرضي. ومع ذلك، فإنه من الصعب تحديد ما هو مورفولوجيا الأنسجة ثلاثية الأبعاد من هذه المقاطع. وبالإضافة إلى ذلك، فإن أقسام الأنسجة فحصها قد لا تحتوي على المنطقة داخل الأنسجة اللازمة لغرض الدراسة الجارية. هذا الحد الأخير يعوق الدراسات النسيجية للأوعية الدموية منذ الآفات الوعائية تتطور بطريقة محورية. وهذا يتطلب طريقة تمكننا من مسح مساحة واسعة من جدار الأوعية الدموية، من سطحه إلى مناطق أعمق. كامل جبل إن وجه إعداد الأوعية الدموية يستوفي هذا الشرط. في هذه المقالة، ونحن سوف تثبت كيفية جعل الاستعدادات وجهه من الشريان الأورطي الماوس والشريان السباتي و إمونوفلورزنتلي وصمة عار لهم للمجهر متحد البؤر وأنواع أخرى من التصوير القائم على مضان.
Introduction
للدراسات النسيجية بواسطة المجهر الضوئي، يتم معالجة قطع ثلاثية الأبعاد من الأنسجة البيولوجية بشكل روتيني لتضمين البارافين تليها باجتزاء وتلطيخ. عينة الأنسجة التي تم البارافين جزءا لا يتجزأ قد تكون عدة مليمترات في جميع الأبعاد الثلاثة. ومع ذلك، لغرض المجهر الضوئي، يجب أن يكون مقطوع أولا بحيث الضوء يمكن أن تمر ومن ثم ملطخة بحيث قسم رقيقة ينتج تباين كاف للتصوير. لأن العينات المقسمة عادة ما تكون 5-10 ميكرون في سمك، واحد يرى سوى جزء صغير جدا من العينة بأكملها في بعدين في وقت واحد. فمن الممكن لجمع المقاطع متتابعة، وبعد التصوير كل قسم على حدة، إجراء إعادة بناء بمساعدة الكمبيوتر من الصور 3D، ولكن هذا هو عمل شاق في الواقع. التشريح المرضي للأوعية الدموية، وخاصة لدراسة التسبب في تصلب الشرايين، ويعرض مشاكل فريدة من نوعها. تصلب الشرايين هو مرض متطور يتطورمحليا في المناطق التي يحدث فيها تدفق الدم المضطرب. وعلاوة على ذلك، يبدأ المرض داخل البطانة، وهو نسيج رقيق يتكون من أحادي الطبقة من الخلايا البطانية والمصفوفة خارج الخلية، من الشرايين الكبيرة. لهذه الأسباب، فإنه من الصعب تحديد ودراسة الآفات المبكرة باستخدام الأوعية الدموية مقطوع لأنه يمكن للمرء أن يغيب بسهولة باجتزاء الآفة. حتى إذا كان القسم لا يشمل منطقة مريضة، واحد سوف نرى فقط 5-10 ميكرون جزء يحتوي على الخلايا البطانية وغيرها من خلايا جدار الأوعية الدموية في وسائل الإعلام والدفنتية.
كل جبل إن وجه (وضوحا än فاس) الاستعدادات تسمح لنا لمسح مساحة واسعة من سطح الأوعية الدموية مثل الشريان الأورطي بأكمله من الجذر الأبهر على طول الطريق وصولا الى الشرايين الحرقفية المشتركة. باستخدام مثل هذه العينة ملطخة الأجسام المضادة محددة وتحقيقات محددة أخرى، يمكن للمرء تحديد موقع الآفات وأيضا حيث تحدث الأحداث الجزيئية المختلفة في الخلايا البطانية بالتزامن وايالتصلب العضلي مثل التغيرات في التعبير، والتعريب، والتعديلات بوستترانزلاتيونال من البروتينات. بالإضافة إلى دراسة تصلب الشرايين، يتم استخدام شكل الخلايا البطانية لوحظ في الاستعدادات وجه إن كمؤشر على نمط تدفق الدم في المتوسط الوقت الإقليمي. هذه البيانات مهمة لدراسة ميكانوسينالينغ من الخلايا البطانية في الموقع. لهذا الغرض، الروتينية الأنسجة المقطعية الأوعية الدموية المقطعية ليست مفيدة. وهكذا، بالنسبة لطب الأوعية الدموية وعلم الأحياء، فمن المهم بشكل خاص للحصول على تقنية لصنع إن وجه استعدادات الأوعية الدموية التي تسمح للمرء أن نلاحظ مساحة واسعة من سطح السفينة وكذلك المناطق تحت السطحية أعمق من السفينة.
كما استعرضها جيليف وسورشيف 1 ، وقد وضعت علماء الأحياء الأوعية الدموية أساليب مختلفة لمراقبة بطانة الأوعية الدموية في وجهه. وقد وضعت بعض الأساليب بارعة في 1940 و 1950. باستخدام هذه الأساليب، كانت قادرة على دراسة التنظيم الأساسي للخلايا البطانية التي خط السطح الداخلي للأوعية الدموية. ومع ذلك، بسبب الطريقة التي تواجهها هذه المستحضرات التحضيرية (ما يسمى طريقة هوتشن 2 ، 3 ، 4 أو تقشير قبالة سطح السفينة 5 ) والطريقة التي تلطخ العينة، لم يكن من الممكن دائما للحصول على المورفولوجية دون انقطاع المعلومات من سطح السفينة إلى المناطق الأعمق من جدار الأوعية الدموية. كله جبل أون وجه إعداد وعاء جنبا إلى جنب مع تلطيخ المناعي سمح لنا ليس فقط دراسة مورفولوجيا الخلايا البطانية والتعبير البروتين وتوطين في هذه الخلايا، ولكن أيضا لتوسيع هذه الدراسات إلى المنطقة تحت البطانية من جدار الوعاء الدموي. الدراسات المبكرة باستخدام الأوعية الدموية أر تواجه الاستعدادات الملون إمونوفلوريسنتلي بدأت تظهر في عام 1980 6 ،f "> 7. مع ظهور المسح بالليزر المجهر متحد البؤر ومؤخرا المجهر مولتيبوتون، يمكن للمرء الآن الحصول على صور واضحة في التركيز من هيكل جدار الأوعية الدموية في عينات من عينات ملون إونوفلورزنتلي في وعاء وكذلك شبكة الأوعية الدموية في الحيوانات الحية 8 ، 9 ، 10 ، 11. هذه تقنيات التصوير القائم على الكمبيوتر تخلق في التركيز الصور المقسمة البصرية، ومن خلال التراص مثل هذه الصور، يمكن للمرء الحصول على صور 3D أعيد بناؤها من جدار الوعاء الدموي وشبكة الأوعية الدموية في الأنسجة، يمكن أن تولد صورا لقسم المحرز على طول المحور Z للصورة أعيد بناؤها 12 ، 13 .
في هذه المقالة، ونحن سوف توضيح طريقة لإعداد إن وجه الاستعدادات من الشريان الأورطي الماوس والشريان السباتي لتلطيخ إمونوفلورسنت. إن وجه الاستعداداتيمكن أن يتم حتى بعد أن تم التلاعب هذه السفن تجريبيا. على سبيل المثال، يمكن أن يكون الشريان السباتي ليغاتد جزئيا ثم إعداد وجه إن بعد هذه الجراحة. لهذا السبب، ونحن سوف تصف أيضا في هذه المقالة كيف نفعل ربط جزئي على الشريان السباتي. وبالمقارنة مع الاستعدادات المماثلة من الحيوانات الكبيرة مثل الفئران والأرانب والبشر، فإن سفن الفأر صغيرة الحجم وأكثر هشاشة، مما يتطلب مزيدا من الرعاية للمناولة أثناء العزلة الجراحية للسفن وإعدادها لتلطيخ الأجسام المضادة والمجهر. لأن النموذج الحيوان الأكثر استخداما لتعديل وراثي هو الماوس، يصبح من الأهمية بمكان للعديد من المحققين للتعامل مع الأوعية الماوس دون الإضرار بها. في هذه المخطوطة، ونحن سوف تصف كيفية التعامل مع الأوعية الدموية الماوس عند صنع الاستعدادات وجهه من الشريان الأورطي الماوس والشريان السباتي. لغرض مظاهرة، سوف نستخدم البرية نوع C57 / B6 الفئران.
Protocol
تمت الموافقة على البروتوكولات للفأر ربط الشريان السباتي الجزئي والعزل من الشريان الأورطي الماوس والشريان السباتي ل إن مواجهة إمونوستينينغ من قبل اللجنة المؤسسية رعاية الحيوان واستخدام (إبت 2014-9231).
1. اليسار الأيسر الشريان السباتي ربط
- إعداد الفضاء الجراحي عن طريق وضع 12 بوصة × 14 بوصة وسادة التدفئة على الطاولة وتغطية لوحة وطاولة الجدول مع ثنى الجراحية نظيفة كبيرة. ضبط الذراع من موقف الطفرة بحيث مجال الرؤية ستيريوميكروسكوب في منطقة وسط لوحة التدفئة.
- قم بتشغيل وسادة التسخين على الطاولة وقم بتعيين قرص التحكم ذو 3 أوضاع على مستوى الحرارة المتوسط. في هذا الإعداد درجة الحرارة، سطح المجلس الجراحي (انظر 1.6.1) سيكون 38-40 درجة مئوية.
- وضع قفص نظيفة على وسادة التدفئة أخرى. بدوره وسادة التدفئة على النحو الوارد أعلاه. سيتم استخدام هذا القفص للشفاء بعد الجراحة (انظر 1.16) وكذلك السكن.
- على الطاولة الجراحية، ضع الحقيبة التعقيم تعقيمها التي تحتوي على مقص القزحية (1 زوج)، ملقط الأنسجة (1 زوج)، ملقط السوبر قبضة (2 أزواج)، مقص الربيع (1 زوج)، ضام حادة (1 زوج؛ 2.5 مم واسعة) ، جولة التعامل مع حامل إبرة (1)، تعقيم 6-0 خياطة الحرير، القطن يميل تطبيقها، مصغرة القطن يميل قضيب، الستائر الجراحية، و 2 "x 2" الإسفنج الشاش. أيضا وضع زجاجة الضغط تحتوي على 70٪ من الإيثانول وآخر يحتوي على كلوروهيكسيدين الجراحية سركبون الجدول الجراحي.
- تزن الماوس. هناك حاجة إلى وزن الجسم لتحديد كمية مناسبة من تسكين، والتي سوف تدار على الفور قبل الجراحة.
- ضع الماوس في غرفة الاستقراء.
- بدوره على خزان الأكسجين والمذاذ مخدر من أجل تخدير الماوس في غرفة الاستقراء. الحفاظ على مستوى الأيزوفلورين في 2٪. يستغرق 3-5 دقائق قبل توقف الماوس تتحرك.
- في حين أن الماوس يجري أنسثتيزد، وضع قطعة أصغر من ثنى الجراحية العقيمة (24 بوصة × 24 بوصة) تحت ستيريوميكروسكوب لخلق سطح الجراحية. ثم ضع لوحة الجراحية الاكريليك (التي تم تنظيفها مع الكحول 70٪) على سطح رايات. ولذلك ينبغي أن يكون المجلس الجراحي على وسادة التدفئة ولكن مفصولة طبقتين من الستائر الجراحية.
- عندما يتوقف الماوس تتحرك في غرفة الاستقراء، ونقل الماوس إلى منطقة إعداد ما قبل الجراحية وموقف أنفه في مخروط الأنف متصلا المرذاذ (2٪ إيسوفلوران). إزالة الشعر حول منطقة عنق الرحم باستخدام الانتهازي الكهربائية أو الشعر مزيل محلول. نوصي إزالة الشعر محلول لأن هذه الطريقة لن تنتج فضفاضة قطع الشعر، والتي يصعب إزالة تماما من منطقة الجراحية.
- مع مخروط الأنف في مكان، حرك الماوس إلى لوحة الجراحية.
- الشريط أسفل اليمين واليسار الصدارة الكفوف إلى لوحة الجراحية. شريط أسفل كل من الساقين الخلفيةثير على الجانب الأيمن من الماوس. وهذا يسبب دوران طفيف من الجسم الفأر بحيث يصبح الجانب الأيسر من منطقة الرقبة من الماوس أفضل وضع لعملية جراحية.
- تطهير منطقة شق مع الكحول 70٪، الكلورهيكسيدين فرك الجراحية، ومرة أخرى مع الكحول 70٪. تغطية الماوس مع ثنى الجراحية معقمة باستثناء منطقة شق عنق الرحم.
- تأكيد أخمص القدمين قرصة أن الماوس هو تخدير كامل ويعطي تسكين (كابروفين 3-5 ملغ / كلغ) عن طريق الحقن داخل الصفاق أو تحت الجلد.
- تحت المجهر تشريح، وجعل شق خط الوسط بطني حول منطقة عنق الرحم باستخدام إما مشرط أو مقص القزحية.
ملاحظة: نحن نستخدم مقص لأن مسافة العمل من ستيريوميكروسكوب محدودة، مما يجعل من الصعب استخدام مشرط. - كشف الشريان السباتي المشترك الأيسر (لسا) عن طريق دفع جانبا وإعادة وضع الغدد اللعابية التي تغطي الأوعية الدموية إلى الجانب الأيسر مننيمال.
- تحديد جميع الأوعية الدموية في مجال العمليات الجراحية ( الشكل 1 ). لسا تشعب في الشريان السباتي الداخلي الأيسر (إيكا) والشريان السباتي الخارجي الأيسر (إيكا). الشريان الدرقي السطحي (ستا) ينشأ من اللجنة الاقتصادية لأفريقيا على الجانب الإنسي. الشريان القذالي (أوا) عادة ما تنشأ من اللجنة الاقتصادية لأفريقيا، ولكن في بعض الفئران أنه ينشأ من إيكا.
- ليغات جميع فروع الشريان باستثناء أوا باستخدام تعقيم 6-0 خياطة الحرير. لتحقيق ذلك، وجعل ربط اثنين التالية.
- إزالة بلطف النسيج الضام حول وتحت الشريان السباتي الداخلي الأيسر (إيكا). الاستيلاء على قطعة من قبل خياطة 6-0 الحرير (~ 2.5 سم) مع ملقط وتمريره تحت الشريان. باستخدام زوج آخر من ملقط، وسحب خياطة تقريبا 1/3 من طوله ويغات الشريان.
- إزالة النسيج الضام حول الشريان السباتي الخارجي الأيسر (إيكا) في نفس الطريقة المذكورة أعلاه وجعل ربط القريبة إلى الأيسر متفوقة الدرقيد الشريان (ستا) ( الشكل 1 ). يجب الحرص على عدم تلف الألياف العصبية التي تعمل داخل المجال الجراحي.
- عندما تم إجراء هذه عمليات الربط، والعودة الغدد اللعابية إلى الوضع الأصلي وهيدرات الحقل الجراحي عن طريق وضع 2-3 قطرات من محلول ملحي معقم. إغلاق الجلد باستخدام خيوط المغلفة فيكريل 6-0.
- بعد الجراحة، ضع الماوس في قفص ما قبل تحسنت (انظر 1.2.1). الماوس يجب أن يستيقظ في غضون 5 دقائق والبدء في التجول. وأكد مرة واحدة أن الماوس يتصرف بشكل طبيعي، وجلب القفص إلى غرفة السكن الحيوان.
- مراقبة الماوس يوميا لمدة 3 أيام الأولى من الانتعاش. الماوس يمكن أن تبقى طالما تتطلب التجربة في ظل مختلف الظروف التي يدعو البروتوكول التجريبي ل. إن وجه الاستعدادات يمكن أن يتم في أي وقت بعد الجراحة.
2. إن الوجه إمونوستينينغ
- الموت ببطء الماوس مع كو 2 عن طريق الاستنشاق جرعة زائدة.
- شريط الماوس في مستلق (الجانب البطن حتى) موقف على لوحة تشريح.
- فضح تجويف البطن عن طريق إجراء شق خط الوسط باستخدام مقص القزحية.
- فضح تجويف الصدري عن طريق قطع الأضلاع أفقيا إلى القص.
- جعل نيك في الوريد الأجوف أو قطع واحدة من الشرايين الفخذية لاستنزاف الدم.
- إدراج إبرة 26 G تعلق على الإعداد نضح الجاذبية (120 سم ضغط المياه) في قمة البطين الأيسر وإرواء الدورة الدموية مع محلول ملحي يحتوي على الهيبارين (40 U / مل). مواصلة نضح حتى يصبح المالحة المتدفقة من قطع يصبح واضحا.
- تبديل نظام نضح من المياه المالحة إلى حل التثبيت تحتوي على بارافورمالدهيد 4٪ في برنامج تلفزيوني (الفوسفات مخزنة المالحة)، ومواصلة بيرفوسينغ لمدة 5 دقائق أكثر.
- حصاد الشريان الأورطي وكل من الشرايين السباتية اليسار واليمين باستخدام مقص نهاية حادة والملقط، ومكان في أنبوب مخروطي 50 مل تحتوي على تثبيتي على الجليد.
- نقل السفينة إلى طبق بتري تحتوي على برنامج تلفزيوني تحت المجهر تشريح، وإزالة بعناية الدهون والأنسجة الضامة تعلق على الشريان الأورطي والشريان السباتي. فصل وتقسيم الشريان الأورطي والشريان السباتي طوليا لفضح البطانة ( الشكل 2 ).
- نقل كل سفينة بشكل منفصل إلى بئر من لوحة 12 جيدا تحتوي على 0.5 مل من محلول بيرمابيليزينغ (0.1٪ تريتون X-100 في برنامج تلفزيوني) لكل بئر. بيرمابيليز الأوعية الدموية لمدة 10 دقيقة مع هزاز في درجة حرارة الغرفة (رت).
- يغسل لفترة وجيزة مع برنامج تلفزيوني.
- لمنع المواقع غير محددة الأجسام المضادة ملزمة، احتضان الأوعية الدموية في مصل طبيعي 10٪ من الأنواع الحيوانية التي تم إجراء الأجسام المضادة الثانوية، في تبس (تريس مخزنة المالحة (تبس) مع 2.5٪ توين 20) لمدة 30 دقيقة مع هزاز في رت.
- احتضان السفن مع الأجسام المضادة الأولية المخفف بشكل مناسب في تبس مع 10٪ مصل طبيعي (كما هو موضح أعلاه) بين عشية وضحاها مع هزاز في 4 درجات مئوية. المستوىمن التخفيف يجب أن تحدد لكل الأجسام المضادة.
- إجراء تلطيخ التحكم التالية.
- احتضان السفن مع تبس بدلا من الأجسام المضادة الأولية تليها الحضانة مع الأجسام المضادة الثانوية.
- احتضان السفن مع تبس التي تحتوي على غير المناعة (أو قبل المناعة) المصل أو إيغ من نفس الحيوان (الأنواع) التي تم إجراء الأجسام المضادة الأولية، تليها الحضانة مع الأجسام المضادة الثانوية.
- حذف الحضانة مع الأجسام المضادة الثانوية. يجب التعامل مع هذه العينات السيطرة بنفس الطريقة، وفي الوقت نفسه عندما يتم تنفيذ تلطيخ مع الأجسام المضادة المحددة.
- غسل الأوعية الدموية 3 مرات مع تبس لمدة 10 دقيقة مع كل هزاز في رت.
- احتضان مع فلورزنتلي المسمى الأجسام المضادة الثانوية المخفف بشكل مناسب في تبس مع 10٪ مصل طبيعي (كما هو موضح أعلاه) لمدة 1 ساعة مع هزاز في رت. تلطيخ النووي مع دابي (4 '، 6-دياميدينو-2-فينيليندول) يمكن إجراء في وقت واحدt هذه المرحلة عن طريق إضافة 1 / 5،000 من حجم وحدة التخزين دابي الحل الذي يحتوي على 5 ملغ / مل من دابي في H 2 O.
- يغسل 3 مرات مع تبس لمدة 10 دقيقة مع كل هزاز في رت.
- شطف لفترة وجيزة في برنامج تلفزيوني.
- وضع قطرة واحدة من كاشف المضادة للتلاشى على غطاء الزجاج (22 مم × 50 مم) ووضع الأوعية الدموية على الزجاج غطاء مع بطانة الأوعية الدموية لأسفل.
- وضع زجاج الشريحة (22 مم × 75 ملم) على الأوعية الدموية مع تجنب فقاعات محاصرة.
- وضع الشريحة على مسح مختبر نظيفة ( مثل كيمويب) وتغطية الشريحة مع قطعتين من مختبر مسح. ضع بلطف 3.5 كجم من الوزن (على سبيل المثال استخدام زجاجة من الماء على كتاب سميك.) على الشريحة لمدة أقصاها 5 دقائق لتسطيح عينة وجه الأوعية الدموية إن.
- إزالة الوزن ومسح الحل الزائد من جميع أنحاء ساترة.
- تطبيق طلاء الأظافر في زوايا 4 ساترة، ووضع الشرائح في مربع الشريحة، ساترة الجانب حتى، والحفاظ في الظلام في رت(أو 4 درجات مئوية) بين عشية وضحاها. هذه العملية تتسطح الأنسجة أكثر ويجعل من الأسهل للقيام المجهري في تكبير عالية.
- ختم ساترة تماما باستخدام طلاء الأظافر.
- أداء المجهري بمجرد طلاء الأظافر جافة.
- إذا لزم الأمر، وتخزين الشرائح في -20 درجة مئوية.
النتائج
ويظهر نموذجي أر وجه المناعي من البطانة في الشكل 3 . تظهر هذه الصورة مقطع بصري واحد من الشريان الأورطي الماوس اتخذت قرب افتتاح الشريان الوربي (منطقة كبيرة على شكل بيضة مظلمة). كان الشريان الأبهر ملطخة المزدوج مع مكافحة في كادهيرين (الأخضر) ومكافحة فكام-1 (الأوعية الدموية التصاق الخلية جزيء -1) (الأحمر). يتم تحديد كل خلية بطانية مع تلطيخ الخطي الأخضر في تقاطع أستيرنز. بسبب تفاوت طفيف في العينة، وبعض الملتصقات تقاطعات هي خارج هذا القسم البصري. مكافحة فكام-1 تلطيخ أقوى في افتتاح الشريان الوربي حيث من المعروف ان تدفق الدم المضطرب أن يحدث. ويبين الشكل 4 إن تلطيخ الوجه من الشرايين السباتية مع مكافحة في كادهيرين (الأخضر)، ومكافحة فكام-1 (الأحمر)، و دابي (الأرجواني). كان الشريان السباتي الأيسر (لكا) ليغاتد جزئيا بينما كان الشريان السباتي الأيمن (رسيا) لم يمسها. تم إجراء عينات السفينة بعد يوم واحد من الجراحة والملطخة. لاحظ زيادة تلطيخ مكافحة فكام-1 في السفينة ليغاتد. العينات الملون إمونوفلورزنتلي مع الأجسام المضادة المختلفة يمكن استخدامها للتحقيق في مستوى التعبير عن البروتينات من الفائدة، ومدى التعديلات بوستترانزلاتيونال من البروتينات المستهدفة، وبالطبع، ونمط توطين البروتينات المختلفة داخل الخلايا البطانية وكذلك في خلايا أخرى داخل جدار الوعاء الدموي 10 ، 11 .
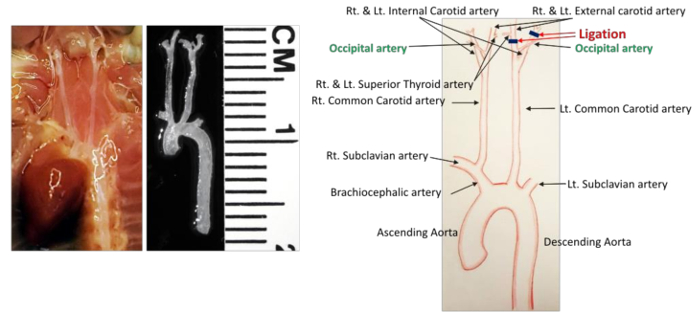
الشكل 1 : مفصل سفينة التشريح في منطقة عنق الرحم الماوس. تظهر شبكة الأوعية الدموية قبل وبعد تشريح على اليسار. يتم تحديد جميع الشرايين في الرسم البياني هو مبين على اليمين. خطوط سوداء تشير ربط. مقياس: 1 ديفيسيون = 1 مم._blank "> الرجاء انقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 2: رسم تخطيطي يوضح كيفية صنع الشرايين السباتية والشريان الأورطي في الاستعدادات الوجه . وتشير الخطوط المنقوطة على طول جدار الوعاء إلى تخفيضات ينبغي فتحها. وتظهر الميكروسكوب الملونة استعدادات الوجه الفعلي. مقياس: 1 ديفيسيون = 1 مم. الرجاء انقر هنا لعرض نسخة أكبر من هذا الرقم.
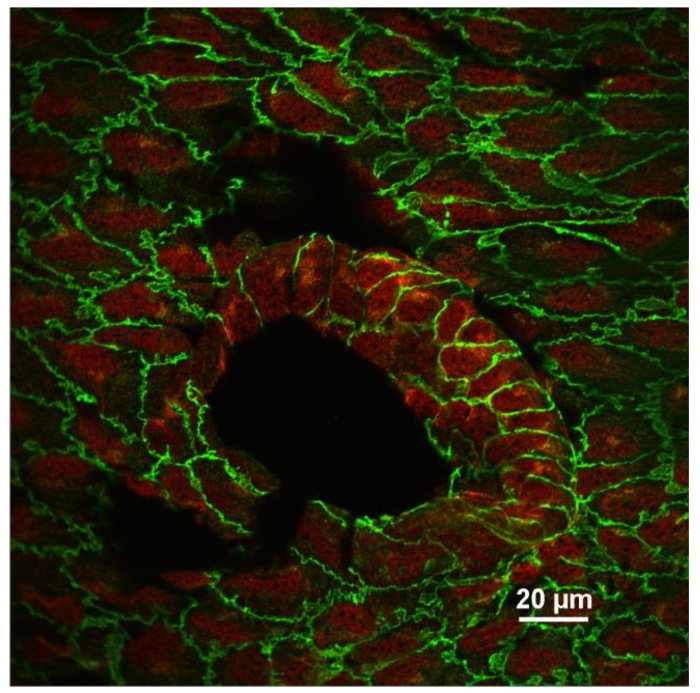
الشكل 3: في وجهه صورة من البطانة الملطخة مع مكافحة في كادهيرين (الأخضر) ومكافحة فكام-1 (الأحمر). مقطع بصري واحد متحد البؤر من الخلايا البطانية بالقرب من افتتاح وربي هومبين. لاحظ أن التعبير فكام-1 يزداد في الخلايا البطانية الموجودة في نقطة فرع السفينة حيث تدفق الدم غير الصفحي. تم تسجيل الصورة باستخدام عدسة الهدف 60X (نا 1.4، النفط). شريط مقياس = 20 ميكرون. الرجاء انقر هنا لعرض نسخة أكبر من هذا الرقم.
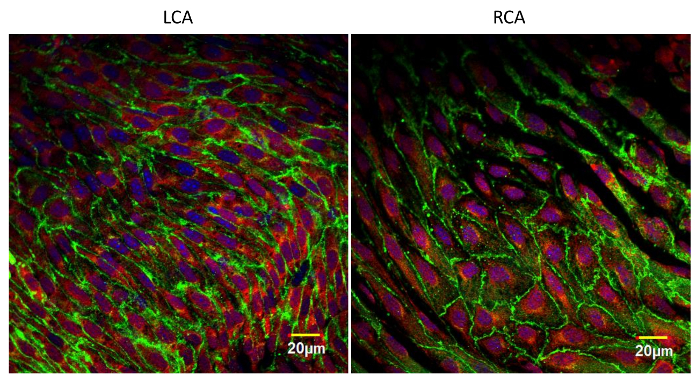
الشكل 4: في وجه صور من الشرايين السباتية اليسار واليمين ملطخة مكافحة في كادهيرين (الأخضر)، ومكافحة فكام-1 (الأحمر)، و دابي (الأرجواني). كان الشريان السباتي الأيسر ليغاتد جزئيا وترك السباتي الأيمن سليمة. وقد أجريت هذه المستحضرات بعد 24 ساعة من الجراحة. زيادة التعبير عن فكام-1 على الجانب ليغاتد مقارنة مع سفينة سليمة هو واضح. أخذت هذه الصور بالقرب من التشعب من الشرايين السباتية المشتركة من قبلوذلك باستخدام ليزر المسح المجهر متحد البؤر مع 60X (نا 1.4، النفط) عدسة موضوعية. الحانات مقياس = 20 ميكرون. الرجاء انقر هنا لعرض نسخة أكبر من هذا الرقم.
Discussion
عند التعامل مع الأوعية الدموية الماوس، من المهم أن نتذكر أن البطانة الهشة وأن أي قوة ميكانيكية مفرطة سوف تلحق الضرر الخلايا البطانية. على سبيل المثال، الخلايا البطانية كسر أو فصل من جدار الوعاء الدموي إذا كان بيرفوسد السفينة بشكل قوي جدا، والتي يمكن أن يحدث بسهولة عندما بيرفوسد الأوعية الدموية باستخدام حقنة تعمل باليد.
للحصول على ضغط نضح المستمر، نستخدم نظام نضح الجاذبية مع ضغط عمود المياه 120 سم. وقد أفيد أن متوسط الضغط الشرياني للفأر، والذي يختلف من سلالة، ويتراوح بين 130 و 170 سم H 2 O 14 . وبالتالي، فإن ضغط نضح نستخدمه هو أقل قليلا من الضغط الشرياني قياسها. عندما كنا نضح الأبهر الجرذان ثابت، تم استخدام 90 سم H 2 O ضغط العمود 6 .
كما تتلف الخلايا البطانية في الموقع إذا تم تمدد الوعاء أثناء الحصاد، والتنظيف، وتقسيم طولي، المناعية، وتصاعد. في الواقع، الأضرار الميكانيكية هي واحدة من الأسباب الشائعة لفقدان الخلايا البطانية في الاستعدادات وجهه. يمكن أن تمتد السفينة تحدث في أي خطوة أثناء الإجراء، ولكن الأكثر شيوعا، فإنه يحدث في وقت حصاد السفينة. كما أنه من السهل أن تمتد السفينة عند إزالة الأنسجة الدهنية تعلق على البرانية.
إن الاستعدادات وجه مصنوعة عن طريق قطع سفينة طوليا على طول كامل. ويتم ذلك عادة باستخدام مقص العيون الحادة. ومع ذلك، فإن غيض من مقص قد تكون كبيرة جدا إذا كان القطر الداخلي للسفينة الهدف صغير. في مثل هذه الحالة، يمكن للمرء أن تستخدم شفرة حلاقة رقيقة المتاح كسر لجعل قطع. لقد استخدمنا هذه التقنية لجعل إن وجه الاستعدادات من الفرخ الشريان المساريقي 15 .
بعد التثبيت، إن وجه الاستعدادات بيرمابيليزد. عادة، يستخدم برنامج تلفزيوني يحتوي على تريتون X-100 لهذا الغرض، ولكن من الممكن استخدام الكواشف بيرمابيليزاتيون أخرى مثل توين 20، نونيديت P-40، سابونين، ديجيتونين، و ليوكوميرم. من الناحية المثالية، يجب أن يكون الأمثل بيرمابيليزاتيون الشرط في كل مختبر. للشريان الأورطي الماوس والشرايين السباتية، ونحن نعاملهم مع برنامج تلفزيوني يحتوي على 0.1٪ تريتون X-100 لمدة 10 دقيقة في رت، وهذا العلاج يكفي ل بيرمابيليز جميع الخلايا داخل جدار الوعاء الدموي. ثم يتم معالجة عينات بيرمابيليزد بالتتابع أولا مع الأجسام المضادة الأولية ثم الأجسام المضادة الثانوية التي هي فلورزنتلي المسمى. لأوعية الماوس تلطيخ، فمن الأهمية بمكان أن لا يتم إجراء الأجسام المضادة الأولية في الماوس لأن الأنسجة الوعائية الماوس سوف تحتوي على الماوس مفتش التي سيتم وصفها من قبل إيغ الثانوية فلورزنتلي المضادة للماوس، مما تسبب في تلطيخ خلفية عالية. للمجهر، يجب أن تكون العينة مسطحة قدر الإمكان. نضغط الشرائح لمدة 5 دقائق مع 3.5 كجم من الوزن. تم تحديد هذا الوزن المحدد تجريبيا.
Wوصفت الاستعدادات الدجاجة أون وجهها إمونوفلورزنتلي، فإنها يمكن دراستها باستخدام المجهر إبيفلورزنس العادي، ليزر المسح المجهر متحد البؤر، ومجهر مولتيفوتون. المجهر متحد البؤر هو أفضل للحصول على صور من البطانة والمنطقة تحت البطانية تصل إلى 50 ميكرون أو نحو ذلك من سطح السفينة في حين اختراق عميق للضوء الإثارة التي حققتها وضع مولتيفوتون من الإضاءة تمكن واحد للحصول على التركيز في الصور من عمق تصل إلى 2 مم من سطح جدار الوعاء. وبالإضافة إلى ذلك، يمكن استخدام المجهري مولتيفوتون للتصوير التوافقي الثاني، ومعظمها لدراسة منظمة الألياف الكولاجين في جدار الوعاء الدموي. إن وجه الاستعدادات كبيرة، مما يسمح لنا لمسح منطقة الأوعية الدموية الكبيرة مثل طول الشريان الأبهر بأكمله. هذه هي بعض من مزايا استخدام إمونوفلورزنتلي ملطخة أر وجه استعدادات الأوعية الدموية. ومع ذلك، هناك بعض عيوب هذه التقنية. أولا وقبل كل شيء، يقتصر الأسلوب علىتوافر الأجسام المضادة المحددة وغيرها من الكواشف فلورزنتلي المسمى مثل فالويدين الفلورسنت، دابي، ودي-أس-لدل (أسيتيلاتد البروتين الدهني منخفض الكثافة المسمى مع 1،1'- ديوكتاديسيل - 3،3،3 '، 3'- رباعي ميثيل-إندوكاربوسيانين بيركلورات). منذ يقوم التصوير على مضان، لا يمكن تصوير أجزاء غير الفلورسنت من العينات. عينات جبل كله في المعرض العام تألق ذاتي، والألياف الإيلاستين وجدت في الأوعية الدموية الكبيرة فلوريس باللون الأخضر. هذا مضان إشكالية خاصة عند استخدام المجهر إبيفلورزنس. وبالتالي، ينصح التصوير بواسطة المجهر مبائر للغاية. ومع ذلك، والتدخل من هذا التألق الذاتي الأخضر يمكن أن تخفض بشكل كبير باستخدام الأجسام المضادة الثانوية المسمى مع صبغة الفلورسنت الحمراء. وأخيرا، منذ إن تواجه العينات سميكة، والتصوير عن طريق الإضاءة المنقولة غير ممكن.
المجاهر متحد البؤر التجارية ومولتيفوتون تأتي مع برنامج تحليل الصور بما في ذلكواحد لتحليل كميا كثافة الفلورسنت من الصور. البيانات الكمية هي أكثر موثوقية إذا تمت المقارنات ضمن الشريحة نفسها. وذلك لأن جميع شروط المناعية هي نفسها للعينة. إذا كان يجب مقارنة شدة تلطيخ بين الشرائح المختلفة (على سبيل المثال، العادية مقابل الأوعية المريضة)، والطريقة الوحيدة للتحقق من صحة البيانات هو زيادة أعداد العينة بحيث يمكن أن يكون متوسط الاختلافات التقنية والبيولوجية. بشكل عام، قياسات كثافة على الصور متحد البؤر التي تم الحصول عليها بالقرب من سطح الأوعية هي أكثر موثوقية. كثافة الفلورسنت من الصور التي تم الحصول عليها من مناطق أعمق من الأنسجة تميل إلى أن تكون أكثر متغير بسبب درجات مختلفة من تشتت وامتصاص كل من الإثارة والضوء الفلورسنت المنبعث. بشكل عام، يجب أن نكون حذرين في تفسير الاختلافات شدة خفية الكشف عنها في المناطق العميقة من العينات. لتحسين القدرة التصوير من مناطق أعمق من الأنسجة، ومحاولات تبذل لجعل tوقد تم الحصول على بعض الصور المثيرة للإعجاب (على سبيل المثال، انظر مقالة نشرت مؤخرا من قبل نيكيل وآخرون 16 والأوراق التي استشهد بها هؤلاء المؤلفين). على الرغم من أنه من الممكن أن العلاجات المستخدمة لجعل الأنسجة شفافة قد استخراج بعض المستضدات و / أو ينكر بعض الحواتم، ويمكن استخدام هذه الطريقة للحصول على المزيد من الإشارات الفلورسنت استنساخه من مناطق أعمق من الأنسجة.
استخدام إن الاستعدادات الوجه لا يقتصر على التصوير بواسطة المجهر مضان. باستخدام المجهر ستيريو، إن وجه الاستعدادات سفينة يمكن استخدامها لدراسة مدى تشكيل وحة تصلب الشرايين بعد تلطيخها مع النفط الأحمر O. إن وجه الاستعدادات سفينة يمكن إجراء مطهر. هذه الاستعدادات يمكن أن تبقى في الثقافة، ويمكن أن تستخدم كنظام خارج الجسم الحي لدراسة الكريات البيض البطانية التفاعل الخلية.
Disclosures
لا شيء
Acknowledgements
وتدعم الأنشطة البحثية للمؤلفين من المنح المقدمة من المعهد الوطني للصحة للدكتور آبي (هل-130193، هل-123346، هل-118462، هل-108551).
Materials
| Name | Company | Catalog Number | Comments |
| 0.9% Sodium Chloride injection solution USP 500 mL bag | Fisher Scientific | NC9788429 | |
| 12-well plates | Fisher Scientific | 12556005 | |
| 6-0 coated vicryl suture | Ethicon | J833G | |
| AF488 goat anti-rat IgG | Life Technologies | A11006 | |
| AF546 goat anti-rabbit IgG | Life Technologies | A11035 | |
| Anti-CD144 (Ve-Cad) | BD Biosciences | BD555289 | |
| Anti-VCAM-1 (H-276) Rabbit polyclonal IgG | Santa Cruze Biotechnology | Sc-8304 | |
| Aoto Flow System | Braintree Scientific | EZ-AF9000 | |
| Autoclave Wrap. 24 inch x 24 inch | Cardinal Health | 4024 | |
| Blunt retractors, 2.5 mm wide | Fine Science Tools | 18200-10 | |
| Caprofen (Rimadyl) | zoetis | NADA#141-199 | |
| Chlorhexidine Scrub, 2% | Med-Vet International | RXCHLOR2-PC | |
| Curity gauze sponges 2 x 2 | Cardinal Health | KC2146 | |
| Electric heating pad, 12 x 14 | Fisher Scientific | NC0667724 | |
| Extra Fine Graefe Forceps | Fine Science Tools | 11152-10 | |
| Iris Scissors | Fine Science Tools | 14090-11 | |
| Micro cover glass 22 mm x 50 mm | VWR | 48393059 | |
| Microscope Slides | Fisher Scientific | 12-550-18 | |
| normal goat serum | Equitech-Bio | GS05 | |
| Paraformaldehyde Solution 4% in PBS | Santa Cruze Biotechnology | SC-281692 | |
| Petri dishes 100 mm x 15 mm | Fisher Scientific | FB0875713 | |
| Prolong Gold Antifade mountant with DAPI | Life Technologies | P-36935 | |
| Puritan cortton swabs | VWR | 10806-005 | |
| Puritan Mini cotton tipped aplicators | VWR | 82004-050 | |
| Round handled Needle Holder | Fine Science Tools | 12076-12 | |
| Silk Suture 6/0 | Fine Science Tools | 18020-60 | |
| Spring scissors | ROBOZ | RS-5601 | |
| Strabismus Scissors | Fine Science Tools | 14075-09 | |
| Super Grip Forceps | Fine Science Tools | 00649-11 | |
| Transparent Dressing | Cardinal Health | TD-26C | |
| Triton X-1000 | Fisher Scientific | AC327371000 |
References
- Jelev, L., Surchev, L. A novel simple technique for en face endothelial observations using water-soluble media -'thinned-wall' preparations. J Anat. 212 (2), 192-197 (2008).
- Neill, J. F. The effect on venous endothelium of alterations in blood flow through the vessels in vein walls, and the possible relation to thrombosis. Ann Surg. 126 (3), 270-288 (1947).
- Rogers, K. A., Kalnins, V. I. A method for examining the endothelial cytoskeleton in situ using immunofluorescence. J Histochem Cytochem. 11 (11), 1317-1320 (1983).
- Poole, J. C. F., Sanders, A. G., Florey, H. W. The regeneration of aortic endothelium. J Pathol Bacteriol. 75, 133-143 (1958).
- Sade, R. M., Folkman, J. En face stripping of vascular endothelium. Microvasc Res. 4, 77-80 (1972).
- White, G. E., Gimbrone, M. A., Fujiwara, K. Factors influencing the expression of stress fibers in vascular endothelial cells in situ. J Cell Biol. 97 (2), 416-424 (1983).
- Kim, D. W., Gotlieb, A. I., Langille, B. L. In vivo modulation of endothelial F-actin microfilaments by experimental alterations in shear stress. Arteriosclero. 9, 439-445 (1989).
- Haka, A., Potteaux, S., Fraser, H., Randolph, G., Maxfield, F. Quantitative analysis of monocyte subpopulations in murine atherosclerotic plaques by multiphoton microscopy. Plos ONE. 7 (9), 244823e (2012).
- Chèvre, R., et al. High-Resolution imaging of intravascular atherogenic inflammation in live mice. Circ Res. 114, 770-779 (2014).
- Heo, K. -. S., et al. Disturbed flow-activated p90RSK kinase accelerates atherosclerosis by inhibiting SENP2 function. J Clin Invest. 125 (3), 1299-1310 (2015).
- Le, N. -. T., et al. A crucial role for p90RSK-mediated reduction of ERK5 transcriptional activity in endothelial dysfunction and atherosclerosis. Circ. 127, 486-499 (2013).
- Kano, Y., Katoh, K., Masuda, M., Fujiwara, K. Macromolecular composition of stress fiber-plasma membrane attachment sites in endothelial cells in situ. Circ Res. 79, 1000-1006 (1996).
- Nigro, P., et al. Cyclophilin A is an inflammatory mediator that promotes atherosclerosis in apolipoprotein E-dependent mice. J Exp Med. 208 (1), 53-66 (2011).
- Mattson, D. L. Comparison of arterial blood pressure in different strains of mice. Am J Hypertens. 14 (5), 405-408 (2001).
- Jinguji, Y., Fujiwara, K. Stress fiber dependent axial organization of fibronectin fibrils in the basal lamina of the chick and mesenteric artery. Endothelium. 2, 35-47 (1994).
- Neckel, P. H., Mattheus, U., Hirt, B., Lust, L., Mack, A. F. Large-scale tissue clearing (PACT): Technical evaluations and new perspectives in immunofluorescence, histology, and ultrastructure. Sci Rep. 6, 34331 (2016).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved