Method Article
マウスの血管の顔面準備
要約
マウス頸動脈および大動脈の顔面の準備を行う手順が記載されている。そのような調製物は、特異的抗体で免疫蛍光染色されたとき、共焦点顕微鏡法によってタンパク質の局在化および血管壁全体の細胞型の同定を研究することができる。
要約
パラフィン包埋組織の切片は、組織組織学および組織病理学の研究に日常的に使用されている。しかしながら、このような切片から三次元組織形態が何であるかを決定することは困難である。さらに、検査される組織の切片は、進行中の研究の目的に必要な組織内の領域を含まないことがある。この後者の制限は、血管病変が局所的に発達するので、血管の組織病理学的研究を妨げる。これには、表面からより深い領域まで、血管壁の広い領域を調査できる方法が必要です。血管の全面的な準備は、この要件を満たす。この記事では、マウス大動脈と頚動脈の顔面の準備を行い、共焦点顕微鏡法や他の蛍光ベースのイメージングのために免疫蛍光染色する方法を実演します。
概要
光学顕微鏡による組織病理学的研究のために、三次元の生物学的組織片をパラフィン包埋のために日常的に処理し、続いて切片化および染色を行う。パラフィン包埋された組織サンプルは、3次元すべてで数ミリメートルであってもよい。しかし、光学顕微鏡の目的のためには、薄い部分が画像化に十分なコントラストをもたらすように、光を通過させて染色することができるように、最初に切断する必要がある。断切られた試験片は、通常、厚さが5〜10μmであるため、一度に2つの寸法の試験片全体のごくわずかな部分のみを見る。逐次セクションを収集し、各セクションを個別にイメージングした後、3D画像のコンピュータ支援再構成を実行することは可能ですが、実際これは面倒な作業です。特にアテローム性動脈硬化症の病因を研究するための血管の組織病理学は、独特の問題を提示する。アテローム性動脈硬化症は、発症する限局性疾患である血流が乱れる領域に局所的に存在する。さらに、この病気は、内膜細胞および大型動脈の単層からなる薄い組織である内膜内で開始される。これらの理由から、切開された血管を用いて早期の病巣を見つけて勉強することは、病変の切開を容易に逃すことができるので困難である。切片に病変領域が含まれていても、培地および外膜に内皮細胞および他の血管壁細胞を含む5〜10μm部分のみが見られる。
全体マウント面は、大動脈根から総腸骨動脈までの全大動脈など、血管表面の広い領域を調べることができます。特定の抗体および他の特異的なプローブで染色されたそのような検体を使用して、病変の位置を特定することができ、様々な分子事象が、内皮細胞において、タンパク質の発現、局在化、および翻訳後修飾の変化などのアテローム発生が含まれる。アテローム発生を研究することに加えて、顔面標本で観察された内皮細胞の形状は、時間的に平均化された血流パターンの指標として使用される。このようなデータは、その場での内皮細胞の機械的シグナル伝達を研究するために重要である。この目的のために、通常の組織学的断面血管は有用ではない。したがって、血管医学および生物学のためには、血管表面の広い領域および血管のより深い地下領域を観察することを可能にする、血管の顔面の準備を行う技術を獲得することが特に重要である。
Jelev and Surchev 1が概説したように、血管生物学者は、血管の内面を観察するための様々な方法を開発してきた。 1940年代と1950年代にはいくつかの独創的な方法が開発されました。これらの方法を使用して、彼らは血管の内面を覆う内皮細胞の基本的な組織を研究することができます。しかしながら、これらの表面調製物が調製される方法(いわゆるHautchen法2,3,4または容器表面5の剥がれ)および試料が染色される方法のために、途切れのない形態学を得ることは必ずしも可能ではなかった血管表面から血管壁のより深い領域への情報。免疫蛍光染色と組み合わされた全面的な血管造影は、内皮細胞形態およびこれらの細胞におけるタンパク質発現および局在を研究するだけでなく、そのような研究を血管壁の内皮下領域にまで拡張することを可能にした。 1980年代には、免疫蛍光で染色された血管内皮調製物を用いた初期の研究が始まり、f "> 7。レーザー走査共焦点顕微鏡検査および最近の多光子顕微鏡検査の出現により、免疫蛍光染色された顔面の血管試料および生きた動物の血管網における血管壁構造の明瞭な合焦画像を得ることができるこれらのコンピュータベースの画像化技術は、合焦された光学断面画像を生成し、このような画像を積み重ねることによって、組織内の血管壁および血管ネットワークの再構成された3D画像を得ることができる。再構成画像12,13の Z軸に沿って作られた断面の画像を生成することができる。
この記事では、免疫蛍光染色のためのマウス大動脈および頸動脈の顔面調製物の調製方法を説明する。顔面準備これらの容器が実験的に操作された後でも行うことができる。例えば、頸動脈を部分的に結紮した後、そのような手術の後に顔面標本を作製することができる。このため、この記事では、頸動脈の部分的な結紮をどのように行うのかについても説明します。ラット、ウサギ、ヒトなどのより大きな動物から同様の調製物を調製する場合と比較して、マウス血管は、サイズが小さく、より壊れ易いため、血管の外科的分離中の取扱いおよび抗体染色および顕微鏡検査のためのそれらの調製に対する注意が必要とされる。遺伝子改変のために最も一般的に使用される動物モデルはマウスであるため、多くの研究者がマウス血管を損傷することなく処理することが重要になります。この原稿では、マウス大動脈と頸動脈の顔面撮影を行う際に、マウスの血管をどのように扱うかを説明します。デモンストレーションの目的で、野生型C57 / b6マウスを使用します。
プロトコル
顔面免疫染色のためのマウス部分頸動脈結紮およびマウス大動脈および頸動脈の単離のためのプロトコールは、Institutional Animal Care and Use Committee(IBT 2014-9231)によって承認されている。
1.左頸動脈頚動脈結紮
- テーブルの上に12インチx 14インチのヒートパッドを置き、パッドとテーブルトップを大きな清潔なドレープで覆うことによって手術スペースを準備します。ステレオ顕微鏡の視野が加熱パッドの中央にくるように、ブームスタンドのアームを調整します。
- テーブル上のヒーティングパッドをオンにし、3設定のコントロールダイヤルを中程度の熱水準に設定します。この温度設定では、手術用ボード表面(1.6.1参照)は38〜40℃になります。
- クリーンケージを別のヒートパッドに置きます。上記のようにヒーターパッドをオンにします。このケージは、手術後の回復(1.16参照)およびハウジングのために使用される。
- 外科用テーブルに、虹彩はさみ(1対)、組織鉗子(1対)、スーパーグリップ鉗子(2対)、スプリングハサミ(1対)、鈍いリトラクタ(1対、幅2.5mm)を含むオートクレーブ滅菌パウチを置き、 (1)、滅菌済み6-0シルク縫合糸、綿棒アプリケータ、ミニ綿棒アプリケータ、手術用ドレープ、および2 "x 2"ガーゼスポンジを備えています。また、70%エタノールを含むスクイズボトルと、クロルヘキシジン手術用スクリューボーンを含む別のものを手術台に置く。
- マウスを秤量する。体重は、手術の直前に投与される鎮痛の適切な量を決定するために必要とされる。
- 誘導チャンバーにマウスを置きます。
- 誘導チャンバー内でマウスを麻酔するために、酸素タンクと麻酔気化器をオンにします。イソフルランレベルを2%に維持する。マウスの動きが止まる3〜5分かかります。
- マウスが麻酔されている間実体顕微鏡の下に滅菌手術用ドレープ(24インチx 24インチ)の小さな部分を置き、手術面を作成します。その後、ドレープされた表面にアクリル製手術ボード(70%アルコールで洗浄されている)を置く。したがって、外科用ボードは、加熱パッド上にあるべきであるが、外科用ドレープの2つの層によって分離されるべきである。
- マウスが誘導チャンバ内で動くのを止めたら、マウスを手術前の準備領域に移し、気化器(2%イソフルラン)に接続されたノーズコーンにノーズを配置します。電動トリマーまたはヘアリムローションを使用して、頸部周辺の髪を取り外します。この方法では、手術部位から完全に取り除くのが難しい髪の毛がゆるくならないので、脱毛ローションをお勧めします。
- ノーズコーンを所定の位置に置き、マウスを手術用ボードに移動します。
- 左右の前足を外科用ボードにテープ留めする。両後肢をテープで下ろすマウスの右側にあります。これにより、マウスの頸部の左側が手術のためにより良好に位置決めされるように、マウス本体のわずかな回転が生じる。
- 70%アルコール、クロルヘキシジン手術スクラブ、さらに70%アルコールで切開領域を消毒する。頚部切開領域を除いて、滅菌済みのドレープでマウスを覆う。
- マウスが完全に麻酔され、腹腔内または皮下注射により鎮痛(カプロフェン3-5mg / kg) を与えることをトウピンチで確認する。
- 解剖顕微鏡下で、メスまたはアイリスハサミのいずれかを使用して、頚部周囲の腹側正中切開を行う。
注:ステレオ顕微鏡の作動距離が限られているため、はさみを使用するため、メスの使用が困難です。 - 左総頸動脈(LCCA)を脇に押して、血管を覆っている唾液腺を左に動かすことによって露出させるnimal。
- 手術野内のすべての血管を特定する( 図1 )。 LCCAは左内頸動脈(ICA)と左外頸動脈(ECA)に分岐する。表在性甲状腺動脈(STA)は、内側のECAから生じる。後頭部動脈(OA)は、通常、ECAから生じるが、一部のマウスでは、ICAから生じる。
- 滅菌6-0シルク縫合を使用して、OA以外のすべての動脈枝をライゲートする。これを達成するには、次の2つの結紮を行います。
- 静かに左内頸動脈(ICA)の周囲および下の結合組織を除去する。予め鉗子で6〜0cmの絹の縫合糸を掴んで動脈の下に通す。別の一対の鉗子を使用して、その長さの約1/3の縫合糸を引っ張り、動脈を結紮する。
- 上記のように左外頸動脈(ECA)の周りの結合組織を除去し、左上甲状腺の近位に結紮するd動脈(STA)( 図1 )。手術野内を走る神経線維を損傷しないように注意してください。
- これらの結紮が行われたら、唾液腺を元の位置に戻し、滅菌生理食塩水を2〜3滴滴下して手術野を水和させる。 6-0コーティングされたvicryl縫合糸を使用して皮膚を閉じる。
- 手術後、マウスを予熱したケージに入れます(1.2.1参照)。マウスは5分以内に目を覚まし、歩き始めるはずです。マウスが正常に動作することを確認したら、ケージを動物の飼育室に持ってきてください。
- 回復の最初の3日間は毎日マウスを観察する。マウスは、実験プロトコルが要求する様々な条件下で実験が必要とする限り維持することができる。顔面の準備は、手術後のいつでも行うことができます。
2. 顔面免疫染色
- 吸入過量によりCO 2でマウスを安楽死させる。
- マウスを仰臥位(腹側を上にして)の位置で解剖板に貼り付けます。
- 虹彩はさみを使用して正中線切開を行うことによって腹腔を露出させる。
- 肋骨を横に胸骨に切断することによって胸腔を露出させる。
- 大静脈に切れ目を入れたり、大腿動脈の1つを切って血液を抜く。
- 重力灌流装置(120cm水圧)に取り付けられた26G針を左心室の頂点に挿入し、循環系をヘパリン(40U / mL)を含む生理食塩水で灌流する。切口から流出する食塩水が透明になるまで灌流を続ける。
- 灌流システムを生理食塩水からPBS(リン酸緩衝食塩水)中の4%パラホルムアルデヒドを含有する固定溶液に切り替え、さらに5分間灌流を続ける。
- 平滑末端のはさみと鉗子を用いて、大動脈および左右の頸動脈を採取し、氷上で固定剤を含む50mLコニカルチューブに入れる。
- 解剖顕微鏡下でPBSを含むペトリ皿に血管を移し、大動脈および頸動脈に付着した脂肪および結合組織を注意深く除去する。大動脈と頸動脈を分離して縦に分割して内皮を露出させます( 図2 )。
- 1ウェルあたり0.5mLの透過性溶液(PBS中の0.1%Triton X-100)を含有する12ウェルプレートのウェルに各容器を別々に移す。室温(RT)でロッキングしながら10分間血管を透過させる。
- PBSで簡単に洗浄します。
- 非特異的な抗体結合部位をブロックするために、TTBS(2.5%Tween20を含むトリス緩衝化生理食塩水(TBS))中で、二次抗体が作製された動物種由来の10%正常血清中の血管を30分間インキュベートする。 RTでロッキング。
- 4℃でロッキングしながら、10%正常血清(上記のように)で一晩TTBSで適切に希釈した一次抗体で血管をインキュベートする。レベル各抗体について希釈度を決定しなければならない。
- 以下のコントロール染色を行います。
- 一次抗体の代わりにTTBSで血管を培養し、続いて二次抗体と共にインキュベートする。
- 最初の抗体が作製された同じ動物(種)の非免疫(または免疫前)血清またはIgを含むTTBSで血管を培養し、続いて二次抗体と共にインキュベートする。
- 二次抗体とのインキュベーションを省略する。これらの対照検体は、特異的抗体による染色が行われるときと同じ方法で同時に処理されなければならない。
- 室温でロッキングしながら、TTBSで10分間3回血管を洗浄する。
- RTでロッキングしながら、10%正常血清(上記の通り)でTTBS中で適切に希釈した蛍光標識二次抗体と1時間インキュベートする。 DAPI(4 '、6-ジアミジノ-2-フェニルインドール)による核染色は、H 2 O中に5mg / mLのDAPIを含有するDAPIストック溶液の1 / 5,000容量を添加することによって、この段階に添加する。
- TTBSで10分間3回洗浄し、RTでロッキングする。
- PBSですすいでください。
- カバーグラス(22 mm x 50 mm)に1滴の抗褪色試薬を置き、内皮を下に向けてカバーガラス上に血管を置きます。
- 血管にスライドガラス(22 mm x 75 mm)を置き、泡を閉じ込めないようにします。
- 清潔な実験用ワイプ( 例えば、 Kimwipe)にスライドを置き、2枚の実験用ワイプでスライドを覆う。スライド上に3.5kgの重さ(静かな本の上に水を入れるなど)を最大5分間入れて、顔面の血管サンプルを平らにする。
- 重量を取って、カバーガラスの周りから余分な溶液を拭き取ってください。
- カバースリップの四隅にネイルポリッシュを塗り、スライドボックスにスライドを置き、カバースリップを上にして、暗所でRTに保つ(または4℃)で一晩インキュベートする。このプロセスは、組織をさらに平らにし、高倍率で顕微鏡検査を行うのを容易にします。
- ネイルポリッシュを使用してカバースリップを完全にシールします。
- マニキュアが乾燥すると直ちに顕微鏡検査を行います。
- 必要に応じて-20℃で保存してください。
結果
内皮の典型的な表面免疫蛍光画像を図3に示す 。この画像は、肋間動脈の開口部付近(大きな黒い卵形領域)で撮影されたマウス大動脈の単一の光学セクションを示す。大動脈は、抗VEカドヘリン(緑色)および抗VCAM-1(血管細胞接着分子-1)(赤色)で二重染色された。各内皮細胞は、接着接合部で緑色の線状染色で輪郭が描かれている。標本のわずかな不均一性のために、いくつかの付着接合部はこの光学部の外側にある。抗VCAM-1染色は、妨げられた血流が生じることが知られている肋間動脈の開口部においてより強い。図4は、抗VE-カドヘリン(緑色)、抗VCAM-1(赤色)、およびDAPI(紫色)を用いた頸動脈の表面の染色を示す。左頸動脈(LCA)は部分的に結紮し、右頸動脈(RCA)は触れなかった。容器標本は、1日後に作製した。手術と染色。ライゲーションした血管における抗VCAM-1染色の増加に注目する。目的のタンパク質の発現レベル、標的タンパク質の翻訳後修飾の程度、および内皮細胞および他の細胞内の様々なタンパク質の局在のパターンを調べるために、種々の抗体で免疫蛍光染色された検体を使用することができる血管壁10,11 。
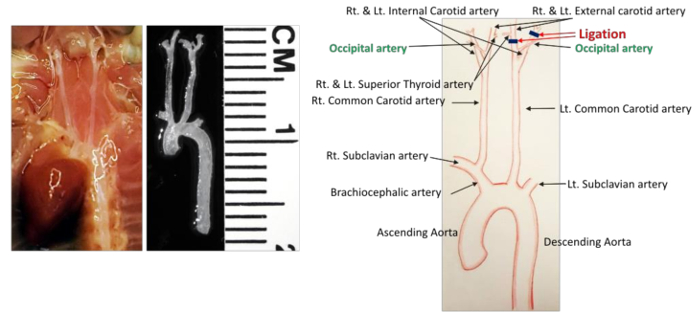
図1 :マウス頸部の詳細な血管構造。解剖の前後の血管網が左側に示されている。すべての動脈は、右の図に示されています。黒い線は結紮を示す。スケール:1区分= 1mm。_blank ">この図の拡大版を見るには、ここをクリックしてください。

図2:頸動脈および大動脈がエンフェースの準備となる様子を示す図。血管壁に沿った点線は、血管を開くための切断部を示す。着色した顕微鏡写真は、実際の顔面の準備を示す。スケール:1区分= 1mm。 この図の拡大版を見るには、ここをクリックしてください。
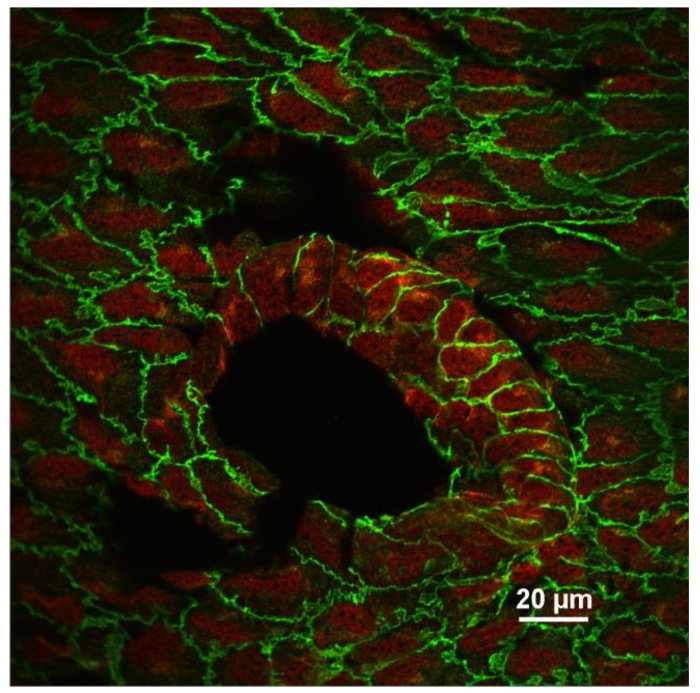
図3:抗VE-カドヘリン(緑色)および抗VCAM-1(赤色)で染色された内皮のEn顔画像。肋間開口付近の内皮細胞の共焦点単一光学部分は、表示されます。 VCAM-1発現は、血流が非層状である血管分岐点に位置する内皮細胞において増加することに留意されたい。画像は、60倍(NA 1.4、油)の対物レンズを用いて記録した。スケールバー=20μm。 この図の拡大版を見るには、ここをクリックしてください。
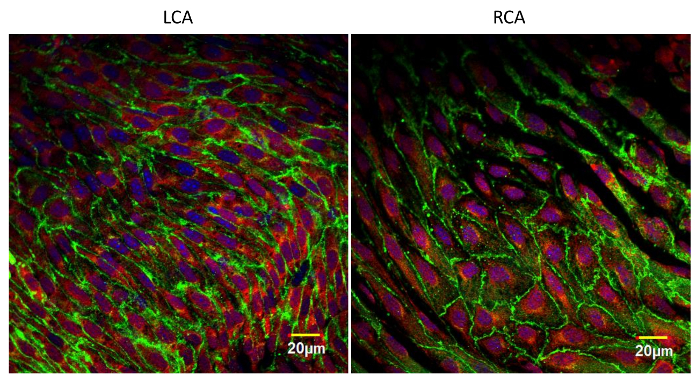
図4:抗VE-カドヘリン(緑色)、抗VCAM-1(赤色)、およびDAPI(紫色)で染色された左右の頸動脈の顔面画像。左頸動脈を部分的に結紮し、右頚動脈をそのまま残した。手術24時間後にこれらの顔面の準備をした。無傷の血管と比較して結紮側でのVCAM-1の発現の増加が明らかである。これらの画像は、一般的な頸動脈の分岐の近くで撮影された。60X(NA 1.4、オイル)対物レンズを備えたレーザー走査共焦点顕微鏡を用いて測定した。スケールバー=20μm。 この図の拡大版を見るには、ここをクリックしてください。
ディスカッション
マウスの血管を扱うときは、内皮が壊れやすく、過剰な機械的な力が内皮細胞に損傷を与えることを覚えておくことが重要です。例えば、血管があまりにも強く灌流された場合、内皮細胞は血管壁から壊れたり離脱したりする。これは、脈管構造が手動シリンジを用いて灌流されたときに容易に起こり得る。
一定の灌流圧を得るために、120cmの水柱圧を有する重力灌流システムを使用する。株によって異なるマウスの平均動脈圧は、130〜170cm H 2 O 14の範囲であることが報告されている。したがって、我々が使用する灌流圧は、測定された動脈圧よりわずかに低い。灌流固定したラット大動脈を90cm H 2 Oカラム圧力で使用した。
インサイチューの内皮細胞は、収穫中に血管を引き伸ばす場合にも損傷を受ける洗浄、縦方向分割、免疫染色、およびマウントが含まれる。実際、機械的損傷は、顔面の準備において内皮細胞を失う一般的な原因の1つである。血管伸展は、処置中の任意の段階で行うことができるが、最も一般的には、血管を収穫するときに起こる。外膜に付着した脂肪組織を除去するときに血管を引き伸ばすことも容易である。
顔全体の準備は、血管をその全長に沿って縦に切断することによって行われる。これは通常、鋭利なはさみを使用して行われます。しかし、鋏の先端は、標的血管の内径が小さい場合、大きすぎることがある。このような場合には、切断された薄い使い捨てカミソリ刃を使用して切断を行うことができる。我々は、この技術を用いてニワトリ腸間膜動脈の顔面の準備を行った15 。
固定後、顔面の準備が透過化される。通常、Triton X-100を含むPBSは、Tween-20、Nonidet P-40、サポニン、ジギトニン、およびLeucomermのような他の透過性化試薬を使用することが可能である。理想的には、各実験室で透過条件を最適化する必要があります。マウス大動脈および頸動脈については、0.1%トリトンX-100を含有するPBSで室温で10分間処理し、この処理は血管壁内のすべての細胞を透過させるのに十分である。次いで、透過化された試料を最初に一次抗体で、次いで蛍光標識された二次抗体で順次処理する。マウス血管を染色するためには、マウス血管組織に蛍光標識二次抗マウスIgGによって標識されるマウスIgGが含まれ、高いバックグラウンド染色を引き起こすので、一次抗体がマウスで作製されないことが重要である。顕微鏡検査では、標本は可能な限り平坦でなければならない。 3.5kgの重量で5分間スライドを押す。この比重は経験的に決定された。
W免疫表面標識調製物は免疫蛍光標識され、通常の落射蛍光顕微鏡、レーザー走査共焦点顕微鏡、および多光子顕微鏡を用いて研究することができる。共焦点顕微鏡法は、血管表面から50μm程度までの内皮および内皮下領域の画像を得るのに最も適しているが、多光子モードの照明によって達成される励起光の深い浸透は、深度から合焦画像を得ることを可能にする。血管壁面から2mmまでさらに、多光子顕微鏡法を第2高調波イメージングに使用することができ、最も典型的には、血管壁におけるコラーゲン線維の組織化を研究する。 En顔の準備は大規模で、大動脈の全長などの大きな血管領域を調べることができます。これらは免疫蛍光染色された顔面血管調製物を使用する利点のいくつかである。しかしながら、この技術のいくつかの欠点がある。まず第一に、この方法は、特異的抗体および蛍光ファロイジン、DAPIおよびDiI-Ac-LDL(1,1'-ジオクタデシル-3,3,3 '、3'-テトラメチルインドカルボシアニンで標識されたアセチル化低密度リポタンパク質)のような他の蛍光標識試薬の入手可能性過塩素酸塩)。画像化は蛍光に基づいているので、標本の非蛍光部分は画像化することができない。全体のマウント標本は一般に自己蛍光を示し、大きな血管に見られるエラスチン繊維は緑色で蛍光を発する。この蛍光は、落射蛍光顕微鏡を使用する場合に特に問題となる。したがって、共焦点顕微鏡によるイメージングが強く推奨されます。しかしながら、赤色蛍光色素で標識された二次抗体を用いることにより、この緑色自己蛍光の干渉を有意に減少させることができる。最後に、面の標本が厚いため、透過照明によるイメージングは不可能である。
市販の共焦点顕微鏡および多光子顕微鏡には、画像解析ソフトウェア画像の蛍光強度を定量的に分析するもの。定量化されたデータは、同じスライド内で比較が行われた場合、より信頼性が高くなります。これは、免疫染色のためのすべての条件が検体について同じであるためです。染色強度を異なるスライド(例えば、正常血管と疾患血管)とで比較しなければならない場合、データを検証する唯一の方法は、技術的および生物学的変異の両方を平均できるように試料数を増加させることである。一般に、血管の表面付近で得られる共焦点画像の強度測定は、より信頼性が高い。組織のより深い領域から得られた画像の蛍光強度は、励起および放出された蛍光の両方の散乱および吸収の度合いが異なるため、より可変である傾向がある。一般的に、標本の深部で検出される微妙な強度差を解釈する際には注意が必要です。組織のより深い領域からの造影能力を改善するために、t(例えば、Neckel らの最近の記事やこれらの著者が引用した論文を参照)。組織を半透明にするために使用される処理が特定の抗原を抽出し、および/または特定のエピトープを変性させる可能性はあるが、この方法は組織のより深い領域からより再現性のある蛍光シグナルを得るために使用され得る。
顔面調製物の使用は、蛍光顕微鏡による画像化に限定されない。ステレオ顕微鏡を用いて、油性赤色Oでそれらを染色した後のアテローム性動脈硬化プラーク形成の程度を調べるために、顔面血管調製物を使用することができる。顔面血管調製物は無菌的に調製することができる。そのような調製物は培養物中に保存することができ、白血球 - 内皮細胞相互作用を研究するための生体外システムとして使用することができる。
開示事項
なし
謝辞
著者らの研究活動は、国立衛生研究所から阿部博士(HL-130193、HL-123346、HL-118462、HL-108551)の助成金によって支えられている。
資料
| Name | Company | Catalog Number | Comments |
| 0.9% Sodium Chloride injection solution USP 500ml bag | Fisher Scientific | NC9788429 | |
| 12-well plates | Fisher Scientific | 12556005 | |
| 6-0 coated vicryl suture | Ethicon | J833G | |
| AF488 goat anti-rat IgG | Life Technologies | A11006 | |
| AF546 goat anti-rabbit IgG | Life Technologies | A11035 | |
| Anti-CD144 (Ve-Cad) | BD Biosciences | BD555289 | |
| Anti-VCAM-1 (H-276) Rabbit polyclonal IgG | Santa Cruze Biotechnology | Sc-8304 | |
| Aoto Flow System | Braintree Scientific | EZ-AF9000 | |
| Autoclave Wrap. 24x24in | Cardinal Health | 4024 | |
| Blunt retractors, 2.5mm wide | Fine Science Tools | 18200-10 | |
| Caprofen (Rimadyl) | zoetis | NADA#141-199 | |
| Chlorhexidine Scrub, 2% | Med-Vet International | RXCHLOR2-PC | |
| Curity gauze sponges 2x2 | Cardinal Health | KC2146 | |
| Electric heating pad, 12X14 | Fisher Scientific | NC0667724 | |
| Extra Fine Graefe Forceps | Fine Science Tools | 11152-10 | |
| Iris Scissors | Fine Science Tools | 14090-11 | |
| Micro cover glass 22x50mm | VWR | 48393059 | |
| Microscope Slides | Fisher Scientific | 12-550-18 | |
| normal goat serum | Equitech-Bio | GS05 | |
| Paraformaldehyde Solution 4% in PBS | Santa Cruze Biotechnology | SC-281692 | |
| Petri Dishes 100x15mm | Fisher Scientific | FB0875713 | |
| Prolong Gold Antifade mountant with DAPI | Life Technologies | P-36935 | |
| Puritan cortton swabs | VWR | 10806-005 | |
| Puritan Mini cotton tipped aplicators | VWR | 82004-050 | |
| Round handled Needle Holder | Fine Science Tools | 12076-12 | |
| Silk Suture 6/0 | Fine Science Tools | 18020-60 | |
| Spring scissors | ROBOZ | RS-5601 | |
| Strabismus Scissors | Fine Science Tools | 14075-09 | |
| Super Grip Forceps | Fine Science Tools | 00649-11 | |
| Transparent Dressing | Cardinal Health | TD-26C | |
| Triton X-1000 | Fisher Scientific | AC327371000 |
参考文献
- Jelev, L., Surchev, L. A novel simple technique for en face endothelial observations using water-soluble media -'thinned-wall' preparations. J Anat. 212 (2), 192-197 (2008).
- Neill, J. F. The effect on venous endothelium of alterations in blood flow through the vessels in vein walls, and the possible relation to thrombosis. Ann Surg. 126 (3), 270-288 (1947).
- Rogers, K. A., Kalnins, V. I. A method for examining the endothelial cytoskeleton in situ using immunofluorescence. J Histochem Cytochem. 11 (11), 1317-1320 (1983).
- Poole, J. C. F., Sanders, A. G., Florey, H. W. The regeneration of aortic endothelium. J Pathol Bacteriol. 75, 133-143 (1958).
- Sade, R. M., Folkman, J. En face stripping of vascular endothelium. Microvasc Res. 4, 77-80 (1972).
- White, G. E., Gimbrone, M. A., Fujiwara, K. Factors influencing the expression of stress fibers in vascular endothelial cells in situ. J Cell Biol. 97 (2), 416-424 (1983).
- Kim, D. W., Gotlieb, A. I., Langille, B. L. In vivo modulation of endothelial F-actin microfilaments by experimental alterations in shear stress. Arteriosclero. 9, 439-445 (1989).
- Haka, A., Potteaux, S., Fraser, H., Randolph, G., Maxfield, F. Quantitative analysis of monocyte subpopulations in murine atherosclerotic plaques by multiphoton microscopy. Plos ONE. 7 (9), 244823e (2012).
- Chèvre, R., et al. High-Resolution imaging of intravascular atherogenic inflammation in live mice. Circ Res. 114, 770-779 (2014).
- Heo, K. -. S., et al. Disturbed flow-activated p90RSK kinase accelerates atherosclerosis by inhibiting SENP2 function. J Clin Invest. 125 (3), 1299-1310 (2015).
- Le, N. -. T., et al. A crucial role for p90RSK-mediated reduction of ERK5 transcriptional activity in endothelial dysfunction and atherosclerosis. Circ. 127, 486-499 (2013).
- Kano, Y., Katoh, K., Masuda, M., Fujiwara, K. Macromolecular composition of stress fiber-plasma membrane attachment sites in endothelial cells in situ. Circ Res. 79, 1000-1006 (1996).
- Nigro, P., et al. Cyclophilin A is an inflammatory mediator that promotes atherosclerosis in apolipoprotein E-dependent mice. J Exp Med. 208 (1), 53-66 (2011).
- Mattson, D. L. Comparison of arterial blood pressure in different strains of mice. Am J Hypertens. 14 (5), 405-408 (2001).
- Jinguji, Y., Fujiwara, K. Stress fiber dependent axial organization of fibronectin fibrils in the basal lamina of the chick and mesenteric artery. Endothelium. 2, 35-47 (1994).
- Neckel, P. H., Mattheus, U., Hirt, B., Lust, L., Mack, A. F. Large-scale tissue clearing (PACT): Technical evaluations and new perspectives in immunofluorescence, histology, and ultrastructure. Sci Rep. 6, 34331 (2016).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved