Method Article
Изоляция, характеристика и очистки макрофагов из пострадавших от связанных с ожирением воспаление тканей
В этой статье
Резюме
Этот протокол позволяет исследователю изолировать и характеризуют ткани резидентов макрофаги в различных hallmark воспаленных тканей, извлеченные из диеты индуцированной модели метаболических расстройств.
Аннотация
Ожирение способствует хронические воспалительные государство, которое во многом опосредовано макрофагов ткани резидентов, а также моноцитарных макрофагов. Диета индуцированной ожирение (DIO) является полезной моделью в изучении роли неоднородности макрофагов; Однако адекватные макрофагов изоляции трудно приобрести из воспаленных тканей. В этом протоколе мы наметим шаги изоляции и необходимого руководства по устранению проблем, производный от наших исследований для получения подходящей населения макрофагов ткани резидентов от мышей после 18 недель высокой жирностью (HFD) или высокой жира/высокий холестерина ( Диетические вмешательство HFHCD). Этот протокол фокусируется на три пробы тканей, учился в ожирение, атеросклероз, включая печень, белой жировой ткани (Ват) и аорты. Мы подчеркиваем как дуалистической использование потока цитометрии можно добиться новое измерение изоляции и характеристика тканей резидентов макрофаги. Основной раздел настоящего протокола адреса тонкости лежащие в основе ткани конкретных ферментативного пищеварения и макрофагов изоляции и последующих клетк поверхности антитело пятная для анализа потока гранулярных. Этот протокол адреса существующих сложностей, лежащих в основе активированного люминесцентные клеток, сортируя (FACS) и представлены разъяснения этих сложностей, с тем чтобы получить широкий диапазон характеристик от адекватно отсортированный клеточных популяций. Методы альтернативной обогащения включены для сортировки клеток, например, плотная печень, позволяя для гибкости и времени управления при работе с СУИМ. Короче говоря этот протокол СПИД исследователь оценить неоднородность макрофагов из множества воспаленных тканей в рамках данного исследования и обеспечивает проницательные советы по устранению неполадок, которые оказались успешными для благоприятного сотовой изоляции и характеристика иммунных клеток в Дио опосредованной воспаления.
Введение
Мышь модели широко используются для изучения динамики заболеваний человека. Надлежащая изоляция резидентов клеток ткани от мышей в состоянии больной может обеспечить платформу для понимания молекулярная и клеточная вклад в патогенезе заболевания1. Одно расстройство, которое имеет решающее значение является ожирение. Распространенность ожирения продолжает расти во всем мире параллельно с сопротивлением инсулина и типа 2 диабет, сердечно-сосудистых заболеваний и жировой болезни печени2,3. Чрезмерное потребление питательных веществ далее перекос, снижение физической активности, вызывая изменения сигналов, вытекающих из жировой ткани, который может изменить клеточного окружения других периферийных тканей, таких как аорты и печени4. Такие нарушения метаболизма гомеостаза приводит к хронической низкосортных внутрирастительного воспаления5.
Классическая активация макрофагов, резидент в аорту и печени, а также их вербовки в белой жировой ткани (Ват) было показано не только инициировать регуляции метаболических сигналов, но также поддерживать воспаление6,7. Фенотипические и функциональных неоднородность макрофагов прочно ассоциируется с патогенезе ожирения связаны сопутствующие заболевания7. Динамический пластичности в макрофагов поляризации позволяет эти клетки демонстрируют широкий спектр активированные фенотипов, которые координируют прогрессии и резолюции воспаления8. В то время как классически Активированные макрофаги (M1) вовлечены в распространении воспаления, альтернативно Активированные макрофаги (м2) были связаны с резолюцией и ткани ремонт9,10.
Как тело испытывает метаболический стресс, аномально накапливается белой жировой ткани. Расширенный жировой ткани привлекает и удерживает воспалительные клетки, которые глубоко изменить функции нормальной Адипоцит содействовать сопротивление инсулина, гипергликемия и в конечном итоге сахарный диабет типа 2, сопротивление инсулина или гипергликемия11, 12. Параллельно белой жировой ткани переделывает в ответ на воспалительные сигналы, выпущенное проникли классически активированные (M1) жировой ткани макрофагами (банкоматов)13,14. Этот многоклеточной орган оказывает Каскад сигналов, derails нормальной функции других органов тела, например, аорта и печени4.
Печень является метаболически электростанция, которая адаптируется в ответ на раздражители, происходящих из близлежащих dysregulated Ват15. Макрофагами печени или клеток Купфера, в ответ на метаболические изменения, выделяют воспалительных цитокинов, что преобразования как Паренхиматозный и фенотип не Паренхиматозный клеток и содействовать тканей ремоделирования. Накопление липидов в печени, воспаление, депозиты чрезмерно внеклеточного матрикса, некроз и возможные функции потерь следует воспалительных оскорбления, предоставляющих широкий спектр повреждения печени, связанные с безалкогольных жирная болезнь печени 16,17,18.
Параллельно с нарушенной Ват и функции печени крупные артерии накапливаться липидов в стенке артерий, как тело испытывает хронический метаболический стресс19. Накопление липидов артериальной вызывает секрецию chemokines активированный эндотелиальных клеток и последующего набора моноциты20. После вербовки, моноциты размножаться, дифференцировать, глотать липопротеинов и стать пены клетки. Атерогенеза инициируется и устойчивого про воспалительных деятельности набранных и тканевых макрофагов резидентов липидов Ладена. Поддаваясь внеклеточные и внутриклеточных стресс сигналы передаются в этом атерогенные микроокружения, эти макрофаги затем заниматься apoptotic сигнальный Каскад. Как эти пены клетки умирают, они способствуют их содержание липидов заполнены на ядро некротические поражения, которое затем приводит к разрыву зубного налета, инфаркта миокарда и инсульта.
Коллективно неоднородность фенотипов макрофагов в части оркеструет ожирения, вызванных воспалительные изменения, наблюдаемые в dysregulated ткани, такие как Ват, печень и аорты8,21. Характеристику набранных и ткани-резидентов макрофаги могут обеспечить понимание потенциальных молекулярных целей, которые манипулируют макрофагов фенотип1. Эффективно охарактеризовать макрофаги от ожирения индуцированной воспаленных тканей, подвески одной ячейки можно получить путем ферментативного пищеварения. Такие протоколы диссоциации должна быть эффективной в достаточно унижающего достоинство соединительной ткани при минимизации иммунных клеток смерть и обеспечивая оптимальное ячейки урожайности. Смесь ферментов зависит от типа ткани и ее структурных составляющих. Эластичных тканей, таких как аорты требует сильнее ферментативную активность, по сравнению с печени и Ват, для достижения ткани диссоциации. От одноклеточного подвеска резидентов макрофаги ткани может быть однозначно характеризуется или изолированные для дополнительного течению анализа, таких как транскрипционный анализ профиля.
Здесь ткани конкретного протокол описан, использующий коллагеназы зависимых тканей пищеварение и полихромный проточной цитометрии эффективно изолировать и характеризуют ткани резидентов макрофаги, полученные от традиционного рациона индуцированной ожирения, атеросклероз, простой стеатоз и стеатогепатит мыши модели. Одновременная окрашивания клеток поверхности маркеров с антителами против лейкоцита-(CD45 или CD11b) и макрофагов - специфических антигенов (F4/80), часто используется для идентификации макрофагов населения22. Активирован флуоресценции клеток, сортируя (FACS) является мощной стратегией, используемый для сортировки этих выявленных подвергающегося высокой чистоты. Отсортированный населения можно затем оценить фенотип профилей конкретных генов с помощью течению молекулярного анализа (например, количественные реального времени полимеразной цепной реакции)23. Хотя стандартные проточной цитометрии и сортировки потока на основе цитометрии клеток являются мощными инструментами в отличительный макрофагов в суспензии значительно гетерогенных клеток, бывший протоколы должны быть оптимизированы для обеспечения успешного вывода. В этом исследовании описываются протоколы, которые эффективно изолировать и характеризуют конкретные жизнеспособных тканевых макрофагов; что еще более важно это исследование обеспечивает решающую понимание технических вопросов, которые часто возникают, а также активную и неисправностей стратегии предотвращения и/или их решения.
протокол
Все экспериментальные протоколы (разделы 1, 1.2 и 1.3) были утверждены институциональный уход животных и использование Комитет (IACUC) в университете штата Пенсильвания.
| Ткани | Диссоциация буферы подготовки | Окончательный объем | Хранения |
| Белой жировой ткани (Ват) | Диссоциация буфера: 2,5% HEPES, 10 мг/мл бычьим сывороточным альбумином (БСА), 3 мг/мл (0.3%) Коллагеназы типа II в Дульбекко изменение Eagle среднего (DMEM) с глюкозой 4,5 г/Л без пируват натрия и L-глютамина | 500 мл | минус 80° C (10 мл аликвоты) |
| Печень | 25 x перфузии буфера концентрат (PBC): 3,55 М NaCl, 168 мм KCl, 240 мм HEPES, 150 мм NaOH в дистиллированной деионизированной H2O | 500 мл | минус 20° C (40 мл аликвоты) |
| Сохранения буфера (PRB): 1% BSA в 1 x перфузии буфера | 1 Л | 4 ° C | |
| Диссоциация буфер: 1 x перфузии буфера дополнена 4,76 мм CaCl2 и 72 ед/мл коллагеназы типа IV | 50 мл (на мышь) | Готовят непосредственно перед использованием | |
| Аорта | Диссоциация: 125 ед/мл коллагеназы тип Буфера XI, 60 ед/мл гиалуронидазы типа I, 60 ед/мл DNase I, 450 ед/мл коллагеназы типа I, 20 мм HEPES 1 x Buffered фосфатный (PBS) | 500 мл | минус 80° C (10 мл аликвоты) |
Таблица 1: Рецепты буфера конкретных перфузии тканей.
1. ткань изоляции и разобщенности
- Ват изоляции и разобщенности
- Подготовка тканей конкретных буферов согласно таблице 1и хранить их, как описано.
- Подготовьте следующие реагентов.
- Подготовьте буфере пищеварение, оттаивания соответствующий объем буфера диссоциации Ват и хранить при 4 ° C до использования. Непосредственно перед применением теплый буфера до 37 ° C. Подготовьте СУИМ буфера путем подготовки 1 x фосфат амортизированное saline (PBS), содержащий 2% плода бычьим сывороточным (ФБС).
- Ват изоляции
- Усыпить камере мыши в двуокись углерода (CO2) заполнены. Проверить эффективность до продолжения на сцену рассечение.
- Окуните Усыпленных мыши кратко в стакан, содержащие 70% этанол до тех пор, пока тщательно смоченной и покрытием с этанолом. Место мыши вентральной поверхности вверх на сцене диссекции и закрепите мыши передний и задние лапы рассечение Совету использованием 21 G иглы.
- Использовать средние точки оконечности щипцы понять брюшной кожи предшествовавшие уретры открытия, а затем использовать рассечения острыми ножницами сделать Ник в захваченной кожи живота.
- Вставьте маленький разрез между кожей и брюшины нижнего лезвия ножниц и сделать боковой разрез от живота к грудной клетке.
- Осторожно потяните назад кожу, чтобы разоблачить нетронутыми брюшной полости и сделать боковой разрез через брюшину и либо загибается прозрачной мембраны или акцизного ткань подвергать брюшной Ват.
- Собрать perigonadal жировых отложений, как описано в Манн и др. 24
- Perigonadal жировых отложений у мышей-самцов слабо связаны и придатка яичек. Сначала найдите семенников и затем с средней точки щипцы, Возьмите голову придатка и слегка потяните.
- С помощью острых ножниц рассечения, акцизных каждый эпидидимальных жировой ткани путем разрезания вдоль поверхности придатка (голова, тело и хвост) и яичках.
- Пинцетом осторожно потяните на жировой ткани во время резки через соединительной ткани непосредственно привязан к структуре придатка яичка.
- С помощью щипцов, твердо захват конец жировой ткани проксимальнее придатка и осторожно снимите жира накладку гонады
- В самок мышей perigonadal жира подушечки слабо Бонда в рога матки и тела матки.
- С помощью средней точки щипцы, сцепление perigonadal жировой ткани и осторожно потяните ткань от рога матки и тела матки.
- Акцизный каждый жировой ткани путем разрезания вдоль тела матки и рога матки с использованием рассечения острыми ножницами.
- Место жир колодки в чашке Петри заполнены с PBS и держать на льду держать влажной ткани.
- Диссоциации о Ват в одну ячейку суспензий
- Удалите избыток PBS из Петри и использовать одним краем лезвия для фарша брюшной Ват на мелкие кусочки.
- С острым краем лезвия бритвы аккуратно очистите фарш брюшной Ват в помечены 15 мл полипропиленовые коллекции трубка, содержащая 2 мл Ват диссоциации буфера.
- Инкубируйте эту смесь ткани пищеварение буфера под медленное непрерывное вращение при 37 ° C на 45 мин.
- Фильтр переваривается ткани через стрейнер ячейки 70 мкм в 50 мл трубки коллекции во время движения резиновые поршень поршень шприца в круговом движении и продолжают сита суспензии клеток через фильтр.
- Пипетки 2 мл Дульбекко вверх и вниз в 15 мл трубки коллекции, нежно накапайте среднего изменения орла (DMEM) и промойте фильтр с одной ячейкой подвеска.
- Промойте фильтр еще два раза с холодной среде DMEM и поместите одну ячейку подвеска на льду.
- Центрифуга суспензию клеток на 300 x g при 4 ° C на 8 мин.
- Используйте Вакуумный аспиратор тщательно удалить плавающие адипоцитов (первый) и оставшиеся супернатант. Убедитесь в том, чтобы не мешать гранулированных стромальные сосудистой дроби (СФДВ).
- С 1000 мкл пипетки нежно вновь приостановите гранулы в буфере аммония хлорид калия (ACK) лизируют эритроцитов согласно инструкциям производителя.
- Разбавить выше суспензию клеток с DMEM и центрифуги суспензию клеток на 300 g при 4 ° C на 8 мин.
- Вновь приостановить клетки в холодной PBS, содержащий 2% FBS (FACS буфера) и подсчитать количество ячеек в Burker камере/Горяева.
- Передача всей ячейки подвеска (для СУИМ) или 1 x 106 клеток (для основных проточной цитометрии) помечены 5 мл раунд дно из полистирола трубы. Продолжить к разделу 2 для проточной цитометрии пятнать протокол.
- Ткани печени изоляции и разобщенности
Примечание: Этот протокол был адаптирован от Smedsrød25.- Подготовка тканей конкретных буферов согласно таблице 1 и хранить их, как описано.
- Подготовьте следующие реагентов.
- Подготовка 1 x перфузии буфера (PB), путем разбавления 40 мл КПБ в 960 мл сверхчистого H2O. предварительно теплой шприц заполнены с PB 50 мл при 37 ° C, непосредственно перед началом перфузии. Исключите любой настоящий пузырьков воздуха.
- Чтобы избежать воздушных пузырей, Инвертируйте шприц, где подсказка блокировки leur указывая вверх. Флик шприц, пока пузырьки воздуха в верхней ПФ шприц или коснитесь ее. Осторожно нажмите на поршень, чтобы изгнать воздух
- Подготовьте пищеварение буфера путем разбавления 0,5 мл 476 мм CaCl2 решениядо 49,5 мл 1 x перфузии буфера. Добавьте 3600U коллагеназы типа IV 4,76 мм CaCl2 – PB решение. Предварительно теплой шприц заполнены с 50 мл буфера пищеварения при 37 ° C, непосредственно перед началом перфузии. Ликвидации нынешней воздушные пузыри, как описано в шаге 1.2.2.1.1.
- Подготовьте сохранения буфера (PRB) путем растворения 2.5 g бычьим сывороточным альбумином (БСА) в 250 мл 1 x перфузии буфера. Хранить при 4 ° C, или держать на льду до использования.
- Подготовьте СУИМ буфер с 1 x PBS и 2% FBS.
- Подготовка 1 x перфузии буфера (PB), путем разбавления 40 мл КПБ в 960 мл сверхчистого H2O. предварительно теплой шприц заполнены с PB 50 мл при 37 ° C, непосредственно перед началом перфузии. Исключите любой настоящий пузырьков воздуха.
- Изоляция ткани печени
- Усыпить мыши CO2 удушение, насытить мышь с 70% этанола для предотвращения загрязнения внутрибрюшное органов с мехом.
- Положение вентральной стороне мыши вверх на полистирола вспененного, пройдя через Совет и обеспечить мыши передних и задних лапы рассечение Совету использованием 21 G иглы.
- Подвергать грудной стенки и брюшной полости, понять брюшной кожа возле уретры открытия с помощью средней точки оконечности щипцами. Затем используйте рассечения ножницами для создания небольшой надрез на захваченной брюшной кожу.
- Вставьте маленький разрез между кожей и брюшины нижнего лезвия ножниц и сделать боковой разрез от паха до подбородка.
- Осторожно потяните назад кожу, чтобы разоблачить нетронутыми брюшной полости и грудной стенки, сделать боковой разрез через брюшину и акцизных мембраны.
- Поднимите грудины и тщательно надрезать диафрагмы, будьте уверены, чтобы не мешать нижней полой вены (IVC). Переместить в сторону органов желудочно-кишечного тракта и найдите subhepatic мкВ. Используйте гемостатический пинцет для зажима suprahepatic IVC поддерживать локализованные перфузии.
Примечание: Чрезмерное накопление висцеральных белой жировой ткани часто может маскировать мкВ. Чтобы лучше визуализировать это судно, можно вырезан небольшой площади жировой ткани рядом с мкВ. Резаная окна в пределах податливой жировой ткани затем может располагаться над IVC подвергать судно для катетеризации. - Прикрепите шприц, заполнены с подогретым PB в наборе сбора и вливания крови 23 G. Осторожно нажмите на поршень, до тех пор, пока иглы и трубки заполнены с PB.
- Вставьте иглу 23 G, параллельно с уровня subhepatic мкВ. Безопасности иглы на месте с помощью гемостатический зажим 4 см.
Примечание: Катетеризации subhepatic, которую IVC предпочтителен в диете кормили мышей в том, что может быть лучше мкВ визуализируется и канюлированной внутри полости заполнены жира. - Осторожно нажмите на поршень начать перфузии, цвет будет быстро избавиться от печени (правой доли сначала) если игла надлежащим образом позиционируется в сосуде. Увеличение долей также является видимым, если иглы правильно вставлена в subhepatic мкВ.
- Быстро вырежьте воротной вены, чтобы позволить PB свободно течь через печень.
- Perfuse печени, до тех пор, пока кровь больше не видна. По случаю мягко массаж печени долей между передний план палец и большой палец, чтобы облегчить перфузии.
Примечание: Важно использовать-зубчатые тупыми краями инструменты для обработки для предотвращения повреждения тканей печени. - Когда 5 мл PB остается в шприц, измените на шприц, заполнены с подогретым диссоциации буфера. Не беспокоить положение обеспеченных иглы в это время.
Примечание: Увеличена печень, который значительно превышает 1,5 g следует увлажненную с больший объем буфера подогретым пищеварение гарантировать успешный печени диссоциации. - Perfuse печени пока не полностью переваривается. Мягко массаж печени лопастями для облегчения перфузии.
Примечание: Разделение Глиссон в капсулу из паренхимы является наблюдаемая в успешно усваивается печенью. Оценить это, используйте тупой край пару щипцов, аккуратно нажмите на левой боковых лепестков. Впечатление должен появиться на поверхности и отступ следует заполнить медленно после удаления щипцы. - Удалите иглу из subhepatic мкВ. Не удаляйте гемостатический пинцет, пережатия suprahepatic мкВ.
- Акцизный весь печени тщательно разрубом через соединение связок, используя короткие прямые лезвия, рассекает ножницы и удаление желчного пузыря.
- Поместите весь печени в чашке Петри 10 см содержащие 10 мл ледяной сохранения буфера и хранить при 4 оC до готовы освободить клетки.
- Диссоциации клеток печени
- Передача печени в 10 см блюдо, содержащие 10 мл ледяной DMEM.
- Захват разорвала suprahepatic, придаваемое IVC подакцизным печени с помощью зубчатого щипцами. Используйте средней точки щипцы выпустить клетки от Глиссон капсулы, применяя поглаживание быстрое движение для каждого лепестка.
- Передайте насыщенных DMEM через стрейнер ячейки 70 мкм, придают коллекции Тюбик 50 мл.
- Накапайте 10 мл ледяной DMEM Петри 10 см и повторите шаги 1.2.4.1 для 1.2.4.3 до насыщения СМИ больше не наблюдается. Место суспензию клеток на льду или на 4 ° C.
- Аккуратно перемешать суспензию клеток, инвертирование трубки коллекции и затем центрифуги на 54 g x 2 мин при 4 ° C.
- Соберите супернатант в коллекции чистый 50 мл трубки. Затем центрифуга суспензию клеток в 54 g x 2 мин при 4 ° C.
- Повторите шаг 1.2.4.6 еще два раза, прежде чем перейти к шагу 1.2.4.8.
- Супернатант передать трубку чистой 50 мл коллекции и центрифуги суспензию клеток на 300 g x 10 мин при 4 ° C.
- Вновь приостановить гранулы не Паренхиматозный клеток в буфере СУИМ и считать их в Burker камере/Горяева.
- Передачи 1 x 106 клеток (для основных проточной цитометрии) или 15 x 106 - 20 х 106 клеток (для СУИМ) помечены 5-мл раунд дно из полистирола трубы. Продолжить к разделу 2 для проточной цитометрии пятнать протокол.
- Аорта изоляции и разобщенности
Примечание: Этот протокол был адаптирован от мясникаet al.26- Подготовка тканей конкретных буферов, основанный на рецепты, приводятся в таблице 1 и хранить их, как описано.
- Подготовьте следующие реагентов.
- Подготовьте буфере пищеварение, оттаивания соответствующий объем буфера диссоциации Ват и хранить при 4 ° C до использования. Непосредственно перед применением теплый буфера до 37 ° C.
- Приготовляют раствор гепарина 10 x, растворяя гепарина натриевой соли в однократном ПБС в концентрации 200 ед/мл. Развести 10 x Стоковый раствор гепарина с ПБС подготовить 1 x Гепарин раствор. Магазин 10 x и 1 x решения гепарина на 4 ° C до использования.
- Подготовьте СУИМ буфер с ПБС, содержащий 2% FBS.
- Дисекция аорты
- Усыпить мышь в камере двуокиси углерода заполнен и полоскания с 70% этиловом спирте.
- Место вентральной стороне мыши вверх на сцене рассечение, распространение мыши передний и задние лапы и закрепите их в Правление рассечение, с помощью иглы 21 G.
- Сразу же после euthanizing мыши, выполните сердца прокол. Обратитесь к шагам 1.3.3.4 для 1.3.3.9, в случае необходимости.
- Найдите мечевидного отростка в нижней части грудины
- Сделать это, Поместите палец медианы по ширине шею животного. Трассировки вдоль вентральной midline от шеи в хвостовой конец грудины, пока не почувствовал хрящевой расширение.
- Используйте корнцанг средней точки понять хрящевой расширение и при необходимости отметьте место мечевидного отростка, удалив патч волос или кожи в зоне.
- Частично Вставьте иглу 26 G под мечевидного отростка под углом 20-30°.
- Осторожно применять отрицательное давление в шприц сняв поршень медленно, а затем вставить иглу далее в полость до потоки крови.
- Если поток крови останавливается, медленно поверните иглу или переместить слегка в и вне.
- Использование пара щипцы захватить провести брюшной кожи предшествовавшие уретры открытие и использовать рассечения острыми ножницами отрезать вдоль вентральной midline через брюшины от паха до подбородка.
- Потяните кожу, чтобы разоблачить органов брюшной полости и грудной клетке с пальцами или тупым щипцами осторожно двигаться органов брюшной полости в сторону.
- Используйте корнцанг захватить провести мечевидного отростка, поднимите грудины и надрезать диафрагмы.
- Рассечения ножницами, вырежьте через боковые ребра с обеих сторон. Сжимать грудину, флип грудную клетку вверх и прорваться через смежные базы. Удаление грудной клетки, подвергая основных органах грудной клетки.
- Perfuse аорты с 26-иглы придает 10 мл шприц, заполнены с 1 x Гепарин раствор путем инъекций 1-2 мл раствора в левом желудочке сердца (LV).
Примечание: Не забудьте perfuse медленными темпами с минимальное давление для обеспечения нетронутыми атеросклеротических поражений аорты. - Акцизы, вилочковой железы, легких и соединительной ткани. Обратитесь к шагам, 1.3.3.16 и 1.3.3.17, в случае необходимости.
- Предшествовавшие сердце найти белый двухлопастную (или бабочка форме) органа и твердо захватить провести тимуса пинцетом. Потяните вверх обеих долях от полости и сократить на базе с ножницами.
- Для удаления легких, щепотку доли легких с щипцами, потяните ткань от грудной полости и сократить на базе. Повторите для каждой оставшейся доли.
- Используйте микроскопом диссекции и микро Рассекающий инструменты и собирать аорты арки (включая безымянной артерии, левую общую сонную артерию и левой подключичной артерии), по возрастанию, по убыванию, грудной и брюшной аорты.
- Найдите восходящей части аорты в левый желудочек сердца.
- С парой изогнутые 0,07 х 0,04 мм наконечник щипцы нежно обхвати часть восходящей части аорты, выходящих из левого желудочка.
Примечание: По сравнению с окружающих желтым оттенком жировой ткани, аорты будет яркий белый судна, возникая от LV, когда достаточно промыть раствором гепарина.- Если аорты не был должным образом покраснел от сердца перфузии, флеш аорты снова в то время как аорты остается подключенным к полости. Чтобы сделать это, сократить около перекрестка сердца аорта, удалить сердце и затем разрезается горизонтально через нижний конец брюшной аорты. Вставьте иглу 26 G в открытии восходящей части аорты и осторожно промойте аорты с 1 x Гепарин раствор.
- Аккуратно буксир на восходящей части аорты лучше различать между жировой ткани и внедренного аорте.
- По-прежнему осторожно потянув на восходящей части аорты, используйте кончик закрытых весны, рассекает ножницы для очистки жира, которые инкапсулируют восходящей аорты и дуги аорты. Чтобы сделать это, инсульт жировой ткани с кончик лезвия закрытыми ножницами оторвать соединения жира.
Примечание: Воздерживаться от иссечения любой жировой ткани путем разрезания до восходящей аорты и дуги могут быть четко визуализированы. Это необходимо для предотвращения резки аорты. - Если восходящей аорты и дуги могут быть четко от объемного жировой ткани, используйте весной, рассекает ножницы для акцизных избыточного жира.
- Аккуратно схватить аорты с щипцами. Снова с помощью ножниц весной кончика, инсульта в жир по длине по убыванию, грудной и брюшной аорты в хвостовой конец брюшной аорты, так на правой стороне рукав жира.
- Продолжать понять вдоль аорты, когда отрыв жир. Не забудьте сделать так нежно, чтобы предотвратить повреждение аорты.
- Осторожно потяните аорты вверх к Микроскоп, так, что жир теперь располагается позади аорты.
- Вставьте лезвия закрытыми ножницами между интерфейсом жир аорты в конце передней нисходящей аорты, тяжелой жировой ткани привязанность к поверхности аорты, тупо используя радикальные движения.
Примечание: Тщательно удаление избыточного жира и соединительные ткани в то время как аорты находится все еще в полость рекомендуется. - Акцизный сердце и режут на хвостовой конец брюшной аорты поперечно. Удалите весь аорты.
- Аорты в 35 мм блюдо и дразнить прочь любые излишки жира на аорте, используя две иглы 21-го калибра. Место подакцизным аорты в пробки microcentrifuge 1,7 мл на льду.
- Диссоциация аорты в одну ячейку суспензий
- Накапайте 0,2 мл аорты диссоциации буфера трубка, содержащая аорты. Вставьте лезвия ножниц весной направлении конической трубки и быстро фарш аорты для облегчения ферментативного пищеварения.
- Передача смеси ткань решение в 15 мл коллекции трубки и пипетки 1.8 мл аорты диссоциации буфер для общего объема 2 мл.
Примечание: Для легкой передачи ткани подвески, вырежьте 1 см конический конец стандартный наконечник пипетки 1000 мкл. Для переноса подвеска с микропипеткой используете кончик сокращен. - Инкубируйте фарш аорты в буфере диссоциации аорты 55 минут при 37 ° C, тряски на 220 об/мин (0,514 x g).
- Передайте подвеска через сито ячейки 50 мкм в 15 мл полипропиленовые коллекции. Для облегчения фильтрации используйте резиновые поршень поршень шприца.
- Промойте трубку коллекции 15 мл с 1 мл СУИМ буфера, собирать подвеска и проходят через сито ячейки.
- Промойте ситечко ячейки 50 мкм еще два раза с 1 мл СУИМ буфера.
- Пелле клетки центрифугированием при 300 g x 5 мин при 4 ° C. Вновь приостановите клетки в холодных СУИМ буфера. Подсчитать ячейки в Burker камере/Горяева.
- 1 x 10-6 (для основных проточной цитометрии) клетки или приостановление всей ячейки (для СУИМ) передавать помечены 5 мл раунд дно из полистирола трубы. Продолжить к разделу 2 для проточной цитометрии пятнать протокол.
2. поток цитометрии и СУИМ пятнать
| Флюорофор | R-фикоэритрин (PE) | PE/цианиновые (Cy) 7 | PE/цианиновые (Cy) 5 | Тихоокеанский синий (PB) |
| Лазер (Нм) | Синий (488 нм) / желтый (561-570 Нм) - зеленый (532 нм) | Синий (488 нм) / желтый (561-570 Нм) - зеленый (532 нм) | Синий (488 нм) / желтый (561-570 Нм) - зеленый (532 нм) | Фиолетовый (405 нм) |
| ВозбужденияМакс (Нм) | 496 | 496 | 496 | 401 |
| ВыбросовМакс (Нм) | 578 | 785 | 667 | 455 |
| Фенотипические маркер | F4/80 | CD11c | CD11b | CD45 |
| EMR1, Ly71 | Интегрин αX, Интегрин αX цепи, CR4, p150, ITGAX | ΑM Интегрин, Mac-1, МО1, CR3, Ly-40, C3biR, ITGAM | T200, Ly-5, ДМС | |
| Тип целевой ячейки | Ткани-резидентов макрофаги | Макрофаги классически активированные (M1) | Моноцитов / макрофагов | Лейкоциты (макрофагов / гранулоцитов, моноцитов и лимфоцитов) |
| Подмножество дендритных клеток | Дендритные клетки, клетки, активация Т-клеток и подмножество кишечных интраэпителиальных лимфоцитов (IEL) | Гранулоцитов, дендритные клетки, клетки и подмножества T и B клеток | ||
| Коэффициент разрежения | 1:50 | 1: 100 | 1: 100 | 1: 100 |
| Isotype элементы управления | PE крыса IgG2a | Армянский хомяка PE/Cy7 IgG | PE/Cy5 крыса IgG2b | Тихоокеанский синий крыса IgG2c |
Таблица 2: Список Флюорофор меткой антител специфических для требовательных ткани-резидентов макрофаги.
- Собрать и подготовить следующие пункты: СУИМ буфера 5 мл раунд дно полистирола трубы, анти мыши CD16/32 Fc рецепторов блокируют антитела, Флюорофор конъюгированных или неконъюгированной первичных антител, конъюгированных Флюорофор вторичные антитела (если необходимо), 1 x фосфат амортизированное saline (PBS).
Примечание: Для окрашивания больших количеств клеток, концентрация антител является наиболее важных, а не номер ячейки. Например если окрашивание 10 х 106 клеток окрашивание объем буфера и антитела концентрация должна быть такой же, как если окрашивание 1.0 x 106 клеток в объеме 100 мкл буфера. Для окрашивания 1.0 x 10 рекомендуется8 клеток, увеличивая количество антител 5 раз. - При необходимости добавьте дополнительные ледяной СУИМ буфер для каждой трубы СУИМ, Пелле клетки центрифугированием в 751 x g 5 мин (4 ° C). Аспирационная супернатанта следующие центрифугирования.
- Добавление анти мыши CD16/CD32 Fc рецептор блокирование антитела для всех образцов в соответствии с инструкциями производителя. Инкубируйте 15 мин при температуре 4 ° C или на льду.
- Добавьте Флюорофор конъюгированных основное антитело коктейль непосредственно с Fc-рецепторами блокирующих антител содержащих клеток подвеска и инкубировать образцы на 4 ° C на 30 мин образцы защищать от света к минимуму обесцвечивания Флюорофор конъюгированных антител.
- В случае, если были использованы неконъюгированной первичных антител, выполните следующие действия после завершения Шаг 2.4.
- Основное антитело мыть окрашенные образцы центрифугированием в 751 x g 5 мин (4 ° C).
- Удалить супернатант сцеживать и вновь приостановить Пелле в 100 мкл буфера СУИМ.
- Добавить все необходимые образцы конъюгированных вторичные антитела и Инкубируйте 30 мин при 4 ° C. Перейдите к шагу 2.5.
- Следующие Антитело инкубации, добавить 2 мл, лед холодной СУИМ буфера, а затем Пелле клетки в 751 x g 5 минут (4 ° C). Декант супернатант и будьте уверены, чтобы не мешать Пелле.
- Осторожно перемешать клетки вновь приостановить с 200-400 мкл буфера СУИМ, а затем сохранить это в темноте при температуре 4 ° C до стандартного потока cytometry анализ или сортировки клеток.
- За короткий срок фиксации окрашенных клеток переходите к 2.8 шаги до 2,10. Для стандартных проточной цитометрии только используйте фиксацию.
- Сразу же после шаг 2.5, вновь приостановить клетки в 0,5 мл 2-4% параформальдегида (PFA) для 15-30 мин в 4 ° C.
Примечание: Осторожно: PFA является известный раздражителем с токсичных и канцерогенных эффектов. При использовании PFA, обращаться с крайней осторожностью. Убедитесь в том использовать надлежащие средства личной защиты и вытяжной вентиляции. - После записи, вымыть клетки путем добавления 2 мл СУИМ буфера для всех образцов и центрифуги на 751 x g в 4 ° C за 5 минут удалить супернатант следующие центрифугирования.
- Ресуспензируйте фиксированные клетки в 200 мкл лед холодной СУИМ буфера и хранить при 4 ° C. Магазин исправить клеток до 1 недели при температуре 4 ° C, идеально выполняют потока цитометрии приобретения в течение 48 часов, чтобы свести к минимуму аутофлюоресценция.
- Приобретать цитометрии потока данных согласно инструкции производителя потока цитометр или выполнение сортировки флуоресцентные активированных клеток, как описано на басу и др. 23
Результаты
При использовании аполипопротеин E недостаточным (ароЕ KO) C57BL/6 (BL6) мышей поддерживается на высоких жиров высокий холестерин диета (HCHFD или HCD) для 18 недель, 1 x 10-4 - 2 х 104 CD45 F4/80+ +аорты макрофаги могут быть изолированы, когда две пробы в пуле. Печень, расчлененный от HFHCD-кормили ароЕ KO мышей, производится больше, чем 5 x 105 сортировка клеток Купфера (которых зависит время сортировки). При использовании высоких жиров (HFD) кормили мышей C57BL/6 дикого типа (WT), 5 x 105 до 1 x 106 -резидентов жировой ткани макрофагами (банкоматов) могут быть отсортированы от стромальные сосудистой дроби (СФДВ). Отмечалось общее количество макрофаги, которые могут быть отсортированы от данной ткани был достаточным для выполнения анализа выражения гена с использованием количественных реального времени полимеразной цепной реакции (ПЦР). Для тканей, где восстанавливаются меньше количества макрофагов населения, например аорты рекомендуется использовать совместно выделений (например, гликоген) и ночь осадков при изолировать РНК необходим для таких анализов.
Здесь эффекты диеты индуцированной метаболических расстройств на фенотип макрофагов с использованием основных потока цитометрии, активируемых флуоресценции клеток сортировки (FACS) и сортировки вниз по течению пост приведены анализы. Эти выводы подтверждают ранее опубликованных замечания, что мышей кормили HFD или HFHCD выставку увеличилось проникновение классически активированных макрофагов (M1) в пораженных тканей, таких как аорты (рис. 1B). Воспользовавшись проточной цитометрии, СУИМ и профилирование выражение гена (через количественные полимеразной цепной реакции (ПЦР), главенствующее фенотипом для Рон рецепторов тирозин киназы выражая CD45 F4/80+ + макрофагов, полученных от тканей, изолированные от диеты кормили мышей наблюдалось. Рон рецептор выражая аорты макрофаги, которые продемонстрировали противовоспалительные фенотип были снижены в HFHCD-кормили мышей (Рисунок 1 c и D). Отсортированный Рон рецептор выражая макрофагов, производный от переваривается аорты продемонстрировали увеличение arginase 1 экспрессии генов (Arg1), который является устоявшейся маркер макрофагов м2 (Рисунок 1E). Про воспалительных макрофаги, которые были охарактеризованы как CD45 F4/80+ CD11c+ + были увеличены в аорты, изолированные от HFHCD-кормили мышей (Рисунок 1B и D). Характеризующие печени резидентов макрофаги далее разъяснил преобладающих фенотип Рон рецептор выражая субпопуляций (рисунок 2A). CD11c + про воспалительных макрофагов населения продемонстрировал снижение экспрессии генов, которые прочно ассоциируется с противовоспалительными (м2) фенотип как Arg1 и Рон (рис. 2B). Аналогичные тенденции наблюдались в популяциях макрофагов, изолированных от переваривается белой жировой ткани (рис. 3). Макрофагов населения с про воспалительных подписью показали уменьшение поверхности выражение Рон рецептора (рис. 3). Сочетание подходов, основные проточной цитометрии и СУИМ, привело убедительных данных, которые далее проверяет рецептор Рон как регулятор альтернативных (м2) активация макрофагов32. Было показано, что такой уклон в сторону противовоспалительные фенотип (м2) играть защитную роль в развитии и прогрессировании ожирение, атеросклероз и стеатогепатит31.

Рисунок 1: Характеристика макрофагов, изолированных от диссоциированных аорты удалены от KO ароЕ мышей, поддерживается на HCD 18 недель. (A) клетки были впервые воротами на CD45+ лейкоцитов, исключая сотовой мусора. (B) CD45 пятнать в сочетании с F4/80 используется для разграничения двойной положительный населения предположительно макрофагов. Дополнительные стробирования был использован для демонстрации процент CD11c+CD45+F4/80+ (M1) и (C) Рон+CD45++ (потенциальные м2) F4/80 макрофаги в аорты, производный от мышей кормили на либо Чоу нормальный или высокий холестерин диета для 18 недель. (D) увеличение доли CD11c+CD45++ (M1) F4/80 макрофагов, а также снижение процентной Рон+CD45++ (потенциальные м2) F4/80 макрофаги были замечены в аорты производные от мышей кормили HCD, по сравнению с мышей кормили нормальной Чоу диету. (E) гена анализ выражения сортировки Рон+CD45+F4/80+ макрофаги продемонстрировал увеличение выражение arginase I (известным мышиных маркер м2). Значения были получены с помощью анализа t тест студента с использованием программного обеспечения для статистического анализа и представлены как средний ± SEM. P < 0,05 считался статистически значимой (* P < 0,05, *** P < 0,001). Рисунок был изменен с ю. и др. (2016) 31. пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.

Рисунок 2: Джин стенограмма профилирование популяции клеток Купфера, отсортированный от переваривается печень расчлененный от KO ароЕ мышей, поддерживается на HCD 18 недель. (A) общая схема стробирования характеризующие и сортировки популяции клеток Купфера. (B) анализ выражения гена отсортированных Рон, выражая (Ron+) и не выражения (Ron–) CD45 F4/80+ +макрофагов, Количественная ПЦР. Студента t тест анализ проводили с помощью статистического программного обеспечения и значения были представлены как средний ± SEM. P < 0,05 считался статистически значимой (* P < 0,05, *** P < 0,001). Рисунок был изменен с ю. и др. (2016) 31 . Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
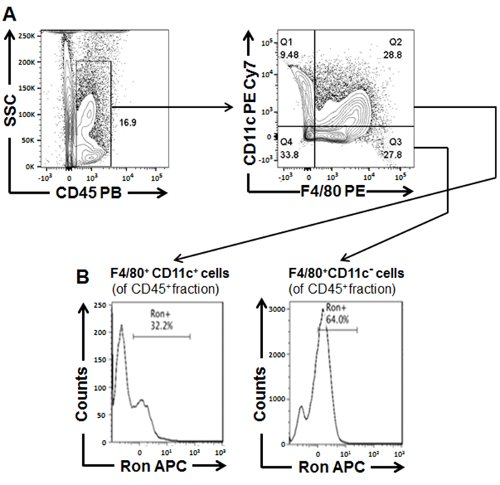
Рисунок 3: Характеристика банкоматов, изолированных от белой жировой ткани, расчлененный от WT BL6 мышей кормили HFD 18 недель. (A) общая схема стробирования характеризующие и сортировки жировой ткани производных макрофагов населения (Б) процент из Рон + клеток в пределах CD45+F4/80+CD11c– и CD45 F4/80+CD11c++ населения макрофагов, отсортированный от Ват. Рисунок был изменен с ю. и др. (2016) 31 . Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
Обсуждение
Чтобы лучше понять глубинные механизмы прогрессирования заболевания широко используются модели диета индуцированной метаболические расстройства, которые имитируют сопутствующие заболевания, таких как атеросклероз, простой стеатоз, стеатогепатитом и диабета типа 2. Коллагеназы зависимых пищеварение часто используется для отмежеваться тканей освободить клетки от16,внеклеточного матрикса (ECM)27. Ферменты, такие как коллагеназы нарушить коллагена, который обеспечивает структурную поддержку для соседних клеток. Структурный состав ткани диктует ткани матрицы жесткость (сопротивление деформации) и какой сырой коллагеназы товара является наиболее эффективным в обеспечении успешного ECM срыв28. Ват, который состоит из «мягкой матрицы» часто переваривается с коллагеназы типа II освободить адипоциты и резидентов иммунные клетки при одновременном сохранении целостности клеток поверхности инсулина рецепторов29. Микроархитектура фибриллярных компонентов аорты способствует к «жесткой матрице», для которого эффективное аорты пищеварение с типом коллагеназы XI (которая имеет наибольшая активность коллагеназы) используется в сочетании с дополнительные ферменты. В отличие от аорты печени пищеварение использует коллагеназы с слабее ферментативной активностью, коллагеназа типа IV, чтобы сорвать матрицы и освободить жизнеспособных клеток Паренхиматозный и не Паренхиматозный30. Хронически воспаленных тканей производным от диеты кормили дикого типа или аполипопротеин E недостаточным (ароЕ KO) мышей на C57BL6 фон часто проходят ремоделирования, что может помешать правильной ферментативного пищеварения. Этот раздел будет обсуждать стратегии сведения к минимуму или исключить возможность неправильного ткани диссоциации и низкой сотовый восстановления.
Общей чертой всех тканей, полученных от моделей диета кормили мышей, которые имитируют ожирение, атеросклероз, и/или Безалкогольные жирная болезнь печени, является атипия тканей ремоделирования. В белой жировой ткани, аорта и печени изменяется состав ECM, часто приводит к чрезмерной осаждения фибриллярного компонентов, таких как коллагены. Мышей дикого типа C57BL6, поддерживается на высоких жиров 18 недель, опыт ткани конкретных аномалии, такие как расширение белой жировой ткани и расширен жирная печень (простой стеатоз). Часто времена эти метаболические функции являются не хлопотно препятствия во время процесса диссоциации ткани. С другой стороны в других диета индуцированной моделей, которые отражают более усугубляется фенотипов, обширной реконструкции ткани может создать проблему во время пищеварения ткани. HFHCD, кормили мышей ароЕ KO, часто используется для модели атеросклероза и стеатогепатит. Общей чертой, связанные с передовых стеатогепатит является чрезмерного осаждения ECM в печени (или фиброз). Фиброзных печени было показано, чтобы быть весьма проблематичным в течение ферментативных ткани диссоциации и часто производит низкой сотовый доходность31. Чтобы улучшить урожайность клеток, важно, что протоколы пищеварения следовать без отклонений. Хотя нормальный печень может быть фарша и погружена пищеварение буфера для достижения диссоциации, перфузии с буфером пищеварение максимизирует контакта между внеклеточного матрикса печени и коллагеназы решения; и поэтому настоятельно рекомендуется этот подход. Кроме того 20-30 мл буфера пищеварение часто является адекватной тома для успешного диссоциации нормальной печень; Однако в отношении мыши модели, которые развиваются расширенного или фиброзных печень, перфузии с 50 мл буфера пищеварения предпочтителен для обеспечения правильного пищеварения при сведении к минимуму гибели клеток. Печень с весами, которые значительно превышают 1,5 g для обеспечения успешной переваривание рекомендуется увеличить объем буфера пищеварения.
| Ткани | Проблема | Возможная причина | Решение |
| Белой жировой ткани (Ват) | Диссоциация бедных ячейки | Плохое пищеварение | Убедитесь, что буфер пищеварение в 37° C |
| Смерть клетки | Чрезмерная коллагеназы пищеварение | Сократить время пищеварения | |
| Уменьшить объем буфера пищеварения | |||
| Аорта | Диссоциация бедных ячейки | Плохое пищеварение | Убедитесь, что буфер пищеварение при 37 ° C |
| Аорта штук в буфере пищеварение были слишком большими | Убедитесь, что аорты является нарезать примерно 1 мм | ||
| Аорта штук не тряслись в буфере диссоциации во время инкубации | Убедитесь, что части аорты тряску в решении пищеварение | ||
| Смерть клетки | Чрезмерная коллагеназы пищеварение | Сократить время пищеварения | |
| Уменьшить объем буфера пищеварения | |||
| Печень | Диссоциация бедных ячейки | Плохое пищеварение | Убедитесь, что буфер пищеварение при 37 ° C |
| Увеличить объем буфера пищеварения | |||
| Неправильное катетеризации IVC (отек тканей, окружающих IVC происходит) | Будьте уверены, что иглы правильно вставлена в МКВ | ||
| Разорванные IVC | Надлежащей безопасности иглы в МКВ до перфузии | ||
| Уменьшить скорость перфузии | |||
| Разорванные ткани | Уменьшить скорость перфузии | ||
| Смерть клетки | Неправильное освобождение клеток от Глиссон капсулы | Будьте уверены, чтобы отделить клетки от капсулы с использованием ранее обсуждали, поглаживая метод | |
| Чрезмерная коллагеназы пищеварение | Сократить время пищеварения | ||
| Уменьшить объем буфера пищеварения |
Таблица 3: Устранение неполадок неудачной ткани диссоциации. Поток цитометрии основе сортировки клеток или СУИМ – это мощный метод для изоляции клеточных популяций, где необходима высокочистых. При очистки ячеек путем сортировки клеток, достижения высокой ячейке урожайность, но и своего рода высокой чистоты требует использования надлежащей стратегии сортировки. В этом разделе методы для улучшения multi Флюорофор потока, сортировки на основе цитометрии клеток ткани, описаны резидентов макрофаги, производные от диеты кормили мышей. Для изоляции различных тканей-резидентов макрофаги выбор поверхности маркер является важным шагом. Макрофаги, производные от Ват, аорта и печени являются часто отличается использованием CD45+, CD11b+, F4/80+ стробирования стратегии. Дополнительный поток гранулярных панели могут использоваться для определения резидентов макрофагов ткани. Эти группы включают антитела которые зонд для поверхности выражение макрофагов конкретных гликопротеинов (CD64, CD68 и CD14), гистосовместимости комплексов (MHCII) и apoptotic клетки тирозин киназы рецепторов (MerTK)32, 33. фенотип конкретные макрофага можно затем определила путем прощупывания для селективного поверхности выражение м2 (CD163, CD209 и CD206) или M1 маркеры (CD38, CD40, CD80 и CD86)34,35. Auto флуоресценции порожденных липидов Ладена макрофагов может вызвать некоторые вопросы при стробирования населения. Использование антител отмеченных флуорохромов, которые возбуждаются желто зеленый лазер (например, ПЭ, ПЭ/Cy5, PE/Cy7) или красный лазер (например, СВУ, СВУ Cy7) приводит к испускаемого флуоресценции, что значительно ярче, чем auto флуоресценции и таким образом можно улучшить результаты36. При выборе Флюорофор конъюгатов с такой высокой окрашивание индекс и потенциал выбросов спектры перекрытием, включение соответствующих механизмов контроля имеет решающее значение. При определении границ стробирования, включение одного пятна (SS) и изотипа элементы управления позволяют для разграничения населения положительных/отрицательных и измерения неспецифической фонового сигнала, вызванные первичных антител, соответственно 37. для обстоятельств, где клетки не хватает, мы рекомендуем использовать компенсацию частиц для элементов управления СС и изотипа. Компенсации частицы обычно выделяют ярче сигналов, чем биологического контроля и также имеют меньше вероятных погрешностей в флуоресцировании фон. Кроме того флуоресценции минус один (FMO) элементы управления являются идеальными для разграничения границ стробирования. Включая контроль FMO, максимум флюоресценции, ожидаемый для подмножества загрязняющими раскрывается в данного канала флюрохром тегами антител специфических для этого конкретного флуоресценции канала при изоляции38. В нашем опыте, кроме одного окрашенных компенсации частиц элементов управления элемент управления неокрашенных биологического сравнения должны быть включены для установления более точных границ положительная/отрицательная.
Исключая сотовой мусора и агрегаты клеток в шлюзовой стратегии является также еще один подход используется для сведения к минимуму auto флуоресценции. Чтобы отличить сотовой мусора от населения жизнеспособных клеток, используя вперед точечной (FSC) и стороны точечной (SSC) является наиболее распространенным стробирования стратегия. Для изолированных клеток, которые будут использоваться для анализа пост сортировки и требуют более высокой жизнеспособности для экстракции ДНК/РНК рекомендуется не использовать жизнеспособности пятна с любой фиксации и/или permeabilization процедурами. Формальдегид фиксации клеток может подорвать целостность нуклеиновой кислоты вследствие нуклеиновых кислот белка сшивки и таким образом ограничить эффективность изоляции, обнаружения и точного количественного определения. Клетки агрегатов как упоминалось ранее не только способствовать излучаемых сигналов авто люминесцентные, но и привести в «совпадение прерывания». Такие действия происходит для поддержания высокой чистоты в своего рода, но если слишком часто, это уменьшает выход сортировки клеток. Сортировки буферу (СУИМ) дополнены DNAse и MgCl2 во время окрашивания клеток можно свести к минимуму агрегации клеток. Рекомендуется не использовать в сочетании с DNAse ЭДТА, как он подавляет активность фермента. Фильтрация одноклеточного подвеска через стрейнер ячейки 70 мкм до сортировки может также освободить клетки из агрегатов. Важно отметить, что для сведения к минимуму агрегации, клеточных суспензий должно быть в концентрации 5 миллионов клеток / мл в минимальный объем 0,4 мл. Клетки изолированы от Ладена липидных тканях, как правило, более склонны к агрегации и это может привести к совпадению прерываниями и урожайность низкая сортировки. Рекомендуется, что образцы далее разводят если агрегации сохраняется. Отсортированный макрофаги могут быть собраны в полипропиленовые коллекции раунд дно пробирки, содержащие плода говядину богатые среднего для максимального восстановления клеток. Первоначальный высокая концентрация FBS обеспечивает восстановление клеток, поскольку концентрация в конечном итоге становится разбавляют каждого отсортированного капелька. Для сбора клеток, которые будут использоваться для анализа ДНК или РНК, клетки могут быть отсортированы непосредственно в соответствующие извлечения реагент (например Тризол) для предотвращения загрязнения РНКазы. При сортировке больших объемов, сортировка клеток сначала в культуре средств массовой информации, с более низкой концентрации FBS, рекомендуется. Сразу же после сортировки, клетки следует затем гранулированных и анализироваться для экстракции ДНК/РНК. Изолированные генетический материал затем можно выполнить профилирование для экспрессии измененных генов. Про воспалительных генов, включая TNFα, IL1-β, IL-6, Ил-12, 1 Л-23, IFNγ, Nos2 и MCP1 (CCL2), часто upregulated в макрофагах, экспонируется классически активированные фенотип (M1)39. С другой стороны, альтернативно активированные фенотип (м2) в макрофагах часто характеризуется индукции генов, кодирующих Chi3l3 (Ym1), Fizz1, Arginase 1, CD206, CD163, CD209 1L-10 и TGFβ34,40. Недавно как M1-специфических генов и c-Myc и Egr2 как M2-специфических генов34были подтверждены CD38, Fpr2 и Gpr18.
Хотя многоцветные потока на основе цитометрии ячейку Сортировка является ценным инструментом для изоляции макрофагов в высокой степени чистоты, этот подход может быть дорогостоящим. Мощный преимущества СУИМ опосредованной сортировки зависит от персонала операций, которые может маневрировать клетки сортировщик в дополнение к высокой стоимости клеток сортировщик обслуживания реагентов. Альтернативные подходы могут использоваться в замену дорогостоящих потока цитометрии основе сортировки клеток. Они включают в себя магнитные активированных клеток, сортировка (Mac) или плотность градиентного центрифугирования. Первый альтернативный клеток, сортировка упомянутый метод охватывает магнитные или microbead столбец изоляции наборы для разделения клетки интереса от крови или твердых тканей41. Во вторую ячейку Сортировка подход отделяет неоднородной ячейки подвеска, основанный на плотность и силу центрифугирования. К сожалению, плотность при посредничестве центрифугирования не является практичным для изоляции макрофагов из аорты или Ват, полученных одноклеточного суспензий. Зачастую продукт, полученный из дифференциального центрифугирования загрязнена и низкой урожайности. Следовательно меньше тканей (таких как аорты или Ват), которые приводят к несколько клеток, изначально после ферментативного пищеварения не являются идеальными кандидатами для дифференциального центрифугирования. С другой стороны клеточных суспензий, производные от диссоциированных печень может производить достаточное количество отсортированных макрофаги, которые могут использоваться в пост рода экспериментов и анализа культуры стимуляцию, ПЦР или западных blotting анализа. Эти альтернативные подходы могут также использоваться для обогащения населения до СУИМ, позволяя более чистых видов. Следует отметить ткани-резидентов макрофаги составляют небольшой процент населения всей ячейки в Ват, печени и аорты. Обогащение клеток до сортировки СУИМ была подход используется, когда изоляция популяций клеток которых менее частыми. Один из вопросов, который является общим в изоляции небольшой численностью населения является что крупноклеточный, что числа должны быть обработаны для получения достаточно клеток для последующего анализа. Обогащение или предварительная сортировка может использоваться для решения такой проблемы. Этот метод помогает в получении более кратким популяция клеток подборку положительных и отрицательных, но она также позволяет Сохранение времени как СУИМ сортировки может быть прочный процесс для плотных тканей источников, таких как печень.
Последние достижения в биологии воспаление подчеркнуть важное значение фенотипических и функциональные характеристики неоднородности макрофагов для углубления понимания сложной роли этих иммунокомпетентных клеток в регулировании хронического воспаления. Короче говоря этот всеобъемлющий протокол обеспечивает многомерный подход к характеристике резидентов макрофаги из трех отличительной тканей учился в установленных диета индуцированной ожирения и модели воспаление тканей. Что еще более важно этот протокол принимает во внимание трудности и меры, необходимые для изолировать чистой одного клеточных суспензий от dysregulated воспаленных тканей, таких как Ват, аортальный бляшек и жирная печень. Протокол позволяет исследователю применять проточной цитометрии и сортировки инструменты СУИМ в инновационный аспект характеризовать ткани-резидентов макрофаги, ключевые регуляторы воспаления в ожирение. Углубленная характеристика динамики народонаселения макрофагов может обеспечить понимание Моноцит людьми в воспаленных тканях и разрешить продолжение механистический оценок через множество экспериментальных подходов на сортированном макрофагов. Дальнейшее характеристика населения Макрофаг может обеспечить решающую понимание биологических основ, которые регулируют неоднородность макрофагов в здоровье и болезни.
Раскрытие информации
Авторы имеют никакого конфликта интересов раскрыть.
Благодарности
Мы хотели бы поблагодарить объекта потока Core цитометрии в Пенсильвании государственного университета тысячелетия науки комплекса.
Материалы
| Name | Company | Catalog Number | Comments |
| 26 G x 5/8 in Needles | BD | 305115 | |
| 23 G x 0.75 in needle x 12 in. tubing Blood Collection Set | BD | 367297 | Used for cannulation of subhepatic IVC during liver perfusion |
| 21 G 1 1/2 in. Needles | BD | 305156 | |
| 1 mL syringe with rubber stops | BD | 309659 | |
| 10 mL Syringes | BD | 309604 | |
| 1 mL Syringe | BD | 309659 | |
| F4/80 PE | Biolegend | 123110 | |
| CD11c PE/Cy7 | Biolegend | 117318 | |
| CD11b PE/Cy5 | eBioscience | 15-0112-81 | |
| Anti-mouse CD16/32 Fc Block | Biolegend | 101320 | |
| CD45 Pacific Blue | Biolegend | 103126 | |
| PE Rat IgG2a | Biolegend | 400508 | |
| PE/Cy7 Armenian Hamster IgG | Biolegend | 400922 | |
| PE/Cy5 Rat IgG2b | Biolegend | 400610 | |
| Pacific Blue Rat IgG2c | Biolegend | 400717 | |
| Dulbecco’s Modified Eagle Medium (DMEM) | Cellgro | 15-017-CV | |
| 1x Phosphate Buffered Saline (PBS) | Cellgro | 21-031-CV | |
| 70 μm cell strainers | Corning, Inc. | 352350 | |
| 1.7 mL microcentrifuge tube | Denville | C2170 | |
| Paraformaldehyde Aqueous Solution -16x | Electron Microscopy Sciences | CAS #30525-89-4 | |
| Micro Dissecting Scissors, 3.5 inch, Straight, 23 mm, Sharp | Stoelting | 52132-10P | Used for general dissecting purposes |
| Micro Forceps, 4 inches, full curve, 0.8 mm | Stoelting | 52102-37P | Used for general dissecting purposes |
| Spring dissection scissors – 3 mm Cutting edge | Fine Science Tool | 15000-10 | Used for aorta dissection Steps 1.3.3.17 to 1.3.3.28 |
| Curved 0.07 mm x 0.04 mm Tip Forceps | Fine Science Tool | 11297-10 | Used for aorta dissection Steps 1.3.3.17 to 1.3.3.28 |
| Hemostatic Forceps (Curved) | Fine Science Tool | 13021-12 | |
| Heparin Sodium Salt | Fischer Scientific | 9041-08-1 | |
| 35 mm Cell Culture/Petri Dishes | Fischer Scientific | 12-565-90 | |
| Polystyrene Petri Dishes (10 cm) w/lid | Fischer Scientific | 08-757-100D | |
| 15 mL Conical Centrifuge Tubes (Polypropylene) | Fischer Scientific | 14-959-53A | |
| 50 mL Conical Centrifuge Tubes (Polypropylene) | Fischer Scientific | 14-432-22 | |
| 5 mL Round-Bottom Polystyrene Tubes | Fischer Scientific | 14-959-5 | |
| Fetal Bovine Serum | Gemini Bio-Products | 100-106 | |
| Ethanol (Stock Ethyl Alcohol Denatured, Anyhydrous) | Millipore | EX0285-1 | |
| Bovine Serum Albumin | Rockland | BSA-50 | |
| HEPES | Sigma-Aldrich | H3375 | |
| Collagenase Type II | Sigma-Aldrich | C6885 | |
| Collagenasse Type XI | Sigma-Aldrich | C7657 | |
| Hyaluronidase Type I | Sigma-Aldrich | H3506 | |
| DNAse | Sigma-Aldrich | DN25 | |
| Collagenase Type I | Sigma-Aldrich | C0130 | |
| NaOH | Sigma Aldrich | 1310-73-2 | |
| CaCl2 | Sigma Aldrich | 449709-10G | |
| 500 mL beaker | Sigma Aldrich | 02-540M | |
| 4 cm Hemostatic clamp | Stoelting | 52120-40 | |
| Toothed forceps | Stoelting | 52104-33P | |
| 50 μm Disposable filters | Systemex | 04-0042-2317 | |
| Collagenase Type IV | ThermoFischer Scientific | 17104019 | |
| Ammonium Chloride Potassium (ACK) | ThermoFischer Scientific | A1049201 | |
| Razors (0.22 mm (0.009")) | VWR International | 55411-050 | |
| Texas Red Live/Dead stain | Red viability stain (in Figure 1A) |
Ссылки
- Davies, L. C., Taylor, P. R. Tissue-resident macrophages: Then and Now. Immunology. 144 (4), 541-548 (2015).
- Kahn, S. E., Hull, R. L., Utzschneider, K. M. Mechanisms linking obesity to insulin resistance and type 2 diabetes. Nature. 444 (12), 840-846 (2006).
- Van Gaal, L. F., Mertens, I. L., De Block, C. E. Mechanisms linking obesity with cardiovascular disease. Nature. 444 (12), 875-880 (2006).
- Jung, U., Choi, M. -S. Obesity and Its Metabolic Complications: The Role of Adipokines and the Relationship between Obesity, Inflammation, Insulin Resistance, Dyslipidemia and Nonalcoholic Fatty Liver Disease. Int J Mol Sci. 15 (4), 6184-6223 (2014).
- Emanuela, F., Grazia, M., Marco, D. R., Maria Paola, L., Giorgio, F., Marco, B. Inflammation as a link between obesity and metabolic syndrome. Nutr Metab. 2012, 1-7 (2012).
- Vieira-Potter, V. J. Inflammation and macrophage modulation in adipose tissues. Cell Microbiol. 16 (10), 1484-1492 (2014).
- Chawla, A., Nguyen, K. D., Goh, Y. P. S. Macrophage-mediated inflammation in metabolic disease. Nat Rev Immunol. 11 (11), 738-749 (2011).
- Dey, A., Allen, J., Hankey-giblin, P. A. Ontogeny and polarization of macrophages in inflammation : blood monocytes versus tissue macrophages. Front Immunol. 5 (1), 1-15 (2015).
- Mills, C. D., Lenz, L. L., Ley, K. Macrophages at the fork in the road to health or disease. Front Immunol. 6 (2), 1-6 (2015).
- Italiani, P., Boraschi, D. From monocytes to M1/M2 macrophages: Phenotypical vs. functional differentiation. Front Immunol. 5 (8), 1-22 (2014).
- Guilherme, A., Virbasius, J. V., Vishwajeet, P., Czech, M. P. Adipocyte dysfunctions linking obesity to insulin resistance and type 2 diabetes. Nat Rev Mol Cell Biol. 9 (5), 367-377 (2008).
- Cummins, T. D., Holden, C. R., et al. Metabolic remodeling of white adipose tissue in obesity. Am J Physiol Endocrinol Metab. 307 (3), 262-277 (2014).
- Fujisaka, S., Usui, I., et al. Regulatory Mechanisms for Adipose Tissue M1 and M2 Macrophages in Diet Induced Obese Mice. Diabetes. 58 (9), 2574-2582 (2009).
- Lumeng, C. N., Bodzin, J. L., Saltiel, A. R. Obesity induces a phenotipic switch in adipose tissue macrophage polarization. J Clin Invest. 117 (1), 175-184 (2007).
- Qureshi, K., Abrams, G. A. Metabolic liver disease of obesity and role of adipose tissue in the pathogenesis of nonalcoholic fatty liver disease. World J Gastroenterol. 13 (26), 3540-3553 (2007).
- Bedossa, P., Paradis, V. Liver extracellular matrix in health and disease. J Pathol. 200 (4), 504-515 (2003).
- Tilg, H., Moschen, A. R. Evolution of inflammation in nonalcoholic fatty liver disease: The multiple parallel hits hypothesis. Hepatology. 52 (5), 1836-1846 (2010).
- Milic, S., Lulic, D., Stimac, D. Non-alcoholic fatty liver disease and obesity: Biochemical, metabolic and clinical presentations. World J Gastroenterol. 20 (28), 9330-9337 (2014).
- Williams, I. L., Wheatcroft, S. B., Shah, A. M., Kearney, M. T. Obesity, atherosclerosis and the vascular endothelium: mechanisms of reduced nitric oxide bioavailability in obese humans. Int J Obesity. 26 (12), 754-764 (2002).
- Mestas, J., Ley, K. Monocyte-Endothelial Cell Interactions in the Development of Atherosclerosis. Trends Cardiovasc Med. 18 (6), 228-232 (2008).
- Wynn, T. A., Chawla, A., Pollard, J. W. Macrophage biology in development, homeostasis and disease. Nature. 496 (7446), 445-455 (2013).
- Davies, L. C., Jenkins, S. J., Allen, J. E., Taylor, P. R. Tissue-resident macrophages. Nat Rev Immunol. 14 (10), 986-995 (2013).
- Basu, S., Campbell, H. M., Dittel, B. N., Ray, A. Purification of specific cell population by fluorescence activated cell sorting (FACS). J Vis Exp. (41), e1546(2010).
- Mann, A., Thompson, A., Robbins, N., Blomkalns, A. L. Localization, Identification, and Excision of Murine Adipose Depots. J Vis Exp. (94), e52174(2014).
- Smedsrød, B. Protocol for preparation of mouse liver Kupffer cells and liver sinusoidal endothelial cells. 1, Available from: http://munin.uit.no/handle/10037/4575 1-10 (2012).
- Butcher, M. J., Herre, M., Ley, K., Galkina, E. Flow cytometry analysis of immune cells within murine aortas. J Vis Exp. (53), e2848(2011).
- Salamone, M., Saladino, S., Pampalone, M. Tissue Dissociation and Primary Cells Isolation Using Recombinant Collagenases Class I and II. Chemical Engineering Transactions. 38, Matsushita 1994 247-252 (2014).
- Wells, R. G. The role of matrix stiffness in regulating cell behavior. Hepatology. 47 (4), 1394-1400 (2008).
- Fain, J. N. Isolation of Free Brown and White Fat Cells. Diabetologia. 375 (1964), 555-561 (1968).
- Seglen, P. Preparation of isolated rat liver cells. Method Cell Biol. 13, 29-83 (1976).
- Yu, S., Allen, J. N., et al. The Ron Receptor Tyrosine Kinase Regulates Macrophage Heterogeneity and Plays a Protective Role in Diet-Induced Obesity, Atherosclerosis, and Hepatosteatosis. J Immunol. 197 (1), 256-265 (2016).
- Yu, Y. R. A., O'Koren, E. G., et al. A protocol for the comprehensive flow cytometric analysis of immune cells in normal and inflamed murine non-lymphoid tissues. PLoS ONE. 11 (3), 1-23 (2016).
- Zizzo, G., Hilliard, B. A., Monestier, M., Cohen, P. L. Efficient clearance of early apoptotic cells by human macrophages requires "M2c" polarization and MerTK induction. J Immunol. 100 (2), 130-134 (2012).
- Jablonski, K. A., Amici, S. A., et al. Novel markers to delineate murine M1 and M2 macrophages. PLoS ONE. 10 (12), 5-11 (2015).
- Rőszer, T. Understanding the Mysterious M2 Macrophage through Activation Markers and Effector Mechanisms. Mediators of Inflamm. 2015, 1-16 (2015).
- Cho, K. W., Morris, D. L., Lumeng, C. N. Flow Cytometry Analysis of Adipose Tissue Macrophages. Methods Enzymol. 4 (164), 297-314 (2011).
- Kim, Y. -J., Brox, T., Feiden, W., Weickert, J. Technical Note: Flow Cytometry Controls, Instrument Setup, and the Determination of Positivity. Cytometry A. 71 (1), 8-15 (2007).
- Tung, J. W., Heydari, K., et al. Modern Flow Cytometry: A Practical Approach. Clin Lab Med. 27 (3), 453-468 (2007).
- Martinez, F. O., Gordon, S. The M1 and M2 paradigm of macrophage activation: time for reassessment. F1000. 6 (3), 13(2014).
- Porcheray, F., Viaud, S., et al. Macrophage activation switching: An asset for the resolution of inflammation. Clin Exp Immunol. 142 (3), 481-489 (2005).
- Plouffe, B. D., Murthy, S. K., Lewis, L. H. Fundamentals and Application of Magnetic Particles in Cell Isolation and Enrichment. Rep Prog Phys. 1 (78), 1-6 (2010).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены