Method Article
受肥胖相关炎症组织的巨噬细胞的分离、鉴定和纯化
摘要
该协议允许研究员分离和表征组织驻留巨噬细胞在各种标志发炎组织提取从饮食诱发的代谢紊乱模型。
摘要
肥胖促进了一种慢性炎症状态, 主要由组织驻留的巨噬细胞以及单核细胞衍生的巨噬病介导。饮食诱发肥胖 (迪奥) 是研究巨噬细胞异质性作用的有价值的模型;然而, 足够的巨噬细胞隔离很难从发炎的组织中获得。在本协议中, 我们概述了从我们的研究获得一个合适的人群组织驻留巨噬细胞后18周高脂肪 (风) 或高脂肪/胆固醇的隔离步骤和必要的故障排除准则 (HFHCD) 饮食干预。本议定书的重点是三标志性组织研究的肥胖和动脉粥样硬化, 包括肝脏, 白脂肪组织 (笏), 和主动脉。我们强调流式细胞术的二元用法如何实现组织驻留巨噬细胞的分离和表征的新维度。本议定书的一个基本部分解决复杂的基础组织特定的酶消解和巨噬细胞分离, 以及随后的细胞表面抗体染色流细胞分析。这项协议解决了现有的复杂的荧光活化细胞分类 (资产管制), 并提出了这些复杂性的澄清, 以获得广泛的范围, 从适当的排序细胞群体的描述。可选的浓缩方法包括对细胞进行分类, 例如稠密的肝脏, 允许在与外地资产管理体系合作时具有灵活性和时间性。简言之, 这项协议帮助研究者评估了一项研究中大量炎症组织的巨噬细胞异质性, 并提供了有洞察力的诊断技巧, 以利于细胞的分离和鉴定。免疫细胞在迪奥介导的炎症。
引言
小鼠模型已被广泛用于研究人类疾病的动态。从患病状态的小鼠中正确分离组织驻留细胞可以提供一个平台, 以了解分子和细胞对疾病发病机制的贡献1。肥胖是一种极其重要的疾病。随着胰岛素抵抗和2型糖尿病、心血管疾病和脂肪性肝病的发生, 肥胖的发病率在全球范围内持续上升2,3。通过减少脂肪组织产生的改变信号的体力活动而进一步扭曲了过量的养分消耗, 从而改变了其他外围组织的细胞环境, 如主动脉和肝脏4。这种扰乱代谢稳态导致慢性低等级系统性炎症5。
经典活化的巨噬细胞的主动脉和肝脏, 以及他们的招募白脂肪组织 (笏) 已被证明不仅启动失调的代谢信号, 但也持续炎症6,7。巨噬细胞表型和功能性异质性与肥胖相关疾病的发病机制有密切关系7。巨噬细胞极化的动态可塑性允许这些单元表现出一系列激活的表型, 以协调炎症的进展和分辨率8。虽然经典激活 (M1) 巨噬细胞是牵连炎症的传播, 或者激活 (M2) 巨噬细胞已与分辨率和组织修复相关的9,10。
当机体经历新陈代谢的压力时, 白色脂肪组织异常堆积。膨胀的脂肪组织吸引并保留了深刻改变正常脂肪细胞功能的炎性神经细胞, 以促进胰岛素抵抗、高血糖和最终2型糖尿病、胰岛素抵抗或高血糖11, 12。在平行, 白色脂肪组织改造反应的炎症信号的渗透经典活化 (M1) 脂肪组织巨噬细胞 (atm)13,14。这多器官施加一连串的信号, 出轨正常功能的其他机构, 如主动脉和肝脏4。
肝脏是一个新陈代谢的发电站, 适应的刺激来自附近的失调笏15。肝巨噬细胞或枯否体细胞, 在反应代谢变化, 分泌炎症细胞因子, 改变实质和实质细胞表型和促进组织重塑。肝脂堆积、炎症、细胞外基质沉积、坏死及最终功能丧失伴随着非酒精性脂肪肝引起的广泛肝损害的炎症反应16,17,18。
当身体承受慢性代谢压力19时, 大动脉在动脉壁内积聚脂质, 同时与受损的笏和肝功能相同。动脉脂质积累引发了活化的内皮细胞分泌的趋化因子, 并随后招募单核20。一旦被吸收, 单核细胞就会增殖, 分化, 摄取脂蛋白, 成为泡沫。动脉粥样硬化的启动和持续的炎活动的招募和组织居民脂质巨噬细胞。这些巨噬细胞屈服于动脉粥样硬化微环境中的胞外和胞内压力信号, 然后参与凋亡信号级联。由于这些泡沫细胞死亡, 他们贡献了他们的脂质填充内容的坏死核心病变, 然后导致斑块破裂, 心肌梗塞, 中风。
整体而言, 巨噬细胞表型的异质性协调在失调组织中观察到的炎症性改变引起的肥胖, 如笏、肝和主动脉8,21。特征的招募和组织驻留巨噬细胞可以提供洞察的潜在分子目标, 操纵巨噬细胞表型1。为了有效地描述由肥胖引起的炎症组织的巨噬细胞, 可以通过酶消化得到单细胞悬浮液。这种离解协议必须有效地在充分降解结缔组织, 同时尽量减少免疫细胞死亡和提供最佳的细胞产量。酶的混合物取决于组织的类型和它的结构构成。弹性组织, 如主动脉, 需要更强的酶活性, 比肝脏和笏, 以实现组织离解。从单细胞悬浮, 组织驻留巨噬细胞可以明确的特征或孤立的进一步的下游分析, 如转录剖面。
在这里, 一个组织特异性的协议描述, 使用胶原酶相关的组织消化和多色流式细胞仪有效分离和表征组织驻留巨噬细胞从传统的饮食诱发肥胖,动脉粥样硬化, 简单的脂肪和脂肪小鼠模型。同时染色细胞表面标记抗体抗白细胞-(CD45 和/或 CD11b) 和巨噬细胞 (F4/80) 特异抗原通常用于识别巨噬细胞的数量22。荧光活化细胞分类 () 是一种强有力的策略, 用来对这些被识别的种群进行高纯度的分类。然后利用下游分子分析 (如定量实时聚合酶链反应)23对表型特定基因图谱进行排序。虽然标准流式细胞仪和流 cytometry-based 细胞排序是强大的工具, 区分巨噬细胞在一个巨大的异构电池悬浮, 前协议必须优化, 以确保成功的输出。在本研究中, 描述了有效分离和表征可行组织特异性巨噬细胞的协议;更重要的是, 这项研究提供了对经常出现的技术问题的重要洞察力, 以及预防和/或解决它们的主动和 trouble-shooting 战略。
研究方案
所有实验性协议 (1、1.2 和1.3 节) 均由宾夕法尼亚州立大学动物保育和使用委员会 (IACUC) 批准。
| 组织 | 离解缓冲器准备 | 最终卷 | 存储 |
| 白脂肪组织 (笏) | 离解缓冲: 2.5% HEPES, 10 毫克/毫升牛血清白蛋白 (BSA), 3 毫克/毫升 (0.3%)Dulbecco 氏改良鹰培养基 II. 型胶原酶 (DMEM), 4.5 克/升葡萄糖, 无 l-谷氨酰胺和丙酮酸钠 | 500毫升 | 负80° c (10 mL 等分) |
| 肝 | 25x 灌注缓冲浓缩液 (PBC): 3.55 米氯化钠, 168 毫米氯化钾, 240 毫米 HEPES, 150 毫米氢氧化钠在蒸馏去离子 H2O | 500毫升 | 负20° c (40 mL 等分) |
| 保存缓冲区 (PRB): 1% 1x 灌注缓冲液中的 BSA | 1升 | 4° c | |
| 离解缓冲: 1x 灌注缓冲液, 4.76 mM CaCl2和 72 U/毫升胶原酶 IV 型 | 50毫升 (每只老鼠) | 在使用前立即准备 | |
| 脉 | 离解缓冲: 125 u/毫升胶原酶类型 XI, 60 u/毫升透明质酸盐 i 型, 60 u/毫升 dnasei i, 450 u/毫升胶原酶 i, 20 毫米 HEPES 在1x 磷酸盐缓冲盐水 (PBS) | 500毫升 | 负80° c (10 mL 等分) |
表 1: 组织特异性灌注缓冲配方。
1. 组织隔离和分离
- 笏隔离和离解
- 根据表 1准备组织特定的缓冲区, 并按所述存储它们。
- 准备以下试剂。
- 准备消化缓冲液, 解冻适当容积的笏离解缓冲液, 贮存在4° c 直至使用。使用前, 预热缓冲器至37° c。准备一份含有2% 胎牛血清 (FBS) 的1x 磷酸缓冲盐水 (PBS), 以制备该资产的缓冲区。
- 笏隔离
- 安乐一只老鼠在二氧化碳 (CO2) 被填装的房间里。在继续解剖阶段之前检查有效性。
- 在含有70% 乙醇的烧杯中, 将被安乐死的小鼠短暂浸泡, 直到彻底浸透并涂上乙醇。将鼠标腹面放在解剖台上, 用21克针将鼠标前后爪固定在解剖板上。
- 使用中点尖端钳抓腹前的尿道开口, 然后用锋利的解剖剪刀做一个在抓住腹部皮肤的尼克。
- 将剪刀的下部刀片插入皮肤和腹膜之间的小切口, 然后从腹侧切开至肋骨。
- 轻轻拉回皮肤, 露出完整的腹膜腔, 并通过腹膜进行侧向切口, 或者折叠透明膜或切除组织以暴露腹部的笏。
- 收集在曼et al.中描述的 perigonadal 脂肪垫24
- 雄性小鼠的 perigonadal 脂肪垫与附睾和睾丸有松散的结合。先定位睾丸, 然后用中点钳, 抓住附睾头并轻轻拉。
- 使用尖锐解剖剪刀, 切除每个附睾脂肪垫通过切割沿附睾表面 (头部, 身体和尾部) 和睾丸。
- 用镊子, 轻轻地拉上脂肪垫, 同时切割通过结缔组织直接绑定到附睾结构。
- 使用镊子, 牢牢地抓住脂肪垫近端的附睾和轻轻剥离脂肪垫远离性腺
- 在雌性小鼠中, perigonadal 脂肪垫与子宫体和子宫角有松散的结合。
- 使用中点钳, 抓住 perigonadal 脂肪组织, 轻轻地拉离子宫体和子宫角的组织。
- 切除每个脂肪垫通过切割沿子宫体和子宫角使用尖锐解剖剪刀。
- 将脂肪垫放在装有 PBS 的培养皿中, 并保持冰块以保持组织湿润。
- 笏与单细胞悬浮液的分离
- 从培养皿中取出多余的 PBS, 使用单刃刀片将腹笏剁碎成小块。
- 用刀片锋利的边缘, 轻轻地刮碎的腹部笏到一个标记15毫升聚丙烯收集管包含 2 ml 笏离解缓冲。
- 在37° c 以下45分钟的慢连续旋转下孵育这种组织消化缓冲液。
- 通过一个70µm 的细胞过滤器滤除一个50毫升收集管, 而移动的橡胶活塞的注射器柱塞在一个圆周运动, 并继续筛的细胞悬浮通过过滤器。
- 吸管2毫升的 Dulbecco 的改良鹰培养基 (DMEM) 到15毫升收集管, 轻轻地吸管上下和洗涤过滤器与单细胞悬浮。
- 用冷 DMEM 冲洗过滤器两次, 并将单细胞悬浮在冰上。
- 离心的细胞悬浮在 300 x g 在4° c 为 8 min。
- 使用真空器, 小心去除漂浮脂肪细胞 (第一) 和剩余上清液。请务必不要扰乱颗粒间质血管部分 (特别)。
- 根据制造商的说明, 用1000µL 吸管轻轻 re-suspend 氯化铵-钾 (ACK) 缓冲液中的颗粒溶解红细胞。
- 稀释上述细胞悬浮液与 DMEM 和离心机的细胞悬浮在300克在4° c 为8分钟。
- 在含有 2% FBS 的冷 PBS 中重新悬浮细胞, 并在 Burker 室/例中计数细胞。
- 传输 1 x 106单元格 (用于基本流式细胞仪) 或整个细胞悬浮 (用于外地资产管制系统), 以标记5毫升圆底聚苯乙烯管。继续2节流式细胞仪染色协议。
- 肝脏组织分离和离解
注意: 此协议是从 Smedsrød25改编的。- 根据表 1准备组织特定的缓冲区, 并按所述存储它们。
- 准备以下试剂。
- 准备1x 灌注缓冲液 (pb), 稀释40毫升的 PBC 为960毫升超纯 H2o. 预热前, 在灌注开始之前, 在37° c 内填充50毫升 PB 的注射器。消除目前的气泡。
- 为了消除气泡, 倒置注射器的路尔锁尖端指向向上。轻拍或轻弹注射器, 直到气泡到顶部的注射器。轻轻推上柱塞排出空气
- 通过稀释0.5 毫升的 476 mM CaCl2解决方案到49.5 毫升1x 灌注缓冲液来准备消化缓冲液.添加3600U 的胶原酶 IV 型到 4.76 mM CaCl2 – PB 解决方案。预热前, 在灌注开始之前, 在37° c 的情况下, 装有50毫升消化缓冲液的注射器。消除任何目前的气泡, 如步骤 1.2. 2.1. 1 所述。
- 在250毫升1x 的灌流缓冲液中溶解2.5 克牛血清白蛋白 (BSA), 制备保存缓冲液 (PRB)。贮存在4° c 或保持在冰上直到使用。
- 准备 1x PBS 和 2% FBS 的外地资产缓冲区。
- 准备1x 灌注缓冲液 (pb), 稀释40毫升的 PBC 为960毫升超纯 H2o. 预热前, 在灌注开始之前, 在37° c 内填充50毫升 PB 的注射器。消除目前的气泡。
- 肝组织隔离
- 安乐一只老鼠通过 CO2窒息, 饱和老鼠与70% 乙醇, 以防止腹部器官的污染与毛皮。
- 将鼠标腹侧放在聚苯乙烯泡沫解剖板上, 用21克针将老鼠的前爪和后腿固定在解剖板上。
- 要暴露胸腔壁和腹膜腔, 用中点尖端钳抓住尿道开口附近的腹部皮肤。然后用锋利的解剖剪刀创建一个小切口, 抓住腹部皮肤。
- 将剪刀的下部刀片插入皮肤和腹膜之间的小切口, 然后从腹股沟到下巴进行侧向切口。
- 轻轻拉回皮肤, 露出完整的腹膜腔和胸壁, 通过腹膜进行侧向切口并切除膜。
- 抬起胸骨, 小心地切开横膈膜, 千万不要打扰下腔静脉 (下静脉)。将胃肠道器官移至一侧, 并定位 subhepatic 下腔。用止血钳夹住 suprahepatic 下腔, 保持局部灌注。
注: 内脏白色脂肪组织过度积聚往往能掩盖下腔静脉。为了更好的形象化这艘船, 在下腔静脉旁的一小部分脂肪组织可以切除。可弯曲的脂肪组织内的切割窗口, 然后可以放置在下腔静脉, 以暴露血管的插管。 - 将装有5ml 铅的注射器连接到23克血液收集和输液组。轻轻地按下活塞, 直到油管和针头充满铅。
- 插入23克针, 平行于 subhepatic 下腔的水平。使用4厘米止血钳将针固定到位。
注: subhepatic 下腔静脉插管在喂养小鼠中是首选, 因为下腔可以更好地可视化和空心内脂肪填充腔。 - 轻轻地推上柱塞开始灌注, 颜色会迅速从肝脏冲洗 (右耳垂), 如果针是适当的定位在血管。如果针正确地插入到 subhepatic 下腔中, 也可以看到扩大耳垂。
- 及时切断门静脉, 使铅通过肝脏自由流动。
- 灌注肝脏, 直到血液不再可见。偶尔轻轻按摩肝裂片之间的前指和拇指, 以方便灌注。
注意: 重要的是使用无钝刃工具来处理肝脏, 以防止组织损伤。 - 当5毫升的 PB 仍然在注射器内, 改变到注射器充满5ml 离解缓冲。在此期间请勿打扰安全针的位置。
注: 扩大肝脏明显超过1.5 克应灌注大量的5ml 消化缓冲, 以保证成功的肝脏分离。 - 灌注肝脏直到完全消化。轻轻按摩肝叶, 便于灌注。
注意: 在成功消化的肝脏中, Glisson 的胶囊与软组织分离是可见的。为了评估这一点, 用一对钳子的钝边, 轻轻按压左外侧叶。一个印象应该出现在表面和压痕应填补缓慢一旦镊子被删除。 - 从 subhepatic 下静脉取出针。不要将止血钳夹在 suprahepatic 下腔。
- 通过使用短的直刃解剖剪刀和切除胆囊, 仔细切断连接韧带, 切除整个肝脏。
- 将整个肝脏放在一个10厘米的培养皿中, 其中含有10毫升 ice-cold 保存缓冲器, 并存储在 4 оC 上, 直到准备好释放细胞。
- 肝细胞离解
- 将肝脏转移到一个10厘米的盘子里, 含有10毫升 ice-cold DMEM。
- 用齿钳夹住切除的肝 suprahepatic 下腔。使用中点钳从 Glisson 的胶囊中释放细胞, 通过对每个肺叶应用快速的抚摸动作。
- 通过一个70µm 细胞过滤器连接到一个50毫升收集管的饱和 DMEM。
- 吸管10毫升 ice-cold DMEM 到 10 cm 培养皿, 重复步骤1.2.4.1 到 1.2.4.3, 直到不再观察到介质饱和。将细胞悬浮在冰上或在4° c。
- 通过倒置收集管轻轻混合细胞悬浮液, 然后在 54 x g 离心2分钟, 在4° c。
- 在干净的50毫升收集管收集上清。然后离心细胞悬浮在 54 x g 为2分钟在4° c。
- 在继续步骤1.2.4.8 之前, 重复步骤1.2.4.6 两次。
- 将上清液转移到一个干净的50毫升收集管和离心的细胞悬浮在 300 x g 10 分钟, 在4° c。
- 将实质细胞颗粒重新悬浮在一个 Burker 室/例中, 并将其计数。
- 传输 1 x 106单元格 (用于基本流式细胞仪) 或 15 x 106 -20 x 106单元格 (用于资产管制署), 以标记为5毫升的圆底聚苯乙烯管。继续2节流式细胞仪染色协议。
- 主动脉分离和离解
注: 本协议由屠夫改编et al.26- 根据表 1中提供的食谱准备组织特定的缓冲区, 并按所描述的方法存储它们。
- 准备以下试剂。
- 准备消化缓冲液, 解冻适当容积的笏离解缓冲液, 贮存在4° c 直至使用。使用前, 预热缓冲器至37° c。
- 将肝素钠盐溶解在 1x PBS 中, 以 200 U/毫升的浓度制备10x 肝素溶液。用 1x PBS 稀释10x 肝素溶液, 制备1x 肝素溶液。将10x 和1x 的肝素溶液储存在4° c 直到使用。
- 准备 1x PBS 包含 2% FBS。
- 主动脉夹层
- 在二氧化碳填充室中安乐一只老鼠, 用70% 乙醇冲洗。
- 将鼠标腹侧放在解剖台上, 用21克针将鼠标放在前后爪上, 并将其固定在解剖板上。
- 安乐后立即进行心脏穿刺。如有必要, 请参阅1.3.3.4 至1.3.3.9 的步骤。
- 定位胸骨下端的剑过程
- 要做到这一点, 将手指中点沿动物的颈部宽度。沿着腹中线从颈部到胸骨尾端, 直到感觉到软骨的延伸。
- 用中点钳抓住软骨的延伸, 如果必要的话, 通过去除毛发或皮肤的部位来标记剑过程的位置。
- 部分插入一个26克针下的剑过程在20-30°角。
- 慢慢地取出活塞, 轻轻地将负压施加到注射器上, 然后再将针头插入腔内直到血液流动。
- 如果血流停止, 慢慢旋转针头或轻微地进出。
- 用镊子钳抓住腹部前尿道开口的部位, 用一把锋利的解剖剪刀沿腹中线穿过腹膜从腹股沟到下巴。
- 用手指或钝钳将腹部器官和胸腔拉回皮肤, 轻轻地将腹部器官移到一侧。
- 用镊子抓住剑过程, 提起胸骨, 切开横膈膜。
- 使用解剖剪刀, 切断两侧侧肋。夹住胸骨, 向上翻转胸腔, 穿过连接底座。取出胸腔外露器官的肋骨。
- 灌注的主动脉与26口径针连接到10毫升注射器充满1x 肝素溶液通过注射1-2 毫升的解决方案进入左心室 (LV) 的心脏。
注意: 一定要以缓慢的速度灌注, 以确保动脉粥样硬化的完整病变。 - 切除胸腺、肺部和结缔组织。如有必要, 请参阅步骤1.3.3.16 和1.3.3.17。
- 在心脏前方定位白色的双浅裂 (或蝶形) 器官, 并牢牢抓住胸腺与钳子。将两个耳垂从腔体向上拉出, 并用剪刀在底座上切割。
- 要取出肺部, 用镊子捏住肺叶, 将组织从胸腔中拉出, 然后在底部切开。对每个剩余的叶重复。
- 使用解剖显微镜和显微解剖工具, 收集主动脉弓 (包括无名动脉, 左颈总动脉和左锁骨下动脉), 升, 降, 胸和腹主动脉。
- 在心脏左心室定位升主动脉。
- 用一对弯曲的 0.07 x 0.04 毫米尖端钳轻轻地抓住从左心室的上升主动脉部分。
注: 与周围黄微染脂肪组织相比, 主动脉将是一个明亮的白色血管起源于 LV 时, 充分冲洗与肝素溶液。- 如果心脏灌注未正确冲洗主动脉, 则再次冲洗主动脉, 同时主动脉仍与腔体相连。要做到这一点, 切近心主动脉的交界处, 取出心脏, 然后水平地切开腹主动脉的下端。在升主动脉的开口插入一个26克针, 用1x 肝素溶液轻轻冲洗主动脉。
- 轻轻地牵引升主动脉, 以更好地区分脂肪组织和嵌入的主动脉。
- 仍然轻轻地拉动升主动脉, 使用闭合弹簧解剖剪刀的尖端来清除包裹升主动脉和主动脉弓的脂肪。要做到这一点, 中风的脂肪组织与尖端的封闭剪刀刀片撕掉连接脂肪。
注意: 不要切开任何脂肪组织, 直到升主动脉和弓可以清楚地形象化。这是为了防止切割主动脉。 - 如果升主动脉和拱可以清楚地从周围脂肪组织划定, 使用弹簧解剖剪刀, 以去除多余的脂肪。
- 用镊子轻轻握住主动脉弓。再次使用弹簧剪刀的尖端, 中风的脂肪沿长度的下降, 胸腹主动脉到尾部的腹主动脉, 这样做对右侧的袖子的脂肪。
- 在撕裂脂肪的时候继续沿着主动脉去抓。一定要轻轻地做, 以防止损害主动脉。
- 轻轻地将主动脉向上拉向显微镜, 使脂肪现在位于主动脉的后面。
- 插入闭合的剪刀刀片之间的脂肪主动脉接口靠近前端的下降主动脉, 严重的脂肪组织的附着到主动脉的表面, 坦率地使用一个扫运动。
注: 建议在主动脉仍在腔内时彻底清除多余脂肪和连接组织。 - 切除心脏和切开在腹主动脉的尾端横。切除整个主动脉
- 将主动脉放在一个35毫米的盘子里, 用两个21口径的针头把主动脉上多余的脂肪逗走。将切除的主动脉放置在冰上1.7 毫升的离心管上。
- 主动脉与单细胞悬浮液的分离
- 吸管0.2 毫升主动脉解离缓冲的管包含主动脉。将弹簧剪刀刀片插入管的锥形端, 并迅速将主动脉切碎, 以利于酶消化。
- 将组织溶液混合物转移到15毫升收集管和吸管1.8 毫升主动脉离解缓冲液中, 总容积为2毫升。
注意: 为便于转移的组织悬浮, 削减1厘米的锥形结束的标准1000µL 吸管尖端。使用缩短的提示转移悬挂与微。 - 在主动脉离解缓冲液孵育55分钟, 在37° c, 晃动 220 rpm (0.514 x g)。
- 通过 50-µm 细胞过滤器的悬浮到一个15毫升聚丙烯收集管。使用注射器柱塞的橡胶活塞, 以方便过滤。
- 冲洗15毫升收集管与1毫升的资产管制系统缓冲区, 收集悬浮和通过细胞过滤器。
- 将50µm 细胞过滤器再用1毫升的缓冲液清洗两次。
- 通过离心在 300 x g 为5分钟在4° c 的细胞颗粒。在冷的缓冲区中重新挂起单元格。在 Burker 室/例中计数细胞。
- 将 1 x 106 (用于基本流式细胞仪) 或整个细胞悬架 (用于外地资产管制系统) 转移到标有5毫升的圆底聚苯乙烯管上。继续2节流式细胞仪染色协议。
2. 流式细胞仪和污染检测
| 荧光 | R-藻 (PE) | PE/青菁 (Cy) 7 | PE/青菁 (Cy) 5 | 太平洋蓝 (PB) |
| 激光 (nm) | 蓝色 (488 nm)/黄色 (561-570 nm)-绿色 (532 nm) | 蓝色 (488 nm)/黄色 (561-570 nm)-绿色 (532 nm) | 蓝色 (488 nm)/黄色 (561-570 nm)-绿色 (532 nm) | 紫罗兰色 (405 nm) |
| 励磁最大(nm) | 496 | 496 | 496 | 401 |
| 发射最大(nm) | 578 | 785 | 667 | 455 |
| 表型标记 | F4/80 | CD11c | CD11b | CD45 |
| EMR1, Ly71 | αX 整合素, 整合素αX 链, CR4, p150, ITGAX | αM 整合素, Mac-1, Mo1, CR3, Ly-40, C3biR, ITGAM | T200, Ly-5, LCA | |
| 目标单元格类型 | 组织驻留巨噬细胞 | 经典活化 (M1) 巨噬细胞 | 单核/巨噬细胞 | 白细胞 (巨噬细胞/单核、淋巴细胞和粒) |
| 树突状细胞的子集 | 树突状细胞、NK 细胞、活化 T 细胞和肠道上皮内淋巴细胞 (IEL) 的一个子集 | 粒、树突状细胞、NK 细胞和 T 和 B 细胞的亚群 | ||
| 稀释因子 | 1:50 | 1:100 | 1:100 | 1:100 |
| 同种控件 | PE 大鼠 IgG2a | PE/Cy7 亚美尼亚仓鼠 IgG | PE/Cy5 鼠 IgG2b | 太平洋蓝鼠 IgG2c |
表 2: 荧光标记抗体的列表, 特异性组织驻留巨噬细胞。
- 收集并准备以下项目: 资产管制署缓冲5毫升圆底聚苯乙烯管, anti-mouse CD16/32 Fc 受体阻断抗体, 荧光共轭或游离主抗体, 荧光共轭二级抗体 (如果必要), 1x 磷酸盐缓冲盐水 (PBS)。
注: 对于大量的细胞, 抗体浓度是最关键的, 而不是细胞数。例如, 如果染色 10 x 106单元格, 则染色缓冲卷和抗体浓度应与在10µL 缓冲卷中染色 1.0 x 6100单元格相同。为染色 1.0 x 108单元格, 建议增加抗体量5倍。 - 如有必要, 将额外的 ice-cold 的外地资产管制署的缓冲区, 在 751 x g 为5分钟 (4 ° c) 离心的颗粒细胞。离心后上清液。
- 根据制造商的说明, 将 anti-mouse CD16/CD32 Fc 受体阻断抗体添加到所有样品中。在4° c 或冰上孵育15分钟。
- 将荧光-共轭主抗体鸡尾酒直接添加到 Fc 受体阻断抗体的细胞悬浮液中, 在4° c 下孵育30分钟的样品, 保护样品免受光照, 减少荧光共轭抗体的漂白。
- 在游离主要抗体被使用的事件, 在完成步骤2.4 之后跟随这些步。
- 以 751 x g 为5分钟 (4 ° c) 的离心法洗涤主要抗体染色样品。
- 迁和 re-suspend 颗粒在100µL 的缓冲区中去除上清。
- 在所有必要的样品中加入共轭的二级抗体, 在4° c 孵育30分钟。继续执行步骤2.5。
- 继抗体孵化后, 在 751 x g 处添加2毫升的冰冷的细胞仪缓冲液, 5 分钟 (4 ° c)。醒酒上清, 一定不要扰乱颗粒。
- 轻轻地混合细胞, 然后用200-400 µL 的 re-suspend 缓冲液, 然后在4° c 的情况下将其保持在黑暗中, 直到标准流式细胞仪分析或细胞分类。
- 对于染色细胞的短期固定, 进行步骤2.8 到2.10。仅使用标准流式细胞仪固定。
- 紧接着步骤 2.5, re-suspend 细胞在0.5 毫升2-4% 甲醛 (煤灰) 为 15-30 min 在4° c。
注: 注意事项: 粉煤灰是一种已知的具有致癌和毒性作用的刺激性物质。使用粉煤灰时, 要格外小心。一定要使用适当的个人防护设备和排气通风。 - 在固定后, 通过在4° c 中将2毫升的缓冲液加入到所有样品和离心机中 751 x g, 洗涤细胞, 在离心后去除上清。
- 重固定细胞在200µL 的冰冷的缓冲区和存储在4° c。储存固定细胞多达1周在4° c, 理想情况下执行流式细胞仪采集在48小时内, 以尽量减少自发荧光。
- 根据流式细胞仪制造商的说明, 或执行巴苏et al描述的荧光活化细胞分类, 获取流量检测数据。23
结果
当使用载脂蛋白 E 缺乏 (载脂蛋白 KO) C57BL/6 (BL6) 小鼠维持高脂肪高胆固醇饮食 (HCHFD 或 HCD) 18 周, 1 x 104 -2 x 104 CD45+F4/80+主巨噬细胞可以被隔离当两个样本汇集.肝解剖从 HFHCD 喂食的载脂蛋白高鼠, 产生大于 5 x 105排序的枯否细胞 (这取决于可用的排序时间)。当使用高脂肪饮食 (风) 喂养野生型 (重量级) C57BL/6 小鼠, 5 x 105到 1 x 106居民脂肪组织巨噬细胞 (atm) 可以从基质血管分数 (特别) 排序。所提到的巨噬细胞的总数量可以从一个给定的组织是足够的执行基因表达分析使用定量实时聚合酶链反应 (qPCR)。对于较少数量的巨噬细胞群的恢复, 如主动脉, 建议使用 co-precipitants (如糖原) 和隔夜降水时, 孤立的 RNA 是需要这些分析。
在这里, 使用基本流式细胞术、荧光活化细胞分选和下游后整理分析显示饮食诱发代谢紊乱对巨噬细胞表型的影响。这些发现证实了先前发表的观察, 即喂食风或 HFHCD 的小鼠在受影响的组织 (如主动脉 (图 1B) 中, 增加了经典活化 (M1) 巨噬细胞的浸润。利用流式细胞仪、系统和基因表达谱 (通过定量聚合酶链反应 (qPCR), 对 Ron 受体酪氨酸激酶表达的占主导地位的表型 CD45+ F4/80+巨噬细胞派生自观察喂养小鼠组织的分离。在 HFHCD 喂养的小鼠 (图 1C和D) 中, 表现出抗炎表型的 Ron 受体表达主动脉巨噬细胞减少。排序 Ron 受体表达巨噬细胞从消化脉证明增加酸 1 (Arg1) 基因表达, 这是一个行之有效的 M2 巨噬细胞标记 (图 1E)。亲炎巨噬细胞的特点是 CD45+ F4/80+ CD11c+增加了脉分离 HFHCD 喂养小鼠 (图 1B和D)。肝细胞的特征, 进一步阐明了 Ron 受体表达的亚群的表型 (图 2A)。CD11c+ 炎巨噬细胞的种群表现出与抗炎 (M2) 表型 (如 Arg1 和 Ron (图 2B) 密切相关的基因的减少表达。在从被消化的白脂肪组织中分离出的巨噬细胞群中也观察到类似的趋势 (图 3)。具有炎特征的巨噬细胞群体显示 Ron 受体的表面表达减少 (图 3)。结合的方法, 基本流式细胞仪和外地资产管制, 导致确凿的数据, 进一步验证 Ron 受体作为一个调节器的替代 (M2) 活化在巨噬细胞32。这种对抗炎 (M2) 表型的偏见已被证明对肥胖、动脉粥样硬化和脂肪性肝炎的发展和进展起到保护作用31。

图 1:HCD 中分离的巨噬细胞的特征, 从载脂蛋白高鼠中取出, 18 周.(A) 细胞首先在 CD45 的+白细胞上封闭, 不包括细胞碎片。(B) CD45 染色与 F4/80 结合使用, 以描述双阳性人群推定为巨噬细胞。额外的浇口用于演示 CD11c+CD45+F4/80+ (M1) 和 (C) Ron+CD45+F4/80 + (潜在 M2) 巨噬细胞在脉从喂食的老鼠正常膳食或高胆固醇饮食18周。(D) 增加的百分比 CD11c+CD45+F4/80+ (M1) 巨噬细胞, 以及减少百分比的 Ron+CD45+F4/80+ (潜在 M2) 巨噬细胞在脉观察从喂食 HCD 的老鼠与喂食正常饮食的老鼠相比。(E) 排序的 Ron+CD45 的基因表达分析+F4/80+巨噬细胞显示增加酸 I (一个著名的小鼠 M2 标记) 的表达。使用统计分析软件进行学生 t 检验分析, 并以平均± SEM 表示. p < 0.05 被认为具有统计学意义 (* p < 0.05, ** p < 0.001)。图已从 Yu et al.中修改(2016)31.请单击此处查看此图的较大版本.

图 2: 对枯否细胞种群的基因转录进行了分类, 从被 HCD 的小鼠身上剥离出来的消化肝脏进行了18周的解剖.(A) 对枯否细胞群进行定性和分类的通用浇注方案。(B) 用定量 rt-pcr 方法对排序 ron 表达 (ron+) 和 non-expressing (ron) CD45+F4/80+巨噬细胞进行基因表达分析。学生的 t 检验分析是使用统计软件进行的, 值以平均± SEM 表示. p < 0.05 被认为有统计学意义 (* p < 0.05, ** p < 0.001)。图已从 Yu et al.中修改(2016)31.请单击此处查看此图的较大版本.
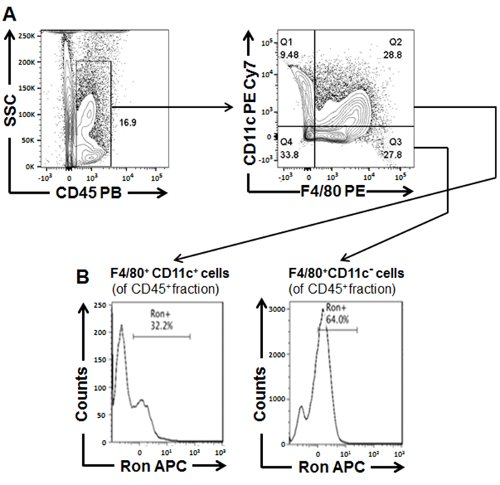
图 3:从 BL6 小鼠身上分离出的白色脂肪组织的 atm 机的特征, 喂食风18周.(A) 用于定性和排序脂肪组织衍生巨噬细胞群的一般浇注方案 (B) CD45 内的 Ron + 单元格的百分比+F4/80+CD11c 和 CD45 + F4/80+CD11c +巨噬细胞群从笏分类。图已从 Yu et al.中修改(2016)31.请单击此处查看此图的较大版本.
讨论
饮食诱导代谢紊乱模型, 模仿疾病, 如动脉粥样硬化, 简单的脂肪, 脂肪性肝炎和2型糖尿病广泛使用, 以更好地了解潜在的分子机制的疾病进展。胶原酶依赖性消化经常被用于游离组织, 从细胞外基质 (ECM)16,27中释放出癌细胞。酶, 如胶原蛋白酶扰乱胶原蛋白, 为相邻细胞提供结构支持。组织的结构组成决定了组织基质的刚度 (抵抗变形), 哪些粗胶原酶产品最有效地确保了 ECM 的成功破坏28。笏, 这是由 "软基质", 通常是消化与胶原酶 II 型, 以解放脂肪细胞和居民免疫细胞, 同时保持完整性的单元表面胰岛素受体29。主动脉纤维成分的微体系结构有助于 "僵硬基质", 而胶原酶 (具有最高胶原酶活性) 的有效主动脉消化与其他酶结合使用。与主动脉不同的是, 肝脏消化用酶活性较弱的胶原蛋白酶 IV 型胶原酶扰乱基质, 释放可行的实质和实质细胞30。长期发炎的组织从饮食喂养野生型或载脂蛋白 E 缺乏 (载脂蛋白) 小鼠在一个 C57BL6 的背景往往进行重塑, 可以防止适当的酶消化。本节将讨论减少和/或消除不适当的组织分离和低细胞恢复的可能性的策略。
由饮食喂养的小鼠模型产生的一种常见的组织特征是, 模拟肥胖症、动脉粥样硬化和/或非酒精性脂肪肝, 是组织重塑的异常。在白脂肪组织中, 主动脉和肝脏, ECM 成分被改变, 往往导致过度沉积的纤维成分, 如胶原蛋白。野生型 C57BL6 小鼠维持在高脂肪饮食十八周, 经历组织特异性异常, 如扩大的白脂肪组织和扩大脂肪肝 (简单脂肪)。通常情况下, 这些代谢特征不是在组织离解过程中克服的麻烦障碍。另一方面, 在其他饮食诱导模型, 反映更严重的表型, 组织的广泛重塑可能会造成一个问题, 在组织消化。HFHCD 喂食载脂蛋白高鼠常被用来模型动脉粥样硬化和脂肪性肝炎。与晚期脂肪性肝炎相关的一个共同特征是肝脏 (或纤维化) 中的 ECM 过度沉积。肝纤维化肝脏已被证明是相当成问题的酶组织离解, 往往产生低细胞产量31。为了提高细胞的产率, 必须遵循消化协议而不产生偏差。虽然正常的肝脏可以被剁碎和淹没在消化缓冲达到离解, 灌流与消化缓冲最大的联系之间的肝细胞外基质和胶原酶溶液;因此, 强烈建议使用此方法。此外, 20-30 毫升的消化缓冲往往是足够的体积, 成功地解离正常肝脏;然而, 在小鼠模型, 发展扩大和/或纤维化肝, 灌注50毫升消化缓冲是首选, 以确保适当的消化, 同时尽量减少细胞死亡。对于体重明显超过1.5 克的肝脏, 建议增加消化缓冲液的体积, 以保证消化成功。
| 组织 | 问题 | 可能的原因 | 解决 |
| 白脂肪组织 (笏) | 细胞离解不良 | 消化不良 | 确保消化缓冲在37° c |
| 细胞死亡 | 过量胶原酶消化 | 减少消化时间 | |
| 减少消化缓冲的体积 | |||
| 脉 | 细胞离解不良 | 消化不良 | 确保消化缓冲在37° c |
| 主动脉片消化缓冲过大 | 确保主动脉被切割成大约1毫米的碎片 | ||
| 在孵化过程中, 主动脉片没有在离解缓冲中晃动 | 确定主动脉片在消化液中晃动 | ||
| 细胞死亡 | 过量胶原酶消化 | 减少消化时间 | |
| 减少消化缓冲的体积 | |||
| 肝 | 细胞离解不良 | 消化不良 | 确保消化缓冲在37° c |
| 增加消化缓冲量 | |||
| 下腔静脉插管不当 (发生下腔静脉组织肿胀) | 确保针正确插入下腔静脉 | ||
| 静脉破裂 | 静脉灌注前正确安全针 | ||
| 降低灌注速度 | |||
| 组织破裂 | 降低灌注速度 | ||
| 细胞死亡 | Glisson 胶囊中细胞的不适当释放 | 一定要用先前讨论的抚摸方法将细胞与胶囊分离 | |
| 过量胶原酶消化 | 减少消化时间 | ||
| 减少消化缓冲的体积 |
表 3: 诊断不成功的组织分离.流式细胞仪的细胞分类或资产管制系统是一种强大的技术, 隔离细胞数量高纯度是必要的。通过细胞分选纯化细胞, 获得高的细胞产量, 而且纯度高, 需要使用适当的分类策略。在这一节中, 介绍了改善 multi-fluorophore 流动 cytometry-based 细胞分型的方法。对于不同组织居民巨噬细胞的分离, 表面标记的选择是一个关键的步骤。从笏, 主动脉和肝脏派生的巨噬细胞通常使用 CD45 的+, CD11b+, F4/80+门控策略来区分。额外的流细胞板可以用来识别组织驻留巨噬细胞。这些面板包括抗体探针的表面表达的巨噬细胞特异性糖蛋白 (CD64, CD68, 和 CD14), 主要组织相容性配合物 (MHCII) 和凋亡细胞酪氨酸激酶受体 (MerTK)32, 33. 然后, 可以通过探测 M2 (CD163、CD209 和 CD206) 或 M1 标记 (CD38、CD40、CD80 和 CD86)34、35的选择性表面表达式来描述特定巨噬细胞表型。由脂质巨噬细胞产生的自动荧光可以在浇口时出现一些问题。使用被黄绿色激光 (如 PE、PE/Cy5、PE/Cy7) 或红色激光 (如 apc、apc Cy7) 所激发的荧光的抗体, 会产生比荧光亮得多的荧光, 从而提高结果36。在选择具有高染色指数和潜在发射光谱重叠的荧光共轭物时, 包括适当的控制是至关重要的。在确定浇口边界时, 包括单染色 (SS) 控制和同种控制允许对正/负种群的划分和对由主抗体引起的非特异性背景信号的测量分别37. 对于细胞稀少的情况, 我们建议使用补偿粒子进行 SS 和同种控制。补偿粒子通常比生物控制发出更亮的信号, 并且在背景荧光中也有较小的方差。此外, 荧光减去一个 (FMO) 控制是理想的划定浇口边界。通过包括 FMO 控制, 当特定荧光通道的荧光标记抗体被排除在38之外时, 在给定通道中会显示出染色子集的最大荧光。在我们的经验, 除了单一的染色补偿颗粒控制, 应包括一个不的生物比较控制, 以确定更精确的正/负边界。
在浇口策略中不包括细胞碎片和细胞聚集物, 也是一种用于最小化荧光的附加方法。采用前向散射 (FSC) 和侧散射 (SSC) 是最常见的门控策略。对于将用于 post 分类分析并要求更高的 DNA/RNA 提取能力的分离细胞, 建议在任何固定和/或性程序中不使用生存力污点。甲醛固定的细胞可能损害核酸的完整性, 由于核酸蛋白交联, 从而限制隔离效率, 检测, 准确的量化。前面提到的单元聚集体不能只对发射的 auto-fluorescent 信号产生作用, 还会导致 "巧合中止"。这种作用发生在某种程度上保持高纯度, 但如果太频繁, 就会降低细胞的产量。在细胞染色过程中辅以 dnasei 和氯化镁2的排序缓冲区 (外地资产缓冲区) 可以最小化单元聚合。建议不要将 EDTA 与 dnasei 结合使用, 因为它能抑制酶的活性。在分类前通过70µm 细胞过滤器筛选单细胞悬浮液, 也可以从聚合体中释放细胞。必须注意的是, 为了尽量减少聚集, 细胞悬浮液的浓度应在每毫升500万细胞的最低量0.4 毫升。从脂质载货组织分离的细胞倾向于聚集, 这可能导致巧合流产和低排序产量。如果聚合仍然存在, 则建议进一步稀释样本。排序的巨噬细胞可以收集在聚丙烯圆底收集管含有胎儿牛丰富的培养基, 以最大限度地恢复细胞。初始高 FBS 浓度确保细胞恢复, 因为浓度最终变得稀释每一个排序滴。对于收集将用于 DNA 或 RNA 分析的细胞, 细胞可以直接分类到适当的萃取试剂 (例如TriZol), 以防止核糖核酸污染。在对高容量进行排序时, 建议先将单元格划分为培养基, 并辅以低浓度的 FBS。紧接着排序后, 细胞应该是颗粒和裂解的 DNA/RNA 提取。分离的遗传物质可以被描述为改变的基因表达。亲炎基因, 包括 TNFα, IL1-β, IL-6, IL-12, 1 升-23, IFNγ, Nos2, MCP1 (CCL2) 往往上调在巨噬细胞表现出一个经典的激活 (M1) 表型39。另一方面, 在巨噬细胞中激活的 (M2) 表型通常由编码 Chi3l3 (Ym1)、Fizz1、酸1、CD206、CD163、CD209 1 l-10 和 TGFβ34,40的基因诱导标记。最近, CD38、Fpr2 和 Gpr18 已被证实为 M1-specific 基因、c-myc 和 Egr2 为 M2-specific 基因34。
虽然多色流 cytometry-based 细胞分类是一个宝贵的工具, 以隔离巨噬细胞在高纯度, 这种方法可能是昂贵的。在细胞分类器维护试剂的高成本的情况下, 利用分选机进行排序的强大优势在于操作人员能够操纵单元分拣机。替代方法可以替代昂贵的流式细胞仪的细胞分类。它们包括磁性活化细胞分选 (mac) 或密度梯度离心。第一个替代的细胞分类方法提到的包括磁性和/或微柱隔离套件, 以分离的细胞的兴趣从血液或固体组织41。第二单元分选方法根据离心的密度和力, 将异质细胞悬浮分离。不幸的是, 密度介导的离心是不实用的孤立巨噬细胞从主动脉或笏衍生单细胞悬浮。通常, 从离心分离得到的产品受到污染, 产量低。因此, 较小的组织 (如主动脉或笏), 导致少量的细胞最初在酶消化后, 是不理想的差异离心的候选。另一方面, 从分离的肝脏中提取的细胞悬浮液可以产生足够数量的排序的巨噬细胞, 可以用于后一类的实验和分析, 如文化刺激, qPCR, 或西方印迹分析。这些替代办法也可用于在外地资产管制方案之前丰富人口, 允许更清洁的种类。值得注意的是, 组织驻留的巨噬细胞在笏、肝和主动脉中占整个细胞总数的一小部分。在对不太频繁的细胞进行分离的时候, 在对细胞进行分类之前, 先将其浓缩。隔离小种群的一个常见问题是, 必须处理大的单元格数, 才能获得足够的单元以供后续分析。浓缩或预可用于解决此类问题。这种方法有助于通过积极和消极的选择来获得更简明的细胞数量, 但它也允许时间的守恒, 因为对于密集的组织来源, 如肝脏, 这是一个持久的过程。
炎症生物学的最新进展突出了巨噬细胞异质性的表型和功能表征的重要性, 进一步了解这些免疫细胞在调节慢性炎症中的复杂作用。简言之, 这一全面的协议提供了一个多维的方法来表征组织居民巨噬细胞从三标志性组织研究的既定饮食诱发肥胖和炎症模型。更重要的是, 这项议定书考虑到的困难和必要的措施, 隔离干净的单细胞悬浮从失调发炎的组织, 如笏, 主动脉斑块和脂肪肝。该协议允许研究员应用流式细胞仪和在一个创新的维度分类工具, 以表征组织驻留巨噬细胞, 主要的调节炎症的肥胖。深入描述巨噬细胞的种群动力学可以提供洞察到单核细胞贩运的发炎组织和允许持续的机械评价通过大量的实验方法对排序巨噬动物。进一步刻画巨噬细胞的数量可以提供一个关键的洞察力的生物基础, 调节巨噬细胞的异质性在健康和疾病。
披露声明
作者没有利益冲突的披露。
致谢
我们要感谢宾夕法尼亚州立大学千禧科学综合体的流式细胞仪核心设施。
材料
| Name | Company | Catalog Number | Comments |
| 26 G x 5/8 in Needles | BD | 305115 | |
| 23 G x 0.75 in needle x 12 in. tubing Blood Collection Set | BD | 367297 | Used for cannulation of subhepatic IVC during liver perfusion |
| 21 G 1 1/2 in. Needles | BD | 305156 | |
| 1 mL syringe with rubber stops | BD | 309659 | |
| 10 mL Syringes | BD | 309604 | |
| 1 mL Syringe | BD | 309659 | |
| F4/80 PE | Biolegend | 123110 | |
| CD11c PE/Cy7 | Biolegend | 117318 | |
| CD11b PE/Cy5 | eBioscience | 15-0112-81 | |
| Anti-mouse CD16/32 Fc Block | Biolegend | 101320 | |
| CD45 Pacific Blue | Biolegend | 103126 | |
| PE Rat IgG2a | Biolegend | 400508 | |
| PE/Cy7 Armenian Hamster IgG | Biolegend | 400922 | |
| PE/Cy5 Rat IgG2b | Biolegend | 400610 | |
| Pacific Blue Rat IgG2c | Biolegend | 400717 | |
| Dulbecco’s Modified Eagle Medium (DMEM) | Cellgro | 15-017-CV | |
| 1x Phosphate Buffered Saline (PBS) | Cellgro | 21-031-CV | |
| 70 μm cell strainers | Corning, Inc. | 352350 | |
| 1.7 mL microcentrifuge tube | Denville | C2170 | |
| Paraformaldehyde Aqueous Solution -16x | Electron Microscopy Sciences | CAS #30525-89-4 | |
| Micro Dissecting Scissors, 3.5 inch, Straight, 23 mm, Sharp | Stoelting | 52132-10P | Used for general dissecting purposes |
| Micro Forceps, 4 inches, full curve, 0.8 mm | Stoelting | 52102-37P | Used for general dissecting purposes |
| Spring dissection scissors – 3 mm Cutting edge | Fine Science Tool | 15000-10 | Used for aorta dissection Steps 1.3.3.17 to 1.3.3.28 |
| Curved 0.07 mm x 0.04 mm Tip Forceps | Fine Science Tool | 11297-10 | Used for aorta dissection Steps 1.3.3.17 to 1.3.3.28 |
| Hemostatic Forceps (Curved) | Fine Science Tool | 13021-12 | |
| Heparin Sodium Salt | Fischer Scientific | 9041-08-1 | |
| 35 mm Cell Culture/Petri Dishes | Fischer Scientific | 12-565-90 | |
| Polystyrene Petri Dishes (10 cm) w/lid | Fischer Scientific | 08-757-100D | |
| 15 mL Conical Centrifuge Tubes (Polypropylene) | Fischer Scientific | 14-959-53A | |
| 50 mL Conical Centrifuge Tubes (Polypropylene) | Fischer Scientific | 14-432-22 | |
| 5 mL Round-Bottom Polystyrene Tubes | Fischer Scientific | 14-959-5 | |
| Fetal Bovine Serum | Gemini Bio-Products | 100-106 | |
| Ethanol (Stock Ethyl Alcohol Denatured, Anyhydrous) | Millipore | EX0285-1 | |
| Bovine Serum Albumin | Rockland | BSA-50 | |
| HEPES | Sigma-Aldrich | H3375 | |
| Collagenase Type II | Sigma-Aldrich | C6885 | |
| Collagenasse Type XI | Sigma-Aldrich | C7657 | |
| Hyaluronidase Type I | Sigma-Aldrich | H3506 | |
| DNAse | Sigma-Aldrich | DN25 | |
| Collagenase Type I | Sigma-Aldrich | C0130 | |
| NaOH | Sigma Aldrich | 1310-73-2 | |
| CaCl2 | Sigma Aldrich | 449709-10G | |
| 500 mL beaker | Sigma Aldrich | 02-540M | |
| 4 cm Hemostatic clamp | Stoelting | 52120-40 | |
| Toothed forceps | Stoelting | 52104-33P | |
| 50 μm Disposable filters | Systemex | 04-0042-2317 | |
| Collagenase Type IV | ThermoFischer Scientific | 17104019 | |
| Ammonium Chloride Potassium (ACK) | ThermoFischer Scientific | A1049201 | |
| Razors (0.22 mm (0.009")) | VWR International | 55411-050 | |
| Texas Red Live/Dead stain | Red viability stain (in Figure 1A) |
参考文献
- Davies, L. C., Taylor, P. R. Tissue-resident macrophages: Then and Now. Immunology. 144 (4), 541-548 (2015).
- Kahn, S. E., Hull, R. L., Utzschneider, K. M. Mechanisms linking obesity to insulin resistance and type 2 diabetes. Nature. 444 (12), 840-846 (2006).
- Van Gaal, L. F., Mertens, I. L., De Block, C. E. Mechanisms linking obesity with cardiovascular disease. Nature. 444 (12), 875-880 (2006).
- Jung, U., Choi, M. -S. Obesity and Its Metabolic Complications: The Role of Adipokines and the Relationship between Obesity, Inflammation, Insulin Resistance, Dyslipidemia and Nonalcoholic Fatty Liver Disease. Int J Mol Sci. 15 (4), 6184-6223 (2014).
- Emanuela, F., Grazia, M., Marco, D. R., Maria Paola, L., Giorgio, F., Marco, B. Inflammation as a link between obesity and metabolic syndrome. Nutr Metab. 2012, 1-7 (2012).
- Vieira-Potter, V. J. Inflammation and macrophage modulation in adipose tissues. Cell Microbiol. 16 (10), 1484-1492 (2014).
- Chawla, A., Nguyen, K. D., Goh, Y. P. S. Macrophage-mediated inflammation in metabolic disease. Nat Rev Immunol. 11 (11), 738-749 (2011).
- Dey, A., Allen, J., Hankey-giblin, P. A. Ontogeny and polarization of macrophages in inflammation : blood monocytes versus tissue macrophages. Front Immunol. 5 (1), 1-15 (2015).
- Mills, C. D., Lenz, L. L., Ley, K. Macrophages at the fork in the road to health or disease. Front Immunol. 6 (2), 1-6 (2015).
- Italiani, P., Boraschi, D. From monocytes to M1/M2 macrophages: Phenotypical vs. functional differentiation. Front Immunol. 5 (8), 1-22 (2014).
- Guilherme, A., Virbasius, J. V., Vishwajeet, P., Czech, M. P. Adipocyte dysfunctions linking obesity to insulin resistance and type 2 diabetes. Nat Rev Mol Cell Biol. 9 (5), 367-377 (2008).
- Cummins, T. D., Holden, C. R., et al. Metabolic remodeling of white adipose tissue in obesity. Am J Physiol Endocrinol Metab. 307 (3), 262-277 (2014).
- Fujisaka, S., Usui, I., et al. Regulatory Mechanisms for Adipose Tissue M1 and M2 Macrophages in Diet Induced Obese Mice. Diabetes. 58 (9), 2574-2582 (2009).
- Lumeng, C. N., Bodzin, J. L., Saltiel, A. R. Obesity induces a phenotipic switch in adipose tissue macrophage polarization. J Clin Invest. 117 (1), 175-184 (2007).
- Qureshi, K., Abrams, G. A. Metabolic liver disease of obesity and role of adipose tissue in the pathogenesis of nonalcoholic fatty liver disease. World J Gastroenterol. 13 (26), 3540-3553 (2007).
- Bedossa, P., Paradis, V. Liver extracellular matrix in health and disease. J Pathol. 200 (4), 504-515 (2003).
- Tilg, H., Moschen, A. R. Evolution of inflammation in nonalcoholic fatty liver disease: The multiple parallel hits hypothesis. Hepatology. 52 (5), 1836-1846 (2010).
- Milic, S., Lulic, D., Stimac, D. Non-alcoholic fatty liver disease and obesity: Biochemical, metabolic and clinical presentations. World J Gastroenterol. 20 (28), 9330-9337 (2014).
- Williams, I. L., Wheatcroft, S. B., Shah, A. M., Kearney, M. T. Obesity, atherosclerosis and the vascular endothelium: mechanisms of reduced nitric oxide bioavailability in obese humans. Int J Obesity. 26 (12), 754-764 (2002).
- Mestas, J., Ley, K. Monocyte-Endothelial Cell Interactions in the Development of Atherosclerosis. Trends Cardiovasc Med. 18 (6), 228-232 (2008).
- Wynn, T. A., Chawla, A., Pollard, J. W. Macrophage biology in development, homeostasis and disease. Nature. 496 (7446), 445-455 (2013).
- Davies, L. C., Jenkins, S. J., Allen, J. E., Taylor, P. R. Tissue-resident macrophages. Nat Rev Immunol. 14 (10), 986-995 (2013).
- Basu, S., Campbell, H. M., Dittel, B. N., Ray, A. Purification of specific cell population by fluorescence activated cell sorting (FACS). J Vis Exp. (41), e1546(2010).
- Mann, A., Thompson, A., Robbins, N., Blomkalns, A. L. Localization, Identification, and Excision of Murine Adipose Depots. J Vis Exp. (94), e52174(2014).
- Smedsrød, B. Protocol for preparation of mouse liver Kupffer cells and liver sinusoidal endothelial cells. 1, Available from: http://munin.uit.no/handle/10037/4575 1-10 (2012).
- Butcher, M. J., Herre, M., Ley, K., Galkina, E. Flow cytometry analysis of immune cells within murine aortas. J Vis Exp. (53), e2848(2011).
- Salamone, M., Saladino, S., Pampalone, M. Tissue Dissociation and Primary Cells Isolation Using Recombinant Collagenases Class I and II. Chemical Engineering Transactions. 38, Matsushita 1994 247-252 (2014).
- Wells, R. G. The role of matrix stiffness in regulating cell behavior. Hepatology. 47 (4), 1394-1400 (2008).
- Fain, J. N. Isolation of Free Brown and White Fat Cells. Diabetologia. 375 (1964), 555-561 (1968).
- Seglen, P. Preparation of isolated rat liver cells. Method Cell Biol. 13, 29-83 (1976).
- Yu, S., Allen, J. N., et al. The Ron Receptor Tyrosine Kinase Regulates Macrophage Heterogeneity and Plays a Protective Role in Diet-Induced Obesity, Atherosclerosis, and Hepatosteatosis. J Immunol. 197 (1), 256-265 (2016).
- Yu, Y. R. A., O'Koren, E. G., et al. A protocol for the comprehensive flow cytometric analysis of immune cells in normal and inflamed murine non-lymphoid tissues. PLoS ONE. 11 (3), 1-23 (2016).
- Zizzo, G., Hilliard, B. A., Monestier, M., Cohen, P. L. Efficient clearance of early apoptotic cells by human macrophages requires "M2c" polarization and MerTK induction. J Immunol. 100 (2), 130-134 (2012).
- Jablonski, K. A., Amici, S. A., et al. Novel markers to delineate murine M1 and M2 macrophages. PLoS ONE. 10 (12), 5-11 (2015).
- Rőszer, T. Understanding the Mysterious M2 Macrophage through Activation Markers and Effector Mechanisms. Mediators of Inflamm. 2015, 1-16 (2015).
- Cho, K. W., Morris, D. L., Lumeng, C. N. Flow Cytometry Analysis of Adipose Tissue Macrophages. Methods Enzymol. 4 (164), 297-314 (2011).
- Kim, Y. -J., Brox, T., Feiden, W., Weickert, J. Technical Note: Flow Cytometry Controls, Instrument Setup, and the Determination of Positivity. Cytometry A. 71 (1), 8-15 (2007).
- Tung, J. W., Heydari, K., et al. Modern Flow Cytometry: A Practical Approach. Clin Lab Med. 27 (3), 453-468 (2007).
- Martinez, F. O., Gordon, S. The M1 and M2 paradigm of macrophage activation: time for reassessment. F1000. 6 (3), 13(2014).
- Porcheray, F., Viaud, S., et al. Macrophage activation switching: An asset for the resolution of inflammation. Clin Exp Immunol. 142 (3), 481-489 (2005).
- Plouffe, B. D., Murthy, S. K., Lewis, L. H. Fundamentals and Application of Magnetic Particles in Cell Isolation and Enrichment. Rep Prog Phys. 1 (78), 1-6 (2010).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。