Method Article
Использование GFP-меченый TMEM184A Построить подтверждения гепарин Receptor идентичности
В этой статье
Резюме
Кодирующий конструкцию TMEM184A с GFP меткой на карбокси-конце, предназначенной для экспрессии эукариотических, использовали в тестах, предназначенных для подтверждения идентификации TMEM184A как гепарин рецепторов в клетках сосудов.
Аннотация
Когда новые белки идентифицированы путем изоляции и биоинформатики анализа аффинности на основе, они часто в значительной степени неизвестными свойствами. Антитела против специфических пептидов в пределах предсказанного последовательности позволяют некоторые эксперименты по локализации. Тем не менее, другие возможные взаимодействия с антителами, часто не могут быть исключены. Такая ситуация дала возможность разработать комплекс анализов в зависимости от последовательности белка. В частности, конструкция, содержащая последовательность гена, соединенную с кодирующей последовательностью GFP на С-конце белка, был получен и использован для этих целей. Эксперименты охарактеризовать локализацию, лиганд сродство, и усиление функции изначально были разработаны и проведены , чтобы подтвердить идентификацию TMEM184A как гепарин рецептора 1. Кроме того, конструкция может быть использована для проведения исследований, касающихся мембранных вопросов топологии и подробные белок-лиганд. В настоящем докладе А.Р.Анж экспериментальных протоколов, основанных на GFP-TMEM184A конструкции, выраженной в клетках сосудов, которые могут быть легко адаптированы для других новых белков.
Введение
Идентификация белков-кандидатов для новых функций часто зависит от аффинности на основе протоколов изоляции с последующим определением частичной последовательности. Недавние примеры вновь выявленных белков включают трансмембранного белка 184А (TMEM184A), гепарин рецептор идентифицирован после того, как гепарин аффинных взаимодействий 1 и TgPH1 домен белка pleckstrin гомологии , который связывает фосфоинозитидного PI (3,5) P 2 2. Другие новые идентификации белков включает в себя прямой анализ последовательности пептидов , таких как , что с помощью Vit, и др. которые использовали трансмембранных пептидов для идентификации белковых продуктов из ранее охарактеризованных генов 3. Аналогичным образом , идентификация новых белковых последовательностей может быть осуществлено с использованием биоинформатики поиске ранее характеризуемых семейств белков , таких как идентификация новых белков 4TM 4. Изучение последовательностей генов аквапорин семьи имеет алтак дали идентификацию новых членов с новыми функциями 5. После идентификации, анализа функции белка, как правило, следующий шаг, который иногда может быть исследована с помощью специального анализа функции белка, таких как в случае аквапорин.
Когда это возможно, функция вновь идентифицированного белка могут быть изучены с специфической ферментативной или аналогичных функциональных анализов в лабораторных условиях . Поскольку многие функции новых белков зависят от сложных взаимодействий , которые происходят только в интактных клетках или организмов, в анализах пробирке не всегда эффективны. Тем не менее, in vivo на анализы должны быть сконструированы таким образом , что они зависят от последовательности гена. В культуре клеток и / или простых модельных организмов, нокдаун может предоставить подтверждающие доказательства для идентификации белка / функции 6. С помощью новых белков, идентифицированных как было отмечено выше, часто бывает недостаточно, чтобы просто сбить белок, чтобы подтвердить функцию, А.Н.d дизайн функциональных анализов in vivo на которые зависят от последовательности гена становится важным для характеристики новых белков.
Недавнее определение TMEM184A как рецептор гепарин (который модулирует пролиферацию в гладких мышцах сосудов и воспалительных реакций в эндотелиальных клетках) с использованием аффинной хроматографии и MALDI MS 1, 7 предоставляется возможность разработать набор анализов после нокдауна дали результаты , согласующиеся с идентификацией , Недавний обзор подтвердил , что гепарин специфически взаимодействует со многими факторами роста, их рецепторов, компонентов внеклеточного матрикса, рецепторы клеточной адгезии, а также другие белки 8. В сосудистой системе, гепарин и гепарансульфат протеогликанов (содержащий гепарансульфат цепи сходен по структуре с гепарином) взаимодействуют с несколькими сотнями белков 9. Для того, чтобы подтвердить, функционально ТНАт TMEM184A был связан с поглощением гепарин и переплета, были разработаны методы, которые использованы генную конструкцию для TMEM184A. Настоящий доклад включает в себя набор анализов на основе GFP-TMEM184A построить для использования в подтверждении идентичности TMEM184A как рецептор гепарином.
протокол
1. Дизайн GFP-белка Construct
- Покупка, или дизайн и сборка, конструкция GFP-меченый на основе рассматриваемого белка.
Примечание: Для получения купленного конструкции, стандартные векторы доступны из коммерческих лабораторий, которые включают все или некоторые из следующих предложений: Для получения мембранного белка, выберите С-концевую расположение GFP, потому что это менее вероятно, мешать мембранном белка. Рассмотрим расширение между интересующим геном и GFP, если есть основания полагать, что С-конец рассматриваемого белка компактно сложить в области белка. Выберите конструкцию для общего выражения эукариотических клеток, но позволяют построить производство в бактериальных системах. Включить сайт расщепления (например, для протеазы TEV), с помощью которого GFP может быть удален, если требуется для некоторых экспериментов, где GFP может помешать активности белка. Добавить другие вставки, такие как дополнительный тег для локализации или аффинность ввзаимодействиями (например, His6). Это не было необходимо для анализов, описанных здесь, но может облегчить другие анализы, или быть полезным непосредственно рядом с геном, перед GFP, если удаление GFP желательно.
2. GFP-TMEM184A экспрессии в клетках сосудов
- Культура эндотелиальной или клеток гладких мышц сосудов на 0,2% покрытые желатином чашки для культивирования тканей , как сообщалось ранее 1, 6, 7.
- Добавить 5 мл раствора для культивирования клеток трипсина (0,5% вес / об) к промытой 100 мм или больше, сливающийся блюдо из клеток. Инкубируют при 37 ° С до тех пор, пока клетки не только освобождены от пластины, и передачи клеток в стерильную полипропиленовую центрифужную пробирку.
- Добавление ингибитора трипсина (например, равного объема регулярных культуральной среды), как он используется в повседневной культуре, к решению клеток / трипсина , чтобы ограничить активность трипсина. Гранул клетки в течение 5 мин при approximленно 600 XG (или соответствующая скорость и время, чтобы просто осадить клетки для стандартной тканевой культуры). Аспирируйте супернатант.
- Ресуспендируют клеток в 1 мл HeBS (Hepes-буферном физиологическом растворе) буфера для электропорации, ограничивая количество времени клеток в осадке или суспензии. Поместите клеточной суспензии на льду и выполнять оставшиеся шаги на льду.
Примечание: на пеллетах можно мыть один раз с HeBS до взмучивания. - Добавьте достаточный объем GFP-меченый TMEM184A плазмиды в клетки, чтобы достичь конечной концентрации 20 мкг / мл ДНК. Используйте идентичный протокол для GFP конструкции.
- Поместите примерно 0,4 мл раствора клеток в HeBS в кювету для электропорации. Предварительно охладить кюветах перед использованием.
- Электропорации клетки с использованием следующих условий: экспоненциальному затуханию, 500 мкФ, ∞ Ом, и 170 В.
Примечание: Напряжение для данного типа клеток должны быть оптимизированы. Предварительные исследования с эндотелиальной и CEL гладких мышцл типа были выполнены с помощью GFP-винкулин конструкции для определения оптимального значения напряжения отметить, например , 10.- Для оптимизации электропорации, начните с рекомендациями изготовителя оборудования (которые включают в себя условия для некоторых стандартных типов клетки). Используйте желаемую конструкцию или управления флуоресцентного белка построить аналогичные по размеру и флуоресцентных характеристик до желаемой конструкции.
Примечание: Малые нуклеиновые кислоты появляются проникать в клетки легче, чем более крупные конструктов, поэтому конструкция с только флуоресцентного белка может быть легче выразить, чем больший. - С помощью флуоресцентной микроскопии для определения жизнеспособности клеток, процент клеток, в которых флуоресцентный конструкция выражается через 24 и 48 ч, а интенсивность экспрессии.
ПРИМЕЧАНИЕ: Уменьшите напряжение и / или время немного, если выживание низка. Стремитесь самое короткое время между выходом из клеток с поверхности культуры и возвращенияклетки в культуре для повышения выживаемости. Незначительное увеличение времени или второго импульса может улучшить поглощение конструкт, если выживание является высоким, и выражение является низким. Оптимальные условия и выражение будет варьироваться между типами клеток. Если процент клеток, экспрессирующих конструкцию высока, но интенсивность мала, повышение концентрации ДНК и мониторинга трансфектированных клеток в течение долгого времени для обеспечения оптимальной интенсивности, которая будет варьироваться в зависимости от белка полураспада, а также выражение, может повысить интенсивность. Окрашивание интенсивность может быть увеличено для некоторых анализов, в случае необходимости, с помощью иммунофлуоресценции окрашивание GFP с анти-GFP антител
- Для оптимизации электропорации, начните с рекомендациями изготовителя оборудования (которые включают в себя условия для некоторых стандартных типов клетки). Используйте желаемую конструкцию или управления флуоресцентного белка построить аналогичные по размеру и флуоресцентных характеристик до желаемой конструкции.
- После электропорации, семена клеток в шесть 30 мм для тканевых культур скважин с покровные для визуализации или в ткани блюда культуры. Культуры клеток с использованием стандартных процедур клеточной культуры.
- Дополнительно: Заменить питательную среду после 24 часов, чтобы удалить электропорации буфера СЭП.
3. Визуализация GFP-TMEM184A Локализация
- Промыть клетки с PBS и осторожном встряхивании после культивирования в течение не менее 24 ч. Ограничение воздействия яркого света, чтобы избежать выцветания GFP.
- Закрепить клетки с 4% параформальдегида (PFA) в PBS в течение 15 мин при комнатной температуре при осторожном встряхивании. Избегайте использования каких-либо метанолсодержащий реагенты, которые могут клетки проницаемыми. Фиксирование с метанолом можно использовать, если нет необходимости, чтобы оценить лиганд.
Внимание: параформальдегид является токсичным. Используйте соответствующие средства индивидуальной защиты. Использование в вытяжном шкафу, с осторожностью, и отказаться от должным образом. - Полоскание с PBS, как описано выше. Для окрашивания антител на основе см 3.6 ниже.
- Маунт-покровные к слайдам с помощью Mowiol или другого подходящего монтажного среды.
- слайды изображений с помощью конфокальной или флуоресцентного микроскопа с соответствующими наборами фильтров для GFP возбуждения и спектров излучения. Конфокальной микроскопии является предпочтительным из-за способности отдельные пробы в плоскости г. Сохранение изображений в шкале серого для QuЦели antitation в формате TIF (в дополнение к полноцветных изображений для иллюстраций).
- Для сравнения с WT TMEM184A выраженным клетками, подготовить другие клетки для иммунофлуоресценции с использованием первичных антител , подготовленных к пептиду (ы) из последовательности TMEM184A, например 1. Идентификация GFP-TEMEM184A также может быть осуществлено с использованием антител против GFP. Оценить оба образца клеток от идентичных методов микроскопии.
4. родамина-гепаринсвязывающий и колокализацию с GFP-TMEM184A-трансфецированных клеток
- Treat GFP-TMEM184A-экспрессирующих клеток с 100 мкг / мл родамина-гепарина добавляют к культуральной среде, и позволяют клеткам инкубировать в течение определенного промежутка времени, как правило, менее чем на 10 мин для клеток A7r5. Промыть и зафиксировать, как в 3.1 и 3.2.
Примечание: Оптимальное время и концентрация лиганда зависит от клеточного ответа, интенсивности флуоресценции от интенсивности лиганда и изображения, полученного. Это Концентратион гепарина был применен , поскольку он приводит к более чем 50% ответа в других анализах 11. Эта концентрация может быть визуализированы с использованием стандартных методов флуоресцентной микроскопии, поэтому не надо было увеличить его. Разбавление родамина-гепарина с немеченых результатами гепарин в нижней флуоресценции в клетках, таким образом, более трудно изображения и количественно. - Для количественной оценки родамина-гепаринсвязывающий в связи с GFP-TMEM184A трансфекции, готовят идентичные клетки без трансфицированных GFP-TMEM184A.
- Изображение клетки с помощью конфокальной микроскопии с соответствующим GFP (488 нм) и родамина (543 нм) возбуждения и излучения - значений (500 530 нм для GFP и больше, чем 560 нм для родамина) для определения совместной локализации. Получение изображений по меньшей мере, 50 клеток, по меньшей мере трех отдельных экспериментов для получения статистических данных. Поддерживать идентичные настройки в экспериментах, и используют образец (ы) управления (например, трансфицированные клетки без обработки) -мна могут быть использованы для стандартизации данных для анализа нескольких экспериментов.
- Изучите изображения, используя компьютерную программу для определения связывания / поглощения в каждой ячейке для количественного связывания относительной родамин.
Примечание: TIF изображения должны быть использованы, поскольку они удобны для анализа и могут быть преобразованы в оттенки серого во многих компьютерных программ, если они не были первоначально сохранены в этом формате. Изображение J (бесплатный) был использован в данном анализе, и позволяет площадь и интенсивность пикселя, чтобы измерить для любого заданного пользователем области в изображении.- Используйте инструмент произвольной формы, чтобы окружить ячейку внутри флуоресцентного изображения и использовать инструмент измерения для определения интенсивности в пределах этого пространства.
Примечание: Эти измерения обеспечивают необходимую информацию для расчета общей интенсивности для определенной пользователем зоны (целой клетки, ядра и т.д.) , что обеспечивает возможность сравнивать различные клетки с различной геометрией. Средняя интенсивность на площади фона могут быть представлены, и что облегчитs коллекция интенсивности фона для анализа. - Экспорт в электронную таблицу для вычисления площади зависит от интенсивности и вычитать фон для той же величину площади. Нормальное флуоресцентное / ячейку для достаточное количество клеток / эксперимента для получения статистической значимости.
- Используйте инструмент произвольной формы, чтобы окружить ячейку внутри флуоресцентного изображения и использовать инструмент измерения для определения интенсивности в пределах этого пространства.
5. флуоресцентного резонанса Передача энергии от GFP-TMEM184A к родамина-гепарином
- Подготовка трансфектированных клеток и инкубировать с 200 мкг / мл родамина-меченый лиганд, в разделе 3.1. Обратите внимание, что время инкубации с флуоресцентным лиганда типа клеток зависит. Устранить только с PFA, и смонтировать слайды для работы с изображениями.
- Во-первых, возбуждают при 405 нм и изображения для излучения родамина (566 - 685 нм; FRET). Во-вторых, возбуждают на 488 для GFP (изображения на 493 - 530), и в-третьих, возбуждают 561 для родамина (изображения при 566 - 685). Элементы управления без GFP-TMEM184A или без родамина-гепарина имеют решающее значение.
6. Live-ячейки изображения родамина-Hepariп Усвоение
- Семя GFP-TMEM184A трансфицированных клеток в отдельные блюда, предназначенные для живых клеток и лечения, как в протоколе 3.
Примечание: Число ячеек, требуемых в зависимости от типа клеток и плотности желаемой. Для того, чтобы свести к минимуму количество времени, клетки в суспензии, не учитываются клетки. Семенной клетки из сливающийся блюдо 100 мм на шесть 35-мм чашках живого изображения для получения клеток вблизи впадения в 48 ч. - Через 48 ч, замените носитель с культуральной средой без фенолового красного.
- Передача блюдо из клеток в конфокальной микроскопии с этапа потепления для поддержания температуры, и фокус микроскопа.
- Пипеткой 100 мкг / мл родамина-гепарин в блюдо и аккуратно перемешать.
- Немедленно начать запись изображения в реальном времени. Если не поглощение клеток гепарина не происходит в пределах области в поле зрения, слегка переместить антенну, чтобы идентифицировать клетки с по меньшей мере, один зеленый пузырек, содержащий метку родамина.
ПРИМЕЧАНИЕ: Визуализация возбуждения и излучения особенности являютсятакой же, как для протокола поглощения гепарин (раздел 5). Период времени между изображениями составлял приблизительно 16 лет. Условия эксперимента и микроскопа, как правило, определяют скорость, с которой могут быть получены изображения.
7. Выделение GFP-TMEM184A и GFP из культивируемых клеток
- После удаления культуральной среды и промыванием PBS, добавляют 2 мл 0,2% (вес / объем) раствор CHAPS 1X PBS с ингибиторами протеазы до 150 мм пластины клеток, экспрессирующих GFP-TMEM184A или GFP (для управления анализах связывания). Скрип клетки из чашки, положите раствор клетки / CHAPS в 15 мл полипропиленовую пробирку на льду, и хорошо перемешать, нажав. Выполните все шаги в ярком свете, чтобы гарантировать, что GFP метка отбеливают для анализа связывания ниже.
- Для того, чтобы специфически связывать GFP-TMEM184A (или соответствующего управления GFP), добавьте 2 мкг / мл биотинилированного анти-GFP антитела к раствору и инкубируют в течение ночи при 4 ° C с качалки.
- Добавить 500 мклстрептавидина-агарозы бисером по крайней мере, 5 мл 0,2% CHAPS / PBS и центрифуге при приблизительно 600 мкг в течение от 3 до 5 мин. Удалить супернатант. Повторите еще два раза со свежим CHAPS / PBS, каждый раз. Добавить бусин в раствор антител и клеток и инкубируют в течение ночи при 4 ° C с качалки, чтобы шарики связываться с биотинилированным анти-GFP антитела, связанного с GFP или GFP-TMEM184A.
- Гранул бисер при центрифугировании (как в 7.3) и удаления несвязанного материала. Добавить ингибиторы по меньшей мере, 5 мл 0,2% CHAPS / PBS / протеазы помыть. Повторить промывку и центрифугирования, по меньшей мере в 3 раза для эффективного удаления несвязанного белка.
- После удаления последней промывки, инкубировать бусинки с 1 мл 0,2 М глицин / 0,2% CHAPS в PBS (рН до 2,0 с помощью HCl) на льду в течение 3 мин, чтобы диссоциировать антитело-GFP, связывание (что приводит к свободной GFP-TMEM184A или бесплатно GFP). Осторожно перемешать, нажав каждые 30 сек.
- Центрифуга при приблизительно 600 XG и передавать супернатант, содержащий очищенный рrotein на новую 15 мл трубки с последующей немедленной нейтрализацией с 5 мл 1 М бикарбоната натрия (довести рН до 7).
- Концентрат образца, используя 10000 Дальтон молекулярную массу СВЕТОТЕНЕВОЙ центробежный концентратор (используют скорость центрифугирования, рекомендованный поставщиком). Когда объем достигает приблизительно 0,5 мл, добавляют 0,2% CHAPS / PBS. Продолжить концентрации и добавляя больше 0,2% CHAPS / PBS до тех пор, по крайней мере, десять томов (раз объем образца начальная) от 0,2% CHAPS / PBS не добавлены.
- Для того, чтобы определить оценку количества изолированной GFP или GFP-меченый белок, получить поглощение при 280 нм и сравнивают его со стандартной кривой, полученной из бычьего сывороточного альбумина или другого белка управления в том же самом буфере.
Примечание: Из-за разницы коэффициентов экстинкции, эта концентрация является оценкой, но может обеспечить приблизительную концентрацию белка для облегчения дальнейшего анализа без потерь пробы. Точная концентрация белка может быть сдерживатьдобывали с помощью белкового анализа микро-Lowry они удостоверяться подготовки стандартного белка в том же буфере, что и образец. Дальнейший анализ изолированного белка может быть достигнуто с помощью вестерн-блоттинга изолированного белка (с использованием функции обнаружения антител к GFP), и сравнение с предсказанной молекулярной массой. В качестве альтернативы, использование TMEM184A антител должно приводить к полосе предсказанного размера конструкта, но также может привести к группе WT TMEM184A если димеров (или олигомеров высшего порядка) присутствуют в образце. Оценка чистоты может быть получена путем окрашивания пятном на общий белок из выделенного образца против общего белка из аликвоты исходного материала.
8. In Vitro гепарин Анализ связывания
- Приготовьте черный покрытые авидином 96-луночного планшета путем промывки 200 мкл 0,2% CHAPS / PBS три раза в течение 5 мин при встряхивании. Готовят идентичную черный неокрашенной 96-луночного планшета с использованием той же процедуры промывки. Подготовитьмакет для экспериментальных образцов (в трех экземплярах), чтобы следовать в процессе анализа. Включить лунки для стандартных концентраций гепарин, управления буфером и лунки с образцами без GFP гепарин для подтверждения отбеливания GFP.
Примечание: Если оптимизированная изоляция или взаимодействие лиганда буферы различны для рассматриваемого белка, сделать все препараты плиты и мойки с оптимальной буферной системой. - Добавьте 100 мкл 60 пмоль / лунку биотинилированного анти-GFP во все лунки в пластине покрытые авидином, где GFP связывание желательно. Количество антитела, достаточно просто насытить имеют высокое сродство авидин в лунках.
- Добавить буфер только для всех скважин, используемых для целей контроля (без GFP или GFP-TMEM184A связывание желательно). Уплотнение скважин с накрыватель для предотвращения испарения. Инкубировать в течение 2 ч при комнатной температуре при встряхивании.
Примечание: Объемы добавлены к лункам и времени инкубации основаны на рекомендациях поставщика.
- Добавить буфер только для всех скважин, используемых для целей контроля (без GFP или GFP-TMEM184A связывание желательно). Уплотнение скважин с накрыватель для предотвращения испарения. Инкубировать в течение 2 ч при комнатной температуре при встряхивании.
- Вымойте все лунки три разав течение 5 мин с 200 мкл 0,2% CHAPS / PBS.
- Добавьте 100 мкл 5 нмоль / лунку GFP-TMEM184A или GFP в соответствующие лунки в пластине покрытые авидином и инкубируют в течение 1 ч при комнатной температуре при встряхивании. Вымойте снова, как в 8.3.
Примечание: Эта была выбрана концентрация белка, чтобы гарантировать, что все сайты насыщали с избытком GFP или GFP-TMEM184A. Это важно, чтобы гарантировать, что то же самое количество белка обязан каждую лунку. Более низкие количества белка также могут насытить сайты, возможность того, что можно было бы рассмотреть путем оценки несвязанного белка, остающегося после инкубации нескольких концентраций белка с пластиной и сравнения несвязанного белка и лиганда анализов связывания. - Приготовьте различные концентрации меченого флуоресцеином гепарина, например, 10, 25, 50, 75, 100, 200 мкг / мл, в 0,2% CHAPS / PBS. Сделайте это, и все остальные работы в темноте.
ПРИМЕЧАНИЕ: При подготовке концентраций, специфические концентрации для других лигандов должны быть определены для Proteiп цель в вопросе. Самая низкая концентрация должна быть обнаруживаемыми в планшет-ридере. Поэтому важно, чтобы сначала определить диапазон, который может быть обнаружен точно в буферной системе, используемой. Затем определяют диапазон, необходимый для получения измеримой связывания. Концентрации флуоресцеином гепарина ниже 10 мкг / мл не последовательно регистрироваться в планшетном ридере при условиях буферных используемых. Аналогичным образом, в то время как родамин-гепарин, такие как используемые в других анализах, могут быть визуализированы в ридере, в буферных условиях и при концентрациях, необходимых для связывания, показания флуоресценции для стандартов не были воспроизводимо с этим иначе флуорофора. - Добавьте 100 мкл флуоресцеин-гепарина в соответствующих испытательных скважин в покрытые авидином плит и стандартных концентрация скважин в обоих авидин покрытием и неустановленным покрытием пластины. Инкубировать в течение 10 мин при комнатной температуре при встряхивании. Держите пластин в темноте (или фольга покрыта).
- Использование пластины Reaдер, записывать первоначальную флуоресцентное излучение от гепарина в контрольных лунках обеих пластин и начальной флуоресценции (общей) эмиссии из скважин с иммобилизованным GFP-TMEM184A или GFP в пластине авидин покрытием. При необходимости регулировки усиления прибора, чтобы обеспечить обнаружение флуоресцентного гепарина между самыми низкими и самыми высокими концентрациями.
Примечание: Убедитесь, что ридер считывает скважины сверху и считывает в оптимальном месте в скважинах, если это регулируется. Для исследования в вопросе, оптимальное расположение было около 75% вниз скважин. Информация, доступная с ридере должны представить предложения, которые являются уникальными для читателя пластины в вопросе для чтения анализы связанного образца в черных пластин. - Удалить несвязанного флуоресцентного гепарин из скважин с иммобилизованным GFP-TMEM184A или GFP и поместить в соответствующие лунки в непокрытой черной пластины. Сразу читать флуоресцентное излучение.
- Добавьте 100 мкл свежей 0,2% CHAPS / PBS назад INTO скважины, из которых флуоресцеин-гепарин был удален, и читать флуоресцентное излучение.
- Повторите шаги 8.8 - 8.9 3x.
Примечание: Эти показания от пластины с покрытием указывают на флуоресцеина гепарин, оставшихся в GFP или GFP-TMEM184A скважин. Если значительная флуоресценция обнаруживается в третьем несвязанных образцов, дополнительная промывка должна произойти. Если флуоресценция продолжает быть удалены в каждой промывке, связывание лиганда может быть низкой аффинностью, а условия должны быть пересмотрены. Окончательное чтение представляет собой связанное чтение гепарин. - Запись флуоресцентное излучение от удаленных, несвязанных, образцы в неокрашенной пластине, получение номера для каждой стирки. Они являются "несвязанные" чтения.
- Используйте суммарные значения выбросов, полученные гепарин в 8.7, чтобы подтвердить правильные уровни гепарина добавляли в каждую лунку. Вычтите средние значения фона из значений.
Примечание: Уэллс без флуоресцеина-гепарином служить в качестве фона из-за антител, GFP и буфера. Averagе фон повторяется, чтобы получить фоновое значение. Вычитание средние показания фона от связанных и несвязанных чтений, чтобы получить фактические значения. - Наймите график эмиссии по сравнению с общей флуоресцеин-гепарин добавил, чтобы определить масштаб эмиссии против количества гепарина.
Примечание: Антитело в одиночку, или антитела и антигена привело к некоторому тушению флуоресценции. Таким образом, общая гепарин была определена на основе общей добавленной гепарина, как отмечено в 8.7. - Участок исправленный связанный гепарин против добавленного гепарина для трехкратном повторе как в случае GFP-TMEM184A и случае GFP.
- Определение свободного лиганда путем добавления несвязанных показания всех промывок для определенной концентрации.
Результаты
В то время как в теории, трансфекция любой конструкции ДНК в клетки могли быть выполнены с помощью липофильных реагентов трансфекции, предыдущие сообщения указывают на более эффективное трансфекция GFP конструкций в эндотелиальных клеток с использованием электропорации 12. Протокол при условии, здесь, как правило, достигается GFP-построить выражение в более чем 80% первичных полученных эндотелиальных клеток и клеток гладких мышц, используемых. Дизайн конструкции используемого использовали коммерчески доступную систему, которая могла поставить эту конструкцию быстро. Основной цели использования было сосредоточено на вопросах адресу, поэтому правильно поставки к мембране, наряду с оптимальной эукариотической экспрессии белка и непрерывного производства конструкта были первичные соображения. Другие соображения, которые могут включать в себя: различные расположение по-разному GFP локализованных белков или белков с С-концом, который является частью складчатой области, возможность wantiнг, чтобы удалить GFP (Добавляя сайт расщепления протеазы), и вторичного сайта сродством. Последнее обеспечило бы альтернативные способы очистки конструкции GFP и стабилизации его на поверхность для анализа связывания. Для подтверждения окрашивания моделей для различных коммерческих антител против TMEM184A, сосудистые клетки, экспрессирующие GFP-TMEM184A сравнивали с идентичных клеток, окрашенных с коммерческими антителами. Продолжительность времени после распределения трансфекции воздействий на GFP-TMEM184A, которая появилась аккумулировать по меньшей мере, 72 ч. Продолжительность времени после трансфекции приводит к оптимальной экспрессии зависит от типа клеток и должны быть оптимизированы для каждого из этих методов. Со временем, более GFP метка находилась в пери-ядерной области. В зависимости от обработки, GFP отбеливания также имели место. Результаты показали , GFP-TMEM184A на клеточной поверхности и в пери-ядерных и других везикул подобных структур локализации наблюдается с использованием меченых антител TMEM184A (рисунок 1). Первичные клетки Рисунок 1 были обследованы через 24 ч после трансфекции, в то время как клонированные клетки A7r5 были обследованы 48 ч после трансфекции. Было принято решение зафиксировать GFP трансфецированных клеток, чтобы гарантировать, что все клетки обрабатывали одинаково для сравнения локализации. Фиксирование вероятно, уменьшенный на клеточной поверхности излучение флуоресценции GFP, до некоторой степени. Узор окрашивание GFP появился наиболее похож на антителе, выработанном против С-концевого пептида, логический результат, учитывая, что GFP, находится на С-конце белка. Окрашивание с антителом, направленной против пептида в N-концевой области также была сходной, но немного более концентрированным появился в пери-ядерной области. Очевидные различия в локализации с различными антителами, может быть из-за связывания лиганда (возможно, вблизи С-конце, в данном случае), который может быть исправлена и ограничения доступа антитела. В качестве альтернативы, N- и С-концы могут быть на противоположных сторонах мембраны. Возможно, вновь синтезированный белок будет окрашивать больше еffectively с антителом по отношению к белковой модифицирована посттрансляционно. Для сравнения полной локализации GFP-TMEM184A эндогенной TMEM184A, окрашивание с антителами к GFP обеспечивает более точную картину общего GFP-TMEM184A, чем просто визуализации GFP. Изображения анти-GFP меченых антител показаны на рисунке 5 , где этот метод был также использован для оценки топологии мембраны.
Использование флуоресцентного лиганда (родамин-гепарин) , облегчено оценку совместной локализации лиганда и рецептора , в течение долгого времени, и две метки позволили провести живого изображения (рисунок 2 и фильм 1). Рисунок 2C изображался путем возбуждения GFP при 405 нм, но захватывая излучение из родамина (средние изображения). GFP возбуждения ограничивается при 405 нм, приносящих ограниченную эмиссию, а также, но это помешало возбуждение родамина и ложный сигнал ладу. Аналогичным образом, FRET-inducред выбросов родамина был слабым. В контрольной с выражением GFP-TMEM184A, но никакой родамина-гепарин и другие только с родамина-гепарином не было выбросов родамина с 405 нм возбуждения. После этого, общая GFP (левое изображения) и общая родамина (правое изображения) были измерены с использованием стандартных длинах волн возбуждения / излучения для каждого флуорофора. Данные в С дальнейшей поддержки совместной локализации лиганда и GFP-TMEM184A. Родамина-гепарин поглощение в RAOEC требуется более длительный инкубационный по сравнению с клетками A7r5. Нет доказательств FRET не наблюдалось в клетках без родамина-гепарина или в нетрансфецированной клетках. Идеальный эксперимент будет включать другую поверхность GFP-конструкцию, которая должна иметь не совместной локализации с лигандом.
Приобретение или восстановление функции может быть также осуществлена с GFP-белковыми конструктами и родамина-гепарином. Это дало возможность использовать GFP в качестве доказательства уровня экспрессии и лиганда со-локализации и количественной оценки взаимодействий. В частности, гепарин поглощение было увеличено в GFP-TMEM184A конструкт трансфицировали A7r5 клеток (рисунок 3). Стабильные нокдаун клетки , которые занимают очень ограниченную родамина-гепарин было произведено 1, и это при условии , систему , в которой можно было бы оценить усиление функции. Трансфекция GFP-TMEM184A конструкции привело к клеткам , которые могли бы снова интернализации родамина-гепарин на уровне клеток дикого типа или выше (рисунок 3). Следует отметить, что "нет гепарин" изображение стабильных нокдаун клеток, которые экспрессируют ли GFP в качестве репортера нокдауна конструкции. Фоновой флуоресценции была выше, в этих клетках, как это наблюдалось в изображении, показанном.
Это, как правило, полезно использовать изолированный рецептор для определения лиганда специфичности, чтобы уменьшить вероятность других белков, взаимодействующих с лигандом. Использование GFP-ProteiN конструкция обеспечивает значительное преимущество в этом отношении в качестве тега GFP может служить в качестве ручки для выделения белка и позволяет избежать возможных взаимодействий антител или других аффинных реагентов с дополнительными белками. GFP, также могут быть выражены в одинаковых популяциях клеток и выделяют, используя ту же самую процедуру GFP сродством. Это обеспечивает контрольный белок для исследований лиганд взаимодействия. В системе TMEM184A, то GFP-TMEM184A выделяли с использованием анти-GFP процедура сродства антител приводит к определенному, насыщающимся гепаринсвязывающий, в то время как контроль GFP не связывался какой - либо гепарин (рисунок 4).
Как правило, GFP метки на конструкциях размещены на конце белка. С-концевая расположение облегчает правильный перемещения белков в мембране. Таким образом, наличие GFP на конкретной стороне мембраны может предоставить доказательства конкретной топологии мембранного белка, если складывание и топология не являютсяlready известно. Простые иммунофлюоресценции окрашивание с антителами к GFP (например, на рисунке 5) могут свидетельствовать о местоположении на основе GFP доступа антител в непермеабилизированных клетках. Анти-GFP антитела распознают GFP, даже если беленой. Иммунофлуоресцентного окрашивание показано на рисунке 5 предполагает значительное анти-GFP окрашивание без пермеабилизации из GFP-TMEM184A трансфицированных клеток , обеспечивающих предварительные доказательства того, что GFP на плазматической мембране является внеклеточной. Очевидно, что внутриклеточный белок в пузырьках также становится окрашенных в проницаемыми клеток. FRET изображения на рис 2С согласуются с этой предложенной топологии.

Рисунок 1: GFP-TEMEM184A Локализация в клетках Подтверждает TMEM184A Локализация Определяется иммунофлуоресценции. A) BAOECs трансфицировали GFP-TMEM184А фиксировали 4% PFA. Nontransfected клетки были обработаны либо с охлажденным льдом метанол (MeOH) фиксации и пермеабилизации или 4% PFA с последующим Тритона Х-100 пермеабилизации (как указано). В nontransfected клетки окрашивали с использованием антитела против С-концевого пептида от TMEM184A (CTD) или N-концевого пептида из TMEM184A (НТД) и вторичное антитело против кроличьего меченый с TRITC. Б) Примеры клонированного (A7r5) и первичные (BAOSMC) гладкие мышечные клетки были обработаны аналогичным образом . Пожалуйста , нажмите здесь , чтобы посмотреть увеличенную версию этой фигуры.
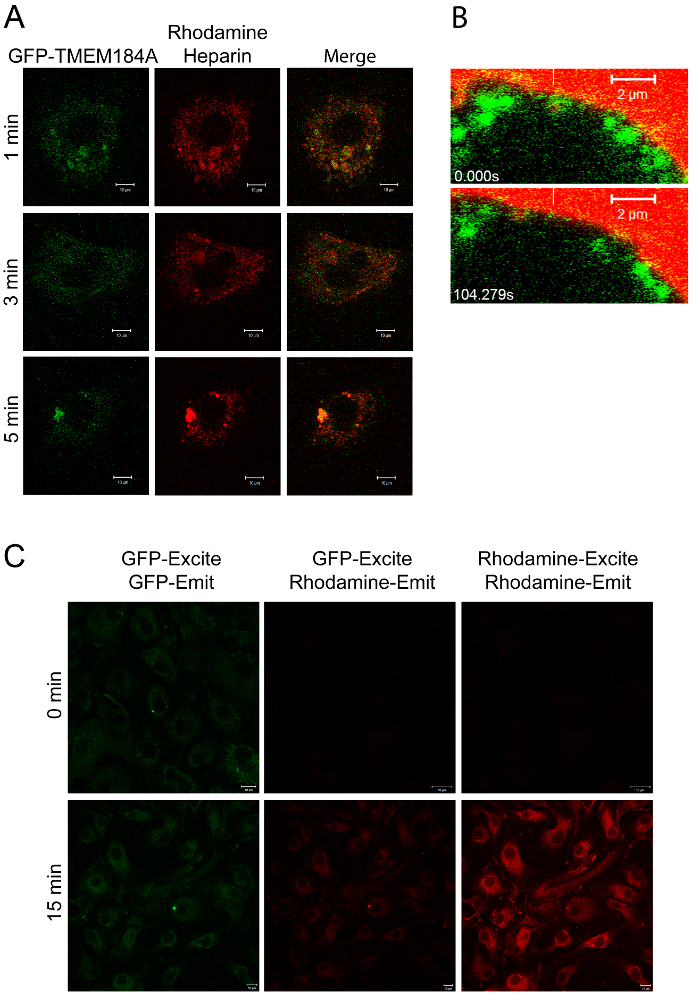
Рисунок 2: Визуализация GFP-TMEM184A с родамина-гепарином. А) A7r5s электропорации с GFP-TMEM184A обрабатывали 100 мкг / мл родамина-гепарина дляраз указано, а затем фиксировали в 4% PFA. Изображения представляют из двух отдельных экспериментов. Б) клетки A7r5 трансфицировали GFP-TMEM184A и родамина-гепарин добавляли с немедленным живого изображения. Отдельные кадры из фильма показаны с белой вертикальной чертой, указывающий на начальной локализации везикулы GFP покрытием, содержащим родамина-гепарин. Этикетка и GFP родамина двигаться вместе. Шкала баров = 2 мкм. C) RAOECs обрабатывают , как в А были обследованы для флуоресцентного резонансного переноса энергии путем возбуждения при 405 (GFP, для FRET) и по сравнению со стандартными настройками, см протокола 3.5. Группа А, и две временные точки в B, были первоначально опубликованы в журнале Biological Chemistry. Pugh, Р. П. и др. 1. Copyright Американское общество по биохимии и молекулярной биологии. Пожалуйста , нажмите здесь , чтобы VIEW большую версию этой фигуры.

Рисунок 3: GFP-TMEM184A Трансфекция Обеспечивает усиление функции. А) Значительно более низкие уровни родамина-гепарина наблюдаются в стабильных нокдаун клеток A7r5 по сравнению с дикого типа A7r5s см пример изображения. "Нет гепарин" изображение устойчивых клеток нокдаун, которые выражают GFP в качестве маркера присутствия конструкции. Шкала бар = 10 мкм. Б) Трансфекция GFP-TMEM184A в обоих дикого типа и стабильных нокдаун клеток значительно увеличивает родамина-гепарин сигнал в этих клетках , основанных на анализе более чем 50 клеток / состояние в трех независимых экспериментах. Усы представляют собой SEM. р <0,0001 на основе теста Тьюки. Эта цифра была первоначально опубликована в журнале Biological Chemistry. Pugh, Р. П. и др. 1. Copyright Американское общество по биохимии и молекулярной биологии. Пожалуйста , нажмите здесь , чтобы посмотреть увеличенную версию этой фигуры.
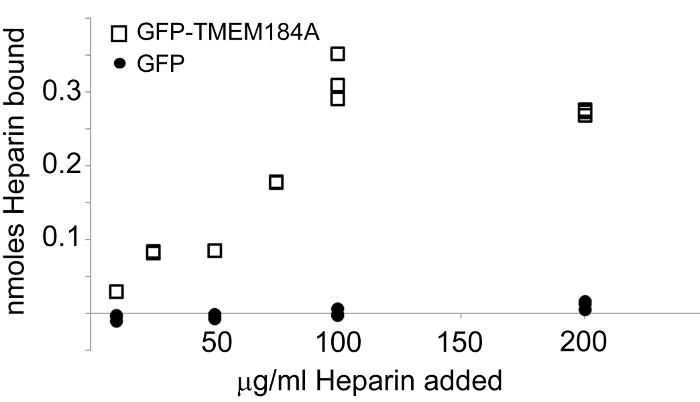
Рисунок 4: Изолированные GFP-TMEM184A Персональный гепарин. GFP-TMEM184A или GFP, был выделен и связан с покрытые авидином планшеты для анализа. Флюоресцеиновая-гепарин добавляли при концентрациях от 0,056 нмоль через 1,111 нмоль. Гепарин связанной определяли путем измерения эмиссии при 519 нм. GFP-TMEM184A (квадраты). управления GFP (кружки). Эта цифра была первоначально опубликована в журнале Biological Chemistry. Pugh, Р. П. и др. 1. Copyright Американское общество по биохимии и молекулярной биологии. _blank "> Пожалуйста, нажмите здесь, чтобы посмотреть увеличенную версию этой фигуры.

Рисунок 5: GFP-TMEM184A и мембранная топология. GFP-TMEM184A трансфицированные клетки либо фиксировали 4% PFA (вверху) или фиксировали 4% PFA и проницаемыми с помощью Triton X-100 (снизу). Клетки окрашивали одинаково с анти-GFP первичными антителами и Cy-3 мечеными вторичными антителами. Шкала бар = 10 мкм. Два разных экспериментов. Вторичные только пятнах клетки не показали по существу отсутствие окрашивания. Пожалуйста , нажмите здесь , чтобы посмотреть увеличенную версию этой фигуры.

pload / 55053 / movie.mp4 "целевых =" _blank "> Фильм 1:.. Live-визуализация GFP-TMEM184A с родамина-гепарин (Щелкните правой кнопкой мыши , чтобы скачать) A7r5 клетки обрабатывали , как на рисунке 2B Фильм иллюстрирует GFP- TMEM184A и родамина-гепарин везикул в верхней движущейся вместе. отдельные варианты цвета в дополнение к слитой версии фильма показаны. везикулы с GFP и содержащий родамина кружком.
Обсуждение
Протоколы , описанные здесь , были разработаны , чтобы предоставить подтверждающие доказательства для идентификации TMEM184A как гепарин рецепторов в клетках сосудов 1. Нокдаун методы, которые обычно используются в качестве механизма для подтверждения идентификации новых белков. Тем не менее, некоторые функциональная потеря после нокдауна, как правило, не является достаточным доказательством того, что белок-кандидат на самом деле правильный рецептор (или другой функциональный белок). Важно также, чтобы иметь доказательства того, что белок-кандидат фактически обнаруживает функцию. Используя конструкцию для нового гена меченой с GFP позволяет усиление экспериментов функции и облегчает выделение меченый белок на основе GFP сродства. Электропорация используется в данном протоколе способствовало очень высокую эффективность трансфекции конструкции (более 80% клеток выражали конструкцию). Тем не менее, другие механизмы трансфекции может быть использован, если электропорации отсутствует или не желателен, Есть несколько преимуществ выбора GFP-меченый конструкцию для подтверждения новой функции белка. Во-первых, служит GFP в качестве репортера для экспрессии и трансфекции гена, и это позволяет суперэкспрессия осуществлять мониторинг через GFP, если линия клеток без экспрессии белка не доступен. Во-вторых, GFP тег предоставляет инструмент для очистки белка, который не зависит ни от сродства лигандов или антител против пептидов. В-третьих, GFP тег предоставляет инструмент для изучения сложной локализации Иммунофлуоресцентной визуализировали с использованием антител, генерируемых против уникальных пептидов в последовательности белка-мишени, чтобы определить, является ли фактический продукт гена аналогично локализованы.
Усиление функциональных анализов с генных конструкций используются для различных целей , в том числе и высокопроизводительного скрининга для идентификации функции нового белка 13. В идеале, усиление функциональных анализов использовали бы хорошо изученную клонированный элементная литийпе, что не выражает искомый ген (клетки должны по-прежнему выражают сотрудничество генные продукты, которые позволяют функции вновь выраженного гена). При использовании конкретного GFP-меченый конструкцию, как в настоящем анализе, важно использовать клетки, в которых GFP-белок может функционировать. Таким образом, выбор клеток зависит от функции и, скорее всего, от типа клетки, в которой функция, как правило, иметь место, чтобы гарантировать, взаимодействующие белки присутствуют. GFP-мечение позволяет дополнительный способ функции мониторинга в том случае , когда флуоресценция GFP-меченый белок можно проследить , как часть функционального анализа (например, см 2 и 3). Одно ограничение этих исследований было бы, если каким-то образом изменяет GFP функцию белка. Связав GFP с С-конце белка, большое количество белков уже были изучены без явного функциональных изменений, но такая возможность существует.
RadioisotopicaLLY меченые лиганды часто используются для изучения связывания лиганда с интактными клетками 11. Однако эти анализы не позволяют просто определять местоположение лиганда после связывания, при этом они не облегчают сравнение лиганда и рецептора вместе, как в настоящем докладе. GFP конструкция также обеспечивает дополнительные возможности для изучения меченого мембранный белок, как здесь. Из-С-концевого расположения GFP тега, можно исследовать расположение GFP тега в трансфицированных клетках по всему анализе. Иммунофлуоресценции с использованием антител к GFP позволяет проводить сравнение GFP доступной для антител с и без пермеабилизации (рисунок 5). Дополнительные применения GFP-TMEM184A воспользоваться визуализации GFP , такие как колокализации с родамина-гепарином (Рисунок 2). Использование FRET, чтобы излучение GFP для возбуждения родамина-гепарин, как показано на 2С обеспечивает интересный способ оценки связывания и внутриклеточного траfficking. Кроме того, лада данные указывают на то, что GFP, достаточно близко (в пределах 10 нм) с родамин-лиганда для передачи возбуждения. Доказательства того, что такая передача из GFP с лигандом работ была опубликована на паратгормона помеченным тетраметил-родамина 14. Альтернативные технологии FRET (фото-отбеливание и / или модели визуализации управляемых компьютером), также могут быть использованы для более сложного анализа, чем то, что показано здесь в качестве примера. Аналогичным образом , взаимодействие других белков с кандидатом могут быть изучены с помощью FRET с флуоресцентными метками , оптимизированных для FRET , как и в системе , EGFP / mCherry Сообщена Albertazzi и соавт. 15 и CFP / YFP и GFP пар , используемые в исследованиях калиевых каналов Ван и коллегами 16. Многие новые малые молекулы флуоресцентных разрабатываются, например 17. Эти молекулы приведет к увеличению числа случаев, когда ладу взаимодействия между GFP-меченных белков и Fluorescent лиганды могут быть рассмотрены. Будущие исследования также могут включать целевые изменения в гене, позволяя конструкцию, чтобы помочь определить последовательность конкретных аспектов функции гена. Одним из ограничений для GFP-меченый мембранных белков, когда на С-конце белка, как правило, внутри. В таких случаях, лада анализы с люминесцентными водорастворимых лигандов не может быть возможным. Тем не менее, альтернативные механизмы для размещения GFP в другом месте в данной конструкции все еще может быть возможно для некоторых таких белков, и до сих пор можно было бы использовать другие анализы представленные здесь.
В дополнение к функции, локализации, и в естественных условиях лиганд взаимодействий, что GFP-меченый белок может быть выделен с использованием антитела анти-GFP и выделенный белок , используемый для изучения функции с использованием в анализах пробирке , где GFP позволяет несмещенной выделение протеина и сравнительно изолированный контроль (свободный GFP). Вместе эти анализы могут обеспечить надежную дополнительные доказательства, необходимые для доказательства-гона функции белка-кандидата как и предполагалось.
Кроме того, так как GFP , является протеаза устойчивостью , если они не будут изменены с сайтов , которые простираются от компактной структуры 18, ограниченное лечение протеазы клеток должны освободить внеклеточный GFP. Расщепление протеазы имело бы место в белке, к которому присоединен GFP, или в проектируемой рычажного области. Выпущенный продукт будет GFP с расширением N-концевой последовательности GFP. Трипсин не следует выпускать GFP, если С-конец белка, к которому присоединен GFP, является внутриклеточным. Предварительный анализ потенциальных продуктов может предложить четкую картину молекулярной массы с GFP-меченый белок выпущен трипсином. Для многих мембранных белков, такие методы приведут четкие доказательства для мембранной топологии путем выпуска GFP или ее отсутствие.
Вместе конкретные анализы представлены и / или предлагаемый в настоящем докладе обеспечивают широкий отбор проб методов тшапка может быть использован для изучения новых белков, начиная с флуоресцентно меченых конструкции. Такие конструкции могут быть легко получены на коммерческой основе. Возможность использовать их для широкого спектра методов делает их экономически целесообразным даже для небольших лабораторий по ограниченным бюджетом.
Раскрытие информации
Авторы не имеют ничего раскрывать.
Благодарности
Research in the Lowe-Krentz lab is supported by research grant HL54269 from the National Institutes of Health to LLK.
Материалы
| Name | Company | Catalog Number | Comments |
| GFP-TMEM184A construct | OriGene | RG213192 | |
| Rhodamine-Heparin | Creative PEGWorks | HP-204 | Light Sensitive |
| Fluorescein-Heparin | Creative PEGWorks | HP-201 | Light Sensitive |
| Mowiol | EMD Millipore | 475904-100GM | |
| Paraformaldehyde (PFA, methanol free) | Thermo Sci Pierce Biotech, available through Fisher Scientific | PI28908 at Fisher | Use in Fume Hood |
| Reacti-bind neutravidin plates (Avidin coated black 96-well dishes) | Thermo Sci Pierce Biotech, through Fisher Scientific | PI15510 at Fisher | Pay attention to shelf-life |
| Black 96-well plates | Corning Life Sciences Plastic, purchased through Fisher Scientific | 064432 at Fisher | |
| A7r5 vascular smooth muscle cell line | ATCC | CRL 1444 | Can be exchanged into MEM medium1 |
| BAOEC bovine aortic endothelial cells | Cell Applications, Inc. | B304-05 | Culture as recommended initially, can be exchanged into MEM medium for continuing culture1,7 |
| BAOSMC bovine aortic smooth muscle cells | Cell Applications, Inc. | B354-05 | Culture as recommended initially, can be exchanged into MEM medium for continuing culture1 |
| RAOEC rat aortic endothelial cells | Cell Applications, Inc. | R304-05a | Culture as recommended initially, can be exchanged into MEM medium for continuing culture7 |
| Biotinylated anti-GFP | Thermo Sci Pierce Biotech, through Fisher Scientific | MA5-15256-BTIN | |
| Streptavidin-coated beads | Sigma | S1638 | |
| HeBS | Available from Bio-Rad | Can be prepared in the lab. The pH is 6.8 | |
| TMEM184A antibody to the N-terminus | Santa Cruz Biotechnology | sc292006 | Only known TMEM184A antibody to N-terminal region. |
| TMEM184A antibody to the C-terminus | Obtained from ProSci Inc, Poway, CA | Pro Sci 5681 | ProSci used in Figure 1 |
| GFP antibodies | Santa Cruz Biotechnology | sc9996 | Used in Figure 5 |
| Secondary antibodies, labeled with TRITC or Cy3 | Jackson ImmunoResearch Laboratories, Inc, West Grove, PA | 711 025 152 (donkey anti-rabbit, TRITC) 715 165 150 (donkey anti-mouse, Cy3) | Minimal cross-reactivity to minimize any nonspecific staining. |
| CHAPS | Purchased from Sigma | C5849 | Note that this specific catalog number has been discontinued. Supplier will provide information regarding replacement. |
| Live imaging 35-mm dishes | MatTek (Ashland MA) | P35G-1.0 – 20 mm - C | |
| Confocal Microscope | Zeiss | LSM 510 Meta with a 63X oil-immersion lens | Used for images and live-imaging in Figures 1, 2 and 3 |
| Confocal Microscope | Nikon | C2+ confocal with a 60X oil-immersion lens | Used for images in Figure 5 |
| Confocal Microscope | Zeiss | Zeiss LSM 880 with a 63X oil-immersion lens | Used for images in Figure 2C |
| Electroporation equipment | Bio-Rad | Gene Pulser X-Cell System | |
| Electroporation cuvettes | Available from MidSci | EC2L | Can also be obtained from equipment supplier |
| Plate reader | TECAN | TECAN Infinite® m200 Pro plate reader | Readings in the middle of the wells rather than at the surface. |
| Computer program for measuring staining intensity | Image J | https://imagej.nih.gov/ij/ Program and information available on-line | Any appropriate program can be used. See https://theolb.readthedocs.io/en/latest/imaging/measuring-cell-fluorescence-using-imagej.html for additional detail |
| Cell Culture trypsin solution | Sigma | T4174 | purchased as a 10x solution |
Ссылки
- Pugh, R. J., et al. Transmembrane Protein 184A Is a Receptor Required for Vascular Smooth Muscle Cell Responses to Heparin. J Biol Chem. 291, 5326-5341 (2016).
- Daher, W., et al. Identification of Toxoplasma TgPH1, a pleckstrin homology domain-containing protein that binds to the phosphoinositide PI(3,5)P. Mol Biochem Parasitol. , (2016).
- Vit, O., et al. Large-scale identification of membrane proteins based on analysis of trypsin-protected transmembrane segments. J Proteomics. , (2016).
- Attwood, M. M., et al. Topology based identification and comprehensive classification of four-transmembrane helix containing proteins (4TMs) in the human genome. BMC genomics. 17, 268(2016).
- Zou, Z., et al. Genome-Wide Identification of Jatropha curcas Aquaporin Genes and the Comparative Analysis Provides Insights into the Gene Family Expansion and Evolution in Hevea brasiliensis. Front Plant Sci. 7, 395(2016).
- Gilotti, A. C., et al. Heparin responses in vascular smooth muscle cells involve cGMP-dependent protein kinase (PKG). J Cell Physiol. 229, 2142-2152 (2014).
- Farwell, S. L., et al. Heparin Decreases in Tumor Necrosis Factor alpha (TNFalpha)-induced Endothelial Stress Responses Require Transmembrane Protein 184A and Induction of Dual Specificity Phosphatase 1. J Biol Chem. 291, 5342-5354 (2016).
- Xu, D., Esko, J. D. Demystifying heparan sulfate-protein interactions. Annu Rev Biochem. 83, 129-157 (2014).
- Chiodelli, P., Bugatti, A., Urbinati, C., Rusnati, M. Heparin/Heparan sulfate proteoglycans glycomic interactome in angiogenesis: biological implications and therapeutical use. Molecules. 20, 6342-6388 (2015).
- Slee, J. B., Lowe-Krentz, L. J. Actin realignment and cofilin regulation are essential for barrier integrity during shear stress. J Cell Biochem. 114, 782-795 (2013).
- Patton, W. A., et al. Identification of a heparin-binding protein using monoclonal antibodies that block heparin binding to porcine aortic endothelial cells. The Biochemical journal. 311, Pt 2 461-469 (1995).
- Doggett, T. M., Breslin, J. W. Study of the actin cytoskeleton in live endothelial cells expressing GFP-actin. J Vis Exp. , (2011).
- Skalamera, D., et al. Generation of a genome scale lentiviral vector library for EF1alpha promoter-driven expression of human ORFs and identification of human genes affecting viral titer. PloS one. 7, 51733(2012).
- Castro, M., Nikolaev, V. O., Palm, D., Lohse, M. J., Vilardaga, J. P. Turn-on switch in parathyroid hormone receptor by a two-step parathyroid hormone binding mechanism. Proc Natl Acad Sci U S A. 102, 16084-16089 (2005).
- Albertazzi, L., Arosio, D., Marchetti, L., Ricci, F., Beltram, F. Quantitative FRET analysis with the EGFP-mCherry fluorescent protein pair. Photochem Photobiol. 85, 287-297 (2009).
- Wang, S., et al. Domain organization of the ATP-sensitive potassium channel complex examined by fluorescence resonance energy transfer. J Biol Chem. 288, 4378-4388 (2013).
- Christiansen, E., Hudson, B. D., Hansen, A. H., Milligan, G., Ulven, T. Development and Characterization of a Potent Free Fatty Acid Receptor 1 (FFA1) Fluorescent Tracer. J Med Chem. 59, 4849-4858 (2016).
- Chiang, C. F., Okou, D. T., Griffin, T. B., Verret, C. R., Green Williams, M. N. fluorescent protein rendered susceptible to proteolysis: positions for protease-sensitive insertions. Arch Biochem Biophys. 394, 229-235 (2001).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены