Method Article
באמצעות TMEM184A GFP-tagged לבנות לתעודה המעידה על הפרין קולטן זהות
In This Article
Summary
TMEM184A קידוד לבנות עם תג ה- GFP על הסופית- carboxy המיועד ביטוי איקריוטיים, הועסק מבחנים שנועדו לאשר את זיהוי של TMEM184A כמו קולטן הפרין בתאי כלי דם.
Abstract
כאשר חלבונים חדשים מזוהים באמצעות ניתוח בידוד ביואינפורמטיקה מבוסס זיקה, הם לעתים קרובות uncharacterized ברובו. נוגדנים נגד פפטידים ספציפיים בתוך רצף החזה לאפשר כמה ניסויי לוקליזציה. עם זאת, אינטראקציות אפשריות אחרות עם הנוגדנים לעתים קרובות לא ניתן לשלול. מצב זה ספק הזדמנות לפתח סדרה של מבחנים תלויים רצף החלבון. באופן ספציפי, מבנה המכיל את רצף הגן מצמידים את רצף קידוד GFP בסוף C- מסוף של החלבון הושג והעסיק למטרות אלה. ניסויים לאפיין לוקליזציה, זיקה ליגנד, ורווח של פונקציה תוכננו במקור ובוצע כדי לאשר את הזיהוי של TMEM184A כמו קולטן הפרין 1. בנוסף, המבנה יכול להיות מועסק ללימודים בשאלות טופולוגיה הממברנה אינטראקציות חלבון-ליגנד מפורטים. הדו"ח הנוכחי מציג arange של פרוטוקולי ניסוי מבוססים על מבנה GFP-TMEM184A לידי ביטוי בתאי כלי דם שיכול בקלות להיות מותאם עבור חלבונים חדשים אחרים.
Introduction
זיהוי של חלבוני מועמד פונקציות רומן לעתים קרובות תלוי פרוטוקולי בידוד מבוסס זיקה ואחריו נחישות רצף חלקית. הדוגמות אחרונות של חלבונים זיהו לאחרונה כוללות הטרנסממברני חלבון 184A (TMEM184A), קולטן הפרין המזוהה לאחר אינטראקציות זיקת הפרין 1, ו TgPH1, חלבון מושלם הומולוגית pleckstrin שקושר PI phosphoinositide (3,5) P 2 2. זיהוי חלבונים הרומן השני כרוך ניתוח רצף ישיר של פפטידים כגון שעד Vit, et al. שהשתמשו פפטידים הטרנסממברני לזהות מוצרי חלבון מן הגנים uncharacterized בעבר 3. באופן דומה, זיהוי רצפי חלבוני רומן ניתן להשיג באמצעות ביואינפורמטיקה מחפש משפחות חלבון מאופיינים בעבר כגון זיהוי של חלבוני 4TM חדשים 4. בחינת רצפי גנים המשפחה aquaporin יש אלכך הניב זיהוי של חברים חדשים עם פונקציות רומן 5. לאחר זיהוי, ניתוח של תפקוד חלבון הוא בדרך כלל השלב הבא שלפעמים ניתן לבדוק באמצעות assay ספציפי של תפקוד חלבון כגון במקרה aquaporin.
במידת האפשר, פונקציה של חלבון זיהו לאחרונה ניתן לבדוק עם האנזימטית ספציפי או מבחני תפקוד חוץ גופית דומה. בגלל פונקציות רבות של חלבונים חדשים תלויות יחסי גומלין מורכבים המתרחשים רק פגעו תאים או אורגניזמים, ב מבחני חוץ גופייה לא תמיד יעילים. עם זאת, מבחני vivo ב חייב להיות מתוכנן בצורה כזאת, כי הם תלויים רצף הגן. תרבית תאים, ו / או אורגניזמים מודל פשוט, מציאה יכולה לספק ראיות תומכות לזיהוי חלבון / הפונקציה 6. עם חלבונים חדשים שזוהו כאמור לעיל, הוא לעתים קרובות די פשוט להפיל חלבון כדי לאשר פונקציה, גידולד העיצוב של in vivo מבחנים תפקודיים שתלויים רצף גן הופך להיות חשוב עבור האפיון של חלבונים חדשים.
הזיהוי האחרונה של TMEM184A כמו קולטן הפרין (כי מודולציה התפשטות שריר חלק בכלי דם ותגובות דלקתיות בתאי האנדותל) באמצעות כרומטוגרפיה זיקת MALDI MS 1, 7 ספקו הזדמנות לפתח אוסף של מבחנים לאחר מציאת ניב תוצאות עקביות עם זיהוי . סקירה אחרונה אשרה כי הפרין אינטראקציה במיוחד עם גורמי גדילה רבים, הקולטנים שלהם, רכיבים תאים מטריקס, קולטנים הידבקות תא, וחלבונים אחרים 8. במערכת כלי הדם, הפרין ו proteoglycans סולפט heparan (המכיל שרשראות סולפט heparan הדומים במבנה שלהם הפרין) אינטראקציה עם כמה מאות חלבונים 9. כדי לאשר מבחינה תפקודית that TMEM184A היה מעורב עם ספיגת הפרין ומחייבת, טכניקות שהעסיקו את מבנה הגן TMEM184A פותחו. הדו"ח הנוכחי כולל אוסף של מבחנים המבוססים על ה- GFP-TMEM184A לבנות לשימוש המאשר את זהותו של TMEM184A כמו קולטן הפרין.
Protocol
עיצוב 1. של Construct GFP-חלבון
- רכישה, או לעצב ולבנות, לבנות-tagged GFP מבוסס על החלבון המדובר.
הערה: לקבלת מבנה שנרכש, וקטורים רגילים זמינים ממעבדות מסחריות הכוללות חלק או את כל ההצעות הבאות: לקבלת חלבון הממברנה, בחרו במיקום C-terminal של GFP כי זה פחות סביר כדי להפריע סחר חלבון הממברנה. שקל רחבה בין הגן של ריבית ה- GFP אם יש סיבה להאמין C- הסופית של החלבון מדובר הוא מקופל בצורה מרוכזת לתוך תחום של החלבון. בחר לבנות לביטוי תא כללי איקריוטיים, אלא לאפשר לבנות ייצור במערכות חיידקים. כלול אתר מחשוף (כגון עבור פרוטאז TEV) שבאמצעותו GFP ניתן להסיר אם רוצים עבור בניסויים מסוימים שבהם GFP יכול להפריע לפעילות חלבון. להוסיף מוסיף אחרים כגון תג נוסף עבור לוקליזציה או זיקה בteractions (למשל, His6). זה לא היה נחוץ עבור המבחנים המתוארים כאן, אבל אולי להקל מבחני אחרים, או להיות שימושי ישירות בסמוך הגן, לפני GFP, אם הסרת GFP היא רצויה.
2. ביטוי GFP-TMEM184A בתאי דם
- האנדותל תרבות או תאי שריר חלק בכלי דם על מנות בתרבית רקמת 0.2% ג'לטין מצופה כפי שדווחו 1 בעבר, 6, 7.
- הוסף 5 מיליליטר תרבית תאי טריפסין פתרון (0.5% w / v) על מ"מ שטוף 100, או גדול יותר, צלחת ומחוברות של תאים. לדגור על 37 מעלות צלזיוס עד תאים שוחררו רק מהצלחת, ולהעביר את תאי צינור צנטריפוגות פוליפרופילן סטרילי.
- הוסף מעכב טריפסין (למשל, נפח שווה של מדיום תרבות הקבוע), כפי שמוצג בתרבות לשגרה, פתרון התא / טריפסין להגבלת פעילות טריפסין. גלולת התאים למשך 5 דקות ב approximately 600 XG (או מהירות וזמן מתאימה רק כדי גלולת התאים לתרבות תקן רקמות). לשאוב supernatant.
- תאים Resuspend ב 1 מ"ל של HeBS (Hepes-בופר) חיץ electroporation, להגביל את כמות תאי הזמן נמצאים גלולה או השעיה. מניח את השעית התא על קרח ולבצע שלבים הנותרים על קרח.
הערה: גלולה ניתן לכבס פעם אחת עם HeBS לפני resuspension. - הוספת נפח מספיק של פלסמיד TMEM184A-tagged GFP לתאים כדי להשיג ריכוז סופי של 20 מיקרוגרם / מ"ל DNA. השתמש בפרוטוקול זהה עבור מבנה GFP.
- מניחים כ 0.4 מ"ל של הפתרון תא HeBS בתוך קובט electroporation. טרום לצנן את cuvettes לפני השימוש.
- Electroporate את התאים באמצעות התנאים הבאים: דעיכה מעריכית, 500 μF, ∞ אוהם, ו -170 V.
הערה: המתח עבור סוג תא נתון צריכה להיות מותאמת. מחקרים ראשוניים עם האנדותל cel שריר חלקסוגי l הושגו עם מבנה GFP-vinculin כדי לקבוע את ערך המתח האופטימלי לציין כאן, למשל 10.- כדי לייעל את electroporation, להתחיל עם המלצות יצרן הציוד (הכוללות תנאים מסוימים סוגי תאים סטנדרטיים). השתמש המבנה הרצוי או חלבון בקרה פלורסנט לבנות בגודל דומה ומאפייני ניאון כדי לבנות הרצוי.
הערה: חומצות גרעין קטנה להופיע להיכנס תאים יותר בקלות מאשר בונה גדולה, כך לבנות עם חלבון פלואורסצנטי רק יכול להיות קל יותר לבטא מאשר אחד גדול יותר. - השתמש מיקרוסקופ פלואורסצנטי כדי לקבוע כדאיות התא, באחוז התאים בהם מבנה ניאון מתבטא לאחר 24 ו -48 שעות, ואת עוצמת הביטוי.
הערה: הנמך את המתח ו / או זמן מעט אם ההישרדות היא נמוכה. כוון בזמן הקצר ביותר האפשרי בין שחרורו של תאים מפני שטח התרבות והחזרהתאים לתרבות כדי לשפר את ההישרדות. עליות קלות בזמן או דופק שני יכולות לשפר ספיגות לבנות אם ההישרדות גבוהה הביטוי הוא נמוך. תנאים וביטוי אופטימום ינועו בין סוגי תאים. אם אחוז תאים המבטאים את המבנה גבוה, אבל העצמה היא נמוכה, להגדיל את ריכוז ה- DNA וניטור תאי transfected לאורך זמן עבור עוצמת אופטימלית, אשר ישתנה בהתאם מחצית חי חלבון כמו גם ביטוי, עשוי לשפר אינטנסיביות. עוצמת מכתים ניתן להגדיל עבור מבחנים מסוימים, אם יהיה צורך בכך, על ידי מכתים immunofluorescence של GFP עם נוגדנים אנטי GFP
- כדי לייעל את electroporation, להתחיל עם המלצות יצרן הציוד (הכוללות תנאים מסוימים סוגי תאים סטנדרטיים). השתמש המבנה הרצוי או חלבון בקרה פלורסנט לבנות בגודל דומה ומאפייני ניאון כדי לבנות הרצוי.
- לאחר electroporation, זרע את התאים לתוך בארות בתרבית רקמה שישה 30 מ"מ עם coverslips הדמיה או לתוך מנות בתרבית רקמה. תרבות תא באמצעות נהלי תרבית תאים סטנדרטיים.
- אופציונאלי: החלף את מדיום התרבות אחרי 24 שעות כדי להסיר כל חיץ electroporation HeBS.
ויזואליזציה 3.-TMEM GFPלוקליזציה 184A
- יש לשטוף את התאים עם PBS ו רעד עדין לאחר culturing עבור h 24 לפחות. להגביל את החשיפה לאור בהיר כדי למנוע דהייה GFP.
- תקן תאים עם paraformaldehyde 4% (PFA) ב PBS במשך 15 דקות ב RT עם רעד עדין. הימנע משימוש בכל ריאגנטים המכיל מתנול אשר עשוי permeabilize התאים. קיבוע עם מתנול יכול לשמש אם זה לא הכרחי כדי להעריך אינטראקציות ליגנד.
זהירות: Paraformaldehyde רעיל. ללבוש ציוד מגן אישי מתאים. השתמש במנדף, בזהירות, וזורקים כראוי. - לשטוף עם PBS כנ"ל. עבור מכתים מבוסס נוגדן, ראה 3.6 להלן.
- Coverslips הר שקופיות באמצעות Mowiol או הרכבה בינונית מתאימה אחרת.
- שקופיות תמונה באמצעות מיקרוסקופ confocal או פלואורסצנטי עם מערכות הסינון המתאימות עבור עירור GFP ספקטרום פליטה. מיקרוסקופיה Confocal עדיפה בגלל היכולת להפריד דגימות מטוס- z. לשמור תמונות בגוונים אפורים עבור quלמטרות antitation בפורמט TIF (בנוסף תמונות בצבע מלא עבור איורים).
- לשם השוואה עם WT TMEM184A הביע ידי התאים, להכין תאים אחרים immunofluorescence באמצעות נוגדנים ראשוניים מוכן פפטיד (שניות) מרגע רצף TMEM184A, למשל 1. זיהוי של GFP-TEMEM184A יכול גם להיות מושג באמצעות נוגדנים נגד GFP. להעריך הוא דגימות התאים על ידי שיטות מיקרוסקופיה זהות.
4. Rhodamine-הפרין מחייב לבין colocalization עם תאי GFP-TMEM184A-טרנספקציה
- פנקו GFP-TMEM184A להביע תאים עם 100 מיקרוגרם / מ"ל הפרין rhodamine להוסיף בינוני תרבות, ולאפשר לתאים דגירה עבור סכום מסוים של זמן, בדרך כלל פחות מ -10 דקות עבור התאים A7r5. לשטוף ולתקן כמו 3.1 ו -3.2.
הערה: בפעם והריכוז האופטימלית של ליגנד תלוי תגובת תא, עוצמת קרינה של עוצמת ליגנד ותמונה שהושגה. תרכיזים זהיון של הפרין הועסק כי התוצאה היא יותר מ -50% בתגובה מבחני אחרים 11. ריכוז זה יכול להיות דמיין באמצעות טכניקות מיקרוסקופ פלואורסצנטי סטנדרטיות, כך שזה לא היה הכרחי כדי להגדיל אותה. דילול של rhodamine-הפרין עם תוצאות הפרין ללא תווית קרינה נמוכה בתאים, וכך קשה יותר תמונה ולכמת. - כדי לכמת את rhodamine-הפרין מחייב בשל transfection GFP-TMEM184A, להכין תאים זהים ללא GFP-TMEM184A transfected.
- תמונה התאים באמצעות מיקרוסקופ confocal עם GFP המתאימה (488 ננומטר) ו rhodamine (543 ננומטר) עירור ופליטה (500 - 530 ננומטר עבור GFP ו יותר מ -560 ננומטר עבור rhodamine) ערכים כדי לקבוע לוקליזציה שיתוף. להשיג תמונות של 50 תאים לפחות מלפחות שלושה ניסויים נפרדים כדי לקבל נתונים סטטיסטיים. שמור הגדרות זהות בתוך ניסויים, ולהעסיק מדגם ביקורת (ים) (למשל, תאי transfected ללא טיפול) הבבית יכול לשמש כדי לתקנן נתונים לניתוח של ניסויים מרובים.
- בדוק את התמונות באמצעות תוכנת מחשב כדי לקבוע rhodamine ביחס מחייב ספיג / בכל תא כדי לכמת מחייב.
הערה: תמונות TIF צריכות להיות מועסקות כפי שהם נוחים לניתוח ניתן להמיר לאפור מידת תוכנות מחשב רבים אם הם לא נצלו בתחילה בפורמט זה. התמונה J (freeware) הועסקה הניתוח המובא ומאפשרת באזור ועוצמת פיקסל יימדדו בכל תחום המוגדר על ידי משתמש בתמונה.- השתמש בכלי חופשי להקיף תא בתוך תמונה פלורסנט ולהשתמש בכלי מדידה כדי לקבוע את עוצמת בתוך המרחב הזה.
הערה: מדידות אלה מספקים את המידע הדרוש כדי לחשב עוצמת הכולל אזור המוגדרים על ידי המשתמש (כל תא, גרעין, וכו ') מאפשר דרך להשוות תאים שונים בגיאומטריות שונות. ממוצע עוצם פני שטח של רקע ניתן לדווח, וכי להקלאוסף ים של עוצמת רקע לניתוח. - ייצא גיליון אלקטרוני כדי לחשב את השטח מוכפל העוצם ולחסר רקע לאותה כמות השטח. ממוצע הקרינה / תא עבור תאים / ניסוי מספיק כדי להשיג מובהקות סטטיסטית.
- השתמש בכלי חופשי להקיף תא בתוך תמונה פלורסנט ולהשתמש בכלי מדידה כדי לקבוע את עוצמת בתוך המרחב הזה.
5. העברת אנרגיה תהודה הקרינה מן ה- GFP-TMEM184A כדי Rhodamine-הפרין
- הכן תאים transfected דגירה עם 200 מיקרוגרם / מ"ל ליגנד-tagged rhodamine כמו 3.1. ראוי לציין, כי זמן הדגירה עם ליגנד הניאון הוא תאים מסוג תלוי. תקן עם PFA בלבד, הר שקופיות הדמיה.
- ראשית, לרגש ב 405 ננומטר ותמונה עבור פליטת rhodamine (566 - 685 ננומטר; סריג). שנית, לרגש ב 488 עבור GFP (תמונה ב 493 - 530), והשלישי, לרגש ב -561 עבור rhodamine (תמונה ב 566 - 685). בקרות ללא GFP-TMEM184A או ללא-הפרין rhodamine הן קריטיות.
6. Live- תא הדמיה של Rhodamine-Heparin ספיגה
- זרעי GFP-TMEM184A תאי transfected לתוך מנות בודדות המיועד דימות תאי חיים ולטפל כמו בפרוטוקול 3.
הערה: מספר התאים הנדרשים תלוי בסוג התא וצפיפות הרצוי. כדי למזער את כמות הזמן התאים בתרחיף, לא לספור תאים. תאי זרע מצלחת ומחוברות 100 מ"מימ לשש 35 מ"מ צלחות הדמיה לחיות להשיג תאי מפגש קרוב 48 שעות. - לאחר 48 שעות, להחליף בינוני עם בינוני תרבות ללא פנול אדום.
- עבר צלחת של תאים כדי מיקרוסקופ confocal עם שלב התחממות כדי לשמור על טמפרטורה, ולמקד את המיקרוסקופ.
- Pipet 100 מיקרוגרם / מ"ל rhodamine-הפרין לתוך צלחת ומערבבים בעדינות.
- מיד להתחיל להקליט תמונות חיות. אם אין ספיגת תא של הפרין מתרחשת בתוך האזור לאור, להזיז את הצלחת מעט כדי לזהות תאים עם לפחות שלפוחית ירוקה אחד המכילה את תווית rhodamine.
הערה: פרטי עירור ופליטת הדמיה הםזהה לפרוטוקול הספיג הפרין (סעיף 5). פרק הזמן בין התמונות היה כ -16 שניות. תנאי הניסוי המיקרוסקופ בדרך כלל יקבעו את המהירות שבה תמונות ניתן להשיג.
בידוד 7. של GFP-TMEM184A ו- GFP מ תאים בתרבית
- לאחר הסרת בינוני תרבות ושטיפה עם PBS, להוסיף 2 מ"ל 0.2% (w / v) פתרון בחורים 1x PBS עם מעכבי פרוטאז לצלחת 150 מ"מ של תאים המבטאים GFP-TMEM184A או GFP (עבור מבחני מחייב שליטה). גרדו את התאים מצלחת, למקם את הפתרון תאים / בחורים בתוך צינור פוליפרופילן 15 מ"ל על הקרח, ומערבבים היטב על ידי הקשה. השלם את כל השלבים באור בהיר כדי להבטיח את תג ה- GFP הוא מחומצן עבור assay מחייב להלן.
- כדי לאגד GFP-TMEM184A במיוחד (או פקד GFP המתאים), להוסיף 2 מיקרוגרם / מ"ל biotinylated אנטי GFP נוגדנים הפתרון ו דגירה לילה ב 4 ° C עם נדנדה.
- הוספת 500 μLחרוזי agarose-streptavidin עם כמה מחברי 5 מיליליטר 0.2% לפחות / PBS ו צנטריפוגות ב כ 600 XG במשך 3 עד 5 דקות. הסר את supernatant. חזור פעמיים נוספות עם בחורים טריים / PBS בכל פעם. להוסיף חרוזים לפתרון נוגדן ותא דגירה לילה ב 4 ° C עם נדנדה לאפשר חרוזים להיקשר נוגדן אנטי GFP biotinylated מאוגד GFP או GFP-TMEM184A.
- גלולה חרוזים על ידי צנטריפוגה (כמו 7.3) ולהסיר החומר מאוגד. הוסף לפחות 5 מ"ל 0.2% בחורים / PBS / מעכבי פרוטאז לשטוף. כביסה צנטריפוגה חזור לפחות 3x כדי להסיר כל חלבון מאוגד ביעילות.
- לאחר הסרת לשטוף הסופי, דגירה חרוזים עם 1 מ"ל של 0.2 מ 'גליצין / 0.2 בחורים% ב PBS (pH 2.0 באמצעות HCl) על קרח למשך 3 דקות כדי לנתק את נוגדן-GFP מחייב (וכתוצאה מכך GFP-TMEM184A בחינם או בחינם GFP). מערבבים בעדינות על ידי הקשה על כל 30 שניות.
- צנטריפוגה ב כ 600 XG ולהעביר את supernatant המכיל את p מטוהריםrotein לצינור 15 מ"ל חדש ואחריו נטרול מיידי עם 5 מ"ל של 1 M סודיום ביקרבונט (להביא את ה- pH 7).
- תתרכז המדגם באמצעות concentrator צנטריפוגלי מולקולרי 10,000 דלתון משקל חתוך (להעסיק מהירות צנטריפוגה המומלץ על ידי הספק). כאשר נפח ומגיע לכ 0.5 מ"ל, להוסיף 0.2% בחורים / PBS. המשך להתרכז והוסיף עוד 0.2% בחורים / PBS עד לפחות עשרה כרכים (פי נפח דגימת ההתחלה) מן הבחורים 0.2% / PBS נוספו.
- כדי לקבוע אומדן של הסכום של GFP המבודד או חלבון מתויג GFP, לקבל ספיגת הקריאה ב 280 ננומטר ולהשוות אותו עקומת סטנדרט המוכנה מן אלבומין בסרום שור או חלבון בקרה אחר באותו החיץ.
הערה: בשל הבדלים מקדמים הכחדה, ריכוז זה הוא אומדן, אבל יכול לספק ריכוז חלבון משוער כדי להקל על ניתוח נוסף בלי לבזבז מדגם. ריכוז החלבון מדויק ניתן להרתיעממוקש באמצעות assay חלבון מיקרו-לורי ביצוע מסוימים להכין את חלבון רגיל באותה חיץ כמו המדגם. ניתוח נוסף של החלבון המבודד ניתן להשיג על ידי סופג המערבי של החלבון המבודד (באמצעות זיהוי נוגדן עבור GFP) והשוואה למשקל המולקולרי חזה. לחלופין, שימוש של נוגדנים TMEM184A אמור לגרום להקה של גודל המבנה חזה, אך עלול גם לגרום להקת WT TMEM184A אם הדימרים (או oligomers מסדר גבוה) נוכחים במדגם. אומדן טוהר ניתן להשיג על ידי מכתים כתם עבור חלבון הכולל מהדגימה המבודדת לעומת חלבון הכולל מ aliquot של החומר המוצא.
8. Assay כריכה במבחנה הפרין
- הכינו צלחת 96-היטב avidin מצופה שחור על ידי שטיפה עם 200 μL 0.2% בחורים / PBS שלוש פעמים במשך 5 דקות עם רעד. הכן צלחת 96-היטב noncoated שחורה זהות בהפעלת נוהל הכביסה אותו. להכיןפריסה עבור דגימות הניסוי (בשלושה עותקים) לעקוב במהלך assay. כלול בארות לריכוזי הפרין רגילים, שולט חיץ, ובארות עם דגימות ה- GFP ללא הפרין כדי לאשר לבן של ה- GFP.
הערה: אם מאגרי בידוד או אינטראקציה ליגנד מותאם הם שונים עבור החלבון מדובר, לעשות את כל הכנות צלחת הכביסה עם מערכת החיץ האופטימלית. - הוספת 100 μL של 60 pmol / biotinylated היטב GFP אנטי לכל הבארות בצלחת מצופית avidin שבו GFP כריכה הוא רצוי. כמות הנוגדנים מספיקה רק כדי להרוות את avidin גבוהה זיקה במי הקידוחים.
- הוסף חוצץ רק לכל הבארות המשמשות למטרות בקרה (לא GFP או GFP-TMEM184A כריכה רצויה). חותם את הבארות עם כיסוי צלחת על מנת למנוע אידוי. דגירה של 2 שעות ב RT, עם רעד.
הערה: כרכים הוסיפו לבארות פעמי דגירה מבוססים על המלצות מהנותנות.
- הוסף חוצץ רק לכל הבארות המשמשות למטרות בקרה (לא GFP או GFP-TMEM184A כריכה רצויה). חותם את הבארות עם כיסוי צלחת על מנת למנוע אידוי. דגירה של 2 שעות ב RT, עם רעד.
- לשטוף את כל הבארות שלוש פעמיםבמשך 5 דקות עם 200 בחורים 0.2% μL / PBS.
- הוספת 100 μL של 5 nmol / טוב GFP-TMEM184A או GFP לנכס בארות בצלחת מצופה avidin דגירה של 1 ש 'ב RT עם רעד. לשטוף שוב כמו 8.3.
הערה: ריכוז זה של חלבון נבחר על מנת להבטיח כי כל האתרים היו רוויים עודף GFP או GFP-TMEM184A. זה חשוב כדי להבטיח כי אותה הכמות של חלבון מאוגדת היטב כל אחד. כמויות נמוכות של חלבון יכולות גם להרוות את האתרים, אפשרות כי ניתן הייתה לבדוק על ידי הערכת חלבון מאוגד הנותר לאחר דוגרי ריכוזים כמה חלבון עם הצלחת והשוואת חלבון מאוגד ליגנד מחייב מבחנים. - הכין ריכוזים שונים של הפרין שכותרתו והעמסה, למשל, 10, 25, 50, 75, 100, 200 מיקרוגרם / מיליליטר, ב 0.2% בחורים / PBS. האם עבודה זו וכל שנותר בחושך.
הערה: לפני ההכנה ריכוזית, בריכוזים מסוימים עבור ligands אחר יקבעו עבור protein היעד המדובר. הריכוז הנמוך ביותר ניתן יהיה לקלוט את קורא הצלחת. לכן חשוב קודם לקבוע את הטווח כי ניתן לאתר במדויק במערכת החיץ המועסקת. ואז לקבוע את הטווח הנדרש להשגת מחייב למדידה. ריכוזים של והעמסה-הפרין מתחת ל -10 מיקרוגרם / מיליליטר לא לרשום בעקביות אצל קורא הצלחת בתנאי החיץ המועסק. בדומה לכך, בעוד rhodamine-הפרין כגון המשמש מבחנים האחרים, יכול להיות דמיינו בקורא הצלחת, בתנאי החיץ בריכוזים הנדרשים מחייב, קריאות הקרינה עבור סטנדרטים לא היו שונות reproducibly עם fluorophore כי. - הוספת 100 μL של וההעמסה-הפרין כדי בארות מתאימות בארות צלחת ורמת ריכוז מצופה avidin היא מצופה avidin ואת הצלחת הלא מצופית. דגירה של 10 דקות ב RT עם רעד. שמור צלחות בחושך (או רדיד מכוסה).
- באמצעות rea צלחתדר, להקליט את פליטת הקרינה הראשונית מן הפרין בבארות מלאה הן של צלחות ואת הקרינה הראשונית (סה"כ) פליטת מבארות עם משותקת GFP-TMEM184A או GFP בצלחת מצופה avidin. במידת הצורך, להתאים את רווח המכשיר כדי לוודא זיהוי של הפרין ניאון בין הנמוך הריכוזים הגבוהים ביותר.
הערה: ודא את קורא צלחת קורא בארות מלמעלה וקורא על המיקום האופטימלי בבארות אם כי היא מתכווננת. לצורך המחקר המדובר, את המיקום האופטימלי היה כ -75% למטה בארות. מידע זמין עם קורא הצלחת צריך לספק הצעות ייחודיות קוראת הצלחת מדוברת לקריאת מבחנים של מדגם כבול צלחות שחורות. - הסר הפרין ניאון מאוגד מבארות עם משותקת GFP-TMEM184A או GFP ומקום לתוך בארות מקבילות צלחת השחור שאינם מצופה. מיד לקרוא את פליטת הקרינה.
- הוספת 100 μL טריים 0.2% בחורים / PBS בחזרה intבארות o שמהם-הפרין וההעמסה הוסרו, ולקרוא פליטת קרינה.
- חזור על שלבים 8.8 - 8.9 3x.
הערה: קריאות אלה מצלחת מצופה מצביעי הפרין והעמסה שנותר בארות GFP או GFP-TMEM184A. אם קרינה משמעותית נמצאת במדגם המאוגד השלישי, לשטוף נוסף אמורים להתרחש. אם הקרינה ממשיכה להסירו בכל לשטוף, מחייב של ליגנד עלול להיות זיקה נמוכה, והתנאים צריכים להיות הערכה מחדש. הקריאה הסופית מהווה את הקריאה הפרין הכבולה. - פליטת קרינת שיא מן הסיר, מאוגדות, הדגימות בצלחת noncoated, השיגו מספרים עבור כל שטיפה. אלו הם קריאות "מאוגדות".
- השתמש ערכי פליטת הפרין כוללים שהושגו 8.7 כדי לאשר את הרמות הנכונות של הפרין מתווספות גם כל. פחת קריאות רקע ממוצעות מערכיה.
הערה: ולס ללא כל והעמסה-הפרין לשמש רקע עקב נוגדנים, GFP חיץ. Averagדואר ברקע חוזר כדי לקבל את הערך ברקע. קריאות רקע ממוצעות לגרוע קריאות הכבולות וחסרת מאוגד כדי לקבל ערכים בפועל. - להעסיק חלקת הפליטה לעומת והעמסה-הפרין מוסף לקבוע את היקף הפליטה לעומת הסכום של הפרין.
הערה: נוגדן לבד, או נוגדן אנטיגן הביאה כמה מרווה של קרינה. לכן, הפרין הכולל נקבע בהתבסס על הפרין המוסף כפי שמצוין 8.7. - עלילת הפרין מחויב לתקן מול הפרין המוסף triplicates בשני במקרה GFP-TMEM184A ותיק GFP.
- לקבוע ליגנד בחינם על ידי הוספת הקריאות המאוגדת מכל שוטף ריכוז ספציפי.
תוצאות
אמנם, בתיאוריה, transfection של כל DNA לבנות לתוך תאים יכול להיות מושלם עם ריאגנטים transfection lipophilic, דיווחים קודמים מצביעים transfection יעיל יותר של GFP בונה לתאי אנדותל באמצעות electroporation 12. הפרוטוקול הניתן כאן בדרך כלל מושגת GFP-לבנות ביטוי יותר מ -80% של תאי אנדותל נגזרות העיקריות ותאי שריר חלק בשימוש. עיצוב של המבנה המועסק השתמש במערכת זמינה מסחרי שיכול לספק מבנה זה במהירות. השימוש המיועד הגדול התמקד בנושאי מיקום, ולכן מסירה נכונה הקרום, יחד עם ביטוי חלבון איקריוטיים אופטימלי וייצור מבנה המשיך היו שיקולים עיקריים. שיקולים אחרים יכול לכלול: מיקום שונה של GFP עבור חלבונים או חלבונים מקומיים שונה עם סופית-C כי הוא חלק מהאזור מקופל, את האפשרות של wanting להסיר את ה- GFP (הוספת אתר מחשוף פרוטאז), ואתר זיקה משנית. האחרון היה לספק דרכים חלופיות לטהר את המבנה GFP וייצוב אותו על משטח עבור assay מחייב. כדי לאשר דפוסי מכתים נוגדנים מסחריים שונים נגד TMEM184A, תאי כלי דם להביע GFP-TMEM184A הושווה תאים זהים מוכתמים הנוגדנים המסחריים. משך הזמן לאחר חלוקת משפיע transfection של GFP-TMEM184A, שהופיע לצבור מעל לפחות 72 שעות. משך הזמן לאחר transfection וכתוצאה מכך ביטוי אופטימלי משתנה בהתאם לסוג התא צריך להיות מותאם לכל טכניקה. במשך הזמן, יותר תווית GFP היה באזור פרי-גרעיני. בהתאם טיפול, הלבנת GFP גם התרחש. התוצאות הצביעו על GFP-TMEM184A על פני התא במבני שלפוחית פרי-גרעיניים ואחרים דומים לוקליזציה ציינה עם מכתים נוגדן TMEM184A (איור 1). התאים הראשוניים איור 1 הם צילמו 24 שעות לאחר transfection, בעוד תאים A7r5 משובטים הם צילמו 48 transfection שעות שלאחר. ההחלטה לתקן תאי transfected GFP נעשתה על מנת להבטיח כי כל התאים טופלו באופן זהה להשוות לוקליזציה. קיבוע מופחת סביר פליטת קרינת GFP תא שטח במידה מסוימת. הדפוס המכתים של GFP הופיע הכי דומה לזה של נוגדן שהועלה כנגד פפטיד C-terminal, תוצאה הגיונית בהתחשב בעובדת GFP הוא בבית C- הסופי של החלבון. צביעה עם נוגדן ממוקד נגד פפטיד באזור N-terminal היה גם דומה, אבל נראה מעט יותר מרוכזת באזור פרי-גרעיני. הבדלים לכאורה בלוקליזציה עם נוגדנים שונים יכולים להיות בשל מחייב של ליגנד (ואולי ליד הסופית- C במקרה זה), אשר יכול להיות קבוע יש ולהגביל גישת נוגדן. לחלופין, N- ו- טרמיני C- יכול להיות משני צדי המתרס של הממברנה. אולי, חלבון מסונתז חדש יכתים יותר דוארffectively עם קרוב משפחה נוגדנים-translationally פוסט שונה חלבון. כדי להשוות לוקליזציה GFP-TMEM184A סך TMEM184A אנדוגני, צביעה עם נוגדנים GFP סיפק תמונה מדויקת יותר של ה- GFP-TMEM184A הכולל מאשר פשוט הדמיה GFP. תמונות של מכתים נוגדן אנטי GFP מוצגות באיור 5 שבו הטכניקה שמשה גם להעריך טופולוגיה הממברנה.
השימוש ליגנד ניאון (rhodamine-הפרין) הקל הערכה של שיתוף לוקליזציה של ליגנד לרצפטור לאורך זמן, ואת שתי התוויות אפשרו לבצע הדמית חיה (איור 2 ו סרט 1). איור 2C צולם על-ידי מרגש ה- GFP ב 405 ננומטר, אבל לכידת פליטה מ rhodamine (התמונות באמצע). עירור GFP מוגבל ב 405 ננומטר מניב פליטה מוגבלת גם כן, אבל זה לא מנע עירור של rhodamine ואיתות סריג שווא. באופן דומה, הסריג inducפליטת rhodamine ed הייתה קלושה. בשנת שולטת עם ביטוי של GFP-TMEM184A, אבל לא rhodamine-הפרין, ואחרים עם רק rhodamine-הפרין אין פליטה rhodamine עם עירור 405 ננומטר. לאחר מכן, GFP הכולל (תמונות משמאל) rhodamine הכולל (תמונות מימין) נמדדו באמצעות אורכי גל תקן עירור / פליטה עבור כל fluorophore. הנתונים בדו להמשיך לתמוך את שיתוף לוקליזציה של ליגנד ואת GFP-TMEM184A. ספיגת Rhodamine-הפרין RAOEC נדרשה דגירה כבר לעומת תאי A7r5. אין ראיות עבור הסריג נצפו בתאים ללא rhodamine-הפרין או בתאי untransfected. ניסוי אידיאלי יכלול מהצבת משטח GFP-לבנות כי צריך שום שיתוף לוקליזציה עם ליגנד.
רכישה או התאוששות של תפקוד יכולה להיות מושלמת גם עם בונת GFP-חלבון-הפרין rhodamine. זה סיפק את ההזדמנות להשתמש GFP כעדות רמת הביטוי שיתוף ליגנדלוקליזציה לכמת את האינטראקציות. באופן ספציפי, ספיגת הפרין הוגדלה ב GFP-TMEM184A לבנות-transfected תאי A7r5 (איור 3). תאי מציאה יציבים אשר תופסים rhodamine-הפרין מוגבל מאוד יוצרו 1, ובתנאים אלה מערכת שבה רווח של פונקציה יכול להיות מוערך. Transfection של מבנה GFP-TMEM184A הביא תאים שיכולים שוב להפנים-הפרין rhodamine ברמת wild-type תאים ומעלה (איור 3). יצוין כי התמונה "לא הפרין" הוא של תאי מציאה יציבים, אשר מבטאים GFP ככתב לבנות מציאה. רקע הקרינה הייתה גבוהה בתאים אלה, כפי שנצפו התמונה המוצגת.
זה בדרך כלל מועיל להשתמש קולטן מבודד לקביעה סגולית ליגנד כדי להקטין את הסבירות של חלבונים אחרים אינטראקציה עם ליגנד. השימוש GFP-protein לבנות מספק יתרון משמעותי בהקשר זה כמו תגית GFP יכול לשמש ידית לבידוד של החלבון ונמנע אינטראקציות אפשריות של נוגדנים או ריאגנטים זיקה אחרים עם חלבונים נוספים. GFP יכול לבוא לידי ביטוי גם באוכלוסיות זהות של תאים מבודדים באמצעות הליך הזיקה אותו GFP. זה מספק חלבון בקרה עבור מחקרי אינטראקציה ליגנד. במערכת TMEM184A, GFP-TMEM184A מבודד באמצעות הליך זיקת נוגדן אנטי GFP הביא הפרין ספציפי, saturable מחייב, בעוד GFP הביקורת לא מחייב כל הפרין (איור 4).
בדרך כלל, תגי ה- GFP על פי בניות ממוקמות קץ של חלבון. מיקום מסוף-C הופך לפשוט סחר חלבון נכון קרום. לכן, על זמינותו של ה- GFP על צד מסוים של קרום יכולה לספק ראיות טופולוגיה ספציפית של חלבון הממברנה אם קיפול טופולוגיה אינוlready ידוע. מכתים immunofluorescence פשוט עם נוגדנים כנגד GFP (כגון באיור 5) היכולים לספק ראיה מיקום GFP מבוסס על גישה נוגדן בתאים שאינם permeabilized. הנוגדנים האנטי-GFP להכיר GFP גם אם מולבן. מכתים Immunofluorescent שמוצג באיור 5 מרמז מכתים אנטי GFP משמעותית ללא permeabilization של תאים transfected GFP-TMEM184A מתן ראיות ראשוניות כי GFP על הממברנה פלזמה היא תאיים. ברור, חלבון תאיים השלפוחית גם הופך מוכתם בתאי permeabilized. תמונות סריג באיור 2C עולות בקנה אחד עם טופולוגיה המוצע.

איור 1: ה- GFP-TEMEM184A לוקליזציה בתאים מאשר TMEM184A הלוקליזציה נקבעה על ידי Immunofluorescence. א) BAOECs transfected עם GFP-TMEM184A תוקנו עם 4% PFA. תאים Nontransfected עובדו או עם מתנול קר כקרח (MeOH) תיקון ו permeabilization או 4% PFA ואחריו טריטון X-100 permeabilization (כאמור). התאים nontransfected הוכתמו באמצעות נוגדן כנגד פפטיד C- מסוף מ TMEM184A (CTD) או פפטיד N- מסוף מ TMEM184A (NTD) ו נוגדן נגד ארנב משני מתוייגים עם TRITC. B) דוגמאות של משובטים (A7r5) והעיקרי (BAOSMC) תאי שריר חלק עובדו באופן דומה. אנא לחץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו.
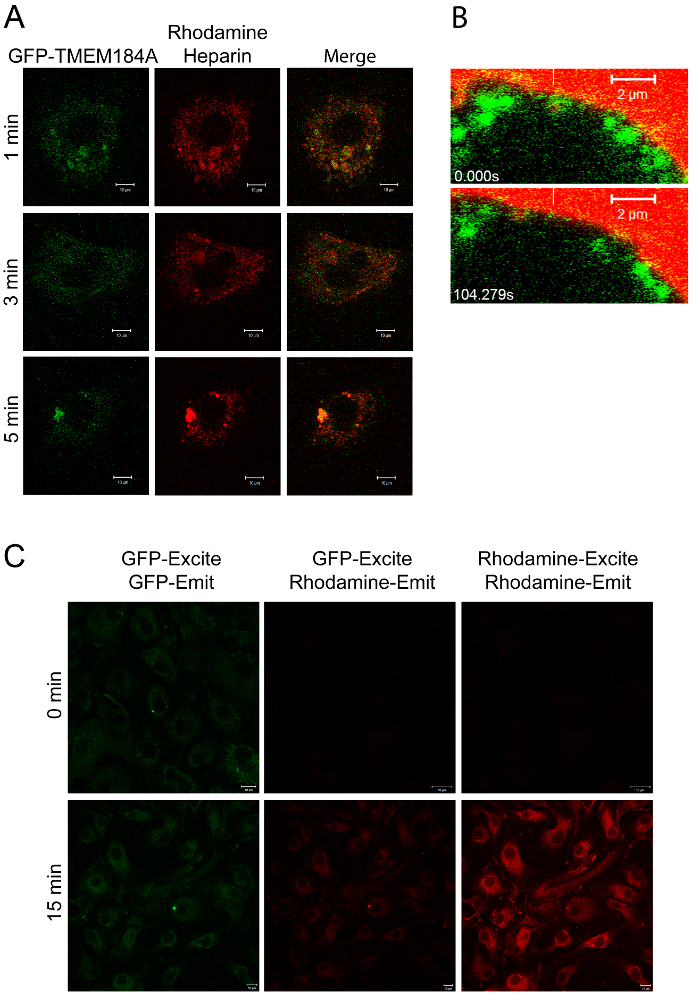
איור 2: הדמיה של ה- GFP-TMEM184A עם Rhodamine-הפרין. א) A7r5s electroporated עם GFP-TMEM184A טופלו 100 מיקרוגרם / מ"ל rhodamine-הפרין עבורפעמים להסבר וסגור קבוע עם PFA 4%. תמונות מייצגות שתיים ניסויים נפרדים. ב) בתאי A7r5 היו transfected עם GFP-TMEM184A ו rhodamine-הפרין נוסף עם הדמיה מיידית. מסגרות נבחרות של הסרט מוצגות עם קו אנכי לבן מצביע על הלוקליזציה הראשונית של שלפוחית GFP מצופה המכילה הפרין rhodamine. תווית GFP ואת rhodamine לנוע יחד. ברי סולם = 2 מיקרומטר. RAOECs C) כאל בלה הם צילמו עבור העברת אנרגיה תהודה הקרינה על ידי מרגש ב 405 (GFP, עבור סריג) ולעומת הגדרות סטנדרטיות, ראה פרוטוקול 3.5. לוח א ', ואת שתי נקודות זמן ב', פורסמו במקור בכתב העת Journal of Biological Chemistry. Pugh, RP, et al. 1. כל הזכויות שמורות האגודה האמריקאית לביוכימיה וביולוגיה מולקולרית. אנא לחץ כאן כדי נiew גרסה גדולה יותר של דמות זו.

איור 3: GFP-TMEM184A Transfection מספק רווח של פונקציה. א) באופן משמעותי רמות נמוכות יותר של הפרין rhodamine נראות תאים יציבים מציאת A7r5 לעומת A7r5s wild-type, לראות תמונות לדוגמא. הדימוי "לא הפרין" הוא של תאי מציאה יציבים המבטאים GFP כסמן של נוכחות מבנה. ברי סולם = 10 מיקרומטר. B) Transfection של GFP-TMEM184A לשני wild-type ותאי מציאה יציבים מגביר באופן משמעותי את האות הפרין-rhodamine בתאים אלה בהתבסס על ניתוח של יותר מ -50 תאים / מצב בשלושה ניסויים בלתי תלויים. ברי שגיאה מייצגים SEM. p <0.0001 על בסיס מבחן Tukey. נתון זה פורסם במקור בכתב העת Journal of Biological Chemistry. Pugh, RP, et al. 1. כל הזכויות שמורות האגודה האמריקאית לביוכימיה וביולוגיה מולקולרית. אנא לחץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו.
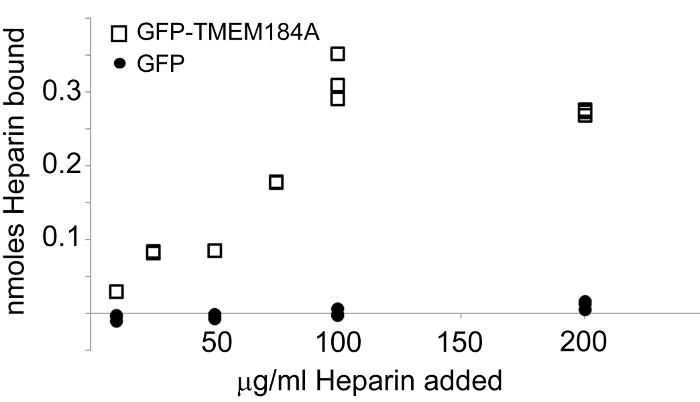
איור 4: מבודד GFP-TMEM184A מקשר הפרין. GFP-TMEM184A או GFP היה מבודד ולא כבול צלחות assay מצופה avidin. והעמסה-הפרין נוסף בריכוזים מ 0.056 nmol דרך 1.111 nmol. הפרין כבול נקבע על ידי מדידת הפליטה ב 519 ננומטר. GFP-TMEM184A (ריבועים). שליטת GFP (עיגולים). נתון זה פורסם במקור בכתב העת Journal of Biological Chemistry. Pugh, RP, et al. 1. כל הזכויות שמורות האגודה האמריקאית לביוכימיה וביולוגיה מולקולרית. _blank "> לחץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו.

איור 5: GFP-TMEM184A ו ממברנה טופולוגיה. תאים transfected GFP-TMEM184A תוקנו גם עם 4% PFA (למעלה) או קבוע עם PFA 4% ו permeabilized באמצעות טריטון X-100 (למטה). תאים הוכתמו זהה עם נוגדנים ראשוניים אנטי GFP ו נוגדנים משני שכותרתו Cy3. ברי סולם = 10 מיקרומטר. שני ניסויים שונים מוצגים. תאים משני מוכתם רק הראו בעצם לא מכתימים. אנא לחץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו.

pload / 55,053 / movie.mp4 "target =" _ blank "> סרט 1:.. הדמיה חיה של ה- GFP-TMEM184A עם Rhodamine-הפרין (לחץ לחיצה ימנית כדי להוריד) תאים A7r5 טופלו כמו באיור 2B הסרט ממחיש את GFP- TMEM184A ואת שלפוחית הפרין-rhodamine בראש נע יחד. גרסות צבע נפרדות בנוסף לגרסה הממוזגת של הסרט מוצג. השלפוחית עם GFP ו rhodamine המכיל שמקיף אותה.
Discussion
הפרוטוקולים דיווחו כאן נועדו לספק עדויות מאשרות לזיהוי TMEM184A כמו קולטן הפרין בתאי כלי הדם 1. טכניקות מציאה משמשים באופן שגרתי כמנגנון אחד כדי לאשר את הזיהוי של חלבונים חדשים. עם זאת, כמה אובדן תפקודי לאחר המציאה היא בדרך כלל לא הוכחה מספקת כי חלבון מועמד הוא למעשה לקולטן הנכון (או חלבון פונקציונלי אחר). כמו כן, חשוב שתהיינה ראיות כי החלבון המועמד למעשה מציג את הפונקציה. העסקת מבנה עבור גן רומן מתויג עם GFP מאפשרת רווח של ניסויי פונקציה ומקל בידוד של החלבון המתויג המבוסס על זיקת GFP. Electroporation מועסק פרוטוקול זה הקל יעיל transfection גבוהה מאוד של המבנה (יותר מ 80% מכלל התא הביעו המבנה). עם זאת, מנגנוני transfection אחרים יכולים לשמש אם electroporation אינו זמין או אינו רצוי. ישנם מספר יתרונות בבחירת מבנה GFP-tagged לאישור של תפקוד חלבון רומן. ראשית, GFP משמש ככתב ביטוי transfection וגן והוא מאפשר ביטוי יתר להיות פיקוח באמצעות GFP אם קו התא ללא ביטוי של החלבון אינו זמין. שנית, תג ה- GFP מספק כלי לטיהור של החלבון שאינה תלויה משני זיקה ליגנד או נוגדנים נגד פפטידים. שלישית, תג ה- GFP מספק כלי לבחון לוקליזציה immunofluorescent מורכבת דמיין באמצעות נוגדנים שנוצרו נגד פפטידים ייחודיים ברצף חלבון המטרה כדי לקבוע אם מוצר הגן בפועל הוא מקומי דומה.
רווח של מבחני תפקוד עם בונה גנים נמצאים בשימוש במשך מספר מטרות, כולל הקרנת תפוקה גבוהה לזיהוי של תפקוד החלבון רומן 13. באופן אידיאלי, רווח של מבחני תפקוד היה להעסיק li תא משובט-למד היטבne כי אינו מבטא את הגן מדובר (התאים עדיין חייבים להביע פעולת מוצרי גנים המאפשרים תפקוד הגן הביע לאחרונה). בעת שימוש קונסטרוקצית GFP-tagged ספציפית כמו המבחנים הנוכחיים, חשוב להשתמש בתא שבה חלבון ה- GFP יכול לתפקד. לכן, הבחירה של תאים תלוי בתפקוד, וסביר להניח, בסוג התא שבו הפונקציה שבדרך כלל מתרחש על מנת להבטיח חלבוני פעולה נוכחים. GFP תיוג מאפשר דרך נוספת של פונקציית ניטור במקרה שבו הקרינה של חלבון מתויג GFP ניתן בעקבות כחלק assay תפקודית (למשל, ראה איורים 2 ו -3). מגבלה אחת המחקרים הללו יהיה אם GFP איכשהו משנה את תפקוד החלבון. ידי קישור ה- GFP אל C- הסופי של החלבון, מספר רב של חלבונים כבר נחקר ללא שינוי פונקציונלי לכאורה, אך אפשרות כזו קיימת.
Radioisotopicaהליגנדים שכותרתו lly שימשו תכופות ללמוד ליגנד מחייב תאים שלמים 11. עם זאת, מבחני אלה אינם מאפשרים קביעה פשוטה של מיקום ליגנד אחרי מחייב, ואין בהם כדי לאפשר השוואה של ליגנד לרצפטור יחד בדו"ח הנוכחי. בונת GFP גם מספקת הזדמנויות נוספות כדי לבחון חלבון הממברנה שכותרתו כמו כאן. בגלל המיקום C-terminal של תג ה- GFP, ניתן לבחון את מיקומו של תג ה- GFP בתאים transfected לאורך כל assay. Immunofluorescence באמצעות נוגדנים GFP מאפשר השוואה של ה- GFP הנגיש נוגדנים עם ובלי permeabilization (איור 5). יישומים נוספים של ה- GFP-TMEM184A לנצל הדמיה GFP כגון colocalization עם הפרין rhodamine (איור 2). העסקת סריג לאפשר פליטה מ GFP כדי להלהיב את-הפרין rhodamine כמוצג 2C מספקת דרך מעניינת להעריך tra מחייב התאיfficking. יתר על כן, סריג הנתונים מצביעים על כך GFP הוא קרוב מספיק (תוך 10 ננומטר) אל-ליגנד rhodamine להעביר עירור. ראיות כי העברה כאמור מן GFP על עבודות ליגנד פורסמו עבור הורמון יותרת התריס מתוייגים עם tetramethyl-rhodamine 14. טכנולוגית סריג אלטרנטיבית (צילום הלבנה ו / או דפוסי הדמיה מונחה מחשב) יכולים גם להיות מועסק על ניתוח מורכב יותר ממה שמוצג כאן כדוגמא. באופן דומה, אינטראקציות של חלבונים אחרים עם מועמד יכול להיבחן באמצעות סריג עם תגי פלורסנט אופטימיזציה עבור סריג כמו במערכת EGFP / mCherry שדווח על ידי אלבראטצי et al. 15 זוגות CFP / YFP ו- GFP שימוש במחקרים ערוץ אשלגן ידי וואנג ועמיתיו 16. מולקולות חדשות רבות פלורסנט קטנות שתוכננו, למשל 17. מולקולות אלה יגבירו את מספר המקרים שבהם סריג אינטראקציות בין חלבונים-tagged GFP ו fניתן לבדוק הליגנדים luorescent. מחקרים עתידיים יכולים גם לערב ממוקד שינויי הגן, המאפשרים לבנות כדי לקבוע רצף היבטים ספציפיים של תפקוד גן. מגבלה אחת עבור חלבונים בממברנה-tagged GFP היא כאשר C- הסופי של החלבון היא בדרך כלל בפנים. במקרים כאלה, סריג מבחנים עם ליגנדים מסיסים במים פלורסנט אינם אפשריים. עם זאת, מנגנונים חלופיים למקום GFP במקומות אחר לבנות עוד אפשרי עבור כמה חלבונים כאלה, ואת מבחני אחרים דיווחו כאן עדיין יכולים להיות מועסקים.
בנוסף פונקציה, לוקליזציה, ואינטראקציות ליגנד in vivo, חלבון ה- GFP-tagged ניתן לבודד באמצעות נוגדן אנטי GFP ואת החלבון המבודד המשמש לבחינת תפקוד העסקת מבחנים במבחנה שבה GFP מאפשר בידוד משוחד של החלבון פקד מבודד יחסית (GFP חינם). יחד מבחנים אלה יכולים לספק ראיות נוספות חזקות צורך להוכיח העל פונקציות חלבון המועמד שהוצע בעבר.
יתרה מזאת, מאחר GFP הוא פרוטאז עמיד אלא אם כן תוקן עם אתרים להאריך הרחק המבנה הקומפקטי 18, טיפול פרוטאז מוגבל של תאים צריך לשחרר GFP התאי. מחשוף פרוטאז יתרחש החלבון שאליו GFP מצורף או באזור הצמדה תוכנן. המוצר שוחרר יהיה GFP עם סיומת N-terminal לרצף GFP. טריפסין אסור לשחרר GFP אם C- הסופי של החלבון שאליו GFP הוא מצורף תאי. ניתוח ראשוני של מוצרים פוטנציאליים יכול להציע דפוס משקל מולקולרי ברור עם חלבון ה- GFP-tagged שפורסם על ידי טריפסין. עבור חלבונים בממברנה רבים, טכניקות כגון תבאנה ראיות ברורות טופולוגיה הממברנה על ידי שחרור של ה- GFP, או היעדרה.
יחד, מבחני הספציפיות המוצגות ו / או מוצעים בדוח זה לספק דגימה רחבה של טכניקות tכובע יכול להיות מועסק על מנת לבחון חלבונים חדשים על ידי מתחיל עם מבנה מתויג fluorescently. מבנים אלה ניתן להשיג בקלות מסחרית. ההזדמנות להשתמש בהם עבור מגוון רחב של טכניקות גורם להם מבחינה כלכלית עבור אפילו מעבדות קטנות על תקציבים מוגבלים.
Disclosures
החוקרים אין לי מה לחשוף.
Acknowledgements
Research in the Lowe-Krentz lab is supported by research grant HL54269 from the National Institutes of Health to LLK.
Materials
| Name | Company | Catalog Number | Comments |
| GFP-TMEM184A construct | OriGene | RG213192 | |
| Rhodamine-Heparin | Creative PEGWorks | HP-204 | Light Sensitive |
| Fluorescein-Heparin | Creative PEGWorks | HP-201 | Light Sensitive |
| Mowiol | EMD Millipore | 475904-100GM | |
| Paraformaldehyde (PFA, methanol free) | Thermo Sci Pierce Biotech, available through Fisher Scientific | PI28908 at Fisher | Use in Fume Hood |
| Reacti-bind neutravidin plates (Avidin coated black 96-well dishes) | Thermo Sci Pierce Biotech, through Fisher Scientific | PI15510 at Fisher | Pay attention to shelf-life |
| Black 96-well plates | Corning Life Sciences Plastic, purchased through Fisher Scientific | 064432 at Fisher | |
| A7r5 vascular smooth muscle cell line | ATCC | CRL 1444 | Can be exchanged into MEM medium1 |
| BAOEC bovine aortic endothelial cells | Cell Applications, Inc. | B304-05 | Culture as recommended initially, can be exchanged into MEM medium for continuing culture1,7 |
| BAOSMC bovine aortic smooth muscle cells | Cell Applications, Inc. | B354-05 | Culture as recommended initially, can be exchanged into MEM medium for continuing culture1 |
| RAOEC rat aortic endothelial cells | Cell Applications, Inc. | R304-05a | Culture as recommended initially, can be exchanged into MEM medium for continuing culture7 |
| Biotinylated anti-GFP | Thermo Sci Pierce Biotech, through Fisher Scientific | MA5-15256-BTIN | |
| Streptavidin-coated beads | Sigma | S1638 | |
| HeBS | Available from Bio-Rad | Can be prepared in the lab. The pH is 6.8 | |
| TMEM184A antibody to the N-terminus | Santa Cruz Biotechnology | sc292006 | Only known TMEM184A antibody to N-terminal region. |
| TMEM184A antibody to the C-terminus | Obtained from ProSci Inc, Poway, CA | Pro Sci 5681 | ProSci used in Figure 1 |
| GFP antibodies | Santa Cruz Biotechnology | sc9996 | Used in Figure 5 |
| Secondary antibodies, labeled with TRITC or Cy3 | Jackson ImmunoResearch Laboratories, Inc, West Grove, PA | 711 025 152 (donkey anti-rabbit, TRITC) 715 165 150 (donkey anti-mouse, Cy3) | Minimal cross-reactivity to minimize any nonspecific staining. |
| CHAPS | Purchased from Sigma | C5849 | Note that this specific catalog number has been discontinued. Supplier will provide information regarding replacement. |
| Live imaging 35-mm dishes | MatTek (Ashland MA) | P35G-1.0 – 20 mm - C | |
| Confocal Microscope | Zeiss | LSM 510 Meta with a 63X oil-immersion lens | Used for images and live-imaging in Figures 1, 2 and 3 |
| Confocal Microscope | Nikon | C2+ confocal with a 60X oil-immersion lens | Used for images in Figure 5 |
| Confocal Microscope | Zeiss | Zeiss LSM 880 with a 63X oil-immersion lens | Used for images in Figure 2C |
| Electroporation equipment | Bio-Rad | Gene Pulser X-Cell System | |
| Electroporation cuvettes | Available from MidSci | EC2L | Can also be obtained from equipment supplier |
| Plate reader | TECAN | TECAN Infinite® m200 Pro plate reader | Readings in the middle of the wells rather than at the surface. |
| Computer program for measuring staining intensity | Image J | https://imagej.nih.gov/ij/ Program and information available on-line | Any appropriate program can be used. See https://theolb.readthedocs.io/en/latest/imaging/measuring-cell-fluorescence-using-imagej.html for additional detail |
| Cell Culture trypsin solution | Sigma | T4174 | purchased as a 10x solution |
References
- Pugh, R. J., et al. Transmembrane Protein 184A Is a Receptor Required for Vascular Smooth Muscle Cell Responses to Heparin. J Biol Chem. 291, 5326-5341 (2016).
- Daher, W., et al. Identification of Toxoplasma TgPH1, a pleckstrin homology domain-containing protein that binds to the phosphoinositide PI(3,5)P. Mol Biochem Parasitol. , (2016).
- Vit, O., et al. Large-scale identification of membrane proteins based on analysis of trypsin-protected transmembrane segments. J Proteomics. , (2016).
- Attwood, M. M., et al. Topology based identification and comprehensive classification of four-transmembrane helix containing proteins (4TMs) in the human genome. BMC genomics. 17, 268(2016).
- Zou, Z., et al. Genome-Wide Identification of Jatropha curcas Aquaporin Genes and the Comparative Analysis Provides Insights into the Gene Family Expansion and Evolution in Hevea brasiliensis. Front Plant Sci. 7, 395(2016).
- Gilotti, A. C., et al. Heparin responses in vascular smooth muscle cells involve cGMP-dependent protein kinase (PKG). J Cell Physiol. 229, 2142-2152 (2014).
- Farwell, S. L., et al. Heparin Decreases in Tumor Necrosis Factor alpha (TNFalpha)-induced Endothelial Stress Responses Require Transmembrane Protein 184A and Induction of Dual Specificity Phosphatase 1. J Biol Chem. 291, 5342-5354 (2016).
- Xu, D., Esko, J. D. Demystifying heparan sulfate-protein interactions. Annu Rev Biochem. 83, 129-157 (2014).
- Chiodelli, P., Bugatti, A., Urbinati, C., Rusnati, M. Heparin/Heparan sulfate proteoglycans glycomic interactome in angiogenesis: biological implications and therapeutical use. Molecules. 20, 6342-6388 (2015).
- Slee, J. B., Lowe-Krentz, L. J. Actin realignment and cofilin regulation are essential for barrier integrity during shear stress. J Cell Biochem. 114, 782-795 (2013).
- Patton, W. A., et al. Identification of a heparin-binding protein using monoclonal antibodies that block heparin binding to porcine aortic endothelial cells. The Biochemical journal. 311, Pt 2 461-469 (1995).
- Doggett, T. M., Breslin, J. W. Study of the actin cytoskeleton in live endothelial cells expressing GFP-actin. J Vis Exp. , (2011).
- Skalamera, D., et al. Generation of a genome scale lentiviral vector library for EF1alpha promoter-driven expression of human ORFs and identification of human genes affecting viral titer. PloS one. 7, 51733(2012).
- Castro, M., Nikolaev, V. O., Palm, D., Lohse, M. J., Vilardaga, J. P. Turn-on switch in parathyroid hormone receptor by a two-step parathyroid hormone binding mechanism. Proc Natl Acad Sci U S A. 102, 16084-16089 (2005).
- Albertazzi, L., Arosio, D., Marchetti, L., Ricci, F., Beltram, F. Quantitative FRET analysis with the EGFP-mCherry fluorescent protein pair. Photochem Photobiol. 85, 287-297 (2009).
- Wang, S., et al. Domain organization of the ATP-sensitive potassium channel complex examined by fluorescence resonance energy transfer. J Biol Chem. 288, 4378-4388 (2013).
- Christiansen, E., Hudson, B. D., Hansen, A. H., Milligan, G., Ulven, T. Development and Characterization of a Potent Free Fatty Acid Receptor 1 (FFA1) Fluorescent Tracer. J Med Chem. 59, 4849-4858 (2016).
- Chiang, C. F., Okou, D. T., Griffin, T. B., Verret, C. R., Green Williams, M. N. fluorescent protein rendered susceptible to proteolysis: positions for protease-sensitive insertions. Arch Biochem Biophys. 394, 229-235 (2001).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved