Method Article
باستخدام TMEM184A GFP الموسومة نبني لتأكيد الهيبارين مستقبلات الهوية
In This Article
Summary
وTMEM184A ترميز بناء مع علامة GFP في-محطة كربوكسي مصممة للتعبير حقيقية النواة، كان يعمل في فحوصات تهدف إلى التأكد من تحديد TMEM184A بمثابة مستقبلات الهيبارين في خلايا الأوعية الدموية.
Abstract
عندما يتم تحديد البروتينات الرواية من خلال العزلة والمعلوماتية الحيوية التحليل القائم على تقارب، فإنها غالبا ما تكون uncharacterized إلى حد كبير. الأجسام المضادة ضد الببتيدات محددة ضمن تسلسل توقع تسمح بعض التجارب التعريب. ومع ذلك، في كثير من الأحيان لا يمكن استبعاد التفاعلات الأخرى المحتملة مع الأجسام المضادة. وقد وفر هذا الوضع فرصة لتطوير مجموعة من فحوصات تعتمد على تسلسل البروتين. على وجه التحديد، تم الحصول على التركيبة التي تحتوي على التسلسل الجيني بالإضافة إلى تسلسل الترميز GFP في نهاية C-محطة من البروتين ويعمل لهذه الأغراض. تجارب لتميز الترجمة، وتقارب يجند، وتحقيق مكاسب من وظيفة صممت في الأصل وتجرى للتأكد من تحديد TMEM184A بمثابة مستقبلات الهيبارين 1. وبالإضافة إلى ذلك، فإن بناء يمكن استخدامها للدراسات معالجة المسائل طوبولوجيا الغشاء والتفاعلات مفصلة البروتين يجند. ويعرض هذا التقرير عآنج من البروتوكولات التجريبية على أساس بناء GFP-TMEM184A أعرب في خلايا الأوعية الدموية التي يمكن بسهولة أن تتكيف للبروتينات جديدة أخرى.
Introduction
تحديد البروتينات مرشح لوظائف جديدة غالبا ما يعتمد على بروتوكولات العزلة القائمة على تقارب تليها الجزئي تحديد التسلسل. ومن الأمثلة الأخيرة من البروتينات التي تم تحديدها حديثا بروتين الغشاء 184A (TMEM184A)، ومستقبلات الهيبارين التي تم تحديدها بعد التفاعلات الهيبارين تقارب 1، وTgPH1، وهو بروتين نطاق pleckstrin التماثل الذي يربط PI فسفوإينوزيتيد (3،5) ف 2 2. يشمل باقي تحديد البروتين رواية تحليل تسلسل مباشر من الببتيدات مثل تلك التي فيت، وآخرون. الذين استخدموا الببتيدات عبر الغشاء إلى التعرف على المنتجات البروتين من الجينات uncharacterized سابقا 3. وبالمثل، وتحديد تسلسل البروتين جديدة يمكن إنجازه باستخدام المعلوماتية الحيوية البحث الأسر بروتين يتميز سابقا مثل تحديد البروتينات 4TM 4 الجديدة. فحص تسلسل الجينات الأسرة aquaporin له اللهحتى أسفرت عن تحديد أعضاء جدد مع وظائف جديدة 5. بعد تحديد وتحليل وظيفة البروتين هو عادة الخطوة التالية التي يمكن في بعض الأحيان أن تدرس باستخدام فحص معين من وظيفة البروتين مثل في حالة aquaporin.
عندما يكون ذلك ممكنا، وظيفة بروتين تم اكتشافه حديثا يمكن فحص مع الأنزيمية محددة أو ما شابه ذلك في فحوصات المختبر وظيفة. لأن العديد من وظائف بروتينات جديدة تعتمد على التفاعلات المعقدة التي تحدث فقط في خلايا سليمة أو الكائنات الحية، في فحوصات المختبر ليست دائما فعالة. ومع ذلك، يجب أن تكون مصممة لفحوصات في الجسم الحي في مثل هذه الطريقة التي تعتمد على تسلسل الجين. في زراعة الخلايا، و / أو الكائنات نموذج بسيط، يمكن ضربة قاضية تقديم الأدلة الداعمة لتحديد بروتين / وظيفة 6. مع البروتينات الجديدة التي تم تحديدها على النحو المشار إليه أعلاه، فإنه غالبا ما يكون غير كاف لمجرد هدم البروتين لتأكيد وظيفة، وهود تصميم في الجسم الحي المقايسات الفنية التي تعتمد على تسلسل الجين يصبح من المهم لتوصيف البروتينات الرواية.
تحديد مؤخرا TMEM184A بمثابة مستقبلات الهيبارين (أن ينظم انتشار في العضلات الملساء الوعائية والاستجابات الالتهابية في الخلايا البطانية) باستخدام اللوني تقارب وMALDI MS 1، شريطة 7 فرصة لتطوير مجموعة من فحوصات بعد أسفرت ضربة قاضية نتائج متسقة مع تحديد . وأكد الاستعراض الأخير أن الهيبارين يتفاعل بشكل خاص مع العديد من عوامل النمو، مستقبلاتها، مكونات المصفوفة خارج الخلية، مستقبلات الخلايا الالتصاق، وغيرها من البروتينات 8. في الأوعية الدموية، الهيبارين والبروتيوغليكان كبريتات heparan (التي تحتوي على سلاسل كبريتات heparan مماثلة في الهيكل للهيبارين) تتفاعل مع عدة مئات من البروتينات 9. لتأكيد وظيفيا ثاوقد ت TMEM184A تشارك مع امتصاص الهيبارين وملزمة، وضعت التقنيات التي استخدمت التركيبة الجينية للTMEM184A. ويتضمن هذا التقرير مجموعة من فحوصات على أساس GFP-TMEM184A بناء لاستخدامها في تأكيد هوية TMEM184A بمثابة مستقبلات الهيبارين.
Protocol
1. تصميم لتعبيد GFP البروتين
- شراء، أو تصميم وبناء، وبناء GFP الموسومة على أساس البروتين في السؤال.
ملاحظة: للحصول بناء شراؤها، هي ناقلات القياسية المتوفرة من المختبرات التجارية التي تشمل بعض أو كل الاقتراحات التالية: للحصول على بروتين الغشاء، حدد موقع C-محطة للGFP لأنها أقل عرضة للتدخل في الاتجار بروتين الغشاء. النظر في تمديد بين الجين وGFP إذا كان هناك سبب للاعتقاد بأن محطة سي من البروتين في السؤال هو مطوية مضغوط إلى مجال من البروتين. حدد بناء للتعبير عن خلية حقيقية النواة العام، ولكن تسمح ببناء الإنتاج في أنظمة بكتيرية. يتضمن الموقع الانقسام (مثل لالبروتيني TEV) التي يمكن إزالة GFP إذا رغبت في ذلك لبعض التجارب حيث GFP يمكن أن تتداخل مع نشاط البروتين. إضافة إدراج أخرى مثل علامة إضافية للتوطين أو تقارب فيteractions (على سبيل المثال، His6). لم يكن ذلك ضروريا لفحوصات الموصوفة هنا، ولكن قد تيسر فحوصات أخرى، أو يكون من المفيد المتاخمة مباشرة لهذا الجين، وذلك قبل GFP، إذا كان المطلوب إزالة GFP.
2. التعبير GFP-TMEM184A في خلايا الأوعية الدموية
- ثقافة البطانية أو الأوعية الدموية خلايا العضلات الملساء في الجيلاتين المغلفة أطباق زراعة الأنسجة 0.2٪ كما ذكرت سابقا 1، 6، 7.
- إضافة 5 مل من محلول زراعة الخلايا التربسين (0.5٪ ث / ت) لتشطف 100 ملم، أو أكبر، طبق متموجة من الخلايا. احتضان عند 37 درجة مئوية حتى يتم الافراج الخلايا فقط من لوحة، ونقل الخلايا إلى أنبوب البولي بروبلين الطرد المركزي معقمة.
- إضافة مثبط التربسين (على سبيل المثال، حجم مساو من مستنبت العادية)، كما تستخدم في الثقافة الروتينية، إلى حل الخلية / التربسين للحد من النشاط التربسين. بيليه الخلايا لمدة 5 دقائق في approxim¢ الأمر 600 x ج (أو سرعة المناسبة والوقت لمجرد خلايا بيليه لزراعة الأنسجة القياسية). نضح طاف.
- Resuspend الخلايا في 1 مل من البسكويت عالي الطاقة (HEPES مخزنة المالحة) عازلة Electroporation لل، مما يحد من كمية الخلايا وقت هي في بيليه أو تعليق. ضع تعليق الخلية على الجليد وتنفيذ الخطوات المتبقية على الجليد.
ملاحظة: بيليه يمكن غسلها مرة واحدة مع البسكويت عالي الطاقة قبل إعادة تعليق. - إضافة كمية كافية من GFP الموسومة TMEM184A البلازميد الخلايا لتحقيق تركيز النهائي من 20 ميكروغرام / مل الحمض النووي. استخدام بروتوكول مماثل لبناء GFP.
- وضع ما يقرب من 0.4 مل من محلول خلية في البسكويت عالي الطاقة في كوفيت Electroporation لل. قبل البرد cuvettes قبل استخدامها.
- Electroporate الخلايا باستخدام الشروط التالية: الأسي الاضمحلال، 500 μF، ∞ أوم، و 170 V.
ملاحظة: الجهد لنوع خلية معينة يجب أن يكون الأمثل. الدراسات الأولية مع البطانية وسل العضلات الملساءتم إنجاز أنواع لتر مع بناء-GFP فينكولين لتحديد قيمة الجهد الأمثل الإشارة هنا، على سبيل المثال 10.- لتحسين Electroporation لل، وتبدأ مع توصيات الشركة المصنعة للمعدات (التي تشمل أوضاع بعض أنواع الخلايا القياسية). استخدام التركيبة المطلوبة أو عنصر تحكم البروتين الفلوري بناء مماثل في حجم وخصائص الفلورسنت لبناء المرجوة.
ويبدو الصغيرة الأحماض النووية لدخول الخلايا بسهولة أكبر من يبني أكبر، ولذلك فإن بناء مع وجود بروتين فلوري قد يكون من الأسهل للتعبير من أكبر واحد: ملاحظة. - استخدام المجهر مضان لتحديد بقاء الخلية، النسبة المئوية للخلايا التي يتم التعبير عن بناء الفلورسنت بعد 24 و 48 ساعة، وكثافة التعبير.
ملاحظة: إنقاص الجهد و / أو الوقت قليلا إذا بقاء منخفض. تهدف لأقصر وقت ممكن بين الافراج عن الخلايا من سطح الثقافة والعودةالخلايا الثقافة لتعزيز بقاء. زيادات طفيفة في الوقت المناسب أو نبضة الثاني يمكن أن يحسن امتصاص بناء إذا البقاء على قيد الحياة عالية والتعبير منخفضة. والظروف المثلى والتعبير تختلف بين أنواع الخلايا. إذا كانت النسبة المئوية للخلايا معربا عن بناء مرتفع، ولكن كثافة منخفضة، مما يزيد من تركيز الحمض النووي ومراقبة الخلايا transfected مع مرور الوقت لشدة المثلى، والتي سوف تختلف بناء على البروتين نصف العمر وكذلك التعبير، قد يحسن كثافة. كثافة تلطيخ يمكن تضخيم لبعض المقايسات، إذا لزم الأمر، من خلال تلوين المناعي من GFP مع أضداد GFP
- لتحسين Electroporation لل، وتبدأ مع توصيات الشركة المصنعة للمعدات (التي تشمل أوضاع بعض أنواع الخلايا القياسية). استخدام التركيبة المطلوبة أو عنصر تحكم البروتين الفلوري بناء مماثل في حجم وخصائص الفلورسنت لبناء المرجوة.
- بعد Electroporation لل، البذور الخلايا في ست آبار زراعة الأنسجة 30 ملم مع coverslips للتصوير أو في أطباق زراعة الأنسجة. ثقافة الخلايا باستخدام إجراءات الثقافة الخلية القياسية.
- اختياري: استبدال مستنبت بعد 24 ساعة لإزالة أي العازلة Electroporation للالبسكويت عالي الطاقة.
3. التصور من GFP-TMEM184A التعريب
- شطف الخلايا مع برنامج تلفزيوني والهز لطيف بعد زراعة لمدة 24 ساعة على الأقل. الحد من التعرض للضوء الساطع لتجنب GFP يتلاشى.
- إصلاح الخلايا مع بارافورمالدهيد 4٪ (PFA) في برنامج تلفزيوني لمدة 15 دقيقة في RT مع اهتزاز لطيف. تجنب استخدام أي الكواشف التي تحتوي على الميثانول التي قد permeabilize الخلايا. تثبيت مع الميثانول يمكن أن تستخدم إذا كان ليس من الضروري تقييم التفاعلات يجند.
تحذير: لامتصاص العرق هي سامة. ارتداء معدات الوقاية الشخصية المناسبة. استخدام في غطاء الدخان، مع الرعاية، وتجاهل بشكل صحيح. - شطف مع برنامج تلفزيوني على النحو الوارد أعلاه. لتلوين الأجسام المضادة مقرها، انظر 3.6 أدناه.
- جبل coverslips على الشرائح باستخدام Mowiol أو غيرها المتوسطة المتزايدة مناسبة.
- شرائح الصور باستخدام المجهر مبائر أو مضان مع مجموعات مرشح المناسبة لإثارة GFP والأطياف الانبعاثات. ويفضل الفحص المجهري متحد البؤر بسبب القدرة على فصل العينات في ض الطائرة. حفظ الصور في مقياس الرمادية لتشوأغراض antitation في شكل TIF (بالإضافة إلى الصور الملونة الكاملة عن الرسوم التوضيحية).
- وعلى سبيل المقارنة مع WT TMEM184A أعرب من قبل خلايا، وإعداد الخلايا الأخرى للالمناعي باستخدام الأجسام المضادة الأولية على استعداد لالببتيد (ق) من تسلسل TMEM184A، على سبيل المثال 1. تحديد GFP-TEMEM184A كما يمكن إنجازه باستخدام الأجسام المضادة ضد GFP. تقييم كل عينات من الخلايا باستخدام تقنيات المجهر متطابقة.
4. الرودامين-الهيبارين وتجليد وColocalization مع خلايا transfected GFP-TMEM184A-
- علاج GFP-TMEM184A، معربا عن الخلايا مع 100 ميكروغرام / مل رودامين-الهيبارين إضافة إلى مستنبت، وتسمح للخلايا لاحتضان لفترة محددة من الزمن، عادة أقل من 10 دقيقة للخلايا A7r5. شطف وإصلاح كما هو الحال في 3.1 و 3.2.
ملاحظة: الوقت الأمثل وتركيز يجند تعتمد على استجابة الخلايا، وكثافة مضان من كثافة يجند والصورة التي تم الحصول عليها. هذا ويركزكان يعمل أيون الهيبارين لأنه يؤدي إلى استجابة أكثر من 50٪ في فحوصات أخرى (11). يمكن تصور هذا التركيز باستخدام تقنيات مضان المجهر القياسية، لذلك لم يكن من الضروري زيادته. التخفيف من رودامين-الهيبارين مع نتائج الهيبارين غير المسماة في أقل مضان في الخلايا، مما هو أكثر صعوبة للصورة وكميا. - ل quantitate ورودامين-الهيبارين ملزم بسبب GFP-TMEM184A ترنسفكأيشن، وإعداد خلايا متطابقة دون transfected GFP-TMEM184A.
- صورة الخلايا باستخدام المجهر متحد البؤر مع GFP المناسب (488 نانومتر) ورودامين (543 نانومتر) الإثارة وانبعاث (500-530 نانومتر لGFP وأكبر من 560 نانومتر لرودامين) القيم لتحديد شارك في التعريب. الحصول على صور لا يقل عن 50 خلايا من لا يقل عن ثلاثة تجارب منفصلة الحصول على إحصائيات. الحفاظ على إعدادات مماثلة في التجارب، وتوظيف العينة الضابطة (ق) (على سبيل المثال، خلايا transfected مع أي علاج) عشرفي يمكن استخدامها لتوحيد البيانات لتحليل تجارب متعددة.
- دراسة الصور باستخدام برنامج كمبيوتر لتحديد رودامين النسبي ملزمة / امتصاص في كل خلية لتحديد الكميات ملزمة.
وينبغي استخدام الصور TIF كما أنها مريحة للتحليل ويمكن تحويلها إلى اللون الرمادي واسعة النطاق في العديد من برامج الكمبيوتر إذا لم تكن المحفوظة في البداية في هذا الشكل: ملاحظة. كان يعمل صورة J (مجانية) في التحليل الحالي ويسمح المنطقة وكثافة بكسل إلى أن تقاس لأي منطقة المعرفة في صورة.- استخدام أداة يدوية لدائرة خلية داخل صورة الفلورسنت واستخدام أداة قياس لتحديد كثافة داخل هذا الفضاء.
ملاحظة: توفر هذه القياسات على المعلومات اللازمة لحساب كثافة الإجمالية للمنطقة المعرفة من قبل المستخدم (خلية كاملة، نواة، الخ) وتوفير وسيلة للمقارنة بين خلايا مختلفة مع هندستها مختلفة. يعني يمكن الإبلاغ عن شدة على مساحة الخلفية، والتي تسهلالصورة مجموعة من شدة الخلفية للتحليل. - تصدير إلى جدول بيانات لحساب مساحة مضروبا في شدة وطرح خلفية لأن نفس الكمية من المنطقة. متوسط مضان / خلية لما يكفي من خلايا / التجربة للحصول على دلالة إحصائية.
- استخدام أداة يدوية لدائرة خلية داخل صورة الفلورسنت واستخدام أداة قياس لتحديد كثافة داخل هذا الفضاء.
5. نقل الإسفار الرنين الطاقة من GFP-TMEM184A إلى الرودامين-الهيبارين
- إعداد الخلايا transfected واحتضان مع 200 ميكروغرام / مل الموسومة رودامين يجند كما في 3.1. لاحظ أن فترة حضانة مع يجند فلوري هو من نوع الخلية التابعة. مع تحديد منهاج العمل فقط، وجبل الشرائح للتصوير.
- أولا، تثير في 405 نانومتر، وصورة عن الانبعاثات رودامين (566-685 نانومتر. الحنق). ثانيا، تثير في 488 لGFP (صورة في 493-530)، والثالث، تثير في 561 لرودامين (صورة في 566-685). دون ضوابط GFP-TMEM184A أو بدون رودامين-الهيبارين حاسمة.
6. التصوير خلية حية من الرودامين-Hepariن امتصاص
- البذور وGFP-TMEM184A خلايا transfected في أطباق فردية مصممة لتصوير الخلايا الحية وعلاج كما هو الحال في بروتوكول 3.
ملاحظة: يعتمد عدد الخلايا المطلوبة على نوع من الخلايا والكثافة المطلوبة. لتقليل مقدار الوقت الخلايا في تعليق، لا تعول الخلايا. خلايا البذور من صحن متكدسة 100 مم إلى 35 مم ستة أطباق التصوير الحي للحصول على خلايا القريب التقاء في 48 ساعة. - بعد 48 ساعة، واستبدال المتوسطة مع مستنبت دون الفينول الأحمر.
- نقل طبق من الخلايا إلى المجهر متحد البؤر مع مرحلة الاحتباس الحراري للحفاظ على درجة الحرارة، والتركيز المجهر.
- الماصة 100 ميكروغرام / مل رودامين-الهيبارين في طبق وتخلط بلطف.
- على الفور بدء تسجيل الصور الحية. إذا لم يحدث امتصاص الخلايا للهيبارين في المنطقة في الرأي، تحريك الطبق قليلا لتحديد الخلايا مع حويصلة الخضراء واحد على الأقل تحتوي على التسمية رودامين.
ملاحظة: التصوير الإثارة وانبعاث تفاصيل هينفس لبروتوكول الهيبارين امتصاص (القسم 5). وكانت الفترة الزمنية بين الصور حوالي 16 ق. فإن شروط التجربة والمجهر تحديد عادة السرعة التي يمكن الحصول على الصور.
7. عزل GFP-TMEM184A وGFP من الخلايا المستزرعة
- بعد إزالة مستنبت والشطف مع برنامج تلفزيوني، إضافة 2 مل 0.2٪ (ث / ت) حل CHAPS برنامج تلفزيوني 1X مع مثبطات الأنزيم البروتيني لوحة 150 ملم من الخلايا معربا عن GFP-TMEM184A أو GFP (لفحوصات ملزمة السيطرة). تتخلص من الخلايا من الطبق، ووضع حل خلية / CHAPS في أنبوب البولي بروبلين 15 مل على الجليد، ومزيج جيد من قبل التنصت. استكمال جميع الخطوات في الضوء الساطع لضمان ابيض علامة GFP للمقايسة ملزمة أدناه.
- ربط على وجه التحديد GFP-TMEM184A (أو عنصر تحكم GFP المناسبة)، إضافة 2 ميكروغرام / مل المعقدة البيروكسيديز المضادة للأجسام المضادة GFP إلى الحل واحتضان بين عشية وضحاها في 4 درجات مئوية مع هزاز.
- إضافة 500 ميكرولترمن الخرز streptavidin الاغاروز للا يقل عن 5 مل 0.2٪ CHAPS / برنامج تلفزيوني وأجهزة الطرد المركزي في حوالي 600 x ج لمدة 3 إلى 5 دقائق. إزالة طاف. كرر مرتين أخريين مع CHAPS جديد / برنامج تلفزيوني في كل مرة. إضافة حبات في حل الأجسام المضادة والخلايا واحتضان بين عشية وضحاها في 4 درجات مئوية مع هزاز للسماح حبات لربط الأجسام المضادة المعقدة البيروكسيديز مكافحة GFP منضمة إلى GFP أو GFP-TMEM184A.
- بيليه الخرز بواسطة الطرد المركزي (كما في 7.3) وإزالة المواد غير منضم. إضافة مثبطات لا يقل عن 5 مل 0.2٪ CHAPS / PBS / البروتيني لغسل. تكرار غسل والطرد المركزي على الأقل 3X نحو فعال لإزالة أي البروتين غير منضم.
- بعد إزالة غسل النهائي، واحتضان حبات مع 1 مل من 0.2 M الجلايسين / 0.2٪ CHAPS في برنامج تلفزيوني (الرقم الهيدروجيني إلى 2.0 باستخدام حمض الهيدروكلوريك) على الجليد لمدة 3 دقائق ليفرق بين الأجسام المضادة GFP ملزمة (مما أدى مجانا GFP-TMEM184A أو مجانا GFP). المزيج بلطف من خلال استغلال كل 30 ثانية.
- أجهزة الطرد المركزي في حوالي 600 x ج ونقل طاف تحتوي ع النقيrotein إلى 15 مل أنبوب جديد تليها تحييد فوري مع 5 مل من 1 M بيكربونات الصوديوم (جلب الرقم الهيدروجيني إلى 7).
- تركيز العينة باستخدام 10،000 دالتون الوزن الجزيئي قطع المكثف الطرد المركزي (توظيف سرعة الطرد المركزي التي أوصت بها المورد). عندما يصل حجم ما يقرب من 0.5 مل، إضافة 0.2٪ CHAPS / برنامج تلفزيوني. / برنامج تلفزيوني حتى / تم إضافة ما لا يقل عن عشرة مجلدات (أضعاف حجم العينة الانطلاق) من 0.2٪ CHAPS برنامج تلفزيوني الاستمرار في التركيز وإضافة المزيد من 0،2٪ CHAPS.
- لتحديد تقدير كمية GFP معزولة أو البروتين GFP الموسومة، الحصول على الامتصاصية القراءة في 280 نانومتر، وذلك لمقارنة منحنى القياسية التي أعدت من ألبومين المصل البقري أو غيرها من البروتين تحكم في المخزن نفسه.
ملاحظة: نظرا للاختلافات معامل الانقراض، هذا التركيز هو تقدير، ولكن يمكن أن توفر تركيز البروتين تقريبي لتسهيل مزيد من التحليل دون إضاعة العينة. تركيز البروتين دقيقة يمكن ردعالملغومة باستخدام بروتين الفحص الجزئي لوري التأكد من أن يعد البروتين القياسي في المخزن نفسه كما العينة. المزيد من التحليل للبروتين معزول ويمكن تحقيق ذلك عن طريق النشاف الغربي من بروتين المعزول (باستخدام الكشف عن الأجسام المضادة لGFP) وبالمقارنة مع الوزن الجزيئي المتوقعة. بدلا من ذلك، يجب استخدام الأجسام المضادة TMEM184A يؤدي إلى الفرقة من حجم بناء توقعت، ولكن قد يؤدي أيضا إلى الفرقة WT TMEM184A إذا dimers (أو الأوليغومرات العليا) موجودة في العينة. تقديرا للنقاء ويمكن الحصول على تلطيخ وصمة عار على البروتين الكلي من عينة معزولة ضد البروتين الكلي من قسامة من المواد الانطلاق.
8. في المختبر الهيبارين الفحص التجليد
- إعداد المغلفة أفيدين السوداء لوحة 96-جيدا عن طريق الغسيل مع 200 ميكرولتر 0.2٪ CHAPS / PBS ثلاث مرات لمدة 5 دقائق مع اهتزاز. إعداد السوداء noncoated لوحة 96-جيدا متطابقة توظيف إجراء الغسيل نفسه. يحضرتخطيط لعينات تجريبية (في ثلاث نسخ) لمتابعة أثناء الفحص. وتشمل الآبار للتركيزات القياسية الهيبارين، وضوابط العازلة، والآبار مع عينات GFP دون الهيبارين لتأكيد تبييض GFP.
ملاحظة: إذا الأمثل العزلة أو التفاعل يجند مخازن مختلفة للبروتين في السؤال، تفعل كل الاستعدادات لوحة والغسيل مع نظام المخزن الأمثل. - إضافة 100 ميكرولتر من 60 بمول / البيروكسيديز جيدا مكافحة GFP لجميع الآبار في لوحة المغلفة أفيدين حيث GFP هو المطلوب ملزمة. كمية من الأجسام المضادة غير كافية لمجرد تشبع أفيدين عالية تقارب في الآبار.
- إضافة العازلة فقط لجميع الآبار المستخدمة لأغراض المراقبة (لا GFP أو GFP-TMEM184A ملزمة المطلوب). اغلاق الآبار مع غطاء لوحة لمنع التبخر. احتضان لمدة 2 ساعة عند RT، مع اهتزاز.
وتقوم وحدات التخزين إضافة إلى الآبار وحضانة مرات على توصيات من مزود: ملاحظة.
- إضافة العازلة فقط لجميع الآبار المستخدمة لأغراض المراقبة (لا GFP أو GFP-TMEM184A ملزمة المطلوب). اغلاق الآبار مع غطاء لوحة لمنع التبخر. احتضان لمدة 2 ساعة عند RT، مع اهتزاز.
- تغسل جميع الآبار ثلاث مراتلمدة 5 دقائق مع 200 ميكرولتر 0.2٪ CHAPS / برنامج تلفزيوني.
- إضافة 100 ميكرولتر من 5 نانومول / جيد GFP-TMEM184A أو GFP أن تخصص الآبار في لوحة المغلفة أفيدين واحتضان لمدة 1 ساعة على RT مع اهتزاز. يغسل مرة أخرى كما هو الحال في 8.3.
ملاحظة: تم اختيار هذا التركيز من البروتين لضمان أن جميع المواقع ومشبعة الزائد GFP أو GFP-TMEM184A. وهذا أمر مهم لضمان أن نفس كمية البروتين لا بد أن كل بئر. قد كميات أقل من البروتين أيضا تشبع المواقع، وهو احتمال يمكن دراستها من خلال تقييم البروتين غير منضم المتبقية بعد احتضان عدة تركيزات البروتين مع لوحة وبمقارنة البروتين غير منضم ويجند المقايسات ملزمة. - إعداد تركيزات مختلفة من الهيبارين المسمى فلوريسئين، على سبيل المثال، 10، 25، 50، 75، 100، 200 ميكروغرام / مل، في 0.2٪ CHAPS / برنامج تلفزيوني. هل هذا وجميع الأعمال المتبقية في الظلام.
ملاحظة: قبل إعداد تركيزات، ينبغي تحديد تركيزات محددة لبروابط أخرى لproteiالهدف ن في السؤال. يجب أن يكون أقل تركيز كشفها في قارئ لوحة. ولذلك فمن المهم أولا تحديد النطاق الذي يمكن الكشف بدقة في نظام المخزن المستخدمة. ثم تحديد مدى الحاجة للحصول ملزمة للقياس. لم تركيزات فلوريسئين-الهيبارين أقل من 10 ميكروغرام / مل يتم تسجيل باستمرار في قارئ لوحة في ظل الظروف العازلة المستخدمة. وبالمثل، في حين رودامين-الهيبارين مثل استخدامها في فحوصات أخرى، يمكن تصور في قارئ لوحة، في الظروف العازلة وفي التركيزات المطلوبة للربط، كانت القراءات مضان لمعايير لا يختلف بتكاثر مع أن fluorophore. - إضافة 100 ميكرولتر من فلوريسئين-الهيبارين إلى آبار اختبار المناسبة في لوحة ومستوى تركيز الآبار المغلفة أفيدين في كل من المغلفة أفيدين ولوحة غير المغلفة. احتضان لمدة 10 دقيقة في RT مع اهتزاز. حافظ على لوحات في الظلام (أو احباط شمل).
- باستخدام لوحة الجرميةدير، وتسجيل الانبعاثات مضان الأولي من الهيبارين في الآبار السيطرة على كل لوحات ومضان الأولي (الإجمالي) الانبعاثات من الآبار مع يجمد GFP-TMEM184A أو GFP في لوحة المغلفة أفيدين. إذا لزم الأمر، وضبط الربح أداة لضمان الكشف عن الهيبارين الفلورسنت بين أدنى وأعلى تركيزات.
ملاحظة: تأكد القارئ لوحة يقرأ الآبار من فوق ويقرأ في الموقع الأمثل في الآبار إذا كان هذا هو قابل للتعديل. للدراسة في السؤال، وكان المكان الأمثل نحو 75٪ إلى أسفل الآبار. المعلومات المتاحة مع قارئ لوحة ينبغي أن توفر الاقتراحات التي هي فريدة من نوعها للقارئ لوحة في السؤال لقراءة فحوصات عينة المربوطة في لوحات سوداء. - إزالة الهيبارين الفلورية غير منضم من الآبار مع يجمد GFP-TMEM184A أو GFP ومكان في المقابلة الآبار في لوحة غير المغلفة السوداء. قراءة مباشرة من انبعاث مضان.
- إضافة 100 ميكرولتر الطازجة بنسبة 0.2٪ CHAPS / PBS كثافة الظهرس الآبار التي تم إزالة فلوريسئين-الهيبارين، وقراءة مضان الانبعاثات.
- كرر الخطوات من 8،8-8،9 3X.
ملاحظة: هذه القراءات من المغلفة لوحة تشير الهيبارين فلوريسئين المتبقية في GFP أو GFP-TMEM184A الآبار. إذا تم العثور مضان كبير في العينة غير منضم الثالثة، ينبغي أن يحدث غسل إضافية. وإذا استمر مضان لإزالتها في كل غسل، ملزم يجند قد تكون منخفضة تقارب، وينبغي للشروط إعادة تقييمها. تشكل القراءة النهائية القراءة الهيبارين المربوطة. - مضان الانبعاثات سجل من إزالتها، غير منضم، والعينات في لوحة noncoated، الحصول على أرقام عن كل غسل. هذه هي قراءات "غير منضم".
- استخدام مجموع القيم الانبعاثات الهيبارين التي تم الحصول عليها في 8.7 لتأكيد مستويات صحيحة من الهيبارين وأضاف أن كل بئر. طرح متوسط قراءات خلفية من القيم.
ملاحظة: ويلز دون أي فلوريسئين-الهيبارين بمثابة الخلفية بسبب الأجسام المضادة، GFP والعازلة. Averagالبريد يكرر الخلفية للحصول على قيمة الخلفية. طرح متوسط قراءات خلفية من القراءات المقيدة وغير منضم للحصول على القيم الفعلية. - استخدام قطعة من الانبعاثات مقابل أضاف الكلي فلوريسئين-الهيبارين لتحديد حجم الانبعاثات مقابل مبلغ من الهيبارين.
ملاحظة: الجسم المضاد وحده، أو الضد والمستضد أدت في بعض تبريد مضان. لذلك، تم تحديد مجموع الهيبارين استنادا إلى مجموع الهيبارين وأضاف كما ورد في 8.7. - رسم الهيبارين ملزمة تصحيح مقابل الهيبارين وأضاف ليثلث في كل حالة GFP-TMEM184A وقضية GFP.
- تحديد يجند مجانا عن طريق إضافة قراءات غير منضم من جميع يغسل لتركيز معين.
النتائج
في حين، من الناحية النظرية، ترنسفكأيشن من أي الحمض النووي بناء في الخلايا يمكن أن يتحقق مع الكواشف ترنسفكأيشن محبة للدهون، وتشير التقارير السابقة ترنسفكأيشن أكثر فعالية من GFP يبني في الخلايا البطانية باستخدام Electroporation لل12. بروتوكول المقدمة هنا يتحقق عادة GFP-بناء التعبير في أكثر من 80٪ من الخلايا البطانية المستمدة من الابتدائي وخلايا العضلات الملساء المستخدمة. تصميم للبناء يعملون استخدام نظام المتاحة تجاريا يمكن أن تقدم هذا البناء بسرعة. وتركز الاستخدام المقصود كبير على القضايا الموقع، وبالتالي التسليم الصحيح للغشاء، جنبا إلى جنب مع تعبير البروتين وحيد الخلية الأمثل واستمر كانت الاعتبارات الأولية إنتاج بناء. اعتبارات أخرى يمكن أن تشمل: موقع مختلف من GFP للبروتينات محلية مختلفة أو البروتينات مع محطة سي التي هي جزء من منطقة مطوية، وإمكانية wantiنانوغرام لإزالة GFP (إضافة موقع انشقاق الأنزيم البروتيني)، وموقع تقارب الثانوي. أن هذا الأخير توفير طرق بديلة لتنقية بناء GFP والاستقرار على سطح لفحص ملزمة. وتمت مقارنة لتأكيد تلطيخ أنماط الأجسام المضادة التجارية المختلفة ضد TMEM184A، خلايا الأوعية الدموية معربا عن GFP-TMEM184A إلى خلايا متطابقة ملطخة الأضداد التجارية. طول الوقت بعد توزيع الآثار ترنسفكأيشن GFP-TMEM184A، التي يبدو أنها تتراكم أكثر من 72 ساعة على الأقل. طول الوقت بعد ترنسفكأيشن مما أدى إلى التعبير الأمثل يختلف بحسب نوع من الخلايا، وينبغي أن يكون الأمثل لكل أسلوب. مع مرور الوقت، كان أكثر التسمية GFP في المنطقة المحيطة النووية. اعتمادا على المناولة ووقع GFP التبييض أيضا. أشارت النتائج GFP-TMEM184A على سطح الخلية وفي الهياكل حويصلة شبه نووية وأخرى مماثلة لتوطين لاحظ مع TMEM184A تلوين الأجسام المضادة (الشكل 1). الخلايا الأولية في تم تصوير الشكل 1 24 ساعة بعد ترنسفكأيشن، بينما تم تصوير الخلايا A7r5 المستنسخة 48 ساعة بعد ترنسفكأيشن. وقد اتخذ هذا القرار لإصلاح خلايا GFP transfected للتأكد من أن جميع الخلايا وعولج مماثل للمقارنة التعريب. تثبيت المرجح خفض الانبعاثات سطح الخلية GFP مضان إلى حد ما. نمط تلطيخ GFP بدا أكثر مماثلة لتلك التي من الأجسام المضادة التي أثيرت ضد الببتيد C-محطة، أعطى النتيجة المنطقية أن GFP هو في محطة سي من البروتين. تلطيخ مع الأجسام المضادة التي تستهدف الببتيد في المنطقة N-المحطة كان أيضا مماثلة، ولكن يبدو قليلا أكثر تركيزا في المنطقة المحيطة النووية. اختلافات واضحة في توطين مع الأجسام المضادة المختلفة يمكن أن يكون راجعا إلى ربط يجند (ربما بالقرب من محطة سي في هذه الحالة)، والتي يمكن أن تكون ثابتة هناك، والحد من وصول الأجسام المضادة. بدلا من ذلك، يمكن للN- وترميني ج- أن يكون على طرفي نقيض من الغشاء. ربما، أن البروتين المركب حديثا وصمة عار المزيد من البريدffectively مع الأجسام المضادة نسبة إلى البروتين المعدل بعد translationally. للمقارنة بين مجموع توطين GFP-TMEM184A إلى TMEM184A الذاتية، تلطيخ مع الأجسام المضادة لGFP تقدم صورة أكثر دقة من الكل GFP-TMEM184A من مجرد تصوير GFP. وتظهر الصور من تلوين الأجسام المضادة لمكافحة GFP في الشكل (5) حيث تم استخدام تقنية أيضا لتقييم طوبولوجيا الغشاء.
استخدام يجند فلوري (رودامين-الهيبارين) تسهيل تقييم المشترك توطين يجند ومستقبلات مع مرور الوقت، وجعل تسميات اثنين من الممكن إجراء التصوير الحي (الشكل 2 وفيلم 1). تم تصوير الشكل 2C التي كتبها مثير للGFP في 405 نانومتر، ولكن التقاط الانبعاثات من رودامين (صور الوسطى). يقتصر الإثارة GFP في 405 نانومتر العائد الانبعاثات محدودا أيضا، ولكن هذا حال دون إثارة رودامين وإشارة الحنق كاذبة. وبالمثل، فإن الحنق-inducكان إد الانبعاثات رودامين خافت. في الضوابط مع التعبير GFP-TMEM184A، ولكن لا رودامين-الهيبارين، وغيرهم من ذوي فقط رودامين-الهيبارين كان هناك أي انبعاث رودامين مع 405 نانومتر الإثارة. بعد ذلك، تم قياس GFP الكلي (الصور اليسرى) ورودامين الإجمالي (الصور اليمنى) باستخدام موجات الإثارة / الانبعاثات القياسية لكل fluorophore. البيانات في C تقديم مزيد من الدعم للزملاء توطين يجند وGFP-TMEM184A. امتصاص-رودامين الهيبارين في RAOEC المطلوب حضانة أطول بالمقارنة مع خلايا A7r5. وقد لوحظ أي دليل على الحنق في الخلايا دون رودامين-الهيبارين أو في خلايا untransfected. وتشمل تجربة مثالية سطح GFP-بناء آخر ما كان يجب أن شارك في التعريب مع يجند.
ويمكن أيضا أن يتحقق اكتساب أو استعادة وظيفة مع بنيات GFP البروتين ورودامين-الهيبارين. وفر ذلك فرصة لاستخدام GFP كدليل على مستوى التعبير والمشارك يجندتعريب ولقياس التفاعلات. على وجه التحديد، وزاد الإقبال الهيبارين في GFP-TMEM184A بناء transfected خلايا A7r5 (الشكل 3). تم إنتاج خلايا ضربة قاضية مستقرة والتي تأخذ محدود جدا رودامين-الهيبارين 1، وهذه المقدمة نظام حيث يمكن تقييمها كسب وظيفة. أدى ترنسفكأيشن من بناء GFP-TMEM184A في الخلايا التي يمكن مرة أخرى استيعاب رودامين-الهيبارين على مستوى الخلايا من النوع البري أو أعلى (الشكل 3). وتجدر الإشارة إلى أن "لا الهيبارين" الصورة من خلايا ضربة قاضية مستقرة، والتي لا تعبر عن GFP كمراسلة لبناء ضربة قاضية. كان مضان الخلفية العالي في هذه الخلايا، كما لوحظ في الصورة المعروضة.
ومن المفيد عادة إلى استخدام مستقبلات معزولة لتحديد خصوصية يجند لتقليل احتمال غيرها من البروتينات التفاعل مع يجند. استخدام GFP-proteiيوفر ن بناء ميزة كبيرة في هذا الصدد كما علامة GFP يمكن أن تكون بمثابة مؤشر لعزل البروتين والابتعاد عن التفاعلات الممكنة من الأجسام المضادة أو غيرها من الكواشف تقارب مع بروتينات إضافية. GFP يمكن التعبير عنه أيضا في أعداد مماثلة من الخلايا وعزلها باستخدام نفس الإجراء GFP تقارب. ويوفر هذا البروتين السيطرة للدراسات يجند التفاعل. في نظام TMEM184A، عزل GFP-TMEM184A باستخدام أدى إجراء الأجسام المضادة تقارب مكافحة GFP في، الهيبارين تشبع محددة ملزمة، في حين أن GFP سيطرة لا يلزم أي الهيبارين (الشكل 4).
عادة، يتم وضع علامات GFP على ثوابت في وضع حد للبروتين. الموقع C-محطة يسهل الاتجار الصحيح البروتين لغشاء. ولذلك، فإن توافر GFP على جانب معين من الغشاء يمكن أن توفر أدلة على طوبولوجيا معين من البروتين غشاء إذا قابلة للطي وطوبولوجيا ليسواlready معروفة. بسيط المناعي تلطيخ مع الأجسام المضادة ضد GFP (كما هو الحال في الشكل 5) يمكن أن توفر أدلة على موقع GFP على أساس وصول الأجسام المضادة في الخلايا غير permeabilized. وأضداد GFP تعترف GFP حتى لو ابيض. مناعي تلطيخ هو مبين في الشكل (5) تشير إلى تلطيخ كبيرا مكافحة GFP دون permeabilization من الخلايا GFP-TMEM184A transfected تقديم الأدلة الأولية إلى أن GFP في غشاء البلازما هي خارج الخلية. ومن الواضح أن البروتين داخل الخلايا في الحويصلات أيضا يصبح الملون في الخلايا permeabilized. صور الحنق في الشكل 2C تتفق مع هذا الهيكل المقترح.

يؤكد التعريب GFP-TEMEM184A في خلايا TMEM184A التعريب يحددها المناعي: الشكل 1. أ) BAOECs transfected مع GFP-TMEM1تم إصلاحها 84A مع PFA 4٪. إما معالجة خلايا Nontransfected مع الميثانول (MeOH) تحديد المثلج وpermeabilization أو 4٪ PFA تليها تريتون X-100 permeabilization (كما ذكر). كانت ملطخة الخلايا nontransfected استخدام أجسام مضادة ضد الببتيد C-محطة من TMEM184A (CTD) أو الببتيد-N محطة من TMEM184A (NTD) والأضداد المضادة للأرنب الثانوية ذات الكلمات الدلالية مع TRITC. ب) تم تجهيزها أمثلة المستنسخة (A7r5) و (BAOSMC) خلايا العضلات الملساء الأولية بالمثل. الرجاء انقر هنا لعرض نسخة أكبر من هذا الرقم.
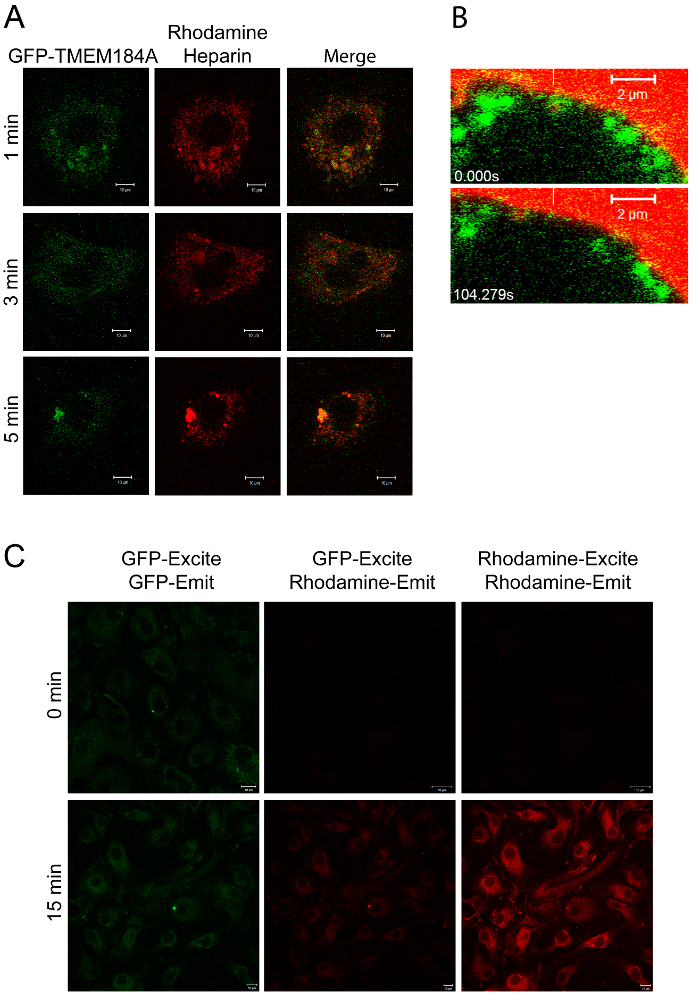
الشكل 2: التصوير من GFP-TMEM184A مع رودامين-الهيبارين. أ) A7r5s electroporated مع GFP-TMEM184A عولجوا مع 100 ميكروغرام / مل رودامين-الهيبارين لمرة وأشارت ثم ثابتة مع PFA 4٪. الصور هي تمثيلية من تجربتين منفصلتين. B) و transfected خلايا A7r5 مع وأضيف GFP-TMEM184A ورودامين-الهيبارين مع التصوير الحي المباشر. وتظهر إطارات مختارة من الفيلم مع شريط عمودي الأبيض يشير إلى توطين الأولي من حويصلة المغلفة GFP تحتوي على رودامين-الهيبارين. التسمية GFP ورودامين التحرك معا. الحانات النطاق = 2 ميكرون. تم تصوير C) RAOECs يعامل كما في ألف لمضان بالرنين نقل الطاقة عن طريق إثارة في 405 (GFP، لالحنق) وبالمقارنة مع الإعدادات القياسية، انظر بروتوكول 3.5. لوحة و، ونقطة مرتين في B، نشرت أصلا في مجلة الكيمياء البيولوجية. بف، RP، وآخرون. 1. حقوق التأليف والنشر الجمعية الأمريكية للكيمياء الحيوية والبيولوجيا الجزيئية. الرجاء النقر هنا لضدiew نسخة أكبر من هذا الرقم.

الشكل (3): GFP-TMEM184A ترنسفكأيشن يوفر ربح من وظيفة. أ) إلى حد كبير تعتبر مستويات أقل من رودامين-الهيبارين في الخلايا A7r5 ضربة قاضية مستقرة مقارنة مع من النوع البري A7r5s، انظر المثال الصور. "لا الهيبارين" الصورة من خلايا ضربة قاضية مستقرة التي تعبر عن GFP كعلامة على وجود بناء. الحانات النطاق = 10 ميكرون. ب) ترنسفكأيشن من GFP-TMEM184A إلى البرية من نوع حد سواء، وخلايا ضربة قاضية مستقرة زيادة كبيرة في إشارة رودامين الهيبارين في هذه الخلايا على أساس تحليل أكثر من 50 خلية / حالة في ثلاث تجارب مستقلة. أشرطة الخطأ تمثل SEM. ف <0.0001 على أساس اختبار توكي. وقد نشر هذا الرقم أصلا في مجلة الكيمياء البيولوجية. بف، RP، وآخرون. 1. حقوق التأليف والنشر الجمعية الأمريكية للكيمياء الحيوية والبيولوجيا الجزيئية. الرجاء انقر هنا لعرض نسخة أكبر من هذا الرقم.
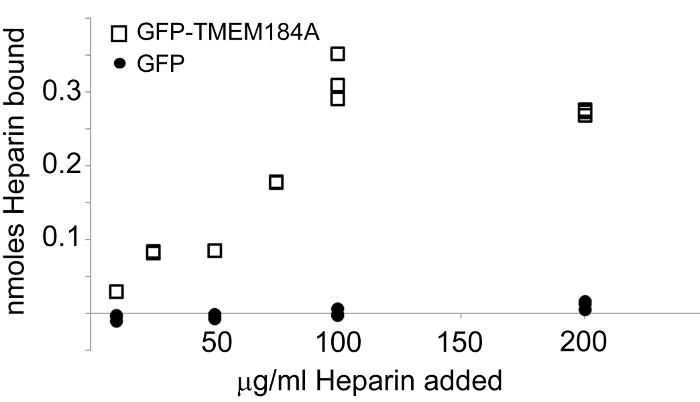
الشكل 4: عزل GFP-TMEM184A تربط الهيبارين. تم عزل GFP-TMEM184A أو GFP وملزمة لوحات الفحص المغلفة أفيدين. تمت إضافة فلوريسئين-الهيبارين بتركيزات تتراوح من 0.056 نانومول من خلال 1.111 نانومول. الهيبارين ملزمة تم تحديدها عن طريق قياس الانبعاثات في 519 نانومتر. GFP-TMEM184A (المربعات). السيطرة GFP (الدوائر). وقد نشر هذا الرقم أصلا في مجلة الكيمياء البيولوجية. بف، RP، وآخرون. 1. حقوق التأليف والنشر الجمعية الأمريكية للكيمياء الحيوية والبيولوجيا الجزيئية. _blank "> اضغط هنا لمشاهدة نسخة أكبر من هذا الرقم.

الرقم 5: GFP-TMEM184A وغشاء طوبولوجيا. إما ثابتة GFP-TMEM184A خلايا transfected مع PFA 4٪ (أعلى) أو ثابتة مع 4٪ PFA وpermeabilized باستخدام تريتون X-100 (القاع). كانت ملطخة خلايا متطابقة مع الأجسام المضادة الأولية لمكافحة GFP والأجسام المضادة الثانوية وصفت و Cy3. الحانات النطاق = 10 ميكرون. يتم عرض تجربتين مختلفتين. وأظهرت الثانوية الخلايا الملون فقط-في الأساس ليست تلطيخ. الرجاء انقر هنا لعرض نسخة أكبر من هذا الرقم.

pload / 55053 / movie.mp4 "الهدف =" _ فارغة "> الفيلم 1:.. لايف التصوير من GFP-TMEM184A مع رودامين-الهيبارين (انقر بزر الماوس الأيمن للتحميل) تم علاج الخلايا A7r5 كما في الشكل 2B يوضح الفيلم GFP- وترد TMEM184A والحويصلة-رودامين الهيبارين في الجزء العلوي تتحرك معا. الإصدارات اللون منفصلة بالإضافة إلى نسخة المدمجة من الفيلم، وحويصلة مع GFP وحلقت تحتوي على رودامين.
Discussion
تم تصميم بروتوكولات ذكرت هنا لتقديم أدلة مؤكدة لتحديد TMEM184A بمثابة مستقبلات الهيبارين في خلايا الأوعية الدموية 1. وتستخدم تقنيات ضربة قاضية بشكل روتيني كآلية لتأكيد تحديد البروتينات الرواية. ومع ذلك، بعض الخسائر الوظيفية بعد ضربة قاضية هي عادة ليست دليلا كافيا على أنه بروتين مرشح هو في الواقع مستقبلات الصحيح (أو البروتين وظيفية أخرى). ومن المهم أيضا أن لديها أدلة على أن البروتين المرشح المعارض في الواقع وظيفة. توظيف بناء لجين الرواية الموسومة ب GFP يمكن كسب التجارب وظيفة ويسهل عزل بروتين الموسومة على أساس تقارب GFP. Electroporation للتوظيف في هذا البروتوكول تسهيل كفاءة ترنسفكأيشن عالية جدا للبناء (أكبر من 80٪ من الخلايا أعربت بناء). ومع ذلك، وآليات ترنسفكأيشن أخرى يمكن أن تستخدم إذا Electroporation للغير متوفر أو غير المستحية. وهناك العديد من المزايا لاختيار التركيبة GFP الموسومة للتأكيد على وظيفة البروتين الرواية. أولا، يخدم GFP كمراسلة لترنسفكأيشن والتعبير الجيني ويسمح overexpression التي يتعين رصدها من خلال GFP إذا كان خط الخلية دون التعبير عن بروتين غير متوفر. ثانيا، توفر علامة GFP أداة لتنقية البروتين الذي لا يعتمد على أي يجند تقارب أو الأجسام المضادة ضد الببتيدات. ثالثا، توفر علامة GFP أداة لدراسة توطين مناعي معقد تصور باستخدام الأجسام المضادة الناتجة ضد الببتيدات فريدة من نوعها في تسلسل البروتين المستهدف لتحديد ما إذا كان يتم ترجمة الجين المنتج الفعلي بالمثل.
ويجري استخدام كسب المقايسات وظيفة مع بنيات الجيني لعدد من الأغراض بما في ذلك فحص الإنتاجية العالية لتحديد وظيفة البروتين رواية 13. من الناحية المثالية، فإن كسب المقايسات وظيفة توظيف مدروسة ليثيوم الخلية المستنسخةشمال شرق لا تعبر عن الجينات في السؤال (الخلايا يجب أن لا يزال تعبير عن التعاون المنتجات الجينات التي تسمح ظيفة الجين المعبر عنها حديثا). عند استخدام بناء محددة GFP الموسومة كما في المقايسات الحالية، فمن الأهمية بمكان أن استخدام الخلايا التي في GFP البروتين يمكن أن تعمل. وهكذا، واختيار الخلايا يعتمد على وظيفة، وعلى الأرجح، على نوع من الخلايا التي تكون وظيفة سوف يحدث عادة لتأمين البروتينات التعاون موجودة. GFP العنونة تسمح وسيلة إضافية من وظيفة الرصد في الحالة التي يكون فيها مضان من البروتين GFP الموسومة يمكن اتباعها كجزء من فحص وظيفي (على سبيل المثال، انظر الشكلين 2 و 3). واحد من شأنه الحد من هذه الدراسات أن إذا GFP يغير بطريقة ما وظيفة البروتين. من خلال ربط GFP لمحطة سي من البروتين، وبالفعل تمت دراسة أعداد كبيرة من البروتينات دون تغيير وظيفي واضح، ولكن لا يوجد مثل هذا الاحتمال.
Radioisotopicaوغالبا ما تستخدم بروابط المسمى LLY لدراسة يجند ملزمة لخلايا سليمة (11). ومع ذلك، فإن هذه المقايسات لا تسمح تقرير بسيط عن الموقع يجند بعد ملزم، كما أنها لا تسهل مقارنات يجند ومستقبلات معا في هذا التقرير. ويوفر بناء GFP أيضا مزيدا من الفرص لفحص بروتين الغشاء وصفت بانها هنا. نظرا للموقع C-محطة للعلامة GFP، فمن الممكن لدراسة الموقع من علامة GFP في الخلايا transfected في جميع أنحاء مقايسة. المناعي باستخدام أجسام مضادة لGFP يسمح مقارنة GFP الوصول إلى الأجسام المضادة مع وبدون permeabilization (الشكل 5). تطبيقات إضافية من GFP-TMEM184A الاستفادة من التصوير GFP مثل colocalization مع رودامين-الهيبارين (الشكل 2). توظيف الحنق للسماح الانبعاثات من GFP لإثارة رودامين-الهيبارين كما هو مبين في 2C يوفر طريقة مثيرة للاهتمام لتقييم هيئة تنظيم الاتصالات ملزمة والخلاياfficking. وعلاوة على ذلك، الحنق وتشير البيانات التي GFP هي قريبة بما فيه الكفاية (في غضون 10 نانومتر) إلى رودامين يجند لنقل الإثارة. دليل على أن هذا النقل من GFP لأعمال يجند وقد نشرت لهرمون الغدة الدرقية ذات الكلمات الدلالية مع ميثيل-رودامين 14. التكنولوجيا البديلة الحنق (الصورة تبيض و / أو أنماط التصوير يحركها الحاسوب) ويمكن أيضا أن تستخدم لتحليل أكثر تعقيدا مما يظهر هنا كمثال. وبالمثل، تفاعلات البروتينات الأخرى مع المرشح قد درست باستخدام الحنق مع به الفلورسنت الأمثل لالحنق كما هو الحال في نظام EGFP / mCherry ذكرت Albertazzi وآخرون. 15 وCFP / YFP وGFP أزواج المستخدمة في الدراسات قناة البوتاسيوم وانغ وزملاؤه 16. ويجري تصميم العديد من الجزيئات الجديدة الفلورسنت الصغيرة، على سبيل المثال 17. وهذه الجزيئات زيادة عدد الحالات التي الحنق التفاعلات بين البروتينات الموسومة GFP وويمكن فحص بروابط luorescent. الدراسات المستقبلية ويمكن أيضا أن تنطوي على تغييرات في الجينات المستهدفة، والسماح للبناء للمساعدة في تحديد تسلسل جوانب محددة من وظيفة الجين. واحد الحد للبروتينات غشاء GFP الموسومة هو عندما C-محطة من البروتين هي عادة في الداخل. في مثل هذه الحالات، الحنق المقايسات مع بروابط للذوبان في الماء الفلورسنت قد لا يكون ممكنا. ومع ذلك، وآليات بديلة لوضع GFP في أي مكان آخر في بناء قد يكون لا يزال من الممكن لبعض هذه البروتينات، ويمكن أن لا يزال بالإمكان استخدام فحوصات أخرى ذكرت هنا.
بالإضافة إلى وظيفة، التعريب، وفي الجسم الحي التفاعلات يجند، وهو بروتين GFP الموسومة يمكن عزل استخدام أجسام مضادة لمكافحة GFP والبروتين معزولة تستخدم لدراسة وظيفة توظيف في فحوصات المختبر حيث يسمح GFP عزلة مشاركات من البروتين و عنصر تحكم معزولة نسبيا (GFP مجاني). يمكن سويا هذه المقايسات تقدم دليلا اضافيا وقويا اللازمة لإثبات عشرفي وظائف البروتين مرشح كما افترض.
وعلاوة على ذلك، لأن GFP مقاومة ما لم تعدل مع المواقع التي تمتد بعيدا عن هيكل مدمج 18 الأنزيم البروتيني، محدودة العلاج البروتيني للخلايا أن تفرج GFP خارج الخلية. أن يحدث انشقاق الأنزيم البروتيني في البروتين الذي GFP تعلق أو في منطقة الربط تصميم. ان المنتجات التي تم إصدارها ستكون GFP مع ملحق N-محطة لتسلسل GFP. يجب التربسين عدم الإفراج عن GFP إذا كانت محطة سي من البروتين الذي GFP يرد هو داخل الخلايا. تحليل أولي للمنتجات المحتملة يمكن أن تشير إلى نمط الوزن الجزيئي واضح مع بروتين GFP الموسومة الصادرة عن التربسين. بالنسبة لكثير من البروتينات الغشاء، فإن هذه الأساليب تؤدي إلى دليل واضح للطوبولوجيا الغشاء الإفراج عن GFP، أو عدم وجودها.
معا، وفحوصات معينة قدمت و / أو المقترحة في هذا التقرير تقديم عينة واسعة من التقنيات رقبعة يمكن استخدامها لدراسة البروتينات الرواية التي كتبها بدءا من بناء الموسومة fluorescently. هذه التركيبات يمكن الحصول عليها بسهولة تجاريا. الفرصة لاستخدامها لمجموعة واسعة من التقنيات يجعلها مجدية اقتصاديا لحتى معامل صغيرة على الميزانيات المحدودة.
Disclosures
الكتاب ليس لديهم ما يكشف.
Acknowledgements
Research in the Lowe-Krentz lab is supported by research grant HL54269 from the National Institutes of Health to LLK.
Materials
| Name | Company | Catalog Number | Comments |
| GFP-TMEM184A construct | OriGene | RG213192 | |
| Rhodamine-Heparin | Creative PEGWorks | HP-204 | Light Sensitive |
| Fluorescein-Heparin | Creative PEGWorks | HP-201 | Light Sensitive |
| Mowiol | EMD Millipore | 475904-100GM | |
| Paraformaldehyde (PFA, methanol free) | Thermo Sci Pierce Biotech, available through Fisher Scientific | PI28908 at Fisher | Use in Fume Hood |
| Reacti-bind neutravidin plates (Avidin coated black 96-well dishes) | Thermo Sci Pierce Biotech, through Fisher Scientific | PI15510 at Fisher | Pay attention to shelf-life |
| Black 96-well plates | Corning Life Sciences Plastic, purchased through Fisher Scientific | 064432 at Fisher | |
| A7r5 vascular smooth muscle cell line | ATCC | CRL 1444 | Can be exchanged into MEM medium1 |
| BAOEC bovine aortic endothelial cells | Cell Applications, Inc. | B304-05 | Culture as recommended initially, can be exchanged into MEM medium for continuing culture1,7 |
| BAOSMC bovine aortic smooth muscle cells | Cell Applications, Inc. | B354-05 | Culture as recommended initially, can be exchanged into MEM medium for continuing culture1 |
| RAOEC rat aortic endothelial cells | Cell Applications, Inc. | R304-05a | Culture as recommended initially, can be exchanged into MEM medium for continuing culture7 |
| Biotinylated anti-GFP | Thermo Sci Pierce Biotech, through Fisher Scientific | MA5-15256-BTIN | |
| Streptavidin-coated beads | Sigma | S1638 | |
| HeBS | Available from Bio-Rad | Can be prepared in the lab. The pH is 6.8 | |
| TMEM184A antibody to the N-terminus | Santa Cruz Biotechnology | sc292006 | Only known TMEM184A antibody to N-terminal region. |
| TMEM184A antibody to the C-terminus | Obtained from ProSci Inc, Poway, CA | Pro Sci 5681 | ProSci used in Figure 1 |
| GFP antibodies | Santa Cruz Biotechnology | sc9996 | Used in Figure 5 |
| Secondary antibodies, labeled with TRITC or Cy3 | Jackson ImmunoResearch Laboratories, Inc, West Grove, PA | 711 025 152 (donkey anti-rabbit, TRITC) 715 165 150 (donkey anti-mouse, Cy3) | Minimal cross-reactivity to minimize any nonspecific staining. |
| CHAPS | Purchased from Sigma | C5849 | Note that this specific catalog number has been discontinued. Supplier will provide information regarding replacement. |
| Live imaging 35-mm dishes | MatTek (Ashland MA) | P35G-1.0 – 20 mm - C | |
| Confocal Microscope | Zeiss | LSM 510 Meta with a 63X oil-immersion lens | Used for images and live-imaging in Figures 1, 2 and 3 |
| Confocal Microscope | Nikon | C2+ confocal with a 60X oil-immersion lens | Used for images in Figure 5 |
| Confocal Microscope | Zeiss | Zeiss LSM 880 with a 63X oil-immersion lens | Used for images in Figure 2C |
| Electroporation equipment | Bio-Rad | Gene Pulser X-Cell System | |
| Electroporation cuvettes | Available from MidSci | EC2L | Can also be obtained from equipment supplier |
| Plate reader | TECAN | TECAN Infinite® m200 Pro plate reader | Readings in the middle of the wells rather than at the surface. |
| Computer program for measuring staining intensity | Image J | https://imagej.nih.gov/ij/ Program and information available on-line | Any appropriate program can be used. See https://theolb.readthedocs.io/en/latest/imaging/measuring-cell-fluorescence-using-imagej.html for additional detail |
| Cell Culture trypsin solution | Sigma | T4174 | purchased as a 10x solution |
References
- Pugh, R. J., et al. Transmembrane Protein 184A Is a Receptor Required for Vascular Smooth Muscle Cell Responses to Heparin. J Biol Chem. 291, 5326-5341 (2016).
- Daher, W., et al. Identification of Toxoplasma TgPH1, a pleckstrin homology domain-containing protein that binds to the phosphoinositide PI(3,5)P. Mol Biochem Parasitol. , (2016).
- Vit, O., et al. Large-scale identification of membrane proteins based on analysis of trypsin-protected transmembrane segments. J Proteomics. , (2016).
- Attwood, M. M., et al. Topology based identification and comprehensive classification of four-transmembrane helix containing proteins (4TMs) in the human genome. BMC genomics. 17, 268(2016).
- Zou, Z., et al. Genome-Wide Identification of Jatropha curcas Aquaporin Genes and the Comparative Analysis Provides Insights into the Gene Family Expansion and Evolution in Hevea brasiliensis. Front Plant Sci. 7, 395(2016).
- Gilotti, A. C., et al. Heparin responses in vascular smooth muscle cells involve cGMP-dependent protein kinase (PKG). J Cell Physiol. 229, 2142-2152 (2014).
- Farwell, S. L., et al. Heparin Decreases in Tumor Necrosis Factor alpha (TNFalpha)-induced Endothelial Stress Responses Require Transmembrane Protein 184A and Induction of Dual Specificity Phosphatase 1. J Biol Chem. 291, 5342-5354 (2016).
- Xu, D., Esko, J. D. Demystifying heparan sulfate-protein interactions. Annu Rev Biochem. 83, 129-157 (2014).
- Chiodelli, P., Bugatti, A., Urbinati, C., Rusnati, M. Heparin/Heparan sulfate proteoglycans glycomic interactome in angiogenesis: biological implications and therapeutical use. Molecules. 20, 6342-6388 (2015).
- Slee, J. B., Lowe-Krentz, L. J. Actin realignment and cofilin regulation are essential for barrier integrity during shear stress. J Cell Biochem. 114, 782-795 (2013).
- Patton, W. A., et al. Identification of a heparin-binding protein using monoclonal antibodies that block heparin binding to porcine aortic endothelial cells. The Biochemical journal. 311, Pt 2 461-469 (1995).
- Doggett, T. M., Breslin, J. W. Study of the actin cytoskeleton in live endothelial cells expressing GFP-actin. J Vis Exp. , (2011).
- Skalamera, D., et al. Generation of a genome scale lentiviral vector library for EF1alpha promoter-driven expression of human ORFs and identification of human genes affecting viral titer. PloS one. 7, 51733(2012).
- Castro, M., Nikolaev, V. O., Palm, D., Lohse, M. J., Vilardaga, J. P. Turn-on switch in parathyroid hormone receptor by a two-step parathyroid hormone binding mechanism. Proc Natl Acad Sci U S A. 102, 16084-16089 (2005).
- Albertazzi, L., Arosio, D., Marchetti, L., Ricci, F., Beltram, F. Quantitative FRET analysis with the EGFP-mCherry fluorescent protein pair. Photochem Photobiol. 85, 287-297 (2009).
- Wang, S., et al. Domain organization of the ATP-sensitive potassium channel complex examined by fluorescence resonance energy transfer. J Biol Chem. 288, 4378-4388 (2013).
- Christiansen, E., Hudson, B. D., Hansen, A. H., Milligan, G., Ulven, T. Development and Characterization of a Potent Free Fatty Acid Receptor 1 (FFA1) Fluorescent Tracer. J Med Chem. 59, 4849-4858 (2016).
- Chiang, C. F., Okou, D. T., Griffin, T. B., Verret, C. R., Green Williams, M. N. fluorescent protein rendered susceptible to proteolysis: positions for protease-sensitive insertions. Arch Biochem Biophys. 394, 229-235 (2001).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved