Method Article
Utilizzando un TMEM184A GFP-tagged Construct per la conferma della Eparina Receptor Identità
In questo articolo
Riepilogo
Un TMEM184A codifica costrutto con un tag GFP al carbossi-terminale progettato per l'espressione eucariotica, è stato impiegato in saggi progettati per confermare l'identificazione di TMEM184A come recettore eparina in cellule vascolari.
Abstract
Quando nuove proteine vengono identificati attraverso l'isolamento e la bioinformatica market basket analysis-based, sono spesso in gran parte indefinita. Gli anticorpi contro peptidi specifici all'interno della sequenza prevista consentono alcuni esperimenti di localizzazione. Tuttavia, spesso non possono essere escluse altre interazioni possibili con gli anticorpi. Questa situazione ha offerto l'opportunità di sviluppare una serie di saggi dipendenti dalla sequenza della proteina. In particolare, un costrutto contenente la sequenza genica accoppiato alla sequenza codificante GFP all'estremità C-terminale della proteina è stata ottenuta e utilizzata per questi scopi. Gli esperimenti per caratterizzare la localizzazione, ligando di affinità, e guadagno di funzione sono stati originariamente progettati e realizzati per confermare l'identificazione di TMEM184A come recettore eparina 1. Inoltre, il costrutto può essere impiegato per studi che riguardano domande topologia di membrana e le interazioni proteina-ligando dettagliate. La presente relazione presenta arange di protocolli sperimentali basati sul costrutto GFP-TMEM184A espresso in cellule vascolari che potrebbe essere facilmente adattato per altre nuove proteine.
Introduzione
L'identificazione di proteine candidate per le funzioni nuove, spesso dipende da protocolli di isolamento di affinità basata seguita da determinazione sequenza parziale. Esempi recenti di nuove proteine identificate sono proteine transmembrana 184A (TMEM184A), un recettore eparina identificato dopo interazioni eparina affinità 1, e TgPH1, una proteina dominio pleckstrin omologia che lega phosphoinositide PI (3,5) P2 2. Altro novel identificazione delle proteine attraverso analisi di sequenza diretta dei peptidi come quello di Vit, et al. che ha usato peptidi transmembrana per identificare i prodotti proteici da geni precedentemente non caratterizzate 3. Allo stesso modo, l'identificazione di nuove sequenze di proteine può essere realizzato utilizzando la bioinformatica alla ricerca di famiglie di proteine precedentemente caratterizzati come l'identificazione di nuove proteine 4TM 4. L'esame delle sequenze di geni della famiglia aquaporin ha alcosì ceduto l'identificazione di nuovi membri caratterizzati da nuove funzioni 5. Dopo l'identificazione, l'analisi della funzione della proteina è tipicamente un passo successivo, che a volte può essere esaminato utilizzando un dosaggio specifico della funzione proteica come nel caso aquaporin.
Quando possibile, la funzione di una proteina di recente identificazione può essere esaminato con particolare enzimatici o simili saggi funzionali in vitro. Poiché molte funzioni delle nuove proteine dipendono complesse interazioni che si verificano solo in cellule intatte o organismi, in vitro non sono sempre efficaci. Tuttavia, i saggi in vivo devono essere progettati in modo tale che essi dipendono dalla sequenza del gene. In coltura cellulare, e / o organismi modello semplici, atterramento in grado di fornire elementi di prova per l'identificazione delle proteine / funzione 6. Con nuove proteine identificate come notato sopra, è spesso insufficiente a battere semplicemente verso il basso una proteina per confermare la funzione, und progettazione di saggi in vivo funzionali che dipendono sequenza genetica diventa importante per la caratterizzazione di nuove proteine.
La recente individuazione di TMEM184A come recettore eparina (che modula la proliferazione in muscolatura liscia vascolare e le risposte infiammatorie nelle cellule endoteliali) mediante cromatografia di affinità e MALDI MS 1, 7 fornito l'opportunità di sviluppare una collezione di saggi dopo atterramento prodotto risultati coerenti con l'identificazione . Una recente revisione ha confermato che l'eparina interagisce specificamente con molti fattori di crescita, i loro recettori, i componenti della matrice extracellulare, recettori di adesione cellulare, e altre proteine 8. Nel sistema vascolare, eparina e proteoglicani eparan solfato (contenente catene eparan solfato di struttura simile a eparina) interagire con diverse centinaia di proteine 9. Per confermare funzionalmente that TMEM184A è stato coinvolto con l'eparina assorbimento e vincolante, sono state sviluppate tecniche che hanno impiegato il costrutto gene per TMEM184A. La presente relazione comprende una raccolta di saggi sulla base di un GFP-TMEM184A costrutto per l'uso nel confermare l'identità di TMEM184A come recettore eparina.
Protocollo
1. Progettazione di un costrutto GFP-proteina
- Acquisto, o la progettazione e costruzione, un costrutto GFP-tagged basato sulla proteina in questione.
NOTA: Per un costrutto acquistato, vettori standard sono disponibili dai laboratori commerciali che includono alcuni o tutti i seguenti suggerimenti: Per una proteina di membrana, selezionare una posizione C-terminale della GFP perché è meno probabile che interferire con il traffico di proteine di membrana. Si consideri una estensione tra il gene di interesse e la GFP se vi è ragione di credere che il C-terminale della proteina in questione è compatto piegato in un dominio della proteina. Selezionare il costrutto di espressione generale cellula eucariotica, ma consentono di costruire la produzione in sistemi batterici. Include un sito di taglio (ad esempio per la proteasi TEV) attraverso il quale GFP può essere rimosso se desiderato per alcuni esperimenti in cui la GFP potrebbe interferire con l'attività della proteina. Aggiungere altri inserti, come un tag aggiuntivo per la localizzazione o di affinità ininterazioni (ad esempio, His6). Questo non era necessario per i saggi descritti qui, ma potrebbe facilitare altri saggi, o essere utile direttamente adiacente al gene, prima della GFP, se la rimozione di GFP è desiderato.
2. Espressione GFP-TMEM184A in cellule vascolari
- Endoteliali cultura o cellule muscolari lisce vascolari su 0,2% ricoperto di gelatina piatti di coltura tissutale come riportato in precedenza 1, 6, 7.
- Aggiungere 5 soluzione di coltura cellulare tripsina mL (0,5% w / v) ad un risciacquato 100 mm, o maggiore, confluenti piatto di cellule. Incubare a 37 ° C finché le cellule sono appena rilasciato dalla piastra, e trasferire le cellule in una provetta di polipropilene da centrifuga sterile.
- Aggiungere un inibitore della tripsina (ad esempio, un uguale volume di mezzo di coltura normale), come usato in coltura di routine, alla soluzione di cellule / tripsina per limitare l'attività tripsina. Agglomerare le cellule per 5 minuti a approximdiatamente 600 g (o la velocità adeguata e il tempo di pellet solo le cellule per coltura tissutale standard). Aspirare il surnatante.
- Risospendere le cellule in 1 ml di HeBS (Hepes-Buffered Saline) tampone elettroporazione, limitando la quantità di cellule di tempo sono nel pellet o sospensione. Posizionare la sospensione cellulare su ghiaccio ed effettuare passaggi rimanenti sul ghiaccio.
NOTA: pellet può essere lavato una volta con HeBS prima di risospensione. - Aggiungere un volume sufficiente di GFP-tagged TMEM184A plasmide alle cellule per ottenere una concentrazione finale di 20 mg / mL di DNA. Utilizzare un protocollo identico per un costrutto GFP.
- Posizionare circa 0,4 mL della soluzione di cellule in HeBS in una cuvetta elettroporazione. Pre-raffreddare le cuvette prima dell'uso.
- L'elettroporazione di cellule utilizzando le seguenti condizioni: decadimento esponenziale, 500 uF, ∞ Ohm, e 170 V.
NOTA: La tensione per un dato tipo di cellula deve essere ottimizzata. Studi preliminari con endoteliali e muscolari lisce celtipi l sono state realizzate con un costrutto GFP-vinculin per determinare il valore di tensione ottimale notato qui, ad esempio 10.- Per ottimizzare elettroporazione, iniziare con le raccomandazioni del produttore di apparecchiature (che includono le condizioni di alcuni tipi di cellule normali). Utilizzare il costrutto desiderato o una proteina fluorescente di controllo costruire simili per dimensioni e caratteristiche fluorescenti per il costrutto desiderato.
NOTA: Piccolo acidi nucleici sembrano entrare nelle cellule più facilmente rispetto costrutti più grandi, quindi un costrutto con soltanto una proteina fluorescente possono essere più conveniente esprimere di una più grande. - Utilizzare microscopia a fluorescenza per determinare la vitalità cellulare, la percentuale di cellule in cui il costrutto fluorescente viene espresso dopo 24 e 48 ore, e l'intensità di espressione.
NOTA: Diminuire la tensione e / o tempo leggermente se la sopravvivenza è bassa. Obiettivo per il minor tempo possibile tra liberazione delle cellule dalla superficie coltura e ritornole cellule alla cultura per favorire la sopravvivenza. Lievi aumenti nel tempo o un secondo impulso possono migliorare l'assorbimento costrutto se la sopravvivenza è alta e l'espressione è basso. condizioni ottimali e di espressione varieranno tra i tipi di cellule. Se la percentuale di cellule che esprimono il costrutto è alto, ma l'intensità è bassa, aumentando la concentrazione di DNA e il monitoraggio delle cellule trasfettate nel tempo per intensità ottimale, che varieranno basato sulla proteina emivita nonché espressione, può migliorare l'intensità. intensità di colorazione può essere ingrandita per alcuni test, se necessario, per immunofluorescenza di GFP con anticorpi anti-GFP
- Per ottimizzare elettroporazione, iniziare con le raccomandazioni del produttore di apparecchiature (che includono le condizioni di alcuni tipi di cellule normali). Utilizzare il costrutto desiderato o una proteina fluorescente di controllo costruire simili per dimensioni e caratteristiche fluorescenti per il costrutto desiderato.
- Dopo l'elettroporazione, seminare le cellule in sei pozzi di coltura di tessuti da 30 mm, con lamelle per l'imaging o in piatti di coltura di tessuti. Coltivare le cellule utilizzando le procedure standard di coltura cellulare.
- Opzionale: Sostituire il terreno di coltura dopo 24 ore per eliminare ogni tampone elettroporazione HeBS.
3. Visualizzazione di GFP-TMEM184A Localizzazione
- Lavare le cellule con PBS e un leggero scuotimento dopo coltura per almeno 24 ore. Limitare l'esposizione alla luce intensa per evitare GFP sbiadimento.
- Fissare cellule con 4% paraformaldeide (PFA) in PBS per 15 minuti a RT agitando delicatamente. Evitare l'uso di eventuali reagenti metanolo contenenti che possono permeabilize le cellule. Fissaggio con metanolo può essere utilizzato se non è necessario valutare interazioni ligando.
Attenzione: Paraformaldeide è tossico. Indossare dispositivi di protezione adeguati. Utilizzare in una cappa aspirante, con cura, e scartare correttamente. - Risciacquare con PBS come sopra. Per la colorazione anticorpi base, vedi 3.6.
- Monte coprioggetto alle diapositive utilizzando Mowiol o altro mezzo di montaggio adatto.
- Le diapositive di immagini utilizzando un microscopio confocale a fluorescenza o con gli appositi set di filtri per GFP di eccitazione e spettri di emissione. La microscopia confocale è preferito a causa della capacità di separare campioni nel piano z. Salvare le immagini in scala di grigi per quAi fini antitation in formato TIF (oltre a immagini a colori per le illustrazioni).
- Per confronto con la WT TMEM184A espressa dalle cellule, preparare altre cellule per immunofluorescenza con anticorpi primari preparati ad un peptide (s) dalla sequenza TMEM184A, ad esempio 1. Identificazione di GFP-TEMEM184A può essere eseguita utilizzando anticorpi contro GFP. Valutare sia campioni di cellule di tecniche di microscopia identici.
4. rodamina-eparina Binding e Colocalizzazione con cellule GFP-TMEM184A transfettate
- Trattare GFP-TMEM184A-cellule che esprimono con 100 mg / ml rodamina-eparina aggiunto al mezzo di coltura, e consentire alle cellule di incubare per un determinato periodo di tempo, in genere meno di 10 min per le cellule A7r5. Risciacquare e fissare come in 3.1 e 3.2.
NOTA: Il momento ottimale e la concentrazione del ligando dipende risposta cellulare, intensità di fluorescenza dell'intensità ligando e l'immagine ottenuta. Questo concentratione di eparina è stata impiegata perché comporta risposta più del 50% in altri test 11. Questa concentrazione può essere visualizzato utilizzando tecniche di microscopia a fluorescenza standard quindi non era necessario aumentarlo. La diluizione di rodamina-eparina con risultati eparina non etichettati in basso a fluorescenza nelle cellule, è quindi più difficile per l'immagine e quantificare. - Per quantificare il legame a causa di GFP-TMEM184A trasfezione rodamina-eparina, preparare cellule identiche senza trasfettate GFP-TMEM184A.
- Immagine le cellule utilizzando un microscopio confocale con la GFP appropriata (488 nm) e rodamina (543 nm) di eccitazione e di emissione (500-530 nm per la GFP e maggiore di 560 nm per rodamina) valori per determinare la co-localizzazione. Ottenere immagini di almeno 50 cellule di almeno tre esperimenti separati per ottenere le statistiche. Mantenere impostazioni identiche all'interno di esperimenti, e impiegano un campione di controllo (s) (ad esempio, cellule trasfettate con nessun trattamento) tha può essere utilizzato per standardizzare i dati per l'analisi dei diversi esperimenti.
- Esaminare le immagini utilizzando un programma per computer per determinare relativo rodamina vincolante / assorbimento in ogni cella per la quantificazione del legame.
NOTA: le immagini TIF devono essere utilizzati come sono convenienti per l'analisi e possono essere convertiti in scala di grigi, in molti programmi per computer, se non sono stati inizialmente salvati in quel formato. Immagine J (freeware) è stato impiegato nella presente analisi e permette area e intensità dei pixel da misurare per qualsiasi area definita dall'utente in un'immagine.- Utilizzare uno strumento a mano libera a cerchio una cella all'interno di una immagine a fluorescenza e utilizzare lo strumento di misura per determinare l'intensità all'interno di quello spazio.
NOTA: Queste misurazioni forniscono le informazioni necessarie per calcolare l'intensità totale per un'area definita dall'utente (cellula intera, nucleo, ecc), che fornisce un modo per confrontare le cellule diverse con diverse geometrie. Intensità media su un'area di sfondo può essere riferito, e che facilitanos raccolta di intensità bassa per l'analisi. - Esporta in un foglio di calcolo per calcolare l'area moltiplicata per l'intensità e sottrarre sfondo per la stessa quantità di area. Nella media la fluorescenza / cella per abbastanza cellule / esperimento per ottenere una significatività statistica.
- Utilizzare uno strumento a mano libera a cerchio una cella all'interno di una immagine a fluorescenza e utilizzare lo strumento di misura per determinare l'intensità all'interno di quello spazio.
5. Fluorescence Resonance Energy Transfer da GFP-TMEM184A a rodamina-eparina
- Preparare cellule trasfettate e incubare con 200 mg / ml rodamina-tag ligando come in 3.1. Si noti che il tempo di incubazione con ligando fluorescente è tipo cellulare dipendente. Fissare con solo PFA, e montare le diapositive per l'imaging.
- In primo luogo, eccitare a 405 nm e immagine per l'emissione rodamina (566-685 nm; FRET). In secondo luogo, eccitare a 488 GFP (immagine a 493-530) per, e la terza, eccitare a 561 per rodamina (immagine a 566-685). Controlli senza GFP-TMEM184A o senza rodamina-eparina sono critici.
6. live-cell imaging di rodamina-Heparin Assorbimento
- Seme della GFP-TMEM184A cellule transfettate in piatti individuali progettati per l'imaging dal vivo di cellule e trattare come al protocollo 3.
NOTA: Il numero di celle richieste dipende dal tipo di cellula e la densità desiderata. Per ridurre al minimo la quantità di tempo cellule sono in sospensione, non contano le cellule. cellule seme da un piatto confluenti 100 millimetri in sei 35 mm piatti di imaging in tempo reale per ottenere cellule nei pressi di confluenza in 48 h. - Dopo 48 h, sostituire il mezzo con terreno di coltura senza rosso fenolo.
- Trasferire un piatto di cellule ad un microscopio confocale con una fase di riscaldamento per mantenere la temperatura, e mettere a fuoco il microscopio.
- Dispensare 100 mg / ml rodamina-eparina nel piatto e mescolare delicatamente.
- iniziare immediatamente la registrazione di immagini in diretta. Se captazione cellulare di eparina avviene all'interno della regione in vista, spostare la parabola leggermente per identificare le cellule con almeno uno verde vescicola contenente l'etichetta rodamina.
NOTA: eccitazione di imaging e delle emissioni specifiche sono lacome per il protocollo eparina assorbimento (punto 5). Il periodo di tempo tra le immagini è stato di circa 16 s. Le condizioni dell'esperimento e il microscopio tipicamente determinare la velocità a cui le immagini possono essere ottenuti.
7. Isolamento di GFP-TMEM184A e GFP da cellule in coltura
- Dopo aver rimosso terreno di coltura e risciacquo con PBS, aggiungere 2 mL 0,2% (w / v) CHAPS PBS 1x con inibitori della proteasi ad una piastra 150 mm di cellule esprimenti GFP-TMEM184A o GFP (per controllo saggi di binding). Raschiare le cellule dal piatto, posizionare la soluzione cellule / Chaps in una provetta da 15 polipropilene sul ghiaccio, e mescolare bene toccando. Completare tutte le fasi di luce per garantire il tag GFP è sbiancato per il saggio di legame qui di seguito.
- Per legare specificamente GFP-TMEM184A (o un controllo adeguato GFP), aggiungere 2 mg / mL biotinilato anticorpo anti-GFP alla soluzione e incubare una notte a 4 ° C con dondolo.
- Aggiungere 500 microlitridi perline streptavidina-agarosio ad almeno 5 ml 0,2% CHAPS / PBS e centrifugare a circa 600 xg per 3 a 5 min. Rimuovere il surnatante. Ripetere altre due volte con CHAPS fresco / PBS ogni volta. Aggiungere perline per la soluzione di anticorpi e cellule e incubare una notte a 4 ° C con dondolo per consentire alle sfere di legarsi agli anticorpi anti-GFP biotinilato legato alla GFP o GFP-TMEM184A.
- Pellet le perline per centrifugazione (come in 7.3) e rimuovere il materiale non legato. Aggiungere inibitori almeno 5 mL 0,2% CHAPS / PBS / proteasi da lavare. Ripetere il lavaggio e centrifugazione almeno 3x per rimuovere efficacemente qualsiasi proteina non legata.
- Dopo aver rimosso l'ultimo lavaggio, incubare le perline con 1 ml di 0,2 M glicina / 0,2% CHAPS in PBS (pH a 2,0 utilizzando HCl) in ghiaccio per 3 minuti a dissociarsi vincolante l'anticorpo-GFP (con conseguente libera GFP-TMEM184A o libero GFP). Mescolare delicatamente toccando ogni 30 s.
- Centrifugare a circa 600 xg e trasferire il surnatante contenente il p purificatorotein ad un nuovo tubo 15 ml seguito da neutralizzazione immediato con 5 ml di 1 M bicarbonato di sodio (portare il pH a 7).
- Concentrare il campione utilizzando un 10.000 Dalton peso molecolare di cut-off concentratore centrifugo (impiegare velocità di centrifugazione raccomandata dal fornitore). Quando il volume raggiunge circa 0,5 ml, aggiungere 0,2% CHAPS / PBS. Continua concentrazione e aggiungendo più 0,2% CHAPS / PBS fino / PBS sono stati aggiunti almeno dieci volumi (volte il volume del campione di partenza) della CHAPS 0,2%.
- Per determinare una stima della quantità di GFP isolata o proteina GFP-tag, avere un'assorbanza a 280 nm e confrontarlo con una curva standard preparata da sieroalbumina bovina o altre proteine di controllo nello stesso tampone.
NOTA: A causa delle differenze del coefficiente di estinzione, questa concentrazione è una stima, ma può fornire una concentrazione approssimativa di proteine per facilitare ulteriore analisi senza sprecare campione. la concentrazione di proteine accurata può essere dissuadereestratto utilizzando un saggio proteico micro-Lowry assicurandosi per preparare la proteina normale nello stesso tampone per il campione. Ulteriori analisi della proteina isolata può essere realizzata mediante western blotting della proteina isolata (utilizzando l'individuazione di anticorpi per GFP) e rispetto al peso molecolare previsto. In alternativa, l'uso degli anticorpi TMEM184A dovrebbe comportare una banda della dimensione costrutto previsto, ma potrebbe anche comportare una banda WT TMEM184A se sono presenti nel campione dimeri (o oligomeri di ordine superiore). Una stima della purezza può essere ottenuto colorando un blot per proteine totali dal campione isolato vs proteine totali da un'aliquota del materiale di partenza.
8. In Vitro Eparina Binding Assay
- Preparare una piastra a 96 pozzetti nero avidina rivestita mediante lavaggio con 200 ml 0,2% CHAPS / PBS tre volte per 5 minuti con agitazione. Preparare un nero noncoated piastra a 96 pozzetti identici utilizzando la stessa procedura di lavaggio. Preparare unlayout per i campioni sperimentali (in triplice copia) per seguire durante il dosaggio. Include pozzi per concentrazioni standard di eparina, controlli tampone, e pozzi con campioni GFP senza eparina per confermare lo sbiancamento della GFP.
NOTA: Se l'isolamento o interazione ligando buffer ottimizzati sono diversi per la proteina in questione, fare tutte le preparazioni di piastra e lavaggio con il sistema tampone ottimale. - Aggiungere 100 ml di 60 pmol / ben biotinilato anti-GFP a tutti i pozzetti della piastra rivestita avidina dove GFP legame è desiderato. La quantità di anticorpo è sufficiente a saturare solo l'avidina alta affinità nei pozzetti.
- Aggiungere tampone solo per tutti i pozzetti utilizzati per il controllo (senza GFP o GFP-TMEM184A rilegatura desiderato). Sigillare i pozzetti con un coperchio piatto per evitare l'evaporazione. Incubare per 2 ore a temperatura ambiente, con agitazione.
NOTA: I volumi aggiunti a pozzi e tempi di incubazione sono basate sulle raccomandazioni del fornitore.
- Aggiungere tampone solo per tutti i pozzetti utilizzati per il controllo (senza GFP o GFP-TMEM184A rilegatura desiderato). Sigillare i pozzetti con un coperchio piatto per evitare l'evaporazione. Incubare per 2 ore a temperatura ambiente, con agitazione.
- Lavare tutti i pozzetti tre volteper 5 min con 200 ml 0,2% CHAPS / PBS.
- Aggiungere 100 ml di 5 nmol / ben GFP-TMEM184A o GFP nei relativi pozzetti nella piastra di avidina rivestita e incubare per 1 ora a temperatura ambiente con agitazione. Lavare nuovamente come in 8.3.
NOTA: Questa concentrazione di proteine è stato scelto per garantire che tutti i siti sono stati saturati con un eccesso di GFP o GFP-TMEM184A. Questo è importante per garantire che la stessa quantità di proteina è legato a ciascun pozzetto. Minori quantità di proteine potrebbe anche saturare tutti i siti, una possibilità che potrebbe essere esaminata valutando la proteina non legata residua dopo incubazione diverse concentrazioni di proteine con la piastra e il confronto di proteine non legato e ligando saggi vincolante. - Preparare varie concentrazioni di eparina marcato con fluoresceina, per esempio, 10, 25, 50, 75, 100, 200 mg / ml, in 0,2% CHAPS / PBS. Fare questo e tutti i restanti lavori nel buio.
NOTA: Prima di preparare le concentrazioni, le concentrazioni specifiche per altri ligandi devono essere determinati per la Protein target in questione. La concentrazione più bassa dovrebbe essere rilevabile nel lettore di piastre. Pertanto è importante determinare prima l'intervallo che può essere rilevato con precisione nel sistema tampone impiegato. Quindi determinare la gamma necessaria per ottenere misurabile vincolante. Le concentrazioni di fluoresceina-eparina inferiore a 10 mg / ml non sempre registrano nel lettore di piastre nelle condizioni di buffer impiegate. Analogamente, mentre rodamina-eparina come utilizzato negli altri test, potrebbe essere visualizzato nel lettore di piastre, nelle condizioni di buffer e alle concentrazioni richieste per la rilegatura, le letture di fluorescenza per le norme non erano riproducibile differente con quella fluoroforo. - Aggiungere 100 ml di fluoresceina eparina a opportuni pozzetti nei pozzetti della piastra e degli standard concentrazione avidina rivestite in entrambe le avidina rivestite e la piastra non rivestito. Incubare per 10 minuti a temperatura ambiente con agitazione. Conservare le piastre al buio (o foglio coperto).
- Utilizzando un piatto reader, registrare l'emissione di fluorescenza iniziale dal eparina nei pozzetti di controllo di entrambe le piastre e la fluorescenza iniziale di emissione (totale) da pozzi con immobilizzata GFP-TMEM184A o GFP nella piastra avidina-rivestita. Se necessario, regolare il guadagno dello strumento per garantire l'individuazione di eparina a fluorescenza tra il più basso e più alte concentrazioni.
NOTA: Accertarsi che il lettore di piastre legge pozzi dall'alto e legge presso la posizione ottimale nei pozzi se questo è regolabile. Per lo studio in questione, la posizione ottimale era circa il 75% rispetto ai pozzetti. Le informazioni disponibili con il lettore di piastre dovrebbe fornire suggerimenti che sono unici per il lettore di piastre in questione per la lettura di saggi di campione legato a piastre nere. - Rimuovere eparina fluorescente non legato da pozzi con immobilizzato GFP-TMEM184A o GFP e il luogo in pozzetti corrispondenti della piastra non rivestiti nero. Leggere immediatamente l'emissione di fluorescenza.
- Aggiungere 100 microlitri freschi 0,2% CHAPS / PBS indietro into pozzi da cui la fluoresceina-eparina è stato rimosso, e leggere emissione di fluorescenza.
- Ripetere i passaggi 8,8-8,9 3x.
NOTA: Queste letture dalla piastra rivestita indicano eparina fluoresceina rimanendo nei pozzi GFP o GFP-TMEM184A. Se la fluorescenza significativa si trova nel terzo campione non legato, dovrebbe verificarsi un lavaggio supplementare. Se la fluorescenza continua ad essere rimosso in ogni lavaggio, legame del ligando potrebbe essere bassa affinità, e le condizioni dovrebbero essere rivalutato. La lettura finale costituisce la lettura eparina legato. - Record emissione di fluorescenza dalle rimosse, non legato, campioni nel piatto noncoated, ottenendo numeri per ogni lavaggio. Queste sono le letture "Unbound".
- Utilizzare i valori totali delle emissioni di eparina ottenuti in 8.7 per confermare i corretti livelli di eparina aggiunta ad ogni pozzetto. Sottrarre letture medie di fondo dai valori.
NOTA: Wells senza fluoresceina eparina servire come sfondo a causa di anticorpi, GFP e di buffer. average lo sfondo ripete per ottenere il valore di fondo. Sottrarre sfondo medie letture letture legati e non legati per ottenere i valori reali. - Impiegare un terreno di emissioni rispetto al totale fluoresceina eparina aggiunto per determinare la scala delle emissioni rispetto a quantità di eparina.
NOTA: solo anticorpo, o anticorpi e antigeni portato ad alcuni quenching della fluorescenza. Pertanto, l'eparina totale è stato determinato sulla base della eparina aggiunto totale, come ha osservato in 8.7. - Tracciare la eparina legata corretto rispetto al eparina aggiunto per i triplice copia in entrambi caso GFP-TMEM184A e il caso GFP.
- Determinare ligando aggiungendo le letture non legato da tutti i lavaggi per una concentrazione specifica.
Risultati
Mentre, in teoria, trasfezione di DNA qualsiasi costrutto in cellule potrebbe essere realizzato con i reagenti di trasfezione lipofili, relazioni precedenti indicano più efficace trasfezione di GFP costrutti in cellule endoteliali mediante elettroporazione 12. Il protocollo fornito qui realizzato tipicamente GFP-costrutto di espressione in più del 80% delle cellule endoteliali primarie derivate e cellule muscolari lisce utilizzati. Progettazione del costrutto impiegato utilizzato un sistema disponibile in commercio in grado di fornire rapidamente questo costrutto. Il principale destinazione d'uso è stata focalizzata su questioni di localizzazione, quindi, corretta consegna alla membrana, insieme con l'espressione della proteina eucariotica ottimale e la produzione costrutto continuato erano considerazioni principali. Altre considerazioni potrebbero includere: diversa posizione della GFP per proteine diversamente localizzate o proteine con C-terminale che è parte di una regione piegata, la possibilità di wanting per rimuovere la GFP (aggiunta di un sito di scissione della proteasi), e un sito affinità secondario. Quest'ultima fornire modi alternativi di purificazione del costrutto GFP e stabilizzante su una superficie per il saggio di legame. Per confermare pattern di colorazione per i diversi anticorpi commerciali contro TMEM184A, cellule vascolari che esprimono GFP-TMEM184A sono stati confrontati con cellule identiche colorate con gli anticorpi commerciali. La lunghezza di tempo dopo impatti transfezione distribuzione di GFP-TMEM184A, che sembrava accumulare su almeno 72 h. Il periodo di tempo dopo la trasfezione con conseguente espressione ottimale varia dal tipo di cellula e dovrebbe essere ottimizzato per ogni tecnica. Nel corso del tempo, più etichette GFP era nella regione peri-nucleare. A seconda della manipolazione, GFP sbiancamento anche verificato. I risultati hanno indicato GFP-TMEM184A sulla superficie cellulare e in strutture vescicola peri-nucleari e altri simili localizzazioni osservate con TMEM184A colorazione anticorpale (figura 1). Le cellule primarie in Figura 1 sono stati ripresi 24 ore dopo la trasfezione, mentre le cellule A7r5 clonate sono state ripreso 48 ore dopo la trasfezione. La decisione di fissare le cellule GFP transfettate è stato fatto per assicurare che tutte le cellule sono state trattate in modo identico a confrontare la localizzazione. Fissazione probabilmente ridotta superficie cellulare emissione di fluorescenza GFP in una certa misura. Il pattern di colorazione di GFP appariva più simile a quella di anticorpi contro un peptide C-terminale, un risultato logico dato che la GFP è al C-terminale della proteina. Colorazione con un anticorpo diretto contro un peptide nella regione N-terminale era simile, ma sembrava leggermente più concentrata nella regione peri-nucleare. apparenti differenze nella localizzazione con diversi anticorpi potrebbero essere dovute al legame del ligando (possibilmente vicino al C-terminale in questo caso), che potrebbe essere fissato lì e limitare l'accesso degli anticorpi. In alternativa, la N- e C- termini potrebbero essere su lati opposti della membrana. Possibilmente, nuova proteina sintetizzata sarebbe macchia più effectively con un anticorpo relative al proteine modificate traduzionalmente post-. Per confrontare la localizzazione totale GFP-TMEM184A a TMEM184A endogena, colorazione con anticorpi anti GFP fornito un quadro più preciso del totale GFP-TMEM184A che semplicemente l'imaging GFP. Immagini di anti-GFP colorazione anticorpi sono mostrati in figura 5 in cui la tecnica è stata utilizzata anche per valutare topologia membrana.
L'utilizzo di un ligando fluorescente (rodamina-eparina) facilitato valutazione di co-localizzazione di ligando e recettore nel tempo, e le due etichette ha permesso di effettuare l'imaging dal vivo (Figura 2 e Film 1). Figura 2C è stato ripreso eccitando la GFP a 405 nm, ma la cattura delle emissioni dalla rodamina (immagini centrale). GFP eccitazione è limitata a 405 nm rendimento emissione limitata pure, ma questo ha impedito l'eccitazione di rodamina e un segnale FRET falso. Allo stesso modo, il FRET-InducEd emissione rodamina era debole. Nei controlli con l'espressione GFP-TMEM184A, ma non rodamina-eparina, e altri con solo rodamina-eparina non vi era alcuna emissione rodamina con 405 nm di eccitazione. In seguito, GFP totale (immagini a sinistra) e rodamina totale (immagini giuste) sono stati misurati utilizzando lunghezze d'onda standard di eccitazione / emissione per ogni fluoroforo. I dati in C supportano ulteriormente la co-localizzazione del legante e la GFP-TMEM184A. uptake Rhodamine-eparina in RAOEC richiesto di incubazione più lungo rispetto alle cellule A7r5. Nessuna prova per FRET è stata osservata nelle cellule senza rodamina-eparina o nelle cellule untransfected. Un esperimento ideale dovrebbe includere un'altra superficie GFP-costrutto che non dovrebbe avere alcuna co-localizzazione con il ligando.
Acquisizione o recupero della funzione potrebbe anche essere realizzato con costrutti GFP-proteici e rodamina-eparina. Questo ha fornito l'opportunità di utilizzare GFP come prova per il livello di espressione e di ligando cooperazionelocalizzazione e di quantificare le interazioni. In particolare, l'assorbimento eparina è stata aumentata a GFP-TMEM184A costrutto-transfettate cellule A7r5 (Figura 3). Cellule knockdown stabili che occupano molto limitata rodamina-eparina sono stati prodotti 1, e questi fornito un sistema in cui è stato possibile valutare guadagno di funzione. Trasfezione di GFP-TMEM184A costrutto provocato cellule che potrebbero ancora internalizzare rodamina-eparina a livello delle cellule wild-type o sopra (Figura 3). Va notato che l'immagine "no eparina" è di cellule smontabili stabili, che non esprimono GFP come reporter per il costrutto knockdown. Sfondo fluorescenza era maggiore in queste cellule, come osservato nell'immagine mostrata.
È tipicamente utile usare recettore isolato per la determinazione del ligando specificità per diminuire la probabilità di altre proteine che interagiscono con il ligando. L'uso di un GFP-Protein costrutto fornisce un vantaggio significativo in proposito il tag GFP può servire come maniglia per l'isolamento della proteina ed evita possibili interazioni di anticorpi o altri reagenti di affinità con le proteine addizionali. GFP può essere espresso anche in popolazioni di cellule identiche e isolato utilizzando la stessa procedura GFP affinità. Questo fornisce una proteina di controllo per studi di interazione ligando. Nel sistema TMEM184A, la GFP-TMEM184A isolato utilizzando una procedura di affinità anticorpale anti-GFP provocato specifico, eparina legame saturabile, mentre la GFP controllo non ha vincola gli eparina (Figura 4).
Tipicamente, i tag GFP su costrutti sono collocati ad una estremità di una proteina. La posizione C-terminale facilita il traffico di proteine corretto ad una membrana. Pertanto, la disponibilità di GFP su un particolare lato di una membrana può fornire evidenza specifica topologia di una proteina di membrana se piegatura e topologia non sonolready noto. Semplice colorazione immunofluorescenza con anticorpi contro GFP (come in figura 5) può fornire la prova della località GFP basati sull'accesso anticorpo in cellule non permeabilizzate. Gli anticorpi anti-GFP riconoscono GFP anche se sbiancato. Immunofluorescenza mostrato nella Figura 5 suggerisce significativa colorazione anti-GFP senza permeabilizzazione delle cellule GFP-TMEM184A trasfettate comprovanti preliminare che la GFP a livello della membrana plasmatica è extracellulare. Chiaramente, la proteina intracellulare in vescicole anche si dovesse macchiare nelle cellule permeabilizzate. Immagini FRET in Figura 2C sono coerenti con questa topologia proposto.

Figura 1: GFP-TEMEM184A Localizzazione in cellule conferma TMEM184A localizzazione determinato mediante immunofluorescenza. A) BAOECs trasfettate con GFP-TMEM184A sono stati fissati con il 4% PFA. cellule Nontransfected state evase con metanolo (MeOH) fixing ghiacciata e permeabilizzazione o 4% PFA seguita da Triton X-100 permeabilizzazione (come indicato). Le cellule sono state colorate nontransfected utilizzando un anticorpo contro un peptide C-terminale da TMEM184A (CTD) o un peptide N-terminale da TMEM184A (NTD) e un anticorpo anti-coniglio secondaria taggati con TRITC. B) Esempi di clonato (A7r5) e BAOSMC) cellule muscolari lisce primarie (sono stati elaborati in modo simile. Clicca qui per vedere una versione più grande di questa figura.
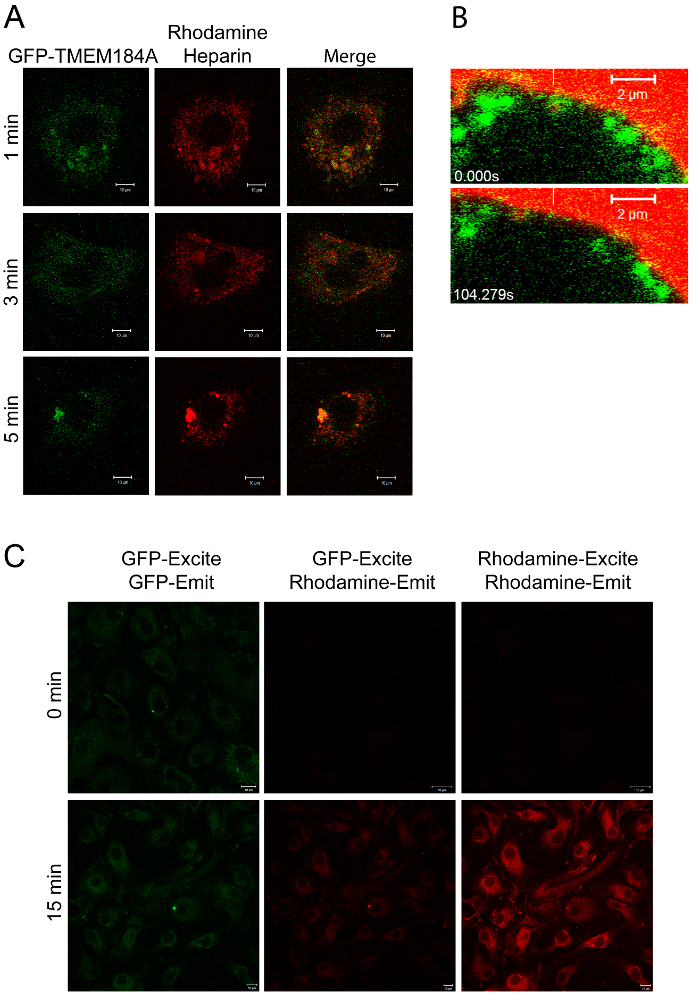
Figura 2: Imaging di GFP-TMEM184A con rodamina-eparina. A) A7r5s elettroporate con GFP-TMEM184A sono stati trattati con 100 mg / ml rodamina-eparina per lai tempi indicati e poi fissate con 4% PFA. Le immagini sono rappresentative di due esperimenti separati. B) le cellule A7r5 sono state trasfettate con GFP-TMEM184A e rodamina-eparina è stato aggiunto con immediato immagini dal vivo. fotogrammi selezionati del film sono mostrati con una barra verticale bianca che indica la localizzazione iniziale di una vescicola GFP-rivestito contenente rodamina-eparina. L'etichetta GFP e rodamina si muovono insieme. Barre di scala = 2 micron. C) RAOECs trattati come in A sono stati ripresi per la fluorescenza di risonanza di trasferimento di energia eccitando a 405 (GFP, per FRET) e confrontati con le impostazioni standard, vedere protocollo 3.5. Pannello A, ed i due punti di tempo in B, sono stati originariamente pubblicati nel Journal of Biological Chemistry. Pugh, RP, et al. 1. Copyright l'American Society for Biochimica e Biologia Molecolare. Clicca qui per view una versione più grande di questa figura.

Figura 3: GFP-TMEM184A Trasfezione Fornisce guadagno di funzione. A) significativamente più bassi livelli di rodamina-eparina sono visti nelle cellule atterramento stabili A7r5 rispetto al wild-type A7r5s, vedere immagini di esempio. L'immagine "no eparina" è di cellule smontabili stabili che esprimono GFP come marcatore della presenza costrutto. Barre di scala = 10 micron. B) La trasfezione di GFP-TMEM184A in entrambi wild-type e le cellule atterramento stabili aumenta in modo significativo il segnale di rodamina-eparina in queste cellule sulla base di analisi di più di 50 cellule / condizione in tre esperimenti indipendenti. Le barre di errore rappresentano SEM. p <0,0001 sulla base di un test di Tukey. Questo dato è stato originariamente pubblicato nel Journal of Biological Chemistry. Pugh, RP, et al. 1. Copyright l'American Society for Biochimica e Biologia Molecolare. Clicca qui per vedere una versione più grande di questa figura.
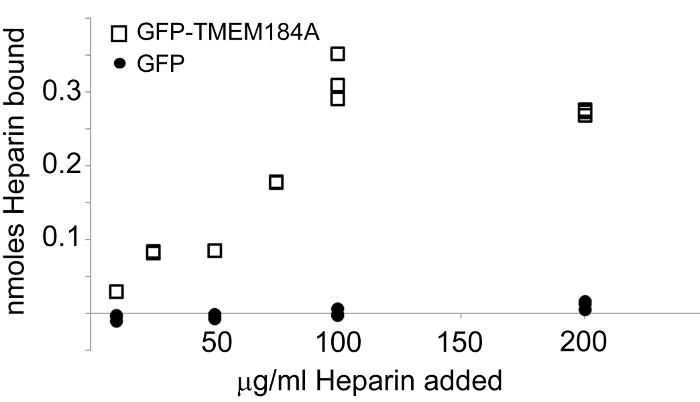
Figura 4: Isolated GFP-TMEM184A Legante eparina. GFP-TMEM184A o GFP è stato isolato e destinati a piastre saggio avidina rivestite. Fluoresceina eparina è stato aggiunto in concentrazioni da 0,056 nmol attraverso 1.111 nmol. Eparina vincolato è stata determinata misurando emissione a 519 nm. GFP-TMEM184A (quadrati). Controllo GFP (cerchi). Questo dato è stato originariamente pubblicato nel Journal of Biological Chemistry. Pugh, RP, et al. 1. Copyright l'American Society for Biochimica e Biologia Molecolare. _blank "> Clicca qui per vedere una versione più grande di questa figura.

Figura 5: GFP-TMEM184A e membrana topologia. cellule trasfettate GFP-TMEM184A erano o fissate con 4% PFA (alto) o fissate con 4% PFA e permeabilizzate con Triton X-100 (in basso). Le cellule sono state colorate in modo identico con anti-GFP anticorpi primari e anticorpi secondari Cy3-etichetta. Barre di scala = 10 micron. Due diversi esperimenti sono mostrati. Secondari celle solo-colorate hanno mostrato essenzialmente non colorazione. Clicca qui per vedere una versione più grande di questa figura.

PLOAD / 55053 / movie.mp4 "target =" _ blank "> Film 1:.. Live-imaging GFP-TMEM184A con rodamina-eparina (clic destro per il download) cellule A7r5 sono stati trattati come in Figura 2B Il film illustra la GFP TMEM184A e vescicole rodamina-eparina in alto si muovono insieme. versioni colore separati in aggiunta alla versione risultante dalla fusione del film sono mostrati. la vescicola con GFP e contenente rodamina è cerchiato.
Discussione
I protocolli qui riportati sono stati progettati per fornire la prova di conferma per l'identificazione di TMEM184A come recettore eparina in cellule vascolari 1. tecniche Knockdown sono abitualmente utilizzati come uno meccanismo per confermare l'identificazione di nuove proteine. Tuttavia, qualche perdita funzionale dopo atterramento non è tipicamente una prova sufficiente che una proteina candidato è effettivamente il recettore corretta (o altra proteina funzionale). E 'anche importante avere la prova che la proteina candidato presenta effettivamente la funzione. L'impiego di un costrutto per un nuovo gene contrassegnati con GFP permette guadagno di esperimenti di funzioni e facilita l'isolamento della proteina GFP contrassegnati sulla base di affinità. Elettroporazione impiegato in questo protocollo facilitato molto elevata efficienza di trasfezione del costrutto (superiore al 80% delle cellule esprimeva il costrutto). Tuttavia, altri meccanismi di transfezione potrebbero essere utilizzati se l'elettroporazione non è disponibile o non desiderato. Ci sono diversi vantaggi per la selezione di un costrutto GFP-tagged per la conferma di una funzione nuova proteina. Innanzitutto, la GFP serve come reporter di espressione genica e trasfezione e permette iperespressione da controllare attraverso GFP se una linea cellulare, senza espressione della proteina non è disponibile. In secondo luogo, il tag GFP fornisce uno strumento per la purificazione della proteina che non dipende né affinità legante o di anticorpi contro peptidi. In terzo luogo, il tag GFP fornisce uno strumento per esaminare la localizzazione immunofluorescenza complesso visualizzati utilizzando anticorpi generati contro peptidi unici nella sequenza proteina bersaglio per determinare se il prodotto del gene reale è simile localizzato.
Guadagno di test funzionali con costrutti genici vengono utilizzati per una serie di scopi, tra cui high-throughput screening per l'identificazione della funzione nuova proteina 13. Idealmente, il guadagno di saggi di funzione sarebbe impiegare un ben studiato clonato li cellularene che non esprime il gene in questione (le cellule devono ancora esprimere cooperare prodotti genici che permettono la funzione del gene di nuova espressione). Quando si utilizza uno specifico costrutto GFP-contrassegnati come nel presente test, è fondamentale utilizzare cellule in cui la GFP-proteina può funzionare. Così, la scelta delle cellule dipende dalla funzione e, probabilmente, dal tipo cellulare in cui la funzione si verificherebbe normalmente per assicurare proteine cooperanti sono presenti. GFP-tagging consente un ulteriore modo di funzione di controllo nel caso in cui la fluorescenza della proteina GFP-tag può essere seguito come parte di un saggio funzionale (ad esempio, vedi figure 2 e 3). Un limite di questi studi sarebbe se GFP altera in qualche modo la funzione delle proteine. Collegando il GFP al C-terminale della proteina, un gran numero di proteine sono già state studiate senza alterazione funzionale apparente, ma tale possibilità esiste.
Radioisotopicaleganti lly etichettati sono stati spesso utilizzati per studiare legarsi alle cellule intatte 11 ligando. Tuttavia, tali test non consentono semplice determinazione della posizione ligando dopo il legame, né facilitare il confronto di ligando e recettore insieme come nella presente relazione. Un costrutto GFP offre anche ulteriori opportunità di esaminare una proteina di membrana etichettato come qui. A causa della posizione C-terminale del tag GFP, è possibile esaminare la posizione del tag GFP nelle cellule trasfettate durante un test. Immunofluorescenza usando anticorpi GFP permette il confronto di GFP accessibili agli anticorpi con e senza permeabilizzazione (Figura 5). Ulteriori applicazioni della GFP-TMEM184A sfruttano dell'imaging GFP come la colocalizzazione con rodamina-eparina (Figura 2). Impiegando FRET per consentire le emissioni da GFP per eccitare l'rodamina-eparina, come mostrato nella 2C offre un modo interessante per valutare Tra vincolante e intracellularefficking. Inoltre, FRET dati indicano che GFP è abbastanza vicino (entro 10 nm) per la rodamina-ligando per il trasferimento di eccitazione. La prova che tale trasferimento da GFP ad un ligando opere è stato pubblicato per l'ormone paratiroideo taggati con tetrametil-rodamina 14. tecnologia alternativa FRET (fotometabolismo e / o schemi di imaging computer guidato) possono anche essere impiegati per analisi più complessa di quanto mostrato qui come esempio. Allo stesso modo, le interazioni di altre proteine con il candidato potrebbe essere esaminati utilizzando FRET con tag fluorescenti ottimizzati per FRET come nel sistema EGFP / mCherry riportata da Albertazzi et al. 15 e il CFP / YFP e GFP coppie utilizzati negli studi del canale del potassio di Wang e colleghi 16. Molte nuove molecole fluorescenti piccoli vengono progettati, ad esempio 17. Queste molecole aumenterà il numero di casi in cui Fret interazioni tra le proteine GFP-tagged e Fleganti luorescent possono essere esaminati. Gli studi futuri possono coinvolgere anche le modifiche al gene bersaglio, permettendo il costrutto per determinare gli aspetti specifici di sequenza di funzione del gene. Una limitazione di proteine di membrana GFP-tag è quando il C-terminale della proteina è normalmente all'interno. In tali casi, FRET saggi con leganti idrosolubili fluorescenti possono non essere possibile. Tuttavia, meccanismi alternativi di collocare GFP altrove nel costrutto potrebbe essere ancora possibile per alcune tali proteine, e gli altri saggi qui riportati potrebbero ancora essere impiegati.
Oltre alla funzione di localizzazione, e in vivo interazioni ligando, una proteina GFP-tag può essere isolato utilizzando un anticorpo anti-GFP e la proteina isolata utilizzato per esaminare la funzione impiegando saggi in vitro dove la GFP permette un isolamento imparziale della proteina e un controllo relativamente isolato (GFP gratuito). Insieme questi test in grado di fornire una forte prova complementare necessaria per dimostrare °le funzioni della proteina candidato come ipotizzato.
Inoltre, perché GFP è resistente a meno modificato con siti che si estendono dalla struttura compatta 18 proteasi, limitata trattamento proteasi di celle deve rilasciare GFP extracellulare. La scissione della proteasi si verificherebbe nella proteina a cui è attaccato GFP o in una regione linkage progettato. Il prodotto rilasciato sarebbe GFP con un'estensione N-terminale alla sequenza GFP. Tripsina non dovrebbe rilasciare GFP se il C-terminale della proteina a cui è attaccato GFP è intracellulare. Un'analisi preliminare dei potenziali prodotti potrebbe suggerire un chiaro modello peso molecolare con una proteina GFP-tagged rilasciato dalla tripsina. Per molte proteine di membrana, tali tecniche si tradurrebbe in chiara evidenza per la topologia della membrana dal rilascio di GFP, o la loro mancanza.
Insieme, i saggi specifici presentati e / o proposte in questo rapporto fornire un'ampia campionatura di tecniche tcappello può essere impiegato per esaminare nuove proteine partendo da un costrutto fluorescente etichettato. Tali costrutti possono essere facilmente ottenuti commercialmente. L'opportunità di usarli per una vasta gamma di tecniche che li rende economicamente fattibile anche per piccoli laboratori su budget limitati.
Divulgazioni
Gli autori non hanno nulla da rivelare.
Riconoscimenti
Research in the Lowe-Krentz lab is supported by research grant HL54269 from the National Institutes of Health to LLK.
Materiali
| Name | Company | Catalog Number | Comments |
| GFP-TMEM184A construct | OriGene | RG213192 | |
| Rhodamine-Heparin | Creative PEGWorks | HP-204 | Light Sensitive |
| Fluorescein-Heparin | Creative PEGWorks | HP-201 | Light Sensitive |
| Mowiol | EMD Millipore | 475904-100GM | |
| Paraformaldehyde (PFA, methanol free) | Thermo Sci Pierce Biotech, available through Fisher Scientific | PI28908 at Fisher | Use in Fume Hood |
| Reacti-bind neutravidin plates (Avidin coated black 96-well dishes) | Thermo Sci Pierce Biotech, through Fisher Scientific | PI15510 at Fisher | Pay attention to shelf-life |
| Black 96-well plates | Corning Life Sciences Plastic, purchased through Fisher Scientific | 064432 at Fisher | |
| A7r5 vascular smooth muscle cell line | ATCC | CRL 1444 | Can be exchanged into MEM medium1 |
| BAOEC bovine aortic endothelial cells | Cell Applications, Inc. | B304-05 | Culture as recommended initially, can be exchanged into MEM medium for continuing culture1,7 |
| BAOSMC bovine aortic smooth muscle cells | Cell Applications, Inc. | B354-05 | Culture as recommended initially, can be exchanged into MEM medium for continuing culture1 |
| RAOEC rat aortic endothelial cells | Cell Applications, Inc. | R304-05a | Culture as recommended initially, can be exchanged into MEM medium for continuing culture7 |
| Biotinylated anti-GFP | Thermo Sci Pierce Biotech, through Fisher Scientific | MA5-15256-BTIN | |
| Streptavidin-coated beads | Sigma | S1638 | |
| HeBS | Available from Bio-Rad | Can be prepared in the lab. The pH is 6.8 | |
| TMEM184A antibody to the N-terminus | Santa Cruz Biotechnology | sc292006 | Only known TMEM184A antibody to N-terminal region. |
| TMEM184A antibody to the C-terminus | Obtained from ProSci Inc, Poway, CA | Pro Sci 5681 | ProSci used in Figure 1 |
| GFP antibodies | Santa Cruz Biotechnology | sc9996 | Used in Figure 5 |
| Secondary antibodies, labeled with TRITC or Cy3 | Jackson ImmunoResearch Laboratories, Inc, West Grove, PA | 711 025 152 (donkey anti-rabbit, TRITC) 715 165 150 (donkey anti-mouse, Cy3) | Minimal cross-reactivity to minimize any nonspecific staining. |
| CHAPS | Purchased from Sigma | C5849 | Note that this specific catalog number has been discontinued. Supplier will provide information regarding replacement. |
| Live imaging 35-mm dishes | MatTek (Ashland MA) | P35G-1.0 – 20 mm - C | |
| Confocal Microscope | Zeiss | LSM 510 Meta with a 63X oil-immersion lens | Used for images and live-imaging in Figures 1, 2 and 3 |
| Confocal Microscope | Nikon | C2+ confocal with a 60X oil-immersion lens | Used for images in Figure 5 |
| Confocal Microscope | Zeiss | Zeiss LSM 880 with a 63X oil-immersion lens | Used for images in Figure 2C |
| Electroporation equipment | Bio-Rad | Gene Pulser X-Cell System | |
| Electroporation cuvettes | Available from MidSci | EC2L | Can also be obtained from equipment supplier |
| Plate reader | TECAN | TECAN Infinite® m200 Pro plate reader | Readings in the middle of the wells rather than at the surface. |
| Computer program for measuring staining intensity | Image J | https://imagej.nih.gov/ij/ Program and information available on-line | Any appropriate program can be used. See https://theolb.readthedocs.io/en/latest/imaging/measuring-cell-fluorescence-using-imagej.html for additional detail |
| Cell Culture trypsin solution | Sigma | T4174 | purchased as a 10x solution |
Riferimenti
- Pugh, R. J., et al. Transmembrane Protein 184A Is a Receptor Required for Vascular Smooth Muscle Cell Responses to Heparin. J Biol Chem. 291, 5326-5341 (2016).
- Daher, W., et al. Identification of Toxoplasma TgPH1, a pleckstrin homology domain-containing protein that binds to the phosphoinositide PI(3,5)P. Mol Biochem Parasitol. , (2016).
- Vit, O., et al. Large-scale identification of membrane proteins based on analysis of trypsin-protected transmembrane segments. J Proteomics. , (2016).
- Attwood, M. M., et al. Topology based identification and comprehensive classification of four-transmembrane helix containing proteins (4TMs) in the human genome. BMC genomics. 17, 268 (2016).
- Zou, Z., et al. Genome-Wide Identification of Jatropha curcas Aquaporin Genes and the Comparative Analysis Provides Insights into the Gene Family Expansion and Evolution in Hevea brasiliensis. Front Plant Sci. 7, 395 (2016).
- Gilotti, A. C., et al. Heparin responses in vascular smooth muscle cells involve cGMP-dependent protein kinase (PKG). J Cell Physiol. 229, 2142-2152 (2014).
- Farwell, S. L., et al. Heparin Decreases in Tumor Necrosis Factor alpha (TNFalpha)-induced Endothelial Stress Responses Require Transmembrane Protein 184A and Induction of Dual Specificity Phosphatase 1. J Biol Chem. 291, 5342-5354 (2016).
- Xu, D., Esko, J. D. Demystifying heparan sulfate-protein interactions. Annu Rev Biochem. 83, 129-157 (2014).
- Chiodelli, P., Bugatti, A., Urbinati, C., Rusnati, M. Heparin/Heparan sulfate proteoglycans glycomic interactome in angiogenesis: biological implications and therapeutical use. Molecules. 20, 6342-6388 (2015).
- Slee, J. B., Lowe-Krentz, L. J. Actin realignment and cofilin regulation are essential for barrier integrity during shear stress. J Cell Biochem. 114, 782-795 (2013).
- Patton, W. A., et al. Identification of a heparin-binding protein using monoclonal antibodies that block heparin binding to porcine aortic endothelial cells. The Biochemical journal. 311, 461-469 (1995).
- Doggett, T. M., Breslin, J. W. Study of the actin cytoskeleton in live endothelial cells expressing GFP-actin. J Vis Exp. , (2011).
- Skalamera, D., et al. Generation of a genome scale lentiviral vector library for EF1alpha promoter-driven expression of human ORFs and identification of human genes affecting viral titer. PloS one. 7, 51733 (2012).
- Castro, M., Nikolaev, V. O., Palm, D., Lohse, M. J., Vilardaga, J. P. Turn-on switch in parathyroid hormone receptor by a two-step parathyroid hormone binding mechanism. Proc Natl Acad Sci U S A. 102, 16084-16089 (2005).
- Albertazzi, L., Arosio, D., Marchetti, L., Ricci, F., Beltram, F. Quantitative FRET analysis with the EGFP-mCherry fluorescent protein pair. Photochem Photobiol. 85, 287-297 (2009).
- Wang, S., et al. Domain organization of the ATP-sensitive potassium channel complex examined by fluorescence resonance energy transfer. J Biol Chem. 288, 4378-4388 (2013).
- Christiansen, E., Hudson, B. D., Hansen, A. H., Milligan, G., Ulven, T. Development and Characterization of a Potent Free Fatty Acid Receptor 1 (FFA1) Fluorescent Tracer. J Med Chem. 59, 4849-4858 (2016).
- Chiang, C. F., Okou, D. T., Griffin, T. B., Verret, C. R., Green Williams, M. N. fluorescent protein rendered susceptible to proteolysis: positions for protease-sensitive insertions. Arch Biochem Biophys. 394, 229-235 (2001).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon