Method Article
Создание пролиферативный тетраплоид клеток из нетрансформированных фибробластах человека
В этой статье
Резюме
Although proliferative polyploid cells are necessary to analyze chromosomal instability of polyploid cells, creating such cells from nontransformed human cells is not easy. The present report describes relatively simple procedures to establish proliferative tetraploid cells free of a diploid population from normal human fibroblasts.
Аннотация
Polyploid (mostly tetraploid) cells are often observed in preneoplastic lesions of human tissues and their chromosomal instability has been considered to be responsible for carcinogenesis in such tissues. Although proliferative polyploid cells are requisite for analyzing chromosomal instability of polyploid cells, creating such cells from nontransformed human cells is rather challenging. Induction of tetraploidy by chemical agents usually results in a mixture of diploid and tetraploid populations, and most studies employed fluorescence-activated cell sorting or cloning by limiting dilution to separate tetraploid from diploid cells. However, these procedures are time-consuming and laborious. The present report describes a relatively simple protocol to induce proliferative tetraploid cells from normal human fibroblasts with minimum contamination by diploid cells. Briefly, the protocol is comprised of the following steps: arresting cells in mitosis by demecolcine (DC), collecting mitotic cells after shaking off, incubating collected cells with DC for an additional 3 days, and incubating cells in drug-free medium (They resume proliferation as tetraploid cells within several days). Depending on cell type, the collection of mitotic cells by shaking off might be omitted. This protocol provides a simple and feasible method to establish proliferative tetraploid cells from normal human fibroblasts. Tetraploid cells established by this method could be a useful model for studying chromosome instability and the oncogenic potential of polyploid human cells.
Введение
Полиплоидии наблюдается не только в специализированных тканях млекопитающих, но и в различных патологических состояниях, таких как рак и дегенеративные заболевания. Полиплоидных ( в основном тетраплоидных) клетки часто наблюдаются в предраковых поражений тканей человека, таких как рак пищевода 1,2 или плоскоклеточного интраэпителиальных поражений Барретта шейки 3,4, и рассматривались как источник злокачественных анеуплоидных клеток в этих тканях 5 , 6. Хотя предполагается, что превращение тетраплоид в анеуплоидных клеток может стать важным событием на ранних стадиях онкогенеза, механизмы, участвующие в этом процессе, полностью не поняты. Это отчасти потому , что не в пробирке модель не была доступна , где нетрансформированных полиплоидные клетки человека могут распространяться.
Некоторые исследователи индуцированных тетраплоидия в нетрансформированных эпителиальных клеток человека через поколения двуядерных клеток с помощью Inhibiting цитокинез 7-9. В этом способе, однако, ненужные диплоидные клетки , должны быть устранены с помощью флуоресцентной активированный сортировки клеток (FACS) 7,8 или клонировании лимитирующим разведением 9. Поскольку эти процедуры являются трудоемкими и не легко выполнить, более простые методы, чтобы установить нетрансформированных тетраплоидных клетки желательны для проведения исследований в этой области.
В настоящем докладе мы опишем протокол о создании пролиферативные тетраплоидных клеток из нормальных человеческих фибробластов или теломераза-увековечены фибробластов человека относительно простыми процедурами. Процедуры используют яд шпинделя демеколцин (DC), чтобы арестовать диплоидных клеток в митозе и делящихся клеток, собранных стряхивая дополнительно обрабатывают DC. Диплоидные клетки, обработанные митоза DC в течение длительного времени преобразовать в тетраплоидным G1 клеток, и эти клетки пролиферируют в тетраплоидных клеток после остановки роста в течение нескольких дней после удаления наркотиков. Этот протокол обеспечиваетэффективный метод для создания полезной модели для изучения взаимосвязи между хромосомной нестабильностью и онкогенного потенциала полиплоидных клеток человека.
протокол
1. Культура клеток
- Получение клеток, чтобы вызвать тетраплоидия. На сегодняшний день было подтверждено, что этот метод может быть применен к фибробласты клеточных линий человека ТИГ-1, BJ, IMR-90 и теломераза-увековеченную TIG-1 (TIG-ХТ).
- Рост клеток в минимальной основной среде с модификацией & alpha; или любой другой среде для культивирования клеток, подходящей для типа клеток, чтобы изучаться с добавлением 10% (об / об) инактивированной нагреванием фетальной бычьей сыворотки (FBS), путем инкубирования в 5% (об / v) атмосфере СО 2 при 37 ° С. Прохождение клетки каждые 3 или 4 дня не должна превышать плотность субконфлюентные.
Примечание: Уровень Удвоение населения (PDL) следует вычислять каждый раз при пассажей для оценки роста клеток и клеток возраста. PDL можно вычислить из числа клеток высевали в чашку (N1) и числа клеток, выделенных на следующей пассирования (N2) с использованием следующей формулы (Х является начальным PDL). PDL = X + (вход N1 - N2 журнал) / Log 2
2. Индукция и Эстаblishment тетраплоидных клеток из диплоидных фибробластах
- Побудить тетраплоидия без вытряхиваемого.
Примечание: Некоторые клеточные штаммы (например , TIG-1) может стать почти полностью тетраплоидный путем непрерывной обработки с демеколцин (DC) следующим образом .- Прохождение клеток в одну или две 100-мм чашек в день до начала лечения, чтобы побудить тетраплоидия. Как правило, готовят 5 х 10 5 до 1 × 10 6 клеток на чашку для индукции тетраплоидных клеток.
- Treat экспоненциально растущие клетки со средой, содержащей 0,1 мкг / мл DC в течение 4 дней.
- Заменить DC-среду , содержащую со средой , свободной от наркотиков и инкубировать клеток в 5% (об / об) атмосфере СО 2 при 37 ° С. Клетки, как правило, возобновить пролиферацию в течение 1 недели.
- Побудить тетраплоидия с вытряхиваемого.
Примечание: Большинство клеток становятся смесью диплоидных и тетраплоидных популяций в результате простого лечения DC описано выше (2.1). Таким образом, некоторые модификации рrocedure ликвидировать диплоидной популяции необходимо следующим образом (рисунок 1).- Прохождение клеток в несколько T75 колб за день до лечения, чтобы побудить тетраплоидия. Как правило, готовят по меньшей мере , 5 × 10 6 клеток (1 × 10 6 клеток на колбу) для индукции тетраплоидных клеток.
- Лечить экспоненциально растущих клеток со средой, содержащей 0,1 мкг / мл DC в течение 16 - 18 ч, чтобы арестовать клетки в митозе. Время, необходимое для ареста клеток в митозе, может зависеть от клеток-мишеней, и должны быть определены с помощью предварительных экспериментов, чтобы получить как можно больше митотических клеток, как это возможно. Например, медленнее растущие клетки должны быть обработаны DC в течение более длительного времени, чем более высокими темпами роста клеток.
Примечание: Если клетки обрабатывают слишком долго на этом этапе, они могут подвергнуться митотическую проскальзывание и прилипают к поверхности посуды, что делает невозможным собрать митотических клеток путем вытряхиваемого на следующей стадии. - Собирают DC-арестованными митотических клеток с помощью вытряхиваемого метода, в КНIch свободно прилипшие митотические клетки собирают осторожном встряхивании колб и промывки среды с последующим центрифугированием (300 XG, 5 мин). Подсчитать количество клеток с помощью соответствующего метода в этом шаге.
- Reseed собранных митотических клеток в культуральных чашках 60 мм и лечения клеток с помощью 0,1 мкг / мл DC в течение еще 3 дней. Семенной более 1 × 10 6 митотических клеток на чашку, потому что меньше , чем 10% клеток , могут выжить в этом лечении.
- Заменить DC-среде, содержащей со средой, свободной от наркотиков и ждать, пока клетки возобновить пролиферацию, которое обычно происходит в течение 1 недели.
- Прохождение клетки так же, как исходных диплоидных клеток.
3. Изучение плоидности ДНК
ПРИМЕЧАНИЕ: Это хорошо установленный порядок и техническое руководство следует передать подробные процедуры и технические советы.
- Урожай клетки (5 × 10 5 - 1 × 10 6) путем инкубирования клеток с мошенником раствором0,05% содержащих трипсин и 0,02% ЭДТА в течение 10 мин при 37 ° С, и нейтрализуют трипсин средой, содержащей 10% FBS.
- Центрифуга клеток в среде и мыть их ресуспендирования в 5 мл фосфатно-солевым буферным раствором (PBS) с последующим центрифугированием (300 XG, 5 мин).
- Подготовка клеток для анализа ДНК с помощью одного из следующих двух методов
- Способ анализа нефиксированных клеток 10
Примечание: Этот метод может быть выполнен с использованием коммерчески доступного набора для анализа клеточного цикла. Образцы, полученные с помощью этого метода следует анализировать непосредственно, потому что клетки не являются фиксированными в порядке, и окрашивают ядра будут повредиться со временем.- Вымойте клеток с 40 мМ цитратного буфера, содержащего 250 мМ сахарозы. В дальнейшем обработать клетки с 250 мкл 0,1% (об / об) Nonidet P40 и 30 мкг / мл трипсина в 200 мкл 40 мМ цитратного буфера, содержащего 250 мМ сахарозы в течение 10 мин при комнатной температуре.
- Добавить 200 мкл 0,5 мкг / мл трипсина Inhibitor и 0,1 мкг / мл РНКазы А в 40 мМ цитратном буфере, содержащем 250 мМ сахарозы, и инкубируют клетки в течение 10 мин при комнатной температуре.
- Добавить 200 мкл 0,4 мг / мл пропидий йодида (PI), в 40 мМ цитратном буфере, содержащем 250 мМ сахарозы, и инкубируют клетки в течение 10 мин при комнатной температуре, чтобы окрасить клеточные ядра.
- Способ анализа фиксированные клетки
- Закрепить клетки с 80% -ным этанолом, приостановив клеток в 1 мл PBS, добавляя 4 мл 100% по каплям этанола при перемешивании суспензии клеток и оставить его при комнатной температуре в течение 30 мин. Клетки в этой закрепителя можно хранить при -20 ° C в течение нескольких недель.
- Промыть клетки путем ресуспендирования их в 5 мл PBS с последующим центрифугированием (300 XG, 5 мин). Treat клетки с 0,5 мг / мл РНКазы А и окрашивают их с 50 мкг / мл пропидиума йодида (PI) (475 мкл 0,5 мг / мл РНКазы А и 25 мкл 1 мг / мл PI) в течение 30 мин при комнатной температуре.
- Способ анализа нефиксированных клеток 10
- Анализ содержания ДНК тон ячеек с помощью проточного цитометра с 488 нм лазером и фильтром эмиссии красного канала (длинный пас> 610 нм). Анализ эталонного образца, полученного из подлинных диплоидных клеток, в то же время для оценки плоидности клеток-мишеней.
- В качестве альтернативы, добавить флуоресценции стандартных бусин для оценки соотношения интенсивности флуоресценции диплоидных клеток по сравнению с бусинами. Используйте 'высоты импульса против широтно - импульсной' вариант потока цитометр различать между отдельными тетраплоидных клеток и сгустки диплоидных клеток 11.
4. Исследование хромосомных графов и анализа кариотипа
ПРИМЕЧАНИЕ: Все это хорошо установленные процедуры и техническое руководство или протоколы изготовителя должны быть переданы для детальных процедур и технических советов.
- Лечить экспоненциально растущих клеток с 0,1 мкг / мл DC в течение 4 часов, чтобы задержать клетки в метафазе.
- Подготовить хромосомные слайды.
- Клетки для уборки урожая ( по крайней мере , 5 × 10 5 клеток) по трипсином и подвесить в среде , содержащей FBS.
- Центрифуга клеток в среде (300 XG, 5 мин) и обрабатывают гипотонический раствор (5 мл 0,075 М KCl) при 37 ° С в течение 10 мин.
- Закрепить и приостановить клетки в фиксаторе Карнуа (метанол: уксусная кислота = 3: 1).
- Распространение клеток на предметное стекло, понижая небольшого объема (25 - 35 мкл) клеточной суспензии. Дополнительные шаги, такие как воздействие горячего пара может быть необходимо для улучшения хромосому распространения.
- Пятно клетки для подсчета хромосом или анализа кариотипа или многоцветной флуоресценции в гибридизация (mFISH).
- Хромосомные имеет значение.
- Пятно клетки с 5% -ным раствором Гимза (или 5 мкг / мл PI, содержащий 0,5 мг / мл РНКазы А для флуоресцентной микроскопии) в течение 15 - 20 мин.
- Цифровым фотографировать, по меньшей мере 50 метафазных клеток.
- Подсчитать количество хромосом на клетку с помощью анализа изображений Softwaповторно после ручного отделения трогательные и перекрывающихся хромосомами с помощью программного обеспечения для редактирования фотографий. Хотя число хромосом может быть забит вручную, рекомендуется компьютеризированные подсчета очков.
- анализ кариотипа
Примечание: Этот анализ должен выполняться квалифицированным специалистом или профессиональной компании.- Пятно клетки по стандартной методике G-обвязочной 12.
- Анализ хромосом , чтобы сделать стандартные karyograms 12.
- mFISH
Примечание: Этот шаг не является обязательным и должно быть выполнено в случае необходимости.- Пятно клеток с использованием разноцветные рыбы зондов для хромосом человека в соответствии с протоколом производителя 13.
- Анализ хромосом с помощью флуоресцентного микроскопа с подходящими фильтрами и программное обеспечение для анализа mFISH 13.
- Хромосомные имеет значение.
Результаты
По нашему опыту, клетки TIG-1 могут быть сделаны почти полностью тетраплоид простой непрерывной обработкой 0,1 мкг / мл DC в течение 4 дней (Рисунок 2А). В противоположность этому, другие фибробласта штаммы, такие как BJ или кондиционированной IMR-90, а также клетки TIG-ХТ, стала смесь диплоидных и тетраплоидных популяций следующих той же обработке, и выделение митотических клеток с помощью вытряхиваемого метода необходимо в течение лечения постоянным током (обычно 16 - 18 ч после начала лечения) (рис 2B, C). После дополнительной обработки DC в течение 3-х дней, клетки прошли остановку роста и выставлены большие, уплощенные морфологию в течение нескольких дней. В течение одной недели в целом, появились небольшие пролиферирующие клетки среди крупных уплощенных клеток (рисунок 3). Клетки стали почти полностью тетраплоид в 2 - 3 недели после лечения постоянным током. Модальное число хромосом в клетках, установленных тетраплоидным в большинстве случаев было 92, Exceпт , что одна из тетраплоидным клеточных линий , созданных из клеток TIG-ХТ была 91 хромосомы в большинстве клеток (рисунок 4). Штатные тетраплоидных клетки росли почти такими же темпами , как диплоидных клеток (рисунок 5). Тетраплоидные клеточные линии , установленные из не иммортализованных клеток показали примерно равное репликативной продолжительности жизни в качестве исходных диплоидных клеток, в то время как те , из иммортализованных клеток , казалось, также бессмертна (рисунок 5). Тетраплоидные клетки , созданные из не иммортализованных клеток TIG-1 показал нормальный кариотип для иметь тетраплоидный число хромосом (рис 6 верхняя панель), в то время как те , из увековечена TIG-1 (TIG-ХТ) клетки показали довольно сложные клоновых аберраций (рис 6 , за исключением средние и нижние панели). Частота клоновых аберраций в последних клетках (TIG-ХТ-4n) увеличилась с 2,5 аберраций на клетку при 255 удвоения популяции уровней (PDLs) до 5,2 аберраций на клетку при 450 PDLс повторным субкультуры.
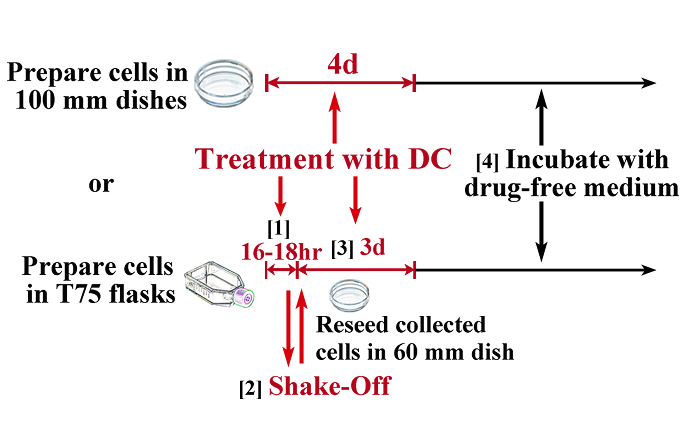
Рисунок 1: Схематическое изображение протокола для индукции тетраплоидия. Для получения тетраплоидных клеток с минимальным загрязнением диплоидных клеток, сочетание митотической вытряхиваемого и лечения DC необходим для большинства штаммов клеток (нижний рисунок), в то время как некоторые клеточные штаммы (например , TIG-1) может стать почти полностью тетраплоидный путем непрерывного лечения с демеколцин (верхний рисунок). 1) Treat клеток в колбах Т75 (не менее 5 х 10 6) с 0,1 мкг / мл в течение 16 DC - 18 ч (это время должно быть определено предварительных экспериментов) задержать клетки в митоз. 2) Соберите митотических клеток с помощью вытряхиваемого метода и осеменяют в 60 мм блюда культуры. 3) Рассматривать клеток с помощью 0,1 мкг / мл DC в течение еще 3 дней. 4) Инкубируйте клеток в среде, свободной от наркотиков (как правило, клетки резюме рroliferation в течение 1 недели). Шкала баров составляет 100 мкм. Пожалуйста , нажмите здесь , чтобы посмотреть увеличенную версию этой фигуры.

Рисунок 2: ДНК Гистограммы фибробластами до и после обработок для индукции тетраплоидия. (A) , TIG-1 клеток. Этот штамм клетка становится тетраплоидном простым непрерывной обработкой 0,1 мкг / мл DC в течение 4 дней. (B) BJ клетки. Поскольку эта клетка становится штамм смесь диплоидных и тетраплоидных популяций следующий простой обработки с DC (слева панели), выделение делящихся клеток путем стряхивая необходимо во время лечения DC установить тетраплоидных клеток (правая панели). (С) TIG-ХТ (теломераза-иммортализованные TIG-1) клеток. Эти клетки также должны быть получены с помощью расчески минации лечения и постоянного тока вытряхиваемого для создания тетраплоидных клеток. Цифрами в гистограмм представляют время (дни) после удаления препарата. По оси абсцисс отложены содержание ДНК (C, дополнение). Пожалуйста , нажмите здесь , чтобы посмотреть увеличенную версию этой фигуры.

Рисунок 3: Типичные микрофотографии BJ клеток , обработанных с DC. (А) BJ клетки обрабатывали 0,1 мкг / мл DC в течение 16 часов. Многие клетки, задержанные в митозе можно увидеть. (B) Конец лечения DC. Почти все клетки роста арестованы. (С) через 7 дней после обработки DC. Малые пролиферирующие клетки среди больших уплощенных клеток можно увидеть. (D) , через 14 дней после обработки DC. Клетки активно растут. e.com/files/ftp_upload/55028/55028fig3large.jpg "целевых =" _blank "> Пожалуйста, нажмите здесь, чтобы посмотреть увеличенную версию этой фигуры.

Рисунок 4: Типичные микрофотографии хромосомах и гистограмм хромосомных Номер для тетраплоид клеток Основана от каждой ячейки штамма. Верхней, средней и нижней панели представляют собой тетраплоидных клетки, установленные от TIG-1 (через 2 недели после лечения DC), BJ (через 2 недели после лечения DC) и TIG-ХТ (7 недель после лечения DC) клетки соответственно. Хромосомы были забиты по крайней мере 50 метафазах. Цифрами в гистограмм модальные числа хромосом. Пожалуйста , нажмите здесь , чтобы посмотреть увеличенную версию этой фигуры.
ftp_upload / 55028 / 55028fig5.jpg "/>
Рисунок 5: Типичные профили роста фибробластов человека (диплоидных клеток) и клеток тетраплоид Основана от каждой ячейки штамма. Левый, центральный и правый панели показывают профили роста оригинальной TIG-1, BJ и TIG-ХТ клетки (открытые маркеры), а также тех, тетраплоидных клеток установлено от каждого штамма клеток (закрытые маркеры). Клетки пересевали два раза в неделю и PDLs были рассчитаны из числа клеток. Пожалуйста , нажмите здесь , чтобы посмотреть увеличенную версию этой фигуры.

Рисунок 6: Представитель Karyograms по G-бандажные и mFISH. Верхняя панель показывает кариограмму по G-бандажные тетраплоидных клеток, созданных из TIG-1 (через 2 недели после лечения DC). Средней и нижней панели показываютkaryograms по mFISH для тетраплоидных клеток, созданных из клеток TIG-ХТ (15 и 41 недель после лечения DC). Кариотипы были основаны на 10 клеток (TIG-1) или 20 клеток (TIG-ГТ). Пожалуйста , нажмите здесь , чтобы посмотреть увеличенную версию этой фигуры.
Обсуждение
Одна из основных проблем в индукции тетраплоидия из диплоидных клеток с помощью химических агентов, либо с помощью ингибиторов цитокинеза или ингибиторами шпинделя, является то, что клетки часто становятся смесью диплоидных и тетраплоидных популяций, и тетраплоидные клетки должны быть отделены от диплоидных клеток. Наиболее распространенные подходы к выделению тетраплоидной населения, свободного от диплоидных клеток используют FACS или клонировании путем ограничения разведения. Тем не менее, эти процедуры являются трудоемкими и не легко выполнить. В этом отчете мы представляем новый протокол о создании пролиферативные тетраплоидных клеток, свободных от диплоидной популяции от нормальных человеческих фибробластов. Протокол использует шпиндель яд DC для ареста диплоидных клеток в митозе, и арестовал митотические клетки разделены стряхивания из диплоидных интерфазных клеток, которые прилипших к поверхности посуды. Собранные клетки обрабатывают DC еще в течение 3-х дней, и диплоидные делящихся клеток преобразовать в тетраплоидным G1 клеток этого длительного лечения постоянным током предположительно бу адаптации контрольной точки (также называемый митотический проскальзывания). Эти клетки перезапустить клеточный рост как тетраплоидным клеток после остановки роста в течение нескольких дней удаления наркотиков.
Преимущество этого способа состоит в том, что процедуры являются относительно простыми и осуществимыми по сравнению с теми, с использованием FACS или клонированием, чтобы изолировать тетраплоидные клетки. Ограничения метода являются следующие. Применимость к другим, чем фибробласты типов клеток, таких как эпителиальные клетки, в настоящее время неизвестно. Это должно быть подтверждено в будущих исследованиях. Небольшой диплоидной популяции может оставаться в некоторых случаях. Тем не менее, эти клетки имеют тенденцию уменьшаться с последовательным пассажей. Если значительная диплоидной популяции сохраняется после лечения постоянным током, более высокой концентрации тока (1,2 - 1,5 мкг / мл) или более длительное лечение с постоянным током после вытряхиваемого (4 дня вместо 3-х дней), может улучшить результат.
Наиболее важные шаги в этом протоколе, являются следующие. Во-первых, время обработки с DC дляrresting клеток в митозе, прежде чем вытряхиваемого имеет решающее значение. Хотя на этот раз лечение должно быть достаточно продолжительным, чтобы собрать как можно больше делящихся клеток, как это возможно, лечение слишком долго может привести к митотическую проскальзывания и адгезию к поверхности посуды, что делает невозможным, чтобы собрать митотических клеток путем стряхивания. Поскольку подходящее время для максимального извлечения митотических клеток может зависеть от клетки-мишени, оно должно быть определено с помощью предварительных экспериментов. Во-вторых, стряхивая шаг, чтобы отделить делящихся клеток от интерфазных клетках также имеет важное значение. На этом этапе, диплоидные митотических клеток, которые свободно прилипшие к поверхности посуды, собирают осторожном встряхивании из колбы с последующим центрифугированием. Этот митотический вытряхиваемого отделяет митотические клетки арестованные ДК из прилипших интерфазных клеток, которые могут быть происхождение загрязнения диплоидного населения позже. Встряхивания яростно может вызвать пузырение среды, что может привести к повреждению клеток, а также отряд интерфазных клеток, гesulting к загрязнению диплоидных клеток. Другим фактором, который может повлиять на успех этого метода является питательная среда. Поскольку надежная стимуляция роста, как представляется, необходимым для восстановления пролиферации после лечения постоянным током, богатой питательными веществами среде, такой как MEM-альфа следует использовать для поддержки пролиферации клеток тетраплоидным. Увеличение концентрации FBS до 20% на конечной стадии индукции тетраплоидным клеток (2.2.5) также может повысить успех этого метода.
Используя этот протокол, мы имеем на сегодняшний день произведено тетраплоидных клеток из штаммов фибробластов человека TIG-1, BJ, IMR-90 и теломераза-увековечен TIG-1 до сих пор 14-16. Среди этих клеточных штаммов, TIG-1 довольно необычно, потому что эта клетка деформация становится почти полностью тетраплоид, когда непрерывно обрабатывают DC, без вытряхиваемого, в течение 4 дней. Причина, по которой только клетки TIG-1 становится полностью тетраплоидный в результате простой обработки с DC в настоящее время неизвестно. Возможные explaнации может оказаться, что значительная часть клеток других типов арестов в диплоидной фазе G1 при обработке DC и возобновляет пролиферацию после лечения, в то время как (1) клетки TIG-1 не арестовывают на G1 с такой же обработкой, или (2) популяция клеток TIG-1 необратимо арестовывает в G1 под такой же обработке и не возобновит распространение в последующий период. В любом случае, различные уровни чувствительности контрольной точки G1 в постоянный ток может быть ответственным за различные поведения клеток после непрерывного лечения с DC.
При исследовании этиологической значимости тетраплоидия в онкогенеза, многие исследователи имеют большие опасения по поводу состояния гена р53 в тетраплоидных клетках, так как было предложено, что тетраплоидия индуцирует р53-зависимый остановку роста клеток, который называется "тетраплоидия контрольно-пропускной пункт" 17-20. Если эта гипотеза верна, передача сигналов p53 в пролиферирующих тетраплоидных клетки должны быть инактивируется. Однако,тетраплоидных клетки , установленные нашим протоколом , кажется, имеют функциональную p53 , несмотря на растущий почти с такой же скоростью , как диплоидных клеток 15,16. Причина такого несоответствия не известно в настоящее время, и значение инактивации р53 в пролиферации клеток тетраплоидных должны быть рассмотрены именно в будущих исследованиях. На самом деле, наличие тетраплоидия контрольно - пропускной пункт , который функционирует через р53 остается спорным 21-23.
Хотя нетрансформированных полиплоидные клетки , которые могут распространяться в пробирке необходимы для детального анализа хромосомной нестабильности и онкогенного потенциала полиплоидных клеток, такие клетки имеют до сих пор редко были доступны. Наш протокол обеспечивает простой и приемлемый метод для установления пролиферативные тетраплоидных клетки от нормальных человеческих фибробластов, которые могли бы быть полезной моделью для изучения механизмов, приводящих к трансформации полиплоидных клеток человека.
Раскрытие информации
Авторы заявляют, что у них нет конкурирующих финансовых интересов.
Благодарности
We thank Mrs. Matsumoto for the technical assistance.
Материалы
| Name | Company | Catalog Number | Comments |
| MEM-α | Sigma-Aldrich | M8042-500ML | |
| Trypsin-EDTA | Sigma-Aldrich | T4174 | |
| FBS | Sigma-Aldrich | 172012-500ML | |
| Demecolcine solution (10 μg/mL in HBSS) | Sigma-Aldrich | D1925-10ML | |
| BD CycleTES Plus DNA Reagent Kits | BD Biosciences | #340242 | For examination of DNA ploidy by flow cytometry |
| Human chromosome multicolor FISH probe 24XCyte | MetaSystems | #D-0125-060-DI | Specialized filter set and software for mFISH analysis are necessary |
| Isis imaging system with mFISH software | MetaSystems | Specialized probe kit is necessary |
Ссылки
- Rabinovitch, P., et al. Predictors of progression in Barrett's esophagus III: baseline flow cytometric variables. Am. J. Gastroenterol. 96 (11), 3071-3083 (2001).
- Galipeau, P., et al. NSAIDs modulate CDKN2A, TP53, and DNA content risk for progression to esophageal adenocarcinoma. PLoS Med. 4 (2), e67 (2007).
- Olaharski, A., et al. Tetraploidy and chromosomal instability are early events during cervical carcinogenesis. Carcinogenesis. 27, 337-343 (2006).
- Liu, Y., et al. p53-independent abrogation of a postmitotic checkpoint contributes to human papillomavirus E6-induced polyploidy. Cancer Res. 67, 2603-2610 (2007).
- Davoli, T., de Lange, T. The causes and consequences of polyploidy in normal development and cancer. Annu Rev Cell Dev Biol. 27, 585-610 (2011).
- Fox, D., Duronio, R. Endoreplication and polyploidy: insights into development and disease. Development. 140, 3-12 (2013).
- Fujiwara, T., et al. Cytokinesis failure generating tetraploids promotes tumorigenesis in p53-null cells. Nature. 437, 1043-1047 (2005).
- Ganem, N., et al. Cytokinesis failure triggers hippo tumor suppressor pathway activation. Cell. 158 (4), 833-848 (2014).
- Kuznetsova, A., et al. Chromosomal instability, tolerance of mitotic errors and multidrug resistance are promoted by tetraploidization in human cells. Cell cycle. 14 (17), 2810-2820 (2015).
- Vindeløv, L., Christensen, I. Detergent and proteolytic enzyme-based techniques for nuclear isolation and DNA content analysis. Methods Cell Biol. 41, 219-229 (1994).
- Darzynkiewicz, Z., Juan, G. DNA content measurement for DNA ploidy and cell cycle analysis. Curr Protoc Cytom. , Chapter 7: Unit 7.5 (2001).
- Knutsen, T., Bixenman, H., Lawce, H., Martin, P. Chromosome analysis guidelines preliminary report. Cancer Genet Cytogenet. 52 (1), 11-17 (1991).
- Liehr, T., et al. Multicolor FISH probe sets and their applications. Histol. Histopathol. 19 (1), 229-237 (2004).
- Ohshima, S., Seyama, A. Formation of bipolar spindles with two centrosomes in tetraploid cells established from normal human fibroblasts. Hum. Cell. 25 (3), 78-85 (2012).
- Ohshima, S., Seyama, A. Establishment of proliferative tetraploid cells from normal human fibroblasts. Front. Oncol. 3, 198 (2013).
- Ohshima, S., Seyama, A. Establishment of proliferative tetraploid cells from telomerase-immortalized normal human fibroblasts. Genes, Chromosome Cancer. 55 (6), 522-530 (2016).
- Di Leonardo, A., et al. DNA rereplication in the presence of mitotic spindle inhibitors in human and mouse fibroblasts lacking either p53 or pRb function. Cancer Res. 57, 1013-1019 (1997).
- Andreassen, P., Lohez, O., Lacroix, F., Margolis, R. Tetraploid state induces p53-dependent arrest of nontransformed mammalian cells in G1. Mol. Biol. Cell. 12, 1315-1328 (2001).
- Vogel, C., et al. Crosstalk of the mitotic spindle assembly checkpoint with p53 to prevent polyploidy. Oncogene. 23, 6845-6853 (2004).
- Aylon, Y., Oren, M. p53: Guardian of ploidy. Mol. Oncol. 5 (4), 315-323 (2011).
- Uetake, Y., Sluder, G. Cell cycle progression after cleavage failure : mammalian somatic cells do not possess a "tetraploidy checkpoint". J. Cell Biol. 165, 609-615 (2004).
- Ganem, N., Pellman, D. Limiting the proliferation of polyploid cells. Cell. 131, 437-440 (2007).
- Ho, C., Hau, P., Marxer, M., Poon, R. The requirement of p53 for maintaining chromosomal stability during tetraploidization. Oncotarget. 1 (7), 583-595 (2010).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены