Method Article
비 형질 인간 섬유 아세포의 증식 배체 세포의 수립
요약
Although proliferative polyploid cells are necessary to analyze chromosomal instability of polyploid cells, creating such cells from nontransformed human cells is not easy. The present report describes relatively simple procedures to establish proliferative tetraploid cells free of a diploid population from normal human fibroblasts.
초록
Polyploid (mostly tetraploid) cells are often observed in preneoplastic lesions of human tissues and their chromosomal instability has been considered to be responsible for carcinogenesis in such tissues. Although proliferative polyploid cells are requisite for analyzing chromosomal instability of polyploid cells, creating such cells from nontransformed human cells is rather challenging. Induction of tetraploidy by chemical agents usually results in a mixture of diploid and tetraploid populations, and most studies employed fluorescence-activated cell sorting or cloning by limiting dilution to separate tetraploid from diploid cells. However, these procedures are time-consuming and laborious. The present report describes a relatively simple protocol to induce proliferative tetraploid cells from normal human fibroblasts with minimum contamination by diploid cells. Briefly, the protocol is comprised of the following steps: arresting cells in mitosis by demecolcine (DC), collecting mitotic cells after shaking off, incubating collected cells with DC for an additional 3 days, and incubating cells in drug-free medium (They resume proliferation as tetraploid cells within several days). Depending on cell type, the collection of mitotic cells by shaking off might be omitted. This protocol provides a simple and feasible method to establish proliferative tetraploid cells from normal human fibroblasts. Tetraploid cells established by this method could be a useful model for studying chromosome instability and the oncogenic potential of polyploid human cells.
서문
배수성은 포유 동물 종의 전문 조직에서뿐만 아니라, 암과 같은 퇴행성 질환의 병리 적 상태의 다양한뿐만 관찰되었다. 배수체 (주로 배체) 세포는 종종 경부 3,4의 바렛 식도 2 또는 편평 상피내 병변 인간 조직의 발암 병변 관찰하고, 그 조직을 5 이수성 악성 세포의 근원으로 간주되어왔다 6. 이 이수성 배체 세포로의 전환이 종양 형성의 초기 단계에서 중요한 이벤트가 될 수 있다고 제시되어 있지만,이 과정에 관여하는 메커니즘은 완전히 이해되지 않는다. 이 비 형질 배수체 인간의 세포를 전파 할 수있는 더 체외 모델을 사용할 수 없었다 부분적으로 있기 때문이다.
일부 연구자들은 INH로 이핵 세포의 생성을 통해 비 형질 인간의 상피 세포에서 tetraploidy을 유도 한세포질 분열 7-9 ibiting. 그러나이 방법 불필요한 이배체 세포 -7,8- 형광 - 활성화 세포 분류 (FACS)에 의해 제거해야 또는 희석 9를 제한하여 클로닝. 이러한 절차를 수행하기 쉬운 힘들고 없기 때문에 간단한 방법은 비 형질 배체 세포가이 분야의 연구를 위해 요구되는 설정합니다.
본 보고서에서, 우리는 비교적 간단한 절차에 의해 정상적인 인간 섬유 아세포 또는 텔로 머라 아제 - 불후의 인간 섬유 아세포의 증식 배체 세포를 확립하기위한 프로토콜을 설명합니다. 절차는 또한 DC로 처리 떨고에 의해 수집 된 유사 분열에서 이배체 세포 및 유사 분열 세포를 체포 스핀들 독 데메 콜신 (DC)를 사용합니다. 오랜 시간 동안 DC 처리 이배체 유사 분열 세포는 G1 배체 세포로 변환하고, 이들 세포는 약물의 제거 다음의 며칠 동안 성장 정지 후 같은 배체 세포 증식. 이 프로토콜은 제공염색체 불안정성 배수체 인간 종양 세포의 전위 사이의 관계를 연구하는 유용한 모델을 생성하는 효과적인 방법.
프로토콜
1. 세포 배양
- tetraploidy을 유도하는 세포를 얻습니다. 최신으로이 기술은 인간 섬유 아세포 세포주 TIG-1, BJ, IMR-90 및 텔로 머라 - 불멸화 TIG-1 (TIG-HT)에 적용 할 수있는 것이 확인되었다.
- α 변형 혹은 10 % (v / v)의 5 %에서 배양함으로써 열 - 불 활성화 소 태아 혈청 (FBS) (V / 보충 공부 될 세포 유형에 적합한 임의의 다른 세포 배양액 최소 필수 배지에서 세포 성장 V) CO 37 ° C에서 2 분위기. 통로 세포는 subconfluent 밀도를 초과마다 3 사일 없습니다.
주 : 인구 배증 레벨 (PDL)는 세포 성장 및 세포 연령 평가에서 계대마다 계산되어야한다. PDL은 접시 (N1) 및 다음 식 (X 초기 PDL이다)를 사용하여 다음 계대 (N2)에서 수확 한 세포 수로 접종 세포 수로부터 계산 될 수있다. PDL은 = X + (N1 로그 - N2 로그) / 2 로그
2. 유도 및 사령관이배체 섬유 아세포에서 배체 세포의 blishment
- 흔들림 오프없이 tetraploidy 유도한다.
참고 : 일부 세포주 (예 : TIG-1)은 다음과 같이 데메 콜신 (DC)로 거의 완전히 배체 연속 처리에 의한 될 수 있습니다.- 치료 전날에 하나 또는 두 개의 100mm 접시에 통로 세포는 tetraploidy 유도합니다. 일반적으로 배체 세포의 유도를 위해 접시 당 5 × 10 5 6 10 × 1 세포를 준비합니다.
- 4 일 동안 0.1 μg의 / ㎖의 DC를 포함하는 매체가 기하 급수적으로 증가 세포 치료.
- 마약없는 매체와 매체를 DC가 함유 교체하고 37 ° C에서 (v / v)의 CO 2 분위기 5 %에서 세포를 배양한다. 세포는 통상 1 주일 이내에 증식을 다시 시작합니다.
- 흔들림 오프로 tetraploidy 유도한다.
주 : 대부분의 세포는 DC와 간단한 처리의 결과로서 이배체 및 사배체 집단의 혼합물이 상기 (2.1)에 설명된다. 는 P의 따라서 일부 수정rocedure (그림 1)을 다음과 같이 이배체 인구가 필요합니다 제거합니다.- 여러 T75에 통로 세포는 tetraploidy을 유도하는 치료 전날 플라스크. 일반적 배체 세포를 유도하기위한 적어도 5 × 106 세포 (플라스크 당 1 × 106 세포)를 준비한다.
- 유사 분열에서 셀을 체포 18 시간 - 16 0.1 μg의 / ㎖의 DC를 포함하는 매체가 기하 급수적으로 증가 세포 치료. 유사 분열에서 세포를 저지하기 위해 필요한 시간은 표적 세포에 의존 할 수 있고, 가능한 한 많은 유사 분열 세포를 얻기 위해 예비 실험에 의해 결정되어야한다. 예를 들어, 느린 성장 세포는 빠르게 성장하는 세포보다 긴 시간 동안 DC로 처리해야합니다.
주 : 셀이 너무 길면,이 단계에서의 치료를하는 경우, 그들은 유사 분열 슬립을 겪을 수 있으며 불가능 다음 단계에서 흔들림 차단하여 세포 분열을 수집하게 식기 표면에 부착. - 어에서 흔들림 오프 법에 의해 DC-체포 유사 분열 세포를 수집ICH 느슨하게 부착 유사 분열 세포는 원심 분리 플라스크 중간 세척 부드러운 진탕 (300 XG, 5 분)에 의해 수집된다. 이 단계에서 적절한 방법으로 세포 수를 계산합니다.
- 60mm 배양 접시에 수집 유사 분열 세포를 다시 시드 및 추가 3 일간 0.1 μg의 / ㎖의 DC와 세포를 치료. 세포의 10 % 미만이 처리를 견딜 수 있으므로, 접시 당 이상 1 × 10 6 세포 유사 분열을 시드.
- 마약없는 매체와 매체를 포함-DC를 교체하고 세포는 통상 1 주일 이내에 발생 확산을 재개 할 때까지 기다립니다.
- 마찬가지로 원래 이배체 세포 통로 세포.
DNA의 배수성 3. 시험
참고 :이 잘 설립 절차 및 기술 설명서는 자세한 절차 및 기술 도움말을 참조해야합니다.
- 수확 세포 (5 × 10 5 - 1 × 6) 솔루션 콘과 배양 세포에 의한37 ° C에서 10 분 동안 0.05 % 트립신 및 0.02 % EDTA를 이닝, 및 10 % FBS를 함유하는 배지에서 트립신을 중화.
- 매체에 원심 분리기 세포와 원심 분리 (300 XG, 5 분) 다음 인산염 완충 생리 식염수 5 ㎖ (PBS)에 재현 탁하여 그들을 씻는다.
- 다음 두 가지 방법 중 하나에 의해 DNA 분석을 위해 세포를 준비
- 고정되지 않은 셀 (10)을 분석하기위한 방법
주 :이 방법은 세포주기 분석을 위해 상업적으로 이용 가능한 키트를 사용하여 수행 될 수있다. 세포가 절차에 고정 핵이 시간이 지남에 따라 손상되어 염색되지 않기 때문에이 방법으로 제조 된 샘플은 즉시 분석되어야한다.- 250 MM의 자당을 함유하는 40 mM의 시트 레이트 버퍼와 세포를 씻으십시오. 이어서 실온에서 10 분 동안 250 mM의 자당을 함유하는 200 μL의 40 mM의 시트르산 완충액, 0.1 % (V / V)의 Nonidet P40, 30 μg의 / ㎖ 트립신 250 μL로 셀을 처리한다.
- 0.5 μg의 / ㎖의 트립신 INH의 200 μL를 추가실온에서 10 분 동안 ibitor 250 mM의 수크로오스를 포함하는 40 mM의 시트르산 완충액 0.1 μg의 / ㎖의 RNase A, 및 세포 배양한다.
- 0.4 mg을 200 μL를 추가 / 250 mM의 자당을 함유하는 40mm의 시트르산 완충액 ㎖의 프로피 디움 요오다 이드 (PI), 및 세포 핵을 염색을 실온에서 10 분 동안 세포를 배양한다.
- 고정 된 세포를 분석하기위한 방법
- 세포 현탁액을 혼합하고 실온에서 30 분 동안을 남기고 100 % EtOH로 적가 4㎖를 첨가, PBS 1 ㎖로 세포를 현탁하여 80 % 에탄올로 세포를 고정한다. 이 정착액의 셀은 여러 주 동안 -20 ℃에서 저장 될 수있다.
- PBS 5ml에 재현 탁하여이를 세포 씻어 원심 분리 (300 × g으로 5 분) 하였다. 0.5 ㎎ / ㎖의 RNase A의 세포를 취급를 50㎍ / ㎖의 프로피 디움 요오다 이드 (PI) (0.5 ㎎ / ㎖의 RNase (A)의 475 μL 1 ㎎을 25 μL / ㎖ PI)을 실온에서 30 분 동안로 얼룩.
- 고정되지 않은 셀 (10)을 분석하기위한 방법
- t의 DNA 함량을 분석그는 488 nm의 적색 레이저 발광 채널 필터로 유동 세포 계측기를 사용하여 세포 (긴> 내지 610 단계). 표적 세포의 배수성을 평가하는 동시에 정품 이배체 세포로부터 제조 된 기준 샘플을 분석한다.
- 대안 적으로, 이배체 세포 대 비드의 형광 강도의 비율을 평가하기 위해 표준 형광 비드를 추가한다. 사이토 단일 배체 세포와 이배체 세포 (11)의 덩어리를 구별하는 흐름의 옵션 '펄스 폭 대 펄스 높이'를 사용합니다.
염색체 수와 핵형 분석 4. 시험
참고 :이 모든 잘 확립 된 절차이며, 기술 매뉴얼 또는 제조사의 프로토콜 세부 절차 및 기술 도움말을 참조해야합니다.
- 중기 세포를 체포하기 위해 4 시간 동안 0.1 μg의 / ㎖의 DC와 함께 기하 급수적으로 증가 세포 치료.
- 염색체 슬라이드를 준비합니다.
- 트립신 처리하여 수확 세포 (적어도 5 × 10 5 세포)와 FBS를 포함하는 배지에서 일시 중지합니다.
- 배지에서 세포 원심 분리 (300 × g으로 5 분), 10 분 동안 37 ° C에서 저장성 용액 (0.075 M KCl을 5 mL)로 처리한다.
- 수정하고 Carnoy의 정착액 세포를 정지 (메탄올 : 아세트산 = 3 : 1).
- 세포 현탁액의 - (35 μL 25) 작은 볼륨을 드롭하여 유리 슬라이드에 세포를 확산. 이러한 뜨거운 증기에 노출되는 등의 추가 단계가 확산 염색체를 개선해야 할 수도 있습니다.
- 현장 하이브리드의 염색체 개수 또는 핵형 분석 또는 여러 가지 빛깔의 형광에 대한 얼룩 세포 (mFISH).
- 염색체 수가.
- 20 분 - 5 % 김사 솔루션 (또는 형광 현미경 0.5 ㎎ / ㎖의 RNase A를 포함하는 5 μg의 / ML의 PI) 15와 얼룩 세포.
- 디지털 적어도 50 중기 세포를 사진.
- 이미지 분석을 이용 softwa 셀당 염색체 수를 계산터치 및 사진 편집 소프트웨어를 사용하여 염색체 중복 설명서를 분리 한 후 다시. 염색체 번호를 수동으로 득점 할 수 있지만, 컴퓨터 채점하는 것이 좋습니다.
- 핵형 분석
참고 :이 분석은 숙련 된 기술자 또는 전문 회사가 수행해야합니다.- 표준 G 밴딩 기술 (12)에 따라 얼룩 세포.
- 표준 karyograms (12)를 만들기 위해 염색체를 분석합니다.
- mFISH
참고 :이 단계는 선택 사항이며 필요한 경우 수행해야합니다.- 제조 업체의 프로토콜 (13)에 따라 인간의 염색체에 대한 여러 가지 빛깔의 물고기 프로브를 사용하여 얼룩 세포.
- 적절한 필터를 사용하여 형광 현미경 분석 mFISH (13)를위한 소프트웨어를 사용하여 염색체 분석.
- 염색체 수가.
결과
우리의 경험에 의하면, TIG-1 세포 4 일 0.1 μg의 / mL의 DC (그림 2A)와 간단한 연속 처리에 의해 거의 완전히 배체 할 수있다. 대조적으로, 예 BJ 또는 IMR-90 및 TIG-HT 세포와 같은 다른 섬유 아세포 균주, 흔들림 오프 법에 의해 이배체 동일한 처리 다음 배체 집단, 및 유사 분열 세포의 분리 혼합물되었다이 과정에서 필요한 (- 치료 시작 후 18 시간 일반적으로 16) (도 2B, C) DC 치료. 3 일간 DC와 추가 처리 후, 세포 성장 체포를 시행하고 대형 전시, 며칠 동안 형태를 평평. 일반적으로 일주일 이내에, 작은 증식 세포는 큰 평평한 세포 사이 (그림 3) 나타났다. DC 처리 후 삼주 - 세포는 거의 완전히 배체 2가되었다. 설립 배체 세포 모달 염색체 번호 exce, 대부분의 경우 92이었다PT TIG-HT 세포로부터 설정된 배체 세포주 중 하나는 세포의 대부분 염색체 91 (도 4)를 가졌다. 설립 배체 세포는 이배체 세포와 거의 같은 속도 (그림 5)에서 성장했다. 불멸화 세포로부터 이들도 불멸 (도 5)가 될 듯하면서 않은 불멸화 세포로부터 확립 배체 세포주 원래 이배체 세포와 같은 거의 동일한 복제 성 수명을 나타내었다. 비 불후 TIG-1 세포에서 설립 배체 세포는 그림 6 (세포가 오히려 복잡한 클론 수차를 보였다 불후 TIG-1 (TIG-HT)에서 그 반면에하는 배체 염색체 수 (그림 6 상단 패널)을 갖는 제외하고 정상 핵형을 보였다 중간과 하단 패널). 후자 세포 클론 수차의 주파수 (TIG-HT-4N)는 PDL에 450 세포 당 5.2 수차 255 집단 배가 레벨 (의 PDL)으로 셀당 2.5 수차 증가반복 하위 문화와.
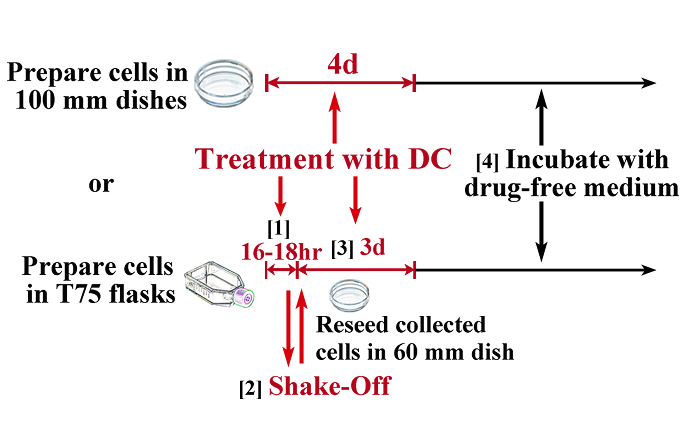
그림 1 : Tetraploidy의 유도를위한 프로토콜의 도식 그림. 일부 세포주 (예 : TIG-1) 연속 처리에 의해 거의 완전히 배체 될 수있는 반면 이배체 세포의 최소 오염과 배체 세포를 얻으려면, 유사 분열 흔들림 오프 및 DC 치료의 조합, 대부분의 세포주 (아래 그림)에 필요한 데메 콜신 (위 그림)와 함께. 유사 분열에서 셀을 체포 18 시간 (이 시간이 예비 실험에 의해 결정되어야한다) - 1) 16 0.1 μg의 / ㎖의 DC와 T75 플라스크 (적어도 5 × 10 6)에 세포를 치료. 2) 흔들림 오프 법에 의해 유사 분열 세포를 수집하고 60mm 배양 접시에 시드. 3) 추가로 3 일 동안 0.1 μg의 / ㎖의 DC와 세포를 치료. 4) 약물이없는 배지에서 세포 (일반적으로 셀 (P)를 다시 인큐베이션일주일 내 roliferation). 스케일 바는 100 μm의를 나타냅니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 2 : 전 섬유 아 세포와 Tetraploidy의 유도에 대한 치료 후 DNA 히스토그램. (A) TIG-1 세포. 이 세포주는 4 일 동안 0.1 μg의 / ㎖의 DC와 간단한 연속 처리하여 배체된다. (B) BJ 세포. 이 세포주는 DC (왼쪽 패널)와 간단한 치료 다음 배체 및 배체 집단의 혼합물이되기 때문에, 떨고에 의해 유사 분열 세포의 분리는 배체 세포 (오른쪽 패널)을 설정하기 위해 DC 치료 중 필요합니다. (C) TIG-HT 세포 (TIG-1, 텔로 머라 아제 - 불멸화). 이들 세포는 또한 빗살에 의해 제조 될 필요 DC 처리 및 흔들어 오프 배체 세포의 설립의 ination. 히스토그램의 숫자는 약 제거 후 시간 (일)을 나타냅니다. 횡축은 DNA 함량 (C 보체)을 나타낸다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 3 : DC로 치료 BJ 세포의 대표 현미경 사진. (A) BJ 세포는 16 시간 동안 0.1 μg의 / ㎖ DC로 처리 하였다. 유사 분열에서 체포 많은 세포를 볼 수 있습니다. (B) DC 치료의 끝. 거의 모든 세포 성장 체포. 칠일 DC 처리 후 (C). 큰 병합 된 셀 사이의 작은 증식 세포를 볼 수 있습니다. 십사일 DC 처리 후 (D). 세포는 활발하게 성장하고있다. e.com/files/ftp_upload/55028/55028fig3large.jpg "대상 ="_ 빈 ">이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 4 : 각 세포주에서 설립 배체 세포에 대한 염색체와 염색체 수의 히스토그램의 대표 현미경 사진. 최고, 중간과 하단 패널은 TIG-1에서 설립 배체 세포 (DC 처리 후 이주), BJ (2 주 후 DC 처리) 및 TIG-HT (DC 처리 후 7 주)는 각각 세포를 나타냅니다. 염색체는 적어도 50 중기 득점했다. 히스토그램의 숫자는 모달 염색체 숫자입니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
ftp_upload / 55028 / 55028fig5.jpg "/>
그림 5 : 인간 섬유 아세포 (이배체 세포)와 각 세포주에서 설립 배체 세포의 대표 성장 프로필. 왼쪽, 중앙, 오른쪽 패널은 원래 TIG-1의 성장 프로필을 보여, BJ와 TIG-HT 세포 (오픈 마커) 각각의 세포주에서 설립 배체 세포들은 (마커를 폐쇄). 세포는 일주일에 두 번 계대하고의 PDL은 세포 수를 계산 하였다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 6 : G-밴딩 및 mFISH에 의해 대표 Karyograms. 상단 패널은 TIG-1에서 설립 배체 세포 (DC 처리 후 이주)의 G-밴딩하여 karyogram을 보여줍니다. 중간과 하단 패널 표시TIG-HT 세포 (DC 치료 후 15, 41 주)에서 설립 배체 세포 mFISH에 의해 karyograms. 핵형 10 세포 (TIG-1) 또는 20 세포 (TIG-HT)에 기초 하였다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
토론
화학 약품에 의한 이배체 세포에서 tetraploidy의 유도에 큰 문제 중 하나 세포질 분열 억제제 또는 스핀들 억제제에 의해 세포가 종종 배체 및 배체 집단의 혼합물이 될 것입니다, 그리고 배체 세포는 이배체 세포로부터 분리해야합니다. 이배체 세포의 무료 배체 인구의 절연을위한 가장 일반적인 방법은 희석을 제한하여 FACS 또는 복제를 사용합니다. 그러나 이러한 과정은 힘들고 수행하기 쉽지 않다. 이 보고서에서 우리는 정상적인 인간의 섬유 아 세포에서 이배체 인구의 무료 증식 배체 세포를 확립 할 수있는 새로운 프로토콜을 제시한다. 이 프로토콜은 유사 분열에서 이배체 세포를 체포하기위한 스핀들 독 DC를 사용하고 접시 표면에 부착 이배체 간기 세포에서 떨이로 구분됩니다 유사 분열 세포를 체포했다. 수집 된 세포는 추가로 3 일간 DC로 처리되고, 유사 분열 이배체 세포는 아마도 DC B이 장기간 처리하여 G1 배체 세포로 변환Y 체크 포인트 적응 (또한 유사 분열 미끄러짐라고도 함). 이 세포는 약물 제거의 며칠 동안 성장 체포 후 배체 세포와 같은 세포 성장을 다시 시작합니다.
이 방법의 장점은 절차가 비교적 간단하고 FACS를 이용하거나 배체 세포를 분리하기 위해 복제와 비교 가능하다는 것이다. 방법의 한계는 다음과 같다. 이러한 상피 세포 등의 섬유 아 세포가 아닌 다른 세포 유형에 적용은 현재 알려져 있지 않다. 이는 향후 연구에서 확인해야합니다. 작은 이배체 인구는 경우에 남아있을 수 있습니다. 그러나, 이들 세포는 계대 직렬로 감소하는 경향이있다. 중요한 이배체 인구가 DC 치료, DC의 높은 농도 지속되면 (1.2-1.5 μg의 / ㎖) 또는 (4 일 대신 삼일의) 흔들림 오프 후 DC와 더 이상 치료 결과를 향상시킬 수 있습니다.
이 프로토콜에서 가장 중요한 단계는 다음과 같다. 우선, 용 DC와 처리 시간흔들림 오프하기 전에 유사 분열에서 셀을 rresting하는 것이 중요합니다. 이 처리 시간은 불가능 떨고하여 유사 분열 세포를 수집하게 식기 표면에 분열 미끄러짐 및 부착을 일으킬 수 너무 오랫동안 치료, 가능한 많은 유사 분열 세포를 수집하기 위해 충분히 있어야 않는다. 유사 분열 세포의 최대 복구를위한 적절한 시간은 표적 세포에 의존 할 수 있기 때문에, 예비적인 실험에 의해 결정되어야한다. 세포를 간기하는 것도 중요하다에서 두 번째로, 떨고 단계는 유사 분열 세포를 분리합니다. 이 단계에서 느슨하게 접시 표면에 부착 이배체 세포 분열, 원심 분리 플라스크 부드러운 흔들림에 의해 수집된다. 이 유사 분열 흔들림 오프 나중에 배체 인구에 의한 오염의 원인이 될 수 있습니다 접착 계면 세포로부터 DC에 의해 체포 유사 분열 세포를 분리한다. 또한 간기 세포의 박리 세포 손상 및 수있는 매체의 기포 발생의 원인이 심하게 진탕 R이배체 세포의 오염 esulting. 이러한 방법의 성공에 영향을 미칠 수있는 다른 인자는 배양 배지이다. 강력한 성장 자극 DC 처리 후의 증식의 회복에 필요한 것으로 보인다되므로, MEM-α와 같은 영양소가 풍부한 배지 배체 세포의 증식을 지원하기 위해 사용되어야한다. 배체 세포 (2.2.5)의 유도의 최종 단계에서 20 % FBS의 농도가 증가하면이 방법의 성공을 증가시킬 수있다.
이 프로토콜을 사용하여, 우리는 지금까지 인간 섬유 아세포 균주 TIG-1, BJ, IMR-90와 텔로 머라 제 - 불후 TIG-1 이제 14 ~ 16까지에서 배체 세포를 생산합니다. 4 일 동안, 흔들림 오프하지 않고, DC 연속적으로 처리 할 때이 세포 변형이 거의 완전히 배체되기 때문에 이들 세포주 중, TIG-1은 오히려 이례적인 일이다. 단 TIG-1 세포는 DC와 간단한 처리의 결과로서 완전히 배체 될 이유는 현재 알려져 있지 않다. 가능한 expla국가 배체 G1 단계에서 다른 유형의 체포 세포의 상당 부분이 DC로 처리하고 (1) TIG-1 세포 (2) 동일한 치료 G1에 체포, 또는하지 않는 반면, 치료 후 증식을 다시 시작할 때하는 것이 될 수 있습니다 TIG-1 세포의 인구는 비가 역적 같은 치료에서 G1에 체포 된 후 증식을 다시 시작되지 않습니다. 어떤 경우에, DC의 G1 체크 포인트의 상이한 민감도 DC 연속 처리 후의 세포의 다른 동작을 담당 할 수있다.
종양에서 tetraploidy의 병인 의의를 조사 할 때, 많은 연구자가 tetraploidy는 "tetraploidy 체크 포인트"라고한다 세포의 p53의 의존적 성장 정지를 유도하는 것이 제안되어 있기 때문에, 배체 세포에서 p53 유전자의 상태에 대해 큰 문제가 17-20. 이 가설이 올바른 경우 배체 세포 증식에서 p53의 시그널링은 불 활성화되어야한다. 하나,우리의 프로토콜에 의해 설립 배체 세포는 이배체 세포 (15, 16)와 거의 같은 속도로 성장에도 불구하고 기능 p53의를 갖고있는 것 같다. 이 차이에 대한 이유는 현재 알려져 있지 않고, 배체 세포의 증식에 p53의 불 활성화의 중요성은 향후 연구에서 정밀하게 조사해야한다. 사실, p53의를 통해 기능하는 tetraploidy 체크 포인트의 존재는 논란이 21-23 남아있다.
체외에서 전파 할 수 있습니다 비 형질 배수체 세포는 염색체 불안정과 배수체 세포의 발암 가능성에 대한 자세한 분석을 위해 필수 불가결하지만, 이러한 세포는 지금까지 거의 사용할 수 없었다. 우리 프로토콜 배수체 인간 세포의 형질 전환 선도 메커니즘을 연구하는데 유용한 모델이 될 수있는 정상적인 인간 섬유 아세포에서 세포 증식 배체를 확립하는 간단하고 실현 가능한 방법을 제공한다.
공개
저자는 더 경쟁 재정적 관심이 없음을 선언합니다.
감사의 말
We thank Mrs. Matsumoto for the technical assistance.
자료
| Name | Company | Catalog Number | Comments |
| MEM-α | Sigma-Aldrich | M8042-500ML | |
| Trypsin-EDTA | Sigma-Aldrich | T4174 | |
| FBS | Sigma-Aldrich | 172012-500ML | |
| Demecolcine solution (10 μg/mL in HBSS) | Sigma-Aldrich | D1925-10ML | |
| BD CycleTES Plus DNA Reagent Kits | BD Biosciences | #340242 | For examination of DNA ploidy by flow cytometry |
| Human chromosome multicolor FISH probe 24XCyte | MetaSystems | #D-0125-060-DI | Specialized filter set and software for mFISH analysis are necessary |
| Isis imaging system with mFISH software | MetaSystems | Specialized probe kit is necessary |
참고문헌
- Rabinovitch, P., et al. Predictors of progression in Barrett's esophagus III: baseline flow cytometric variables. Am. J. Gastroenterol. 96 (11), 3071-3083 (2001).
- Galipeau, P., et al. NSAIDs modulate CDKN2A, TP53, and DNA content risk for progression to esophageal adenocarcinoma. PLoS Med. 4 (2), e67 (2007).
- Olaharski, A., et al. Tetraploidy and chromosomal instability are early events during cervical carcinogenesis. Carcinogenesis. 27, 337-343 (2006).
- Liu, Y., et al. p53-independent abrogation of a postmitotic checkpoint contributes to human papillomavirus E6-induced polyploidy. Cancer Res. 67, 2603-2610 (2007).
- Davoli, T., de Lange, T. The causes and consequences of polyploidy in normal development and cancer. Annu Rev Cell Dev Biol. 27, 585-610 (2011).
- Fox, D., Duronio, R. Endoreplication and polyploidy: insights into development and disease. Development. 140, 3-12 (2013).
- Fujiwara, T., et al. Cytokinesis failure generating tetraploids promotes tumorigenesis in p53-null cells. Nature. 437, 1043-1047 (2005).
- Ganem, N., et al. Cytokinesis failure triggers hippo tumor suppressor pathway activation. Cell. 158 (4), 833-848 (2014).
- Kuznetsova, A., et al. Chromosomal instability, tolerance of mitotic errors and multidrug resistance are promoted by tetraploidization in human cells. Cell cycle. 14 (17), 2810-2820 (2015).
- Vindeløv, L., Christensen, I. Detergent and proteolytic enzyme-based techniques for nuclear isolation and DNA content analysis. Methods Cell Biol. 41, 219-229 (1994).
- Darzynkiewicz, Z., Juan, G. DNA content measurement for DNA ploidy and cell cycle analysis. Curr Protoc Cytom. , Chapter 7: Unit 7.5 (2001).
- Knutsen, T., Bixenman, H., Lawce, H., Martin, P. Chromosome analysis guidelines preliminary report. Cancer Genet Cytogenet. 52 (1), 11-17 (1991).
- Liehr, T., et al. Multicolor FISH probe sets and their applications. Histol. Histopathol. 19 (1), 229-237 (2004).
- Ohshima, S., Seyama, A. Formation of bipolar spindles with two centrosomes in tetraploid cells established from normal human fibroblasts. Hum. Cell. 25 (3), 78-85 (2012).
- Ohshima, S., Seyama, A. Establishment of proliferative tetraploid cells from normal human fibroblasts. Front. Oncol. 3, 198 (2013).
- Ohshima, S., Seyama, A. Establishment of proliferative tetraploid cells from telomerase-immortalized normal human fibroblasts. Genes, Chromosome Cancer. 55 (6), 522-530 (2016).
- Di Leonardo, A., et al. DNA rereplication in the presence of mitotic spindle inhibitors in human and mouse fibroblasts lacking either p53 or pRb function. Cancer Res. 57, 1013-1019 (1997).
- Andreassen, P., Lohez, O., Lacroix, F., Margolis, R. Tetraploid state induces p53-dependent arrest of nontransformed mammalian cells in G1. Mol. Biol. Cell. 12, 1315-1328 (2001).
- Vogel, C., et al. Crosstalk of the mitotic spindle assembly checkpoint with p53 to prevent polyploidy. Oncogene. 23, 6845-6853 (2004).
- Aylon, Y., Oren, M. p53: Guardian of ploidy. Mol. Oncol. 5 (4), 315-323 (2011).
- Uetake, Y., Sluder, G. Cell cycle progression after cleavage failure : mammalian somatic cells do not possess a "tetraploidy checkpoint". J. Cell Biol. 165, 609-615 (2004).
- Ganem, N., Pellman, D. Limiting the proliferation of polyploid cells. Cell. 131, 437-440 (2007).
- Ho, C., Hau, P., Marxer, M., Poon, R. The requirement of p53 for maintaining chromosomal stability during tetraploidization. Oncotarget. 1 (7), 583-595 (2010).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유