Method Article
Gründung der proliferativen Tetraploid Zellen aus nicht-transformierten menschlichen Fibroblasten
In diesem Artikel
Zusammenfassung
Although proliferative polyploid cells are necessary to analyze chromosomal instability of polyploid cells, creating such cells from nontransformed human cells is not easy. The present report describes relatively simple procedures to establish proliferative tetraploid cells free of a diploid population from normal human fibroblasts.
Zusammenfassung
Polyploid (mostly tetraploid) cells are often observed in preneoplastic lesions of human tissues and their chromosomal instability has been considered to be responsible for carcinogenesis in such tissues. Although proliferative polyploid cells are requisite for analyzing chromosomal instability of polyploid cells, creating such cells from nontransformed human cells is rather challenging. Induction of tetraploidy by chemical agents usually results in a mixture of diploid and tetraploid populations, and most studies employed fluorescence-activated cell sorting or cloning by limiting dilution to separate tetraploid from diploid cells. However, these procedures are time-consuming and laborious. The present report describes a relatively simple protocol to induce proliferative tetraploid cells from normal human fibroblasts with minimum contamination by diploid cells. Briefly, the protocol is comprised of the following steps: arresting cells in mitosis by demecolcine (DC), collecting mitotic cells after shaking off, incubating collected cells with DC for an additional 3 days, and incubating cells in drug-free medium (They resume proliferation as tetraploid cells within several days). Depending on cell type, the collection of mitotic cells by shaking off might be omitted. This protocol provides a simple and feasible method to establish proliferative tetraploid cells from normal human fibroblasts. Tetraploid cells established by this method could be a useful model for studying chromosome instability and the oncogenic potential of polyploid human cells.
Einleitung
Polyploidie wurde in spezialisierten Geweben von Säugetieren nicht nur beobachtet, sondern auch in einer Vielzahl von pathologischen Zuständen, wie Krebs und degenerativen Erkrankungen. Polyploiden (meist tetraploid) Zellen werden oft in präneoplastischen Läsionen des menschlichen Geweben beobachtet, wie Barrett-Ösophagus 1,2 oder Plattenepithelkarzinom intraepitheliale Läsionen des Gebärmutterhalses 3,4, und wurden als die Quelle für maligne aneuploid Zellen in diesen Geweben auf 5 , 6. Obwohl vorgeschlagen wird, dass zur Aneuploidzellen Umwandlung von tetraploiden ein entscheidendes Ereignis in den frühen Stadien der Tumorgenese sein könnte, die an diesem Prozess beteiligten Mechanismen sind nicht vollständig verstanden. Dies ist zum Teil , weil keine in - vitro - Modell verfügbar ist , wo nicht - transformierten polyploid menschlichen Zellen ausbreiten kann.
Einige Forscher haben induzierte Tetraploidie in nicht-transformierten menschlichen Epithelzellen durch Erzeugung von zweikerniger Zellen durch Einwibiting cytokinesis 7-9. In diesem Verfahren muß jedoch unnötige diploiden Zellen durch fluoreszenzaktivierte Zellsortierung (FACS) eliminiert werden 7,8 oder Klonierung durch limitierende Verdünnung 9. Da diese Verfahren mühsam und nicht leicht durchzuführen sind, einfacherer Methoden nicht transformierten tetraploiden Zellen zu etablieren sind für die Forschung auf diesem Gebiet erwünscht.
Im vorliegenden Bericht beschreiben wir ein Protokoll proliferative tetraploiden Zellen von normalen humanen Fibroblasten oder Telomerase-immortalisierten humanen Fibroblasten durch relativ einfache Verfahren zu etablieren. Die Verfahren verwenden Spindelgift Demecolcin (DC) diploiden Zellen in der Mitose und mitotischen Zellen durch Abschütteln gesammelt zu verhaften werden weiter mit DC behandelt. Diploide mitotischen mit DC behandelten Zellen für eine längere Zeit zu tetraploiden G1 Zellen umwandeln, und diese Zellen vermehren als tetraploiden Zellen nach Wachstumsstopp für mehrere Tage nach der Arzneimittelentfernung. Dieses Protokoll siehtein effizientes Verfahren ein nützliches Modell für die Erstellung der Beziehung zwischen Chromosom Instabilität und dem onkogenen Potential der polyploiden menschlichen Zellen zu untersuchen.
Protokoll
1. Zellkultur
- Besorgen Sie sich die Zellen Tetraploidie zu induzieren. Bis heute bestätigt worden, daß diese Technik auf die menschliche Fibroblasten-Zelllinien-TIG 1 angewendet werden kann, BJ, IMR-90 und Telomerase immortalisiert TIG-1 (TIG-HT).
- Wachsen Zellen in minimalem essentiellem Medium mit α Änderung oder jede andere Zellkulturmedium für den Zelltyp geeignet, um mit 10% (v / v) hitzeinaktiviertem fötalem Rinderserum (FBS) ergänzt, untersucht werden, indem in einem 5% (v Inkubieren / v) CO 2 -Atmosphäre bei 37 ° C. Passage-Zellen alle 3 oder 4 Tage nicht subkonfluenten Dichte zu überschreiten.
HINWEIS: Verdopplung der Population Ebene (PDL) sollte jedes Mal bei Passagierung berechnet werden, um Zellwachstum und die Zell Alter zu bewerten. PDL kann bei der nächsten Passagierung (N2) mit der folgenden Formel (X ist die anfängliche PDL) geerntet aus der Zellzahl ausgesät in eine Schale (N1) und der Zellzahl berechnet werden. PDL = X + (N1 log - log N2) / log 2
2. Induktion und Estaaufbau von Tetraploid Zellen aus diploiden Fibroblasten
- Induce Tetraploidie ohne shake-off.
ANMERKUNG: Manche Zellstämme (zB TIG-1) nahezu vollständig tetraploid durch kontinuierliche Behandlung wird mit Demecolcin (DC) folgendermaßen.- Passage-Zellen in eine oder zwei 100 mm-Schalen am Tag vor der Behandlung Tetraploidie zu induzieren. Normalerweise bereiten 5 x 10 5 bis 1 x 10 6 Zellen pro Schale für die Induktion von tetraploiden Zellen.
- Behandeln Sie exponentiell wachsenden Zellen mit Medium, das 0,1 ug / ml DC für 4 Tage.
- Ersetzen DC-haltigem Medium mit arzneimittelfreiem Medium und Inkubation Zellen in einem 5% (v / v) CO 2 -Atmosphäre bei 37 ° C. Die Zellen wieder aufnehmen in der Regel Proliferation innerhalb 1 Woche.
- Induce Tetraploidie mit Shake-off.
HINWEIS: Die meisten Zellen werden eine Mischung aus diploid und tetraploid Populationen als Ergebnis der einfachen Behandlung mit DC oben beschrieben (2.1). Daher einige Modifikationen des pERFAHREN zu eliminieren eine diploide Population notwendig sind wie folgt (1).- Passage-Zellen in mehrere T75-Flaschen am Tag vor der Behandlung Tetraploidie zu induzieren. Üblicherweise Vorbereitung mindestens 5 x 10 6 Zellen (1 x 10 6 Zellen pro Kolben) für die Induktion von tetraploiden Zellen.
- Behandeln Sie exponentiell wachsenden Zellen mit Medium, das 0,1 ug / ml DC 16 - 18 Uhr Zellen in der Mitose zu verhaften. Die Zeit, die Zellen in der Mitose zu verhaften können auf Zielzellen abhängen und sollte durch Vorversuche ermittelt werden, wie viele mitotische Zellen wie möglich zu erhalten. Zum Beispiel langsamer sollte wachsende Zellen mit DC werden für längere Zeit behandelt als schneller wachsende Zellen.
HINWEIS: Wenn Zellen in diesem Schritt zu lange behandelt werden, könnten sie mitotischen Schlupf zu unterziehen und mit der Geschirroberfläche anhaften, wodurch es unmöglich mitotischen Zellen durch shake-off in der nächsten Stufe zu sammeln. - Sammeln Sie DC-verhaftete mitotischen Zellen durch die shake-off-Verfahren, in which lose anhaftenden mitotischen Zellen werden durch vorsichtiges Schütteln der Flaschen und Waschen mit Medium durch Zentrifugation (300 xg, 5 min) gesammelt, gefolgt. Zählen der Zellzahl durch ein geeignetes Verfahren in diesem Schritt.
- Reseed gesammelt mitotischen Zellen in 60 mm Kulturschalen und Behandlung von Zellen mit 0,1 ug / ml DC für weitere 3 Tage. Samen mehr als 1 x 10 6 mitotischen Zellen pro Schale, da weniger als 10% der Zellen können diese Behandlung überleben.
- Ersetzen Sie DC-haltiges Medium mit drogenfreien Medium und warten Zellen-Proliferation fortzusetzen, die in der Regel innerhalb von 1 Woche auftritt.
- Passage-Zellen ähnlich ursprünglichen diploiden Zellen.
3. Prüfung der DNA-Ploidie
Hinweis: Dies ist ein gut etabliertes Verfahren und ein technisches Handbuch sollte für detaillierte Verfahren und technische Tipps bezeichnet werden.
- Ernte Zellen (5 x 5 bis 01 Oktober x 10 6) durch Inkubieren von Zellen mit einer Lösung conenthaltenden 0,05% Trypsin und 0,02% EDTA bei 37 ° C für 10 min, und zu neutralisieren Trypsin durch Medium mit 10% FBS.
- Zentrifugen Zellen in Medium und sie zu waschen, indem in 5 ml phosphatgepufferter Kochsalzlösung (PBS), gefolgt von Zentrifugation (300 xg, 5 min) Resuspendieren.
- Bereiten Zellen für die DNA-Analyse durch eine der folgenden beiden Methoden
- Verfahren zum Analysieren von unfixierten Zellen 10
Hinweis: Dieses Verfahren kann unter Verwendung eines handelsüblichen Kits für die Zellzyklus-Analyse durchgeführt werden. Die Proben mit diesem Verfahren hergestellten sollten sofort untersucht werden, da die Zellen in dem Verfahren nicht fixiert sind und gefärbten Kerne werden im Laufe der Zeit beschädigt werden.- Wasche die Zellen mit 40 mM Citrat-Puffer, enthaltend 250 mM Saccharose. Anschließend behandeln Zellen mit 250 & mgr; l von 0,1% (v / v) Nonidet P40 und 30 ug / ml Trypsin in 200 & mgr; l von 40 mM Citrat-Puffer, enthaltend 250 mM Sucrose für 10 min bei Raumtemperatur.
- In 200 ul 0,5 ug / ml Trypsin Einwibitor und 0,1 ug / ml RNase A in 40 mM Citrat-Puffer, enthaltend 250 mM Saccharose, und Inkubieren Zellen für 10 min bei Raumtemperatur.
- Mit 200 & mgr; l von 0,4 mg / ml Propidiumiodid (PI) in 40 mM Citrat-Puffer, enthaltend 250 mM Saccharose, und Inkubieren Zellen für 10 min bei Raumtemperatur Zellkerne anzufärben.
- Verfahren zur Analyse von fixierten Zellen
- Fix-Zellen mit 80% Ethanol durch Zellen in 1 ml PBS, Zugabe von 4 ml 100% EtOH tropfenweise unter Mischen der Zellsuspension und lassen es bei Raumtemperatur für 30 min suspendiert. Zellen in dieser Fixiermittel kann bei -20 ° C für mehrere Wochen gelagert werden.
- Wash-Zellen, indem sie in 5 ml PBS resuspendiert, gefolgt von Zentrifugation (300 · g, 5 min). Behandlung von Zellen, die mit 0,5 mg / ml RNase A und färben sie mit 50 ug / ml Propidiumjodid (PI) (475 & mgr; l von 0,5 mg / ml RNase A und 25 ul 1 mg / ml PI) für 30 min bei Raumtemperatur.
- Verfahren zum Analysieren von unfixierten Zellen 10
- Analyse des DNA-Gehalts von ter Zellen, die ein Durchflusszytometer mit einem 488-nm-Laser und roten Kanal Emissionsfilter (long pass> 610 nm). Analysieren einer Referenzprobe, die aus echten diploiden Zellen zugleich Ploidie der Zielzellen abzuschätzen.
- Alternativ Fluoreszenzstandard Perlen fügen Sie die Fluoreszenzintensität Verhältnis von diploiden Zellen im Vergleich zu den Perlen zu bewerten. Verwenden Sie die "Impulshöhe vs. Impulsbreite 'Option des Durchflusszytometer zwischen einzelnen tetraploiden Zellen und Klumpen von diploiden Zellen 11 zu unterscheiden.
4. Prüfung der Chromosome Grafen und Karyotypanalyse
HINWEIS: Diese sind alle gut etablierte Verfahren und ein technisches Handbuch oder den Protokollen des Herstellers sollten für detaillierte Verfahren und technische Tipps bezeichnet werden.
- Behandeln Sie exponentiell wachsenden Zellen mit 0,1 ug / ml DC 4 h Zellen in Metaphase zu halten.
- Bereiten Sie Chromosom Dias.
- Ernte Zellen (mindestens 5 x 10 5 Zellen) durch Trypsinisierung und suspendieren in Medium FBS enthält.
- Zentrifugenzellen in Medium (300 × g, 5 min) und behandle mit hypotonischer Lösung (5 ml 0,075 M KCl) bei 37 ° C für 10 min.
- Fix und suspendieren Zellen in Carnoy-Fixiermittel (Methanol: Essigsäure = 3: 1).
- Breiteten Zellen auf einen Glasträger durch ein kleines Volumen Tropft (25 - 35 & mgr; l) der Zellsuspension. Zusätzliche Schritte, wie beispielsweise Einwirkung von heißem Dampf erforderlich sein Chromosom zu verbessern verbreiten.
- Stain - Zellen für die Chromosomenzahl oder Karyotypanalyse oder mehrfarbige Fluoreszenz - in - situ - Hybridisierung (MFISH).
- Chromosome zählt.
- Stain Zellen mit 5% Giemsa-Lösung (oder 5 & mgr; g / ml PI, enthaltend 0,5 mg / ml RNase A für Fluoreszenzmikroskopie) für 15 - 20 min.
- Digital fotografieren mindestens 50 Metaphase-Zellen.
- Graf Chromosomenzahl pro Zelle, die eine Bildanalyse softwa mitre nach einer manuellen Trennung von berühren und überlappende Chromosomen mit einer Bildbearbeitungssoftware. Obwohl kann Chromosomenzahl manuell bewertet werden, ist EDV-Scoring empfohlen.
- Karyotypanalyse
HINWEIS: Diese Analyse sollte von einem Fachmann oder einer professionellen Firma durchgeführt werden.- Stain Zellen nach einem Standard G-Banding - Technik 12.
- Analysieren Chromosomen Standard Karyogramme 12 machen.
- MFISH
Hinweis: Dieser Schritt ist optional und sollte bei Bedarf durchgeführt werden.- Stain Zellen unter Verwendung von Mehrfarben - FISH - Sonden für menschliche Chromosomen gemäß dem Herstellerprotokoll 13.
- Analysieren Chromosomen eines Fluoreszenzmikroskops mit geeigneten Filtern und eine Software zur MFISH Analyse 13.
- Chromosome zählt.
Ergebnisse
In unserer Erfahrung können TIG-1 - Zellen für 4 Tage (2A) fast vollständig tetraploid durch einfache kontinuierliche Behandlung mit 0,1 & mgr; g / mL DC erfolgen. Im Gegensatz dazu sind andere Fibroblasten-Stämme, wie BJ oder IMR-90 und TIG-HT-Zellen, wurde ein Gemisch aus diploid und tetraploid Populationen nach der gleichen Behandlung, und zur Isolierung von mitotischen Zellen von der shake-off-Verfahren ist notwendig, während des Verlaufs Gleichbehandlung ( in der Regel 16 bis 18 h nach dem Beginn der Behandlung) (Abbildungen 2B, C). Nach einer zusätzlichen Behandlung mit DC für 3 Tage unterzogen Zellen Wachstumsarrest und zeigten große abgeflachte Morphologie für mehrere Tage. Innerhalb einer Woche in der Regel kleine proliferierenden Zellen erschienen unter den großen abgeflachten Zellen (Abbildung 3). Die Zellen wurden in 2 fast vollständig tetraploiden - 3 Wochen nach der Gleichbehandlung. Die modale Chromosomenzahl in den etablierten tetraploiden Zellen war 92 in den meisten Fällen except , dass einer der tetraploiden etablierte Zellinien von TIG-hT Zellen hatten 91 - Chromosomen in der Mehrzahl der Zellen (Abbildung 4). Gegründet tetraploiden Zellen wuchsen in fast der gleichen Rate wie diploiden Zellen (Abbildung 5). Tetraploide Zelllinien von nicht-immortalisierten Zellen etabliert zeigte eine annähernd gleiche replikativen Lebensdauer wie die ursprünglichen diploiden Zellen, während diejenigen , die aus immortalisierten Zellen schienen auch unsterblich (Abbildung 5) zu sein. Tetraploid Zellen etabliert aus nicht unsterblich gemacht WIG-1 - Zellen zeigte einen normalen Karyotyp mit Ausnahme einer tetraploiden Chromosomenzahl (Abbildung 6 oberes Feld) aufweist, während die von verewigt WIG-1 (WIG-HT) Zellen zeigten ziemlich komplizierte klonalen Aberrationen (Abbildung 6 Mittel- und Bodenplatten). Die Häufigkeit der klonalen Aberrationen in den letzteren Zellen (TIG-HT-4n) bei 255 Populationsverdopplungsstufen (PDLs) 2,5 Aberrationen pro Zelle erhöht auf 5,2 Aberrationen pro Zelle bei 450 PDLmit wiederholten Subkultur.
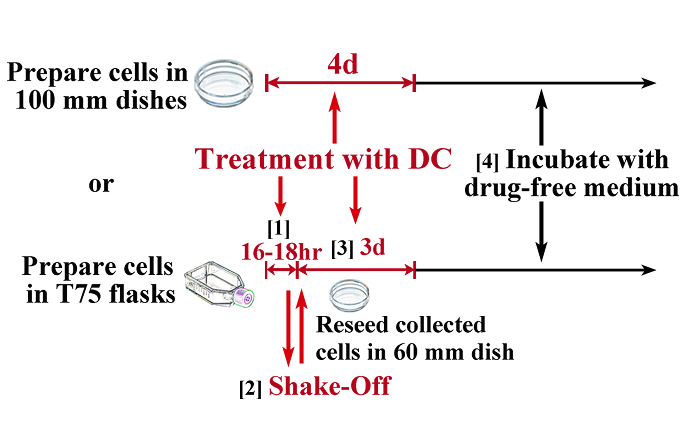
Abbildung 1: Schematische Darstellung des Protokolls für die Induktion von Tetraploidie. Zu erhalten tetraploiden Zellen mit minimaler Kontamination von diploiden Zellen, einer Kombination von mitotischen shake-off und DC Behandlung notwendig ist für die meisten Zellstämme (untere Abbildung), während einige Zellstämme (zB TIG-1) durch eine kontinuierliche Behandlung fast vollständig tetraploid werden kann mit Demecolcin (obere Abbildung). 1) Behandeln Zellen in T75 - Kolben (mindestens 5 x 10 6) mit 0,1 & mgr; g / ml DC für 16 bis 18 Stunden (Zeit sollte durch Vorversuche ermittelt werden) Zellen in der Mitose zu verhaften. 2) sammeln mitotischen Zellen durch die shake-off-Methode und reseed in 60 mm Kulturschalen. 3) Behandeln Zellen mit 0,1 & mgr; g / ml DC für weitere 3 Tage. 4) inkubieren Zellen in drogenfreien Medium (in der Regel Zellen wieder aufnehmen proliferation innerhalb von 1 Woche). Maßstabsbalken repräsentieren 100 & mgr; m. Bitte klicken Sie hier , um eine größere Version dieser Figur zu sehen.

Abbildung 2: DNA - Histogramme von Fibroblasten Vor und nach den Behandlungen für die Induktion von Tetraploidie. (A) TIG-1 - Zellen. Diese Zellstamm wird durch einfache kontinuierliche Behandlung mit 0,1 ug / ml DC für 4 Tage tetraploiden. (B) BJ - Zellen. Da diese Zellstamm eine Mischung aus diploiden und tetraploiden Populationen folgende einfache Behandlung mit DC (linke Felder) wird die Isolierung von mitotischen Zellen durch abzuschütteln ist bei DC Behandlung notwendig tetraploiden Zellen (rechte Felder) zu etablieren. (C) TIG-hT (Telomerase-immortalisierten TIG-1 - Zellen). Diese Zellen müssen auch von einem Kamm vorbereitet werden nierung von DC Behandlung und shake-off für die Errichtung von tetraploiden Zellen. Die Ziffern in den Histogrammen repräsentieren die Zeit (Tage) nach der Arzneimittelentfernung. Die Abszisse stellt den DNA-Gehalt (C, Komplement). Bitte klicken Sie hier , um eine größere Version dieser Figur zu sehen.

Abbildung 3: Repräsentative Mikroskopische Aufnahmen von BJ Zellen , die mit DC behandelt. (A) BJ - Zellen mit 0,1 & mgr; g / mL DC für 16 h behandelt. Viele Zellen in der Mitose festgehalten zu sehen. (B) Das Ende der DC - Behandlung. Fast alle Zellen sind wachstums verhaftet. (C) 7 Tage nach der Gleichbehandlung. Kleine proliferierenden Zellen bei großen abgeflachten Zellen gesehen werden kann. (D) 14 Tage nach der DC - Behandlung. Die Zellen wachsen aktiv. e.com/files/ftp_upload/55028/55028fig3large.jpg "target =" _ blank "> Bitte hier klicken, um eine größere Version dieser Figur zu sehen.

Abbildung 4: Repräsentative Mikroskopische Aufnahmen von Chromosome und Histogramme der Chromosomenzahl für Tetraploid Zellen aus jeder Zellstamm etabliert. Top, mittleren und unteren Platten repräsentieren tetraploiden etablierte Zellen aus TIG-1 (2 Wochen nach der DC-Behandlung), BJ (2 Wochen nach der DC-Behandlung) und WIG-ht (7 Wochen nach der Gleichbehandlung) Zellen sind. Chromosome wurden in mindestens 50 Metaphasen erzielt. Die Ziffern in Histogramme sind modale Chromosomenzahlen. Bitte klicken Sie hier , um eine größere Version dieser Figur zu sehen.
ftp_upload / 55028 / 55028fig5.jpg "/>
Abbildung 5: Repräsentative Wachstumsprofile der menschlichen Fibroblasten (diploiden Zellen) und Tetraploid Zellen aus jeder Zellstamm etabliert. Links, Mitte und rechts Tafeln zeigen Wachstumsprofile von Original-TIG-1, BJ und WIG-HT- Zellen (offene Marker) und denen der tetraploiden Zellen aus jeder Zellstamm etabliert (geschlossen Marker). Die Zellen wurden zweimal wöchentlich passagiert und PDLs wurden aus Zellzahlen berechnet. Bitte klicken Sie hier , um eine größere Version dieser Figur zu sehen.

Abbildung 6: Repräsentative Karyogramme durch G-Banding und MFISH. Top-Panel zeigt eine Karyogramm von G-Banding von tetraploiden Zellen etabliert aus TIG-1 (2 Wochen nach der Gleichbehandlung). Mittel- und Bodenplatten zeigenKaryogramme von MFISH für tetraploiden Zellen etabliert aus TIG-HT- Zellen (15 und 41 Wochen nach der Gleichbehandlung). Karyotypen wurden anhand von 10 Zellen (TIG-1) oder 20-Zellen (TIG-HT). Bitte klicken Sie hier , um eine größere Version dieser Figur zu sehen.
Diskussion
Ein Hauptproblem bei der Induktion von Tetraploidie von diploiden Zellen, die durch chemische Mittel, entweder durch Zytokinese Inhibitoren oder durch Spindelinhibitoren, ist, dass die Zellen häufig eine Mischung aus diploide und tetraploide Populationen werden und tetraploiden Zellen müssen von diploiden Zellen getrennt werden. Die häufigsten Ansätze zur Isolierung einer tetraploiden Bevölkerung verwenden frei von diploiden Zellen FACS oder Klonierung durch limitierende Verdünnung. Jedoch sind diese Verfahren mühsam und nicht leicht durchzuführen. In diesem Bericht präsentieren wir ein neues Protokoll proliferative tetraploiden Zellen frei von einer diploiden Population von normalen menschlichen Fibroblasten zu etablieren. Das Protokoll verwendet Spindelgift DC für diploiden Zellen in der Mitose festzunehmen, und mitotischen Zellen verhaftet werden durch Ausschütteln-off von diploiden Interphase-Zellen getrennt, die mit der Geschirroberfläche haftete. Gesammelten Zellen werden für zusätzliche 3 Tage mit DC behandelt und diploid mitotischen Zellen umwandeln tetraploid G1-Zellen durch diese verlängerten DC Behandlung vermutlich by Kontrollpunkt Anpassung (auch mitotische Schlupf genannt). Diese Zellen neu starten, das Zellwachstum als tetraploiden Zellen nach Wachstumsstopp für mehrere Tage von Drogenentfernung.
Ein Vorteil dieses Verfahrens besteht darin, dass die Verfahren sind relativ einfach und durchführbar ist, verglichen mit denen unter Verwendung von FACS oder Klonierung von tetraploiden Zellen zu isolieren. Einschränkungen des Verfahrens sind die folgenden. Anwendbarkeit auf andere Zelltypen als Fibroblasten, wie Epithelzellen, ist zurzeit nicht bekannt. Dies sollte in zukünftigen Studien bestätigt werden. Eine kleine diploiden Bevölkerung könnte in einigen Fällen bleiben. Allerdings neigen diese Zellen mit seriellen Passagierung zu verringern. Wenn eine signifikante diploide Population bleibt nach Gleichbehandlung, einer höheren Konzentration von DC (1,2 bis 1,5 g / ml) oder eine längere Behandlung mit DC nach dem Shake-off (4 Tage statt 3 Tage) könnte das Ergebnis verbessern.
Die kritischsten Schritte in diesem Protokoll sind folgende. Erstens für eine mit GleichbehandlungszeitZellen in der Mitose vor shake-off rresting ist kritisch. Dies sollte zwar die Behandlungszeit lang genug sein, so viele mitotische Zellen wie möglich zu sammeln, zu lange Behandlung könnte mitotischen Schlupf und die Haftung an der Geschirroberfläche verursachen, so dass es unmöglich ist, die mitotischen Zellen Abschütteln zu sammeln. Weil eine angemessene Zeit für die maximale Rückgewinnung von mitotischen Zellen auf den Zielzellen abhängt, sollte es durch Vorversuche ermittelt werden. Zweitens, um das Abschütteln Schritt mitotischen Zellen getrennt von Zellen der Interphase auch kritisch ist. In diesem Schritt diploid mitotische Zellen, die mit der Geschirroberfläche lose anhaften, werden durch vorsichtiges Schütteln der durch Zentrifugation gefolgt Kolben gesammelt. Diese mitotischen shake-off trennt mitotischen durch DC arretierten Zellen vom anhaftenden Interphase-Zellen, die den Ursprung der Verschmutzung durch die diploide Population später sein könnte. Schütteln heftig sprudelnden des Mediums führen kann, die Zellen schädigen könnten, und auch Ablösung von Interphase-Zellen, resulting in Kontamination von diploiden Zellen. Ein weiterer Faktor, der den Erfolg dieser Methode beeinflussen kann, ist das Kulturmedium. Da ein robustes Wachstum Stimulation für die Gewinnung von Proliferation nach DC Behandlung, nährstoffreiche Medium wie MEM-α notwendig zu sein scheint, sollte die Proliferation von tetraploiden Zellen zu unterstützen verwendet werden. Eine Erhöhung FBS Konzentration auf 20% im letzten Schritt der Induktion von tetraploiden Zellen (2.2.5) könnte auch den Erfolg dieser Methode zu erhöhen.
Unter Verwendung dieses Protokolls, haben wir bisher von den menschlichen Fibroblasten - Stämme tetraploiden Zellen produziert WIG-1, BJ, IMR-90 und Telomerase-immortalisierten WIG-1 bisher 14-16. Unter diesen Zellstämme, ist TIG-1 eher ungewöhnlich, da diese Zellstamm fast vollständig tetraploiden wird, wenn sie kontinuierlich mit DC behandelt, ohne shake-off, für 4 Tage. Der Grund, warum nur TIG-1-Zellen mit DC als Ergebnis einer einfachen Behandlung vollständig tetraploid werden, ist derzeit unbekannt. Mögliche explanationen könnte, dass bei diploiden G1 Phase ein signifikanter Anteil der Zellen anderer Typen Verhaftungs sein, wenn sie mit DC behandelt und wieder Proliferation nach der Behandlung, während (1) TIG-1-Zellen in G1 nicht mit der gleichen Behandlung arretieren, oder (2) a Bevölkerung von TIG-1-Zellen hemmt irreversibel bei G1 unter der gleichen Behandlung und nicht fortgesetzt Proliferation danach. In jedem Fall könnten unterschiedliche Empfindlichkeiten des G1-Checkpoint zu DC für das unterschiedliche Verhalten der Zellen nach der kontinuierlichen Behandlung mit DC verantwortlich.
Wenn das ätiologische Bedeutung Tetraploidie in Tumorigenese Untersuchung viele Forscher haben große Bedenken über den Zustand des p53-Gens in tetraploide Zellen, da vorgeschlagen wurde, dass Tetraploidie p53-abhängige Wachstumsstillstand von Zellen induziert, die die "Tetraploidie checkpoint" bezeichnet wird 17-20. Wenn diese Hypothese richtig ist, p53 Signal tetraploiden Zellen in proliferierenden sollte inaktiviert werden. Aber,tetraploiden durch unser Protokoll etablierte Zellen scheinen in fast der gleichen Rate wie diploiden Zellen trotz des wachsenden 15,16 funktionellen p53 zu haben. Der Grund für diese Diskrepanz ist derzeit nicht bekannt, und die Bedeutung des p53-Inaktivierung in der Proliferation von tetraploiden Zellen sollten genau in zukünftigen Studien untersucht werden. In der Tat, dass die Anwesenheit eines Tetraploidie Kontrollpunkt durch p53 fungiert , bleibt umstritten 21-23.
Obwohl nicht transformierten polyploid Zellen , die in vitro ausbreiten kann für eine detaillierte Analyse der chromosomalen Instabilität und das onkogene Potential von polyploiden Zellen unentbehrlich sind, haben solche Zellen bisher nur selten zur Verfügung. Unser Protokoll bietet eine einfache und praktikable Methode proliferative tetraploiden Zellen von normalen humanen Fibroblasten zu etablieren, das führt zu Transformation von polyploid menschlichen Zellen ein nützliches Modell für die Untersuchung der Mechanismen sein könnte.
Offenlegungen
Die Autoren erklären, dass sie keine finanziellen Interesse haben.
Danksagungen
We thank Mrs. Matsumoto for the technical assistance.
Materialien
| Name | Company | Catalog Number | Comments |
| MEM-α | Sigma-Aldrich | M8042-500ML | |
| Trypsin-EDTA | Sigma-Aldrich | T4174 | |
| FBS | Sigma-Aldrich | 172012-500ML | |
| Demecolcine solution (10 μg/mL in HBSS) | Sigma-Aldrich | D1925-10ML | |
| BD CycleTES Plus DNA Reagent Kits | BD Biosciences | #340242 | For examination of DNA ploidy by flow cytometry |
| Human chromosome multicolor FISH probe 24XCyte | MetaSystems | #D-0125-060-DI | Specialized filter set and software for mFISH analysis are necessary |
| Isis imaging system with mFISH software | MetaSystems | Specialized probe kit is necessary |
Referenzen
- Rabinovitch, P., et al. Predictors of progression in Barrett's esophagus III: baseline flow cytometric variables. Am. J. Gastroenterol. 96 (11), 3071-3083 (2001).
- Galipeau, P., et al. NSAIDs modulate CDKN2A, TP53, and DNA content risk for progression to esophageal adenocarcinoma. PLoS Med. 4 (2), e67 (2007).
- Olaharski, A., et al. Tetraploidy and chromosomal instability are early events during cervical carcinogenesis. Carcinogenesis. 27, 337-343 (2006).
- Liu, Y., et al. p53-independent abrogation of a postmitotic checkpoint contributes to human papillomavirus E6-induced polyploidy. Cancer Res. 67, 2603-2610 (2007).
- Davoli, T., de Lange, T. The causes and consequences of polyploidy in normal development and cancer. Annu Rev Cell Dev Biol. 27, 585-610 (2011).
- Fox, D., Duronio, R. Endoreplication and polyploidy: insights into development and disease. Development. 140, 3-12 (2013).
- Fujiwara, T., et al. Cytokinesis failure generating tetraploids promotes tumorigenesis in p53-null cells. Nature. 437, 1043-1047 (2005).
- Ganem, N., et al. Cytokinesis failure triggers hippo tumor suppressor pathway activation. Cell. 158 (4), 833-848 (2014).
- Kuznetsova, A., et al. Chromosomal instability, tolerance of mitotic errors and multidrug resistance are promoted by tetraploidization in human cells. Cell cycle. 14 (17), 2810-2820 (2015).
- Vindeløv, L., Christensen, I. Detergent and proteolytic enzyme-based techniques for nuclear isolation and DNA content analysis. Methods Cell Biol. 41, 219-229 (1994).
- Darzynkiewicz, Z., Juan, G. DNA content measurement for DNA ploidy and cell cycle analysis. Curr Protoc Cytom. , Chapter 7: Unit 7.5 (2001).
- Knutsen, T., Bixenman, H., Lawce, H., Martin, P. Chromosome analysis guidelines preliminary report. Cancer Genet Cytogenet. 52 (1), 11-17 (1991).
- Liehr, T., et al. Multicolor FISH probe sets and their applications. Histol. Histopathol. 19 (1), 229-237 (2004).
- Ohshima, S., Seyama, A. Formation of bipolar spindles with two centrosomes in tetraploid cells established from normal human fibroblasts. Hum. Cell. 25 (3), 78-85 (2012).
- Ohshima, S., Seyama, A. Establishment of proliferative tetraploid cells from normal human fibroblasts. Front. Oncol. 3, 198 (2013).
- Ohshima, S., Seyama, A. Establishment of proliferative tetraploid cells from telomerase-immortalized normal human fibroblasts. Genes, Chromosome Cancer. 55 (6), 522-530 (2016).
- Di Leonardo, A., et al. DNA rereplication in the presence of mitotic spindle inhibitors in human and mouse fibroblasts lacking either p53 or pRb function. Cancer Res. 57, 1013-1019 (1997).
- Andreassen, P., Lohez, O., Lacroix, F., Margolis, R. Tetraploid state induces p53-dependent arrest of nontransformed mammalian cells in G1. Mol. Biol. Cell. 12, 1315-1328 (2001).
- Vogel, C., et al. Crosstalk of the mitotic spindle assembly checkpoint with p53 to prevent polyploidy. Oncogene. 23, 6845-6853 (2004).
- Aylon, Y., Oren, M. p53: Guardian of ploidy. Mol. Oncol. 5 (4), 315-323 (2011).
- Uetake, Y., Sluder, G. Cell cycle progression after cleavage failure : mammalian somatic cells do not possess a "tetraploidy checkpoint". J. Cell Biol. 165, 609-615 (2004).
- Ganem, N., Pellman, D. Limiting the proliferation of polyploid cells. Cell. 131, 437-440 (2007).
- Ho, C., Hau, P., Marxer, M., Poon, R. The requirement of p53 for maintaining chromosomal stability during tetraploidization. Oncotarget. 1 (7), 583-595 (2010).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten