Method Article
Mise en place de cellules tétraploïdes proliférative de fibroblastes humains non transformés
Dans cet article
Résumé
Although proliferative polyploid cells are necessary to analyze chromosomal instability of polyploid cells, creating such cells from nontransformed human cells is not easy. The present report describes relatively simple procedures to establish proliferative tetraploid cells free of a diploid population from normal human fibroblasts.
Résumé
Polyploid (mostly tetraploid) cells are often observed in preneoplastic lesions of human tissues and their chromosomal instability has been considered to be responsible for carcinogenesis in such tissues. Although proliferative polyploid cells are requisite for analyzing chromosomal instability of polyploid cells, creating such cells from nontransformed human cells is rather challenging. Induction of tetraploidy by chemical agents usually results in a mixture of diploid and tetraploid populations, and most studies employed fluorescence-activated cell sorting or cloning by limiting dilution to separate tetraploid from diploid cells. However, these procedures are time-consuming and laborious. The present report describes a relatively simple protocol to induce proliferative tetraploid cells from normal human fibroblasts with minimum contamination by diploid cells. Briefly, the protocol is comprised of the following steps: arresting cells in mitosis by demecolcine (DC), collecting mitotic cells after shaking off, incubating collected cells with DC for an additional 3 days, and incubating cells in drug-free medium (They resume proliferation as tetraploid cells within several days). Depending on cell type, the collection of mitotic cells by shaking off might be omitted. This protocol provides a simple and feasible method to establish proliferative tetraploid cells from normal human fibroblasts. Tetraploid cells established by this method could be a useful model for studying chromosome instability and the oncogenic potential of polyploid human cells.
Introduction
Polyploidy a été observée non seulement dans les tissus des espèces de mammifères spécialisés, mais également dans une variété d'états pathologiques tels que le cancer et les maladies dégénératives. ( La plupart des cellules polyploïdes tétraploïdes) sont souvent observées dans les lésions précancéreuses de tissus humains, tels que l' œsophage 1,2 ou squameuses lésions intra - épithéliales de Barrett du col 3,4, et ont été considérés comme étant la source des cellules aneuploïdes malignes dans les tissus 5 , 6. Bien qu'il soit suggéré que la conversion de tétraploïdes à des cellules aneuploïdes pourrait être un événement crucial dans les premières étapes de la tumorigenèse, les mécanismes impliqués dans ce processus ne sont pas complètement comprises. Ceci est en partie parce qu'aucun modèle in vitro a été disponible , où les cellules humaines polyploïdes non transformées peuvent se propager.
Certains chercheurs ont induit tétraploïdie dans les cellules épithéliales humaines non transformées par la génération de cellules binucléées par inhibiting cytokinesis 7-9. Dans ce procédé, cependant, les cellules diploïdes inutiles doivent être éliminées par tri cellulaire activé par fluorescence (FACS) 7,8 ou le clonage par dilution limitante 9. Parce que ces procédures sont laborieuses et pas facile à réaliser, des méthodes plus simples à mettre en place des cellules tétraploïdes non transformées sont souhaitées pour la recherche dans ce domaine.
Dans le présent rapport, nous décrivons un protocole pour établir des cellules tétraploïdes prolifératives de fibroblastes humains normaux ou des fibroblastes humains télomérase immortalisés par des procédures relativement simples. Les procédures utilisent la broche poison démécolcine (DC) pour arrêter les cellules diploïdes en mitose, et les cellules mitotiques recueillies par secouer sont encore traités avec DC. les cellules mitotiques diploïdes traitées avec courant continu pour convertir le temps prolongé dans les cellules G1 tétraploïdes, et ces cellules proliférer les cellules tétraploïdes que, après un arrêt de croissance pendant plusieurs jours après le retrait du médicament. Ce protocole prévoitune méthode efficace pour créer un modèle utile pour étudier la relation entre l'instabilité chromosomique et le potentiel oncogénique de cellules humaines polyploïdes.
Protocole
1. Culture cellulaire
- Obtenir les cellules pour induire tétraploïdie. À ce jour, il a été confirmé que cette technique peut être appliquée sur les lignées cellulaires de fibroblastes humains TIG 1, BJ, IMR-90 et de la télomérase immortalisation TIG-1 (TIG-HT).
- Cultiver les cellules dans du milieu essentiel minimal avec modification α ou tout autre milieu de culture cellulaire approprié pour le type de cellules à étudier additionné de 10% (v / v) de sérum de fœtus bovin inactivé par la chaleur (FBS) par mise en incubation dans un 5% (v / v) une atmosphère de CO2 à 37 ° C. cellules Passage tous les 3 ou 4 jours de ne pas dépasser la densité de subconfluent.
REMARQUE: Le niveau de doublement de la population (PDL) doit être calculé chaque fois à repiquage pour évaluer la croissance cellulaire et l'âge de la cellule. PDL peut être calculé à partir du nombre de cellules ensemencées dans une boîte (N1) et le nombre de cellules récoltées à côté des passages (N2) à l'aide de la formule suivante (X est la première PDL). PDL = X + (log N1 - log N2) / log 2
2. Induction et Estaétablis- des cellules tétraploïdes à partir de diploïdes Fibroblastes
- Provoquer tétraploïdie sans shake-off.
NOTE: Certaines souches de cellules (par exemple TIG-1) peut devenir presque complètement tétraploïde par un traitement continu avec démécolcine (DC) comme suit.- cellules Passage dans une ou deux boîtes de 100 mm le jour avant le traitement pour induire tétraploïdie. En règle générale, la préparation de 5 x 10 5 à 1 x 10 6 cellules par boîte pour l' induction de cellules tétraploïdes.
- Traiter des cellules en croissance exponentielle dans un milieu contenant 0,1 pg / ml à courant continu pendant 4 jours.
- Remplacer DC milieu contenant un milieu exempt de drogue et incuber les cellules dans un 5% (v / v) atmosphère de CO 2 à 37 ° C. Les cellules reprennent généralement la prolifération dans 1 semaine.
- Provoquer tétraploïdie avec shake-off.
REMARQUE: La plupart des cellules deviennent un mélange de populations diploïdes ou tétraploïdes à la suite du traitement simple en courant continu décrit ci-dessus (2.1). Par conséquent, certaines modifications de la pROCÉDURE pour éliminer une population diploïde sont nécessaires comme suit (Figure 1).- cellules Passage dans plusieurs T75 Gourde le jour avant le traitement pour induire tétraploïdie. Habituellement, préparer au moins 5 x 10 6 cellules (1 x 10 6 cellules par flacon) pour l' induction de cellules tétraploïdes.
- Traiter les cellules en croissance exponentielle avec un milieu contenant 0,1 pg / mL DC pendant 16 - 18 h pour arrêter les cellules en mitose. Le temps requis pour arrêter les cellules en mitose peut dépendre des cellules cibles et devrait être déterminée par des expériences préliminaires pour obtenir autant de cellules mitotiques que possible. Par exemple, les cellules à croissance plus lente devraient être traitées avec DC pour plus de temps que les cellules à croissance rapide.
NOTE: Si les cellules sont traitées pendant trop longtemps dans cette étape, ils pourraient subir un glissement mitotique et adhérer à la surface de la boîte, ce qui rend impossible la collecte de cellules en mitose par shake-off à l'étape suivante. - Recueillir les cellules en mitose DC-arrêtés par la méthode shake-off, dans which cellules en mitose lâchement adhérées sont collectées par agitation douce de flacons et le lavage avec du milieu puis par centrifugation (300 xg, 5 min). Compter le nombre de cellules par une méthode appropriée dans cette étape.
- Réensemencer cellules mitotiques recueillies dans des boîtes de culture de 60 mm et de traiter les cellules avec 0,1 pg / mL DC pendant 3 jours. Graine plus de 1 x 10 6 cellules en mitose par boîte, parce que moins de 10% des cellules peut survivre à ce traitement.
- Remplacez DC milieu contenant un milieu exempt de drogue et d'attendre pour les cellules de reprendre la prolifération, qui se produit habituellement dans 1 semaine.
- Passage des cellules de manière similaire à des cellules diploïdes d'origine.
3. Examen de l'ADN ploïdie
NOTE: Ceci est une procédure bien établie et un manuel technique devrait être renvoyée à des procédures détaillées et des conseils techniques.
- Récolte des cellules (5 x 10 5 - 1 x 10 6) par incubation des cellules avec une solution concontenant 0,05% de trypsine et 0,02% d'EDTA pendant 10 min à 37 ° C et on neutralise la trypsine par un milieu contenant 10% de FBS.
- centrifuger les cellules dans le milieu et les laver par remise en suspension dans 5 ml de solution saline tamponnée au phosphate (PBS) suivie par une centrifugation (300 x g, 5 min).
- Préparer des cellules pour l'analyse de l'ADN par une des deux méthodes suivantes
- Procédé d'analyse de cellules non fixées 10
Remarque: Cette méthode peut être réalisée en utilisant un kit disponible dans le commerce pour l'analyse du cycle cellulaire. Les échantillons préparés avec cette méthode doivent être analysés immédiatement, parce que les cellules ne sont pas fixés dans la procédure et colorées noyaux seront endommagés au fil du temps.- Laver les cellules avec 40 mM de tampon citrate contenant 250 mM de saccharose. traiter ensuite les cellules avec 250 ul de 0,1% (v / v) de Nonidet P40 et 30 pg / ml de trypsine dans 200 pl de 40 mM de tampon citrate contenant 250 mM de saccharose pendant 10 min à température ambiante.
- Ajouter 200 pi de 0,5 pg / ml de trypsine inhibitor et 0,1 pg / ml de RNase A dans 40 mM de tampon citrate contenant 250 mM de saccharose, et on incube les cellules pendant 10 min à température ambiante.
- Ajouter 200 ul de 0,4 mg / mL d'iodure de propidium (PI) dans un tampon de citrate 40 mM contenant 250 mM de saccharose, et on incube les cellules pendant 10 min à température ambiante pour colorer des noyaux cellulaires.
- Procédé pour analyser des cellules fixées
- Fixer les cellules avec 80% d'éthanol en mettant en suspension les cellules dans 1 ml de PBS, en ajoutant 4 ml de EtOH à 100%, goutte à goutte tout en mélangeant la suspension de cellules et en le laissant à température ambiante pendant 30 min. Les cellules de cette fixatif peuvent être conservés à -20 ° C pendant plusieurs semaines.
- Laver les cellules en les remettant en suspension dans 5 ml de PBS puis par centrifugation (300 x g, 5 min). Traiter les cellules avec 0,5 mg / ml de RNase A et les colorer avec 50 pg / ml d'iodure de propidium (PI) (475 pl de 0,5 mg / ml de RNase A et 25 ul de 1 mg / mL de PI) pendant 30 min à température ambiante.
- Procédé d'analyse de cellules non fixées 10
- Analyser le contenu d'ADN de til cellules en utilisant un cytomètre de flux avec un laser de 488 nm et un filtre d'émission de canal rouge (longue passe> 610 nm). Analyser un échantillon de référence préparé à partir de cellules diploïdes d'origine en même temps pour évaluer la ploïdie des cellules cibles.
- En variante, ajouter des perles de fluorescence standard pour évaluer le rapport d'intensité de fluorescence des cellules diploïdes par rapport aux billes. Utilisez la «hauteur d'impulsion de largeur d'impulsion par rapport à « l' option de la cytométrie de flux pour distinguer entre les cellules et amas de cellules diploïdes 11 tétraploïdes simples.
4. Examen des Comtes chromosomiques et analyse caryotype
NOTE: Ce sont toutes des procédures bien établies et un manuel technique ou les protocoles du fabricant devraient être soumises à des procédures détaillées et des conseils techniques.
- Traiter les cellules en croissance exponentielle avec 0,1 pg / mL DC pendant 4 h pour arrêter les cellules en métaphase.
- Préparer des lames chromosomiques.
- cellules de récolte (au moins 5 x 10 5 cellules) par trypsinisation et suspendre dans un milieu contenant du FBS.
- centrifuger les cellules dans un milieu (300 xg, 5 min) et on traite avec une solution hypotonique (5 ml de 0,075 M de KCl) à 37 ° C pendant 10 min.
- Fix et suspendre les cellules dans le fixateur de Carnoy (méthanol: acide acétique = 3: 1).
- Étaler des cellules sur une lame de verre en laissant tomber un petit volume (25 - 35 ul) de la suspension cellulaire. Des mesures supplémentaires telles que l'exposition à la vapeur d'eau chaude pourraient être nécessaires pour améliorer le chromosome se propager.
- Cellules Stain pour comptage des chromosomes ou l' analyse du caryotype ou fluorescence multicolore hybridation in situ (MFish).
- compte chromosomiques.
- les cellules tache avec une solution de Giemsa à 5% (ou 5 ug PI / ml contenant 0,5 mg / ml de RNase A pour la microscopie par fluorescence) pendant 15 - 20 min.
- photographier numériquement au moins 50 cellules métaphasiques.
- Comptez le nombre de chromosomes par cellule en utilisant un softwa d'analyse d'imagere après séparation manuelle de toucher et de chevauchement des chromosomes à l'aide d'un logiciel de retouche photo. Bien que le nombre de chromosomes peut être marqué manuellement, pointage informatisé est recommandé.
- analyse du caryotype
NOTE: Cette analyse doit être effectuée par un technicien qualifié ou une entreprise professionnelle.- Cellules Stain selon une technique G-banding standard de 12.
- Analyser les chromosomes de faire Caryogamies standard de 12.
- mFISH
REMARQUE: Cette étape est facultative et doit être effectuée si nécessaire.- Cellules Stain en utilisant des sondes FISH multicolores pour les chromosomes humains selon le protocole du fabricant 13.
- Analyser les chromosomes en utilisant un microscope à fluorescence avec des filtres adaptés et d' un logiciel d'analyse mFISH 13.
- compte chromosomiques.
Résultats
Dans notre expérience, TIG-1 cellules peuvent être presque complètement tétraploïde par un traitement simple et continu avec 0,1 pg / mL DC pendant 4 jours (figure 2A). En revanche, d'autres souches fibroblastiques, tels que BJ ou IMR-90 et des cellules TIG Ht, est devenu un mélange de diploïdes et les populations tétraploïdes suivant le même traitement, et l'isolement des cellules en mitose par la méthode d'agitation d'arrêt est nécessaire au cours de traitement en courant continu (habituellement 16 - 18 h après le début du traitement) (figures 2B, C). Après un traitement supplémentaire avec DC pendant 3 jours, les cellules ont subi un arrêt de croissance et présentaient un grand, aplaties morphologie pendant plusieurs jours. Moins d' une semaine en général, de petites cellules qui prolifèrent sont apparues dans les grandes cellules aplaties (figure 3). Les cellules sont devenues presque complètement tétraploïde dans 2 - 3 semaines après le traitement DC. Le nombre modal de chromosomes dans les cellules tétraploïdes établies était de 92 dans la plupart des cas, except que l' une des lignées cellulaires établies à partir de cellules tétraploïdes TIG Ht eu 91 chromosomes dans la majorité des cellules (figure 4). Cellules tétraploïdes établies ont augmenté à peu près au même rythme que les cellules diploïdes (Figure 5). Des lignées cellulaires établies à partir de cellules tétraploïdes non immortalisées ont montré une durée de vie réplicative à peu près égale à celle des cellules diploïdes d' origine, tandis que celles des cellules immortalisées semble être aussi immortelle (figure 5). Cellules tétraploïdes établies à partir de non-immortalisées TIG-1 cellules ont montré un caryotype normal sauf pour avoir un nombre de chromosomes tétraploïde (Figure 6 panneau supérieur), tandis que ceux de immortalisés TIG-1 (TIG-hT) cellules ont montré des aberrations clonales assez compliquées (Figure 6 milieu et panneaux de fond). La fréquence des aberrations clonales dans les dernières cellules (TIG-hT-4n) est passée de 2,5 aberrations par cellule à 255 doublement de la population (PDL) à 5,2 aberrations par cellule à 450 PDLavec sous-culture répétée.
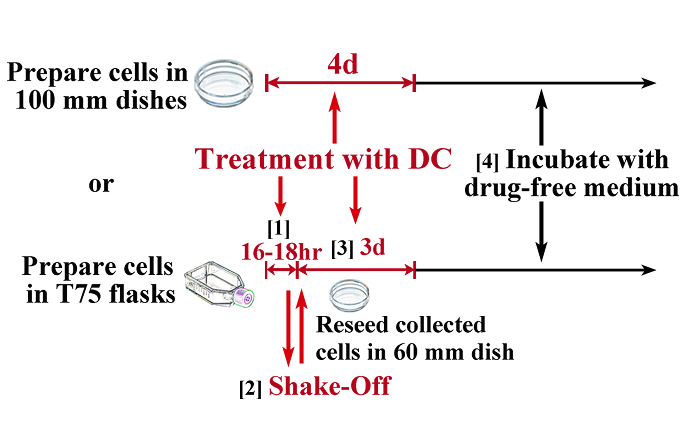
Figure 1: Illustration schématique du Protocole pour l' induction de tétraploïdie. Pour obtenir des cellules tétraploïdes avec une contamination minimale de cellules diploïdes, une combinaison de mitotique secousse d'arrêt et de traitement continu est nécessaire pour la plupart des souches cellulaires (figure du bas), alors que certaines souches de cellules (par exemple TIG-1) peuvent être presque complètement tétraploïde par un traitement continu avec démécolcine (illustration supérieure). 1) traiter les cellules dans des flacons T75 (au moins 5 x 10 6) avec 0,1 ug / ml CC pendant 16 - 18 h (temps devrait être déterminée par des essais préliminaires) pour arrêter les cellules en mitose. 2) Recueillir les cellules en mitose par la méthode shake-off et réensemencer dans 60 boîtes de culture de mm. 3) traiter les cellules avec 0,1 pg / ml à courant continu pendant un temps supplémentaire de 3 jours. 4) Incuber les cellules dans un milieu sans drogue (cellules habituellement reprennent proliferation dans 1 semaine). Les barres d'échelle représentent 100 um. S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.

Figure 2: ADN histogrammes de Fibroblastes Avant et après les traitements pour l' induction de tétraploïdie. (A) TIG-1 cellules. Cette souche cellulaire devient tétraploïdes par un traitement simple et continu avec 0,1 pg / mL DC pendant 4 jours. (Cellules B) BJ. Parce que cette souche de la cellule devient un mélange de populations diploïdes et tétraploïdes après un traitement simple avec DC (panneaux de gauche), l'isolement des cellules en mitose en secouant est nécessaire pendant le traitement continu pour établir des cellules tétraploïdes (panneaux de droite). (C) TIG-hT (télomérase-immortalisées TIG-1) cellules. Ces cellules doivent également être préparé par un peigne mination du traitement DC et secouez-off pour l'établissement de cellules tétraploïdes. Références numériques sur les histogrammes représentent le temps (jours) après le retrait du médicament. L'abscisse représente la teneur en ADN (C, complément). S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.

Figure 3: photomicrographies représentatifs de cellules BJ traitées avec DC. Les cellules (A) , BJ traitées avec 0,1 pg / ml CC pendant 16 h. De nombreuses cellules arrêt de la mitose peut être vu. (B) la fin du traitement continu. Presque toutes les cellules sont la croissance arrêtée. (C) 7 jours après le traitement DC. cellules proliférantes petites entre grandes cellules aplaties peuvent être vus. (D) 14 jours après le traitement DC. Les cellules sont en croissance active. e.com/files/ftp_upload/55028/55028fig3large.jpg "target =" _ blank "> S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.

Figure 4: photomicrographies représentatifs de Chromosomes et histogrammes du nombre de chromosomes pour les cellules tétraploïdes établies de chaque souche cellulaire. , Panneaux du milieu et du bas représentent les cellules tétraploïdes établies à partir de TIG-1 (2 semaines après le traitement continu), BJ (2 semaines après le traitement de CC) et TIG-HT (7 semaines après le traitement continu) des cellules, respectivement. Chromosomes ont été marqués dans au moins 50 métaphases. Numéraux en histogrammes sont des nombres chromosomiques modales. S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.
ftp_upload / 55028 / 55028fig5.jpg "/>
Figure 5: Profils de croissance représentatifs de fibroblastes humains (cellules diploïdes) et les cellules tétraploïdes établies à partir de chaque souche de cellule. A gauche, centre et panneaux de droite montrent des profils d'origine TIG-1 croissance, les cellules BJ et TIG-Ht (marqueurs ouverts) et celles des cellules tétraploïdes établie à partir de chaque souche de cellule (marqueurs fermés). Les cellules ont été repiquées deux fois par semaine et LDP sont calculées à partir du nombre de cellules. S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.

Figure 6: Représentant Caryogamies par G-banding et mFISH. Le panneau supérieur montre un caryotype par G-banding des cellules tétraploïdes établies à partir de TIG-1 (2 semaines après le traitement DC). panneaux intermédiaires et inférieurs montrentCaryogamies par mFISH pour les cellules tétraploïdes établies à partir de cellules TIG-Ht (15 et 41 semaines après le traitement DC). Les caryotypes étaient basées sur 10 cellules (TIG-1) ou 20 cellules (TIG-Ht). S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.
Discussion
Un problème majeur dans l'induction de tétraploïdie à partir de cellules diploïdes par des agents chimiques, soit par des inhibiteurs de la cytokinèse ou par des inhibiteurs de la broche, est que les cellules deviennent souvent un mélange de populations diploïdes ou tétraploïdes et les cellules tétraploïdes doivent être séparés des cellules diploïdes. La plupart des approches communes pour l'isolement d'une population tétraploïde exempte de cellules diploïdes utilisent FACS ou le clonage par dilution limite. Toutefois, ces procédures sont laborieuses et pas facile à réaliser. Dans ce rapport, nous présentons un nouveau protocole pour établir des cellules tétraploïdes prolifératives libres d'une population diploïde à partir de fibroblastes humains normaux. Le protocole utilise la broche poison DC pour arrêter les cellules diploïdes dans la mitose, et arrêté les cellules en mitose sont séparés par des secousses-off à partir de cellules diploïdes interphase, qui ont adhéré à la surface du plat. les cellules recueillies sont traitées avec courant continu pendant 3 jours et les cellules en mitose des cellules diploïdes sont converties en G1 tétraploïdes par ce traitement continu prolongé vraisemblablement by checkpoint adaptation (également appelé glissement mitotique). Ces cellules redémarrer la croissance des cellules comme des cellules tétraploïdes après arrêt de la croissance pendant plusieurs jours de l'enlèvement de la drogue.
Un avantage de cette méthode est que la procédure est relativement simple et réalisable par rapport à ceux utilisant le clonage FACS, ou pour isoler des cellules tétraploïdes. Limites de la méthode sont les suivantes. Applicabilité aux types autres que les fibroblastes de cellules, comme les cellules épithéliales, est inconnue à l'heure actuelle. Cela devrait être confirmé dans les études futures. Une petite population diploïde pourrait rester dans certains cas. Cependant, ces cellules ont tendance à diminuer avec le passage en série. Si une population diploïde importante persiste après un traitement continu, une concentration plus élevée de courant continu (1,2 à 1,5 pg / ml) ou un traitement plus long à courant continu après la secousse d'arrêt (4 jours au lieu de 3 jours) pourrait améliorer le résultat.
Les étapes les plus critiques de ce protocole sont les suivants. Tout d'abord, le temps de traitement avec DC pour unerresting cellules en mitose avant shake-off est critique. Bien que ce temps de traitement doit être suffisamment longue pour collecter autant de cellules en mitose que possible, le traitement trop longtemps pourrait provoquer le glissement mitotique et l'adhérence à la surface de la boîte, ce qui rend impossible de recueillir les cellules en mitose en secouant. Car un temps approprié pour la récupération maximale des cellules en mitose peut dépendre des cellules cibles, il doit être déterminé par des expériences préliminaires. Deuxièmement, l'étape secouer pour séparer les cellules en mitose de cellules en interphase est également critique. Dans cette étape, les cellules mitotiques diploïdes qui sont lâchement collée à la surface de cuvette, sont collectés par agitation douce des flacons puis par centrifugation. Cette secousse-off mitotique sépare les cellules en mitose arrêtés par DC à partir de cellules interphase adhérées qui pourraient être à l'origine de la contamination par la population diploïde plus tard. Secouer violemment peut provoquer bouillonnement du milieu, ce qui pourrait endommager les cellules, ainsi que le détachement des cellules en interphase, resulting la contamination des cellules diploïdes. Un autre facteur qui peut influer sur le succès de cette méthode est le milieu de culture. Parce que la stimulation de la croissance robuste semble être nécessaire pour la récupération de la prolifération après un traitement continu, le milieu riche en nutriments tels que MEM-α devrait être utilisé pour soutenir la prolifération des cellules tétraploïdes. L'augmentation de la concentration de FBS à 20% à l'étape finale de l'induction des cellules tétraploïdes (2.2.5) pourrait également augmenter le succès de cette méthode.
En utilisant ce protocole, nous avons à ce jour a produit des cellules tétraploïdes à partir des souches de fibroblastes humains TIG-1, BJ, IMR-90 et télomérase immortalisées TIG-1 jusqu'à maintenant 14-16. Parmi ces souches cellulaires, TIG-1 est assez inhabituel parce que cette souche de la cellule devient presque complètement tétraploïde lorsqu'ils sont traités en continu avec DC, sans secousse-off, pendant 4 jours. La raison pour laquelle seulement TIG-1 cellules deviennent complètement tétraploïde à la suite d'un traitement simple avec DC est inconnue à l'heure actuelle. EXPOSÉ possiblenations pourraient être qu'une proportion importante de cellules d'autres types d'arrestations à la phase G1 diploïde lorsqu'ils sont traités avec DC et reprend la prolifération après le traitement, alors que (1) TIG-1 cellules n'arrêtent à G1 avec le même traitement, ou (2) un population de TIG-1 cellules arrête de manière irréversible à G1 sous le même traitement et ne reprend pas la prolifération par la suite. Dans tous les cas, des sensibilités différentes du point de contrôle G1 à DC pourraient être responsables pour les différents comportements des cellules après un traitement continu avec DC.
Lorsque l'on étudie la signification étiologique de tétraploïdie dans la tumorigenèse, de nombreux chercheurs ont de grandes préoccupations sur le statut du gène p53 dans les cellules tétraploïdes, car il a été proposé que tétraploïdie induit la croissance arrestation de p53-dépendante des cellules, qui est appelé le "checkpoint tétraploïdie" 17-20. Si cette hypothèse est correcte, la signalisation de p53 dans des cellules proliférantes tétraploïdes devrait être inactivé. cependant,cellules tétraploïdes établies par notre protocole semblent avoir p53 fonctionnelle malgré une croissance à peu près au même rythme que les cellules diploïdes 15,16. La raison de cet écart ne sait pas à l'heure actuelle, et l'importance de l'inactivation de p53 dans la prolifération des cellules tétraploïdes devrait être examiné précisément dans les études futures. En effet, la présence d'un poste de contrôle tétraploïdie qui fonctionne par le biais p53 reste controversée 21-23.
Bien que les cellules polyploïdes non transformées qui peuvent se propager in vitro sont indispensables pour une analyse détaillée de l' instabilité chromosomique et le potentiel oncogénique de cellules polyploïdes, ces cellules ont jusqu'à présent rarement été disponible. Notre protocole fournit une méthode simple et réalisable d'établir des cellules tétraploïdes prolifératives à partir de fibroblastes humains normaux, ce qui pourrait être un modèle utile pour étudier les mécanismes conduisant à la transformation de cellules humaines polyploïdes.
Déclarations de divulgation
Les auteurs déclarent qu'ils ont aucun intérêt financier en compétition.
Remerciements
We thank Mrs. Matsumoto for the technical assistance.
matériels
| Name | Company | Catalog Number | Comments |
| MEM-α | Sigma-Aldrich | M8042-500ML | |
| Trypsin-EDTA | Sigma-Aldrich | T4174 | |
| FBS | Sigma-Aldrich | 172012-500ML | |
| Demecolcine solution (10 μg/mL in HBSS) | Sigma-Aldrich | D1925-10ML | |
| BD CycleTES Plus DNA Reagent Kits | BD Biosciences | #340242 | For examination of DNA ploidy by flow cytometry |
| Human chromosome multicolor FISH probe 24XCyte | MetaSystems | #D-0125-060-DI | Specialized filter set and software for mFISH analysis are necessary |
| Isis imaging system with mFISH software | MetaSystems | Specialized probe kit is necessary |
Références
- Rabinovitch, P., et al. Predictors of progression in Barrett's esophagus III: baseline flow cytometric variables. Am. J. Gastroenterol. 96 (11), 3071-3083 (2001).
- Galipeau, P., et al. NSAIDs modulate CDKN2A, TP53, and DNA content risk for progression to esophageal adenocarcinoma. PLoS Med. 4 (2), e67 (2007).
- Olaharski, A., et al. Tetraploidy and chromosomal instability are early events during cervical carcinogenesis. Carcinogenesis. 27, 337-343 (2006).
- Liu, Y., et al. p53-independent abrogation of a postmitotic checkpoint contributes to human papillomavirus E6-induced polyploidy. Cancer Res. 67, 2603-2610 (2007).
- Davoli, T., de Lange, T. The causes and consequences of polyploidy in normal development and cancer. Annu Rev Cell Dev Biol. 27, 585-610 (2011).
- Fox, D., Duronio, R. Endoreplication and polyploidy: insights into development and disease. Development. 140, 3-12 (2013).
- Fujiwara, T., et al. Cytokinesis failure generating tetraploids promotes tumorigenesis in p53-null cells. Nature. 437, 1043-1047 (2005).
- Ganem, N., et al. Cytokinesis failure triggers hippo tumor suppressor pathway activation. Cell. 158 (4), 833-848 (2014).
- Kuznetsova, A., et al. Chromosomal instability, tolerance of mitotic errors and multidrug resistance are promoted by tetraploidization in human cells. Cell cycle. 14 (17), 2810-2820 (2015).
- Vindeløv, L., Christensen, I. Detergent and proteolytic enzyme-based techniques for nuclear isolation and DNA content analysis. Methods Cell Biol. 41, 219-229 (1994).
- Darzynkiewicz, Z., Juan, G. DNA content measurement for DNA ploidy and cell cycle analysis. Curr Protoc Cytom. , Chapter 7: Unit 7.5 (2001).
- Knutsen, T., Bixenman, H., Lawce, H., Martin, P. Chromosome analysis guidelines preliminary report. Cancer Genet Cytogenet. 52 (1), 11-17 (1991).
- Liehr, T., et al. Multicolor FISH probe sets and their applications. Histol. Histopathol. 19 (1), 229-237 (2004).
- Ohshima, S., Seyama, A. Formation of bipolar spindles with two centrosomes in tetraploid cells established from normal human fibroblasts. Hum. Cell. 25 (3), 78-85 (2012).
- Ohshima, S., Seyama, A. Establishment of proliferative tetraploid cells from normal human fibroblasts. Front. Oncol. 3, 198 (2013).
- Ohshima, S., Seyama, A. Establishment of proliferative tetraploid cells from telomerase-immortalized normal human fibroblasts. Genes, Chromosome Cancer. 55 (6), 522-530 (2016).
- Di Leonardo, A., et al. DNA rereplication in the presence of mitotic spindle inhibitors in human and mouse fibroblasts lacking either p53 or pRb function. Cancer Res. 57, 1013-1019 (1997).
- Andreassen, P., Lohez, O., Lacroix, F., Margolis, R. Tetraploid state induces p53-dependent arrest of nontransformed mammalian cells in G1. Mol. Biol. Cell. 12, 1315-1328 (2001).
- Vogel, C., et al. Crosstalk of the mitotic spindle assembly checkpoint with p53 to prevent polyploidy. Oncogene. 23, 6845-6853 (2004).
- Aylon, Y., Oren, M. p53: Guardian of ploidy. Mol. Oncol. 5 (4), 315-323 (2011).
- Uetake, Y., Sluder, G. Cell cycle progression after cleavage failure : mammalian somatic cells do not possess a "tetraploidy checkpoint". J. Cell Biol. 165, 609-615 (2004).
- Ganem, N., Pellman, D. Limiting the proliferation of polyploid cells. Cell. 131, 437-440 (2007).
- Ho, C., Hau, P., Marxer, M., Poon, R. The requirement of p53 for maintaining chromosomal stability during tetraploidization. Oncotarget. 1 (7), 583-595 (2010).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon