Method Article
ADSC листов Трансплантация для предотвращения стриктуры после продолжительного пищеводного эндоскопическую подслизистую Вскрытие
В этой статье
Резюме
Это исследование сообщает об успешном метод эндоскопического жировой ткани стромальные клетки (ADSC) -sheet трансплантации для профилактики пищеводного стриктуры после продолжительного эндоскопическую подслизистую диссекции (ОУР) в качестве модели свиней.
Аннотация
В прошлые годы, конструкция сотового листа стимулировало широкий интерес к регенеративной медицине, особенно для реконструктивных процедур по хирургии. Развитие разнообразных технологий, сочетающих полученных из жировой ткани стромальных клеток (ADSCs) с различными биоматериалов привело к строительству многочисленных видов тканевой инженерии заменителей, таких как кости, хряща и жировой ткани от грызуна, свиньи или человека ADSCs. Расширенная пищеводного эндоскопической подслизистой диссекции (ОУР) отвечает за формирование стриктура пищевода. профилактика Стриктура остается сложной, без каких-либо эффективных процедур. Предыдущие исследования сообщили об эффективности трансплантации клеток слизистой оболочки листов в собачьей модели и в организме человека. ADSCs приписываются противовоспалительные свойства, местные иммунные эффекты Модулируемая индукции неоваскуляризации и дифференциации способностей в мезенхимальных и не-мезенхимальных родословных. Это оригинальное исследование описывает эндоскопическую траnsplantation из тканевой инженерии конструкции ADSC, чтобы предотвратить стриктура пищевода в свином модели. ADSC конструкция состояла из двух аллогенных ADSC листов слоистых друг на друга на опорной бумаги мембраны. В ADSCs метили с PKH67 флуорофора, чтобы позволить зонд на основе конфокальной лазерной эндомикроскопии (PCle) мониторинг. В день трансплантации, проводили в 5-ти см и геми-окружная ОУР как известно, индуцирует стриктура пищевода. Животные были немедленно эндоскопически пересаживают с 4 ADSC конструкций. Полная адгезия ADSC конструктов было получено через 10 мин нежного применения. Животных забивали на 28-й день все животные были успешно пересаженной. Трансплантация была подтверждена на 3-й день с положительной оценкой PCle. По сравнению с трансплантированных животных, у контрольных животных развились тяжелые стриктуры, с большим развитием фиброзной ткани, более частой алиментарной неприятности, и снижение веса. В нашей модели, трансплантация allogeniс ADSCs, организованные в виде листов двойных клеток, после продолжительного ОУР был успешным, и в значительной степени связано с более низкой скоростью стриктуры пищевода.
Введение
Управление поверхностных опухолей пищевода изменилась с развитием новых эндоскопических методов. В настоящее время эндоскопическая резекция является первой линии терапии. В самом деле, это связано с более низкими показателями заболеваемости и смертности , чем хирургии с онкологическими равными результатами 1, 2, 3. Эндоскопическая резекция слизистой оболочки (EMR) и эндоскопическая подслизистая резекция (ОУР) являются наиболее широко используемые методы. В случае длительного поверхностных опухолей, является предпочтительным ESD. По сравнению с ЭМИ, ESD позволяет единым блоком резекции, независимо от размера и формы поражения 4, 5, 6. Основная задержка осложнением ОУР является формирование стриктура пищевода, которое обычно происходит от одной до двух недель после резекции. Последние опубликованные исследования показали, что образование стриктур коррелирует сразмер резекции. Японский эндоскопическое общество рекомендует избегать ESD размером более ¾ окружности пищевода, потому что они связаны с развитием стриктуры более чем в 90% случаев и несут ответственность за серьезных проблем кормления и серьезным ухудшением качества жизни.
Предотвращение стриктура пищевода остается сложной. Механизмы, участвующие в формировании стриктуры лишь частично известны. Стриктуры образований похоже, является результатом объединения двух различных механизмов: (1) про-воспалительный клеточный набора и (2) чрезмерное развитие фиброза 7. Было предложено несколько профилактических процедур. Тем не менее, результаты оказались неудовлетворительными, с мало пользы и серьезных побочных эффектов 8, 9. В последнее время японская команда, Охки и др. , Предложил пересадить сотовый лист однослойный аутологичных клеток слизистой оболочки полости рта в esophageal шрам. Трансплантация была проведена сразу после ОУР 10, 11. Они продемонстрировали эффективность этого инновационного подхода, во-первых, в собачьей модели, а затем у больных.
Полученных из жировой ткани стромальные клетки (ADSCs) перспективны в регенеративной медицине. Их применение в нескольких областях показал интересные результаты, особенно в процессе заживления ран. ADSC терапия имеет ряд преимуществ, потому что клетки легко изолированы и связаны с противовоспалительными свойствами, локальные эффекты иммуномодуляторов, индукция неоваскуляризации и дифференцировку возможностями в мезенхимальных и не-мезенхимальных линий 12, 13, 14.
В предыдущем исследовании, наша команда продемонстрировала эффективность двойной трансплантации эндоскопической ADSC листов для стриктура пищевода предention после продолжительного ОУР в свином модели 15. В этой статье представлены отчеты о строительстве ADSC листов и эндоскопической техники трансплантации.
протокол
Все животные были обработаны в соответствии с Комитетом по этике исследований животных (Руководящие принципы Министерства сельского хозяйства на французском языке). Протокол получил одобрение местным комитетом по этике, уполномоченного на экспериментам животных на Парижской Декарта университета (регистрационный номер Mesr 2035,02; факультет медицины Париж Декарт, Париж, Франция).
1. ADSC культура и маркировка
- Получить подтвержденные ADSCs из частного учреждения. Культура аллогенных ADSCs при 37 ° С и 5% CO 2 с альфа - минимально необходимой среды, состоящей из 10% фетальной телячьей сыворотки и 1% антибиотиков (пенициллин и стрептомицин).
- Получают около 24 х 10 6 ADSCs на одно животное с использованием стандартных процедур расширения клеток (37 ° C и 5% CO 2). Урожай ADSCs с использованием стандартного раствора трипсина (10 мл для T150 блюдо). Выполнить подсчет клеток с помощью гемоцитометра.
- Выполните ячейку маркировки день перед трансплантацией использованием PKH67 окрашивания прocedure описано ниже.
Примечание: Целью процедуры окрашивания, чтобы отслеживать клеток после трансплантации.- Для того , чтобы этикетка 2 х 10 6 ADSCs, подготовить Раствор А (2 х 10 6 клеток 100 мкл разбавляющего C) и раствор B (4 мкл PKH67 с 1 мл разбавител C).
- Выдержите Растворы А и В в течение 2 мин. Затем добавьте 100 мкл эмбриональной телячьей сыворотки в течение 1 мин.
- Ополосните раствор 300 мкл цитратной RPMI (298,5 мкл среды RPMI и 1,5 мкл цитрат) и центрифуге при 1500 х г в течение 5 мин. Повторите эту операцию 2 раза. Поддерживать меченые клетки и не защищают их от света до листовой конструкции.
2. Дважды ADSC листов Construct
- За день до пересадки, подготовить 12-луночного температуры реагирующих клеток культуры блюдо с 4 мл на лунку среды для культивирования клеток, описанных выше, до того PKH маркировки. Семенной блюдо с 1,5 × 10 6 PKH-этикетокг клеток на лунку и инкубировать в течение 12 ч (37 ° С и 5% CO 2).
- В день трансплантации, отсоединение клеток листа сливающийся путем инкубирования блюдо при комнатной температуре в течение 30 мин.
- Аккуратно аспирата один ADSC лист с пипеткой и слой его на гидрофобной бумаги (диаметром 1,5 см). Используйте эту бумагу в качестве поддерживающей мембраны.
- Возьмитесь другой ADSC лист и аккуратно поместить его поверх другого, чтобы получить конструкцию двойного слоя.
- Повторите эти процедуры для получения столько ADSC листов конструкции по мере необходимости (4 на одно животное).
3. пищеводного эндоскопическую подслизистую Рассечение (ESD)
- В день трансплантации, предварительно самолечением животных с 10 мг / кг кетамина внутримышечного и побудить их с 8 мг / кг внутривенного пропофол. Затем выполните интубации трахеи и поддержания анестезии с изофлуран 2,5% ингаляции.
- После того, как животное находится под общим наркозом, выполняют ОУР с gastroscОПЕ, A видеоскоп, и блок электрохирургия.
- Используйте эндоскопическую нож и мягкой коагуляции для получения Hemi-окружная спинные метки в пределах от 40 см до 45 см от зубной дуги.
- Вводят глицериновый раствор, содержащий краситель индигокармин в подслизистый слой для отделения слоя через слизистую оболочку от мышечного слоя.
- Используйте эндоскопическую нож с режимом endocut I, чтобы получить окружные надрезы.
- Используйте эндоскопическую нож с режимом принудительной коагуляции для выполнения подслизистого рассечения, двигаясь от проксимального разреза к дальнему разреза.
- В конце процедуры ESD, наблюдать геми-окружная, 5 см длиной пищеводного рубец, раскрывающую мышечный слой.
4. Эндоскопические Трансплантация
- Сразу же после того, как ОУР, эндоскопически пересаживать животных с 4-мя двойными конструкциями ADSC листов.
- Возьмитесь в ADSC листов конструкции с эндоскопическими щипцами изащитить его во время транспортировки на участок раны с использованием большого, прозрачного эндоскопическое колпачок.
- Нанесите на всю поверхность конструкции ADSC листа на основание язвы.
- Осторожно применять конструкцию ADSC листов в течение 10 мин, чтобы получить полную и стабильную приживление. Для применения, используйте эндоскопических щипцов или эндоскопическое колпачок и нанести всю поверхность ADSC построить на пищеводного подслизистого слоя.
- Повторите эту процедуру четыре раза для каждого животного, чтобы получить четыре пересажены и прилипшие конструкции двойных клеток листов.
Примечание: Цель состоит в том, чтобы покрыть Аппроксимативно половину раненых области.
5. Послеоперационный Оценка и последующая деятельность
- Для каждого животного, обеспечить пост-ESD обезболивание с внутримышечной инъекции 0,2 мг / кг морфина три раза в день в течение первого дня и с 28-дневной анти-кислотной обработки эзомепразола (40 мг / сут). Выполните антибиотикопрофилактику с amoxicillв (1 г / сут) в течение 7 дней. Авторизоваться жидкости на 1-й день и твердые вещества на следующий день.
- Последующие с животными в течение 28 дней. Получите ежедневные клинические оценки с использованием Mellow Пинкасова дисфагии 16 и измерения изменение веса.
- Мультимодальные оценка стриктуры: под общим наркозом, в определенные дни месяца 3, 14 и 28, выполняют мультимодальный оценку возникновения стриктуры.
- Провести эндоскопическое оценку с помощью описания шрама, измерение стриктур и обнаружение поддержки бумаги мембраны. Измерьте стриктуры с помощью гастроскоп, чтобы пересечь через стриктурой (диаметр гастроскоп составляет 8 мм). Обратите внимание на шрам, обращая внимание на воспалительный аспект (через слизистую оболочку эритемы, отека слизистой и слизистым спонтанное кровотечение) и отсутствие или наличие опоры для бумаги мембраны внутри рубца.
- Применить PCle зеленый зонд через оператора гастроскоп канала непосредственно в рубцовую кровать. Поиск спонтанныйи организованный зеленый сигнал, совместимый с PKH67-меченого ADSC листов конструкта приживления.
- Выполните 2 ортогональных числа случаев Барит эзофагографии с радиологической обруча (спереди и левосторонней числа случаев). Хранить сжатые частоту для оценки стриктуры (степень стриктуры (%) = [1- (длина короткой оси при стенозе / длина нормальной оси при стенозе) х 100)]) 17, 18.
- Жертвоприношение животных.
- На 28-й день, в конце периода наблюдения, выполнять жертвоприношения животных. В то время как животное все еще находится под общей анестезией, вводят 100 мг / кг внутривенно фенобарбитал. Обеспечить смерть животных с использованием клиническое обследование на отсутствие сердцебиения и дыхания движения.
- После воздействия стернотомии и органов, удалить пищевод от каждого жертвенного животного (10% фиксации буферном растворе формалина, парафин и 4 мкм толщиной секций). Пятно слайдыгематоксилином и шафран 15. Оцифровки слайды для компьютерного анализа и сравнения групп животных 15.
Результаты
Культура ADSCs и процедуры для получения ADSC листа показан на рисунке 1. На рисунке 2 показано построение трансплантата, состоящий из двух листов ADSC слоистых друг на друга на своей мембране опоры для бумаги. ADSCs ранее были помечены флуорофора PKH67 , чтобы в естественных условиях мониторинга трансплантата с PCle. На рисунке 3 показаны различные этапы расширенной пищеводной эндоскопическую подслизистую диссекции, что приводит к 5-см и геми-окружная пищеводного рубца. На рисунке 4 показана эндоскопической процедуры трансплантации. Трансплантация прошла успешно для всех животных через 10 мин нежного применения. На рисунке 5 показана положительная оценка PCle на 3 -й день, что подтверждает успех процедуры трансплантации.
Период наблюдения позволили мультимодальных стриктуры Analys является. Различные оценки показаны в следующих рисунках и таблицы. По сравнению с контрольными животными, пересаженный группа животных показали, реже алиментарный неприятности и больший прирост веса на 28-й день у одного животного из пересаженных группа развилась тяжелая стриктура пищевода по сравнению со всеми животными в контрольной группе. По сравнению с пересаженными животных, контрольных животных развивались значительные фиброзной ткани. В таблице 1 представлены клинические и эндоскопические результаты в течение последующего периода. На рисунке 6 показана эндоскопические и радиологические результаты в конце периода наблюдения в трансплантированных и не трансплантированных животных. На рисунке 7 показаны различные гистологических между пересажены и контрольными животными. Эти данные подтверждают эффективность трансплантации ADSC листов для профилактики стриктур пищевода.
018fig1.jpg "/>
Рисунок 1. ADSC листов Construct. A и B. Раннее прохождение ADSCs в стандартных блюдах культуры с различными увеличениями. ADSC листы были получены культивированием PKH меченные ADSCs на коммерческих культуральных чашках температурно-отзывчивыми. C. Когда температура инкубации была снижена до 20 ° С (комнатная температура), все клетки спонтанно отсоединена от посудомоечных поверхностей в виде неизмененной ADSC листов, без необходимости ферментной обработки. D. ADSC лист собирают до того трансплантата конструкции с использованием переноса мембраны. Пожалуйста , нажмите здесь , чтобы посмотреть увеличенную версию этой фигуры.
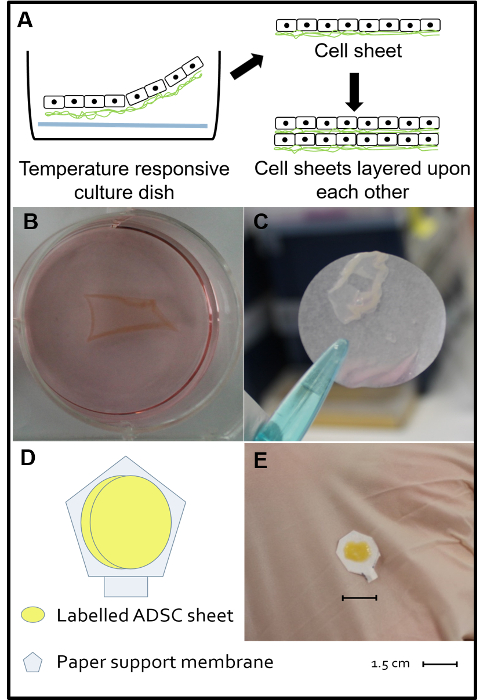
Рисунок 2. Двойной ADSC листов Construct. A, B и C. За день до transplantation, РКН-меченные ADSCs собирали в начале числом пассажей (P4 - P5), отобранный от температуры реагирующих культуры клеток 12-луночного, и культивировали при 37 ° С и 5% CO 2 с альфа - минимально необходимой среды, состоящей из 10% плодной телячья сыворотка и 1% антибиотиков (пенициллин и стрептомицин). Каждую лунку покрывают поли-N-изопропилакриламида мембраной (на дне каждой лунки) и засевали 1,5 × 10 6 клеток. Когда температура инкубации была снижена до 20 ° С (комнатная температура), все клетки спонтанно отдельно в виде неизмененной ADSC листов без необходимости ферментной обработки. Д. Теоретическая схема конструкции двойного клеточного листа , состоящего из двух листов ADSC слоистых друг на друга и наносят на подложку бумаги мембраны. E. Макроскопические вид законченной двойной конструкции ячейки листа. Измененный Reference 15. Пожалуйста , нажмите здесь , т O просмотреть большую версию этой фигуры.
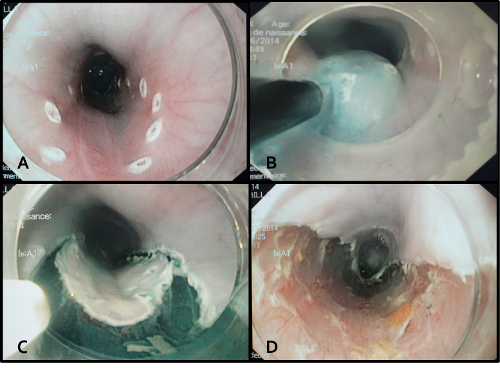
Рисунок 3. эндоскопическую подслизистую Dissection процедуры. Знаки А. Эндоскопические были созданы , чтобы очертить область засечки, в пределах от 40 до 45 см от зубной дуги и с участием половины окружности. Б. подслизистой инъекции глицерина раствора , содержащего краситель индигокармин. Целью этой инъекции было отделить слой слизистой оболочки от мышечного слоя для того, чтобы обнажить подслизистого слоя. C. Периферийные надрезы были выполнены снаружи эндоскопических знаков, раскрывая впрыскивается подслизистого слоя. Д. Эндоскопическое вид в конце подслизистой диссекции показывая 5 см длиной и геми-окружная пищеводного рубец.и др = "_blank"> Пожалуйста, нажмите здесь, чтобы посмотреть увеличенную версию этой фигуры.
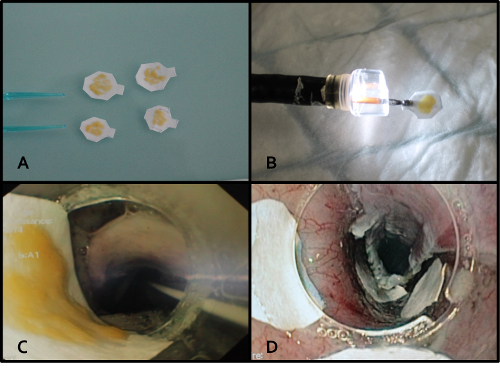
Рисунок 4. Двойной ADSC листов эндоскопической процедуры трансплантации. А. Четыре ADSC конструкции готовы быть пересажены. B. Защита ADSC построить под большой эндоскопической крышкой перед трансплантацией. C. Эндоскопическая вид скрещивания животных зева, показывая ADSC конструкцию защищенной под эндоскопическим крышкой. Д. 10 мин применения было достаточно , чтобы получить соблюдения листа. Применение проводили с использованием эндоскопического колпачка или эндоскопических щипцов. Пожалуйста , нажмите здесь , чтобы посмотреть увеличенную версию этой фигуры.
Рисунок 5. PCle Выводы. PCle на 3 -й день показывает спонтанные и интенсивные сигналы , аналогичные тем , которые получены в лабораторных условиях , совместимых с успешной трансплантации клеток листа. Ни один сигнал не был обнаружен на дни 14 и 28 А. В пробирке PCle сигнала из ADSCs в суспензии. B. В пробирке PCle сигнал ADSCs организованных в ячейке листа. С. в естественных условиях PCle применение зонда к пищеводу рубца. D. В естественных условиях PCle сигнал ADSCs визуализируются на 3 -й день после трансплантации. Модифицированный из ссылки 15. Пожалуйста , нажмите здесь , чтобы посмотреть увеличенную версию этой фигуры.
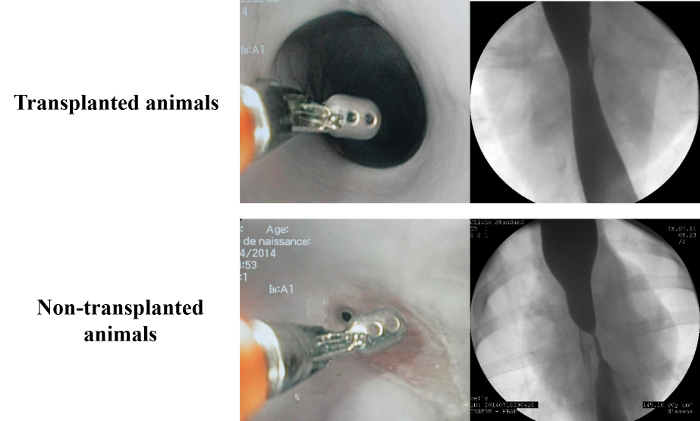
Рисунок 6. Результатыиз анализа морфологической на 28 -й день по сравнению с контрольной группой, эндоскопический и рентгенологические данные на 28 -й день показали короткий и легкий стриктуры без верхнего дилатации и полностью переработана эпителизируется слизистую оболочку. Модифицированный из ссылки 15. Пожалуйста , нажмите здесь , чтобы посмотреть увеличенную версию этой фигуры.

Рисунок 7. гистологической оценки стриктуры районов. Гистологический анализ был проведен после того, как HES-маркировки и слайдов цифровизации. В трансплантированных животных (А), процесс заживления был улучшен, с повышенным реэпителизации и слабому развитию фиброза, по сравнению с не-трансплантированных животных (B). Развитие Интенсивное фиброзная ткань быланаблюдается из-за разрушения мышечной слизистыми оболочками, фиброзной внутреннего вторжения слоя, мышечной и крупных дефектов слизистых оболочек. Модифицированный из ссылки 15. Пожалуйста , нажмите здесь , чтобы посмотреть увеличенную версию этой фигуры.

Таблица 1. Клинические оценки в течение периода наблюдения. Клинические исследования были выполнены с использованием ежедневной клинической оценки по шкале Mellow Пинкасова и с изменением веса. (*) Mellow Пинкасова счет 16. Модифицированный из ссылки 15.
Обсуждение
В этой модели свиньи, трансплантация ADSC-лист был технически успешным, и естественных условиях оценка PCle в разрешенных для мониторинга приживления клеток. Клинические, эндоскопические, рентгенологические и гистологические оценки продемонстрировали эффективность эндоскопического ADSC листа при пищеводного профилактики стриктур после продолжительного ОУР.
Эндоскопическое Трансплантация ADSC глицерина раствора, содержащего лист кармин краситель индиго представляет собой новаторский подход в регенеративной медицине. Охки и др. впервые описал эндоскопическую процедуру трансплантации. В своих исследованиях клеток листов конструкции состоят из слизистой оболочки полости рта эпителиальных клеток листов нанесенный слоем на тонкий лист поливинилидендифторид, используемых в качестве опорной мембраны 10, 11, 19. Поддержка мембрана была захвачена с эндоскопическими щипцами и осторожно положил на кровать язвы. Celприсоединение L-лист был получен через 10 мин нежного применения. Эта процедура еще не был воспроизведен. В этом исследовании двойные конструкции ADSC листов были пересажены по нескольким причинам. Выбор ADSC был основан на нескольких исследованиях, которые продемонстрировали свои противовоспалительными способности, особенно в процессе заживления кожи,. ADSCs , как известно, модулирует кератиноцитов и фибробластов взаимодействий 7. Механизм развития фиброза является сложным и только частично изучена. Паракринная эффект , кажется, играет главную роль в действии ADSC, в том числе противовоспалительного производства фактора, такие как TGF - beta и про-ангиогенных факторов 20.
Эндоскопические трансплантация ADSC листов имеет несколько ограничений. Во-первых, клеточные листы были применены в течение 10 мин к пищеводу рубца, чтобы получить устойчивую адгезию. Эта часть процедуры была сложной, технически сложно, и должны были быть выполнены опытным эндоскопистом, Тем не менее, все животные были успешно пересажены, подтверждающие целесообразность эндоскопической процедуры. В последнее время использование 3D - печатных устройств , чтобы улучшить успех трансплантации клеток листа сообщалось 21. Во-вторых, этот метод связан с неизвестной скоростью выживаемости. Пищеводного шрам агрессивная среда для клеток. Температура реагирующих блюдо позволяет изготавливать из сотового листа построить через внеклеточный матрикс и для образования соединений клеток. Таким образом, чтобы улучшить выживаемость и ADSC взаимодействий, двойной конструкцией ADSC листов был выбран 22, 23. Это исследование не было разработано для оценки либо выживаемость клеток или эффекта дозы пересадки на профилактику стриктур пищевода, которые являются важными вопросы. В- третьих, как и в Охки и др. , Использование опорной мембраны было необходимо, чтобы нести конструкцию ADSC листов. в кормовой частиэр трансплантация, поддержка бумаги мембрана не может быть удален без разрушения конструкции. Это внутри пищеводного инородный материал был ответственен за увеличение воспаления. Оптимизированная методика позволила бы для удаления опоры для бумаги мембраны.
Мониторинг Пересадка с PCle также был сложным. Этот новый эндоскопический метод визуализации позволяет в естественных условиях гистологического анализа, включая визуализацию железистой рисунка, микро-васкуляризации и клеточной изменения. PCle оценивали во многих заболеваний органов пищеварения, таких как воспалительные заболевания кишечника, пищевода Барретта, и муцинозных поджелудочной железы кист 24, 25. PCle-совместимый PKH67 Флуорофор использовался для маркировки клеток. Флуоресцентный сигнал совместим с наличием ADSC листа наблюдалось у 4 животных на 3-й день Этот положительный результат отражает успешность трансплантации ADSC листов. Тем не менее, БекаИспользование PKH67 имеет пониженную сигнал в течение долгого времени и после деления клеток, оценка PCle было возможно только через несколько дней после трансплантации 26. Охки и др. и Kanai и др. мониторинг трансплантации клеток листа через иммунное окрашивание, и они подтвердили присутствие клеток до 8-й день после трансплантации. Зрелые клетки были использованы в этом исследовании, которые имеют преимущество конкретного иммунное окрашивание.
Стриктура пищевода является одним из самых серьезных побочных реакций после ОУР, тем самым ограничивая развитие техники. Оптимальные методы для предотвращения образования стриктуры до сих пор отсутствуют. В клинической практике пациенты с расширенной пищеводного ОУР назначают различные профилактические процедуры, такие как кортикостероиды, эндоскопические баллонных растяжений или стентирования пищевода 27. Местное применение биоматериала проводилось, с различными результатами 28, 29 . Целью регенеративной медицины является восстановление ткани или органа, используя различные подходы, такие как замена ткани или местного иммуномодуляции. Для замены тканей, использование биологических каркасах с использованием или без эпителиальных клеток оценивали в литературе 30, 31. Скороспелый и увеличение реэпителизацию наблюдалось в пищеводе рубца. Для локального иммуномодуляции, мало данных в литературе о ADSC инъекции или амниотической применения 32 мембраны, 33. наблюдалось образование Задержанная стриктуры и сниженную скорость стриктуры.
В этой модели свиньи, процедура трансплантации клеток эндоскопическое листов была успешно выполнена. Пересаживают ADSCs организованных в листах двойных клеток продемонстрировали свою способность предотвращать образование стриктура пищевода после длительного статического электричества. Механизмы, участвующие в ADSC исцеленияПроцесс плохо изучены и должны быть предметом дальнейшего расследования в будущих исследованиях. Таким образом, с учетом этих многообещающих результатов, клиническое испытание должно быть проведено с целью оценки эффективности ADSC листов конструкции после длительного ESD у пациентов.
Раскрытие информации
Авторы не имеют ничего раскрывать.
Благодарности
This study was supported and funded by the Avenir Foundation (Fondation de l'Avenir, 255 rue de Vaugirard, 75719 Paris cedex 15, Paris, France). This study would never have been conducted without the precious help of the veterinary team of the Laboratory of Biosurgical Research from the Alain Carpentier Foundation.
Материалы
| Name | Company | Catalog Number | Comments |
| Transparent endoscopic cap Q180 compatible | Olympus Optical Co | ||
| GIF-Q180 gastroscope | Olympus Optical Co | ||
| Videoscope System Exera II | Olympus Optical Co | ||
| Injection needle 18 G | Olympus Optical Co | ||
| Electrosurgery unit ERBE ICC 350 | ERBE Technology | ||
| Indigo carmin 1% | Life | ||
| Endoscopic hybrid knife | Life | ||
| Minisonde Z pCLE green probe | Mauna Kea Technology | You must learn how to use the probe. The manipulation could be difficult. | |
| Fetal bovine serum | Sigma Aldrich | 12105C | |
| Trypsin | Sigma Aldrich | T146 | |
| Alpha minimum essential medium | Thermo Fisher | 22561-021 | |
| Phosphate-Buffered Salines | Thermo Fisher | 10010-023 | |
| PKH67 dye kit | Sigma Aldrich | Mini67-KT | |
| 12-well temperature responsive cell culture dish | Upcell Thermo Scientific | 174900 | Feel the weel with 4 mL standard medium culture 30 min before seeding cells |
| Esomeprazole 40 mg | Biogaran | ||
| Moprhine sulfate 50 mg/mL | Lavoisier | ||
| Amoxicilline 1 g | Biogaran | ||
| Ketamine 250 mg/5 mL | Panpharma | ||
| Propofol 10 mg/mL | Fresenius | ||
| Hydrophobic paper | Carrefour |
Ссылки
- Ono, S., Fujishiro, M., et al. Long-term outcomes of endoscopic submucosal dissection for superficial esophageal squamous cell neoplasms. Gastrointestinal endoscopy. 70 (5), 860-866 (2009).
- Pech, O., May, A., et al. Long-term efficacy and safety of endoscopic resection for patients with mucosal adenocarcinoma of the esophagus. Gastroenterology. 146 (3), 652-660 (2014).
- Yahagi, N. Is esophageal endoscopic submucosal dissection an extreme treatment modality, or can it be a standard treatment modality. Gastrointestinal Endoscopy. 68 (6), 1073-1075 (2008).
- Rösch, T., Sarbia, M., et al. Attempted endoscopic en bloc resection of mucosal and submucosal tumors using insulated-tip knives: a pilot series. Endoscopy. 36 (9), 788-801 (2004).
- Chennat, J., Ross, A. S., et al. Advanced pathology under squamous epithelium on initial EMR specimens in patients with Barrett's esophagus and high-grade dysplasia or intramucosal carcinoma: implications for surveillance and endotherapy management. Gastrointestinal endoscopy. 70 (3), 417-421 (2009).
- Oyama, T., Tomori, A., et al. Endoscopic submucosal dissection of early esophageal cancer. Clinical gastroenterology and hepatology: the official clinical practice journal of the American Gastroenterological Association. 3 (7), Suppl 1 67-70 (2005).
- Werner, S., Krieg, T., Smola, H. Keratinocyte-fibroblast interactions in wound healing. The Journal of Investigative Dermatology. 127 (5), 998-1008 (2007).
- Yamaguchi, N., Isomoto, H., et al. Effect of oral prednisolone on esophageal stricture after complete circular endoscopic submucosal dissection for superficial esophageal squamous cell carcinoma: a case report. Digestion. 83 (4), 291-295 (2011).
- Hanaoka, N., Ishihara, R., et al. Intralesional steroid injection to prevent stricture after endoscopic submucosal dissection for esophageal cancer: a controlled prospective study. Endoscopy. 44 (11), 1007-1011 (2012).
- Ohki, T., Yamato, M., et al. Treatment of oesophageal ulcerations using endoscopic transplantation of tissue-engineered autologous oral mucosal epithelial cell sheets in a canine model. Gut. 55 (12), 1704-1710 (2006).
- Ohki, T., Yamato, M., et al. Prevention of esophageal stricture after endoscopic submucosal dissection using tissue-engineered cell sheets. Gastroenterology. 143 (3), 582-588 (2012).
- García-Gómez, I., Elvira, G., et al. Mesenchymal stem cells: biological properties and clinical applications. Expert opinion on biological therapy. 10 (10), 1453-1468 (2010).
- Jorgensen, C., Noël, D. Mesenchymal stem cells in osteoarticular diseases. Regenerative Medicine. 6 (6), Suppl 44-51 (2011).
- Antonic, A., Sena, E. S., et al. Stem cell transplantation in traumatic spinal cord injury: a systematic review and meta-analysis of animal studies. PLoS biology. 11 (12), 1001738(2013).
- Perrod, G., Rahmi, G., et al. Cell Sheet Transplantation for Esophageal Stricture Prevention after Endoscopic Submucosal Dissection in a Porcine Model. PLOS ONE. 11 (3), 0148249(2016).
- Mellow, M. H., Pinkas, H. Endoscopic laser therapy for malignancies affecting the esophagus and gastroesophageal junction. Analysis of technical and functional efficacy. Archives of Internal Medicine. 145 (8), 1443-1446 (1985).
- N.A.S.C.E.T. Beneficial effect of carotid endarterectomy in symptomatic patients with high-grade carotid stenosis. The New England Journal of Medicine. 325 (7), 445-453 (1991).
- Randomised trial of endarterectomy for recently symptomatic carotid stenosis: final results of the MRC European Carotid Surgery Trial (ECST). Lancet. 351 (9113), 1379-1387 (1998).
- Kanai, N., Yamato, M., Ohki, T., Yamamoto, M., Okano, T. Fabricated autologous epidermal cell sheets for the prevention of esophageal stricture after circumferential ESD in a porcine model. Gastrointestinal Endoscopy. 76 (4), 873-881 (2012).
- Aggarwal, S., Pittenger, M. F. Human mesenchymal stem cells modulate allogeneic immune cell responses. Blood. 105 (4), 1815-1822 (2005).
- Maeda, M., Kanai, N., et al. Endoscopic cell sheet transplantation device developed by using a 3-dimensional printer and its feasibility evaluation in a porcine model. Gastrointestinal Endoscopy. , (2015).
- Haraguchi, Y., Shimizu, T., et al. Fabrication of functional three-dimensional tissues by stacking cell sheets in vitro. Nature Protocols. 7 (5), 850-858 (2012).
- Nishida, K., Yamato, M., et al. Corneal reconstruction with tissue-engineered cell sheets composed of autologous oral mucosal epithelium. The New England Journal of Medicine. 351 (12), 1187-1196 (2004).
- Napoléon, B., Lemaistre, A. -I., et al. A novel approach to the diagnosis of pancreatic serous cystadenoma: needle-based confocal laser endomicroscopy. Endoscopy. 47 (1), 26-32 (2015).
- Gabbani, T., Manetti, N., Bonanomi, A. G., Annese, A. L., Annese, V. New endoscopic imaging techniques in surveillance of inflammatory bowel disease. World Journal of Gastrointestinal Endoscopy. 7 (3), 230-236 (2015).
- Nagyova, M., Slovinska, L., et al. A comparative study of PKH67, DiI, and BrdU labeling techniques for tracing rat mesenchymal stem cells. In Vitro Cellular & Developmental Biology. Animal. 50 (7), 656-663 (2014).
- Jain, D., Singhal, S. Esophageal Stricture Prevention after Endoscopic Submucosal Dissection. Clinical Endoscopy. 49 (3), 241-256 (2016).
- Lua, G. W., Tang, J., Liu, F., Li, Z. S. Prevention of Esophageal Strictures After Endoscopic Submucosal Dissection: A Promising Therapy Using Carboxymethyl Cellulose Sheets. Digestive Diseases and Sciences. 61 (6), 1763-1769 (2016).
- Sakaguchi, Y., Tsuji, Y., et al. Triamcinolone Injection and Shielding with Polyglycolic Acid Sheets and Fibrin Glue for Postoperative Stricture Prevention after Esophageal Endoscopic Resection: A Pilot Study. The American Journal of Gastroenterology. 111 (4), 581-583 (2016).
- Sakurai, T., Miyazaki, S., Miyata, G., Satomi, S., Hori, Y. Autologous buccal keratinocyte implantation for the prevention of stenosis after EMR of the esophagus. Gastrointestinal endoscopy. 66 (1), 167-173 (2007).
- Nieponice, A., McGrath, K., et al. An extracellular matrix scaffold for esophageal stricture prevention after circumferential EMR. Gastrointestinal Endoscopy. 69 (2), 289-296 (2009).
- Honda, M., Hori, Y., et al. Use of adipose tissue-derived stromal cells for prevention of esophageal stricture after circumferential EMR in a canine model. Gastrointestinal endoscopy. 73 (4), 777-784 (2011).
- Barret, M., Pratico, C. A., et al. Amniotic membrane grafts for the prevention of esophageal stricture after circumferential endoscopic submucosal dissection. PloS One. 9 (7), 100236(2014).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены