Method Article
Стволовых клеток На основе Engineered иммунитет против ВИЧ-инфекции в модели Гуманизированные мыши
В этой статье
Резюме
This protocol describes the methods in constructing a humanized bone-marrow/liver/thymus mouse model with stem cell-based engineered immunity against HIV infection.
Аннотация
С быстрым развитием генной терапии на основе стволовых клеток против ВИЧ, существует требование для прессования животной модели для изучения дифференцировки гемопоэтических и иммунной функции генетически модифицированных клеток. Гуманизированное костного мозга / печени / Тимус (BLT) Мышиная модель позволяет полное воссоздание человеческой иммунной системы на периферии, которая включает в себя Т-лимфоциты, В-лимфоциты, клетки NK и моноцитов. Тимуса имплантат человека также позволяет тимуса селекции Т-клеток в аутогенной тимуса ткани. В дополнение к изучению ВИЧ-инфекции, модель выступает в качестве мощного инструмента для изучения дифференциации, развитие и функциональные возможности клеток, полученных из гемопоэтических стволовых клеток (ГСК). Здесь мы наметим строительство гуманизированного не страдающих ожирением диабетической (NOD) -severe комбинированным иммунодефицитом (SCID) -Общие гамма - цепи нокаута (с = Г - / -) мышей -Bone мозга / печени / тимус (NSG-BLT) с ГСК трансдуцированных с CD4 химерного рецептора антигена (CD4CAR)лентивирусов вектор. Покажем, что CD4CAR ГСК могут успешно дифференцироваться в множественные клоны и обладают активностью против ВИЧ. Цель исследования состоит в том, чтобы продемонстрировать использование NSG-BLT модели мыши в качестве модели в естественных условиях для сконструированного иммунитета против ВИЧ. Стоит отметить, что, так как лентивирусов и ткани человека используется, эксперименты и операции должны быть выполнены в шкафу II класса биологической безопасности в биологической безопасности 2-го уровня (BSL2) с соблюдением специальных мер предосторожности (BSL2 +) объекта.
Введение
Несмотря на успех комбинированной антиретровирусной терапии, ВИЧ-инфекция по-прежнему является пожизненное заболевание. Клеточный иммунный ответ против ВИЧ-инфекции играет чрезвычайно важную роль в борьбе с ВИЧ-репликации. Последние достижения в области манипулирования стволовых клеток позволило для быстрого развития генной терапии подходы к лечению ВИЧ - 1-3. В результате, важно иметь надлежащую животную модель , которая позволяет в естественных условиях исследования эффективности клеточной терапии против ВИЧ.
Работа с ВИЧ, в моделях на животных осложняется тем фактом, что вирус заражает только клетки человека. Чтобы обойти это ограничение, ученые прибегают к использованию модели заболеваний , как вирусом иммунодефицита обезьян (SIV) в макак - резусов 4,5. К сожалению, существуют серьезные ограничения в этой модели из-за присущей различий между видами и различия между SIV и ВИЧ. Кроме того, только узкоспециализированные объекты являются сapable поддерживать работу с приматами нечеловеческих и каждого макаки требует больших инвестиций. Таким образом, существует настоятельная потребность в модели, которая использует иммунную систему человека, которая восприимчивы к ВИЧ-инфекции / патогенеза, и менее финансово непомерно высокой.
Без ожирения диабетические (NOD) -severe комбинированным иммунодефицитом (SCID) -Общие гамма - цепи нокаута (с γ - / -) (или NSG) Кровь / Печень / тимус (BLT) модель гуманизированное мышь все более доказал, что является важным инструментом для изучения ВИЧ-инфекции. Имплантацией гемопоэтических стволовых клеток (ГСК) и фетальной вилочковой железы мышей способны развиваться и резюмировать человека иммунную систему 1-3. Один тип генной терапии, основанной стволовых клеток включает в себя «перенаправлять» периферических Т-клеток целевой ВИЧ путем перепрограммирования гемопоэтических стволовых клеток (ГСК) к дифференцировке в антиген-специфических Т-клеток. Ранее мы показали, что инженерные ГСК с молекулярным клонированного анти-ВИЧ-специфических Т-клеток ререцептор (TCR) по отношению к эпитопу SL9 (аминокислоты 77-85; SLYNTVATL) ВИЧ-1 Gag может переадресовать стволовых клеток в формировании зрелых Т - клеток , которые подавляют репликацию ВИЧ в гуманизированного NSG-BLT модели мыши 6. Оговоркой использования молекулярного клонированный TCR, что оно ограничено конкретным человеческого лейкоцитарного антигена (HLA) подтипа, которые ограничивают применение этой терапии. Химерный антиген рецепторов (CAR), с другой стороны, может быть универсально применен ко всем подтипам HLA. Первоначальные исследования были проведены с использованием CAR, построенную с внеклеточных и трансмембранных доменов человеческого CD4, слитого с внутриклеточным z, домен CD3 сигнализации (называется CD4ζCAR). CD4ζCAR экспрессируются на клетках CD8 Т - могут распознавать оболочку ВИЧ и вызывают цитотоксических Т - клеточный ответ , который похож на что опосредовано Т - клеточного рецептора 7. Недавно мы показали, что человеческие гемопоэтические стволовые клетки могут быть модифицированы с CD4ζCAR, которые затем могут дифференцироваться во множественные кроветворной Lineages, в том числе функциональные Т - клетки способны подавлять репликацию ВИЧ в гуманизированные модели мыши 8. В связи с быстрым продвижением в химерных терапии рецептора антигена рака 9, и продолжающейся характеризации мощных широких нейтрализующих антител 10-12 против ВИЧ , которые позволяют строительство CARs антител одноцепочечных, то воспринимаемое , что многие новые кандидаты конструкции, в дополнение к CD4ζCAR , будет сгенерирован и испытаны для стволовых клеток генной терапии заболеваний ВИЧ и других заболеваний на основе. Кроме того, гуманизированное мышиная модель NSG-BLT , содержащие эти антиген-специфические КДК может также служить полезным инструментом внимательно изучить Т - клеточные ответы человека в естественных условиях. Важно отметить, что наш протокол отличается от предыдущих описанных методов построения гуманизированным из BLT мышей в 13-15 , что гемопоэтические стволовые клетки в желатиновой белковой смеси используют вместо эмбриональных стволах 16 с печенью. Этот протокол описывает: 1) построение HumaniZed BLT мышей сконструированные с CD4ζCAR; и 2) характеристика дифференциации генетически модифицированных клеток; и 3) характеристика функциональности генетически модифицированных клеток.
протокол
Этический Заявление: Человек ткань плода была получена из Advanced Biosciences ресурсов или из Novogenix и был получен без идентификации информации и не требует IRB разрешения на ее использование. Исследования на животных описано в этой рукописи был выполнен в соответствии с письменного согласия Университета Калифорнии, Лос-Анджелес и научно-исследовательского комитета (UCLA) животных (ARC) в соответствии со всеми федеральными, государственными и местными нормативами. В частности, эти исследования проводились в строгом соответствии с руководящими принципами в Руководстве по уходу и использованию лабораторных животных Национального исследовательского совета и аккредитации и руководящих принципов Ассоциации по оценке и аккредитации содержания лабораторных животных (AALAC) Международный под UCLA АРК Номер протокола 2010-038-02B. Все операции проводились под кетамином / ксилазином и изофлуран анестезии и все усилия были сделаны, чтобы свести к минимуму животных боль и дискомфорт.
1. Конструирование гуманизированного мышах с CD4 химерного антигена рецептора
- Обработка фетальный тимуса и разделительный CD34 + ГСК из фетальной печени
- Тимус Processing
- Осторожно промыть тимус в фосфатно-буферном солевом растворе (PBS), рН 7,4, в 15 мл коническую пробирку. Повторите шаг стирки 3 - 4 раза.
- Добавить 7 мл RPMI СМИ + 10% FBS + ручка / стрептококк. Слейте все в стерильный 100 мм чашки Петри.
- Используйте скальпель , чтобы разрезать тимус на мелкие кусочки около 1 мм 2. Поместите каждый из тимуса кусок в одной скважине на 96-луночный планшет. Используйте изогнутый тупой пинцет при передаче тимуса части в 96-луночный планшет.
- Добавьте небольшое количество средств массовой информации (100 - 200 мкл), чтобы все лунки так, чтобы ткань не высохнет. Визуализируйте под микроскопом (thymi есть лепестки и должны выглядеть мешками клеток).
Примечание: Отменить любые куски, которые выглядят сомнительными в любом случае;часто есть соединительная ткань, и это не должно быть имплантировано.
- Добавьте небольшое количество средств массовой информации (100 - 200 мкл), чтобы все лунки так, чтобы ткань не высохнет. Визуализируйте под микроскопом (thymi есть лепестки и должны выглядеть мешками клеток).
- Удалить части подтвердили-тимуса и поместить их в T25 колбу для культивирования клеток. Добавить 7 мл RPMI, дополненной 10% FBS и 450 мкг / мл пиперациллина / тазобактама и амфотерицин B. Осторожно покачайте колбу перемешать. Культура колбу в течение ночи при 37 ° С / 5% CO 2.
Примечание: Этот шаг необходим для предотвращения бактериального загрязнения ткани. - (Необязательный шаг) Замораживание тимус для использования в будущем. Равновесие ломти в 90% сыворотки АВ человека с 10% диметилсульфоксида (ДМСО) в течение 10 мин. Замораживать их со скоростью 1 ° C / мин до -50 ° С, затем быстрое охлаждение до -150 ° С. Когда все будет готово к оттепели, быстро оттаивают в водяной бане при 37 ° С и осторожно промойте 3 раза в RPMI полной среде без ДМСО.
- Обработка печени
- Осторожно промыть печень в PBS в коническую пробирку на 50 мл. Повторите шаг стирки 3 - 4 раза.
- Добавьте 10 мл (измененная Дульбекко Медиа Исков) IMDM СМИ в 50 мл коническую трубку. Слейте все в 100 мм стерильную чашку Петри.
- Однородный ткани печени с помощью двух скальпели. Вырезать печень на мелкие кусочки около 3 мм 2. Вырежьте и выбросьте любую белую соединительную ткань.
- Используйте шприц объемом 10 мл, снабженный 16 калибра тупой иглой взять куски печени и средств массовой информации. Затем перенесите в коническую пробирку на 50 мл.
- Аккуратно ресуспендируют СМИ и ткани суспензии и выслать более 5-7 раз, чтобы полностью гомогенизировать ткани.
- Приготовьте 10 мл IMDM, дополненной ферментами: 500 ед / мл коллагеназы, 2400 Ед / мл гиалуронидаза, и 300 ед / мл ДНКазы, а также 450 мкг / мл пиперациллина / тазобактама и амфотерицин В. Фильтр носителя через фильтр 0,22 мкм, то добавить СМИ к суспензии печени.
- Закрывают 50 мл коническую пробирку, содержащую суспензию печени и плотно прилегают с самоклеящимся пленки, такие как Parafilm то предотвращения утечек. Поворот в ротатор трубки в инкубаторе при температуре 37 ° С в течение 90 мин.
- Фильтр Гидролизованный суспензии клеток через клеточный фильтр 100 мкм в свежий 50 мл пробирку.
Примечание: Добавить PBS к суспензии, чтобы довести общий объем до 50 мл. Разделить это на две пробирки по 50 мл пробирки, каждая из которых содержала 25 мл суспензии клеток. - Медленно и аккуратно легли в основу клеток в каждую пробирку с 10 мл плотности центрифугирования сред (например, Ficoll). Спин при 1200 мкг в течение 20 мин без тормоза. Примечание: все центрифугирование упомянутые в настоящем протоколе делается при комнатной температуре (25 ° C).
- Осторожно снимите интерфейс (то есть., Охристые пальто) из каждой пробирки и передачи на два отдельных 50 мл пробирки. Довести объем каждой трубки интерфейса до 50 мл с помощью PBS. Спин при 300 мкг в течение 7 - 10 мин. тщательно Аспирируйте супернатант.
- Объедините две гранулы. Промыть еще три раза с 50 мл PBS, содержащем 2% FBS. Отжима при 300 мкг в течение 7 - 10 мв каждый раз, в то время как тщательно аспирационных супернатант.
- Ресуспендируют осадок в 50 мл RPMI СМИ + 10% FBS. Граф клеток с использованием гемоцитометра в это время, прежде чем приступить к сортировке клеток.
- Сортировка клеток CD34 + CD34 сразу с помощью сортировки Kit (например., CD34 микро-гранулы), в соответствии с протоколом производителя.
Примечание: В качестве альтернативы, клетки можно культивировать в среде RPMI СМИ + 10% FBS в 1 млн / мл в течение ночи. - Сохранить как CD34 + и CD34- фракции.
ПРИМЕЧАНИЕ: На этом этапе, CD34 + и CD34- клетки могут быть заморожены с помощью Bambanker замораживания средств массовой информации или других замерзающих носители. Замораживание 1 мл 4 - 6 × 10 6 CD34 + клеток на пробирку и заморозить 1 мл 40 - 60 х 10 6 CD34- клеток на пробирку.
- Тимус Processing
- Трансдукция клеток CD34 +
- Подсчитать количество трансдукции скважин, требуемых от 6 хорошо тканевого культурального планшета. 1 также может быть использован для трансдукции до 8 × 10 6 клеток. Длякаждая BLT мышь, 0,5 х 10 6 CD34 + будет имплантирован вместе с клетками CD34- и тимуса под капсулу почки и 0,5 × 10 6 CD34 + клеток будет вводиться внутривенно. Число клеток CD34 + для использования определяется числом мышей (1 млн клеток на мышь).
- Покрыть необходимое количество лунок культуры без ткани обрабатывают 6-луночный планшет с 1,25 мл раствора рекомбинантного фибронектина человека (например., Retronectin) (20 мкг / мл в PBS) в каждую лунку. Закройте планшет и дайте ему постоять в течение 2 ч при комнатной температуре в шкафу чистой биологической безопасности.
- Отберите раствор фибронектина из скважин и добавляют 1,25 мл FACS буфера (PBS с 4% FBS) в каждую лунку для блокирования. Разрешить планшет выдерживали при комнатной температуре (25 ° C) в течение 30 мин.
- Отберите FACS буфера и промывки скважин один раз PBS.
- Хранить PBS в покрытые лунки, пока пластина не будет готов к использованию. Храните планшет при 4 ° С в течение ночи, если он не используется сразу.
- Пластинчатые CD34 + клеток в среде (Infection 2% сывороточный альбумин человека в Yssel в свободной от сыворотки Т-клеточной среде) в растворе фибронектина покрытием лунок (~ 2 х 10 6 клеток / мл) и инкубируют при 37 ° С в течение 1 ч.
- С помощью пипетки для добавления лентивирусов вектора в лунки при множественности инфекции (MOI) между 2 - 10. Аккуратно перемешать и инкубировать в течение ночи при 37 ° С.
Примечание: Титр лентивирусов вектора, используемого должно быть определено заранее. - Урожай клеток на следующее утро, аккуратно очищая дно лунок с клеточным скребком. Собирают клетки и считаться с гемоцитометра в это время.
- Для подготовки клеток для имплантата, смешайте 0,5 х 10 6 трансдуцированных клеток CD34 + с 4,5 × 10 6 CD34- клеток на мышь, аликвоты в стерильные 1,5 мл завинчивающейся крышкой трубки. Спин клетки вниз на 300 мкг, чтобы осадить их, аспирация супернатант. Спин их снова при 300 мкг и аспирация любой остающийся супернатант с использованием P10 пипетки и аспирационных очень чаrefully. Хранить сухие гранулы на льду в течение всего исследования. Примечание: Для того, чтобы убедиться, что клетки жизнеспособны, используют осажденные клетки и выполнять операции в течение 2-3 часов.
- Для подготовки клеток для инъекций, спина 0,5 х 10 6 трансдуцированных CD34 + клеток на мышь , чтобы осадить их, аспирация супернатант. Ресуспендируют клеток в 100 мкл RPMI сред на мышь и держать на льду.
- Для того, чтобы проверить эффективность трансдукции, аликвоты ~ 1 х 10 5 не-трансдуцированных и трансдуцированных клеток CD34 + из каждого состояния и культуры в 200 мкл цитокиновой среды (RPMI среде с 10% FBS, с добавлением 100 нг / мл человеческого IL-3, IL-6 , SCF) в 96-луночный планшет в течение 5 - 7 дней при 37 ° с.
Примечание: Клетки, используемые на этой стадии, не используется для операции, но, чтобы гарантировать, что трансдукция является успешным, а вектор не является токсичным для выживания и обновления стволовых клеток. Эффективность трансдукции может быть проверена путем поиска экспрессии гена вектора (например., GFP и CD4) , и анализируют с помощью проточной цитометрии.
- Тканевые трансплантаты Построить Генетически преобразованных мышей
- В тот же день до операции выполняют общее облучение тела с ослабленным иммунитетом мышей NOD.Cg- Prkdc SCID Il2rg т m1Wjl / SZJ (NSG) с цезием-137 Облучатель и дозе 2,7 Гр (270Rad).
ПРИМЕЧАНИЕ: NSG мышей сильно ослабленным иммунитетом. Поэтому их жилье и техническое обслуживание должно соответствовать самым высоким стандартам здравоохранения и обрабатываются высококвалифицированным персоналом. - Налейте тимуса кусочки и среду из колбы в 60 мм чашку. Налейте PBS в другой 60 мм блюдо, которое будет использоваться для очистки троакар и сохранить почки мокрые.
- Охладить положительные советы смещения пипеток, помещая их в открытые 1,5 мл стерильного завинчивающейся крышкой пробирки на льду. Держите на льду с высушенными клеточными гранул и желатиновой смеси белков, таких как Матригель.
Примечание: Важно, чтобы сохранить желеобразную смесь белка и любые трубы или советы, которыебудет прикоснуться к ней холодно во все времена, пока не будет загружена игла имплантата. - Обезболить мышей: Взвесьте мышей по отдельности и записывать веса; уха пробивать мышей сосчитать их. Вводят их внутрибрюшинно с 15 мкл кетамина (2,6 мг / мл в физиологическом растворе) / ксилазином (100 мг / мл в физиологическом растворе) на грамм массы тела). Положите мышей обратно в клетку и ждать его, чтобы быть полностью под наркозом.
ПРИМЕЧАНИЕ: Проверьте уровень анестезии мыши, сжав лапу. Если мышь рефлекторно вздрагивает, управлять 25-50% от первоначальной суммы кетамина / ксилазина для дальнейшего анестезию мыши. Подождите, пока он не рефлекторно дрогнул выполнить операцию. - С помощью машинки для стрижки Oster (электробритвы), брить левую сторону каждой мыши от бедра к плечу между центром спины и живота. Подкожно вводят 0,3 мл разведенной Carprofen (6 мг / кг) в плечо животного или паховой треугольника (нога ямы). Используя ватный тампон, положить небольшую каплю искусственной слезына каждый глаз и положите мышь на его стороне обратно в клетку.
Примечание: Предел операции Prep к одной клетке (приблизительно 4 - 5 мышей) одновременно. - Промойте канюлю имплантата рака иглой 16 калибра (троакара) с PBS. Используя пару тупых изогнутых щипцов, место кусок тимуса от 60 мм блюдо в отверстие канюли с троакаром только внутри отверстия, а затем потянуть назад на троакар аспирацию ткани в канюлю.
- Используйте положительное пипетку смещение и охлажденный наконечник поставить 5 мкл холодной желатиновой белковой смеси в пробирку с высушенного осадка клеток (CD34 + и CD34- смеси для имплантированных клеток) и осторожно перемешать, чтобы генерировать клеточной суспензии. Не пипеткой вверх и вниз. Пипетировать студенистой белковой суспензии смесь / клеток в отверстие полой иглы и медленно потяните на троакар, чтобы загрузить иглу.
Примечание: Рекомендуется иметь помощника, чтобы загрузить пипетку в то время как один манипулирует иглу имплантата. - Тампон выбритый участок мыши с повидон-йодом, а затем вытрите область со спиртом салфетку три раза. Определите самые темные пятна под кожей. Это указывает местоположение селезенки. Почек составляет приблизительно 5 мм спинные селезенки. Поднимите кожу с изогнутыми щипцами и сделать 15 мм разрез с хирургическими ножницами в коже параллельно селезенки. Затем сделайте аналогичный разрез в брюшине слое ниже. У мужчин, почки должны быть хорошо видны, и можно выдавливать просто нажав на животе. Вы можете поддержать почку с кровоостанавливающего или парой изогнутых тупыми щипцами. У самок, яичники, как правило, блокируют почки от легкой добычи. Использование кровоостанавливающего, поднимите яичник и осторожно выставить из почки.
- Используйте игольчатым наконечником пинцет, чтобы срывать крошечное отверстие на заднем конце капсулы почки.
ПРИМЕЧАНИЕ: Не используйте эти иглы наконечником щипцов для обработки биологически опасных материалов. - Вставьте имплантатигла в это отверстие и вдоль почки, пока отверстие канюли не полностью покрыта почечную капсулу.
- Осторожно выдавите ткани под почечную капсулу, и вытащить иглу обратно. Части тимуса может быть липким, так что используйте изогнутым пинцетом, чтобы убедиться, что тимус часть не выходит с иглой.
- Поднимите брюшины с пинцетом и аккуратно использовать кровоостанавливающего, чтобы подтолкнуть почку на место. Привяжите один двойной завязанный стежок в брюшине, используя 4-0 викрил рассасывающиеся шовные материалы. Используйте два Autoclips раны клипы, чтобы закрыть кожу.
- Смешайте трансдуцированных CD34 + клетки , которые были установлены в сторону для инъекций и поглощение 100 мкл (0.5x10 6 клеток) в шприц инсулина. Внедрить эти клетки в мышь через заглазничными инъекции вены или других способов внутривенного введения. Используя ватный тампон, положить небольшую каплю искусственных слез на каждый глаз и положить мышь на его стороне обратно в клетку.
- После того, как все мыши были бееп имплантированы, подтверждают, что животные приходя в сознание и ambulating обычно, прежде чем покинуть их.
- Послеоперационный уход: На следующий день после операции, подкожно вводят 0,3 мл разведенной Carprofen (6 мг / кг) и 1,2 мл стерильного физиологического раствора в каждую мышь. 2 и 3 дня после операции, подкожно вводят 1,5 мл стерильного физиологического раствора в каждую мышь. Монитор мышей и надрезы в течение 10-14 дней после операции. Удалите Autoclips и взвешивают мышей через 10-14 дней. ПРИМЕЧАНИЕ: Мыши вялым после лучевой терапии и инъекции физиологического раствора предотвращает животных от обезвоживания организма.
- Через 8 - 10 недель, проверьте приживление кровотечением мышей и проведение анализа FACS на периферической крови, окрашивая для маркеров, таких как CD45, CD3, CD4, CD8, а также любые гены, вектор должен выразить.
- В тот же день до операции выполняют общее облучение тела с ослабленным иммунитетом мышей NOD.Cg- Prkdc SCID Il2rg т m1Wjl / SZJ (NSG) с цезием-137 Облучатель и дозе 2,7 Гр (270Rad).
2. Характеристика дифференцировки и развития генно модифицированных клеток
- ХарактеристикаГенные модифицированные клетки из периферической крови
- 8 - 10 недель после трансплантации, получают 50 - 100 мкл крови мышей из ретро-орбитальное обрез. Место в микроцентрифужных пробирки, содержащие 10 мкл ЭДТА. Центрифуга клетки при 350 мкг в течение 3 мин. Собирают плазму. Замораживание при -80 для анализа ELISA или плазмы анализа вирусной нагрузки, если мышь инфицирован ВИЧ.
- Добавить раствор 2 мл раствором NH4Cl (83%) , чтобы лизировать красные кровяные клетки. Инкубировать в течение 5 минут при комнатной температуре (25 ° C). После инкубации добавляют 10 мл RPMI 10% FBS, чтобы заполнить трубу. Спин при 300 мкг в течение 5 мин. тщательно Аспирируйте супернатант. Клетки готовы к иммунологического окрашивания и проточной цитометрии анализа и других анализов.
Примечание: Маркеры для различных гематопоэтических клеточных клонов, активации и фенотипических маркеров для наивных или памяти клеток могут быть измерены через каждые 2 недели до и после того, как ВИЧ-инфекции с помощью проточной цитометрии. Вентили создаются путем окрашивания клеток с контролем изотипа. Рекомендуется для окрашивания Healtхй человека МНПК и использовать его в качестве положительного контроля. В качестве альтернативы, мышь может быть умерщвлены и до 1 мл периферической крови могут быть получены из пункции сердца , который обеспечит достаточное количество клеток для нескольких панелей анализа потока 17.
- Характеристика гена модифицированных клеток из селезенки, вилочковой железы и костного мозга
- Урожай селезенка, тимус и костный мозг от мышей Гуманизированные BLT
- Эвтаназии мышей с помощью передозировки изофлуран. Подтвердите эвтаназию с вторичным смещением шейных позвонков. Spray поверхность каркаса с 70% -ным этанолом, чтобы держать мех от прилипания к тканям. Придавить конечности на восковую рассечение лоток.
- Используйте хирургические ножницы, разрезать кожу, а затем разрезают через брюшную слой, чтобы обнажить полость тела.
- Удалить селезенку с помощью щипцов. Удалите тимуса имплантат на почки с помощью щипцов и ножниц. Поместите тимуса имплантат и селезенку в промаркированные пробирки Контаоцен- ками в 5 мл PBS.
- С середины живота вырезать и удалить кожу от дистальной части мыши, покрывающей нижние конечности.
- Отрезать мышцы от нижних конечностей с помощью ножниц и тщательно вывихнуть от вертлужной впадины тазобедренного сустава. Удалить бедренной и большеберцовой костей и поместить их в пробирку, содержащую 5 мл PBS.
- Выделение спленоцитов
- Поместите сетчатый фильтр 100 мкм клеток на коническую трубку емкостью 50 мл. Влажный фильтр с 3 мл RPMI среде с добавлением 10% FBS и пен / стреп (RPMI полной среды).
- Поместите селезенку на клеточный фильтр. С помощью резиновой поршень 10 мл шприц, разомните селезенку, чтобы расщепить ее через сито в 50 мл пробирку.
- Промыть фильтр грубой очистки клеток с 5 мл RPMI полной среды от 4 до 5 раз.
- Спин клетки при 300 мкг в течение 10 мин.
- Отберите супернатант и ресуспендируют осадок в 5 мл красных кровяных клеток лизис буфера. Выдержите при комнатной темпераTURE в течение 10 мин. Добавьте 20 мл RPMI полной среды и спина при 300 мкг в течение 7 мин.
- Отберите супернатант и ресуспендируют осадок в 10 мл RPMI полной среды и фильтр снова через 100 мкм клеточный фильтр с. Граф клеток с использованием гемоцитометра.
Примечание: Клетки могут быть использованы для естественных условиях анализов ех, анализ потока и может быть жизнеспособно заморожены для дальнейшего использования. Перед подсчетом клеток, трипанового синего может быть использован для определения количества жизнеспособных клеток.
- Выделение человека из тимоцитов Implant
- Поместите тимус в 5 мл PBS в лунку 6-луночного планшета с. Использование чистых тупыми щипцами и ножницами вырезать тимус на мелкие кусочки.
- Поместите стерилизованного сетка из нержавеющей стали квадрат в скважину. С помощью резиновой поршень 10 мл шприца, разотрите тимуса штук на сетке из нержавеющей стали распадаться тимус.
- Ресуспендируют клетки хорошо и процедить через 100 мкм клеточный фильтр с. Спин клетки при 300 мкг в течение 10 мин.Приостановка клеток в 10 мл RPMI полной среды. Если комки видны, проходят ресуспензированной-клетки через клеточный фильтр снова.
- Граф клеток с использованием гемоцитометра.
Примечание: клетки могут быть использованы для анализа потока и жизнеспособно замораживают для последующего использования.
- Выделение клеток из костного мозга
- Чистый и стерилизовать ступку и пестик с 70% -ным этанолом. Поместите бедренной и большеберцовой костей в ступке. Добавьте 5 мл холодного PBS. Используйте пестик, чтобы сокрушить кости, пока PBS не станет светло-розовый и облачно.
- Пипетировать вверх жидкость из раствора и фильтруют через сетчатый фильтр 50 клеток мкМ помещают на 50 мл коническую трубку. Вымойте раствор с 5 мл PBS и повторить пять раз, пока PBS не станет ясно.
- Спин клетки вниз на 300 мкг в течение 7 мин. Отберите супернатант и ресуспендируют в 10 мл RPMI полной среды.
- Граф клеток с использованием гемоцитометра.
Примечание: клетки могут быть использованы для анализов бывших естественных условиях, и анализ потока может быть жизнеспособно замороженный Fили последующего использования.
- Урожай селезенка, тимус и костный мозг от мышей Гуманизированные BLT
3. Функциональная характеристика генных модифицированных клеток
- Инфекция и мониторинг вирусной репликации ВИЧ в течение долгого времени
- После подтверждения системы восстановления иммунной человека, вводить желаемое количество вируса ВИЧ с помощью инъекции вену ретроорбитальной использованием инсулиновый шприц. После того, как ВИЧ-инфекции, собирают 100 мкл периферической крови через ретро-орбитальное кровотечение каждые 2 недели.
- Урожай плазмы, выполнив действия, описанные в части 2.1.1 - 2.1.2. Для анализа вирусной нагрузки ВИЧ, экстракт вирусной РНК с использованием набора для экстракции РНК в соответствии с инструкцией изготовителя и измерять вирусную нагрузку в реальном масштабе времени RT-PCR с соответствующими праймеров и зондов наборов для вируса ВИЧ используется 4,8,18,19.
- Для измерения клеток связаны РНК ВИЧ и идентифицировать клетки, которые активно заражены ВИЧ, сначала выполнить RBC лизис следующие шаги 2.1.2
- Ресуспендируют суспензии клеток в 1; Мл PBS, делят равномерно на две трубки. Спин при 300 мкг в течение 5 мин. Отберите супернатант.
- Для измерения соты, ассоциированной РНК, экстракт РНК с использованием набора для экстракции РНК в соответствии с инструкцией изготовителя и выполнять в режиме реального времени RT-PCR с использованием соответствующих праймеров и зондов наборов.
Примечание: Важно, чтобы грунтовка / зонд не распознает лентивирусов, используемый для модифицированных стволовых клеток - Для измерения ВИЧ-инфицированных клеток с помощью проточной, ресуспендирования клеток в другой трубке в 50 мкл FACS буфера и выполнить поверхностную окраску с желаемого антитела, такие как анти-CD45, анти-CD4 и анти-CD3. После того, как поверхность пятна, исправить и проницаемыми клетки и пятно внутриклеточно для экспрессии затычки с использованием анти-Gag антитела (клон KC57). Выполните проточной цитометрии.
- Ex Vivo цитокин Анализ Гена модифицированных клеток из спленоцитах
- Урожай спленоциты от мышей, как описано в разделе 2.2.2.
- Подготовка клеток-мишеней. Для тестирования функционаланость CD4 химерный рецептор антигена модифицированных Т-клеток, используют клетки, инфицированные ВИЧ-T1 в качестве клеток-мишеней. Инфицировать клетки T1 с ВИЧ 3 дней до анализа цитокина, подтверждают ВИЧ-инфекции путем окрашивания клеток внутриклеточно с анти-ВИЧ рвотным-антителом (клон KC57). Используйте неинфицированных клеток T1 в качестве целевых контрольных клеток.
- Co-инкубировать спленоцитов с целевыми или контрольными клетками в соотношении 1: 1 в течение ночи. Для достижения наилучшего результата, проводить титрование (1: 1, 1: 3, 1: 9) эффекторных (спленоциты) против клеток-мишеней (инфицированные T1s). Например, ресуспендируют 0,9 млн спленоцитов в 0,25 мл RPMI полной среды, добавить 0,9, 0,3 или 0,1 миллиона инфицированных T1 или неинфицированных T1s ресуспендировали в 0,25 мл RPMI полной среды.
- На следующее утро, добавить ингибитор белка транспорта в течение 6 часов , чтобы ингибировать транспорт белков и выполнять окрашивание внеклеточных маркеров и внутриклеточной экспрессии цитокинов , как описано выше в 8.
Результаты
На рисунке 1 показан контур построения гуманизированные мышей BLT с модифицированной стволовой клетки. 10 недель после имплантации, мышей умерщвляли для оценки дифференцировки и развития генных модифицированных клеток. Как показано на рисунке 2, множественные лимфоидные ткани (кровь, селезенка, тимус и костный мозг) собирали из мышей , который был изменен с CD4ζCAR. CD4ζCAR используется в данном протоколе содержит CD4 химерный рецептор антигена и GFP , которые можно обнаружить с помощью анти-CD4 антитела и экспрессию GFP 8. Клетки были выделены и окрашивали антителом против человеческого CD45, а также анти-CD4-антитела и анализировали с помощью проточной цитометрии. были обнаружены GFP и CD4 двойные положительные клетки, что указывает на присутствие CD4CAR + клеток в нескольких лимфоидных тканей.
Для исследования дифференцировки гена модифицированных клеток, спленоциты окрашивали антителами против человеческого CD45 (лимфоцитов), CD3 (Т-клетки), CD19 (В-клетки), CD14 (моноцитов и макрофагов) и CD337 (NK-клетки). Как показано на рисунке 3, CD4ζCAR гемопоэтических стволовых клеток дифференцироваться в нескольких родословных.
Для того, чтобы исследовать, если CD4CAR модифицированные клетки являются функциональными, мы с спленоцитов выдерживают совместно клеток-мишеней, что CD4CAR клетки будут распознают (клетки, инфицированные ВИЧ T1 или неинфицированных клеток T1 в качестве контроля). Клетки совместно инкубировали в течение ночи, а ингибитор белка транспорта был добавлен в течение еще 6 часов. Затем клетки фиксировали и проницаемыми для окрашивания для внутриклеточной экспрессии цитокинов, таких как TNF & alpha; IFN & gamma; и. Как показано на рисунке 4, CAR экспрессирующие клетки получают большее количество IFN & gamma ; и TNF & alpha ; с зараженными клетками T1.
нагрузка / 54048 / 54048fig1.jpg "/>
Рисунок 1: Схема построения гуманизированных BLT мышей с модифицированными стволовыми клетками FT: фетальный. Тимуса. FL:. Фетальной печени Пожалуйста , нажмите здесь , чтобы увидеть большую версию этой фигуры.

На рис . 2: CD4 рецептора химерный антиген модифицированные клетки могут быть обнаружены в нескольких лимфоидных тканей мышей с CD4CAR модифицированные ГСК были умерщвлены в течение 10 недель после операции и нескольких лимфоидной ткани собирали и клетки окрашивали CD45 анти-человеческие и анти-CD4 человека антител и анализировали с помощью проточной цитометрии. Пожалуйста , нажмите здесь , чтобы посмотреть увеличенную версию этой фигуры.
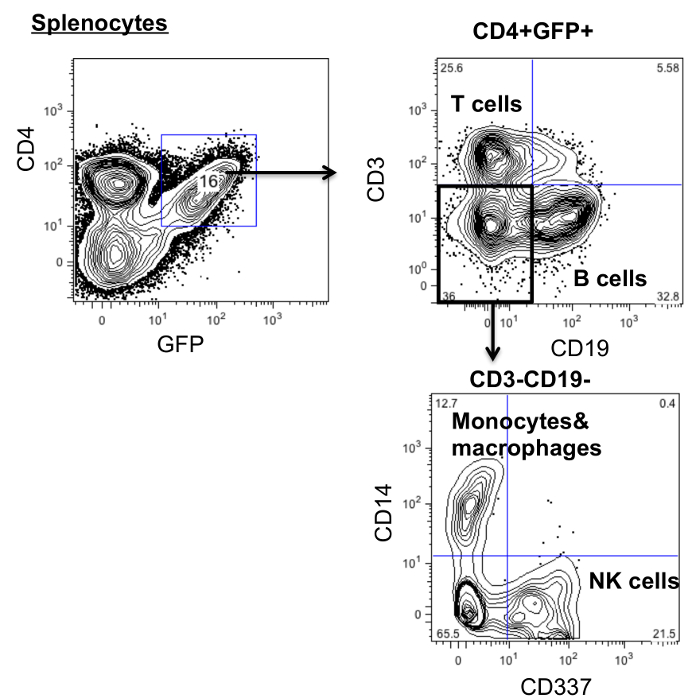
Рисунок 3:.. CD4 рецептора химерный антиген модифицированные клетки могут дифференцироваться в множественные клоны спленоциты из CD4CAR модифицированных мышей собирали и окрашивали антителами против человеческого CD45, CD3, CD19, CD14 и CD337 и анализировали с помощью проточной цитометрии Пожалуйста , нажмите здесь , чтобы увидеть увеличенную версия этой фигуры.
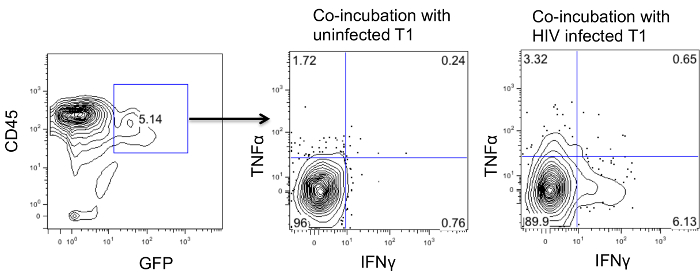
Рис . 4: Ex естественных условиях цитокин анализ на CD4 CAR + Т - клеток спленоциты от ВИЧ - инфицированных мышей CD4CAR стимулировали либо клеток , инфицированных или неинфицированных ВИЧ T1 и их внутриклеточной продукции цитокина показан. Пожалуйста , нажмите здесь , чтобы вива большую версию этой фигуры.
Обсуждение
С CAR и HSC на основе инженерии иммунитета набирает обороты в направлении клинических исследований, важно иметь подходящую модель животного, чтобы внимательно изучить дифференцировку и функции этих сконструированных клетках. В этом протоколе мы описали методы построения и тестирования гуманизированные мышей с генетически модифицированных стволовых клеток инженерии против ВИЧ. Важно, чтобы иметь эффективную трансдукции стволовых клеток перед трансплантацией. Тем не менее, из - за способности Т - клеток к пролиферации после распознавания клеток - мишеней, низкие уровни модификации стволовых клеток было достаточно , чтобы сформировать устойчивый ответ против ВИЧ - репликации 8.
Тем не менее, для достижения высокого уровня модификации стволовых клеток, мы рекомендуем использовать трансдуцированных клеток CD34 + в желатиновой белковой смеси с аутогенной тимуса вместо печени и тимуса куски для мышей хирургии , которые были описаны в другом месте 13-15. Студенистый белка смесь представляет собой solubilizе изд ткани базальной мембраны богаты белками внеклеточного матрикса. В нормальных физиологических условиях, студенистое протеиновую смесь полимеризуется для получения водостойких, биологически активные и стабильные матрицы , которая позволила бы эффективное вложение и дифференцировку стволовых клеток 20. восстановление человеческой клетки может быть проверена с помощью ретро-орбитальное кровотечения и проточной цитометрии 6 - 8 недель после операции. Для того, чтобы гарантировать, что вектор не является токсичным для выживания и обновления стволовых клеток, рекомендуется титровать вектор в CD34 + клеток до эксперимента, как описано в 1.2.6.
Пропускная способность мышиной модели NSG-BLT для поддержки инфекции слизистых оболочек, последовательное виремии и клеточный иммунный ответ делает ее весьма полезной моделью для изучения иммунной патологии ВИЧ и клеточной терапии для лечения ВИЧ - инфекции 1. Самое главное, что Т-клетки, полученные от мышей NSG-BLT выбраны в аутологичных тимуса ткани, что позволяет исследователю изучить судьбугенных модифицированные стволовые клетки после тимуса селекции 8,21. С помощью описанного метода, мы смогли получить 40% -90% воссоздание иммунных клеток человека последовательно. Низкий уровень восстановления клеток человека может быть результатом нескольких факторов, в том числе навыки лица, выполняющего операцию и качества тканей для трансплантации. Для достижения высокого уровня восстановления клеток человека, важно обеспечить трансплантаты надежно размещается под почечную капсулу. Кроме того, настоятельно рекомендуется изучить каждую тимуса имплантат, подготовленный к операции под световым микроскопом и отказаться от любых сомнительных штук.
Хотя гуманизированное модель BLT мышь является перспективным инструментом для изучения сконструированную иммунитета против ВИЧ (обзор в 1,15,22), она имеет свои ограничения. А именно, эта модель не идеально имитировать человеческую периферическую иммунную систему. Исследования показали, замедленное развитие гипер-мутировали, класса с коммутацией каналов IgG antiboду 1,23. Кроме того, с помощью иммунно-дефицитных мышей является технически сложной задачей и поддержание этих мышей здоровым требует значительных ресурсов и подготовки кадров. Незначительные оппортунистические инфекции могут проявляться как существенные различия между образцами и потенциально могут иметь негативные последствия для экспериментов. Поэтому важно иметь хорошо подготовленные помещения и соответствующим образом обученный персонал для поддержания целостности будущего 1,24 данных. С учетом этих ограничений в виду, гуманизированное NSG-BLT модель мыши по- прежнему является важным инструментом для изучения на основе стволовых клеток сконструированного иммунитета, как это показано на этих примерах 4,8.
С тенденцией развития химерных рецепторов антигенов на основе ВИЧ - Broad нейтрализующих антител 10 и модификации домена сигнализации для более эффективного CAR 25, эта модель и протокол может быть использован для характеристики и исследовать функциональность гена модифицированного CELLs с новым поколением автомобилей. Кроме того, эта модель потенциально может вместить исследования по терапии на основе иммунной (такие как ингибирующее блокады рецепторов) в сочетании с Engineered иммунитета.
Раскрытие информации
The authors have nothing to disclose.
Благодарности
We would like to thank Ms. Jessica Selander in providing artistic assistant in making our figures. This work was funded by grants from the NIAID/NIH, grant no. RO1AI078806, the UCLA Center for AIDS Research (CFAR), grant no. P30AI28697, the California Institute for Regenerative Medicine, grant no. TR4-06845, the American Federation for AIDS Research (amfAR), grant no. #108929-54-RGRL, and the UC Multi-campus Research Program and Initiatives, California Center for Antiviral Drug discovery (CCADD)
Материалы
| Name | Company | Catalog Number | Comments |
| CD34 microbead kit | Miltenyi | 130-046-702 | For sorting human CD34+ progenitor cells |
| Bambanker | Wako | 302-14681 | For freezing cells |
| QIAamp Viral RNA kit | Qiagen | 52904 | For measuring viral load in the serum |
| MACSQuant Flow Cytometer | Miltenyi | For flow analysis | |
| BD LSRFortessa™ | BD biosciences | For flow analysis | |
| Hyaluronidase | Sigma | H6254-500MG | For tissue digestion |
| Deoxyribonuclease I | Worthington | LS002006 | for tissue digestion |
| Collagenase | Life technology | 17104-019 | for tissue digestion |
| CFX Real time PCR detection system | Biorad | For measuring viral load and gene expression | |
| Mice, strain NOD.Cg-Prkdcscid Il2rgtm1Wjl/SzJ | The Jackson Laboratory | 5557 | For constructing the humanized mice |
| Penicillin Streptomycin (Pen Strep) | Thermo Fisher Scientific | 10378016 | For culturing cells |
| Piperacillin/tazobactam | Pfizer | Zosyn | Anti-fungal |
| Amphotericin B (Fungizone antimycotic) | Thermo Fisher Scientific | 15290-018 | Anti-fungal |
| Autoclip Wound Clips, 9 mm - 1,000 units | Becton Dickinson | 427631 | For surgery |
| Sterile Poly-Reinforced Aurora Surgical Gowns, 30 per case | Medline | DYNJP2707 | For surgery |
| Sutures, 4-0, vicryl | Owens and Minor | 23000J304H | For surgery |
| Alcohol prep pads | Owens and Minor | 3583006818 | For surgery |
| Gloves, surgical, 6 1/2 | Owens and Minor | 4075711102 | For surgery |
| Yssel’s Serum-Free T-Cell Medium | Gemini Bio-products | 400-102 | For CD34+ cell transduction |
| Human Serum Albumin | Sigma-Aldrich | A9511 | For CD34+ cell transduction |
Ссылки
- Karpel, M. E., Boutwell, C. L., Allen, T. M. BLT humanized mice as a small animal model of HIV infection. Current opinion in virology. 13, 75-80 (2015).
- Zhen, A., Kitchen, S. Stem-cell-based gene therapy for HIV infection. Viruses. 6 (1), 1-12 (2014).
- Goulder, P. J. R., Watkins, D. I. HIV and SIV CTL escape: implications for vaccine design. Nature Reviews: Immunology. 4 (8), 630-640 (2004).
- Kitchen, S. G., Bennett, M., et al. Engineering Antigen-Specific T Cells from Genetically Modified Human Hematopoietic Stem Cells in Immunodeficient Mice. PloS one. 4 (12), e8208(2009).
- Goulder, P. J. R., Watkins, D. I. HIV and SIV CTL escape: implications for vaccine design. Nature Reviews: Immunology. 4 (8), 630-640 (2004).
- Kitchen, S. G. S., Levin, B. R. B., et al. In vivo suppression of HIV by antigen specific T cells derived from engineered hematopoietic stem cells. PLoS Pathogens. 8 (4), e1002649(2012).
- Yang, O. O., Tran, A. C., Kalams, S. A., Johnson, R. P., Roberts, M. R., Walker, B. D. Lysis of HIV-1-infected cells and inhibition of viral replication by universal receptor T cells. PNAS. 94 (21), 11478-11483 (1997).
- Zhen, A., Kamata, M., et al. HIV-specific Immunity Derived From Chimeric Antigen Receptor-engineered Stem Cells. Molecular Therapy. 23 (8), 1358-1367 (2015).
- Barrett, D. M., Singh, N., Porter, D. L., Grupp, S. A., June, C. H. Chimeric Antigen Receptor Therapy for Cancer. Annual Review of Medicine. 65 (1), 333-347 (2014).
- Pejchal, R., Doores, K. J., et al. A Potent and Broad Neutralizing Antibody Recognizes and Penetrates the HIV Glycan Shield. Science. 334 (6059), 1097-1103 (2011).
- Caskey, M., Klein, F., et al. Viraemia suppressed in HIV-1-infected humans by broadly neutralizing antibody 3BNC117. Nature. 522 (7557), 487-491 (2015).
- West, A. P., Scharf, L., Scheid, J. F., Klein, F., Bjorkman, P. J., Nussenzweig, M. C. Structural insights on the role of antibodies in HIV-1 vaccine and therapy. Cell. 156 (4), 633-648 (2014).
- Lan, P., Tonomura, N., Shimizu, A., Wang, S., Yang, Y. -G. Reconstitution of a functional human immune system in immunodeficient mice through combined human fetal thymus/liver and CD34+ cell transplantation. Blood. 108 (2), 487-492 (2006).
- Melkus, M. W., Estes, J. D., et al. Humanized mice mount specific adaptive and innate immune responses to EBV and TSST-1. Nature medicine. 12 (11), 1316-1322 (2006).
- Shultz, L. D., Brehm, M. A., Garcia-Martinez, J. V., Greiner, D. L. Humanized mice for immune system investigation: progress, promise and challenges. Nature Reviews: Immunology. 12 (11), 786-798 (2012).
- Vatakis, D. N., Bristol, G. C., et al. Using the BLT humanized mouse as a stem cell based gene therapy tumor model. Journal of visualized experiments : JoVE. (70), e4181(2012).
- De Rosa, S. C., Brenchley, J. M., Roederer, M. Beyond six colors: a new era in flow cytometry. Nature medicine. 9 (1), 112-117 (2003).
- Shimizu, S., Hong, P., et al. A highly efficient short hairpin RNA potently down-regulates CCR5 expression in systemic lymphoid organs in the hu-BLT mouse model. Blood. 115 (8), 1534-1544 (2010).
- Denton, P. W., Olesen, R., et al. Generation of HIV latency in humanized BLT mice. Journal of virology. 86 (1), 630-634 (2012).
- Zhou, J., Zhang, Y., et al. Embryoid bodies formation and differentiation from mouse embryonic stem cells in collagen/Matrigel scaffolds. Journal of Genetics and Genomics. 37 (7), 451-460 (2010).
- Vatakis, D. N., Arumugam, B., Kim, S. G., Bristol, G., Yang, O., Zack, J. A. Introduction of Exogenous T-cell Receptors Into Human Hematopoietic Progenitors Results in Exclusion of Endogenous T-cell Receptor Expression. Molecular Therapy. 21 (5), 1055-1063 (2013).
- Ito, R., Takahashi, T., Katano, I., Ito, M. Current advances in humanized mouse models. Cellular & Molecular Immunology. 9 (3), 208-214 (2012).
- Martinez-Torres, F., Nochi, T., Wahl, A., Garcia, J. V., Denton, P. W. Hypogammaglobulinemia in BLT humanized mice--an animal model of primary antibody deficiency. PloS one. 9 (10), e108663(2014).
- McCune, J. M. Development and applications of the SCID-hu mouse model. Seminars in Immunology. 8 (4), 187-196 (1996).
- Srivastava, S., Riddell, S. R. Engineering CAR-T Cells: Design Concepts. Trends in immunology. 36 (8), (2015).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены