Method Article
Stammzellen Basierend Engineered Immunität gegen HIV-Infektion in der humanisierten Maus-Modell
In diesem Artikel
Zusammenfassung
This protocol describes the methods in constructing a humanized bone-marrow/liver/thymus mouse model with stem cell-based engineered immunity against HIV infection.
Zusammenfassung
Mit der schnellen Entwicklung von Stammzell-basierten Gentherapie gegen HIV, ist es Anforderung Pressen für ein Tiermodell die hämatopoetische Differenzierung und Immunfunktion der genetisch veränderten Zellen zu untersuchen. Der humanisierte Knochenmark / Leber / Thymus (BLT) Maus-Modell ermöglicht die vollständige Rekonstitution eines menschlichen Immunsystems in der Peripherie, die T-Zellen, B-Zellen umfasst, NK-Zellen und Monozyten. Der menschliche Thymus-Implantat ermöglicht auch die Thymus-Auswahl von T-Zellen in autologem Thymusgewebes. Neben der Untersuchung der HIV-Infektion, steht das Modell als leistungsfähiges Werkzeug Differenzierung, Entwicklung und Funktion von Zellen, die aus hämatopoetischen Stammzellen (HSCs) abgeleitet zu studieren. Hier beschreiben wir den Aufbau von humanisierten nicht obese diabetic (NOD) -severe kombiniert immunodeficient (SCID) -common gamma - Kette Knockout (c γ - / -) -Bone Mark / Leber / Thymus (NSG-BLT) Mäuse mit HSZ transduziert mit CD4 chimären Antigenrezeptoren (CD4CAR)Lentivirusvektor. Wir zeigen, dass die CD4CAR HSCs erfolgreich in mehrere Linien differenzieren können, und Anti-HIV-Aktivität aufweisen. Das Ziel der Studie ist es, die Verwendung von NSG-BLT - Mausmodell als ein in vivo - Modell für engineered Immunität gegen HIV zu demonstrieren. Es ist erwähnenswert, dass, weil Lentiviren und menschlichem Gewebe verwendet wird, Experimente und Operationen sollten in der Klasse II Biosicherheitswerkbank in einem Biosafety Level 2 (BSL2) mit besonderen Vorsichtsmaßnahmen (BSL2 +) Einrichtung durchgeführt werden.
Einleitung
Trotz des Erfolgs der kombinierten antiretroviralen Therapie, ist eine HIV-Infektion noch eine lebenslange Krankheit. Die zelluläre Immunantwort gegen HIV spielt sehr wichtige Rolle in der HIV-Replikation steuern. Die jüngsten Fortschritte in der Stammzellmanipulation hat sich für die rasche Entwicklung der Gentherapie Ansätze zur HIV - Behandlung 1-3 erlaubt. Infolgedessen ist es wichtig , einen geeigneten Tiermodell zu haben , die der Wirksamkeit von zellbasierten Therapien gegen HIV in vivo Studie erlaubt.
Arbeiten mit HIV in Tiermodellen wird durch die Tatsache kompliziert, daß nur das Virus menschliche Zellen infiziert. Um diese Einschränkung zu umgehen, haben die Wissenschaftler zur Verwendung von Krankheitsmodellen wie dem Simian Immunodeficiency Virus (SIV) in Rhesus - Makaken gegriffen 4,5. Leider gibt es in diesem Modell wesentliche Einschränkungen aufgrund der inhärenten Unterschiede zwischen den Arten und die Unterschiede zwischen SIV und HIV. Darüber hinaus sind nur hoch spezialisierte Einrichtungen sind capable der Arbeit mit nicht-menschlichen Primaten zu unterstützen und jedem Makaken erfordert eine große Investition. Somit besteht ein dringendes Bedürfnis nach einem Modell, das das menschliche Immunsystem verwendet, die mit HIV-Infektion / Pathogenese geeignet ist, und ist weniger wirtschaftlich unerschwinglich.
Die nicht-obese diabetic (NOD) -severe kombiniert immunodeficient (SCID) -common gamma - Kette Knockout (c γ - / -) (oder NSG) Blut / Leber / Thymus (BLT) humanisierten Mausmodell nachgewiesen wird zunehmend ein wichtiges Instrument sein , HIV-Infektion zu studieren. Hämatopoetischer Stammzellen (HSZ) und fötalen Thymus durch Implantation sind die Mäuse entwickeln können und ein menschliches Immunsystem 1-3 rekapitulieren. Eine Art von stammzellbasierten Gentherapie beinhaltet peripheren T-Zellen "Umleitung" HIV zum Ziel durch hämatopoetische Stammzellen Neuprogrammierung (HSZ) in Antigen-spezifischen T-Zellen zu unterscheiden. Wir haben bereits gezeigt, dass Engineering-HSCs mit einem molekularen geklont Anti-HIV-spezifischen T-Zell-reRezeptor (TCR) gegen die SL9 Epitop (Aminosäuren 77-85; SLYNTVATL) von HIV-1 Gag können Stammzellen zu bilden , reife T - Zellen leiten , die HIV - Replikation in dem humanisierten NSG-BLT Maus 6 - Modell unterdrücken. Der Nachteil eines molekularen geklont TCR ist, dass es zu einem bestimmten humanen Leukozyten-Antigen (HLA) Subtyp beschränkt ist, die die Anwendung dieser Therapie beschränken. Chimäre Antigenrezeptoren (CAR), auf der anderen Seite, ist universell für alle HLA-Subtypen angewendet werden. Erste Studien wurden ein Auto mit den extrazellulären und Transmembrandomänen des humanen CD4 an die intrazelluläre ζ fusioniert konstruiert durchgeführt unter Verwendung von Signal-Domäne von CD3 (der so genannten CD4ζCAR). CD4ζCAR ausgedrückt auf CD8 - T - Zellen können HIV envelope erkennen und eine zytotoxische T - Zellantwort auslösen, die zu der durch ein T - Zell - Rezeptor - vermittelten 7 ähnlich ist. Wir haben vor kurzem gezeigt, dass menschliche HSCs mit CD4ζCAR modifiziert werden, die dann in mehrere hämatopoetische li unterscheiden kannneages, einschließlich funktionelle T - Zellen unterdrücken kann die HIV - Replikation in dem humanisierten Maus - Modell 8. Mit dem schnellen Fortschritt in chimären Antigen - Rezeptor - Therapien für Krebs 9 und der laufenden Charakterisierung potent breiten neutralisierenden Antikörpern gegen HIV 10-12, die die Konstruktion von Einzelketten - Antikörper CARs ermöglichen, ist es erkennbar , dass viele neue Kandidaten - Konstrukte, zusätzlich zu CD4ζCAR wird für Stammzellen basierten Gentherapie von HIV-Erkrankungen und andere Erkrankungen erzeugt und getestet werden. Darüber hinaus kann der humanisierte NSG-BLT - Mausmodell , diese antigenspezifischen CARs enthält auch ein nützliches Instrument zur eng humanen T - Zell - Antworten in vivo zu untersuchen. Wichtig ist , unterscheidet sich unser Protokoll der letzten Zeit beschriebenen Verfahren zur Konstruktion von humanisierten von BLT Mäuse 13-15, dass das HSZ in gallertartig Proteinmischung wird 16 anstelle von fötalen Leberstämme verwendet. Dieses Protokoll beschreibt: 1) Aufbau von humanized BLT Mäuse mit CD4ζCAR entwickelt; und 2) Charakterisierung der Differenzierung der genetisch modifizierten Zellen; und 3) Charakterisierung der Funktionalität der genetisch modifizierten Zellen.
Protokoll
Ethic Statement: Human fötalen Gewebe wurde von Advanced Biosciences Ressourcen oder aus Novogenix erhalten und wurde erhalten , ohne Informationen zu identifizieren und nicht IRB - Zulassung für den Einsatz benötigen. Tierforschung in diesem Manuskript beschrieben wurde unter der schriftlichen Genehmigung der University of California, Los Angeles durchgeführt wird, und (UCLA) Animal Research Committee (ARC) in Übereinstimmung mit allen Bundes-, Länder- und lokalen Richtlinien. Im einzelnen wurden diese Studien unter strikter Übereinstimmung mit den Richtlinien in der Führung durchgeführt für die Pflege und Verwendung von Labortieren des National Research Council und die Akkreditierung und Richtlinien des Verbandes für die Bewertung und Zulassung von Labortierpflege (AALAC) Internationale unter UCLA ARC Protokollnummer 2010-038-02B. Alle Operationen wurden unter Ketamin / Xylazin und Isofluran Anästhesie durchgeführt, und alle Versuche wurden gemacht, Tier Schmerzen und Beschwerden zu minimieren.
1. Konstruktion humanisierter Mäuse, mit CD4 chimären Antigenrezeptoren
- Fetal Thymus Verarbeitung und Isolierung von CD34 + HSZ von fötalen Leber
- Thymus Verarbeitung
- Waschen Sie sich leicht die Thymusdrüse in phosphatgepufferter Salzlösung (PBS), pH 7,4, in einem 15 ml konischen Röhrchen. Wiederholen Waschschritt 3 bis 4 mal.
- In 7 ml RPMI-Medium + 10% FBS + Pen / Streptomycin. Dekantieren alles in einen sterilen 100 mm Petrischale.
- Skalpelle den Thymus in kleine Stücke von etwa 1 mm 2 geschnitten. Platzieren Sie jedes einzelne Thymus Stück in einem einzigen Bohrloch auf einer 96-Well-Platte. Verwenden gebogenen stumpfen Pinzette, wenn Thymus Stücke auf die 96-Well-Platte übertragen.
- Eine kleine Menge von Medien (100 bis 200 & mgr; l), um alle der Vertiefungen so, dass das Gewebe nicht austrocknet. Visualisieren Sie unter dem Mikroskop (Thymi haben Lappen und sollte wie Säcke von Zellen aussehen).
HINWEIS: Entsorgen Sie alle Teile, die in irgendeiner Weise fragwürdig aussehen;gibt es oft Bindegewebe und das nicht implantiert werden sollen.
- Eine kleine Menge von Medien (100 bis 200 & mgr; l), um alle der Vertiefungen so, dass das Gewebe nicht austrocknet. Visualisieren Sie unter dem Mikroskop (Thymi haben Lappen und sollte wie Säcke von Zellen aussehen).
- Entfernen Sie die bestätigten-Thymus Stücke und legen Sie sie alle in eine T25 Zellkulturflasche. In 7 ml RPMI-Medium mit 10% FBS und 450 ug / ml Piperacillin / Tazobactam und Amphotericin B. vorsichtig Rock Kolben zu mischen. Kultur der Kolben über Nacht bei 37 ° C / 5% CO 2.
HINWEIS: Dieser Schritt ist eine bakterielle Kontamination des Gewebes zu verhindern. - (Optional Schritt) Einfrieren des Thymus für die zukünftige Verwendung. Äquilibrieren der Stücke in 90% humanem AB-Serum mit 10% Dimethylsulfoxid (DMSO) für 10 min. Frieren Sie sie mit einer Rate von 1 ºC / min auf -50 ° C, dann eine schnelle Abkühlung auf -150 ºC. Wenn Sie bereit sind zu tauen, tauen schnell in einem 37 ° C Wasserbad und vorsichtig waschen 3x in RPMI Komplettmedium ohne DMSO.
- Leber Verarbeitung
- Waschen Sie sich leicht in die Leber in PBS in einem 50 ml konischen Röhrchen. Wiederholen Waschschritt 3 bis 4 mal.
- 10 ml (Iscove modifiziertem Dulbecco-Medien) IMDM Medium zu dem 50 ml konischen Röhrchen. Dekantieren alles in einen 100 mm sterilen Petrischale.
- Homogenisieren das Lebergewebe unter Verwendung von zwei Skalpelle. Schneiden die Leber in kleine Stücke von ungefähr 3 mm 2. Ausschneiden und entsorgen Sie alle weißen Bindegewebe.
- Verwenden Sie 10-ml-Spritze mit einem Messgerät 16 ausgerüstet stumpfe Nadel die Leberstücke und Medien zu übernehmen. Dann Transfer zu einem 50 ml konischen Röhrchen.
- resuspendieren vorsichtig die Medien und Gewebesuspension und vertreiben 5-7 weitere Male vollständig um das Gewebe zu homogenisieren.
- Prepare 10 ml IMDM Medium mit Enzymen ergänzt: Filter 500 U / ml Kollagenase, 2.400 U / ml Hyaluronidase und 300 U / ml DNase sowie 450 ug / ml Piperacillin / Tazobactam und Amphotericin B. die Medien über ein 0,22-um-Filter dann fügen Sie die Medien in die Leber Suspension.
- Verschließe das 50 ml konischen Röhrchen, die Leber Suspension und Dichtung dicht mit selbstdichtenden Film, beispielsweise Parafilm beinhalteto verhindern Leckagen. Drehen Sie in einem Rohr Rotator im Inkubator bei 37 ° C für 90 min.
- Filtern Sie die verdaute Zellsuspension durch ein 100 & mgr; m Zelle Sieb in ein frisches 50-ml-Tube.
HINWEIS: In PBS in die Suspension auf 50 ml, das Gesamtvolumen von bis zu bringen. Aufgeteilt dies in zwei Röhrchen mit 50 ml-Röhrchen mit je 25 ml der Zellsuspension. - Langsam und sanft Unterlage , die Zellen in jedem Röhrchen mit 10 ml Dichtezentrifugation Medien (beispielsweise Ficoll). Spin bei 1200 × g für 20 min ohne Bremse. Hinweis: alle Zentrifugation in diesem Protokoll erwähnt wird bei Raumtemperatur durchgeführt (25 ° C).
- Entfernen Sie vorsichtig die Schnittstelle (dh., Leukozytenmanschette) aus jedem Röhrchen und Transfer in zwei separate 50 - ml - Röhrchen. Bringen Sie das Volumen jeder Röhre Schnittstelle bis zu 50 ml mit PBS. Spin bei 300 g für 7 - 10 min. Absaugen Überstand vorsichtig.
- Kombinieren Sie die beiden Pellets. Waschen Sie drei Mal mit 50 ml PBS 2% FBS enthält. Spin bei 300 g für 7 bis 10 min jedem Zeit Ansaugen während sorgfältig den Überstand.
- Das Pellet in 50 ml RPMI-Medium + 10% FBS. Zählen von Zellen zu diesem Zeitpunkt mit Hemocytometer vor dem Zellsortierung fortfahren.
- Sortier CD34 + Zellen sofort Kit CD34 Sortieranlagen (z. B. CD34 - Mikroperlen), entsprechend dem Protokoll des Herstellers.
HINWEIS: Alternativ können Zellen in RPMI-Medium + 10% FBS bei 1 Million / ml über Nacht kultiviert werden. - Speichern Sie beide CD34 + und CD34-Fraktion.
HINWEIS: Bei diesem Schritt CD34 + und CD34- Zellen eingefroren werden kann Bambanker Einfrieren Medien oder andere Medien Gefrieren verwendet wird. Gefriert 1 ml 4 - 6 x 10 6 CD34 + -Zellen pro Röhrchen und gefrier 1 ml von 40 - 60 x 10 6 CD34- Zellen pro Röhrchen.
- Thymus Verarbeitung
- Transduktion von CD34 + Zellen
- Berechnen Sie die Anzahl der Transduktion Brunnen erforderlich eines 6 gut Gewebekulturplatte. 1 auch verwendet werden , um 8 x 10 6 Zellen zu transduzieren up. Fürjede BLT Maus, 0,5 x 10 6 CD34 + CD34- wird zusammen mit Zellen und Thymus unter Nierenkapsel und 0,5 x 10 6 CD34 + Zellen implantiert werden intravenös injiziert werden. Die Anzahl von CD34 + -Zellen wird durch die Anzahl von Mäusen (1 Million Zellen pro Maus) bestimmt zu verwenden.
- Coat die benötigte Anzahl von Vertiefungen einer nicht-Gewebekultur - behandelte 6-Well - Platte mit 1,25 ml von rekombinantem Human - Fibronektin - Lösung (z. B. Retronectin) (20 ug / ml in PBS) in jede Vertiefung. Decken Sie die Platte und lassen Sie es für 2 Stunden bei Raumtemperatur in einem sauberen Biosicherheitsschrank stehen.
- Aspirat Fibronektin-Lösung aus den Vertiefungen und fügen 1,25 ml FACS-Puffer (PBS mit 4% FBS) in jede Vertiefung für die Blockierung. Lassen Sie die Platte bei Raumtemperatur (25 ° C) für 30 min stehen.
- Absaugen FACS-Puffer und Waschbrunnen einmal mit PBS.
- Halten PBS in den beschichteten Vertiefungen, bis die Platte für den Gebrauch bereit ist. Lagern Sie die Platte bei 4 ° C über Nacht, wenn es nicht sofort verwendet.
- Platte CD34 + Zellen in Infektionsmedium (2% Humanserumalbumin in Yssels Serum-Free T-Cell Medium) in Fibronectin - Lösung beschichteten Vertiefungen (~ 2 x 10 6 Zellen / ml) und bei 37 ºC für 1 h inkubiert.
- Verwenden Sie eine Pipette lentiviralen Vektor in die Vertiefungen bei einer Infektionsmultiplizität (MOI) zwischen 2 hinzufügen - 10. vorsichtig mischen und Inkubation über Nacht bei 37 ºC.
HINWEIS: Der Titer der lentivirus vector verwendet wird, sollte vorher bestimmt werden. - Ernten Sie die Zellen am nächsten Morgen durch sanft die Böden der Vertiefungen mit einer Zellschaber. Sammeln Zellen und zählen mit Hemocytometer zu diesem Zeitpunkt.
- Zur Herstellung von Zellen für die Implantation kombinieren 0,5 x 10 6 transduzierten CD34 + Zellen mit 4,5 × 10 6 CD34 - Zellen pro Maus, aliquoten in sterile 1,5 ml mit Schraubverschluss Röhrchen. Drehen Sie die Zellen bei 300 g bis zu pelletieren sie, absaugen Überstand. Spin sie wieder bei 300 g und absaugen alle verbleibenden Überstand eine P10-Pipette und Absaugen sehr carefully. Halten Sie die trockenen Pellets auf Eis während der gesamten Studie. Hinweis: Um sicherzustellen, dass die Zellen lebensfähig sind, die pelletierten Zellen verwenden und die Operation innerhalb von 2-3 Stunden durchführen.
- Zur Herstellung von Zellen zur Injektion spin 0,5 x 10 6 transduzierten CD34 + Zellen pro Maus , um sie absaugen Überstand zu pelletieren. Die Zellen in 100 ul RPMI-Medium pro Maus und halten auf dem Eis.
- Um zu überprüfen , Transduktionswirksamkeit aliquote ~ 1 x 10 5 nichttransduzierten und transduzierten CD34 + Zellen aus jeder Bedingung und Kultur in 200 ul Zytokin - Medium (RPMI - Medium mit 10% FBS, ergänzt mit 100 ng / ml humanes IL-3, IL-6 SCF) in 96-Well-Platte für 5 bis 7 Tage bei 37 ºC.
HINWEIS: Die Zellen in diesem Schritt verwendet wird, nicht für eine Operation verwendet, aber diese Transduktion sicherzustellen erfolgreich ist und der Vektor ist nicht toxisch für die Stammzellüberleben und der Erneuerung. Transduktionswirksamkeit kann , indem man für die Genexpression des Vektors (z. B. GFP & CD4) und zu analysieren , mittels Durchflusszytometrie überprüft werden.
- Gewebetransplantaten zu konstruieren gentechnisch veränderte Mäuse
- Am selben Tag vor der Operation durchführen Ganzkörperbestrahlung der NOD.Cg- Prkdc scid IL2RG t m1Wjl / SZJ (NSG) immungeschwächten Mäusen mit einem Cesium-137 Irradiator und einer Dosis von 2,7 Gy (270Rad).
HINWEIS: Die NSG-Mäuse sind stark immungeschwächten. Deshalb ist ihr Gehäuse und Wartung müssen von sehr gut ausgebildetes Personal auf den höchsten Gesundheitsstandard und behandelt entsprechen. - Gießen Thymus Stücke und Medium aus dem Kolben in eine 60-mm-Schale. Gießen PBS in eine andere 60-mm-Schale, die verwendet wird, um den Trokar zu reinigen und halten Sie die Niere nass.
- Chill-Verdränger-Pipettenspitzen, indem sie in offenen 1,5 ml sterile Schraubverschluss Röhrchen auf Eis legen. Halten Sie sich auf Eis mit den getrockneten Zellpellets und gallertartig Proteinmischung wie Matrigel.
Hinweis: Es ist wichtig, die gallertartig Proteinmischung und alle Rohre oder Tipps zu halten, dieberühren wird es zu allen Zeiten kalt, bis das Implantat Nadel geladen wird. - Anesthetize die Mäuse: Wiegen Mäuse einzeln und Rekordgewichte; Ohr Punsch die Mäuse sie zählen. Injizieren sie intraperitoneal mit 15 & mgr; l von Ketamin (2,6 mg / ml in Kochsalzlösung) / Xylazin (100 mg / ml in Kochsalzlösung) pro Gramm Körpergewicht). Setzen Sie die Mäuse wieder in den Käfig und warten, bis es vollständig betäubt werden.
HINWEIS: Überprüfen Sie die Anästhesie Ebene der Maus durch eine Pfote drückte. Wenn die Maus reflexiv flinches, verwalten 25-50% der ursprünglichen Menge von Ketamin / Xylazin die Maus weiter zu betäuben. Warten Sie, bis es nicht reflexiv nicht davor zurück, die Operation durchzuführen. - Mit dem Oster Klipper (Shaver), rasieren Sie die linke Seite jeder Maus von der Hüfte zwischen der Mitte des Rückens und den Magen zu schultern. Subkutan 0,3 ml der verdünnten Carprofen injizieren (6 mg / kg) in die Schulter des Tieres oder Leisten Dreieck (Beingrube). Mit einem Wattestäbchen, einen kleinen Tropfen von künstlichen Tränenauf jedes Auge und legen in den Käfig mit der Maus auf die Seite zurück.
HINWEIS: Limit Chirurgie Prep einem Käfig (ca. 4 - 5 Mäuse) zu einem Zeitpunkt. - Spülen Sie die Kanüle des 16-Gauge-Krebs Implantationsnadel (Trokar) mit PBS. Mit einem Paar stumpfer gebogenen Pinzette, legen Sie ein Stück des Thymus aus der 60-mm-Schale in die Öffnung der Kanüle mit dem Trokar gerade innerhalb der Öffnung, und ziehen Sie dann wieder auf den Trokar das Gewebe in die Kanüle zu aspirieren.
- Verwenden eine positive Verdrängungspipette und eine gekühlte Spitze 5 & mgr; l kaltem gelatinösen Proteinmischung mit einer getrockneten Zellpellet (CD34 + und CD34- Mischung für implantierte Zellen) in das Rohr zu legen und sanft rühren Zellsuspension zu erzeugen. Pipettieren Sie nicht nach oben und unten. Pipette, um die gallertartig Proteinmischung / Zellsuspension in die Öffnung der Kanüle und langsam zurückziehen auf den Trokar die Nadel zu laden.
HINWEIS: Es wird empfohlen, einen Helfer haben, um die Pipette zu laden, während man die Implantationsnadel manipuliert. - Swab die rasierte Fläche der Maus mit Povidon-Jod und anschließend die Fläche wischen Sie mit einem dreimal Alkoholtupfer. Bestimmen Sie die dunkelste Stelle unter der Haut. Dies zeigt die Position der Milz. Die Niere ist etwa 5 mm dorsal zur Milz. Heben Sie die Haut mit einer gebogenen Pinzette und machen einen 15 mm langen Schnitt mit chirurgische Scheren in der Haut parallel zur Milz. Dann machen Sie einen ähnlichen Schnitt in die Bauchhöhle unter der Schicht. Bei Männern, sollte die Niere gut sichtbar sein und kann einfach durch Drücken auf das Abdomen extrudiert werden. Sie können die Niere mit einem hemostat oder ein Paar von gebogenen stumpfen Pinzette unterstützen. Bei Frauen, neigen die Ovarien die Niere aus die einfache Extraktion zu blockieren. Mit Hilfe eines hemostat, nehmen Sie den Eierstock und sorgfältig die Niere aussetzen aus.
- Verwenden Sie die Nadelspitze Zange ein kleines Loch am hinteren Ende der Nierenkapsel zu zupfen.
HINWEIS: Stellen Sie diese Nadelspitze Zange verwenden, um Biohazard Materialien verarbeiten. - Schieben Sie das ImplantatNadel in das Loch und entlang der Niere, bis die Öffnung der Kanüle vollständig durch die Nierenkapsel abgedeckt ist.
- extrudieren vorsichtig das Gewebe unter der Nierenkapsel und ziehen Sie die Nadel wieder heraus. Die Thymus Stücke können klebrig sein, so dass eine gebogenen Pinzette verwenden, um die Thymusdrüse Stück mit der Nadel nicht herauskommt sicherstellen.
- Heben Sie das Peritoneum mit der Zange und verwenden Sie sanft die hemostat die Niere wieder an ihren Platz zu schieben. Binden Sie ein doppelt verknotet Stich in das Peritoneum mit 4-0 Vicryl resorbierbaren Fäden. Verwenden Sie zwei Autoclips Wundklammern, die Haut zu schließen.
- Mischen Sie die transduzierten CD34 + Zellen , die beiseite für die Injektion eingestellt wurden und die Aufnahme 100 ul (0,5x10 6 Zellen) in einer Insulinspritze. Injizieren Sie diese Zellen in der Maus durch retroorbitalen Veneninjektion oder andere Wege der intravenösen Injektion. Mit einem Wattestäbchen, einen kleinen Tropfen von künstlichen Tränen auf jedes Auge und legen Sie die Maus auf die Seite zurück in einem Käfig.
- Sobald alle die Mäuse been implantiert, bestätigen, dass die Tiere das Bewusstsein wiedererlangt werden und ambulating normalerweise vor ihnen zu verlassen.
- Post-operative Betreuung: Der Tag nach der Operation injiziert subkutan 0,3 ml verdünntem Carprofen (6 mg / kg) und 1,2 ml steriler Kochsalzlösung in jede Maus. 2 und 3 Tage nach der Operation injiziert subkutan 1,5 ml steriler Kochsalzlösung in jede Maus. Überwachen Sie die Mäuse und die Einschnitte für 10-14 Tage nach der Operation. Nehmen Sie die Autoclips und wiegen die Mäuse nach 10-14 Tagen. HINWEIS: Die Mäuse träge sind nach der Bestrahlung und die Injektion von Kochsalzlösung aus zu dehydrieren die Tiere verhindert.
- Nach 8 - 10 Wochen überprüfen Verpflanzung durch die Mäuse Blutungen und FACS-Analyse auf dem peripheren Blut durchführen, Färbung für Marker wie CD45, CD3, CD4, CD8, und alle Gene sollte der Vektor auszudrücken.
- Am selben Tag vor der Operation durchführen Ganzkörperbestrahlung der NOD.Cg- Prkdc scid IL2RG t m1Wjl / SZJ (NSG) immungeschwächten Mäusen mit einem Cesium-137 Irradiator und einer Dosis von 2,7 Gy (270Rad).
2. Charakterisierung der Differenzierung und Entwicklung von Gen-veränderten Zellen
- CharakterisierungGene Modified Zellen aus peripherem Blut
- 8 - 10 Wochen nach der Transplantation erhalten 50 bis 100 & mgr; l Mäuseblut von retro-orbitale bluten. Legen Sie in Mikrozentrifugenröhrchen, das 10 & mgr; l EDTA. Centrifuge Zellen bei 350 × g für 3 min. Sammeln Sie Plasma. Einfrieren bei -80 für ELISA-Analyse oder Plasma-Viruslast-Test, wenn die Maus HIV infiziert.
- 2 ml NH 4 Cl (83%) Lösung der roten Blutzellen zu lysieren. Inkubieren für 5 Minuten bei Raumtemperatur (25 ° C). Nach der Inkubation, 10 ml RPMI 10% FBS Röhre zu füllen. Spin bei 300 g für 5 min. Absaugen Überstand vorsichtig. Die Zellen sind bereit für die Immunfärbung und Durchflusszytometrie-Analyse und andere Tests.
HINWEIS: Markierungen für verschiedene hämatopoetische Zelllinien, Aktivierung und phänotypischen Marker für naive oder Speicherzellen können alle 2 Wochen vor und nach der HIV-Infektion durch Durchflusszytometrie gemessen werden. Tore werden durch Anfärben der Zellen mit Isotypkontrollen erstellt. Es wird empfohlen, healt zu färbenhy menschlichen PBMCs und verwenden, die als positive Kontrolle. Alternativ kann die Maus getötet und bis zu 1 ml peripherem Blut werden von Herzpunktur erhalten werden , die 17 genügend Zellen für mehrere Platten aus Flussanalyse zur Verfügung stellt.
- Charakterisierung von Gen - veränderten Zellen aus Milz, Thymus und Knochenmark
- Ernte Milz, Thymus und Knochenmark aus dem humanisierten BLT Mäuse
- Euthanize Mäuse durch Überdosierung von Isofluran mit. Bestätigen Sie die Euthanasie mit sekundären Zervikaldislokation. Sprühen Sie die Oberfläche der Karkasse mit 70% Ethanol aus Festhalten an Gewebe Fell zu halten. Festnageln die Glieder auf Wachs Dissektion Fach.
- Verwenden chirurgische Schere, schneiden Sie die Haut öffnen, und dann schneiden durch die Bauchlage in die Körperhöhle zu belichten.
- Entfernen Sie die Milz einer Pinzette. Entfernen Sie die Thymus-Implantat auf die Niere mit einer Pinzette und Schere. Legen Sie die Thymus-Implantat und Milz in markierten Röhrchen containing 5 ml PBS.
- Von Mitte Bauch die Haut von dem distalen Teil der Maus schneiden und entfernen Sie die unteren Extremitäten bedecken.
- Schneiden Sie die Muskeln von den unteren Extremitäten mit einer Schere ab und sorgfältig die Hüftpfanne aus dem Hüftgelenk verrücken. Entfernen Sie die Oberschenkel und Schienbein und sie in ein Röhrchen mit 5 ml PBS.
- Isolation von Splenozyten
- Legen Sie eine 100 um Zellsieb auf einem 50 ml konischen Röhrchen. Befeuchten Sie das Sieb mit 3 ml RPMI-Medium mit 10% FBS und Pen / Strep (RPMI vollständige Medien).
- Legen Sie die Milz auf die Zelle Sieb. Mit dem Gummikolben einer 10-ml-Spritze, zerdrücken die Milz es durch das Sieb in den 50-ml-Röhrchen zu trennen.
- Spülen Sie die Zelle Sieb mit 5 ml RPMI Komplettmedium 4 bis 5 mal.
- Spin-Zellen bei 300 g für 10 min.
- Überstand entfernen und Pellet in 5 ml roter Blutpuffer Zelllyse. Inkubieren bei Raumtemperatur für 10 min. 20 ml RPMI komplette Medien-und Spin bei 300 g für 7 min.
- Überstand entfernen und Pellet in 10 ml RPMI-Voll Medien und Filter wieder durch ein 100 & mgr; m Zelle Sieb. Zählen von Zellen mit einem Hämozytometer.
HINWEIS: Die Zellen können für ex - vivo - Assays verwendet werden, die Analyse fließen und kann mit vertretbarem Aufwand für die spätere Verwendung eingefroren werden. Vor der Zellzählung, kann Trypan blau verwendet werden, um die Anzahl der lebensfähigen Zellen zu bestimmen.
- Isolierung von humanen Thymocyten aus Implant
- Setzen Sie den Thymus in 5 ml PBS in eine Vertiefung einer 6-Well-Platte. Mit sauberen stumpfen Pinzette und Schere schneiden Sie den Thymus in kleine Stücke.
- Legen Sie eine sterilisierte Edelstahlgewebe Platz in den Brunnen. Mit dem Gummikolben einer 10-ml-Spritze, zerdrücken die Thymusdrüse Stücke auf dem Edelstahlgewebe, um den Thymus auseinander brechen.
- Die Zellen gut und die Belastung durch ein 100 & mgr; m Zelle Sieb. Spin-Zellen bei 300 g für 10 min.Suspend-Zellen in 10 ml RPMI-Vollmedium. Wenn Klumpen sichtbar sind, passieren die resuspendierten-Zellen wieder durch eine Zelle Sieb.
- Zählen von Zellen mit einem Hämozytometer.
HINWEIS: Die Zellen können für eine spätere Verwendung für Flow-Analyse und mit vertretbarem Aufwand eingefroren werden.
- Isolierung von Zellen aus dem Knochenmark
- Reinigen und Sterilisieren Mörser und Stößel mit 70% Ethanol. Platzieren Sie den Femur und Tibia in Mörtel. 5 ml kaltem PBS. Verwenden Stößel die Knochen zu zermalmen, bis die PBS hellrosa und trüb wird.
- Pipettieren, um die Flüssigkeit aus dem Mörtel und filtriert durch ein Sieb 50 uM Zelle platziert auf einem 50 ml konischen Röhrchen. Waschen Sie Mörtel mit 5 ml PBS und wiederholen Sie fünf Mal, bis PBS klar wird.
- Spin-Zellen nach unten bei 300 g für 7 min. Absaugen Überstand und resuspendieren in 10 ml RPMI-Vollmedium.
- Zählen von Zellen mit einem Hämozytometer.
HINWEIS: Die Zellen können für ex - vivo - Assays verwendet werden, die Analyse fließen und mit vertretbarem Aufwand gefroren f sein kannoder höher verwenden.
- Ernte Milz, Thymus und Knochenmark aus dem humanisierten BLT Mäuse
3. Funktionelle Charakterisierung von Gen-veränderten Zellen
- HIV - Infektion und Überwachung der Virusreplikation im Laufe der Zeit
- Nach Bestätigung der Rekonstitution menschlichen Immunsystems, injizieren gewünschte Menge an HIV-Virus via retroorbitalen Veneninjektion unter Verwendung einer Insulinspritze. Nach einer HIV-Infektion, sammeln 100 ul peripheren Blut über retro-orbitale alle 2 Wochen Blutungen.
- Ernte-Plasma durch folgende Schritte in Teil 2.1.1 - 2.1.2. Für Viruslast - Test HIV, extrahieren virale RNA - RNA - Extraktions - Kits mit den Anweisungen des Herstellers nach und Viruslast durch Echtzeit - RT-PCR mit geeigneten Primer und Sondensätze für das HIV - Virus verwendet 4,8,18,19 messen.
- Um Zelle zugeordnet HIV-RNA und identifizieren Zellen messen, die von HIV aktiv infiziert sind, führen erste RBC-Lyse folgenden Schritte 2.1.2
- Resuspendieren Zellsuspension in 1; Ml PBS, teilen sich gleichmäßig in zwei Röhren. Spin bei 300 g für 5 min. Überstand entfernen.
- Um Zelle zugeordnet RNA messen, extrahieren RNA-Extraktions-Kits RNA unter Verwendung nach den Anweisungen des Herstellers und eine Echtzeit-RT-PCR geeigneten Primer und Sondensätze verwenden.
HINWEIS: Es ist wichtig, dass die Primer / Sonde nicht die Lentiviren modifizierte Stammzellen verwendet erkennt - Zur Messung der HIV infizierten Zellen durch Strömungs resuspendieren Zellen in dem anderen Rohr in 50 & mgr; l FACS-Puffer und oberflächen Fleck mit gewünschten Antikörper wie anti-CD45, anti-CD4 und anti-CD3 zuführen. Nach der Oberflächen Fleck, fixieren und Zellen und Flecken intrazellulär für gag-Expression unter Verwendung von Anti-Gag-Antikörper (Klon KC57) permeabilisiert. Führen Sie die Durchflusszytometrie.
- Ex - vivo - Zytokin - Assay der Gene modifizierten Zellen aus Splenocyten
- Ernte Splenozyten von Mäusen, wie in Abschnitt 2.2.2 beschrieben.
- Bereiten Sie die Zielzellen. Um zu testen, die funktionellekeit von Rezeptor modifizierten T-Zellen chimären Antigen CD4, HIV-infizierten T1-Zellen als Zielzellen verwendet werden. T1-Zellen mit HIV-3 Tage Infect vor dem Zytokin-Assay, bestätigen HIV-Infektion, indem die Zellen Färbung intrazellulär mit Anti-HIV-gag-Antikörper (Klon KC57). Verwenden Sie nicht infizierten Zellen T1 als Steuerzielzellen.
- Co-Inkubation Splenozyten mit Ziel- oder Kontrollzellen bei 1: 1 Übernachtung Verhältnis. Für das beste Ergebnis, führen eine Titration (1: 1, 1: 3, 1: 9) von Effektorzellen (Splenozyten) im Vergleich zu Zielzellen (infizierte T1-). Zum Beispiel resuspendieren 0,9 Mio. Splenozyten in 0,25 ml RPMI Komplettmedium, fügen Sie 0,9, 0,3 oder 0,1 Millionen Infizierte T1 oder nicht infizierten T1- in 0,25 ml RPMI Komplettmedium resuspendiert.
- Am nächsten Morgen, Protein - Transport - Inhibitor hinzufügen 6 Stunden Proteintransport zu hemmen und führen für extrazelluläre Marker und die intrazelluläre Expression von Zytokinen Färbung wie in 8 zuvor beschrieben.
Ergebnisse
Figur 1 zeigt eine Skizze der Konstruktion von humanisierten BLT Mäuse mit modifizierten Stammzelle. 10 Wochen nach der Implantation wurden die Mäuse geopfert, um die Differenzierung und Entwicklung von Gen-modifizierten Zellen zu bewerten. Wie in 2 gezeigt, mehrere Lymphgewebe (Blut, Milz, Thymus und Knochenmark) wurden aus einer Maus geerntet , die mit CD4ζCAR geändert wurde. Die CD4ζCAR in diesem Protokoll verwendet wird, enthält CD4 chimären Antigenrezeptor und GFP , das von anti-CD4 - Antikörper und die Expression von GFP 8 detektiert werden kann. Die Zellen wurden mit Antikörper gegen humanes CD45 sowie anti-CD4-Antikörper und analysiert mittels Durchflusszytometrie isoliert und gefärbt. GFP und CD4 doppelt positive Zellen nachgewiesen, die das Vorhandensein von CD4CAR + Zellen in mehreren lymphoiden Geweben.
Um die Differenzierung der Gen-modifizierten Zellen zu untersuchen, Splenozyten wurden mit Antikörpern gegen menschliches CD45 (Lymphozyten), CD3 (T-Zellen), CD19 (B-Zellen), CD14 (Monozyten und Makrophagen) und CD337 (NK-Zellen) gefärbt. Wie in 3 zu differenzieren in mehrere Linien hämatopoetischen Stammzellen CD4ζCAR gezeigt.
Um zu untersuchen, ob CD4CAR modifizierten Zellen funktionell sind, koinkubiert wir Splenozyten mit Zielzellen, die CD4CAR Zellen erkennen würde (HIV infizierten T1-Zellen oder nicht-infizierten T1-Zellen als Kontrolle). Zellen wurden zusammen über Nacht inkubiert und der Proteintransport Inhibitor wurde für weitere 6 Stunden zugegeben. Danach wurden die Zellen fixiert und permeabilisiert für die intrazelluläre Expression von Zytokinen wie IFN & ggr; und TNF & agr; zu färben. Wie in der CAR 4 gezeigt exprimierenden Zellen produziert höhere Menge an IFNy und TNFa mit infizierten T1 - Zellen.
Last / 54048 / 54048fig1.jpg "/>
Abbildung 1: Übersicht über die Konstruktion von humanisierten BLT Mäuse mit modifizierten Stammzellen FT:. Fetal Thymus. FL:. Fötalen Leber Bitte hier klicken , um eine größere Version dieser Figur zu sehen.

Fig . 2: CD4 chimären Antigen - Rezeptor modifizierten Zellen können in mehreren lymphatischen Geweben nachgewiesen werden Maus mit CD4CAR modifizierten HSCs wurden 10 Wochen nach der Operation und mehrere Lymphgewebe geopfert wurden geerntet und die Zellen wurden mit anti-human - CD45 und anti-human - CD4 - Antikörpern gefärbt und mittels Durchflusszytometrie analysiert. Bitte hier klicken , um eine größere Version dieser Figur zu sehen.
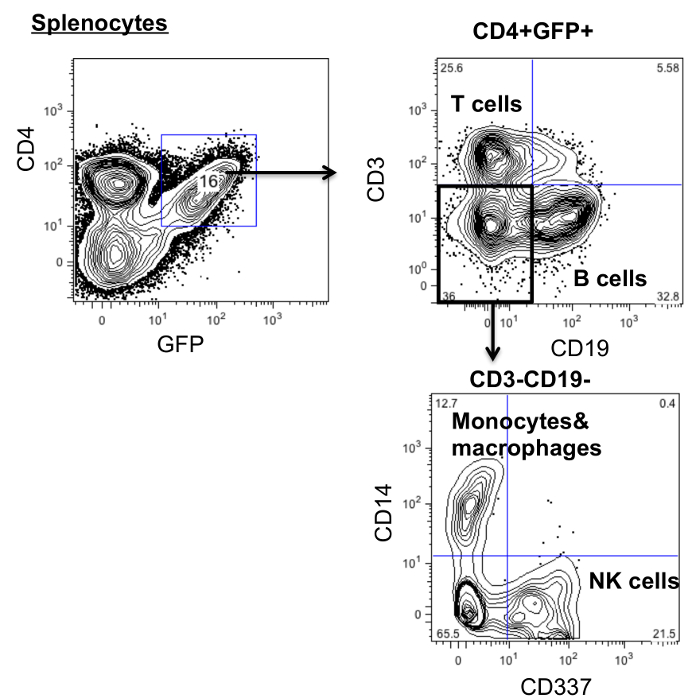
Abbildung 3:.. CD4 chimären Antigenrezeptoren modifizierten Zellen in mehrere Linien unterscheiden können Splenozyten von CD4CAR veränderten Mäusen wurden geerntet und gefärbt mit Antikörpern gegen das humane CD45, CD3, CD19, CD14 und CD337 und analysiert mittels Durchflusszytometrie Bitte klicken Sie hier um ein , um zu vergrößern Version dieser Figur.
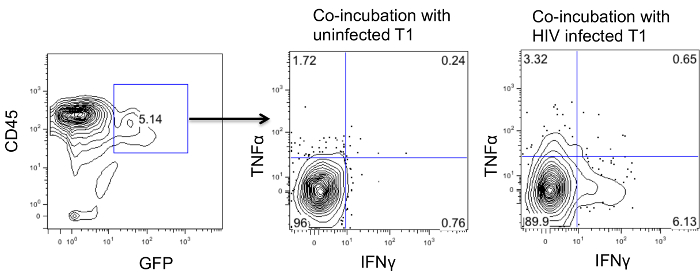
Abbildung 4:. Ex vivo Zytokin - Assay von CD4 CAR + T - Zellen , Splenozyten von HIV - infizierten CD4CAR Mäuse mit stimuliert wurden entweder HIV - infizierten oder nicht infizierten T1 - Zellen und deren intrazelluläre Produktion von Zytokin gezeigt. Bitte klicken Sie hier , um die viewa größere Version dieser Figur.
Diskussion
Mit CAR und HSC-basierten entwickelt Immunität gewinnt an Dynamik zu klinischen Studien, ist es wichtig, eine richtige Tiermodell zu haben, um genau die Differenzierung und Funktion dieser gentechnisch veränderten Zellen zu untersuchen. In diesem Protokoll beschrieben wir die Methoden für die Konstruktion und Prüfung der humanisierten Mäuse mit genetisch veränderten Stammzellen gentechnisch gegen HIV. Es ist wichtig, eine effiziente Transduktion von Stammzellen vor der Transplantation zu haben. Jedoch aufgrund der Fähigkeit von T - Zellen bei Erkennung von Zielzellen zu vermehren, geringe Mengen an Stammzell Modifikation waren ausreichend , um eine robuste Antwort gegen HIV - Replikation 8 zu erzeugen.
Dennoch hohe Stammzell Modifikation zu erreichen, empfehlen wir die Verwendung transduzierten CD34 + Zellen in gallertartig Proteinmischung mit autologem Thymus anstelle von Leber und Thymus Brocken für Mäuse Chirurgie , die an anderer Stelle 13 bis 15 beschrieben worden war. Gelatinous Proteinmischung ist ein solubilized Gewebe Basalmembran reich an extrazellulären Matrixproteinen. Unter normalen physiologischen Bedingungen polymerisieren gelatinösen Proteinmischung eine rekonstituierte, biologisch aktive und stabile Matrix zu erzeugen , die wirksame Anhaftung und Differenzierung der Stammzelle 20 ermöglichen würde. Menschliche Zelle Rekonstitution kann durch retro-orbitales Bluten überprüft werden und Durchflusszytometrie 6 - 8 Wochen nach der Operation. Um sicherzustellen, dass der Vektor für die Stammzellüberleben und die Erneuerung nicht toxisch ist, ist es empfehlenswert, den Vektor in CD34 + Zellen vor dem Experiment zu titrieren, wie in 1.2.6 beschrieben.
Die Kapazität des NSG-BLT - Mausmodell mukosalen Infektion, konsistente Virämie und zelluläre Immunantworten ist es ein sehr nützliches Modell zum Studium von HIV immune Pathologie und zellbasierte Therapien zu unterstützen HIV - Infektion 1 zu behandeln. Am wichtigsten ist, erzeugt T-Zellen aus den NSG-BLT-Mäuse werden in der autologe Thymusgewebes ausgewählt, die Forscher ermöglicht, das Schicksal zu studierender Gen - modifizierten Stammzellen nach thymic Auswahl 8,21. Mit dem beschriebenen Verfahren konnten wir durchweg 40% -90% menschlichen Immunzellen Rekonstitution zu erhalten. Geringe Mengen an menschlichen Zell Rekonstitution können aus mehreren Faktoren ergeben, einschließlich der Fähigkeiten der Person, die Operation und die Qualität der Gewebe für die Transplantation durchgeführt wird. Auf einen hohen Pegel von menschlichen Zell Rekonstitution zu erreichen, ist es wichtig, die Transplantate zu gewährleisten sicher unterhalb der Nierenkapsel platziert. Darüber hinaus ist es sehr empfehlenswert, jedes Thymus Implantat für Chirurgie unter dem Lichtmikroskop und entsorgen Sie alle fragwürdigen Stücke vorbereitet zu untersuchen.
Obwohl die humanisierte BLT Mausmodell zur Untersuchung von gentechnisch Immunität gegen HIV ( überprüft in 1,15,22) ein vielversprechendes Werkzeug ist, hat es seine eigenen Grenzen. Und zwar ist dieses Modell perfekt keinen menschlichen peripheren Immunsystem nachzuahmen. Studien haben beeinträchtigte Entwicklung von hyper-mutierten gezeigt, Klasse vermitteltes IgG Antibody 1,23. Darüber hinaus ist immun-defizienten Mäusen mit technisch anspruchsvoll und gesund erfordert diese Mäuse halten beträchtliche Ressourcen und Ausbildung. Subtile opportunistische Infektionen können als signifikante Unterschiede zwischen den Proben manifestieren und haben negative Auswirkungen auf die Experimente. Deshalb ist es wichtig , gut vorbereitet Einrichtungen zu haben und entsprechend geschultes Personal Integrität der zukünftigen Daten 1,24 zu halten. Mit diesen Einschränkungen im Sinn stellt die humanisierte NSG-BLT - Mausmodell noch ein wichtiges Werkzeug für die Untersuchung von Stammzelle basierend engineered Immunität, wie sie durch diese Beispiele gezeigt wird , 4,8.
Mit dem Trend chimären Antigenrezeptoren der Entwicklung basierend auf HIV - Antikörper breiten 10 und Änderung der Signal - Domäne für eine effizientere CAR 25, ist dieses Modell und Protokoll neutralisieren kann verwendet werden , um die Funktionalität des Gens modifiziert cel zu charakterisieren und zu untersuchenls mit einer neuen Generation von Autos. Darüber hinaus kann dieses Modell möglicherweise aufnehmen Studien zur Immun basierte Therapie (wie inhibitorische Rezeptor-Blockade) in Verbindung mit Engineered Immunität.
Offenlegungen
The authors have nothing to disclose.
Danksagungen
We would like to thank Ms. Jessica Selander in providing artistic assistant in making our figures. This work was funded by grants from the NIAID/NIH, grant no. RO1AI078806, the UCLA Center for AIDS Research (CFAR), grant no. P30AI28697, the California Institute for Regenerative Medicine, grant no. TR4-06845, the American Federation for AIDS Research (amfAR), grant no. #108929-54-RGRL, and the UC Multi-campus Research Program and Initiatives, California Center for Antiviral Drug discovery (CCADD)
Materialien
| Name | Company | Catalog Number | Comments |
| CD34 microbead kit | Miltenyi | 130-046-702 | For sorting human CD34+ progenitor cells |
| Bambanker | Wako | 302-14681 | For freezing cells |
| QIAamp Viral RNA kit | Qiagen | 52904 | For measuring viral load in the serum |
| MACSQuant Flow Cytometer | Miltenyi | For flow analysis | |
| BD LSRFortessa™ | BD biosciences | For flow analysis | |
| Hyaluronidase | Sigma | H6254-500MG | For tissue digestion |
| Deoxyribonuclease I | Worthington | LS002006 | for tissue digestion |
| Collagenase | Life technology | 17104-019 | for tissue digestion |
| CFX Real time PCR detection system | Biorad | For measuring viral load and gene expression | |
| Mice, strain NOD.Cg-Prkdcscid Il2rgtm1Wjl/SzJ | The Jackson Laboratory | 5557 | For constructing the humanized mice |
| Penicillin Streptomycin (Pen Strep) | Thermo Fisher Scientific | 10378016 | For culturing cells |
| Piperacillin/tazobactam | Pfizer | Zosyn | Anti-fungal |
| Amphotericin B (Fungizone antimycotic) | Thermo Fisher Scientific | 15290-018 | Anti-fungal |
| Autoclip Wound Clips, 9 mm - 1,000 units | Becton Dickinson | 427631 | For surgery |
| Sterile Poly-Reinforced Aurora Surgical Gowns, 30 per case | Medline | DYNJP2707 | For surgery |
| Sutures, 4-0, vicryl | Owens and Minor | 23000J304H | For surgery |
| Alcohol prep pads | Owens and Minor | 3583006818 | For surgery |
| Gloves, surgical, 6 1/2 | Owens and Minor | 4075711102 | For surgery |
| Yssel’s Serum-Free T-Cell Medium | Gemini Bio-products | 400-102 | For CD34+ cell transduction |
| Human Serum Albumin | Sigma-Aldrich | A9511 | For CD34+ cell transduction |
Referenzen
- Karpel, M. E., Boutwell, C. L., Allen, T. M. BLT humanized mice as a small animal model of HIV infection. Current opinion in virology. 13, 75-80 (2015).
- Zhen, A., Kitchen, S. Stem-cell-based gene therapy for HIV infection. Viruses. 6 (1), 1-12 (2014).
- Goulder, P. J. R., Watkins, D. I. HIV and SIV CTL escape: implications for vaccine design. Nature Reviews: Immunology. 4 (8), 630-640 (2004).
- Kitchen, S. G., Bennett, M., et al. Engineering Antigen-Specific T Cells from Genetically Modified Human Hematopoietic Stem Cells in Immunodeficient Mice. PloS one. 4 (12), e8208(2009).
- Goulder, P. J. R., Watkins, D. I. HIV and SIV CTL escape: implications for vaccine design. Nature Reviews: Immunology. 4 (8), 630-640 (2004).
- Kitchen, S. G. S., Levin, B. R. B., et al. In vivo suppression of HIV by antigen specific T cells derived from engineered hematopoietic stem cells. PLoS Pathogens. 8 (4), e1002649(2012).
- Yang, O. O., Tran, A. C., Kalams, S. A., Johnson, R. P., Roberts, M. R., Walker, B. D. Lysis of HIV-1-infected cells and inhibition of viral replication by universal receptor T cells. PNAS. 94 (21), 11478-11483 (1997).
- Zhen, A., Kamata, M., et al. HIV-specific Immunity Derived From Chimeric Antigen Receptor-engineered Stem Cells. Molecular Therapy. 23 (8), 1358-1367 (2015).
- Barrett, D. M., Singh, N., Porter, D. L., Grupp, S. A., June, C. H. Chimeric Antigen Receptor Therapy for Cancer. Annual Review of Medicine. 65 (1), 333-347 (2014).
- Pejchal, R., Doores, K. J., et al. A Potent and Broad Neutralizing Antibody Recognizes and Penetrates the HIV Glycan Shield. Science. 334 (6059), 1097-1103 (2011).
- Caskey, M., Klein, F., et al. Viraemia suppressed in HIV-1-infected humans by broadly neutralizing antibody 3BNC117. Nature. 522 (7557), 487-491 (2015).
- West, A. P., Scharf, L., Scheid, J. F., Klein, F., Bjorkman, P. J., Nussenzweig, M. C. Structural insights on the role of antibodies in HIV-1 vaccine and therapy. Cell. 156 (4), 633-648 (2014).
- Lan, P., Tonomura, N., Shimizu, A., Wang, S., Yang, Y. -G. Reconstitution of a functional human immune system in immunodeficient mice through combined human fetal thymus/liver and CD34+ cell transplantation. Blood. 108 (2), 487-492 (2006).
- Melkus, M. W., Estes, J. D., et al. Humanized mice mount specific adaptive and innate immune responses to EBV and TSST-1. Nature medicine. 12 (11), 1316-1322 (2006).
- Shultz, L. D., Brehm, M. A., Garcia-Martinez, J. V., Greiner, D. L. Humanized mice for immune system investigation: progress, promise and challenges. Nature Reviews: Immunology. 12 (11), 786-798 (2012).
- Vatakis, D. N., Bristol, G. C., et al. Using the BLT humanized mouse as a stem cell based gene therapy tumor model. Journal of visualized experiments : JoVE. (70), e4181(2012).
- De Rosa, S. C., Brenchley, J. M., Roederer, M. Beyond six colors: a new era in flow cytometry. Nature medicine. 9 (1), 112-117 (2003).
- Shimizu, S., Hong, P., et al. A highly efficient short hairpin RNA potently down-regulates CCR5 expression in systemic lymphoid organs in the hu-BLT mouse model. Blood. 115 (8), 1534-1544 (2010).
- Denton, P. W., Olesen, R., et al. Generation of HIV latency in humanized BLT mice. Journal of virology. 86 (1), 630-634 (2012).
- Zhou, J., Zhang, Y., et al. Embryoid bodies formation and differentiation from mouse embryonic stem cells in collagen/Matrigel scaffolds. Journal of Genetics and Genomics. 37 (7), 451-460 (2010).
- Vatakis, D. N., Arumugam, B., Kim, S. G., Bristol, G., Yang, O., Zack, J. A. Introduction of Exogenous T-cell Receptors Into Human Hematopoietic Progenitors Results in Exclusion of Endogenous T-cell Receptor Expression. Molecular Therapy. 21 (5), 1055-1063 (2013).
- Ito, R., Takahashi, T., Katano, I., Ito, M. Current advances in humanized mouse models. Cellular & Molecular Immunology. 9 (3), 208-214 (2012).
- Martinez-Torres, F., Nochi, T., Wahl, A., Garcia, J. V., Denton, P. W. Hypogammaglobulinemia in BLT humanized mice--an animal model of primary antibody deficiency. PloS one. 9 (10), e108663(2014).
- McCune, J. M. Development and applications of the SCID-hu mouse model. Seminars in Immunology. 8 (4), 187-196 (1996).
- Srivastava, S., Riddell, S. R. Engineering CAR-T Cells: Design Concepts. Trends in immunology. 36 (8), (2015).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten